北京市2021-2022学年高三各区上学期期末化学考试分类汇编 :物质结构与性质(word版含答案)
文档属性
| 名称 | 北京市2021-2022学年高三各区上学期期末化学考试分类汇编 :物质结构与性质(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 723.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 20:32:11 | ||
图片预览


文档简介
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编
物质结构与性质
(海淀区)1. 碳酸二甲酯()是一种绿色化工原料,用于汽车、医疗器械等领域。以甲醇为原料制备碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中羰基碳原子的杂化类型是 。
(2)CuCl中,基态的价电子排布式为 ,CuCl在生产碳酸二甲酯的反应过程中所起的作用是 。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i甲醇单位时间内的转化率主要受Cu(I)(价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度小,且其中的易被氧化为难溶的CuO。
iii.加入4-甲基咪唑()可与Cu形成配合物,可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大键,电子云密度降低。
请结合信息回答以下问题:
①4-甲基咪唑中,1~4号原子 (填“在”或“不在”)同一平面上, (填“1”或“3”)号N原子更容易与形成配位键。
②加入4-甲基基咪唑后,甲醇转化率提高,可能的原因是 (填序号)。
a.Cu(I)配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的CuO
c.形成的Cu(I)配合物能增大反应的限度
(4)原子提供孤电子对的能力是影响配体与之间配位键强度的重要因素。若用某结构相似的含O配体与配位,所得配合物的稳定性比含N配体低,可能的原因是 。
(东城区)2. 过渡元素铂的单质是一种重要的催化剂,其化合物可用于医药领域。
(1)基态的价层电子排布式是,该元素在元素周期表中位于第___________周期。
(2)的晶胞示意图如下。
①该晶胞中含有的铂原子数目为___________。
②该晶体中,每个铂原子周围与它最近且等距离的铂原子有___________个。
(3)是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为,但只有甲的水解产物能与草酸反应生成。
①根据相似相溶的规律,可推断___________(填“甲”或“乙”)在水中的溶解度较大。
②依据上述信息:___________,可推断不是四面体结构。
③发生水解反应的化学方程式是___________。
④和中铂的配体数不同,但配位数均为4,是由于每个中有___________个原子与铂配位。
⑤查阅资料可知,甲、乙均为平面结构。画出乙的水解产物的空间结构并推测其不能与草酸反应生成的原因:___________。
(西城区)3.硅烷SiH4可用于制造高纯硅。采用硅化镁法制备SiH4的化学方程式如下:Mg2Si+4NH4Cl+8NH3=SiH4+2MgCl2·6NH3
(1)硅在元素周期表中的位置是___________,基态硅原子占据的最高能级的符号是___________。
(2)①SiH4的电子式是___________。
②SiH4的沸点比CH4的___________。(填“高”或“低”),原因是___________。
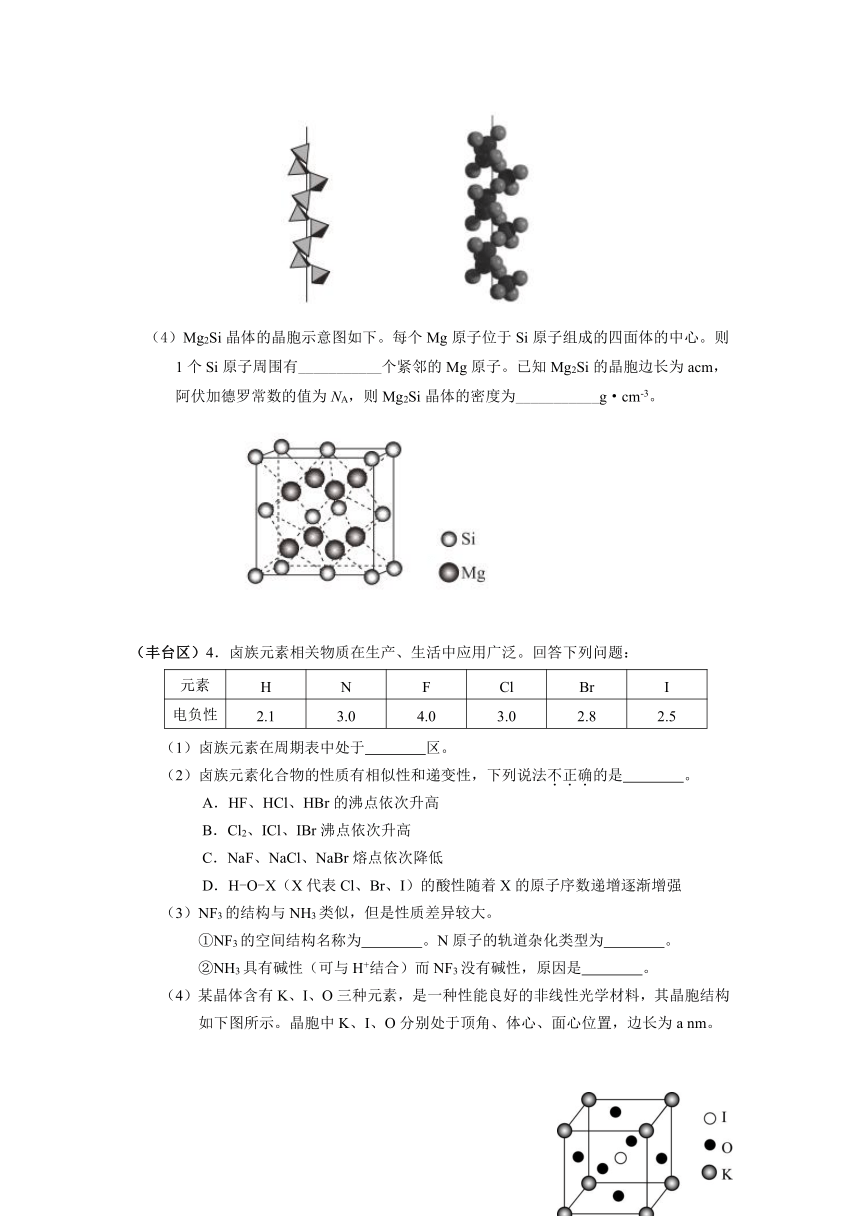
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于___________晶体(填晶体类型),一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如图)。其中Si原子的杂化轨道类型是___________。
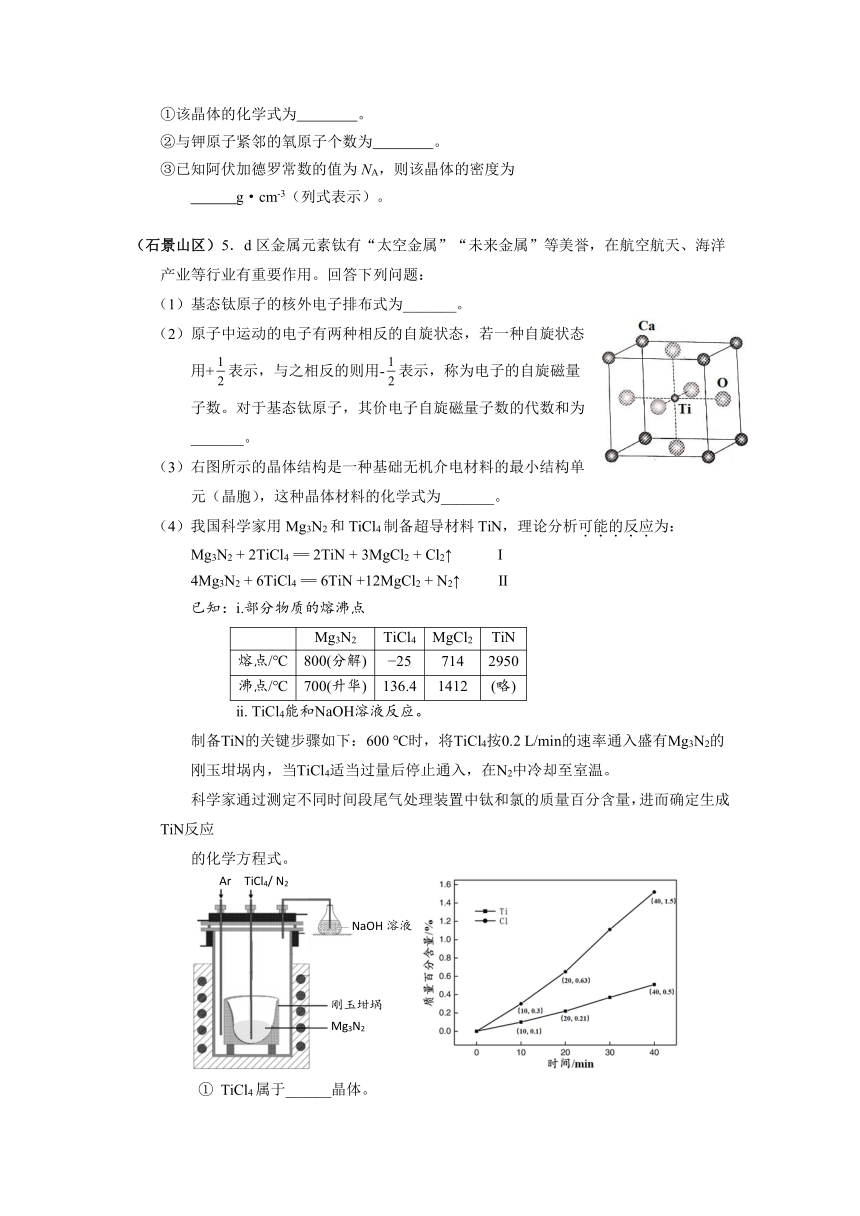
(4)Mg2Si晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________个紧邻的Mg原子。已知Mg2Si的晶胞边长为acm,阿伏加德罗常数的值为NA,则Mg2Si晶体的密度为___________g·cm-3。
(丰台区)4.卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
元素 H N F Cl Br I
电负性 2.1 3.0 4.0 3.0 2.8 2.5
(1)卤族元素在周期表中处于 区。
(2)卤族元素化合物的性质有相似性和递变性,下列说法不正确的是 。
A.HF、HCl、HBr的沸点依次升高
B.Cl2、ICl、IBr沸点依次升高
C.NaF、NaCl、NaBr熔点依次降低
D.H-O-X(X代表Cl、Br、I)的酸性随着X的原子序数递增逐渐增强
(3)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为 。N原子的轨道杂化类型为 。
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是 。
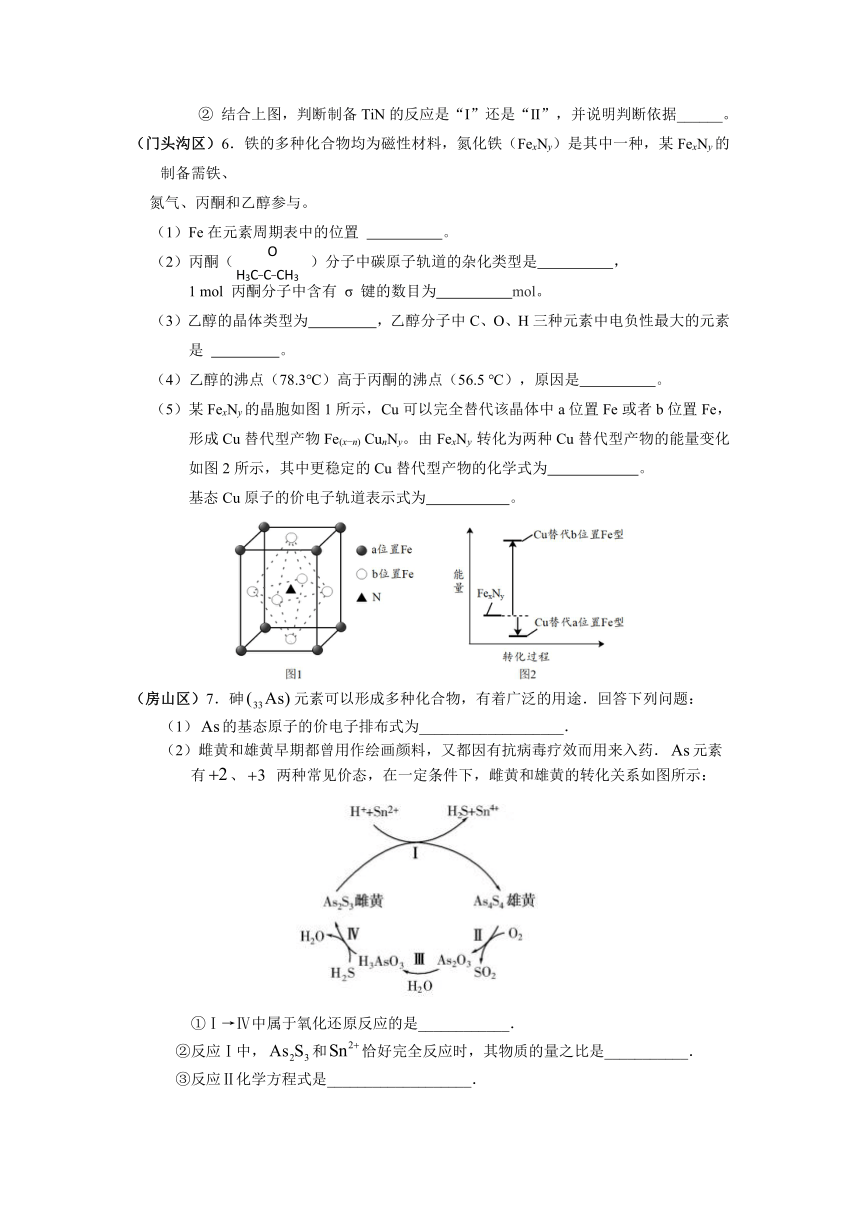
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为a nm。
①该晶体的化学式为 。
②与钾原子紧邻的氧原子个数为 。
③已知阿伏加德罗常数的值为NA,则该晶体的密度为
g·cm-3(列式表示)。
(石景山区)5.d区金属元素钛有“太空金属”“未来金属”等美誉,在航空航天、海洋产业等行业有重要作用。回答下列问题:
(1)基态钛原子的核外电子排布式为_______。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的则用-表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为_______。
(3)右图所示的晶体结构是一种基础无机介电材料的最小结构单元(晶胞),这种晶体材料的化学式为_______。
(4)我国科学家用Mg3N2和TiCl4制备超导材料TiN,理论分析可能的反应为:
Mg3N2 + 2TiCl4 = 2TiN + 3MgCl2 + Cl2↑ Ⅰ
4Mg3N2 + 6TiCl4 = 6TiN +12MgCl2 + N2↑ Ⅱ
已知:ⅰ.部分物质的熔沸点
Mg3N2 TiCl4 MgCl2 TiN
熔点/℃ 800(分解) 25 714 2950
沸点/℃ 700(升华) 136.4 1412 (略)
ⅱ. TiCl4能和NaOH溶液反应。
制备TiN的关键步骤如下:600 ℃时,将TiCl4按0.2 L/min的速率通入盛有Mg3N2的刚玉坩埚内,当TiCl4适当过量后停止通入,在N2中冷却至室温。
科学家通过测定不同时间段尾气处理装置中钛和氯的质量百分含量,进而确定生成TiN反应
的化学方程式。
(
NaOH溶液
刚玉坩埚
Mg
3
N
2
Ar
TiCl
4
/
N
2
)
① TiCl4属于______晶体。
② 结合上图,判断制备TiN的反应是“Ⅰ”还是“Ⅱ”,并说明判断依据______。
(门头沟区)6.铁的多种化合物均为磁性材料,氮化铁(FexNy)是其中一种,某FexNy的制备需铁、
氮气、丙酮和乙醇参与。
(
H
3
C
_
C
_
CH
3
O
H
3
C
_
C
_
CH
3
O
)(1)Fe在元素周期表中的位置 。
(2)丙酮( )分子中碳原子轨道的杂化类型是 ,
1 mol 丙酮分子中含有 σ 键的数目为 mol。
(3)乙醇的晶体类型为 ,乙醇分子中C、O、H三种元素中电负性最大的元素是 。
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5 ℃),原因是 。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x n) CunNy。由FexNy 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为 。
基态Cu原子的价电子轨道表示式为 。
(房山区)7.砷元素可以形成多种化合物,有着广泛的用途.回答下列问题:
(1)的基态原子的价电子排布式为___________________.
(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药.元素有、 两种常见价态,在一定条件下,雌黄和雄黄的转化关系如图所示:
①Ⅰ→Ⅳ中属于氧化还原反应的是____________.
②反应Ⅰ中,和恰好完全反应时,其物质的量之比是___________.
③反应Ⅱ化学方程式是___________________.
(3)砷化镓是一种重要的半导体材料.
①与都是由原子之间以共价键的成键方式结合而成的晶体.熔点为,熔点为,熔点低于的原因为_______.
②砷化镓晶胞结构如下图所示.平均每个晶胞所含的原子个数为_______.
③晶体密度可以用晶胞的质量除以体积来求算.已知晶胞棱长为,阿伏加德罗常数为,则该晶体的密度______(列出计算式即可,的摩尔质量为).
(顺义区)8. 北京时间2021年10月16日,神舟十三号载人飞船发射成功。飞船材料由金
属材料(镁合金、钛合金、铝合金等)和非金属材料加工而成。
钛具有较强抗腐蚀性及强度。
①钛在元素周期表中的位置是 ,基态钛原子的价层电子排布为 ,从结构角度解释TiCl3中Ti还原性较强的原因 。
②钛与卤素形成的化合物的熔沸点如下表所示:
熔点/℃ 沸点/℃
TiCl4 -25 136.5
TiBr4 39 230
TiI4 150 377
TiCl4、 TiBr4、TiI4的熔点和沸点逐渐增大的原因是 。
(2)氧化锆基陶瓷热障涂层是航天发动机的关键技术。下图为立方氧化锆晶胞结构示意图
①氧化锆的化学式是 。
②每个Zr周围等距且紧邻的Zr有 个。
③若晶胞中距离最近的两个Zr原子间的距离为a nm,
则立方氧化锆的密度ρ= g cm-3(列出计算式)(1nm=10-9m,阿伏伽德罗常数用NA代表)。
(昌平区)9. 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)钛元素在周期表中的位置______;基态钛原子的电子排布式为______。
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为______(用元素符号表示);SO的空间构型为______,其中S原子的杂化方式为______。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是______(选填字母序号)。
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,在该晶胞结构中,钛离子、钡离子、氧离子的个数比为______;该物质的化学式为______;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是______;其晶胞参数约为apm,钛酸钡晶体的密度ρ=______g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)。
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编
物质结构与性质 参考答案
(海淀区)1.
(东城区) 2.
(1)六
(2)①. 4 ②. 12
(3)①. 甲
②. 存在同分异构体
③.
④. 2
⑤. 乙分子水解产物的结构为,键角为180°(两个配位氧原子的距离较远),草酸的两个羧基无法与铂同时形成配位键
(西城区)3.
(1)①. 第四周期ⅣA族 ②. 3p
(2)①. ②. 高 ③. SiH4和CH4是结构相似的分子晶体,SiH4的相对分子质量大于CH4,分子间作用力高于CH4
(3)①. 原子 ②. sp3
(4)①. 4 ②.
(丰台区)4.
(1)P
(2)A D
(3)① 三角锥形 sp3
② NF3中F元素电负性强,使得N原子呈正电性(δ+),难与H+结合
(4)① KIO3 ② 12 ③ 214/(NA×a3×10-21)
(石景山区)5.
(1)1s22s22p63s23p63d24s2
(2)+1或 1
(3)CaTiO3
(4)①分子晶体
②制备TiN的反应是Ⅱ,经计算n(Cl) : n(Ti) ≈ 4 : 1,且不同时间段内n(Cl) : n(Ti)不变,NaOH溶液吸收的物质只有TiCl4
(门头沟区)6.
(1)第四周期 VIII族(2分)
(2)sp2和sp3(2分) 9 mol(1分)
(3)分子晶体(1分)O(1分)
(4)乙醇分子间存在氢键(1分)
(
3d 4s 4s
)(5)Fe3CuN(2分)(1分
(房山区)7.
(1)
(2)①Ⅰ、Ⅱ ②
③
(3)①二者均为共价晶体,半径,键长,键能
②4
③
(顺义区)8.
(1)①第四周期Ⅳ族
价层电子为,失去一个电子后,能级处于全空稳定状态,所以易失电子,还原性较强
②、、都是分子晶体,组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高
(2)① ZrO2 ②12
③
(昌平区)9.
(1)①. 第四周期第IVB族 ②. 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)①. O>S>Ba ②. 正四面体形 ③. sp3
(3)c
(4)①. 1:1:3 ②. BaTiO3 ③. 12 ④.
物质结构与性质
(海淀区)1. 碳酸二甲酯()是一种绿色化工原料,用于汽车、医疗器械等领域。以甲醇为原料制备碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中羰基碳原子的杂化类型是 。
(2)CuCl中,基态的价电子排布式为 ,CuCl在生产碳酸二甲酯的反应过程中所起的作用是 。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i甲醇单位时间内的转化率主要受Cu(I)(价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度小,且其中的易被氧化为难溶的CuO。
iii.加入4-甲基咪唑()可与Cu形成配合物,可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大键,电子云密度降低。
请结合信息回答以下问题:
①4-甲基咪唑中,1~4号原子 (填“在”或“不在”)同一平面上, (填“1”或“3”)号N原子更容易与形成配位键。
②加入4-甲基基咪唑后,甲醇转化率提高,可能的原因是 (填序号)。
a.Cu(I)配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的CuO
c.形成的Cu(I)配合物能增大反应的限度
(4)原子提供孤电子对的能力是影响配体与之间配位键强度的重要因素。若用某结构相似的含O配体与配位,所得配合物的稳定性比含N配体低,可能的原因是 。
(东城区)2. 过渡元素铂的单质是一种重要的催化剂,其化合物可用于医药领域。
(1)基态的价层电子排布式是,该元素在元素周期表中位于第___________周期。
(2)的晶胞示意图如下。
①该晶胞中含有的铂原子数目为___________。
②该晶体中,每个铂原子周围与它最近且等距离的铂原子有___________个。
(3)是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为,但只有甲的水解产物能与草酸反应生成。
①根据相似相溶的规律,可推断___________(填“甲”或“乙”)在水中的溶解度较大。
②依据上述信息:___________,可推断不是四面体结构。
③发生水解反应的化学方程式是___________。
④和中铂的配体数不同,但配位数均为4,是由于每个中有___________个原子与铂配位。
⑤查阅资料可知,甲、乙均为平面结构。画出乙的水解产物的空间结构并推测其不能与草酸反应生成的原因:___________。
(西城区)3.硅烷SiH4可用于制造高纯硅。采用硅化镁法制备SiH4的化学方程式如下:Mg2Si+4NH4Cl+8NH3=SiH4+2MgCl2·6NH3
(1)硅在元素周期表中的位置是___________,基态硅原子占据的最高能级的符号是___________。
(2)①SiH4的电子式是___________。
②SiH4的沸点比CH4的___________。(填“高”或“低”),原因是___________。
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于___________晶体(填晶体类型),一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如图)。其中Si原子的杂化轨道类型是___________。
(4)Mg2Si晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________个紧邻的Mg原子。已知Mg2Si的晶胞边长为acm,阿伏加德罗常数的值为NA,则Mg2Si晶体的密度为___________g·cm-3。
(丰台区)4.卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
元素 H N F Cl Br I
电负性 2.1 3.0 4.0 3.0 2.8 2.5
(1)卤族元素在周期表中处于 区。
(2)卤族元素化合物的性质有相似性和递变性,下列说法不正确的是 。
A.HF、HCl、HBr的沸点依次升高
B.Cl2、ICl、IBr沸点依次升高
C.NaF、NaCl、NaBr熔点依次降低
D.H-O-X(X代表Cl、Br、I)的酸性随着X的原子序数递增逐渐增强
(3)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为 。N原子的轨道杂化类型为 。
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是 。
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为a nm。
①该晶体的化学式为 。
②与钾原子紧邻的氧原子个数为 。
③已知阿伏加德罗常数的值为NA,则该晶体的密度为
g·cm-3(列式表示)。
(石景山区)5.d区金属元素钛有“太空金属”“未来金属”等美誉,在航空航天、海洋产业等行业有重要作用。回答下列问题:
(1)基态钛原子的核外电子排布式为_______。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的则用-表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为_______。
(3)右图所示的晶体结构是一种基础无机介电材料的最小结构单元(晶胞),这种晶体材料的化学式为_______。
(4)我国科学家用Mg3N2和TiCl4制备超导材料TiN,理论分析可能的反应为:
Mg3N2 + 2TiCl4 = 2TiN + 3MgCl2 + Cl2↑ Ⅰ
4Mg3N2 + 6TiCl4 = 6TiN +12MgCl2 + N2↑ Ⅱ
已知:ⅰ.部分物质的熔沸点
Mg3N2 TiCl4 MgCl2 TiN
熔点/℃ 800(分解) 25 714 2950
沸点/℃ 700(升华) 136.4 1412 (略)
ⅱ. TiCl4能和NaOH溶液反应。
制备TiN的关键步骤如下:600 ℃时,将TiCl4按0.2 L/min的速率通入盛有Mg3N2的刚玉坩埚内,当TiCl4适当过量后停止通入,在N2中冷却至室温。
科学家通过测定不同时间段尾气处理装置中钛和氯的质量百分含量,进而确定生成TiN反应
的化学方程式。
(
NaOH溶液
刚玉坩埚
Mg
3
N
2
Ar
TiCl
4
/
N
2
)
① TiCl4属于______晶体。
② 结合上图,判断制备TiN的反应是“Ⅰ”还是“Ⅱ”,并说明判断依据______。
(门头沟区)6.铁的多种化合物均为磁性材料,氮化铁(FexNy)是其中一种,某FexNy的制备需铁、
氮气、丙酮和乙醇参与。
(
H
3
C
_
C
_
CH
3
O
H
3
C
_
C
_
CH
3
O
)(1)Fe在元素周期表中的位置 。
(2)丙酮( )分子中碳原子轨道的杂化类型是 ,
1 mol 丙酮分子中含有 σ 键的数目为 mol。
(3)乙醇的晶体类型为 ,乙醇分子中C、O、H三种元素中电负性最大的元素是 。
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5 ℃),原因是 。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x n) CunNy。由FexNy 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为 。
基态Cu原子的价电子轨道表示式为 。
(房山区)7.砷元素可以形成多种化合物,有着广泛的用途.回答下列问题:
(1)的基态原子的价电子排布式为___________________.
(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药.元素有、 两种常见价态,在一定条件下,雌黄和雄黄的转化关系如图所示:
①Ⅰ→Ⅳ中属于氧化还原反应的是____________.
②反应Ⅰ中,和恰好完全反应时,其物质的量之比是___________.
③反应Ⅱ化学方程式是___________________.
(3)砷化镓是一种重要的半导体材料.
①与都是由原子之间以共价键的成键方式结合而成的晶体.熔点为,熔点为,熔点低于的原因为_______.
②砷化镓晶胞结构如下图所示.平均每个晶胞所含的原子个数为_______.
③晶体密度可以用晶胞的质量除以体积来求算.已知晶胞棱长为,阿伏加德罗常数为,则该晶体的密度______(列出计算式即可,的摩尔质量为).
(顺义区)8. 北京时间2021年10月16日,神舟十三号载人飞船发射成功。飞船材料由金
属材料(镁合金、钛合金、铝合金等)和非金属材料加工而成。
钛具有较强抗腐蚀性及强度。
①钛在元素周期表中的位置是 ,基态钛原子的价层电子排布为 ,从结构角度解释TiCl3中Ti还原性较强的原因 。
②钛与卤素形成的化合物的熔沸点如下表所示:
熔点/℃ 沸点/℃
TiCl4 -25 136.5
TiBr4 39 230
TiI4 150 377
TiCl4、 TiBr4、TiI4的熔点和沸点逐渐增大的原因是 。
(2)氧化锆基陶瓷热障涂层是航天发动机的关键技术。下图为立方氧化锆晶胞结构示意图
①氧化锆的化学式是 。
②每个Zr周围等距且紧邻的Zr有 个。
③若晶胞中距离最近的两个Zr原子间的距离为a nm,
则立方氧化锆的密度ρ= g cm-3(列出计算式)(1nm=10-9m,阿伏伽德罗常数用NA代表)。
(昌平区)9. 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)钛元素在周期表中的位置______;基态钛原子的电子排布式为______。
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为______(用元素符号表示);SO的空间构型为______,其中S原子的杂化方式为______。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是______(选填字母序号)。
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,在该晶胞结构中,钛离子、钡离子、氧离子的个数比为______;该物质的化学式为______;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是______;其晶胞参数约为apm,钛酸钡晶体的密度ρ=______g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)。
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编
物质结构与性质 参考答案
(海淀区)1.
(东城区) 2.
(1)六
(2)①. 4 ②. 12
(3)①. 甲
②. 存在同分异构体
③.
④. 2
⑤. 乙分子水解产物的结构为,键角为180°(两个配位氧原子的距离较远),草酸的两个羧基无法与铂同时形成配位键
(西城区)3.
(1)①. 第四周期ⅣA族 ②. 3p
(2)①. ②. 高 ③. SiH4和CH4是结构相似的分子晶体,SiH4的相对分子质量大于CH4,分子间作用力高于CH4
(3)①. 原子 ②. sp3
(4)①. 4 ②.
(丰台区)4.
(1)P
(2)A D
(3)① 三角锥形 sp3
② NF3中F元素电负性强,使得N原子呈正电性(δ+),难与H+结合
(4)① KIO3 ② 12 ③ 214/(NA×a3×10-21)
(石景山区)5.
(1)1s22s22p63s23p63d24s2
(2)+1或 1
(3)CaTiO3
(4)①分子晶体
②制备TiN的反应是Ⅱ,经计算n(Cl) : n(Ti) ≈ 4 : 1,且不同时间段内n(Cl) : n(Ti)不变,NaOH溶液吸收的物质只有TiCl4
(门头沟区)6.
(1)第四周期 VIII族(2分)
(2)sp2和sp3(2分) 9 mol(1分)
(3)分子晶体(1分)O(1分)
(4)乙醇分子间存在氢键(1分)
(
3d 4s 4s
)(5)Fe3CuN(2分)(1分
(房山区)7.
(1)
(2)①Ⅰ、Ⅱ ②
③
(3)①二者均为共价晶体,半径,键长,键能
②4
③
(顺义区)8.
(1)①第四周期Ⅳ族
价层电子为,失去一个电子后,能级处于全空稳定状态,所以易失电子,还原性较强
②、、都是分子晶体,组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高
(2)① ZrO2 ②12
③
(昌平区)9.
(1)①. 第四周期第IVB族 ②. 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)①. O>S>Ba ②. 正四面体形 ③. sp3
(3)c
(4)①. 1:1:3 ②. BaTiO3 ③. 12 ④.
同课章节目录
