陕西省蓝光中学2021-2022学年高三上学期期末教学检测化学试题(word版含答案)
文档属性
| 名称 | 陕西省蓝光中学2021-2022学年高三上学期期末教学检测化学试题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 449.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-19 20:57:41 | ||
图片预览

文档简介
绝密★启用前
蓝光中学2021-2022年度第一学期期未教学检测
高三化学试题
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息;
2.请将答案正确填写在答题卡上;
可能用到的相对原子质量 C-12 N-14 O-16 Na-23 AI-27 S-32 CI-35.5 Fe-56 Cu-64
卷I(选择题)
一、 选择题 (本题共计 16 小题 ,每题 3 分 ,共计48分 )
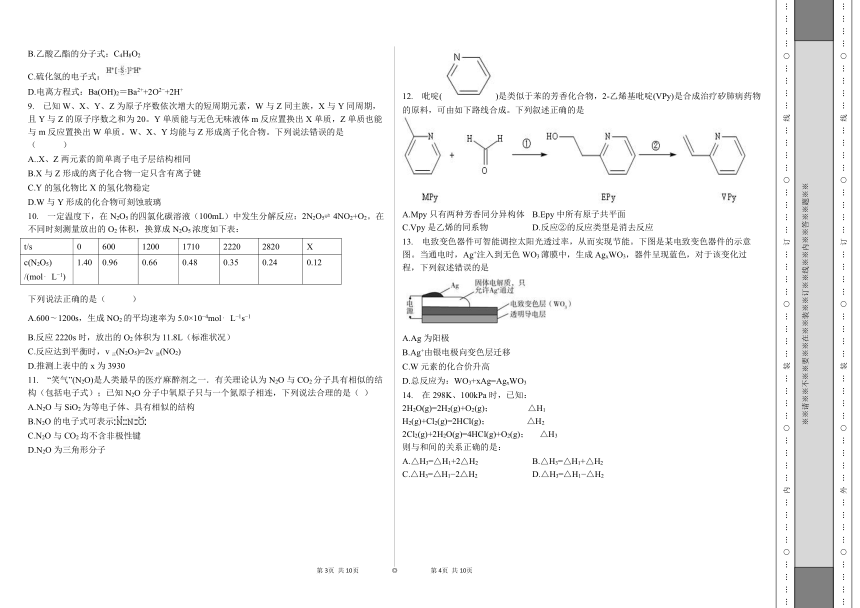
1. 下列操作规范且能达到实验目的的是( )
A. 测定醋酸浓度 B. 测定中和热
C. 稀释浓硫酸 D. 萃取分离碘水中的碘
2. NA是阿伏加德罗常数的值,下列说法错误的是( )
A.22.4L(标准状况)氟气所含的质子数为18NA
B.1moL碘蒸气和1moL氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1L 1moL L 1溴化铵水溶液中NH4+与H+与离子数之和大于NA
3. 不能正确表示下列变化的离子方程式是( )
A.碳酸镁与稀盐酸反应:CO32 +2H+===CO2↑+H2O
B.亚硫酸氢钠的水解:HSO3 +H2O H2SO3+OH
C.锌溶于氢氧化钠溶液:Zn+2OH +2H2O===[Zn(OH)4]2 +H2↑
D.亚硝酸钠与氯化铵溶液受热反应:NO2 +NH4+===N2↑+2H2O
4. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
5. 近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是( )
A.“天宫二号”航天器使用的质量轻强度高的材料——钛合金
B.“北斗三号”导航卫星使用的太阳能电池材料——砷化镓
C.“长征五号”运载火箭使用的高效燃料——液氢
D.“C919”飞机身使用的复合材料——碳纤维和环氧树脂
6. 化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.铝合金大量用于高铁建设
C.活性炭具有除异味和杀菌作用
D.碘酒可用于皮肤外用消毒
7. 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
A.海水酸化能引起浓度增大、浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.能引起海水酸化,其原理为+H+
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
8. 下列化学用语表示正确的是( )
A.铝离子的结构示意图:
B.乙酸乙酯的分子式:C4H8O2
C.硫化氢的电子式:
D.电离方程式:Ba(OH)2=Ba2++2O2 +2H+
9. 已知W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20。Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。W、X、Y均能与Z形成离子化合物。下列说法错误的是( )
A..X、Z两元素的简单离子电子层结构相同
B.X与Z形成的离子化合物一定只含有离子键
C.Y的氢化物比X的氢化物稳定
D.W与Y形成的化合物可刻蚀玻璃
t/s 0 600 1200 1710 2220 2820 X
c(N2O5) /(mol L 1) 1.40 0.96 0.66 0.48 0.35 0.24 0.12
10. 一定温度下,在N2O5的四氯化碳溶液(100mL)中发生分解反应:2N2O5 4NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
下列说法正确的是( )
A.600 1200s,生成NO2的平均速率为5.0×10 4mol L 1s 1
B.反应2220s时,放出的O2体积为11.8L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3930
11. “笑气”(N2O)是人类最早的医疗麻醉剂之一.有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是( )
A.N2O与SiO2为等电子体、具有相似的结构
B.N2O的电子式可表示
C.N2O与CO2均不含非极性键
D.N2O为三角形分子
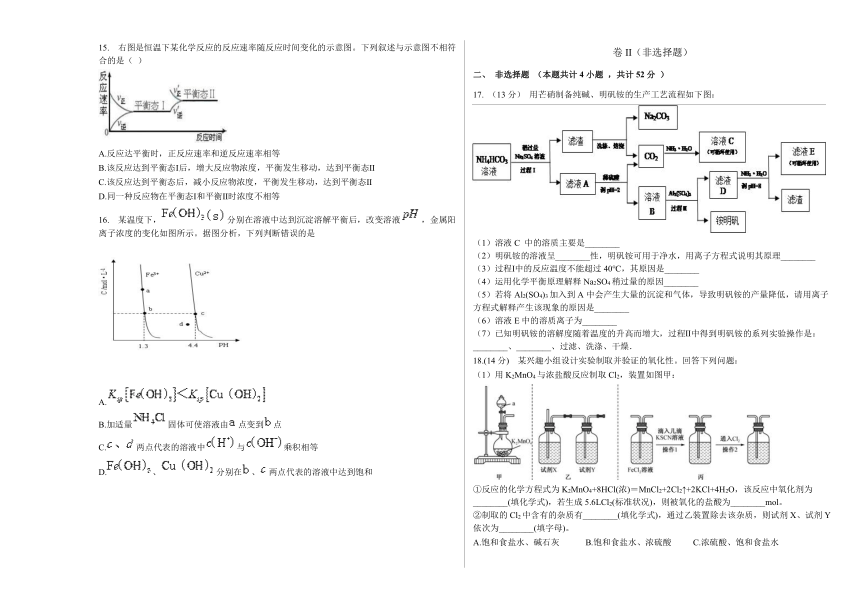
12. 吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述正确的是
A.Mpy只有两种芳香同分异构体 B.Epy中所有原子共平面
C.Vpy是乙烯的同系物 D.反应②的反应类型是消去反应
13. 电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
A.Ag为阳极
B.Ag+由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:WO3+xAg=AgxWO3
14. 在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g); △H1
H2(g)+Cl2(g)=2HCl(g); △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g); △H3
则与和间的关系正确的是:
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1 2△H2 D.△H3=△H1 △H2
15. 右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A.
B.加适量固体可使溶液由点变到点
C.两点代表的溶液中与乘积相等
D.、分别在、两点代表的溶液中达到饱和
卷II(非选择题)
二、 非选择题 (本题共计4小题 ,共计52分 )
(13分) 用芒硝制备纯碱、明矾铵的生产工艺流程如下图:
(1)溶液C 中的溶质主要是________
(2)明矾铵的溶液呈________性,明矾铵可用于净水,用离子方程式说明其原理________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是________
(4)运用化学平衡原理解释Na2SO4稍过量的原因________
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是________
(6)溶液E中的溶质离子为________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是:________、________、过滤、洗涤、干燥.
18.(14分) 某兴趣小组设计实验制取并验证的氧化性。回答下列问题:
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:
①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为________(填化学式),若生成5.6LCl2(标准状况),则被氧化的盐酸为________mol。
②制取的Cl2中含有的杂质有________(填化学式),通过乙装置除去该杂质,则试剂X、试剂Y依次为________(填字母)。
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为________________,操作2后观察到现象为________________,产生操作2后现象的原因是________________________(用必要的语言和离子方程式说明)。
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是________(填“KMnO4”或“K2MnO4”)。
19.(13分) 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4):n(H2O)=________。当反应达到平衡时,若增大压强,则n(C2H4)________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2):n(H2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是________、________。CO2催化加氢合成C2H4反应的ΔH_____0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_____________(MPa) 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当_______________________。
20.(12分) 苯基环丁烯酮(PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
已知如下信息:
回答选下列问题:
(1)A的化学名称是______________。
(2)B的结构简式为________。
(3)由C生成D所用的试剂和反应条件为_____________;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,该副产物的结构简式为_____________。
(4)写出化合物E中含氧官能团的名称________;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。
(5)M为C的一种同分异构体。已知:1molM与饱和碳酸氢钠溶液充分反应能放出2mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为____________。
(6)对于,选用不同的取代基R′,在催化剂作用下与PCBO发生的
[4+2]反应进行深入研究,R′对产率的影响见下表:
R′ -CH3 -C2H5 -CH2CH2C6H5
产率 91 80 63
请找出规律,并解释原因_________________________________________。
2021-2022学年度蓝光中学高三上学期期末考试
参考答案与试题解析
一、 选择题 (本题共计 16 小题 ,每题 3 分 ,共计48分 )
1.A 2.C 3.A 4.D 5.A 6.C 7.C 8.B 9.B 10.D 11.B 12.D 13.C 14.A 15.C 16.B
17.(1)NH4HCO3, (2) 酸, Al3++3H2O Al(OH)3+3H+, (3) NH4HCO3易受热分解,
(4)HCO32 (aq)+Na+(aq) NaHCO3(s),Na+浓度增大平衡向正反应方向移,
(5)Al3++3HCO32 =Al(OH)3↓+3CO2↑, (6)NH4+、SO42 , (7)蒸发浓缩,冷却结晶
18.(1) C
(2)无(明显)现象 溶液变为血红色
2Fe2++Cl2=2Fe3++2Cl Fe3+与SCN 反应,生成血红色的Fe(SCN)3
(3)KMnO4
19.(1)1:4,变大
(2)d,c, 小于
(3)或等
(4)选择合适催化剂等
20. (1)羟基苯甲醛(水杨醛)
(2) (3)乙醇、浓硫酸/加热,
(4)羟基、酯基, 2 (5)
(6)随着R′体积增大,产率降低;原因是R′体积增大,位阻增大
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
第3页 共16页 ◎ 第4页 共16页
蓝光中学2021-2022年度第一学期期未教学检测
高三化学试题
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息;
2.请将答案正确填写在答题卡上;
可能用到的相对原子质量 C-12 N-14 O-16 Na-23 AI-27 S-32 CI-35.5 Fe-56 Cu-64
卷I(选择题)
一、 选择题 (本题共计 16 小题 ,每题 3 分 ,共计48分 )
1. 下列操作规范且能达到实验目的的是( )
A. 测定醋酸浓度 B. 测定中和热
C. 稀释浓硫酸 D. 萃取分离碘水中的碘
2. NA是阿伏加德罗常数的值,下列说法错误的是( )
A.22.4L(标准状况)氟气所含的质子数为18NA
B.1moL碘蒸气和1moL氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1L 1moL L 1溴化铵水溶液中NH4+与H+与离子数之和大于NA
3. 不能正确表示下列变化的离子方程式是( )
A.碳酸镁与稀盐酸反应:CO32 +2H+===CO2↑+H2O
B.亚硫酸氢钠的水解:HSO3 +H2O H2SO3+OH
C.锌溶于氢氧化钠溶液:Zn+2OH +2H2O===[Zn(OH)4]2 +H2↑
D.亚硝酸钠与氯化铵溶液受热反应:NO2 +NH4+===N2↑+2H2O
4. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
5. 近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是( )
A.“天宫二号”航天器使用的质量轻强度高的材料——钛合金
B.“北斗三号”导航卫星使用的太阳能电池材料——砷化镓
C.“长征五号”运载火箭使用的高效燃料——液氢
D.“C919”飞机身使用的复合材料——碳纤维和环氧树脂
6. 化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.铝合金大量用于高铁建设
C.活性炭具有除异味和杀菌作用
D.碘酒可用于皮肤外用消毒
7. 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
A.海水酸化能引起浓度增大、浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.能引起海水酸化,其原理为+H+
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
8. 下列化学用语表示正确的是( )
A.铝离子的结构示意图:
B.乙酸乙酯的分子式:C4H8O2
C.硫化氢的电子式:
D.电离方程式:Ba(OH)2=Ba2++2O2 +2H+
9. 已知W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20。Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。W、X、Y均能与Z形成离子化合物。下列说法错误的是( )
A..X、Z两元素的简单离子电子层结构相同
B.X与Z形成的离子化合物一定只含有离子键
C.Y的氢化物比X的氢化物稳定
D.W与Y形成的化合物可刻蚀玻璃
t/s 0 600 1200 1710 2220 2820 X
c(N2O5) /(mol L 1) 1.40 0.96 0.66 0.48 0.35 0.24 0.12
10. 一定温度下,在N2O5的四氯化碳溶液(100mL)中发生分解反应:2N2O5 4NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
下列说法正确的是( )
A.600 1200s,生成NO2的平均速率为5.0×10 4mol L 1s 1
B.反应2220s时,放出的O2体积为11.8L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3930
11. “笑气”(N2O)是人类最早的医疗麻醉剂之一.有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是( )
A.N2O与SiO2为等电子体、具有相似的结构
B.N2O的电子式可表示
C.N2O与CO2均不含非极性键
D.N2O为三角形分子
12. 吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述正确的是
A.Mpy只有两种芳香同分异构体 B.Epy中所有原子共平面
C.Vpy是乙烯的同系物 D.反应②的反应类型是消去反应
13. 电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
A.Ag为阳极
B.Ag+由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:WO3+xAg=AgxWO3
14. 在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g); △H1
H2(g)+Cl2(g)=2HCl(g); △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g); △H3
则与和间的关系正确的是:
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1 2△H2 D.△H3=△H1 △H2
15. 右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A.
B.加适量固体可使溶液由点变到点
C.两点代表的溶液中与乘积相等
D.、分别在、两点代表的溶液中达到饱和
卷II(非选择题)
二、 非选择题 (本题共计4小题 ,共计52分 )
(13分) 用芒硝制备纯碱、明矾铵的生产工艺流程如下图:
(1)溶液C 中的溶质主要是________
(2)明矾铵的溶液呈________性,明矾铵可用于净水,用离子方程式说明其原理________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是________
(4)运用化学平衡原理解释Na2SO4稍过量的原因________
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是________
(6)溶液E中的溶质离子为________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是:________、________、过滤、洗涤、干燥.
18.(14分) 某兴趣小组设计实验制取并验证的氧化性。回答下列问题:
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:
①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为________(填化学式),若生成5.6LCl2(标准状况),则被氧化的盐酸为________mol。
②制取的Cl2中含有的杂质有________(填化学式),通过乙装置除去该杂质,则试剂X、试剂Y依次为________(填字母)。
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为________________,操作2后观察到现象为________________,产生操作2后现象的原因是________________________(用必要的语言和离子方程式说明)。
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是________(填“KMnO4”或“K2MnO4”)。
19.(13分) 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4):n(H2O)=________。当反应达到平衡时,若增大压强,则n(C2H4)________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2):n(H2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是________、________。CO2催化加氢合成C2H4反应的ΔH_____0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_____________(MPa) 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当_______________________。
20.(12分) 苯基环丁烯酮(PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
已知如下信息:
回答选下列问题:
(1)A的化学名称是______________。
(2)B的结构简式为________。
(3)由C生成D所用的试剂和反应条件为_____________;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,该副产物的结构简式为_____________。
(4)写出化合物E中含氧官能团的名称________;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。
(5)M为C的一种同分异构体。已知:1molM与饱和碳酸氢钠溶液充分反应能放出2mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为____________。
(6)对于,选用不同的取代基R′,在催化剂作用下与PCBO发生的
[4+2]反应进行深入研究,R′对产率的影响见下表:
R′ -CH3 -C2H5 -CH2CH2C6H5
产率 91 80 63
请找出规律,并解释原因_________________________________________。
2021-2022学年度蓝光中学高三上学期期末考试
参考答案与试题解析
一、 选择题 (本题共计 16 小题 ,每题 3 分 ,共计48分 )
1.A 2.C 3.A 4.D 5.A 6.C 7.C 8.B 9.B 10.D 11.B 12.D 13.C 14.A 15.C 16.B
17.(1)NH4HCO3, (2) 酸, Al3++3H2O Al(OH)3+3H+, (3) NH4HCO3易受热分解,
(4)HCO32 (aq)+Na+(aq) NaHCO3(s),Na+浓度增大平衡向正反应方向移,
(5)Al3++3HCO32 =Al(OH)3↓+3CO2↑, (6)NH4+、SO42 , (7)蒸发浓缩,冷却结晶
18.(1) C
(2)无(明显)现象 溶液变为血红色
2Fe2++Cl2=2Fe3++2Cl Fe3+与SCN 反应,生成血红色的Fe(SCN)3
(3)KMnO4
19.(1)1:4,变大
(2)d,c, 小于
(3)或等
(4)选择合适催化剂等
20. (1)羟基苯甲醛(水杨醛)
(2) (3)乙醇、浓硫酸/加热,
(4)羟基、酯基, 2 (5)
(6)随着R′体积增大,产率降低;原因是R′体积增大,位阻增大
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
第3页 共16页 ◎ 第4页 共16页
同课章节目录
