安徽省怀宁县第二中学2021-2022学年高三上学期期末考试化学试题(含答案)
文档属性
| 名称 | 安徽省怀宁县第二中学2021-2022学年高三上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 308.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-26 11:40:49 | ||
图片预览



文档简介
2021—2022学年度第一学期期末考试
高三化学试题
命题人:
一、单选题(22小题,每题2.5分,共55分)
1.化学在生产和日常生活中有着重要的作用。下列有关说法正确的是
A.福尔马林可作食品的保鲜剂
B.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.浓硫酸可刻蚀石英制艺术品
2.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25 ℃、1.01×105 Pa状态下,1 mol SO2中含有的原子总数为3NA
C.常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.1L1.0 mol·L-1盐酸中含有NA个HCl分子
3.我国出土的文物呈现了瑰丽的历史文化。下列文物中,主要成分属于合金的是
A. A B. B C. C D. D
4.常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Fe3+、NH4+、Br-、CO32-
B. 0.1mol L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO42-
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO32-、AlO2-
D. 水电离产生的c(H+)=10-13mol L-1的溶液中:K+、Ca2+、NO3-、HCO3-
5.下列各项操作或现象能达到预期实验目的的是
选项 操作或现象 实验目的
A 将铁钉放入试管中,用盐酸浸没 验证铁的吸氧腐蚀
B 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 证明Br- 还原性强于Cl-
C 将氯化亚铁固体溶于适量蒸馏水中 配制FeCl2 溶液
D 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 除去氯气中的HCl气体
6.下列制备金属单质的方法或原理正确的是
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
7.元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
R
X T Z
Q
A. 简单离子半径:R<T<X
B. X元素在自然界中只存在化合态
C. 气态氢化物的稳定性:R<T<Q
D. 最高价氧化物的水化物的酸性:T<X
8.下列离子方程式中正确的是
A. 用铁电极电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑
B. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2
C. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D. 向Mg(HCO3)2溶液中加入过量的NaOH溶液: Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O
9.一种用于驱动检验管道焊缝设备爬行器的甲醇-燃料电池的工作原理示意如图,下列有关该电池说法正确的是
A. 该电池工作时,每消耗22.4 L CH3OH转移6 mol电子
B. 电子由电极A经负载流向电极B,再经过氢氧化钠溶液返回电极A,形成闭合回路
C. 电池工作时,OH-向电极A移动,溶液的pH减小
D. 电极B上发生的电极反应为O2+4H++4e-═2H2O
10. Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A. Na2O2只作氧化剂
B. 2 mol FeSO4发生反应时,共有8 mol电子转移
C. 每生成22.4L氧气就有2 mol Fe2+ 被氧化
D. Na2FeO4既是还原产物又是氧化产物
11.进行下列实验,相关说法正确的是
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
12.已知反应:① 2H2(g)+O2(g)===2H2O(g) ΔH1
② N2(g)+2O2(g)===2NO2(g) ΔH2
③ N2(g)+3H2(g)===2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g)===4NO2(g)+6H2O(g)的ΔH为
A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3 D.3ΔH1+2ΔH2+2ΔH3
13.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
D.可加入硫酸以提高电解质的导电性
14.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Z>W
B.QZ2所形成的分子空间构型为直线形
C.Q和W可形成原子个数比为1:1和2:1的化合物
D.X、Z和W三种元素形成的化合物的水溶液可能呈碱性
15.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A.反应的化学方程式为X(g)+Y(g)===Z(g)
B.反应开始到10s时Y的转化率为79.0%
C.反应开始到10s,X的物质的量浓度减少了0.79mol/L
D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
16.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是
A.a,b,c三点溶液的n(H+):c<a<b
B.a,b,c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a,b,c三点溶液用1 mol L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b
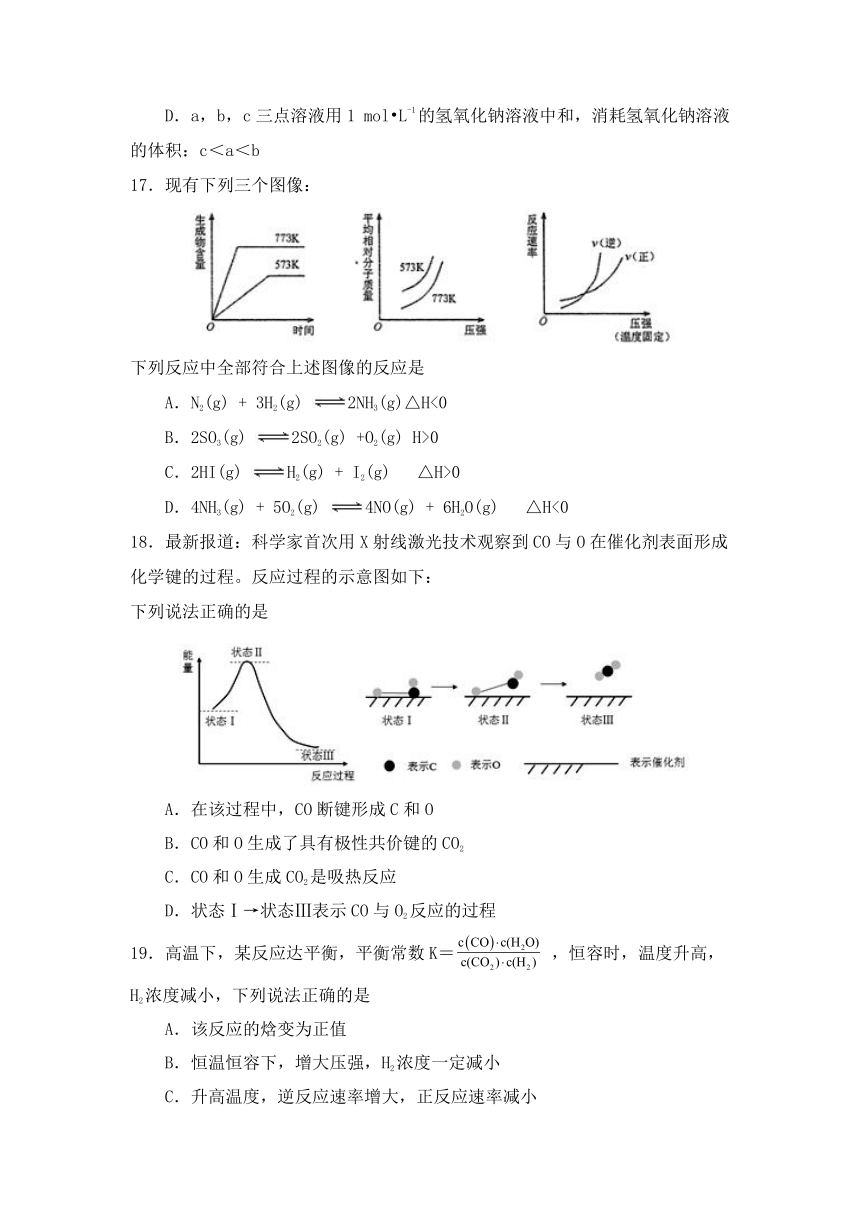
17.现有下列三个图像:
下列反应中全部符合上述图像的反应是
A.N2(g) + 3H2(g) 2NH3(g)△H<0
B.2SO3(g) 2SO2(g) +O2(g) H>0
C.2HI(g) H2(g) + I2(g) △H>0
D.4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H<0
18.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是
A.在该过程中,CO断键形成C和O
B.CO和O生成了具有极性共价键的CO2
C.CO和O生成CO2是吸热反应
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
19.高温下,某反应达平衡,平衡常数K= ,恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率增大,正反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
20.下列说法正确的是
A.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0
B.0.1mol/L氨水加水稀释后,溶液中的值减小
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大
21.下列叙述正确的是
A.常温下pH=1的盐酸与pH=13的Ba(OH)2溶液中水的电离程度相等
B.物质的量浓度均为0.1mol L﹣1的H2SO4和NaOH溶液等体积混合后pH>7
C.分别将pH=3的盐酸、醋酸稀释100倍后,pH都为5
D.pH=14与pH=12的两种NaOH溶液等体积混和后,c(H+)=(10﹣14+10﹣12)
22.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是
A.溶液酸性越强,R的降解速率越小
B.在0-50min时,pH=2和pH=7时R的降解百
分率相等
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04 mol L-1 min-1
二、填空题(共45分)
23.(8分)短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)C元素在周期表中的位置是 。
(2)B、C组成的一种化合物与水发生反应生成气体,其化学方程式为:_______________ 。
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X、Y均为石墨电极,接通直流电源。
X电极的电极反应式为 。
电解池总反应的离子方程式为: 。
24.(14分)碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0 g。
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:________________。
(2)装置D中生成沉淀,发生反应的离子方程式为______________________。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是: 。
(4)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为4.8 g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为_______mol。
(5)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 预期现象和结论
步骤1:取反应后装置C中的少许固体于试管中
步骤2:__________________________________ _________________
25.(13分) 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Al(OH)3 Co(OH)2 Fe(OH)2 Mn(OH)2
完全沉淀的pH 3.7 5.2 9.2 9.6 9.8
(1)浸出过程中加入Na2SO3的主要目的是___________________________。
(2)向浸出液中加入NaClO3的离子反应方程式:_____________________。
(3)已知:常温下NH3·H2ONH4++OH- Kb=1.8×10-5
H2C2O4H++HC2O4- Ka1=5.4×10-2
HC2O4-H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH____7 (填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选试剂_____(填字母代号)。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除去锰离子,其使用的适宜pH范围是________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是____________。[注:Ar(Co)=59]
26.(10分)液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) NH3(g) + HI(g) b.2HI(g) H2(g) + I2(g)
①写出反应a的平衡常数表达式 。
②达到平衡后,扩大容器体积,达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大 e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为 kJ。
②0~1 h内N2的平均反应速率为 。
2021—2022学年度第一学期期末考试
高三化学试题参考答案
一、单选题(22小题,每题2.5分,共55分)
题号 1 2 3 4 5 6 7 8 9 10 11
答案 C B D B B B A D C D B
题号 12 13 14 15 16 17 18 19 20 21 22
答案 C A C B B B B A A A B
二、填空题(共45分)
23.(8分)
(1)第三周期IA族
(2)2Na2O2+2H2O=4NaOH +O2↑
(3)2H+ +2e- =H2↑
2Cl + 2H2O 通电 = Cl2↑+H2 ↑+2OH-↑
24.(14分)
(1)Mg(OH)2+NH4Cl △= MgOHCl+NH3↑+H2O;
(2)Al3+ +3NH3H2O=Al(OH)3 ↓ + 3NH4+ (3)防止倒吸; (4)0.15
(5)步骤2:向试管中加入2mol/LH2SO4溶液
现象和结论:液中出现蓝色,说明红色固体中含有Cu2O
25.(13分)
(1)将Co3+ 还原为Co2+ (2)ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O
(3)< (4)A (5)B (6)Co2O3
26.(10分)
(1)① k=c(NH3) c(HI) ②变浅
(2) b、d
(3)①27.78 ②0.05mol/(L h)
高三化学试题
命题人:
一、单选题(22小题,每题2.5分,共55分)
1.化学在生产和日常生活中有着重要的作用。下列有关说法正确的是
A.福尔马林可作食品的保鲜剂
B.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.浓硫酸可刻蚀石英制艺术品
2.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25 ℃、1.01×105 Pa状态下,1 mol SO2中含有的原子总数为3NA
C.常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.1L1.0 mol·L-1盐酸中含有NA个HCl分子
3.我国出土的文物呈现了瑰丽的历史文化。下列文物中,主要成分属于合金的是
A. A B. B C. C D. D
4.常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Fe3+、NH4+、Br-、CO32-
B. 0.1mol L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO42-
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO32-、AlO2-
D. 水电离产生的c(H+)=10-13mol L-1的溶液中:K+、Ca2+、NO3-、HCO3-
5.下列各项操作或现象能达到预期实验目的的是
选项 操作或现象 实验目的
A 将铁钉放入试管中,用盐酸浸没 验证铁的吸氧腐蚀
B 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 证明Br- 还原性强于Cl-
C 将氯化亚铁固体溶于适量蒸馏水中 配制FeCl2 溶液
D 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 除去氯气中的HCl气体
6.下列制备金属单质的方法或原理正确的是
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
7.元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
R
X T Z
Q
A. 简单离子半径:R<T<X
B. X元素在自然界中只存在化合态
C. 气态氢化物的稳定性:R<T<Q
D. 最高价氧化物的水化物的酸性:T<X
8.下列离子方程式中正确的是
A. 用铁电极电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑
B. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2
C. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D. 向Mg(HCO3)2溶液中加入过量的NaOH溶液: Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O
9.一种用于驱动检验管道焊缝设备爬行器的甲醇-燃料电池的工作原理示意如图,下列有关该电池说法正确的是
A. 该电池工作时,每消耗22.4 L CH3OH转移6 mol电子
B. 电子由电极A经负载流向电极B,再经过氢氧化钠溶液返回电极A,形成闭合回路
C. 电池工作时,OH-向电极A移动,溶液的pH减小
D. 电极B上发生的电极反应为O2+4H++4e-═2H2O
10. Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A. Na2O2只作氧化剂
B. 2 mol FeSO4发生反应时,共有8 mol电子转移
C. 每生成22.4L氧气就有2 mol Fe2+ 被氧化
D. Na2FeO4既是还原产物又是氧化产物
11.进行下列实验,相关说法正确的是
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
12.已知反应:① 2H2(g)+O2(g)===2H2O(g) ΔH1
② N2(g)+2O2(g)===2NO2(g) ΔH2
③ N2(g)+3H2(g)===2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g)===4NO2(g)+6H2O(g)的ΔH为
A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3 D.3ΔH1+2ΔH2+2ΔH3
13.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
D.可加入硫酸以提高电解质的导电性
14.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Z>W
B.QZ2所形成的分子空间构型为直线形
C.Q和W可形成原子个数比为1:1和2:1的化合物
D.X、Z和W三种元素形成的化合物的水溶液可能呈碱性
15.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A.反应的化学方程式为X(g)+Y(g)===Z(g)
B.反应开始到10s时Y的转化率为79.0%
C.反应开始到10s,X的物质的量浓度减少了0.79mol/L
D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
16.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是
A.a,b,c三点溶液的n(H+):c<a<b
B.a,b,c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a,b,c三点溶液用1 mol L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b
17.现有下列三个图像:
下列反应中全部符合上述图像的反应是
A.N2(g) + 3H2(g) 2NH3(g)△H<0
B.2SO3(g) 2SO2(g) +O2(g) H>0
C.2HI(g) H2(g) + I2(g) △H>0
D.4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H<0
18.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是
A.在该过程中,CO断键形成C和O
B.CO和O生成了具有极性共价键的CO2
C.CO和O生成CO2是吸热反应
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
19.高温下,某反应达平衡,平衡常数K= ,恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率增大,正反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
20.下列说法正确的是
A.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0
B.0.1mol/L氨水加水稀释后,溶液中的值减小
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大
21.下列叙述正确的是
A.常温下pH=1的盐酸与pH=13的Ba(OH)2溶液中水的电离程度相等
B.物质的量浓度均为0.1mol L﹣1的H2SO4和NaOH溶液等体积混合后pH>7
C.分别将pH=3的盐酸、醋酸稀释100倍后,pH都为5
D.pH=14与pH=12的两种NaOH溶液等体积混和后,c(H+)=(10﹣14+10﹣12)
22.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是
A.溶液酸性越强,R的降解速率越小
B.在0-50min时,pH=2和pH=7时R的降解百
分率相等
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04 mol L-1 min-1
二、填空题(共45分)
23.(8分)短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)C元素在周期表中的位置是 。
(2)B、C组成的一种化合物与水发生反应生成气体,其化学方程式为:_______________ 。
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X、Y均为石墨电极,接通直流电源。
X电极的电极反应式为 。
电解池总反应的离子方程式为: 。
24.(14分)碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0 g。
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:________________。
(2)装置D中生成沉淀,发生反应的离子方程式为______________________。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是: 。
(4)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为4.8 g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为_______mol。
(5)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 预期现象和结论
步骤1:取反应后装置C中的少许固体于试管中
步骤2:__________________________________ _________________
25.(13分) 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Al(OH)3 Co(OH)2 Fe(OH)2 Mn(OH)2
完全沉淀的pH 3.7 5.2 9.2 9.6 9.8
(1)浸出过程中加入Na2SO3的主要目的是___________________________。
(2)向浸出液中加入NaClO3的离子反应方程式:_____________________。
(3)已知:常温下NH3·H2ONH4++OH- Kb=1.8×10-5
H2C2O4H++HC2O4- Ka1=5.4×10-2
HC2O4-H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH____7 (填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选试剂_____(填字母代号)。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除去锰离子,其使用的适宜pH范围是________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是____________。[注:Ar(Co)=59]
26.(10分)液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) NH3(g) + HI(g) b.2HI(g) H2(g) + I2(g)
①写出反应a的平衡常数表达式 。
②达到平衡后,扩大容器体积,达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大 e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为 kJ。
②0~1 h内N2的平均反应速率为 。
2021—2022学年度第一学期期末考试
高三化学试题参考答案
一、单选题(22小题,每题2.5分,共55分)
题号 1 2 3 4 5 6 7 8 9 10 11
答案 C B D B B B A D C D B
题号 12 13 14 15 16 17 18 19 20 21 22
答案 C A C B B B B A A A B
二、填空题(共45分)
23.(8分)
(1)第三周期IA族
(2)2Na2O2+2H2O=4NaOH +O2↑
(3)2H+ +2e- =H2↑
2Cl + 2H2O 通电 = Cl2↑+H2 ↑+2OH-↑
24.(14分)
(1)Mg(OH)2+NH4Cl △= MgOHCl+NH3↑+H2O;
(2)Al3+ +3NH3H2O=Al(OH)3 ↓ + 3NH4+ (3)防止倒吸; (4)0.15
(5)步骤2:向试管中加入2mol/LH2SO4溶液
现象和结论:液中出现蓝色,说明红色固体中含有Cu2O
25.(13分)
(1)将Co3+ 还原为Co2+ (2)ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O
(3)< (4)A (5)B (6)Co2O3
26.(10分)
(1)① k=c(NH3) c(HI) ②变浅
(2) b、d
(3)①27.78 ②0.05mol/(L h)
同课章节目录
