北京市2021-2022学年高三各区上学期期末化学考试分类汇编 选择题(五):化学平衡 离子平衡(含答案)
文档属性
| 名称 | 北京市2021-2022学年高三各区上学期期末化学考试分类汇编 选择题(五):化学平衡 离子平衡(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 455.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-26 11:45:10 | ||
图片预览



文档简介
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编 选择题(五)化学平衡 离子平衡
一、化学平衡
(海淀区)1.Fe3O4(s)与CO(g)主要发生如下反应。
① Fe3O4(s) + CO(g) 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
② Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g) ΔH2
反应的还原产物与温度密切相关。其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如下图所示。下列说法不正确的是
A. 反应FeO(s) + CO(g) Fe(s) + CO2(g)的焓变为(ΔH2 -ΔH1)
B. 根据图像推测,ΔH2应当小于0
C. 反应温度越高,Fe3O4主要还原产物中铁元素的价态越低
D. 温度高于1040℃时,Fe3O4(s)和CO(g)发生的主要反应的化学平衡常数K>4
(朝阳区)2.。实验发现,一定条件下向一密闭容器中充入SO2和18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。下列分析不正确的是
A.18O2与O2的化学性质基本相同
B.断裂2 mol SO2 + 1 mol O2中的共价键的能量小于断裂2 mol SO3 中的共价键的能量
C.化合反应与分解反应可同时发生,说明反应存在可逆性
D.平衡时,18O2初始浓度c0(18O2)与平衡时各组分浓度c之间一定存在:
2c0(18O2) = 2c(S18O2) + 3c(S18O3) + 2c(18O2)
(朝阳区)3.一定条件下,按n(NO)∶n(O2) = 2∶1的比例向反应容器充入NO、O2,发生反应
。温度、压强(p)对NO平衡转化率的影响如下,
下列分析正确的是
A.压强大小关系:p1>p2
B.其他条件相同时,随温度升高该反应的平衡
常数增大
C.400℃、p1条件下,O2的平衡转化率为40%
D.500℃、p1条件下,该反应的化学平衡常数一定为
(东城区)4.ICl与H2能发生反应: 。
已知:
①该反应由两个基元反应分步完成,第一步为
②两步反应的活化能分别为、,且
下列判断不正确的是
A. 第一步为氧化还原反应
B. 第一步的化学反应速率大于第二步的化学反应速率
C. 已知键能:,可推知键能:
D. 第二步的热化学方程式为
(东城区)5.气态醋酸中存在平衡 。实验测得压强分别为 和时,上述平衡体系中气体的平均摩尔质量()随温度(T)的变化如下图所示。[已知:;]
下列说法不正确的是
A.
B.
C. a点时,
D. 为使的值接近60,可采取高温、低压的实验条件
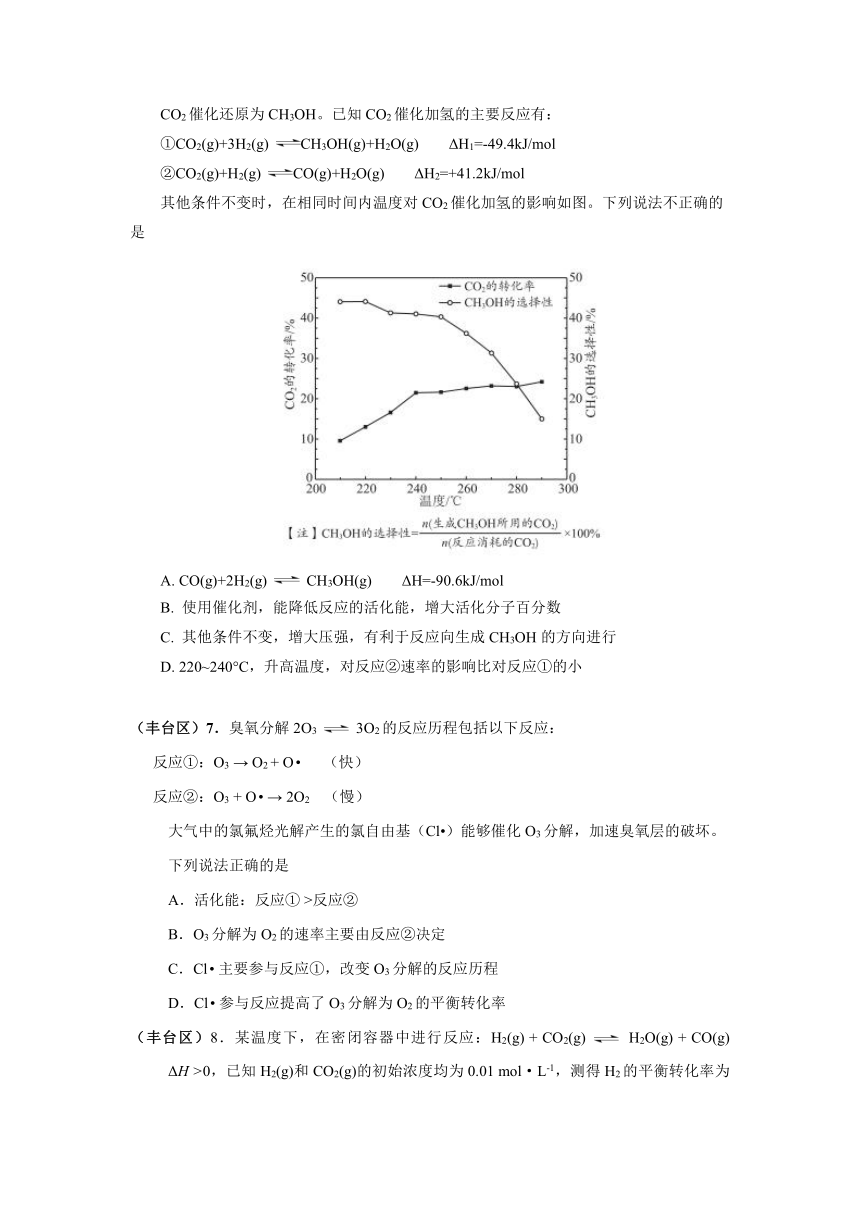
(西城区)6.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是
A. CO(g)+2H2(g) CH3OH(g) ΔH=-90.6kJ/mol
B. 使用催化剂,能降低反应的活化能,增大活化分子百分数
C. 其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行
D. 220~240°C,升高温度,对反应②速率的影响比对反应①的小
(丰台区)7.臭氧分解2O3 3O2的反应历程包括以下反应:
反应①:O3 → O2 + O (快)
反应②:O3 + O → 2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl )能够催化O3分解,加速臭氧层的破坏。下列说法正确的是
A.活化能:反应① >反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl 主要参与反应①,改变O3分解的反应历程
D.Cl 参与反应提高了O3分解为O2的平衡转化率
(丰台区)8.某温度下,在密闭容器中进行反应:H2(g) + CO2(g) H2O(g) + CO(g) ΔH >0,已知H2(g)和CO2(g)的初始浓度均为0.01 mol·L-1,测得H2的平衡转化率为60%,下列说法不正确的是
A.CO2的平衡转化率为60%
B.升高温度平衡常数K增大
C.该温度下反应的平衡常数K = 2.25
D.若初始H2(g)、CO2(g)、H2O(g)、CO(g)浓度均为0.01 mol·L-1,则反应逆向进行
(石景山区)9.在容积不变的密闭容器中发生反应:CO(g) + H2O(g) CO2(g) + H2(g) ΔH < 0,830℃时反应的平衡常数是1.0,下列说法正确的是
A.容器内的压强不变时,说明反应达到平衡状态
B.若平衡时移走CO2,则平衡向正反应方向移动,化学反应速率加快
C.830℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,CO平衡转化率为75%
D.1000℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol/L,此时平衡向正反应方向移动
(昌平区)10.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A. 当T<200℃时,反应2NO(g)+O2(g)=2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 由图示信息可以推测:该反应在400℃时反应速率小于500℃时
D. 400℃时(Y点),若c始(NO)=c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率约为40%,则平衡常数K=5000
二、离子平衡
(海淀区)1.测定0.1 mol·L-1 Na2CO3溶液升温过程中的pH(不考虑水的蒸发),数据如下。
温度/℃ 20 40 60 80
pH 11.80 11.68 11.54 11.42
下列说法正确的是
A.温度升高,Na2CO3溶液中c(OH-)降低
B.温度升高时溶液pH降低,原因是CO32-水解生成少量H2CO3
C.Na2CO3溶液pH的变化是Kw改变与水解平衡移动共同作用的结果
D.溶液中c(CO32-)+ c(HCO3-)始终等于0.1 mol·L-1
(海淀区)2. 小组同学探究盐溶液对反应Fe 3++ SCN- [Fe(SCN)] 2+(血红色)的影响。
将2 mL 0.01 mol·L-1的FeCl3溶液与2 mL 0.02 mol·L-1的KSCN溶液混合,分别加 入等量 的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:i.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略
ii.Fe3++4Cl-[FeCl4]-(黄色)
下列说法不正确的是
A. 注入试剂①后溶液透光率增大,证明Fe 3++ SCN- [Fe(SCN)] 2+逆向移动
B. 透光率③比②高,可能是阳离子种类或溶液pH导致的
C. 透光率④比③高,可能发生了反应[Fe(SCN)]2+ + 4Cl- [FeCl4] -+ SCN-
D. 若要证明试剂③中Cl-对平衡体系有影响,还应使用0.04 mol·L-1的KNO3溶液进行实验
(朝阳区)3. 对浓度均为0.1 mol·L﹣1 ①CH3COOH溶液、②CH3COONa溶液,下列判断不正确的是
A.向①中滴加石蕊溶液,溶液变红,说明CH3COOH是弱电解质
B.向②中滴加石蕊溶液,溶液变蓝,说明CH3COOH是弱电解质
C.向①中滴加Na2CO3溶液,产生气泡,说明Ka(CH3COOH)>Ka1(H2CO3)
D.①、②中的c(CH3COOH) 与c(CH3COO-) 之和相等
(朝阳区)4.下列变化中,不能用盐类水解原理解释的是
A.用KI溶液将AgCl转化为AgI
B.用热饱和Na2CO3溶液清洗试管壁上附着的植物油
C.向Al2(SO4)3溶液中加入浓NaHCO3溶液,产生沉淀和气体
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体
(东城区)5.电离常数是研究电解质在水溶液中的行为的重要工具。现有、和三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如下表所示。
酸 电离常数(25℃)
下列说法正确的是
A. 在水溶液中结合的能力:
B. 溶液中离子浓度的关系:
C. 溶液与过量反应的离子方程式:
D. 25℃时,浓度均为的和溶液的:
(东城区)6.25℃时,用图1装置进行实验:向蒸馏水中加入粉末,一段时间后再加入稀硫酸。测得随时间变化的曲线如图2所示。
下列对曲线的分析不正确的是
A. bc段存在平衡
B. cd段
C. a点时加入的大于c点时加入的
D. e点时再加入足量粉末,可使溶液的与b点的相同
(西城区)7.关于下列实验的说法不正确的是
A.CH3COO-的水解程度增大 B.溶液的pH减小是CH3COO-水解平衡移动的结果 C.NH4Cl可促进CH3COO-的水解 D.混合液中c(CH3COO-)和c(CH3COOH)之和大于c(Na+)
(丰台区)8.常温下浓度均为0.1 mol·L-1的两种溶液:① CH3COOH溶液 ② CH3COONa溶液,下列说法不正确的是
A.水电离产生的c(OH-):① < ②
B.CH3COONa溶液pH > 7说明CH3COOH为弱酸
C.两种溶液中均存在:c(CH3COO-) + c(CH3COOH) = 0.1 mol·L-1
D.等体积混合所得酸性溶液中:c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(石景山区)9.在常温下,有关下列4种溶液的叙述中不正确的是
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
A.在溶液①和②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小
B.分别取1 mL稀释至10 mL,4种溶液的pH:①>②>④>③
C.将溶液②和③等体积混合,所得溶液中:c(CH3COO )>c(Na+)>c(OH )>c(H+)
D.将a L溶液②和b L溶液④混合后,若所得溶液的pH = 4,则a : b = 9 : 11
(门头沟区)10.下列有关说法正确的是
A.水溶液中c(OH-) > c(H+),溶液一定显碱性
B.pH均为3的盐酸和醋酸溶液与足量锌反应,后者产生的氢气多
C.NH4HSO4溶液呈酸性说明NH3·H2O是弱电解质
D.室温下,将0.2mol/L的醋酸溶液与0.1mol/L的NaOH溶液等体积混合,所得溶液
pH<7,则:c(Na+) > c(CH3COO-)
(顺义区)11. 某化学小组通过测定溶液pH,计算K2Cr2O7溶液中
“Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+”的平衡常数,结果如下:
实验序号 温度(℃) K2Cr2O7溶液浓度(mol/L) pH 平衡常数
① 26.3 0.1000 a 2.5×10-15
② 26.3 0.3000 3.78 b
③ 50.0 0.1000 3.75 1.01×10-14
下列说法不合理的是
A. a大于3.78,b等于2.5×10-15
B. 实验②对应平衡常数b计算式为
C.由实验①③结果可说明该反应为吸热反应
D. 向实验①的2mL溶液中加入6滴6 mol/L NaOH溶液,溶液橙色加深;恢复原温度,平衡常数不变
(顺义区)12. 借助pH传感器测得0.1mol/LNaHCO3溶液在先升温、后降温过程中pH变化如下图所示:
图1. 升温过程中溶液pH变化 图2. 降温过程中溶液pH变化
下列有关实验数据的分析中,不合理的是
A. 图1中25℃时,溶液中存在关系:c(HCO3-)> c(H2CO3) > c(CO32-)
B. 图1中25~45℃过程,溶液pH逐渐减小,说明HCO3—及水的电离平衡正移对pH影响大于HCO3—水解平衡正移对pH的影响
C. 图1中45~60℃过程,溶液pH逐渐增大,可能是NaHCO3分解,c(CO32-)逐渐增大导致的结果
D. 图2中降温过程,溶液pH逐渐增大,可能是HCO3—或CO32-水解平衡正移所致
(昌平区)13. 某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A. 稀释前溶液的浓度:c(HCl) >c(CH3COOH)
B. 溶液中水的电离程度:b点<c点
C. 从b点到d点,溶液中c(H+)c(OH-)逐渐增大
D. 在d点和e点均存在:c(H+)<c(酸根阴离子)
(房山区)14.时,在溶液中逐滴加入溶液,变化曲线如下图所示:下列说法不正确的是
A.若用代替溶液,所得溶液小于a点
B.b点溶液中微粒浓度:
C.a点点的过程中持续增大
D.若向a点对应的溶液中滴加1滴溶液或1滴醋酸溶液, 变化均不大
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编 选择题(五)化学平衡 离子平衡 参考答案
一、化学平衡
1. C 2. D 3. C 4. B 5. B 6. D 7. B 8. D 9. C 10. B
二、离子平衡
1. C 2. A 3. A 4. A 5. C 6. D 7. B
8. D 9. C 10. A 11. D 12. D 13. B 14. B
一、化学平衡
(海淀区)1.Fe3O4(s)与CO(g)主要发生如下反应。
① Fe3O4(s) + CO(g) 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
② Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g) ΔH2
反应的还原产物与温度密切相关。其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如下图所示。下列说法不正确的是
A. 反应FeO(s) + CO(g) Fe(s) + CO2(g)的焓变为(ΔH2 -ΔH1)
B. 根据图像推测,ΔH2应当小于0
C. 反应温度越高,Fe3O4主要还原产物中铁元素的价态越低
D. 温度高于1040℃时,Fe3O4(s)和CO(g)发生的主要反应的化学平衡常数K>4
(朝阳区)2.。实验发现,一定条件下向一密闭容器中充入SO2和18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。下列分析不正确的是
A.18O2与O2的化学性质基本相同
B.断裂2 mol SO2 + 1 mol O2中的共价键的能量小于断裂2 mol SO3 中的共价键的能量
C.化合反应与分解反应可同时发生,说明反应存在可逆性
D.平衡时,18O2初始浓度c0(18O2)与平衡时各组分浓度c之间一定存在:
2c0(18O2) = 2c(S18O2) + 3c(S18O3) + 2c(18O2)
(朝阳区)3.一定条件下,按n(NO)∶n(O2) = 2∶1的比例向反应容器充入NO、O2,发生反应
。温度、压强(p)对NO平衡转化率的影响如下,
下列分析正确的是
A.压强大小关系:p1>p2
B.其他条件相同时,随温度升高该反应的平衡
常数增大
C.400℃、p1条件下,O2的平衡转化率为40%
D.500℃、p1条件下,该反应的化学平衡常数一定为
(东城区)4.ICl与H2能发生反应: 。
已知:
①该反应由两个基元反应分步完成,第一步为
②两步反应的活化能分别为、,且
下列判断不正确的是
A. 第一步为氧化还原反应
B. 第一步的化学反应速率大于第二步的化学反应速率
C. 已知键能:,可推知键能:
D. 第二步的热化学方程式为
(东城区)5.气态醋酸中存在平衡 。实验测得压强分别为 和时,上述平衡体系中气体的平均摩尔质量()随温度(T)的变化如下图所示。[已知:;]
下列说法不正确的是
A.
B.
C. a点时,
D. 为使的值接近60,可采取高温、低压的实验条件
(西城区)6.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是
A. CO(g)+2H2(g) CH3OH(g) ΔH=-90.6kJ/mol
B. 使用催化剂,能降低反应的活化能,增大活化分子百分数
C. 其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行
D. 220~240°C,升高温度,对反应②速率的影响比对反应①的小
(丰台区)7.臭氧分解2O3 3O2的反应历程包括以下反应:
反应①:O3 → O2 + O (快)
反应②:O3 + O → 2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl )能够催化O3分解,加速臭氧层的破坏。下列说法正确的是
A.活化能:反应① >反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl 主要参与反应①,改变O3分解的反应历程
D.Cl 参与反应提高了O3分解为O2的平衡转化率
(丰台区)8.某温度下,在密闭容器中进行反应:H2(g) + CO2(g) H2O(g) + CO(g) ΔH >0,已知H2(g)和CO2(g)的初始浓度均为0.01 mol·L-1,测得H2的平衡转化率为60%,下列说法不正确的是
A.CO2的平衡转化率为60%
B.升高温度平衡常数K增大
C.该温度下反应的平衡常数K = 2.25
D.若初始H2(g)、CO2(g)、H2O(g)、CO(g)浓度均为0.01 mol·L-1,则反应逆向进行
(石景山区)9.在容积不变的密闭容器中发生反应:CO(g) + H2O(g) CO2(g) + H2(g) ΔH < 0,830℃时反应的平衡常数是1.0,下列说法正确的是
A.容器内的压强不变时,说明反应达到平衡状态
B.若平衡时移走CO2,则平衡向正反应方向移动,化学反应速率加快
C.830℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,CO平衡转化率为75%
D.1000℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol/L,此时平衡向正反应方向移动
(昌平区)10.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A. 当T<200℃时,反应2NO(g)+O2(g)=2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 由图示信息可以推测:该反应在400℃时反应速率小于500℃时
D. 400℃时(Y点),若c始(NO)=c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率约为40%,则平衡常数K=5000
二、离子平衡
(海淀区)1.测定0.1 mol·L-1 Na2CO3溶液升温过程中的pH(不考虑水的蒸发),数据如下。
温度/℃ 20 40 60 80
pH 11.80 11.68 11.54 11.42
下列说法正确的是
A.温度升高,Na2CO3溶液中c(OH-)降低
B.温度升高时溶液pH降低,原因是CO32-水解生成少量H2CO3
C.Na2CO3溶液pH的变化是Kw改变与水解平衡移动共同作用的结果
D.溶液中c(CO32-)+ c(HCO3-)始终等于0.1 mol·L-1
(海淀区)2. 小组同学探究盐溶液对反应Fe 3++ SCN- [Fe(SCN)] 2+(血红色)的影响。
将2 mL 0.01 mol·L-1的FeCl3溶液与2 mL 0.02 mol·L-1的KSCN溶液混合,分别加 入等量 的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:i.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略
ii.Fe3++4Cl-[FeCl4]-(黄色)
下列说法不正确的是
A. 注入试剂①后溶液透光率增大,证明Fe 3++ SCN- [Fe(SCN)] 2+逆向移动
B. 透光率③比②高,可能是阳离子种类或溶液pH导致的
C. 透光率④比③高,可能发生了反应[Fe(SCN)]2+ + 4Cl- [FeCl4] -+ SCN-
D. 若要证明试剂③中Cl-对平衡体系有影响,还应使用0.04 mol·L-1的KNO3溶液进行实验
(朝阳区)3. 对浓度均为0.1 mol·L﹣1 ①CH3COOH溶液、②CH3COONa溶液,下列判断不正确的是
A.向①中滴加石蕊溶液,溶液变红,说明CH3COOH是弱电解质
B.向②中滴加石蕊溶液,溶液变蓝,说明CH3COOH是弱电解质
C.向①中滴加Na2CO3溶液,产生气泡,说明Ka(CH3COOH)>Ka1(H2CO3)
D.①、②中的c(CH3COOH) 与c(CH3COO-) 之和相等
(朝阳区)4.下列变化中,不能用盐类水解原理解释的是
A.用KI溶液将AgCl转化为AgI
B.用热饱和Na2CO3溶液清洗试管壁上附着的植物油
C.向Al2(SO4)3溶液中加入浓NaHCO3溶液,产生沉淀和气体
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体
(东城区)5.电离常数是研究电解质在水溶液中的行为的重要工具。现有、和三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如下表所示。
酸 电离常数(25℃)
下列说法正确的是
A. 在水溶液中结合的能力:
B. 溶液中离子浓度的关系:
C. 溶液与过量反应的离子方程式:
D. 25℃时,浓度均为的和溶液的:
(东城区)6.25℃时,用图1装置进行实验:向蒸馏水中加入粉末,一段时间后再加入稀硫酸。测得随时间变化的曲线如图2所示。
下列对曲线的分析不正确的是
A. bc段存在平衡
B. cd段
C. a点时加入的大于c点时加入的
D. e点时再加入足量粉末,可使溶液的与b点的相同
(西城区)7.关于下列实验的说法不正确的是
A.CH3COO-的水解程度增大 B.溶液的pH减小是CH3COO-水解平衡移动的结果 C.NH4Cl可促进CH3COO-的水解 D.混合液中c(CH3COO-)和c(CH3COOH)之和大于c(Na+)
(丰台区)8.常温下浓度均为0.1 mol·L-1的两种溶液:① CH3COOH溶液 ② CH3COONa溶液,下列说法不正确的是
A.水电离产生的c(OH-):① < ②
B.CH3COONa溶液pH > 7说明CH3COOH为弱酸
C.两种溶液中均存在:c(CH3COO-) + c(CH3COOH) = 0.1 mol·L-1
D.等体积混合所得酸性溶液中:c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(石景山区)9.在常温下,有关下列4种溶液的叙述中不正确的是
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
A.在溶液①和②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小
B.分别取1 mL稀释至10 mL,4种溶液的pH:①>②>④>③
C.将溶液②和③等体积混合,所得溶液中:c(CH3COO )>c(Na+)>c(OH )>c(H+)
D.将a L溶液②和b L溶液④混合后,若所得溶液的pH = 4,则a : b = 9 : 11
(门头沟区)10.下列有关说法正确的是
A.水溶液中c(OH-) > c(H+),溶液一定显碱性
B.pH均为3的盐酸和醋酸溶液与足量锌反应,后者产生的氢气多
C.NH4HSO4溶液呈酸性说明NH3·H2O是弱电解质
D.室温下,将0.2mol/L的醋酸溶液与0.1mol/L的NaOH溶液等体积混合,所得溶液
pH<7,则:c(Na+) > c(CH3COO-)
(顺义区)11. 某化学小组通过测定溶液pH,计算K2Cr2O7溶液中
“Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+”的平衡常数,结果如下:
实验序号 温度(℃) K2Cr2O7溶液浓度(mol/L) pH 平衡常数
① 26.3 0.1000 a 2.5×10-15
② 26.3 0.3000 3.78 b
③ 50.0 0.1000 3.75 1.01×10-14
下列说法不合理的是
A. a大于3.78,b等于2.5×10-15
B. 实验②对应平衡常数b计算式为
C.由实验①③结果可说明该反应为吸热反应
D. 向实验①的2mL溶液中加入6滴6 mol/L NaOH溶液,溶液橙色加深;恢复原温度,平衡常数不变
(顺义区)12. 借助pH传感器测得0.1mol/LNaHCO3溶液在先升温、后降温过程中pH变化如下图所示:
图1. 升温过程中溶液pH变化 图2. 降温过程中溶液pH变化
下列有关实验数据的分析中,不合理的是
A. 图1中25℃时,溶液中存在关系:c(HCO3-)> c(H2CO3) > c(CO32-)
B. 图1中25~45℃过程,溶液pH逐渐减小,说明HCO3—及水的电离平衡正移对pH影响大于HCO3—水解平衡正移对pH的影响
C. 图1中45~60℃过程,溶液pH逐渐增大,可能是NaHCO3分解,c(CO32-)逐渐增大导致的结果
D. 图2中降温过程,溶液pH逐渐增大,可能是HCO3—或CO32-水解平衡正移所致
(昌平区)13. 某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A. 稀释前溶液的浓度:c(HCl) >c(CH3COOH)
B. 溶液中水的电离程度:b点<c点
C. 从b点到d点,溶液中c(H+)c(OH-)逐渐增大
D. 在d点和e点均存在:c(H+)<c(酸根阴离子)
(房山区)14.时,在溶液中逐滴加入溶液,变化曲线如下图所示:下列说法不正确的是
A.若用代替溶液,所得溶液小于a点
B.b点溶液中微粒浓度:
C.a点点的过程中持续增大
D.若向a点对应的溶液中滴加1滴溶液或1滴醋酸溶液, 变化均不大
北京市2021-2022学年高三各区第一学期期末化学考试分类汇编 选择题(五)化学平衡 离子平衡 参考答案
一、化学平衡
1. C 2. D 3. C 4. B 5. B 6. D 7. B 8. D 9. C 10. B
二、离子平衡
1. C 2. A 3. A 4. A 5. C 6. D 7. B
8. D 9. C 10. A 11. D 12. D 13. B 14. B
同课章节目录
