内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题(含答案)
文档属性
| 名称 | 内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 828.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-29 21:20:23 | ||
图片预览


文档简介
2022届高三上学期期末考试化学试题2022、1、22
可能用到的相对原子质量:C--12 O--16 H--1 N--14 S--32 Na--11
单项选择题(每小题3分,共48分)
1、化学与生活、科技、社会发展息息相关。下列有关说法错误的是( )
A.德尔塔(Delta),是新冠病毒变异毒株,传播性更强,其成分含有蛋白质
B.市面上的防晒衣通常用聚酯纤维材料制作,忌长期用肥皂或碱性较强的液体洗涤
C.“天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属无机非金属材料
D.中芯国际是我国生产芯片的龙头企业,所生产芯片的主要成分是二氧化硅
2、Co是γ放射源,可用于农作物诱变育种。Co原子的核内质子数为( )
A.60 B.27 C.87 D.33
3、下列物质中不属于天然高分子化合物的是( )
A.淀粉 B.纤维素 C.蛋白质 D.乙醇
4、下列化学用语错误的是( )
A.的电子式为 B.乙醛的比例模型为
C.聚酯纤维(涤纶)的结构简式为
D.中子数为22的氩原子符号为
5、某化学反应达到化学平衡:A(g)+3B(g)2C(g) ΔH<0,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率和逆反应速率都变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
6、利用如图所示的装置制备气体可以控制反应,下列气体制备能选用如图所示装置的是( )
选项 试剂 制备气体
A MnO2和KClO3 O2
B FeS和稀硫酸 H2S
C 生石灰和浓氨水 NH3
D Cu和浓H2SO4 SO2
7、下列过程中的化学反应,相应的离子方程式书写正确的是( )
A.将H2C2O4溶液滴入酸性KMnO4溶液:
B.用FeCl3溶液蚀刻铜制印刷电路板:Fe3+ + Cu =Fe2+ + Cu2+
C.用醋酸除去水垢中的碳酸钙:2H++CaCO3=Ca2++ CO2 ↑ +H2O
D.向NH4Al(SO4)2溶液中加入足量Ba(OH)2溶液
8、设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 9.2 g C2H6O含有共价键的数目为1.6NA
B. 等物质的量的I2和H2反应生成HI分子的数目为2NA
C. 1 L 0.1 mol·L-1 Na2SO3溶液中SO离子数目为0.1NA
D. 标准状况下,2.24 L CCl4含有的原子数目为0.5NA
9、短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
10、 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:,这是迄今最接近人造光合作用的方法,加氢制的一种催化机理如图。下列说法正确的是( )
A. 反应中是中间产物
B. 转化为利用了的氧化性
C. 经过活性中心裂解产生带负电荷的H
D. 使用催化剂可以降低反应的焓变,从而提高化学反应速率
11、下列对物质或离子的检验,结论正确的是( )
A.加入KSCN溶液,溶液变红,证明原溶液含有Fe3+
B.将气体通入酸性KMnO4溶液,溶液紫色褪去,证明气体为乙烯
C.将气体通入澄清石灰水,有白色沉淀生成,证明气体为CO2
D.加入BaCl2溶液,生成的沉淀不溶于盐酸,证明原溶液含有SO2
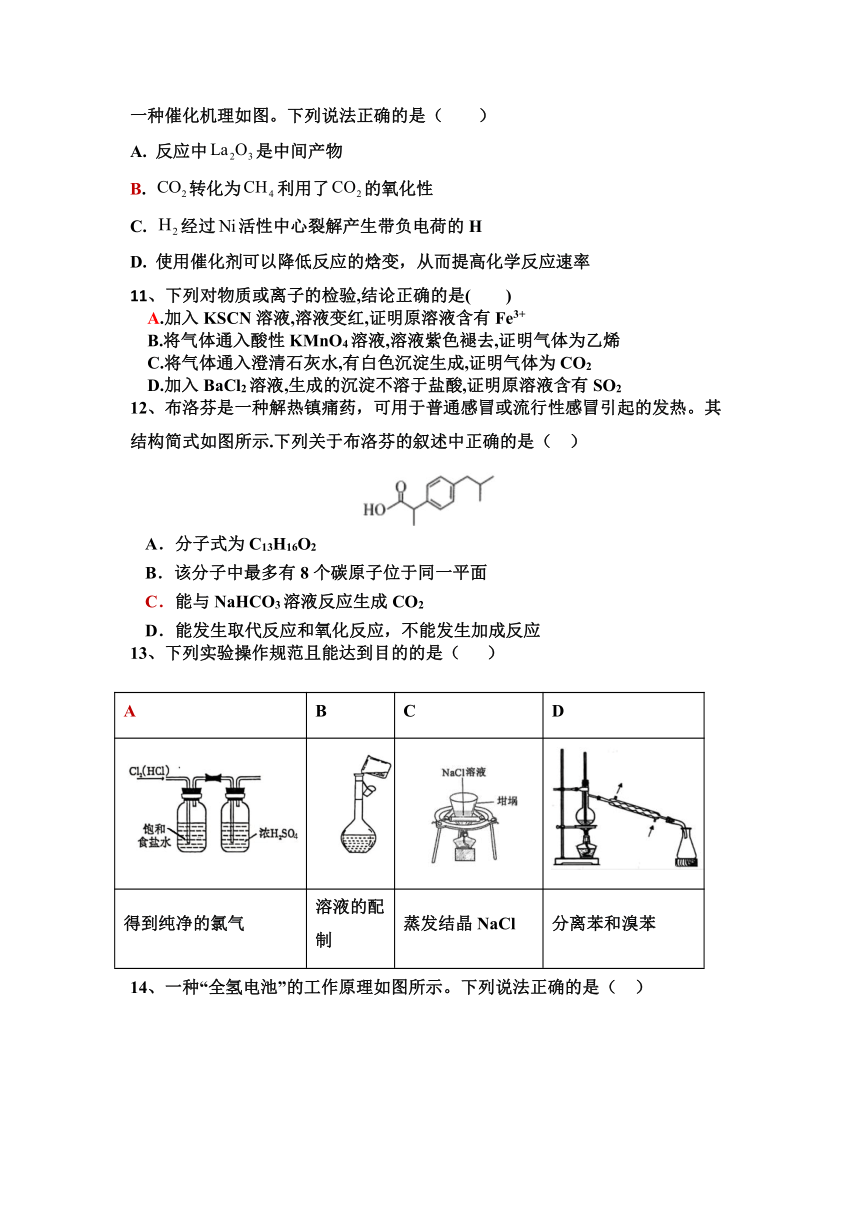
12、布洛芬是一种解热镇痛药,可用于普通感冒或流行性感冒引起的发热。其结构简式如图所示.下列关于布洛芬的叙述中正确的是( )
A.分子式为C13H16O2
B.该分子中最多有8个碳原子位于同一平面
C.能与NaHCO3溶液反应生成CO2
D.能发生取代反应和氧化反应,不能发生加成反应
13、下列实验操作规范且能达到目的的是( )
A B C D
得到纯净的氯气 溶液的配制 蒸发结晶NaCl 分离苯和溴苯
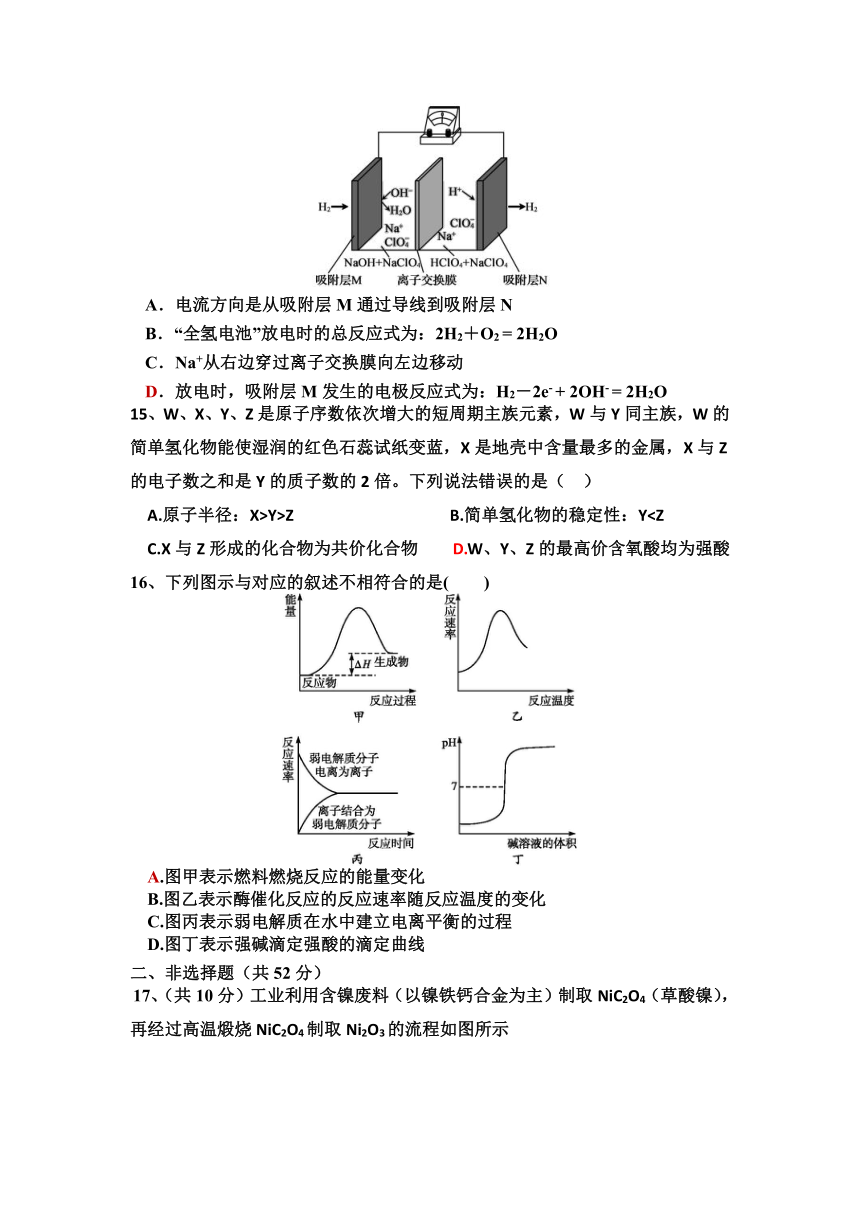
14、一种“全氢电池”的工作原理如图所示。下列说法正确的是( )
A.电流方向是从吸附层M通过导线到吸附层N
B.“全氢电池”放电时的总反应式为:2H2+O2 = 2H2O
C.Na+从右边穿过离子交换膜向左边移动
D.放电时,吸附层M发生的电极反应式为:H2-2e- + 2OH- = 2H2O
15、W、X、Y、Z是原子序数依次增大的短周期主族元素,W与Y同主族,W的简单氢化物能使湿润的红色石蕊试纸变蓝,X是地壳中含量最多的金属,X与Z的电子数之和是Y的质子数的2倍。下列说法错误的是( )
A.原子半径:X>Y>Z B.简单氢化物的稳定性:YC.X与Z形成的化合物为共价化合物 D.W、Y、Z的最高价含氧酸均为强酸
16、下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
二、非选择题(共52分)
17、(共10分)工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图所示
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法 (写一种即可)。
(2)加入H2O2发生的主要反应的离子方程式为 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为________________________。
(4)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为___________。
(5)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如下图,
由图可知Co2+、Ni2+两种离子中催化效果更好的是__________________。
18、(14分)某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。已知在溶液中:FeSO4+NO Fe(NO)]SO4(棕色),该反应可用于检验NO。
(1)实验开始前,向装置中通入一段时间的N2,目的是_______。
(2)盛装Cu片的仪器名称叫_______,请写出装置E中反应的离子方程式___ _。
(3)装置F中盛放的是水,作用是_______;装置Ⅰ中盛放的试剂是______,作用是_______。
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式 。
19、(16分)页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2),与通入聚焦太阳能反应器,发生反应 。已知:
①
②
③
则_______(用含、、的代数式表示)
(2)用合成气生成甲醇的反应为 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示
200℃时随时间的变化如下表所示:
t/min 0 1 3 5
n(H2)/mol 8.0 5.4 4.0 4.0
①该反应的平衡常数表达式为K=_______;_______(填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______。
③下列说法正确的是 (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:P1④0~1min内用CH3OH表示的反应速率V (CH3OH)=_______ mol·L-1 ·min-1。
⑤向上述200℃达到平衡的恒容密闭容器中再加入2 molCO、4 molH2、2 molCH3OH,保持温度不变,则化学平衡_______(填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。充入22.4L(折算为标准状况下)甲烷,测得电路中转移5.6mol电子,则甲烷的利用率为_______。
20、(共12分)三氯苯达唑是一种新型的驱虫药物,在医药工业中的一种合成方法如下:
已知:
回答下列问题:
(1)A的结构简式为___________.
(2)D中含氧官能团的名称是___________.
(3)的反应类型为___________.
(4)已知的化学反应还生成一种小分子产物,写出的化学方程式_________ .
(5)B的同分异构体中,与B官能团种类和数目均相同的芳香化合物还有___________种.
(6)参照上述合成路线,以为原料,设计合成的路线__________.
2022届高三上学期期末考试化学试题答案
一、单项选择题(每小题3分,共48分)
选项 1 2 3 4 5 6 7 8
答案 D B D B A B A A
选项 9 10 11 12 13 14 15 16
答案 C B A C A D D A
二、非选择题(共52分)
17、(共10分)(1)粉碎镍废料、适当增大硫酸浓度、适当升温等写一条即可(2分)
(2)2Fe2++H2O2+2H+==2Fe3++2H2O(2分) (
高温
)(3)促进Fe3+水解,使其沉淀完全(2分)
(4)2NiC2O4 = Ni2O3+3CO↑+CO2↑(2分)(5)CO2+(2分)
18、(共14分,每小空2分)(1)排除装置中的空气,防止生成的NO被氧气氧化 (2)三颈烧瓶 3Cu+8H++2NO=3Cu2++2NO↑+4H2O (3)除去挥发出的硝酸蒸气 FeSO4溶液 检验NO (4)2NO+2Cu2CuO+N2
19.(共16分)(1)(2分)
(2) (2分) < (2分) 增大浓度(或增大压强) (2分)
cd (2分) 0.13 (2分) 正向 (2分) (3)70%(2分)
20、(共12分)(1)(2分)(2)硝基、醚键(2分)(3)取代反应(2分)
(4)
(5)5(2分)
(2分)
可能用到的相对原子质量:C--12 O--16 H--1 N--14 S--32 Na--11
单项选择题(每小题3分,共48分)
1、化学与生活、科技、社会发展息息相关。下列有关说法错误的是( )
A.德尔塔(Delta),是新冠病毒变异毒株,传播性更强,其成分含有蛋白质
B.市面上的防晒衣通常用聚酯纤维材料制作,忌长期用肥皂或碱性较强的液体洗涤
C.“天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属无机非金属材料
D.中芯国际是我国生产芯片的龙头企业,所生产芯片的主要成分是二氧化硅
2、Co是γ放射源,可用于农作物诱变育种。Co原子的核内质子数为( )
A.60 B.27 C.87 D.33
3、下列物质中不属于天然高分子化合物的是( )
A.淀粉 B.纤维素 C.蛋白质 D.乙醇
4、下列化学用语错误的是( )
A.的电子式为 B.乙醛的比例模型为
C.聚酯纤维(涤纶)的结构简式为
D.中子数为22的氩原子符号为
5、某化学反应达到化学平衡:A(g)+3B(g)2C(g) ΔH<0,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率和逆反应速率都变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
6、利用如图所示的装置制备气体可以控制反应,下列气体制备能选用如图所示装置的是( )
选项 试剂 制备气体
A MnO2和KClO3 O2
B FeS和稀硫酸 H2S
C 生石灰和浓氨水 NH3
D Cu和浓H2SO4 SO2
7、下列过程中的化学反应,相应的离子方程式书写正确的是( )
A.将H2C2O4溶液滴入酸性KMnO4溶液:
B.用FeCl3溶液蚀刻铜制印刷电路板:Fe3+ + Cu =Fe2+ + Cu2+
C.用醋酸除去水垢中的碳酸钙:2H++CaCO3=Ca2++ CO2 ↑ +H2O
D.向NH4Al(SO4)2溶液中加入足量Ba(OH)2溶液
8、设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 9.2 g C2H6O含有共价键的数目为1.6NA
B. 等物质的量的I2和H2反应生成HI分子的数目为2NA
C. 1 L 0.1 mol·L-1 Na2SO3溶液中SO离子数目为0.1NA
D. 标准状况下,2.24 L CCl4含有的原子数目为0.5NA
9、短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
10、 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:,这是迄今最接近人造光合作用的方法,加氢制的一种催化机理如图。下列说法正确的是( )
A. 反应中是中间产物
B. 转化为利用了的氧化性
C. 经过活性中心裂解产生带负电荷的H
D. 使用催化剂可以降低反应的焓变,从而提高化学反应速率
11、下列对物质或离子的检验,结论正确的是( )
A.加入KSCN溶液,溶液变红,证明原溶液含有Fe3+
B.将气体通入酸性KMnO4溶液,溶液紫色褪去,证明气体为乙烯
C.将气体通入澄清石灰水,有白色沉淀生成,证明气体为CO2
D.加入BaCl2溶液,生成的沉淀不溶于盐酸,证明原溶液含有SO2
12、布洛芬是一种解热镇痛药,可用于普通感冒或流行性感冒引起的发热。其结构简式如图所示.下列关于布洛芬的叙述中正确的是( )
A.分子式为C13H16O2
B.该分子中最多有8个碳原子位于同一平面
C.能与NaHCO3溶液反应生成CO2
D.能发生取代反应和氧化反应,不能发生加成反应
13、下列实验操作规范且能达到目的的是( )
A B C D
得到纯净的氯气 溶液的配制 蒸发结晶NaCl 分离苯和溴苯
14、一种“全氢电池”的工作原理如图所示。下列说法正确的是( )
A.电流方向是从吸附层M通过导线到吸附层N
B.“全氢电池”放电时的总反应式为:2H2+O2 = 2H2O
C.Na+从右边穿过离子交换膜向左边移动
D.放电时,吸附层M发生的电极反应式为:H2-2e- + 2OH- = 2H2O
15、W、X、Y、Z是原子序数依次增大的短周期主族元素,W与Y同主族,W的简单氢化物能使湿润的红色石蕊试纸变蓝,X是地壳中含量最多的金属,X与Z的电子数之和是Y的质子数的2倍。下列说法错误的是( )
A.原子半径:X>Y>Z B.简单氢化物的稳定性:Y
16、下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
二、非选择题(共52分)
17、(共10分)工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图所示
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法 (写一种即可)。
(2)加入H2O2发生的主要反应的离子方程式为 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为________________________。
(4)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为___________。
(5)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如下图,
由图可知Co2+、Ni2+两种离子中催化效果更好的是__________________。
18、(14分)某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。已知在溶液中:FeSO4+NO Fe(NO)]SO4(棕色),该反应可用于检验NO。
(1)实验开始前,向装置中通入一段时间的N2,目的是_______。
(2)盛装Cu片的仪器名称叫_______,请写出装置E中反应的离子方程式___ _。
(3)装置F中盛放的是水,作用是_______;装置Ⅰ中盛放的试剂是______,作用是_______。
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式 。
19、(16分)页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2),与通入聚焦太阳能反应器,发生反应 。已知:
①
②
③
则_______(用含、、的代数式表示)
(2)用合成气生成甲醇的反应为 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示
200℃时随时间的变化如下表所示:
t/min 0 1 3 5
n(H2)/mol 8.0 5.4 4.0 4.0
①该反应的平衡常数表达式为K=_______;_______(填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______。
③下列说法正确的是 (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:P1
⑤向上述200℃达到平衡的恒容密闭容器中再加入2 molCO、4 molH2、2 molCH3OH,保持温度不变,则化学平衡_______(填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。充入22.4L(折算为标准状况下)甲烷,测得电路中转移5.6mol电子,则甲烷的利用率为_______。
20、(共12分)三氯苯达唑是一种新型的驱虫药物,在医药工业中的一种合成方法如下:
已知:
回答下列问题:
(1)A的结构简式为___________.
(2)D中含氧官能团的名称是___________.
(3)的反应类型为___________.
(4)已知的化学反应还生成一种小分子产物,写出的化学方程式_________ .
(5)B的同分异构体中,与B官能团种类和数目均相同的芳香化合物还有___________种.
(6)参照上述合成路线,以为原料,设计合成的路线__________.
2022届高三上学期期末考试化学试题答案
一、单项选择题(每小题3分,共48分)
选项 1 2 3 4 5 6 7 8
答案 D B D B A B A A
选项 9 10 11 12 13 14 15 16
答案 C B A C A D D A
二、非选择题(共52分)
17、(共10分)(1)粉碎镍废料、适当增大硫酸浓度、适当升温等写一条即可(2分)
(2)2Fe2++H2O2+2H+==2Fe3++2H2O(2分) (
高温
)(3)促进Fe3+水解,使其沉淀完全(2分)
(4)2NiC2O4 = Ni2O3+3CO↑+CO2↑(2分)(5)CO2+(2分)
18、(共14分,每小空2分)(1)排除装置中的空气,防止生成的NO被氧气氧化 (2)三颈烧瓶 3Cu+8H++2NO=3Cu2++2NO↑+4H2O (3)除去挥发出的硝酸蒸气 FeSO4溶液 检验NO (4)2NO+2Cu2CuO+N2
19.(共16分)(1)(2分)
(2) (2分) < (2分) 增大浓度(或增大压强) (2分)
cd (2分) 0.13 (2分) 正向 (2分) (3)70%(2分)
20、(共12分)(1)(2分)(2)硝基、醚键(2分)(3)取代反应(2分)
(4)
(5)5(2分)
(2分)
同课章节目录
