广东省东莞市2022届高三上学期期末教学质量检查化学试卷(PDF版含答案)
文档属性
| 名称 | 广东省东莞市2022届高三上学期期末教学质量检查化学试卷(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 17:12:44 | ||
图片预览


文档简介
2021—2022学年度第一学期教学质量检查
高三化学
注意事项:
1.本试卷分选择题和非选择题两部分。
2.试卷满分 100分,考试时间 75分钟。
可能用到的相对原子质量:H 1 N 14 O 16 Co 59
一、选择题(本题包括 16小题,共 44分。其中 1~10小题,每小题 2分,共 20分。11~16小题,
每小题 4分,共 24分。每小题只有一个选项符合题意。)
1.2021年 10月 16日神舟十三号载人飞船成功发射,中国航天人取得航天事业又一里程碑式成
就。下列有关物质类别的描述错误的是
选项 物质 类别
A 飞船外壳使用的铝合金 化合物
B 发射时形成的烟尘 混合物
C 运载火箭使用的燃料液氢 单质
D 航天员食用的脱水米饭所含淀粉 有机物
2.广东地处沿海,利用海洋资源历史悠久。下列说法错误的是
A.能建造“蚝宅”的牡蛎,外壳主要成分为碳酸钙
B.从虾、蟹等水产中提取的虾青素( )有良好的抗
氧化性
C.海盐营养成分高于湖盐、井盐
D.从海洋甲壳类动物壳中提取出的甲壳素(C8H13O5N)n应用广泛,属于高分子化合物
3.下列化学用语正确的是
A.N2的电子式
B.质子数 18、中子数 17的原子符号表示式
C.29498Cf + 4020Ca → 297118Og+37n(中子)是化学变化
D.氧化还原反应电子转移可表示为:
高三化学 第 1 页 共 10 页
4.化学与科技、社会、文化、生活有着密切的联系。下列说法正确的是
A.中国自主研发的首个 5G微基站射频芯片,主要材料是二氧化硅
B.利用潮汐发电,是将化学能转化为电能
C.“落红不是无情物,化作春泥更护花”,蕴藏着自然界的碳、氮循环
D.SO2可作为漂白剂、防腐剂、强氧化剂使用
5.2021年诺贝尔化学奖得主本杰明·利斯特,用实验证明了脯氨酸(图 1)能驱动不对称催化反
应,革新了分子合成方式。下列关于脯氨酸的说法错误的是
A.属于氨基酸
B.分子中所有原子均在同一平面
C.能与金属钠反应 图 1
D.能发生酯化反应
6.五育并举,劳动先行。下列劳动项目涉及的化学知识正确的是
选项 劳动项目 化学知识
A 使用牙膏除去茶杯中的茶渍 牙膏可溶解碳酸钙
B 将新切土豆丝浸没在水里防止变色 土豆中的氧化性物质遇空气变色
C 劳动后用免洗酒精洗手液消毒 酒精的强氧化性能灭活病毒
D 用砂纸磨刀 制作砂纸的金刚砂 SiC硬度很大
7.海带中含有碘元素,可通过以下步骤提取:①灼烧海带成灰;②将海带灰转移,加入蒸馏水,
搅拌,煮沸;③过滤,向滤液中滴入氯水,振荡;④将氧化后溶液转移,向其中加入 CCl4,
振荡,静置。以上步骤不需要用到的仪器是
A. B. C. D.
8.微粒观是重要的化学观念,其形成对物质及其变化的学习具有重要作用。下列关于离子共存的
判断及离子方程式的书写正确的是
A.在能使紫色石蕊试液变蓝的溶液中,离子:Na+、NH - -4+、CO32 、ClO 可大量共存
B.在含有硝酸钠的溶液中,离子:H+、Mg2+、Fe2+、SO 2-4 可大量共存
C.用 FeCl3溶液腐蚀铜电路板发生反应:Fe3+ + Cu = Fe2+ + Cu2+
D.将过量 SO2通入 NaOH - -溶液中发生反应:SO2 + OH = HSO3
高三化学 第 2 页 共 10 页
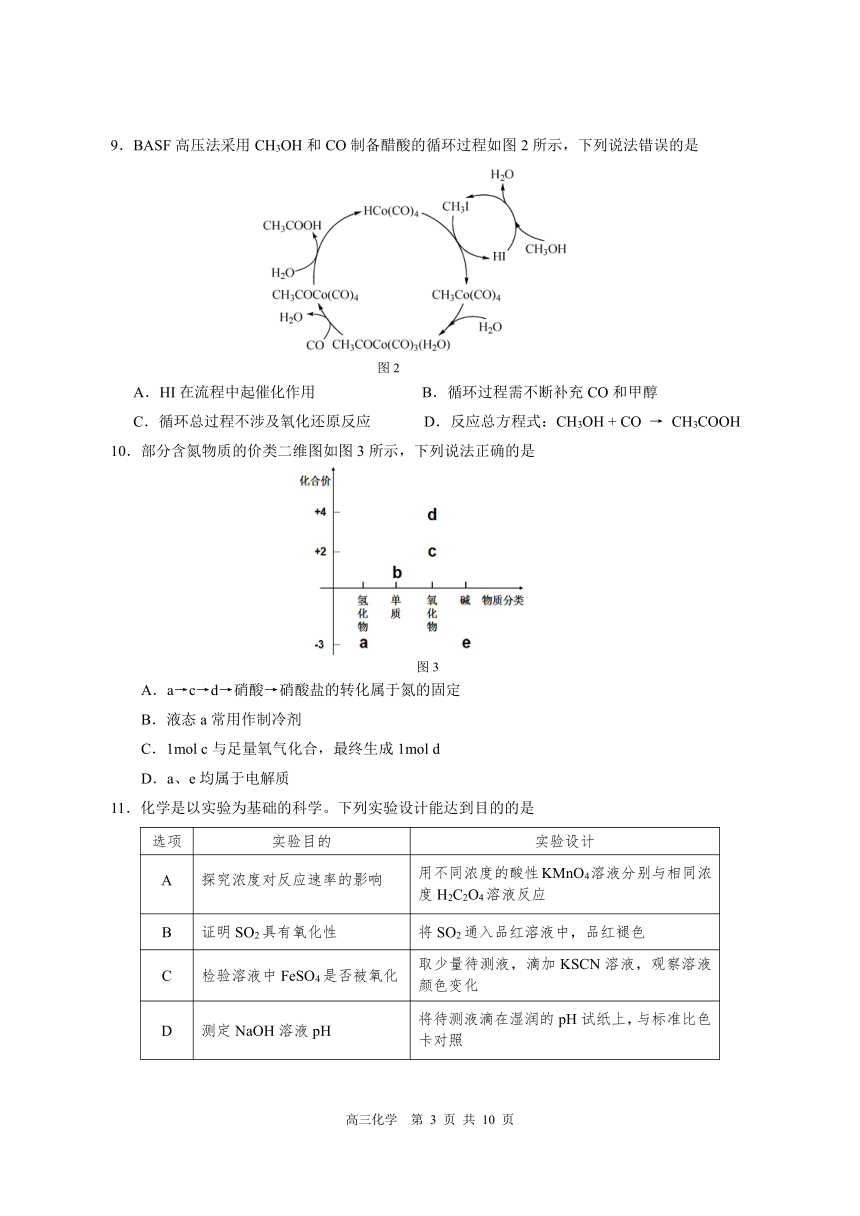
9.BASF高压法采用 CH3OH和 CO制备醋酸的循环过程如图 2所示,下列说法错误的是
图 2
A.HI在流程中起催化作用 B.循环过程需不断补充 CO和甲醇
C.循环总过程不涉及氧化还原反应 D.反应总方程式:CH3OH + CO → CH3COOH
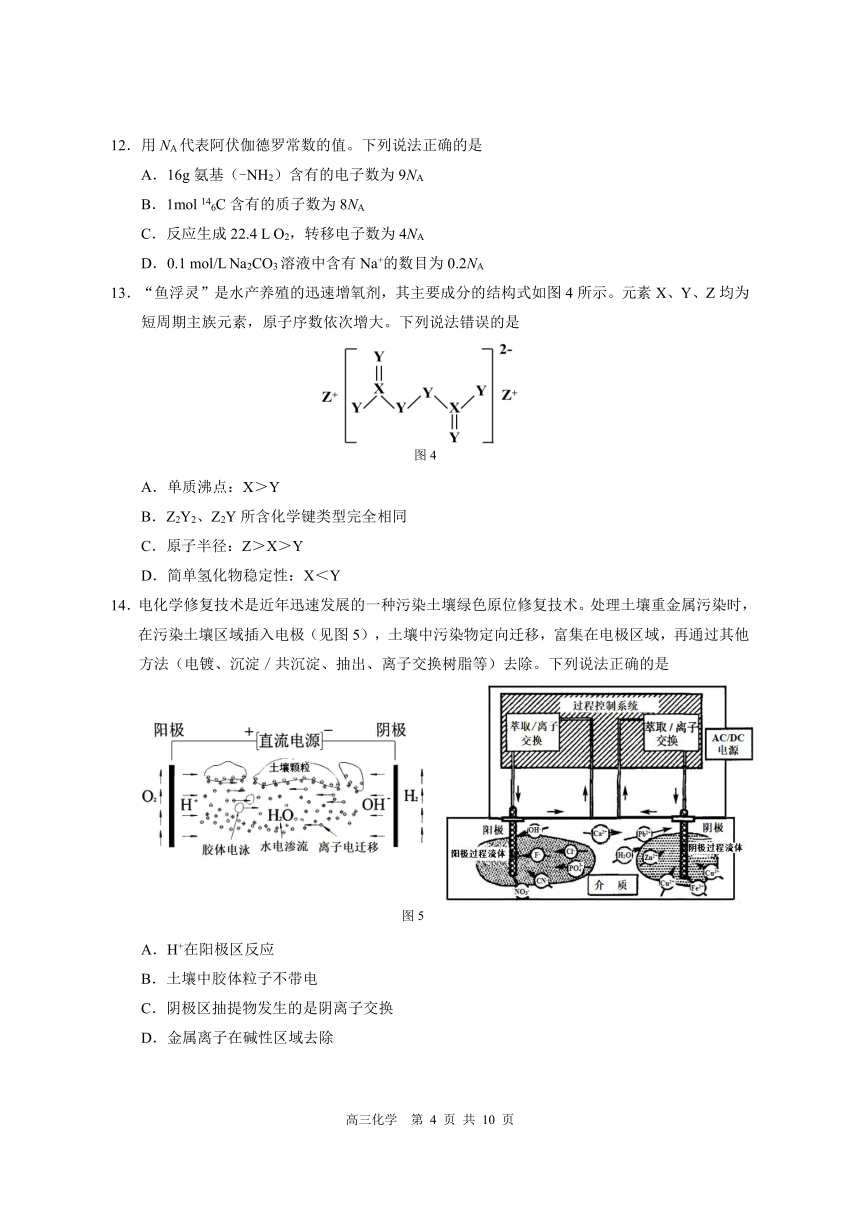
10.部分含氮物质的价类二维图如图 3所示,下列说法正确的是
图 3
A.a→c→d→硝酸→硝酸盐的转化属于氮的固定
B.液态 a常用作制冷剂
C.1mol c与足量氧气化合,最终生成 1mol d
D.a、e均属于电解质
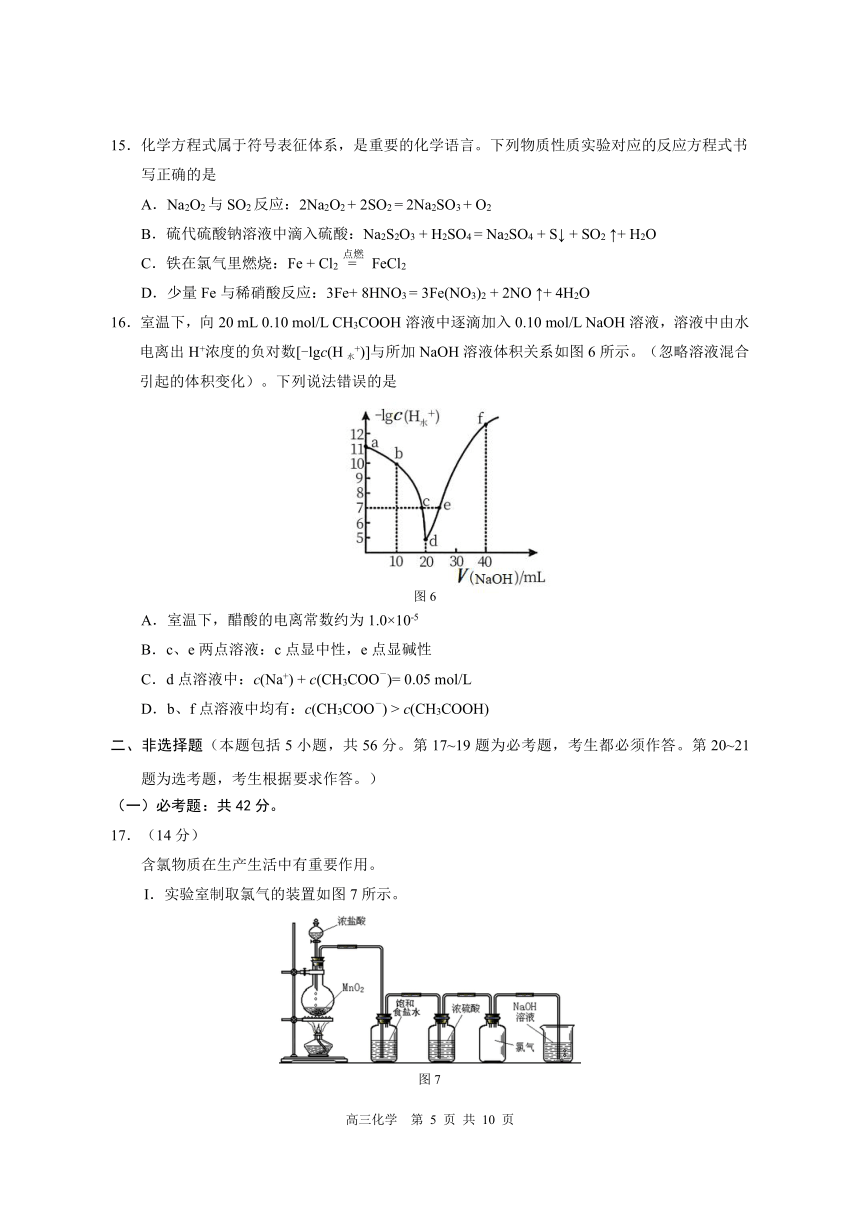
11.化学是以实验为基础的科学。下列实验设计能达到目的的是
选项 实验目的 实验设计
A 探究浓度对反应速率的影响 用不同浓度的酸性KMnO4溶液分别与相同浓
度 H2C2O4溶液反应
B 证明 SO2具有氧化性 将 SO2通入品红溶液中,品红褪色
取少量待测液,滴加 KSCN溶液,观察溶液
C 检验溶液中 FeSO4是否被氧化
颜色变化
将待测液滴在湿润的 pH试纸上,与标准比色
D 测定 NaOH溶液 pH
卡对照
高三化学 第 3 页 共 10 页
12.用 NA代表阿伏伽德罗常数的值。下列说法正确的是
A.16g氨基(-NH2)含有的电子数为 9NA
B.1mol 146C含有的质子数为 8NA
C.反应生成 22.4 L O2,转移电子数为 4NA
D.0.1 mol/LNa2CO3溶液中含有 Na+的数目为 0.2NA
13.“鱼浮灵”是水产养殖的迅速增氧剂,其主要成分的结构式如图 4所示。元素 X、Y、Z均为
短周期主族元素,原子序数依次增大。下列说法错误的是
图 4
A.单质沸点:X>Y
B.Z2Y2、Z2Y所含化学键类型完全相同
C.原子半径:Z>X>Y
D.简单氢化物稳定性:X<Y
14.电化学修复技术是近年迅速发展的一种污染土壤绿色原位修复技术。处理土壤重金属污染时,
在污染土壤区域插入电极(见图 5),土壤中污染物定向迁移,富集在电极区域,再通过其他
方法(电镀、沉淀/共沉淀、抽出、离子交换树脂等)去除。下列说法正确的是
图 5
A.H+在阳极区反应
B.土壤中胶体粒子不带电
C.阴极区抽提物发生的是阴离子交换
D.金属离子在碱性区域去除
高三化学 第 4 页 共 10 页
15.化学方程式属于符号表征体系,是重要的化学语言。下列物质性质实验对应的反应方程式书
写正确的是
A.Na2O2与 SO2反应:2Na2O2+ 2SO2= 2Na2SO3+ O2
B.硫代硫酸钠溶液中滴入硫酸:Na2S2O3 + H2SO4= Na2SO4 + S↓ + SO2 ↑+ H2O
点燃
C.铁在氯气里燃烧:Fe + Cl2 = FeCl2
D.少量 Fe 与稀硝酸反应:3Fe+ 8HNO3= 3Fe(NO3)2 + 2NO ↑+ 4H2O
16.室温下,向 20 mL 0.10 mol/L CH3COOH溶液中逐滴加入 0.10 mol/L NaOH 溶液,溶液中由水
电离出 H+浓度的负对数[-lgc(H +水 )]与所加 NaOH溶液体积关系如图 6所示。(忽略溶液混合
引起的体积变化)。下列说法错误的是
图 6
A.室温下,醋酸的电离常数约为 1.0×10-5
B.c、e两点溶液:c点显中性,e点显碱性
C.d点溶液中:c(Na+) + c(CH3COO-)= 0.05 mol/L
D -.b、f点溶液中均有:c(CH3COO ) > c(CH3COOH)
二、非选择题(本题包括 5 小题,共 56 分。第 17~19 题为必考题,考生都必须作答。第 20~21
题为选考题,考生根据要求作答。)
(一)必考题:共 42 分。
17.(14分)
含氯物质在生产生活中有重要作用。
I.实验室制取氯气的装置如图 7所示。
图 7
高三化学 第 5 页 共 10 页
(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整。
(2)NaOH溶液的作用是(用离子方程式表示)____。
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习
小组分析成因时提出如下猜想:
猜想 a:随 H+浓度降低,MnO2的氧化性减弱。
猜想 b:随 Cl-浓度降低,Cl-的还原性____(填“增强”、“不变”或“减弱”)。
猜想 c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、SO42-对体系中各物质的氧化性与还原性均无影响。
②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物
中加入试剂。
组别 试剂 产物
1 较浓硫酸 有 Cl2生成
2 X 有 Cl2生成
3 X和 Y 无 Cl2生成
通过三组实验,a、b、c三个猜想都.得.到.了.证.实.,则 X为____(填化学式),Y为
____(填化学式)。
Ⅱ .已知 FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与 FeCl3能否反
应产生 Cl2。
实验操作和现象:
实验操作 现象
点燃酒精喷灯,加热 加热一段时间后,装置 A中产生黄色气体,装置 B中溶液变蓝
(4)实验前,需要进行的操作为____。
(5)该实验装置从安全角度分析,存在的问题是____。
(6)装置经改进后,继续实验,确认产物有 Cl2和MnCl2,则 A中发生反应的化学方程式
为_____。
高三化学 第 6 页 共 10 页
18.(14分)
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化
行业以及印染工业等行业,由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为
原料制取 NiSO4·6H2O的步骤如下:
H2SO4+H2O2溶液 Na2SO4溶液 H2S NaF溶液 NaOH溶液
废料 溶解 除铁 除铜 除镁 沉镍 … NiSO4·6H2O
滤渣 MgO
已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价。
②常温下 Ksp(MgF )=6.4×10-2 9, Ka(HF)=6.4×10-4 。
(1)滤渣的主要成分是_____。
(2)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,其中铁元素的化合价为_____。
(3)“溶解”时加入 H2O2溶液的目的是_____。
(4)向“除铜”后的滤液中加入 NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液 pH偏低,
将会导致MgF2沉淀不完全,其原因是_____。当溶液中镁离子恰好沉淀完全时,溶液中
c(F-)为_____mol/L。
(5)“沉镍”后得到的滤液中,可循环使用的主要溶质为_____(填化学式)。
(6)制备 NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是_____。
(7)NiSO4在 NaOH溶液中用 NaClO氧化,可制得碱性镍镉电池电极材料 NiOOH。该反应
的离子方程式为_____。
19.(14分)
CO2的资源化利用能有效减少 CO2排放,缓解能源危机。用 CO2、H2为原料合成甲醇(CH3OH)
过程主要涉及以下反应:
a) CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
b) CO2(g)+H2(g) CO(g)+H2O(g) △H2= +41.2 kJ/mol
c) CO(g)+H2(g) CH3OH(g) △H3= -45.1 kJ/mol
(1)根据盖斯定律,反应 a的△H1=_____。
(2)我国学者结合实验与计算机模拟结果,研究了 CO2与 H2在 TiO2/Cu 催化剂表面生成
CH3OH和 H2O的部分反应历程,如图 8所示,其中吸附在催化剂表面的物种用*标注。
高三化学 第 7 页 共 10 页
图 8
反应历程中最小能垒(活化能)E 正=_____eV。写出历程②的化学方程式_____。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.升高温度,反应 b正向移动,反应 c逆向移动
B.加入反应 a的催化剂,可以降低反应的活化能及反应热
C.增大 H2的浓度,有利于提高 CO2的平衡转化率
D.及时分离除 CH3OH,可以使得反应 a的正反应速率增大
(4)加压,甲醇产率将_____;若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,
甲醇产率将_____。(填“升高”、“不变”、“降低”或“无法确定”)。
(5)使用新型催化剂,让 1mol CO2和 3mol H2在 1L密闭容器中只发生反应 a、b,CO2平衡
转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 CO 2 物质的量分数)随温
度的变化趋势如图 9所示。
图 9
553K时,若反应后体系的总压为 p ,反应 a的 Kp=_____(列出计算式)。(Kp为压强
平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压
等于总压乘以物质的量分数。)
由图 9可知,适宜的反应温度为_____。
高三化学 第 8 页 共 10 页
(二)选考题:14 分。请考生在第 20、21 题中任选一题作答,并将答题卡上对应题号涂黑。如
果不涂,则按第 20 题计分。
20.[选修 3:物质结构与性质](14分)
我国科学家利用新型模板剂合成了含钴磷铝分子筛催化剂。Co、P、Al的单质及其化合物用
途广泛。回答下列问题:
(1)基态 Co原子的价电子排布图为_____。
(2)第三周期主族元素中,按第一电离能大小排序,第一电离能在P和Al之间的元素有_____。
(3)PH3在水中溶解性比 NH3小,原因是_____。NH3溶于水后产生的 NH4+空间构型为_____。
(4)Co可以形成[Co(NH3)6]Cl3、K3[Co(NO3)6]等配合物。
① 1mol[Co(NH3)6]3+中 Co3+形成的σ键数目为_____。
② 已知[Co(NH3)6]3+的立体结构如图 10,其中 1~6处的小圆圈表示 NH3分子,且各相
邻的 NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若其
中四个 NH - -3被 NO3 取代形成[Co(NH3)2(NO3)4] ,其结构有几种_____。
图 10 图 11
(5)CoO可用作催化剂和制特种玻璃,可通过 CoCO3高温分解制备 CoO,同时生成 CO2。
①分子中的大π键可表示为 ,其中 m代表参与形成大π键的原子数,n代表参与形成
大π键的电子数,则 CO32-中的大π键可表示为_____。
②CoO晶体结构为 NaCl型(如图 11),若阿伏加德罗常数的值为 NA,已知晶体的密
度为 d g/cm3,则晶胞边长 a=_____pm(用含 d、NA的代数式表示)。
高三化学 第 9 页 共 10 页
21.[选修 5:有机化学基础](14分)
化合物 J是工业合成中重要的有机合成中间体,实验室由芳香烃 D和丙烯制备 J的一种合成
路线如下:
已知:
回答下列问题:
(1)化合物 J的分子式为_____,J中官能团的名称为_____。
(2)由 A→B的反应类型为_____。
(3)F→G的反应方程式为_____。
(4)化合物 H的芳香族同分异构体中,同时满足如下条件的有_____种(不考虑立体异构),
若其中一种遇 FeCl3溶液显紫色,结构简式为_____。
条件:a.含有碳碳双键 b.核磁共振氢谱的峰面积之比为 6:2:2:1:1
(5)I的分子结构中,手性碳原子数为_____。
(6)根据上述信息,写出由 和 为原料合成 的合成路线_____(无机试
剂任选)。
高三化学 第 10 页 共 10 页
2021—2022学年度第一学期教学质量检查
高三化学参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 A C D C B D A D C B C A B D B C
17.(14分)
(1) (1分)
(2)Cl2 + 2OH- = Cl- + ClO- + H2O (2分)
(3)减弱(1分) KCl(2分) MnSO4(2分)
(4)检查装置气密性 (2分,其他合理答案也给分)
(5)FeCl3易升华,遇冷会凝华而易堵塞导管 (2分,表述合理即给分)
(6)4FeCl3+3MnO2 2Fe2O3+3MnCl2+3Cl2↑ (2分)
18.(14分)
(1)SiO2(1分,二氧化硅也给 1分)
(2)+3(1分)
(3)将 Fe2+氧化成 Fe3+;促使镍完全溶解(2分,表述合理即给分)
4 pH -( ) 偏低形成 HF,导致溶液中 F 浓度减小,MgF2沉淀不完全(2分)
2.5×10-2(2分,8×10-2.5也可给分)
(5)Na2SO4(2分)
(6)减少晶体的损失,便于晶体干燥(2分)
(7)2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O(2分)
19.(14分)
(1)-49.0 kJ/mol(1分)
(2)0.61(1分);H*+HOCO*=CO*+HO*+H* 或 HOCO*=CO*+HO* (2分)
(3)AC(2分)
(4)升高(2分);升高(2分)
(5) (2分)473K (2分)
第 1 页 共 2 页
20. (14分)
4s
3d
(1) (2分)
(2)Mg、Si、S (2分)
(3)NH3与 H2O能形成氢键,而 PH3不能(2分);正四面体形(1分)
(4)6NA(1分); 2 (2分)
(5)π46(2分)
(6) (2分)
21.(14分)
(1)C11H10O2(1分);酯基、碳碳双键(2分)
(2)取代反应(1分)
(3) (2分)
(4)6(1分); 或 或 (2分)
(5)1(1分)
(6) (4分)
第 2 页 共 2 页
高三化学
注意事项:
1.本试卷分选择题和非选择题两部分。
2.试卷满分 100分,考试时间 75分钟。
可能用到的相对原子质量:H 1 N 14 O 16 Co 59
一、选择题(本题包括 16小题,共 44分。其中 1~10小题,每小题 2分,共 20分。11~16小题,
每小题 4分,共 24分。每小题只有一个选项符合题意。)
1.2021年 10月 16日神舟十三号载人飞船成功发射,中国航天人取得航天事业又一里程碑式成
就。下列有关物质类别的描述错误的是
选项 物质 类别
A 飞船外壳使用的铝合金 化合物
B 发射时形成的烟尘 混合物
C 运载火箭使用的燃料液氢 单质
D 航天员食用的脱水米饭所含淀粉 有机物
2.广东地处沿海,利用海洋资源历史悠久。下列说法错误的是
A.能建造“蚝宅”的牡蛎,外壳主要成分为碳酸钙
B.从虾、蟹等水产中提取的虾青素( )有良好的抗
氧化性
C.海盐营养成分高于湖盐、井盐
D.从海洋甲壳类动物壳中提取出的甲壳素(C8H13O5N)n应用广泛,属于高分子化合物
3.下列化学用语正确的是
A.N2的电子式
B.质子数 18、中子数 17的原子符号表示式
C.29498Cf + 4020Ca → 297118Og+37n(中子)是化学变化
D.氧化还原反应电子转移可表示为:
高三化学 第 1 页 共 10 页
4.化学与科技、社会、文化、生活有着密切的联系。下列说法正确的是
A.中国自主研发的首个 5G微基站射频芯片,主要材料是二氧化硅
B.利用潮汐发电,是将化学能转化为电能
C.“落红不是无情物,化作春泥更护花”,蕴藏着自然界的碳、氮循环
D.SO2可作为漂白剂、防腐剂、强氧化剂使用
5.2021年诺贝尔化学奖得主本杰明·利斯特,用实验证明了脯氨酸(图 1)能驱动不对称催化反
应,革新了分子合成方式。下列关于脯氨酸的说法错误的是
A.属于氨基酸
B.分子中所有原子均在同一平面
C.能与金属钠反应 图 1
D.能发生酯化反应
6.五育并举,劳动先行。下列劳动项目涉及的化学知识正确的是
选项 劳动项目 化学知识
A 使用牙膏除去茶杯中的茶渍 牙膏可溶解碳酸钙
B 将新切土豆丝浸没在水里防止变色 土豆中的氧化性物质遇空气变色
C 劳动后用免洗酒精洗手液消毒 酒精的强氧化性能灭活病毒
D 用砂纸磨刀 制作砂纸的金刚砂 SiC硬度很大
7.海带中含有碘元素,可通过以下步骤提取:①灼烧海带成灰;②将海带灰转移,加入蒸馏水,
搅拌,煮沸;③过滤,向滤液中滴入氯水,振荡;④将氧化后溶液转移,向其中加入 CCl4,
振荡,静置。以上步骤不需要用到的仪器是
A. B. C. D.
8.微粒观是重要的化学观念,其形成对物质及其变化的学习具有重要作用。下列关于离子共存的
判断及离子方程式的书写正确的是
A.在能使紫色石蕊试液变蓝的溶液中,离子:Na+、NH - -4+、CO32 、ClO 可大量共存
B.在含有硝酸钠的溶液中,离子:H+、Mg2+、Fe2+、SO 2-4 可大量共存
C.用 FeCl3溶液腐蚀铜电路板发生反应:Fe3+ + Cu = Fe2+ + Cu2+
D.将过量 SO2通入 NaOH - -溶液中发生反应:SO2 + OH = HSO3
高三化学 第 2 页 共 10 页
9.BASF高压法采用 CH3OH和 CO制备醋酸的循环过程如图 2所示,下列说法错误的是
图 2
A.HI在流程中起催化作用 B.循环过程需不断补充 CO和甲醇
C.循环总过程不涉及氧化还原反应 D.反应总方程式:CH3OH + CO → CH3COOH
10.部分含氮物质的价类二维图如图 3所示,下列说法正确的是
图 3
A.a→c→d→硝酸→硝酸盐的转化属于氮的固定
B.液态 a常用作制冷剂
C.1mol c与足量氧气化合,最终生成 1mol d
D.a、e均属于电解质
11.化学是以实验为基础的科学。下列实验设计能达到目的的是
选项 实验目的 实验设计
A 探究浓度对反应速率的影响 用不同浓度的酸性KMnO4溶液分别与相同浓
度 H2C2O4溶液反应
B 证明 SO2具有氧化性 将 SO2通入品红溶液中,品红褪色
取少量待测液,滴加 KSCN溶液,观察溶液
C 检验溶液中 FeSO4是否被氧化
颜色变化
将待测液滴在湿润的 pH试纸上,与标准比色
D 测定 NaOH溶液 pH
卡对照
高三化学 第 3 页 共 10 页
12.用 NA代表阿伏伽德罗常数的值。下列说法正确的是
A.16g氨基(-NH2)含有的电子数为 9NA
B.1mol 146C含有的质子数为 8NA
C.反应生成 22.4 L O2,转移电子数为 4NA
D.0.1 mol/LNa2CO3溶液中含有 Na+的数目为 0.2NA
13.“鱼浮灵”是水产养殖的迅速增氧剂,其主要成分的结构式如图 4所示。元素 X、Y、Z均为
短周期主族元素,原子序数依次增大。下列说法错误的是
图 4
A.单质沸点:X>Y
B.Z2Y2、Z2Y所含化学键类型完全相同
C.原子半径:Z>X>Y
D.简单氢化物稳定性:X<Y
14.电化学修复技术是近年迅速发展的一种污染土壤绿色原位修复技术。处理土壤重金属污染时,
在污染土壤区域插入电极(见图 5),土壤中污染物定向迁移,富集在电极区域,再通过其他
方法(电镀、沉淀/共沉淀、抽出、离子交换树脂等)去除。下列说法正确的是
图 5
A.H+在阳极区反应
B.土壤中胶体粒子不带电
C.阴极区抽提物发生的是阴离子交换
D.金属离子在碱性区域去除
高三化学 第 4 页 共 10 页
15.化学方程式属于符号表征体系,是重要的化学语言。下列物质性质实验对应的反应方程式书
写正确的是
A.Na2O2与 SO2反应:2Na2O2+ 2SO2= 2Na2SO3+ O2
B.硫代硫酸钠溶液中滴入硫酸:Na2S2O3 + H2SO4= Na2SO4 + S↓ + SO2 ↑+ H2O
点燃
C.铁在氯气里燃烧:Fe + Cl2 = FeCl2
D.少量 Fe 与稀硝酸反应:3Fe+ 8HNO3= 3Fe(NO3)2 + 2NO ↑+ 4H2O
16.室温下,向 20 mL 0.10 mol/L CH3COOH溶液中逐滴加入 0.10 mol/L NaOH 溶液,溶液中由水
电离出 H+浓度的负对数[-lgc(H +水 )]与所加 NaOH溶液体积关系如图 6所示。(忽略溶液混合
引起的体积变化)。下列说法错误的是
图 6
A.室温下,醋酸的电离常数约为 1.0×10-5
B.c、e两点溶液:c点显中性,e点显碱性
C.d点溶液中:c(Na+) + c(CH3COO-)= 0.05 mol/L
D -.b、f点溶液中均有:c(CH3COO ) > c(CH3COOH)
二、非选择题(本题包括 5 小题,共 56 分。第 17~19 题为必考题,考生都必须作答。第 20~21
题为选考题,考生根据要求作答。)
(一)必考题:共 42 分。
17.(14分)
含氯物质在生产生活中有重要作用。
I.实验室制取氯气的装置如图 7所示。
图 7
高三化学 第 5 页 共 10 页
(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整。
(2)NaOH溶液的作用是(用离子方程式表示)____。
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习
小组分析成因时提出如下猜想:
猜想 a:随 H+浓度降低,MnO2的氧化性减弱。
猜想 b:随 Cl-浓度降低,Cl-的还原性____(填“增强”、“不变”或“减弱”)。
猜想 c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、SO42-对体系中各物质的氧化性与还原性均无影响。
②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物
中加入试剂。
组别 试剂 产物
1 较浓硫酸 有 Cl2生成
2 X 有 Cl2生成
3 X和 Y 无 Cl2生成
通过三组实验,a、b、c三个猜想都.得.到.了.证.实.,则 X为____(填化学式),Y为
____(填化学式)。
Ⅱ .已知 FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与 FeCl3能否反
应产生 Cl2。
实验操作和现象:
实验操作 现象
点燃酒精喷灯,加热 加热一段时间后,装置 A中产生黄色气体,装置 B中溶液变蓝
(4)实验前,需要进行的操作为____。
(5)该实验装置从安全角度分析,存在的问题是____。
(6)装置经改进后,继续实验,确认产物有 Cl2和MnCl2,则 A中发生反应的化学方程式
为_____。
高三化学 第 6 页 共 10 页
18.(14分)
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化
行业以及印染工业等行业,由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为
原料制取 NiSO4·6H2O的步骤如下:
H2SO4+H2O2溶液 Na2SO4溶液 H2S NaF溶液 NaOH溶液
废料 溶解 除铁 除铜 除镁 沉镍 … NiSO4·6H2O
滤渣 MgO
已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价。
②常温下 Ksp(MgF )=6.4×10-2 9, Ka(HF)=6.4×10-4 。
(1)滤渣的主要成分是_____。
(2)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,其中铁元素的化合价为_____。
(3)“溶解”时加入 H2O2溶液的目的是_____。
(4)向“除铜”后的滤液中加入 NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液 pH偏低,
将会导致MgF2沉淀不完全,其原因是_____。当溶液中镁离子恰好沉淀完全时,溶液中
c(F-)为_____mol/L。
(5)“沉镍”后得到的滤液中,可循环使用的主要溶质为_____(填化学式)。
(6)制备 NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是_____。
(7)NiSO4在 NaOH溶液中用 NaClO氧化,可制得碱性镍镉电池电极材料 NiOOH。该反应
的离子方程式为_____。
19.(14分)
CO2的资源化利用能有效减少 CO2排放,缓解能源危机。用 CO2、H2为原料合成甲醇(CH3OH)
过程主要涉及以下反应:
a) CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
b) CO2(g)+H2(g) CO(g)+H2O(g) △H2= +41.2 kJ/mol
c) CO(g)+H2(g) CH3OH(g) △H3= -45.1 kJ/mol
(1)根据盖斯定律,反应 a的△H1=_____。
(2)我国学者结合实验与计算机模拟结果,研究了 CO2与 H2在 TiO2/Cu 催化剂表面生成
CH3OH和 H2O的部分反应历程,如图 8所示,其中吸附在催化剂表面的物种用*标注。
高三化学 第 7 页 共 10 页
图 8
反应历程中最小能垒(活化能)E 正=_____eV。写出历程②的化学方程式_____。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.升高温度,反应 b正向移动,反应 c逆向移动
B.加入反应 a的催化剂,可以降低反应的活化能及反应热
C.增大 H2的浓度,有利于提高 CO2的平衡转化率
D.及时分离除 CH3OH,可以使得反应 a的正反应速率增大
(4)加压,甲醇产率将_____;若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,
甲醇产率将_____。(填“升高”、“不变”、“降低”或“无法确定”)。
(5)使用新型催化剂,让 1mol CO2和 3mol H2在 1L密闭容器中只发生反应 a、b,CO2平衡
转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 CO 2 物质的量分数)随温
度的变化趋势如图 9所示。
图 9
553K时,若反应后体系的总压为 p ,反应 a的 Kp=_____(列出计算式)。(Kp为压强
平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压
等于总压乘以物质的量分数。)
由图 9可知,适宜的反应温度为_____。
高三化学 第 8 页 共 10 页
(二)选考题:14 分。请考生在第 20、21 题中任选一题作答,并将答题卡上对应题号涂黑。如
果不涂,则按第 20 题计分。
20.[选修 3:物质结构与性质](14分)
我国科学家利用新型模板剂合成了含钴磷铝分子筛催化剂。Co、P、Al的单质及其化合物用
途广泛。回答下列问题:
(1)基态 Co原子的价电子排布图为_____。
(2)第三周期主族元素中,按第一电离能大小排序,第一电离能在P和Al之间的元素有_____。
(3)PH3在水中溶解性比 NH3小,原因是_____。NH3溶于水后产生的 NH4+空间构型为_____。
(4)Co可以形成[Co(NH3)6]Cl3、K3[Co(NO3)6]等配合物。
① 1mol[Co(NH3)6]3+中 Co3+形成的σ键数目为_____。
② 已知[Co(NH3)6]3+的立体结构如图 10,其中 1~6处的小圆圈表示 NH3分子,且各相
邻的 NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若其
中四个 NH - -3被 NO3 取代形成[Co(NH3)2(NO3)4] ,其结构有几种_____。
图 10 图 11
(5)CoO可用作催化剂和制特种玻璃,可通过 CoCO3高温分解制备 CoO,同时生成 CO2。
①分子中的大π键可表示为 ,其中 m代表参与形成大π键的原子数,n代表参与形成
大π键的电子数,则 CO32-中的大π键可表示为_____。
②CoO晶体结构为 NaCl型(如图 11),若阿伏加德罗常数的值为 NA,已知晶体的密
度为 d g/cm3,则晶胞边长 a=_____pm(用含 d、NA的代数式表示)。
高三化学 第 9 页 共 10 页
21.[选修 5:有机化学基础](14分)
化合物 J是工业合成中重要的有机合成中间体,实验室由芳香烃 D和丙烯制备 J的一种合成
路线如下:
已知:
回答下列问题:
(1)化合物 J的分子式为_____,J中官能团的名称为_____。
(2)由 A→B的反应类型为_____。
(3)F→G的反应方程式为_____。
(4)化合物 H的芳香族同分异构体中,同时满足如下条件的有_____种(不考虑立体异构),
若其中一种遇 FeCl3溶液显紫色,结构简式为_____。
条件:a.含有碳碳双键 b.核磁共振氢谱的峰面积之比为 6:2:2:1:1
(5)I的分子结构中,手性碳原子数为_____。
(6)根据上述信息,写出由 和 为原料合成 的合成路线_____(无机试
剂任选)。
高三化学 第 10 页 共 10 页
2021—2022学年度第一学期教学质量检查
高三化学参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 A C D C B D A D C B C A B D B C
17.(14分)
(1) (1分)
(2)Cl2 + 2OH- = Cl- + ClO- + H2O (2分)
(3)减弱(1分) KCl(2分) MnSO4(2分)
(4)检查装置气密性 (2分,其他合理答案也给分)
(5)FeCl3易升华,遇冷会凝华而易堵塞导管 (2分,表述合理即给分)
(6)4FeCl3+3MnO2 2Fe2O3+3MnCl2+3Cl2↑ (2分)
18.(14分)
(1)SiO2(1分,二氧化硅也给 1分)
(2)+3(1分)
(3)将 Fe2+氧化成 Fe3+;促使镍完全溶解(2分,表述合理即给分)
4 pH -( ) 偏低形成 HF,导致溶液中 F 浓度减小,MgF2沉淀不完全(2分)
2.5×10-2(2分,8×10-2.5也可给分)
(5)Na2SO4(2分)
(6)减少晶体的损失,便于晶体干燥(2分)
(7)2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O(2分)
19.(14分)
(1)-49.0 kJ/mol(1分)
(2)0.61(1分);H*+HOCO*=CO*+HO*+H* 或 HOCO*=CO*+HO* (2分)
(3)AC(2分)
(4)升高(2分);升高(2分)
(5) (2分)473K (2分)
第 1 页 共 2 页
20. (14分)
4s
3d
(1) (2分)
(2)Mg、Si、S (2分)
(3)NH3与 H2O能形成氢键,而 PH3不能(2分);正四面体形(1分)
(4)6NA(1分); 2 (2分)
(5)π46(2分)
(6) (2分)
21.(14分)
(1)C11H10O2(1分);酯基、碳碳双键(2分)
(2)取代反应(1分)
(3) (2分)
(4)6(1分); 或 或 (2分)
(5)1(1分)
(6) (4分)
第 2 页 共 2 页
同课章节目录
