江苏省南通市如东县2021-2022学年高三上学期期末学情检测化学试题(Word版含答案)
文档属性
| 名称 | 江苏省南通市如东县2021-2022学年高三上学期期末学情检测化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-17 15:50:42 | ||
图片预览

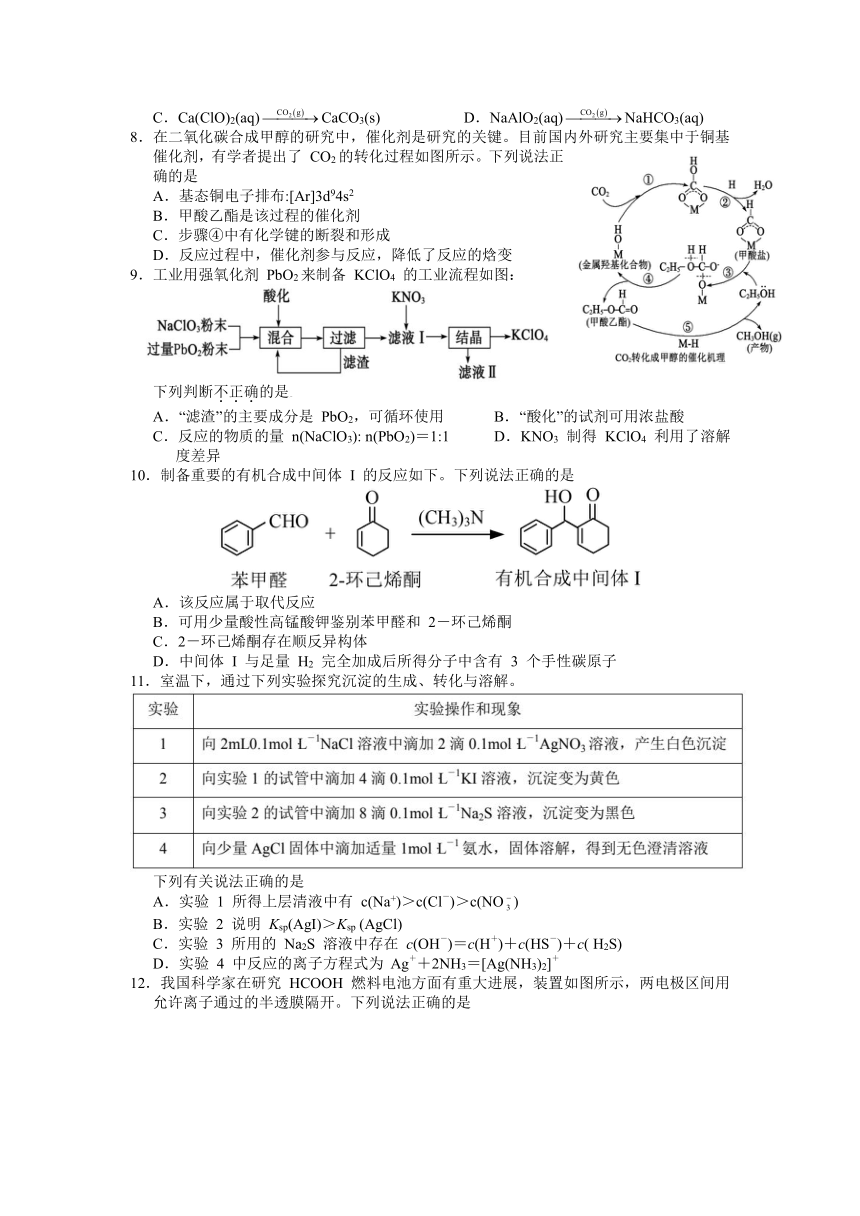


文档简介
如东县2021-2022学年高三上学期期末学情检测
化 学
可能用到的相对原子质量:H 1 C 12 O 16 S 32 K 39
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1.2020 年 11 月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度 10909 米处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是
A.“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B.“奋斗者”号使用的锂离子电池工作时 Li++向正极移动
C.未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D.制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
2.LiA1H4是重要的还原剂与储氢材料,其合成方法为:NaA1H4+LiC1=LiA1H4+NaC1。下列说法正确的是
A.NaC1 的电子式: B.中子数为 18 的氯原子:
C.Li+比 H-多一个电子层 D.LiA1H4既含有离子键又含有共价键
3.实验室可用反应 2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备 CuI(CuI 受热易被氧化)。下列实验装置和操作不能达到实验目的的是
A.用甲装置制备 SO2 B.用乙装置制备 CuI
C.用丙装置分离出 CuI D.用丁装置干燥 CuI 固体
4.下列有关物质的性质与用途不具有对应关系的是
A.Al2O3 熔点高,可用作耐高温材料 B.明矾溶于水能形成胶体,可用作净水剂
C.AlCl3熔点低,可用于工业电解铝的原料 D.Al(OH)3具有弱碱性,可用于治疗胃酸过多
5.短周期主族元素 X、Y、Z、W 原子序数依次增大,基态时 X 原子 2p 轨道上有 3 个电子,Y 位于ⅡA 族,X 与 Z 处于同一主族, W 的单质常温下是一种黄绿色气体。下列说法正确的是
A.原子半径:r(X)B.由 X 与 Y 两种元素可形成化合物 Y3X2
C.Z 的最高价氧化物对应水化物的酸性比 X 的强
D.W 的氢化物分子间能形成氢键
阅读下列资料,完成 6~8 题。
CO2 的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2 的手段,使 CO2 排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。
6.下列有关 CO2 说法正确的是_220196
A.CO2与 SiO2 的晶体类型相同 B.CO2 的空间构型为直线形
C.元素第一电离能:I1(C)>I1(O) D.CO2 属于弱电解质
7.指定条件下,下列选项所示的转化关系不能实现是
A.NaCl(aq)NaHCO3(s) B.Na2CO3(aq)NaHCO3(aq)
C.Ca(ClO)2(aq)CaCO3(s) D.NaAlO2(aq)NaHCO3(aq)
8.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了 CO2的转化过程如图所示。下列说法正确的是
A.基态铜电子排布:[Ar]3d94s2
B.甲酸乙酯是该过程的催化剂
C.步骤④中有化学键的断裂和形成
D.反应过程中,催化剂参与反应,降低了反应的焓变
9.工业用强氧化剂 PbO2来制备 KClO4 的工业流程如图:
下列判断不正确的是_196
A.“滤渣”的主要成分是 PbO2,可循环使用 B.“酸化”的试剂可用浓盐酸
C.反应的物质的量 n(NaClO3): n(PbO2)=1:1 D.KNO3 制得 KClO4 利用了溶解度差异
10.制备重要的有机合成中间体 I 的反应如下。下列说法正确的是
A.该反应属于取代反应
B.可用少量酸性高锰酸钾鉴别苯甲醛和 2-环己烯酮
C.2-环己烯酮存在顺反异构体
D.中间体 I 与足量 H2 完全加成后所得分子中含有 3 个手性碳原子
11.室温下,通过下列实验探究沉淀的生成、转化与溶解。
下列有关说法正确的是
A.实验 1 所得上层清液中有 c(Na+)>c(Cl-)>c(NO)
B.实验 2 说明 Ksp(AgI)>Ksp (AgCl)
C.实验 3 所用的 Na2S 溶液中存在 c(OH-)=c(H+)+c(HS-)+c( H2S)
D.实验 4 中反应的离子方程式为 Ag++2NH3=[Ag(NH3)2]+
12.我国科学家在研究 HCOOH 燃料电池方面有重大进展,装置如图所示,两电极区间用允许离子通过的半透-ss;alh膜隔开。下列说法正确的是
A.正极电极反应式为:HCOO--2e-+2OH-=HCO+H2O
B.隔膜为阳离子交换膜,储液池中需补充的物质 A 为 H2SO4
C.当电路中转移 1mol 电子时,理论上生成 174 g K2SO4
D.当 1 mol HCOOH 转化为 KHCO3 时,理论上消耗 11.2 L 氧气
13.常温下将NaOH溶zxy196液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是
A.Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO)
B.若直线丙表示pH与-lg的变化关系,应该在甲、乙之间
C.常温下H3PO4:Ka2(H3PO4)=10-6.79
D.当c(HPO)=c(H3PO4)时,pH=4.68
14.丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为 x mol·L-1,反应过程中的液体体积变化忽略不计。下列说法正确的是
A.a、c两点丙酮的物质的量浓度:c(a)>c(c)
B.b、c两点的逆反应速率:v(b)C.100℃时,0~5h之间丙酮的平均反应速率为0.14 x mol·L-1·h-1
D.若b点处于化学平衡,则120℃时反应的平衡常数
二、非选择题:共4题,共58分。
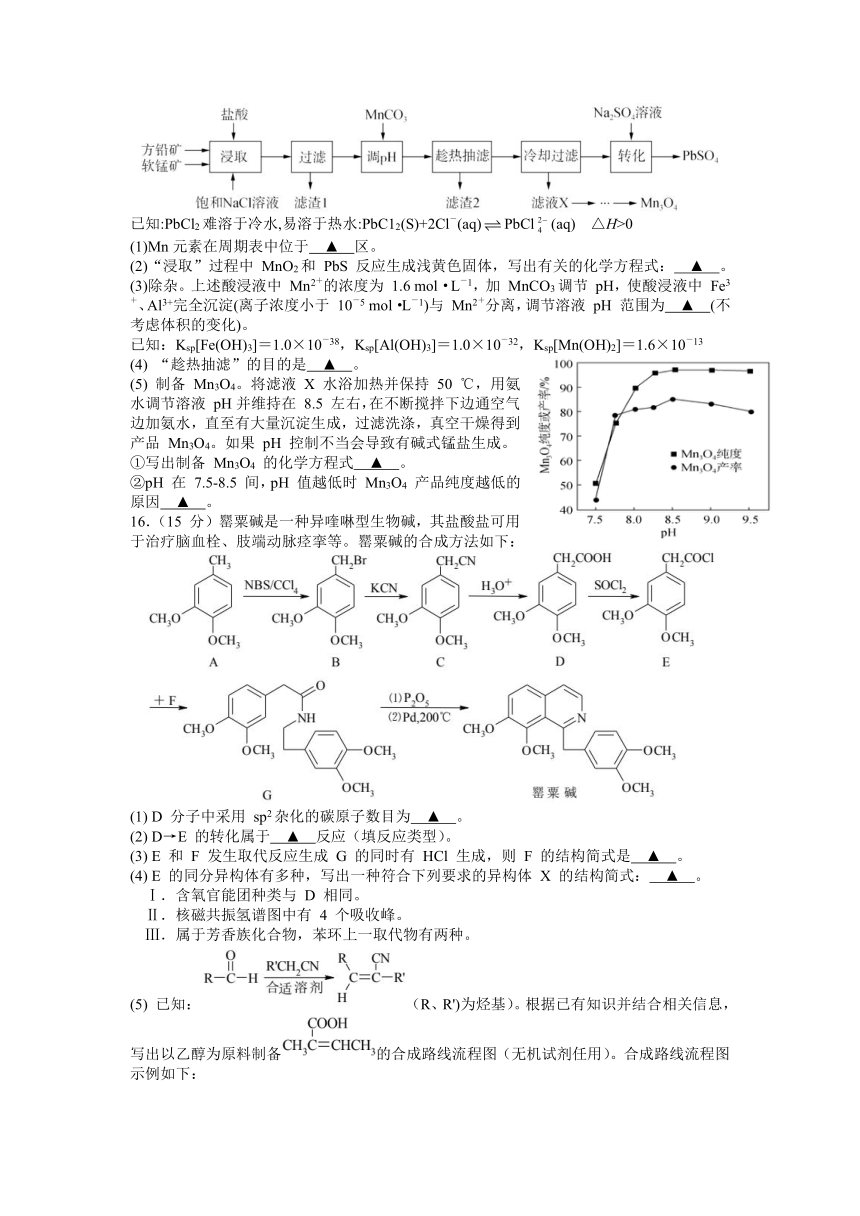
15.(15分)用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,A12O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq)PbCl(aq) △H>0
(1)Mn元素在周期表中位于 ▲ 区。
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式: ▲ 。
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为 ▲ (不考虑体积的变化)。
已知:Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,Ksp[Mn(OH)2]=1.6×10-13
(4) “趁热抽滤”的目的是 ▲ 。
(5) 制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4 的化学方程式 ▲ 。
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4 产品纯度越低的原因 ▲ 。
16.(15 分)罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下:
(1) D 分子中采用 sp2杂化的碳原子数目为 ▲ 。
(2) D→E 的转化属于 ▲ 反应(填反应类型)。
(3) E 和 F 发生取代反应生成 G 的同时有 HCl 生成,则 F 的结构简式是 ▲ 。
(4) E 的同分异构体有多种,写出一种符合下列要求的异构体 X 的结构简式: ▲ 。
Ⅰ.含氧官能团种类与 D 相同。
Ⅱ.核磁共振氢谱图中有 4 个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5) 已知:(R、R')为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
17.( 16 分)三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以含钴单质(杂质不溶于盐酸)为原料经二氯化钴制备[Co(NH3)6]Cl3·6H2O 晶体。
已知:① Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
② [Co(NH3)6]Cl3·6H2O 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)溶解。将钴单质溶于稀盐酸,过滤除去杂质,得到 CoCl2溶液。写出该反应的化学方程式 ▲ 。
(2)混合。向 CoCl2 溶液中加入少量 NH4Cl 溶液,加入活性炭作催化剂。加入的 NH4Cl 溶液有利于后续 Co2+与 NH3 的配合反应,其原理是 ▲ 。
(3)配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水、H2O2 中的一种,充分反应,再向混合溶液中滴加另一种溶液,加热,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。
①另一种溶液是 ▲ 。
②控制三颈烧瓶中溶液温度为 60℃的原因是 ▲ 。
③加入 H2O2溶液时发生反应的离子方程式为 ▲ 。
(4)制备[Co(NH3)6]Cl3·6H2O。请补充完整实验方案:将三颈烧瓶中所得混合物 ▲ ,低温干燥。
已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。
实验中须使用的试剂:稀盐酸、浓盐酸、无水乙醇。
18.(12 分)太阳能光解水制备的 H2和化工生产的副产氢,可实现资源的再利用。
(1)半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物。
①该催化剂在水中发生光催化反应的原理如图-1 所示。用简洁的语言描述光解水的过程: ▲ 。
②若将该催化剂置于 AgNO3溶液中,产物之一为 O2,另一产物为 ▲ 。
(2)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的 Na2FeO4,同时获得氢气:
Fe+2H2O+2OH- 电解 FeO +3H2↑。工作原理如图-2 所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:Na2FeO4 只在强碱性条件下稳定,易被 H2 还原。
①电解过程中须将阴极产生的气体及时排出,其原因是 ▲ 。
②c(Na2FeO4)随初始 c(NaOH)的变化如图-3。M、N 两点的 c(Na2FeO4)均低于最高值的原因是 ▲ 。
如东县2021-2022学年高三上学期期末学情检测
化 学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 6 页,包含选择题(第 1 题~第 14 题,共 42 分)、非选择题(第 15 题~第 18 题,共 58 分)两部分。本次考试时间为 75 分钟,满分 100 分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的姓名、学校、班级、座位号、考试证号用 0.5 毫米的黑色签字笔写在答题卡上相应的位置,并将条形码贴在指定区域。
3.选择题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,在其他位置作答一律无效。如需改动,用橡皮擦干净后,再选涂其他答案。非选择题请用 0.5毫米的黑色签字笔在答题卡指定区域作答。在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用 2B 铅笔作答,并请加黑加粗,描写清楚。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 K 39
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1. 2020 年 11 月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度 10909 米处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是
A. “奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B. “奋斗者”号使用的锂离子电池工作时 Li+向正极移动
C. 未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D. 制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
答案 A
2. LiA1H4是重要的还原剂与储氢材料,其合成方法为:NaA1H4+LiC1=LiA1H4+NaC1。下列说法正确的是
A. NaC1 的电子式: B. 中子数为 18 的氯原子:
C. Li+比 H-多一个电子层 D. LiA1H4既含有离子键又含有共价键
答案 D
3. 实验室可用反应2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是
A. 用甲装置制备SO2
B. 用乙装置制备CuI
C. 用丙装置分离出CuI
D. 用丁装置干燥CuI固体
答案 D
4. 下列有关物质的性质与用途不具有对应关系的是
A. Al2O3 熔点高,可用作耐高温材料
B. 明矾溶于水能形成胶体,可用作净水剂
C. AlCl3熔点低,可用于工业电解铝的原料
D. Al(OH)3具有弱碱性,可用于治疗胃酸过多
答案 C
5. 短周期主族元素X、Y、Z、W原子序数依次增大,基态时X原子2p轨道上有3个电子,Y位于ⅡA族,X与Z处于同一主族,W的单质常温下是一种黄绿色气体。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. 由X与Y两种元素可形成化合物Y3X2
C. Z的最高价氧化物对应水化物的酸性比X的强
D. W的氢化物分子间能形成氢键
答案 B
6. CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2的手段,使 CO2排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。下列有关 CO2说法正确的是
A. CO2与 SiO2的晶体类型相同 B. CO2的空间构型为直线形
C. 元素第一电离能:I1(C)>I1(O) D. CO2属于弱电解质
答案 B
7. CO2 的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2 的手段,使 CO2 排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。指定条件下,下列选项所示的转化关系不能实现是
A. NaCl(aq)NaHCO3(s) B. Na2CO3(aq)NaHCO3(aq)
C. Ca(ClO)2(aq)CaCO3(s) D. NaAlO2(aq)NaHCO3(aq)
答案 A
8. CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2的手段,使 CO2排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了 CO2的转化过程如图所示。下列说法正确的是
A. 基态铜电子排布:[Ar]3d94s2
B. 甲酸乙酯是该过程催化剂
C. 步骤④中有化学键的断裂和形成
D. 反应过程中,催化剂参与反应,降低了反应的焓变
答案 C
9. 工业用强氧化剂 PbO2来制备 KClO4的工业流程如图:
下列判断不正确的是
A. “滤渣”的主要成分是 PbO2,可循环使用
B. “酸化”的试剂可用浓盐酸
C. 反应的物质的量 n(NaClO3):n(PbO2)=1:1
D. KNO3制得 KClO4利用了溶解度差异
答案 B
10. 制备重要的有机合成中间体I的反应如下。下列说法正确的是
A. 该反应属于取代反应
B. 可用少量酸性高锰酸钾鉴别苯甲醛和2-环己烯酮
C. 2-环己烯酮存在顺反异构体
D. 中间体I与足量H2完全加成后所得分子中含有3个手性碳原子
答案 D
11. 室温下,通过下列实验探究沉淀的生成、转化与溶解。
实验 实验操作和现象
1 向溶液中滴加2滴溶液,产生白色沉淀
2 向实验1的试管中滴加4滴溶液,沉淀变为黄色
3 向实验2的试管中滴加8滴溶液,沉淀变为黑色
4 向少量固体中滴加适量氨水,固体溶解,得到无色澄清溶液
下列有关说法正确的是
A. 实验 1 所得上层清液中有 c(Na+)>c(Cl-)>c(NO)
B. 实验 2 说明 Ksp(AgI)>Ksp (AgCl)
C. 实验 3 所用的 Na2S 溶液中存在 c(OH-)=c(H+)+c(HS-)+c( H2S)
D. 实验 4 中反应的离子方程式为 Ag++2NH3=[Ag(NH3)2]+
答案 A
12. 我国科学家在研究 HCOOH 燃料电池方面有重大进展,装置如图所示,两电极区间用允许离子通过的半透膜隔开。下列说法正确的是
A. 正极电极反应式为:HCOO--2e-+2OH-= +H2O
B. 隔膜为阳离子交换膜,储液池中需补充的物质 A 为 H2SO4
C. 当电路中转移 1mol 电子时,理论上生成 174 g K2SO4
D. 当 1 mol HCOOH 转化为 KHCO3时,理论上消耗 11.2 L 氧气
答案 B
13. 常温下将NaOH溶液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是
A. Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c()+c()+c()
B. 若直线丙表示pH与-lg变化关系,应该在甲、乙之间
C. 常温下H3PO4:Ka2(H3PO4)=10-6.79
D. 当c()=c(H3PO4)时,pH=4.68
答案 D
14. 丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:CH3COCH3+,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为 x mol·L-1,反应过程中的液体体积变化忽略不计。下列说法正确的是
A. a、c两点丙酮的物质的量浓度:c(a)>c(c)
B. b、c两点的逆反应速率:v(b)C. 100℃时,0~5h之间丙酮的平均反应速率为0.14 x mol·L-1·h-1
D. 若b点处于化学平衡,则120℃时反应的平衡常数
答案 C
二、非选择题:共4题,共58分。
15. 用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,A12O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq)PbCl(aq) △H>0
(1)Mn元素周期表中位于___________区。
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式:___________。
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为___________(不考虑体积的变化)。已知:Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,Ksp[Mn(OH)2]=1.6×10-13
(4)“趁热抽滤”目的是___________。
(5)制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4的化学方程式___________。
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4产品纯度越低的原因___________。
答案 (1)d (2)
(3)
(4)降温易结晶析出,趁热抽滤有利于铅的化合物与不溶性杂质分离
(5) ①. ②. pH值越低,氯化锰与氨水形成碱式锰盐越多,并被四氧化三锰包裹无法洗出
16. 罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下:
(1)D 分子中采用 sp2杂化的碳原子数目为___________。
(2)D→E 的转化属于___________反应(填反应类型)。
(3)E 和 F 发生取代反应生成 G 的同时有 HCl 生成,则 F 的结构简式是___________。
(4)E 的同分异构体有多种,写出一种符合下列要求的异构体 X 的结构简式:___________。
Ⅰ.含氧官能团种类与 D 相同。
Ⅱ.核磁共振氢谱图中有 4 个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5)已知: (R、R')为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备合成路线流程图______ (无机试剂任用)。合成路线流程图示例如下:
CH3CH2OHH2C=CH2
答案 (1)7 (2)取代反应
(3) (4)或
(5)
17. 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以含钴单质(杂质不溶于盐酸)为原料经二氯化钴制备[Co(NH3)6]Cl3·6H2O 晶体。
已知:① Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
② [Co(NH3)6]Cl3·6H2O 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)溶解。将钴单质溶于稀盐酸,过滤除去杂质,得到CoCl2溶液。写出该反应的化学方程式___________。
(2)混合。向CoCl2溶液中加入少量NH4Cl溶液,加入活性炭作催化剂。加入的 NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是___________。
(3)配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水、H2O2中的一种,充分反应,再向混合溶液中滴加另一种溶液,加热,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。
①另一种溶液是___________。
②控制三颈烧瓶中溶液温度为60℃的原因是___________。
③加入H2O2溶液时发生反应的离子方程式为___________。
(4)制备[Co(NH3)6]Cl3·6H2O。请补充完整实验方案:将三颈烧瓶中所得混合物___________,低温干燥。
已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。
实验中须使用的试剂:稀盐酸、浓盐酸、无水乙醇。
答案 (1)Co+2HCl=CoCl2+H2↑
(2)抑制NH3·H2O的电离和Co2+的水解
(3) ①. H2O2 ②. 保证较快的反应速率,减少氨气的挥发(或H2O2的分解) ③.
(4)趁热过滤,向滤渣中加入热的稀盐酸溶解,趁热过滤,冷却后向滤液中加入少量浓盐酸,边加边搅拌,充分静置后过滤,用无水乙醇洗涤2~3次
18. 太阳能光解水制备的 H2和化工生产的副产氢,可实现资源的再利用。
(1)半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物。
①该催化剂在水中发生光催化反应的原理如图-1 所示。用简洁的语言描述光解水的过程:___________。
②若将该催化剂置于 AgNO3溶液中,产物之一为 O2,另一产物为___________。
(2)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的 Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑。工作原理如图-2 所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解过程中须将阴极产生的气体及时排出,其原因是___________。
②c(Na2FeO4)随初始 c(NaOH)的变化如图-3。M、N两点的 c(Na2FeO4)均低于最高值的原因是___________。
答案 (1) ①. 半导体光催化剂在光照条件下产生光生电子和光生空穴,(或)被光生电子还原为,(或)被光生空穴氧化为 ②. Ag
(2) ①. 防止与反应使产率降低 ②. 低,稳定性差,且反应速率慢使产率降低,过高,铁电极上有(或)生成,使产率降低
化 学
可能用到的相对原子质量:H 1 C 12 O 16 S 32 K 39
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1.2020 年 11 月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度 10909 米处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是
A.“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B.“奋斗者”号使用的锂离子电池工作时 Li++向正极移动
C.未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D.制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
2.LiA1H4是重要的还原剂与储氢材料,其合成方法为:NaA1H4+LiC1=LiA1H4+NaC1。下列说法正确的是
A.NaC1 的电子式: B.中子数为 18 的氯原子:
C.Li+比 H-多一个电子层 D.LiA1H4既含有离子键又含有共价键
3.实验室可用反应 2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备 CuI(CuI 受热易被氧化)。下列实验装置和操作不能达到实验目的的是
A.用甲装置制备 SO2 B.用乙装置制备 CuI
C.用丙装置分离出 CuI D.用丁装置干燥 CuI 固体
4.下列有关物质的性质与用途不具有对应关系的是
A.Al2O3 熔点高,可用作耐高温材料 B.明矾溶于水能形成胶体,可用作净水剂
C.AlCl3熔点低,可用于工业电解铝的原料 D.Al(OH)3具有弱碱性,可用于治疗胃酸过多
5.短周期主族元素 X、Y、Z、W 原子序数依次增大,基态时 X 原子 2p 轨道上有 3 个电子,Y 位于ⅡA 族,X 与 Z 处于同一主族, W 的单质常温下是一种黄绿色气体。下列说法正确的是
A.原子半径:r(X)
C.Z 的最高价氧化物对应水化物的酸性比 X 的强
D.W 的氢化物分子间能形成氢键
阅读下列资料,完成 6~8 题。
CO2 的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2 的手段,使 CO2 排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。
6.下列有关 CO2 说法正确的是_220196
A.CO2与 SiO2 的晶体类型相同 B.CO2 的空间构型为直线形
C.元素第一电离能:I1(C)>I1(O) D.CO2 属于弱电解质
7.指定条件下,下列选项所示的转化关系不能实现是
A.NaCl(aq)NaHCO3(s) B.Na2CO3(aq)NaHCO3(aq)
C.Ca(ClO)2(aq)CaCO3(s) D.NaAlO2(aq)NaHCO3(aq)
8.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了 CO2的转化过程如图所示。下列说法正确的是
A.基态铜电子排布:[Ar]3d94s2
B.甲酸乙酯是该过程的催化剂
C.步骤④中有化学键的断裂和形成
D.反应过程中,催化剂参与反应,降低了反应的焓变
9.工业用强氧化剂 PbO2来制备 KClO4 的工业流程如图:
下列判断不正确的是_196
A.“滤渣”的主要成分是 PbO2,可循环使用 B.“酸化”的试剂可用浓盐酸
C.反应的物质的量 n(NaClO3): n(PbO2)=1:1 D.KNO3 制得 KClO4 利用了溶解度差异
10.制备重要的有机合成中间体 I 的反应如下。下列说法正确的是
A.该反应属于取代反应
B.可用少量酸性高锰酸钾鉴别苯甲醛和 2-环己烯酮
C.2-环己烯酮存在顺反异构体
D.中间体 I 与足量 H2 完全加成后所得分子中含有 3 个手性碳原子
11.室温下,通过下列实验探究沉淀的生成、转化与溶解。
下列有关说法正确的是
A.实验 1 所得上层清液中有 c(Na+)>c(Cl-)>c(NO)
B.实验 2 说明 Ksp(AgI)>Ksp (AgCl)
C.实验 3 所用的 Na2S 溶液中存在 c(OH-)=c(H+)+c(HS-)+c( H2S)
D.实验 4 中反应的离子方程式为 Ag++2NH3=[Ag(NH3)2]+
12.我国科学家在研究 HCOOH 燃料电池方面有重大进展,装置如图所示,两电极区间用允许离子通过的半透-ss;alh膜隔开。下列说法正确的是
A.正极电极反应式为:HCOO--2e-+2OH-=HCO+H2O
B.隔膜为阳离子交换膜,储液池中需补充的物质 A 为 H2SO4
C.当电路中转移 1mol 电子时,理论上生成 174 g K2SO4
D.当 1 mol HCOOH 转化为 KHCO3 时,理论上消耗 11.2 L 氧气
13.常温下将NaOH溶zxy196液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是
A.Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO)
B.若直线丙表示pH与-lg的变化关系,应该在甲、乙之间
C.常温下H3PO4:Ka2(H3PO4)=10-6.79
D.当c(HPO)=c(H3PO4)时,pH=4.68
14.丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为 x mol·L-1,反应过程中的液体体积变化忽略不计。下列说法正确的是
A.a、c两点丙酮的物质的量浓度:c(a)>c(c)
B.b、c两点的逆反应速率:v(b)
D.若b点处于化学平衡,则120℃时反应的平衡常数
二、非选择题:共4题,共58分。
15.(15分)用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,A12O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq)PbCl(aq) △H>0
(1)Mn元素在周期表中位于 ▲ 区。
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式: ▲ 。
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为 ▲ (不考虑体积的变化)。
已知:Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,Ksp[Mn(OH)2]=1.6×10-13
(4) “趁热抽滤”的目的是 ▲ 。
(5) 制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4 的化学方程式 ▲ 。
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4 产品纯度越低的原因 ▲ 。
16.(15 分)罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下:
(1) D 分子中采用 sp2杂化的碳原子数目为 ▲ 。
(2) D→E 的转化属于 ▲ 反应(填反应类型)。
(3) E 和 F 发生取代反应生成 G 的同时有 HCl 生成,则 F 的结构简式是 ▲ 。
(4) E 的同分异构体有多种,写出一种符合下列要求的异构体 X 的结构简式: ▲ 。
Ⅰ.含氧官能团种类与 D 相同。
Ⅱ.核磁共振氢谱图中有 4 个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5) 已知:(R、R')为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
17.( 16 分)三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以含钴单质(杂质不溶于盐酸)为原料经二氯化钴制备[Co(NH3)6]Cl3·6H2O 晶体。
已知:① Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
② [Co(NH3)6]Cl3·6H2O 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)溶解。将钴单质溶于稀盐酸,过滤除去杂质,得到 CoCl2溶液。写出该反应的化学方程式 ▲ 。
(2)混合。向 CoCl2 溶液中加入少量 NH4Cl 溶液,加入活性炭作催化剂。加入的 NH4Cl 溶液有利于后续 Co2+与 NH3 的配合反应,其原理是 ▲ 。
(3)配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水、H2O2 中的一种,充分反应,再向混合溶液中滴加另一种溶液,加热,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。
①另一种溶液是 ▲ 。
②控制三颈烧瓶中溶液温度为 60℃的原因是 ▲ 。
③加入 H2O2溶液时发生反应的离子方程式为 ▲ 。
(4)制备[Co(NH3)6]Cl3·6H2O。请补充完整实验方案:将三颈烧瓶中所得混合物 ▲ ,低温干燥。
已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。
实验中须使用的试剂:稀盐酸、浓盐酸、无水乙醇。
18.(12 分)太阳能光解水制备的 H2和化工生产的副产氢,可实现资源的再利用。
(1)半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物。
①该催化剂在水中发生光催化反应的原理如图-1 所示。用简洁的语言描述光解水的过程: ▲ 。
②若将该催化剂置于 AgNO3溶液中,产物之一为 O2,另一产物为 ▲ 。
(2)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的 Na2FeO4,同时获得氢气:
Fe+2H2O+2OH- 电解 FeO +3H2↑。工作原理如图-2 所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:Na2FeO4 只在强碱性条件下稳定,易被 H2 还原。
①电解过程中须将阴极产生的气体及时排出,其原因是 ▲ 。
②c(Na2FeO4)随初始 c(NaOH)的变化如图-3。M、N 两点的 c(Na2FeO4)均低于最高值的原因是 ▲ 。
如东县2021-2022学年高三上学期期末学情检测
化 学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 6 页,包含选择题(第 1 题~第 14 题,共 42 分)、非选择题(第 15 题~第 18 题,共 58 分)两部分。本次考试时间为 75 分钟,满分 100 分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的姓名、学校、班级、座位号、考试证号用 0.5 毫米的黑色签字笔写在答题卡上相应的位置,并将条形码贴在指定区域。
3.选择题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,在其他位置作答一律无效。如需改动,用橡皮擦干净后,再选涂其他答案。非选择题请用 0.5毫米的黑色签字笔在答题卡指定区域作答。在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用 2B 铅笔作答,并请加黑加粗,描写清楚。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 K 39
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1. 2020 年 11 月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度 10909 米处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是
A. “奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B. “奋斗者”号使用的锂离子电池工作时 Li+向正极移动
C. 未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D. 制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
答案 A
2. LiA1H4是重要的还原剂与储氢材料,其合成方法为:NaA1H4+LiC1=LiA1H4+NaC1。下列说法正确的是
A. NaC1 的电子式: B. 中子数为 18 的氯原子:
C. Li+比 H-多一个电子层 D. LiA1H4既含有离子键又含有共价键
答案 D
3. 实验室可用反应2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是
A. 用甲装置制备SO2
B. 用乙装置制备CuI
C. 用丙装置分离出CuI
D. 用丁装置干燥CuI固体
答案 D
4. 下列有关物质的性质与用途不具有对应关系的是
A. Al2O3 熔点高,可用作耐高温材料
B. 明矾溶于水能形成胶体,可用作净水剂
C. AlCl3熔点低,可用于工业电解铝的原料
D. Al(OH)3具有弱碱性,可用于治疗胃酸过多
答案 C
5. 短周期主族元素X、Y、Z、W原子序数依次增大,基态时X原子2p轨道上有3个电子,Y位于ⅡA族,X与Z处于同一主族,W的单质常温下是一种黄绿色气体。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. 由X与Y两种元素可形成化合物Y3X2
C. Z的最高价氧化物对应水化物的酸性比X的强
D. W的氢化物分子间能形成氢键
答案 B
6. CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2的手段,使 CO2排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。下列有关 CO2说法正确的是
A. CO2与 SiO2的晶体类型相同 B. CO2的空间构型为直线形
C. 元素第一电离能:I1(C)>I1(O) D. CO2属于弱电解质
答案 B
7. CO2 的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2 的手段,使 CO2 排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。指定条件下,下列选项所示的转化关系不能实现是
A. NaCl(aq)NaHCO3(s) B. Na2CO3(aq)NaHCO3(aq)
C. Ca(ClO)2(aq)CaCO3(s) D. NaAlO2(aq)NaHCO3(aq)
答案 A
8. CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2的手段,使 CO2排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了 CO2的转化过程如图所示。下列说法正确的是
A. 基态铜电子排布:[Ar]3d94s2
B. 甲酸乙酯是该过程催化剂
C. 步骤④中有化学键的断裂和形成
D. 反应过程中,催化剂参与反应,降低了反应的焓变
答案 C
9. 工业用强氧化剂 PbO2来制备 KClO4的工业流程如图:
下列判断不正确的是
A. “滤渣”的主要成分是 PbO2,可循环使用
B. “酸化”的试剂可用浓盐酸
C. 反应的物质的量 n(NaClO3):n(PbO2)=1:1
D. KNO3制得 KClO4利用了溶解度差异
答案 B
10. 制备重要的有机合成中间体I的反应如下。下列说法正确的是
A. 该反应属于取代反应
B. 可用少量酸性高锰酸钾鉴别苯甲醛和2-环己烯酮
C. 2-环己烯酮存在顺反异构体
D. 中间体I与足量H2完全加成后所得分子中含有3个手性碳原子
答案 D
11. 室温下,通过下列实验探究沉淀的生成、转化与溶解。
实验 实验操作和现象
1 向溶液中滴加2滴溶液,产生白色沉淀
2 向实验1的试管中滴加4滴溶液,沉淀变为黄色
3 向实验2的试管中滴加8滴溶液,沉淀变为黑色
4 向少量固体中滴加适量氨水,固体溶解,得到无色澄清溶液
下列有关说法正确的是
A. 实验 1 所得上层清液中有 c(Na+)>c(Cl-)>c(NO)
B. 实验 2 说明 Ksp(AgI)>Ksp (AgCl)
C. 实验 3 所用的 Na2S 溶液中存在 c(OH-)=c(H+)+c(HS-)+c( H2S)
D. 实验 4 中反应的离子方程式为 Ag++2NH3=[Ag(NH3)2]+
答案 A
12. 我国科学家在研究 HCOOH 燃料电池方面有重大进展,装置如图所示,两电极区间用允许离子通过的半透膜隔开。下列说法正确的是
A. 正极电极反应式为:HCOO--2e-+2OH-= +H2O
B. 隔膜为阳离子交换膜,储液池中需补充的物质 A 为 H2SO4
C. 当电路中转移 1mol 电子时,理论上生成 174 g K2SO4
D. 当 1 mol HCOOH 转化为 KHCO3时,理论上消耗 11.2 L 氧气
答案 B
13. 常温下将NaOH溶液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是
A. Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c()+c()+c()
B. 若直线丙表示pH与-lg变化关系,应该在甲、乙之间
C. 常温下H3PO4:Ka2(H3PO4)=10-6.79
D. 当c()=c(H3PO4)时,pH=4.68
答案 D
14. 丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:CH3COCH3+,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为 x mol·L-1,反应过程中的液体体积变化忽略不计。下列说法正确的是
A. a、c两点丙酮的物质的量浓度:c(a)>c(c)
B. b、c两点的逆反应速率:v(b)
D. 若b点处于化学平衡,则120℃时反应的平衡常数
答案 C
二、非选择题:共4题,共58分。
15. 用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,A12O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq)PbCl(aq) △H>0
(1)Mn元素周期表中位于___________区。
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式:___________。
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为___________(不考虑体积的变化)。已知:Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,Ksp[Mn(OH)2]=1.6×10-13
(4)“趁热抽滤”目的是___________。
(5)制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4的化学方程式___________。
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4产品纯度越低的原因___________。
答案 (1)d (2)
(3)
(4)降温易结晶析出,趁热抽滤有利于铅的化合物与不溶性杂质分离
(5) ①. ②. pH值越低,氯化锰与氨水形成碱式锰盐越多,并被四氧化三锰包裹无法洗出
16. 罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下:
(1)D 分子中采用 sp2杂化的碳原子数目为___________。
(2)D→E 的转化属于___________反应(填反应类型)。
(3)E 和 F 发生取代反应生成 G 的同时有 HCl 生成,则 F 的结构简式是___________。
(4)E 的同分异构体有多种,写出一种符合下列要求的异构体 X 的结构简式:___________。
Ⅰ.含氧官能团种类与 D 相同。
Ⅱ.核磁共振氢谱图中有 4 个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5)已知: (R、R')为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备合成路线流程图______ (无机试剂任用)。合成路线流程图示例如下:
CH3CH2OHH2C=CH2
答案 (1)7 (2)取代反应
(3) (4)或
(5)
17. 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以含钴单质(杂质不溶于盐酸)为原料经二氯化钴制备[Co(NH3)6]Cl3·6H2O 晶体。
已知:① Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
② [Co(NH3)6]Cl3·6H2O 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)溶解。将钴单质溶于稀盐酸,过滤除去杂质,得到CoCl2溶液。写出该反应的化学方程式___________。
(2)混合。向CoCl2溶液中加入少量NH4Cl溶液,加入活性炭作催化剂。加入的 NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是___________。
(3)配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水、H2O2中的一种,充分反应,再向混合溶液中滴加另一种溶液,加热,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。
①另一种溶液是___________。
②控制三颈烧瓶中溶液温度为60℃的原因是___________。
③加入H2O2溶液时发生反应的离子方程式为___________。
(4)制备[Co(NH3)6]Cl3·6H2O。请补充完整实验方案:将三颈烧瓶中所得混合物___________,低温干燥。
已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。
实验中须使用的试剂:稀盐酸、浓盐酸、无水乙醇。
答案 (1)Co+2HCl=CoCl2+H2↑
(2)抑制NH3·H2O的电离和Co2+的水解
(3) ①. H2O2 ②. 保证较快的反应速率,减少氨气的挥发(或H2O2的分解) ③.
(4)趁热过滤,向滤渣中加入热的稀盐酸溶解,趁热过滤,冷却后向滤液中加入少量浓盐酸,边加边搅拌,充分静置后过滤,用无水乙醇洗涤2~3次
18. 太阳能光解水制备的 H2和化工生产的副产氢,可实现资源的再利用。
(1)半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物。
①该催化剂在水中发生光催化反应的原理如图-1 所示。用简洁的语言描述光解水的过程:___________。
②若将该催化剂置于 AgNO3溶液中,产物之一为 O2,另一产物为___________。
(2)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的 Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑。工作原理如图-2 所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解过程中须将阴极产生的气体及时排出,其原因是___________。
②c(Na2FeO4)随初始 c(NaOH)的变化如图-3。M、N两点的 c(Na2FeO4)均低于最高值的原因是___________。
答案 (1) ①. 半导体光催化剂在光照条件下产生光生电子和光生空穴,(或)被光生电子还原为,(或)被光生空穴氧化为 ②. Ag
(2) ①. 防止与反应使产率降低 ②. 低,稳定性差,且反应速率慢使产率降低,过高,铁电极上有(或)生成,使产率降低
同课章节目录
