广西壮族自治区玉林市容县2021-2022学年高三上学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 广西壮族自治区玉林市容县2021-2022学年高三上学期期末考试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 730.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 23:31:05 | ||
图片预览



文档简介
容县2021-2022学年高三上学期期末考试
化学试卷
一、单选题
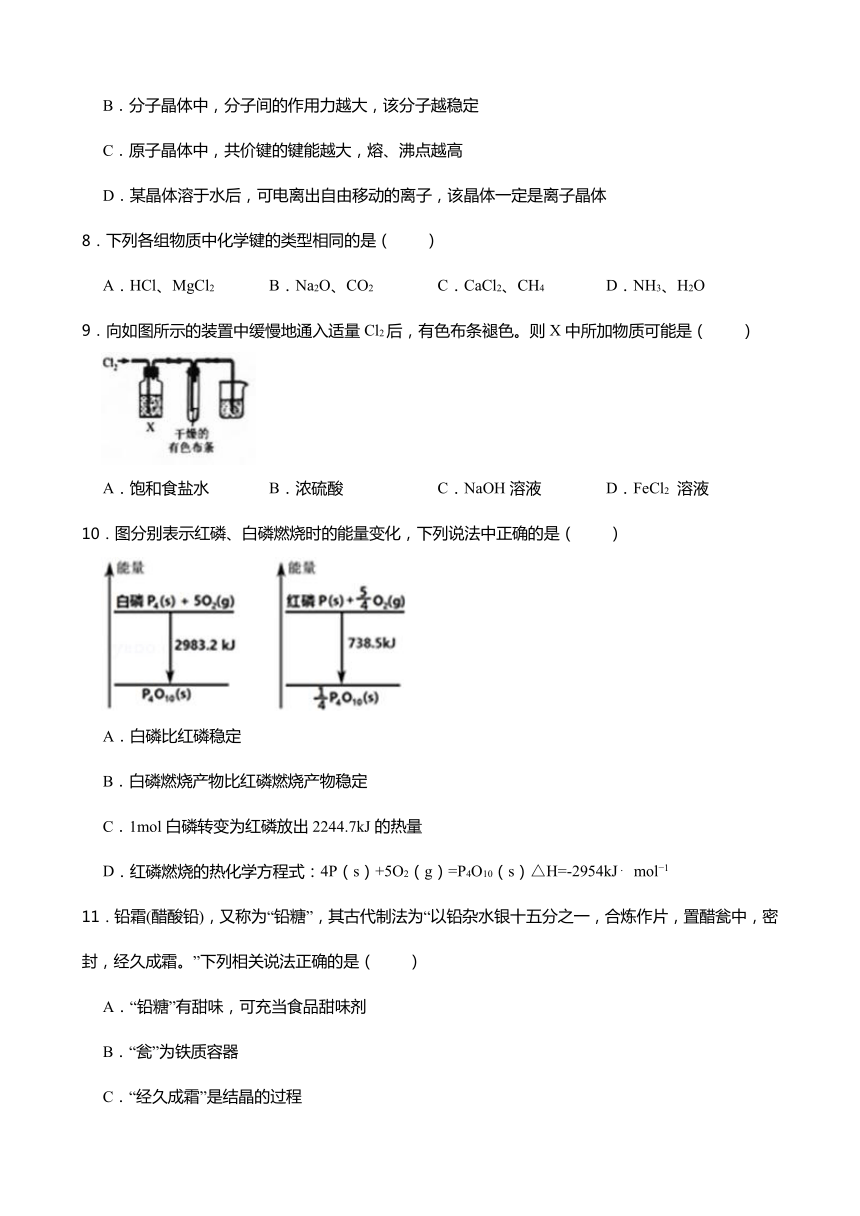
1.鲁米诺因能快速鉴定衣物等表面是否存在血迹而被称为“血迹检测小王子”,其一种合成路线如下图所示。下列说法正确的是( )
A.鲁米诺的分子式为
B.鲁米诺中最多12个原子位于同一平面
C.甲可以与 溶液反应生成
D.反应(1)是取代反应,反应(2)是氧化反应
2.关于反应:CO+ CuO Cu+CO2的叙述正确的是( )
A.CO和CO2均属于酸性氧化物,CuO属于碱性氧化物
B.该反应既是氧化还原反应,也是置换反应
C.CuO为氧化剂,CO2为氧化产物
D.28gCO参加反应,得到2mol电子
3.下列说法正确的是( )
A.可以用丁达尔效应区分氯化铝溶液和氯化钠溶液
B.二氧化硅是一种酸性氧化物,故不能和酸发生反应
C.NaCl饱和溶液中依次通入足量的NH3、CO2,可析出NaHCO3
D.可以通过电解熔融氯化铝的方法来制备铝
4.某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是()
A.充电时,太阳能转化为化学能,化学能又转化为电能
B.放电时,a极为正极
C.充电时,阳极的电极反应式为3I--2e-=I3-
D.M可以使用阴离子交换膜
5.下列属于氧化还原反应的是( )
A.Fe+CuCl2=Cu+FeCl2
B.Na2O+H2O=2NaOH
C.SiO2+2NaOH=Na2SiO3+H2O
D.CuSO4 5H2O CuSO4+5H2O
6.下列物质对应的组成错误的是( )
A.烧碱:NaOH
B.木醇:CH3OH
C.2-甲基丁烷:
D.生石膏:CaSO4·2H2O
7.关于晶体的叙述中,正确的是( )
A.分子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.原子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
8.下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2 B.Na2O、CO2 C.CaCl2、CH4 D.NH3、H2O
9.向如图所示的装置中缓慢地通入适量Cl2后,有色布条褪色。则X中所加物质可能是( )
A.饱和食盐水 B.浓硫酸 C.NaOH溶液 D.FeCl2 溶液
10.图分别表示红磷、白磷燃烧时的能量变化,下列说法中正确的是( )
A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol白磷转变为红磷放出2244.7kJ的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=-2954kJ mol 1
11.铅霜(醋酸铅),又称为“铅糖”,其古代制法为“以铅杂水银十五分之一,合炼作片,置醋瓮中,密封,经久成霜。”下列相关说法正确的是( )
A.“铅糖”有甜味,可充当食品甜味剂
B.“瓮”为铁质容器
C.“经久成霜”是结晶的过程
D.该制法以铅作正极,汞作负极,发生电化学腐蚀
12.实验室合成乙酰苯胺的路线如下(反应条件略去):
下列说法错误的是( )
A.反应①完成后,碱洗和水洗可除去混合酸
B.若反应②中加入过量酸,则苯胺产率降低
C.乙酰苯胺在强酸或强碱条件下长时间加热可发生水解反应
D.上述合成路线中的反应均为取代反应
13.在下列各溶液中通入足量CO2气体,最终有浑浊产生的( )
①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2 溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A.全部 B.除①④外
C.除①②③④外 D.除②③④外
14.根据下列反应所得结论正确的是( )
选项 反应 结论
A 非金属性:C>Si
B 非金属性:Br>I
C 金属性:Na>K
D 金属性:Fe>Cu
A.A B.B C.C D.D
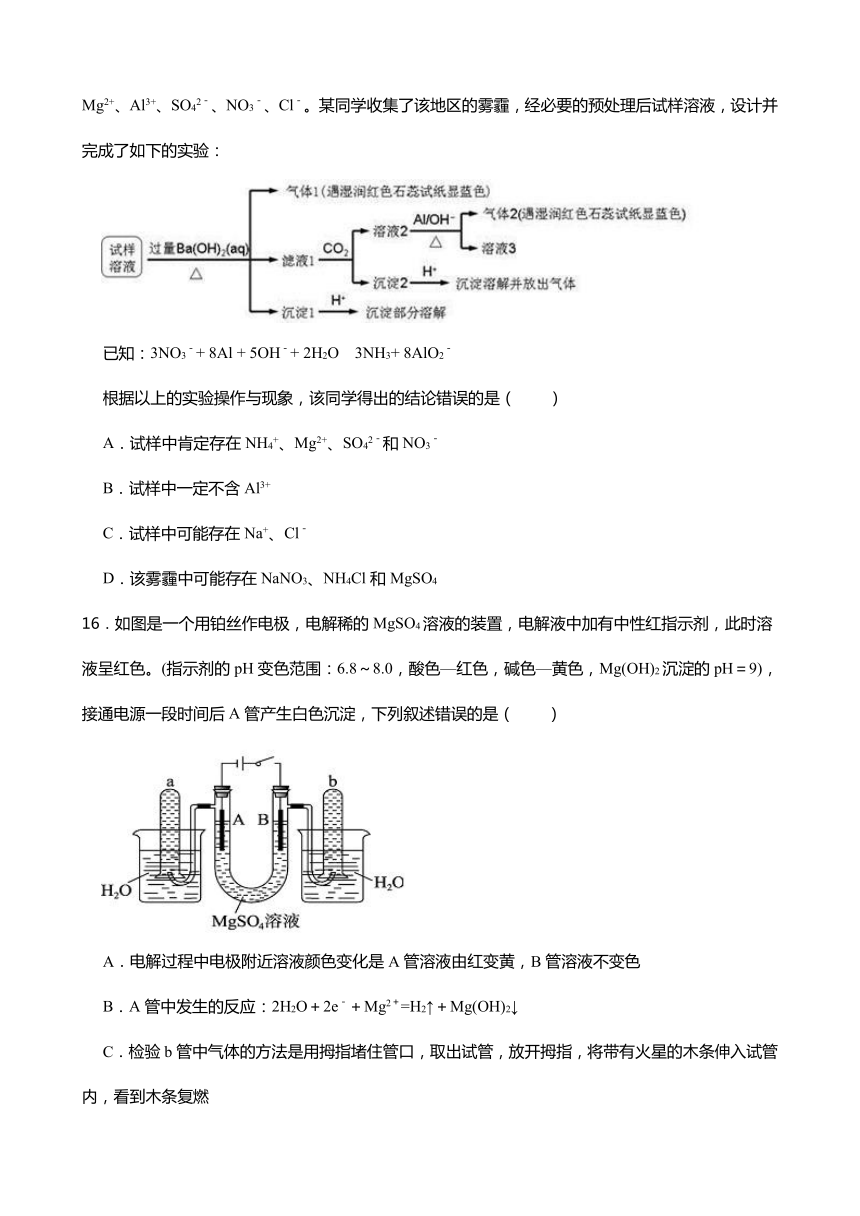
15.雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论错误的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
16.如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色,Mg(OH)2沉淀的pH=9),接通电源一段时间后A管产生白色沉淀,下列叙述错误的是( )
A.电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色
B.A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓
C.检验b管中气体的方法是用拇指堵住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,看到木条复燃
D.电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是溶液呈黄色,白色沉淀溶解
17.—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 温度/K 物质的起始浓度(mol/L) 物质的平衡浓度(mol/L)
CO2(g) H2(g) C2H5OH(g) H2O(g) C2H5OH(g)
甲 500 0.20 0.60 0 0 0.083
乙 500 0.40 1.20 0 0
丙 600 0 0 0.10 0.30 0.039
A.该反应正反应为吸热反应
B.达平衡时,甲、乙容器内:2c(CO2,甲)C.达平衡时,容器甲中的逆反应速率比容器乙中的大
D.达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
18.下列推断合理的是( )
A.某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.单质 氧化物 酸或碱 盐,能按照上述转化关系直接转化的可以是硫元素
C.浓硫酸有强氧化性,常温下能与Cu发生剧烈反应
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
19.蜂胶中某活性物质X的结构简式如下,下列关于X的说法正确的是( )
A.X不具有顺式和反式结构 B.X不能与浓溴水发生取代反应
C.1 mol X最多能与2 mol NaOH反应 D.一定条件下X可发生加聚反应
20.检验下列物所选用的试剂正确的是( )
待检验物质 所用试剂
A 海水中的碘元素 淀粉溶液
B SO2气体 澄清石灰水
C 溶液中的Cu2+ 氨水
D 溶液中的 NaOH溶液,湿润的蓝色石蕊试纸
A.A B.B C.C D.D
二、填空题
21.雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJ mol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min)浓度(mol L﹣1) 0 10 20 30 40 50
NO 1.00 0.58 0.40 0.40 0.48 0.48
N2 0 0.21 0.30 0.30 0.36 0.36
CO2 0 0.21 0.30 0.30 0.36 0.36
0~10min内,CO2的平均反应速率v(CO2)= ,反应进行到30min时,NO 的转化率= .
22.NaAlH4晶体中(晶胞结构如图),与阴离子AlH4﹣空间构型相同的两种离子 (填化学式),与Na+紧邻且等距的AlH4﹣有 个;若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式).
23.甲基丙烯酸甲酯()是生产有机玻璃的单体.
①甲基丙烯酸甲酯分子中官能团的名称为碳碳双键和 .
②通常情况下,甲基丙烯酸甲酯与溴水反应生成的有机物的结构简式为 .
③一定条件下,甲基丙烯酸甲酯发生加聚反应生成的聚合物的反应为
24.已知KI溶液与Pb(NO3)2溶液混合后可形成沉淀PbI2,此沉淀的Ksp=7.0×10﹣9.现将等体积的KI溶液与Pb(NO3)2溶液混合,若原KI溶液的浓度为1×10﹣2mo1/L,则生成沉淀所需原Pb(NO3)2溶液的最小浓度为 .
25.已知 苯酚具有弱酸性,其Ka=1.1×10﹣10;水杨酸第一级电离形成的
离子能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是 .
26.Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: .每2molNa2O2参加反应,转移电子数为 .
27.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+,则下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 .
①硫酸铝和氨水 ②偏铝酸钠和稀盐酸 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水.
28. A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3两种化合物.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.请回答下列问题:
①D元素在元素周期表中的位置是 .
②A与D所形成的化合物的电子式为 .
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为 .
29.甲烷燃料电池可以提升能量利用率,如图是利用甲烷燃料电池电解50mol2mol L﹣1的氯化铜溶液的装置示意图:
请回答:
甲烷燃料电池的负极反应式是: .
30.已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ mol﹣1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量 57.3kJ.(填>,<或=)
三、解答题
31.以石灰石、焦炭、食盐和水为原料制取聚氯乙烯,写出各合成过程中有关的化学方程式.
四、综合题
32.山梨酸钾是世界公认的安全型食品防腐剂,山梨酸钾的一条合成路线如下图所示。
回答下列问题:
(1)B中含氧官能团名称是
(2)①的反应的类型是 ,③的反应条件是
(3)②的反应方程式为
(4)D有多种同分异构体,写出一种符合下列要求或者信息的有机物的结构简式
Ⅰ.分子中所有碳原子在一个环上,且只有一个环
Ⅱ.含有三种化学环境不同的氢原子
Ⅲ.当羟基与双键碳原子相连接时,这种结构是不稳定的,易发生如下转化:
(5)苯甲酸钠( )也是一种重要的防腐剂,写出由甲苯制备苯甲酸钠的合成路线。(其他试剂任选)
(合成路线常用的表示方式为A B…… 目标产物)
五、推断题
33.
已知:R—Cl+ → (R1、R2烃为基或H)
(1)B的化学名称为 ,反应②⑤的反应类型分别为 , 。
(2)反应②的化学方程式为 。
(3)D的结构简式为 。
(4)A的同分异构体中,满足下列条件的有 种。
①含苯环且遇氯化铁溶液显紫色
②苯环上连有2个取代基,且苯环上的一氯代物有2种
③含有—N—H,且不含N—N结构
其中核磁共振氢谱为4:3:2:2:1的结构简式为 。
(5)以 、H2C=CH2为基本原料合成 (其他无机试剂任选) 。
六、实验探究题
34.高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11,Ksp(MgCO3)=2.6×10﹣5,已知离子浓度小于1.0×10﹣5mol L﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
答案解析部分
1.C
2.C
3.C
4.C
5.A
6.C
7.C
8.D
9.A
10.D
11.C
12.D
13.D
14.B
15.B
16.D
17.C
18.B
19.D
20.C
21.0.021mol/(L.min);60%
22.NH4+、BH4﹣、NH4+、SO42﹣等;8;Na3Li[AlH4]4
23.酯基;;
24.5.6×10﹣4 mol/L
25.<; 中形成分子内氢键,使其更难电离出H+
26.2SO3+2Na2O2=2Na2SO4+O2;2mol
27.②③④
28.第四周期第ⅠA族;;Cl2+S2﹣=2Cl﹣+S↓
29.CH4﹣8e﹣+2H2O=CO2+8H+
30.>
31.解:石灰石主要成分为碳酸钙,在高温条件下生成氧化钙和二氧化碳,反应为:①CaCO3 CaO+CO2↑,氧化钙与碳高温反应生成碳化钙(电石),反应②为:CaO+3C CaC2+CO↑,电石和水反应生成HC≡CH,反应为:③CaC2+2H2O→Ca(OH)2+CH≡CH↑,
食盐水电解生成氢气和氯气,反应为:④2NaCl+H2O 2NaOH+H2↑+Cl2↑,
氢气和氯气反应生成氯化氢,反应为:⑤H2+Cl2 2HCl,
HC≡CH与HCl发生加成反应生成氯乙烯,反应⑥为:CH≡CH+HCl CH2=CHCl,
氯乙烯(CH2=CHCl)发生加聚反应得到高聚物聚氯乙烯,反应⑦为: ,
答:各合成过程中有关的化学方程式:①CaCO3 CaO+CO2↑;②CaO+3C CaC2+CO↑;③CaC2+2H2O﹣→Ca(OH)2+CH≡CH↑;④2NaCl+2H2O 2NaOH+H2↑+Cl2↑⑤H2+Cl2 2HCl;⑥CH≡CH+HCl CH2=CHCl;⑦
32.(1)酯基
(2)加成反应;浓硫酸、加热
(3)
(4)
(5)
33.(1)对氟苯甲醛;取代反应;加成反应
(2) + +HCl
(3)
(4)8;
(5) 或
34.(1)提高软锰矿中锰的浸出率;作还原剂
(2)增加MnCO3的产量(或不引入新的杂质等);MnO2+H2O2+2H+=Mn2++2H2O+O2↑
(3)减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3 MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
(4)解:Ksp(MnCO3)=c(Mn2+) c(CO ),当Mn2+沉淀完全时,c(CO )= ×10﹣5=1.8×10﹣6 mol L﹣1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10﹣5/1.8×10﹣6=14.4 mol L﹣1,Mg2+的浓度0.01mol/L远小于14.4 mol L﹣1,若净化液中的c(Mg2+)=10﹣2mol/L,说明Mg2+的存在不会影响MnCO3的纯度,
答:Ksp (MnCO3)=c(Mn2+) c(CO ),当Mn2+沉淀完全时,c(CO )= ×10﹣5=1.8×10﹣6 mol L﹣1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10﹣5/1.8×10﹣6=14.4 mol L﹣1,Mg2+的浓度0.01mol/L远小于14.4 mol L﹣1,若净化液中的c(Mg2+)=10﹣2mol/L,说明Mg2+的存在不会影响MnCO3的纯度
化学试卷
一、单选题
1.鲁米诺因能快速鉴定衣物等表面是否存在血迹而被称为“血迹检测小王子”,其一种合成路线如下图所示。下列说法正确的是( )
A.鲁米诺的分子式为
B.鲁米诺中最多12个原子位于同一平面
C.甲可以与 溶液反应生成
D.反应(1)是取代反应,反应(2)是氧化反应
2.关于反应:CO+ CuO Cu+CO2的叙述正确的是( )
A.CO和CO2均属于酸性氧化物,CuO属于碱性氧化物
B.该反应既是氧化还原反应,也是置换反应
C.CuO为氧化剂,CO2为氧化产物
D.28gCO参加反应,得到2mol电子
3.下列说法正确的是( )
A.可以用丁达尔效应区分氯化铝溶液和氯化钠溶液
B.二氧化硅是一种酸性氧化物,故不能和酸发生反应
C.NaCl饱和溶液中依次通入足量的NH3、CO2,可析出NaHCO3
D.可以通过电解熔融氯化铝的方法来制备铝
4.某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是()
A.充电时,太阳能转化为化学能,化学能又转化为电能
B.放电时,a极为正极
C.充电时,阳极的电极反应式为3I--2e-=I3-
D.M可以使用阴离子交换膜
5.下列属于氧化还原反应的是( )
A.Fe+CuCl2=Cu+FeCl2
B.Na2O+H2O=2NaOH
C.SiO2+2NaOH=Na2SiO3+H2O
D.CuSO4 5H2O CuSO4+5H2O
6.下列物质对应的组成错误的是( )
A.烧碱:NaOH
B.木醇:CH3OH
C.2-甲基丁烷:
D.生石膏:CaSO4·2H2O
7.关于晶体的叙述中,正确的是( )
A.分子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.原子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
8.下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2 B.Na2O、CO2 C.CaCl2、CH4 D.NH3、H2O
9.向如图所示的装置中缓慢地通入适量Cl2后,有色布条褪色。则X中所加物质可能是( )
A.饱和食盐水 B.浓硫酸 C.NaOH溶液 D.FeCl2 溶液
10.图分别表示红磷、白磷燃烧时的能量变化,下列说法中正确的是( )
A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol白磷转变为红磷放出2244.7kJ的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=-2954kJ mol 1
11.铅霜(醋酸铅),又称为“铅糖”,其古代制法为“以铅杂水银十五分之一,合炼作片,置醋瓮中,密封,经久成霜。”下列相关说法正确的是( )
A.“铅糖”有甜味,可充当食品甜味剂
B.“瓮”为铁质容器
C.“经久成霜”是结晶的过程
D.该制法以铅作正极,汞作负极,发生电化学腐蚀
12.实验室合成乙酰苯胺的路线如下(反应条件略去):
下列说法错误的是( )
A.反应①完成后,碱洗和水洗可除去混合酸
B.若反应②中加入过量酸,则苯胺产率降低
C.乙酰苯胺在强酸或强碱条件下长时间加热可发生水解反应
D.上述合成路线中的反应均为取代反应
13.在下列各溶液中通入足量CO2气体,最终有浑浊产生的( )
①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2 溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A.全部 B.除①④外
C.除①②③④外 D.除②③④外
14.根据下列反应所得结论正确的是( )
选项 反应 结论
A 非金属性:C>Si
B 非金属性:Br>I
C 金属性:Na>K
D 金属性:Fe>Cu
A.A B.B C.C D.D
15.雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论错误的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
16.如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色,Mg(OH)2沉淀的pH=9),接通电源一段时间后A管产生白色沉淀,下列叙述错误的是( )
A.电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色
B.A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓
C.检验b管中气体的方法是用拇指堵住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,看到木条复燃
D.电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是溶液呈黄色,白色沉淀溶解
17.—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 温度/K 物质的起始浓度(mol/L) 物质的平衡浓度(mol/L)
CO2(g) H2(g) C2H5OH(g) H2O(g) C2H5OH(g)
甲 500 0.20 0.60 0 0 0.083
乙 500 0.40 1.20 0 0
丙 600 0 0 0.10 0.30 0.039
A.该反应正反应为吸热反应
B.达平衡时,甲、乙容器内:2c(CO2,甲)
D.达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
18.下列推断合理的是( )
A.某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.单质 氧化物 酸或碱 盐,能按照上述转化关系直接转化的可以是硫元素
C.浓硫酸有强氧化性,常温下能与Cu发生剧烈反应
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
19.蜂胶中某活性物质X的结构简式如下,下列关于X的说法正确的是( )
A.X不具有顺式和反式结构 B.X不能与浓溴水发生取代反应
C.1 mol X最多能与2 mol NaOH反应 D.一定条件下X可发生加聚反应
20.检验下列物所选用的试剂正确的是( )
待检验物质 所用试剂
A 海水中的碘元素 淀粉溶液
B SO2气体 澄清石灰水
C 溶液中的Cu2+ 氨水
D 溶液中的 NaOH溶液,湿润的蓝色石蕊试纸
A.A B.B C.C D.D
二、填空题
21.雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJ mol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min)浓度(mol L﹣1) 0 10 20 30 40 50
NO 1.00 0.58 0.40 0.40 0.48 0.48
N2 0 0.21 0.30 0.30 0.36 0.36
CO2 0 0.21 0.30 0.30 0.36 0.36
0~10min内,CO2的平均反应速率v(CO2)= ,反应进行到30min时,NO 的转化率= .
22.NaAlH4晶体中(晶胞结构如图),与阴离子AlH4﹣空间构型相同的两种离子 (填化学式),与Na+紧邻且等距的AlH4﹣有 个;若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式).
23.甲基丙烯酸甲酯()是生产有机玻璃的单体.
①甲基丙烯酸甲酯分子中官能团的名称为碳碳双键和 .
②通常情况下,甲基丙烯酸甲酯与溴水反应生成的有机物的结构简式为 .
③一定条件下,甲基丙烯酸甲酯发生加聚反应生成的聚合物的反应为
24.已知KI溶液与Pb(NO3)2溶液混合后可形成沉淀PbI2,此沉淀的Ksp=7.0×10﹣9.现将等体积的KI溶液与Pb(NO3)2溶液混合,若原KI溶液的浓度为1×10﹣2mo1/L,则生成沉淀所需原Pb(NO3)2溶液的最小浓度为 .
25.已知 苯酚具有弱酸性,其Ka=1.1×10﹣10;水杨酸第一级电离形成的
离子能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是 .
26.Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: .每2molNa2O2参加反应,转移电子数为 .
27.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+,则下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 .
①硫酸铝和氨水 ②偏铝酸钠和稀盐酸 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水.
28. A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3两种化合物.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.请回答下列问题:
①D元素在元素周期表中的位置是 .
②A与D所形成的化合物的电子式为 .
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为 .
29.甲烷燃料电池可以提升能量利用率,如图是利用甲烷燃料电池电解50mol2mol L﹣1的氯化铜溶液的装置示意图:
请回答:
甲烷燃料电池的负极反应式是: .
30.已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ mol﹣1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量 57.3kJ.(填>,<或=)
三、解答题
31.以石灰石、焦炭、食盐和水为原料制取聚氯乙烯,写出各合成过程中有关的化学方程式.
四、综合题
32.山梨酸钾是世界公认的安全型食品防腐剂,山梨酸钾的一条合成路线如下图所示。
回答下列问题:
(1)B中含氧官能团名称是
(2)①的反应的类型是 ,③的反应条件是
(3)②的反应方程式为
(4)D有多种同分异构体,写出一种符合下列要求或者信息的有机物的结构简式
Ⅰ.分子中所有碳原子在一个环上,且只有一个环
Ⅱ.含有三种化学环境不同的氢原子
Ⅲ.当羟基与双键碳原子相连接时,这种结构是不稳定的,易发生如下转化:
(5)苯甲酸钠( )也是一种重要的防腐剂,写出由甲苯制备苯甲酸钠的合成路线。(其他试剂任选)
(合成路线常用的表示方式为A B…… 目标产物)
五、推断题
33.
已知:R—Cl+ → (R1、R2烃为基或H)
(1)B的化学名称为 ,反应②⑤的反应类型分别为 , 。
(2)反应②的化学方程式为 。
(3)D的结构简式为 。
(4)A的同分异构体中,满足下列条件的有 种。
①含苯环且遇氯化铁溶液显紫色
②苯环上连有2个取代基,且苯环上的一氯代物有2种
③含有—N—H,且不含N—N结构
其中核磁共振氢谱为4:3:2:2:1的结构简式为 。
(5)以 、H2C=CH2为基本原料合成 (其他无机试剂任选) 。
六、实验探究题
34.高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11,Ksp(MgCO3)=2.6×10﹣5,已知离子浓度小于1.0×10﹣5mol L﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
答案解析部分
1.C
2.C
3.C
4.C
5.A
6.C
7.C
8.D
9.A
10.D
11.C
12.D
13.D
14.B
15.B
16.D
17.C
18.B
19.D
20.C
21.0.021mol/(L.min);60%
22.NH4+、BH4﹣、NH4+、SO42﹣等;8;Na3Li[AlH4]4
23.酯基;;
24.5.6×10﹣4 mol/L
25.<; 中形成分子内氢键,使其更难电离出H+
26.2SO3+2Na2O2=2Na2SO4+O2;2mol
27.②③④
28.第四周期第ⅠA族;;Cl2+S2﹣=2Cl﹣+S↓
29.CH4﹣8e﹣+2H2O=CO2+8H+
30.>
31.解:石灰石主要成分为碳酸钙,在高温条件下生成氧化钙和二氧化碳,反应为:①CaCO3 CaO+CO2↑,氧化钙与碳高温反应生成碳化钙(电石),反应②为:CaO+3C CaC2+CO↑,电石和水反应生成HC≡CH,反应为:③CaC2+2H2O→Ca(OH)2+CH≡CH↑,
食盐水电解生成氢气和氯气,反应为:④2NaCl+H2O 2NaOH+H2↑+Cl2↑,
氢气和氯气反应生成氯化氢,反应为:⑤H2+Cl2 2HCl,
HC≡CH与HCl发生加成反应生成氯乙烯,反应⑥为:CH≡CH+HCl CH2=CHCl,
氯乙烯(CH2=CHCl)发生加聚反应得到高聚物聚氯乙烯,反应⑦为: ,
答:各合成过程中有关的化学方程式:①CaCO3 CaO+CO2↑;②CaO+3C CaC2+CO↑;③CaC2+2H2O﹣→Ca(OH)2+CH≡CH↑;④2NaCl+2H2O 2NaOH+H2↑+Cl2↑⑤H2+Cl2 2HCl;⑥CH≡CH+HCl CH2=CHCl;⑦
32.(1)酯基
(2)加成反应;浓硫酸、加热
(3)
(4)
(5)
33.(1)对氟苯甲醛;取代反应;加成反应
(2) + +HCl
(3)
(4)8;
(5) 或
34.(1)提高软锰矿中锰的浸出率;作还原剂
(2)增加MnCO3的产量(或不引入新的杂质等);MnO2+H2O2+2H+=Mn2++2H2O+O2↑
(3)减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3 MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
(4)解:Ksp(MnCO3)=c(Mn2+) c(CO ),当Mn2+沉淀完全时,c(CO )= ×10﹣5=1.8×10﹣6 mol L﹣1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10﹣5/1.8×10﹣6=14.4 mol L﹣1,Mg2+的浓度0.01mol/L远小于14.4 mol L﹣1,若净化液中的c(Mg2+)=10﹣2mol/L,说明Mg2+的存在不会影响MnCO3的纯度,
答:Ksp (MnCO3)=c(Mn2+) c(CO ),当Mn2+沉淀完全时,c(CO )= ×10﹣5=1.8×10﹣6 mol L﹣1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10﹣5/1.8×10﹣6=14.4 mol L﹣1,Mg2+的浓度0.01mol/L远小于14.4 mol L﹣1,若净化液中的c(Mg2+)=10﹣2mol/L,说明Mg2+的存在不会影响MnCO3的纯度
同课章节目录
