山西省运城市2021-2022学年高三上学期期末考试 理科综合化学试卷(含答案)
文档属性
| 名称 | 山西省运城市2021-2022学年高三上学期期末考试 理科综合化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 634.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-20 16:36:50 | ||
图片预览

文档简介
运城市2021~2022学年度高三第一学期期末调研测试
理科综合试题
化学
本试卷共300分,考试时间150分钟。考生作答时,将答案写在答题卡上,在本试卷上答题无效,考试结束后,将答题卡交回。
注意事项:
1.答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2.答题时使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚。
3. 请按照题号在各题的答题区域(黑色线框)内作答, 超出答题区域书写的答案无效。
4.保持卡面清洁,不折叠,不破损。
可能用到的相对原子质量:H-1 Li- -7 C- -12 O- -16 Na- 23 Al- -27 S一32
Fe- 56 Cu- 64
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与社会、科学、技术、生活等密切相关,下列说法正确的是
A.“凡引水种盐,待夏秋之交,南风大起,则一宵结成”该过程属于蒸发结晶
B.制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型有机高分子材料
C.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是天然纤维素,属于高分子化合物
8.下列反应的离子方程式正确的是
A.向碳酸氢铵溶液中加入足量石灰水:Ca2+ +HCO3- +OH-= CaCO3↓+H2O
B.向稀硝酸中滴加Na2S2O3溶液:2H+ +S2O32- =S↓+SO2↑+H2O
C.用亚硫酸钠溶液吸收少量氯气:3SO32- +Cl2 +H2O =2HSO3-+2Cl- +SO42-
D. KClO 碱性溶液与Fe( OH)3反应生成K2 FeO4:
3ClO~-+ 2Fe(OH)3=2FeO42- +3Cl- +4H+ + H2O
9. M、X、Y、Z为原子序数依次增大的短周期主族元素,Y的简单氢化物常用作制冷剂,Z的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是
A.原子半径:Y >X> M
B.M、Y、Z三种元素可组成离子化合物
C.简单气态氢化物的稳定性:X> Y
D.X、Y、Z的最高价氧化物对应的水化物均为强酸
10.有机物X、Y、Z在一定条件下可实现如下转化,下列说法正确的是
A. Y的分子式为C7H9O
B.Y和Z可以用金属钠来鉴别
C.化合物Z环上的一氯代物共有3种(不考虑立体异构)
D.X、Y、Z分子中所有碳原子均处于同一平面
11.已知:CH4(g) +O2(g) =CH3OH(g)△H。CH4 、O2和H2O(g)(H2O的作用是活化催化剂)按照一定体积比在催化剂表面合成甲醇反应的部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。下列说法正确的是
A.该反应的△H= - 32. 51kJ/ mol
B.在催化剂表面上更容易被吸附的是O2
C.该历程中正反应最大的活化能为21.22kJ/mol
D.决定反应速率步骤(慢反应)的化学方程式为: *CH4 + *OH+ *H= *CH3OH +2* H
12.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是
A.图中的甲池为电解池,乙池为原电池
B. N2O5在c极上产生,c极的电极反应为N2O4 -2e- + H2O=N2O5 +2H+
C.a极发生的电极反应为SO2-2e- +2H2O= =SO42- +4H+
D.每转移2mol电子,生成1molN2O5和1molH2SO4
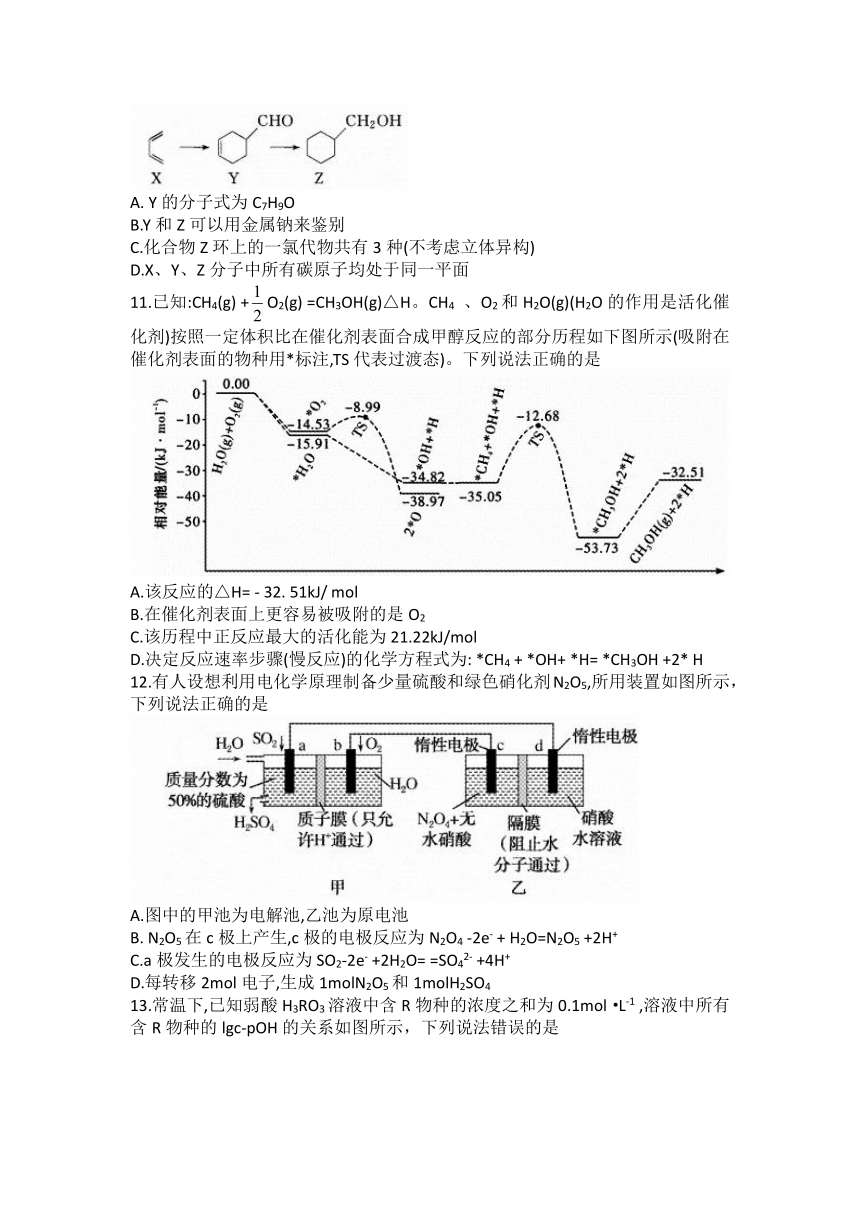
13.常温下,已知弱酸H3RO3溶液中含R物种的浓度之和为0.1mol·L-1 ,溶液中所有含R物种的lgc-pOH的关系如图所示,下列说法错误的是
已知,①pOH表示0H-浓度的负对数[pOH= - lgc(OH- )]。
②a、b、c三点的坐标,a(7.3, -1.3)、b(10.0, -3.6)、c(12.6,-1.3)。
A. H3RO3为二元弱酸
B.曲线③表示lgc( H3RO3 )随pOH的变化
C. pH=6.7的溶液中:2c( HRO32-) +c(H3RO3) =0. 1mol·L-1
D.反应H3RO3 +HRO32-2H2RO3- 的平衡常数K=1.0x104
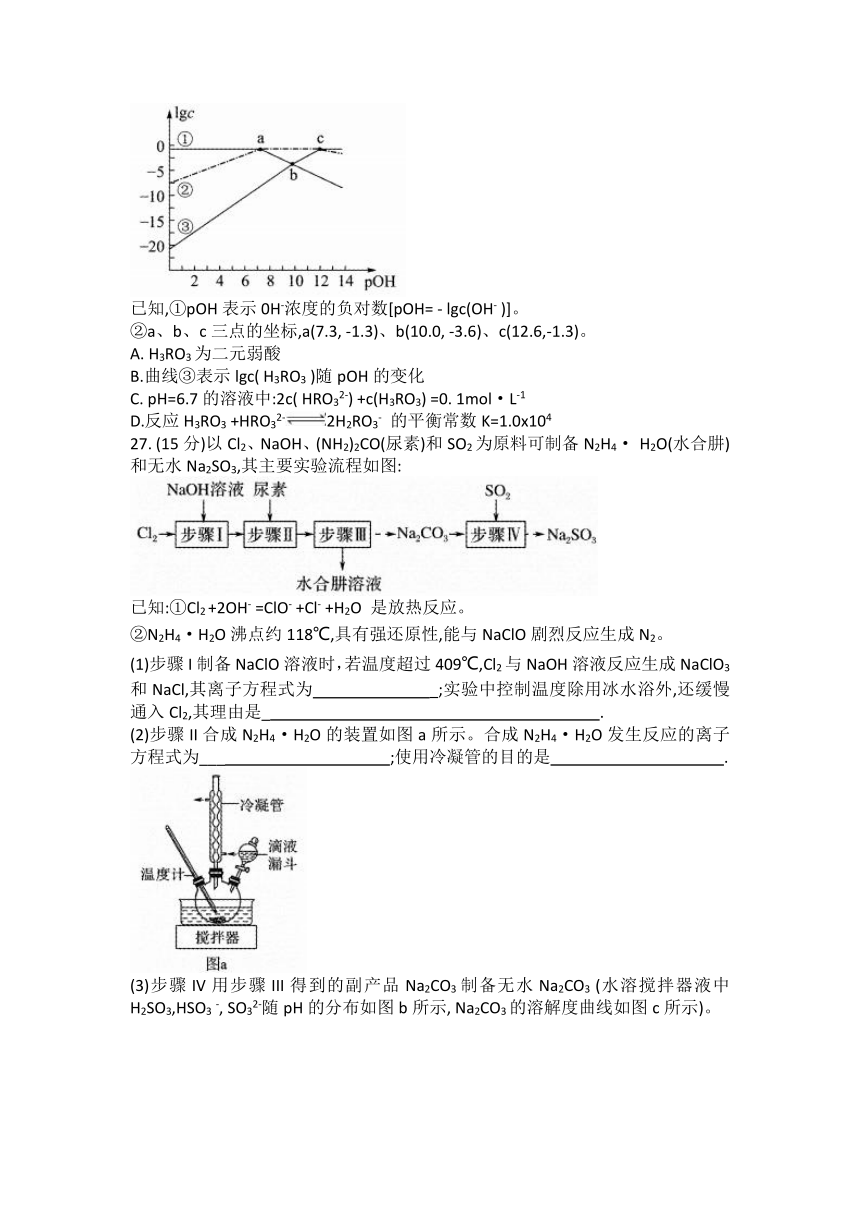
27. (15分)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4· H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
已知:①Cl2 +2OH- =ClO- +Cl- +H2O 是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过409℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为 _;实验中控制温度除用冰水浴外,还缓慢通入Cl2,其理由是_ .
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为___ ;使用冷凝管的目的是 .
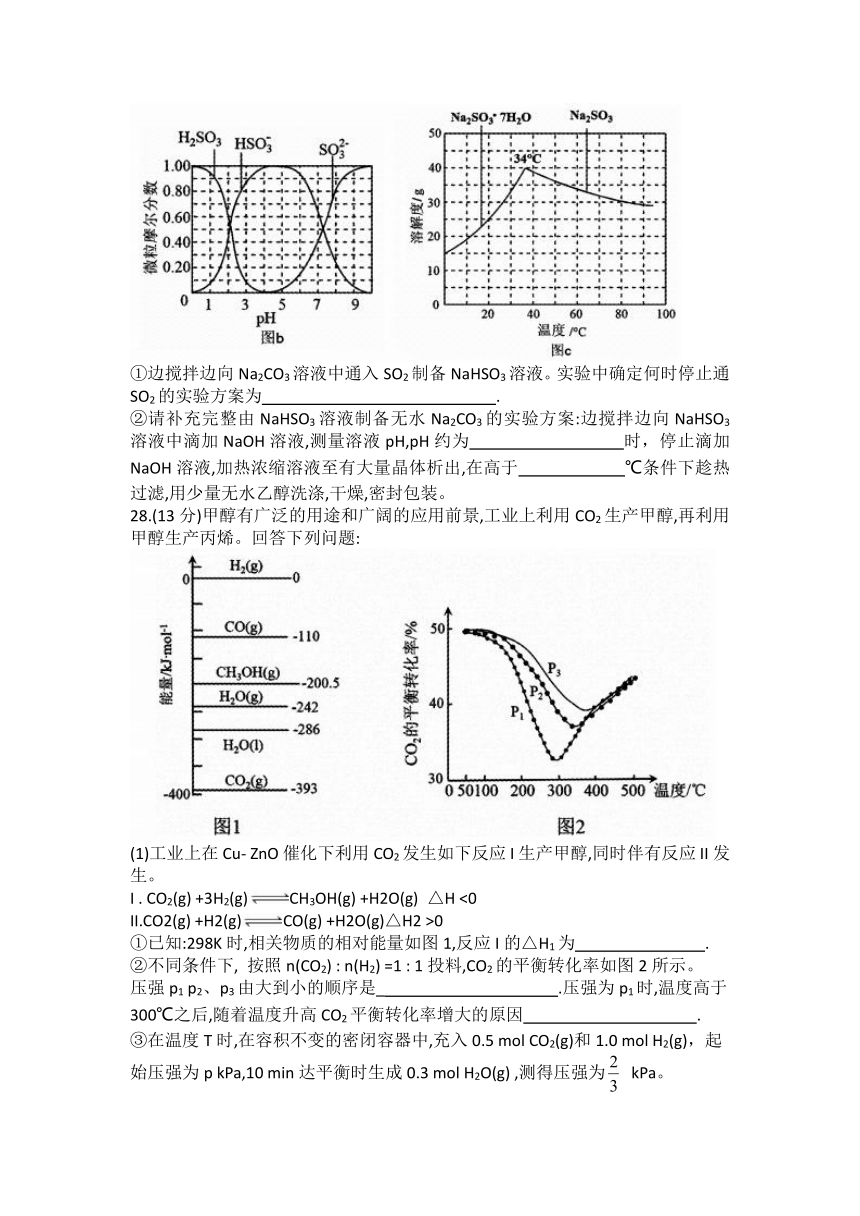
(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3 (水溶搅拌器液中H2SO3,HSO3 -, SO32-随pH的分布如图b所示, Na2CO3的溶解度曲线如图c所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通
SO2的实验方案为 .
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于 ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。
28.(13分)甲醇有广泛的用途和广阔的应用前景,工业上利用CO2生产甲醇,再利用甲醇生产丙烯。回答下列问题:
(1)工业上在Cu- ZnO催化下利用CO2发生如下反应I生产甲醇,同时伴有反应II发生。
I . CO2(g) +3H2(g)CH3OH(g) +H2O(g) △H <0
II.CO2(g) +H2(g)CO(g) +H2O(g)△H2 >0
①已知:298K时,相关物质的相对能量如图1,反应I的△H1为 .
②不同条件下, 按照n(CO2) : n(H2) =1 : 1投料,CO2的平衡转化率如图2所示。
压强p1 p2、p3由大到小的顺序是_ .压强为p1时,温度高于300℃之后,随着温度升高CO2平衡转化率增大的原因 .
③在温度T时,在容积不变的密闭容器中,充入0.5 mol CO2(g)和1.0 mol H2(g),起
始压强为p kPa,10 min达平衡时生成0.3 mol H2O(g) ,测得压强为 kPa。
若反应速率用单位时间内分压变化表示,则10min内CH3OH的反应速率v(CH3OH)
为 kPa·min-1。则反应II的平衡常数KP= .
(2)甲醇催化制取丙烯的过程中发生如下反应:
I .3CH3OH(g)C3H6(g) +3H2O(g)
II.2CH3OH(g)C2H4(g) +2H2O(g)
反应I的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arrhenius 经验公式为RInk=+C (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化
能Ea= _kJ/ mol。
29. (10分)硫化氢(H2S)、二氧化硫( SO2 )是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:
H2S +Cu2++ (aq) =CuS +2H+ ( aq) ,计算25℃时,该反应的平衡常数为 .
(已知25℃时Ksp(CuS) =1.25x10-36 ,H2S的Ka1=1 x10-7 ,Ka2=1 x10 - 13 )
(2)某科研小组将微电池技术用于去除天然气中的H2S,装置如图,主要反应:2Fe +2H2S+ O2 =2FeS +2H2O (FeS难溶于水) , 室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。
①装置中微电池负极的电极反应式为 .
②一段时间后,单位时间内H2S的去除率降低,可能的原因是 .
(3)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图甲所示。
将一定体积含 H2S的空气匀速通入Fe2(SO4) 3溶液中,反应相同时间,初始Fe3+浓度(Fe3+)及其pH与H2S脱除率的关系如图乙所示。当(Fe3+) >10g·L-1 ,H2S脱除率下降的原因是 。
(4)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图所示),该过程中部分物质的物质的量浓度随时间的变化关系如图所示:
依据上图描述H2还原SO2生成S的两步反应为:
(用化学方程式表示)
30. (20分)2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用使锂的需求量大增,自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。
I.(1)为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈 ,可以认为存在锂元素。
A.紫红色 B.绿色 C.黄色 D.紫色(需透过蓝色钴玻璃)
II.锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
查阅资料,Li2CO3在水中的溶解度(s) :20℃ ,1.33g;80℃ ,0. 85g。
(2)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理后,获得正极片。下列分析你认为合理的是_ 。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(3)工业上为了最终获得一种常用金属,向碱溶所得滤液①中加入一定量硫酸,请写出此时硫酸参与反应的所有离子方程式 .
(4)有人提出在酸浸时,用H2O2代替HNO3效果会更好。请写出用双氧水代替硝酸时主要反应的化学方程式_ 。
(5)若滤液②中c(Li+) =4mol/L,加入等体积的Na2CO3溶液后,沉淀中的Li元素占原Li元素总量的95.5%,计算滤液③中c(CO3 ) = 。(Ksp(Li2CO3) =1.62 x
10-3)
(6)综合考虑,最后流程中对滤渣③洗涤时,常选用下列 (填字母)洗涤。
A.热水 B.冷水 C.酒精
原因是_ .
(7)工业上将回收的Li2CO3和滤渣②中FePO4 粉碎与足量炭黑混合高温灼烧再生制备LiFePO4 ,实现了物质的循环利用,更好的节省了资源。请写出反应的化学方程式:_ .
理科综合试题
化学
本试卷共300分,考试时间150分钟。考生作答时,将答案写在答题卡上,在本试卷上答题无效,考试结束后,将答题卡交回。
注意事项:
1.答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2.答题时使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚。
3. 请按照题号在各题的答题区域(黑色线框)内作答, 超出答题区域书写的答案无效。
4.保持卡面清洁,不折叠,不破损。
可能用到的相对原子质量:H-1 Li- -7 C- -12 O- -16 Na- 23 Al- -27 S一32
Fe- 56 Cu- 64
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与社会、科学、技术、生活等密切相关,下列说法正确的是
A.“凡引水种盐,待夏秋之交,南风大起,则一宵结成”该过程属于蒸发结晶
B.制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型有机高分子材料
C.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是天然纤维素,属于高分子化合物
8.下列反应的离子方程式正确的是
A.向碳酸氢铵溶液中加入足量石灰水:Ca2+ +HCO3- +OH-= CaCO3↓+H2O
B.向稀硝酸中滴加Na2S2O3溶液:2H+ +S2O32- =S↓+SO2↑+H2O
C.用亚硫酸钠溶液吸收少量氯气:3SO32- +Cl2 +H2O =2HSO3-+2Cl- +SO42-
D. KClO 碱性溶液与Fe( OH)3反应生成K2 FeO4:
3ClO~-+ 2Fe(OH)3=2FeO42- +3Cl- +4H+ + H2O
9. M、X、Y、Z为原子序数依次增大的短周期主族元素,Y的简单氢化物常用作制冷剂,Z的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是
A.原子半径:Y >X> M
B.M、Y、Z三种元素可组成离子化合物
C.简单气态氢化物的稳定性:X> Y
D.X、Y、Z的最高价氧化物对应的水化物均为强酸
10.有机物X、Y、Z在一定条件下可实现如下转化,下列说法正确的是
A. Y的分子式为C7H9O
B.Y和Z可以用金属钠来鉴别
C.化合物Z环上的一氯代物共有3种(不考虑立体异构)
D.X、Y、Z分子中所有碳原子均处于同一平面
11.已知:CH4(g) +O2(g) =CH3OH(g)△H。CH4 、O2和H2O(g)(H2O的作用是活化催化剂)按照一定体积比在催化剂表面合成甲醇反应的部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。下列说法正确的是
A.该反应的△H= - 32. 51kJ/ mol
B.在催化剂表面上更容易被吸附的是O2
C.该历程中正反应最大的活化能为21.22kJ/mol
D.决定反应速率步骤(慢反应)的化学方程式为: *CH4 + *OH+ *H= *CH3OH +2* H
12.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是
A.图中的甲池为电解池,乙池为原电池
B. N2O5在c极上产生,c极的电极反应为N2O4 -2e- + H2O=N2O5 +2H+
C.a极发生的电极反应为SO2-2e- +2H2O= =SO42- +4H+
D.每转移2mol电子,生成1molN2O5和1molH2SO4
13.常温下,已知弱酸H3RO3溶液中含R物种的浓度之和为0.1mol·L-1 ,溶液中所有含R物种的lgc-pOH的关系如图所示,下列说法错误的是
已知,①pOH表示0H-浓度的负对数[pOH= - lgc(OH- )]。
②a、b、c三点的坐标,a(7.3, -1.3)、b(10.0, -3.6)、c(12.6,-1.3)。
A. H3RO3为二元弱酸
B.曲线③表示lgc( H3RO3 )随pOH的变化
C. pH=6.7的溶液中:2c( HRO32-) +c(H3RO3) =0. 1mol·L-1
D.反应H3RO3 +HRO32-2H2RO3- 的平衡常数K=1.0x104
27. (15分)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4· H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
已知:①Cl2 +2OH- =ClO- +Cl- +H2O 是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过409℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为 _;实验中控制温度除用冰水浴外,还缓慢通入Cl2,其理由是_ .
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为___ ;使用冷凝管的目的是 .
(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3 (水溶搅拌器液中H2SO3,HSO3 -, SO32-随pH的分布如图b所示, Na2CO3的溶解度曲线如图c所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通
SO2的实验方案为 .
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于 ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。
28.(13分)甲醇有广泛的用途和广阔的应用前景,工业上利用CO2生产甲醇,再利用甲醇生产丙烯。回答下列问题:
(1)工业上在Cu- ZnO催化下利用CO2发生如下反应I生产甲醇,同时伴有反应II发生。
I . CO2(g) +3H2(g)CH3OH(g) +H2O(g) △H <0
II.CO2(g) +H2(g)CO(g) +H2O(g)△H2 >0
①已知:298K时,相关物质的相对能量如图1,反应I的△H1为 .
②不同条件下, 按照n(CO2) : n(H2) =1 : 1投料,CO2的平衡转化率如图2所示。
压强p1 p2、p3由大到小的顺序是_ .压强为p1时,温度高于300℃之后,随着温度升高CO2平衡转化率增大的原因 .
③在温度T时,在容积不变的密闭容器中,充入0.5 mol CO2(g)和1.0 mol H2(g),起
始压强为p kPa,10 min达平衡时生成0.3 mol H2O(g) ,测得压强为 kPa。
若反应速率用单位时间内分压变化表示,则10min内CH3OH的反应速率v(CH3OH)
为 kPa·min-1。则反应II的平衡常数KP= .
(2)甲醇催化制取丙烯的过程中发生如下反应:
I .3CH3OH(g)C3H6(g) +3H2O(g)
II.2CH3OH(g)C2H4(g) +2H2O(g)
反应I的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arrhenius 经验公式为RInk=+C (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化
能Ea= _kJ/ mol。
29. (10分)硫化氢(H2S)、二氧化硫( SO2 )是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:
H2S +Cu2++ (aq) =CuS +2H+ ( aq) ,计算25℃时,该反应的平衡常数为 .
(已知25℃时Ksp(CuS) =1.25x10-36 ,H2S的Ka1=1 x10-7 ,Ka2=1 x10 - 13 )
(2)某科研小组将微电池技术用于去除天然气中的H2S,装置如图,主要反应:2Fe +2H2S+ O2 =2FeS +2H2O (FeS难溶于水) , 室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。
①装置中微电池负极的电极反应式为 .
②一段时间后,单位时间内H2S的去除率降低,可能的原因是 .
(3)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图甲所示。
将一定体积含 H2S的空气匀速通入Fe2(SO4) 3溶液中,反应相同时间,初始Fe3+浓度(Fe3+)及其pH与H2S脱除率的关系如图乙所示。当(Fe3+) >10g·L-1 ,H2S脱除率下降的原因是 。
(4)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图所示),该过程中部分物质的物质的量浓度随时间的变化关系如图所示:
依据上图描述H2还原SO2生成S的两步反应为:
(用化学方程式表示)
30. (20分)2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用使锂的需求量大增,自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。
I.(1)为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈 ,可以认为存在锂元素。
A.紫红色 B.绿色 C.黄色 D.紫色(需透过蓝色钴玻璃)
II.锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
查阅资料,Li2CO3在水中的溶解度(s) :20℃ ,1.33g;80℃ ,0. 85g。
(2)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理后,获得正极片。下列分析你认为合理的是_ 。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(3)工业上为了最终获得一种常用金属,向碱溶所得滤液①中加入一定量硫酸,请写出此时硫酸参与反应的所有离子方程式 .
(4)有人提出在酸浸时,用H2O2代替HNO3效果会更好。请写出用双氧水代替硝酸时主要反应的化学方程式_ 。
(5)若滤液②中c(Li+) =4mol/L,加入等体积的Na2CO3溶液后,沉淀中的Li元素占原Li元素总量的95.5%,计算滤液③中c(CO3 ) = 。(Ksp(Li2CO3) =1.62 x
10-3)
(6)综合考虑,最后流程中对滤渣③洗涤时,常选用下列 (填字母)洗涤。
A.热水 B.冷水 C.酒精
原因是_ .
(7)工业上将回收的Li2CO3和滤渣②中FePO4 粉碎与足量炭黑混合高温灼烧再生制备LiFePO4 ,实现了物质的循环利用,更好的节省了资源。请写出反应的化学方程式:_ .
同课章节目录
