江西省抚州市东乡二中2021-2022学年九年级下学期开学适应性考试化学试(word版有答案)
文档属性
| 名称 | 江西省抚州市东乡二中2021-2022学年九年级下学期开学适应性考试化学试(word版有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 396.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 22:48:36 | ||
图片预览

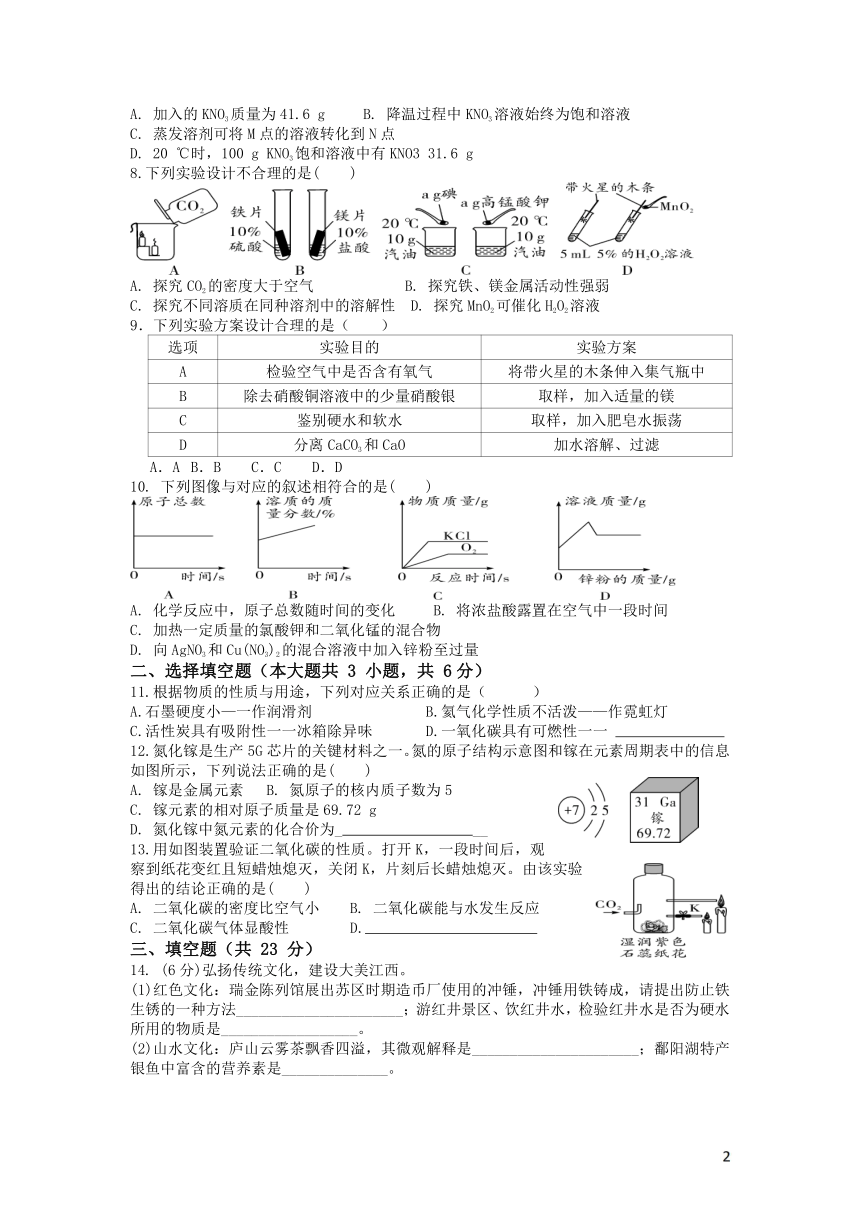
文档简介
2022届第二学期开学适应性试考试
(考试范围:第一到第九单元2022.2.17)
本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 P-31 Cl-35.5 K-39 Fe-56 Ag-108
一、单项选择题(本大题包括10小题,前5题每题1分,后5题每小题2分,共15分。)
序号 1 2 3 4 5 6 7 8 9 10
答案
1.第24届冬季奥运会将于2022年在北京举办,为落实“绿色冬奥”的理念,冬奥会使用的汽车燃料从环保的角度考虑,最理想的是( ) A.氢气B.天然气C.酒精 D.汽油
2.燃烧与人类的生活以及社会的发展有着密切的联系。下列有关燃烧和灭火的说法错误的是( )A. 釜底抽薪——移除可燃物 B. 电器着火——用水浇灭
C. 钻木取火——使温度达到可燃物的着火点以上
D. 架空篝火——使木材与空气有足够大的接触面积
3.下列选项中,对相应实验的描述正确的是( )
A.甲烷燃烧生成二氧化碳和水 B.铁能在氧气中燃烧
C.红磷的着火点比白磷的低 D.用于除去二氧化碳中的水蒸气
4.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测定反应前后各物质的质量如下表,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 25 15 1 5
反应后的质量/g 11 X 1 22
A、X 值为 3g B、乙全部发生了反应
C、丙一定是催化剂 D、 甲与乙反应的质量比为 14:3
选项 X Y Z
A 纯净物 氧化物 氯酸钾
B 可再生能源 化石燃料 天然气
C 空气 稀有气体 Ne
D 灭火原理 隔绝氧气 高压水枪灭火
5. 分类是研究物质的常用方法,X、Y、Z之间的形象关系如图所示 ,则下列选项符合该关系的是( )
6.现有某铁样品5.6 g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示,
则下列结论正确的个数是( )
①恰好完全反应时,一定没有固体剩余 ②x的值为0.2
③铁样品中可能含有镁 ④M点对应的溶液中含有2种或3种溶质
1个 B. 2个 C.3个 D.4个
7.60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图1。结合图2,下列说法正确的是( )
图1 图2
A. 加入的KNO3质量为41.6 g B. 降温过程中KNO3溶液始终为饱和溶液
C. 蒸发溶剂可将M点的溶液转化到N点
D. 20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
8.下列实验设计不合理的是( )
A. 探究CO2的密度大于空气 B. 探究铁、镁金属活动性强弱
C. 探究不同溶质在同种溶剂中的溶解性 D. 探究MnO2可催化H2O2溶液
9.下列实验方案设计合理的是( )
选项 实验目的 实验方案
A 检验空气中是否含有氧气 将带火星的木条伸入集气瓶中
B 除去硝酸铜溶液中的少量硝酸银 取样,加入适量的镁
C 鉴别硬水和软水 取样,加入肥皂水振荡
D 分离CaCO3和CaO 加水溶解、过滤
A.A B.B C.C D.D
10. 下列图像与对应的叙述相符合的是( )
A. 化学反应中,原子总数随时间的变化 B. 将浓盐酸露置在空气中一段时间
C. 加热一定质量的氯酸钾和二氧化锰的混合物
D. 向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
二、选择填空题(本大题共 3 小题,共 6分)
11.根据物质的性质与用途,下列对应关系正确的是( )
A.石墨硬度小—一作润滑剂 B.氦气化学性质不活泼——作霓虹灯
C.活性炭具有吸附性一一冰箱除异味 D.一氧化碳具有可燃性一一
12.氮化镓是生产5G芯片的关键材料之一。氮的原子结构示意图和镓在元素周期表中的信息如图所示,下列说法正确的是( )
A. 镓是金属元素 B. 氮原子的核内质子数为5
C. 镓元素的相对原子质量是69.72 g
D. 氮化镓中氮元素的化合价为_ __
13.用如图装置验证二氧化碳的性质。打开K,一段时间后,观察到纸花变红且短蜡烛熄灭,关闭K,片刻后长蜡烛熄灭。由该实验得出的结论正确的是( )
A. 二氧化碳的密度比空气小 B. 二氧化碳能与水发生反应
C. 二氧化碳气体显酸性 D.
三、填空题(共 23 分)
14. (6分)弘扬传统文化,建设大美江西。
(1)红色文化:瑞金陈列馆展出苏区时期造币厂使用的冲锤,冲锤用铁铸成,请提出防止铁生锈的一种方法______________________;游红井景区、饮红井水,检验红井水是否为硬水所用的物质是__________________。
(2)山水文化:庐山云雾茶飘香四溢,其微观解释是______________________;鄱阳湖特产银鱼中富含的营养素是______________。
(3)江右文化:青砖灰瓦是赣派建筑的一大亮点,而徽派建筑的主要特点是白墙青瓦。白墙是指在墙壁上粉刷一层石灰浆,从而能让墙壁变的“又白又硬”,原因是_________________ ________________________ (用化学方程式表示)。
15. (4分)如图是2021年央视春晚《国宝回家》节目展示的四件回归文物。
(1)龙山石窟的岩石中含有二氧化硅(SiO2),二氧化硅中硅元素的化合价为______。
(2)用墨绘制的《五牛图》从古代保存至今仍不变色,是因为碳的化学性质________。
(3)金可加工成秦公鸷鸟形金饰片主要利用了金的________性。
(4)圆明园青铜虎蓥的主要成分是青铜,我国古代“火法炼铜”中用辉铜矿(主要成分为Cu2S)炼铜的反应原理之一是:其中X的化学式为________。
16.(6分)某同学设计的工业制备氢氧化钠的流程如图
资料:,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)工业生产中应选择途径______(“①”或“②”),理由是_________________________.
(2)Cl2可用于生产84消毒液(有效成分 NaClO),反应原理为:Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有______种。
(3)图2实验测定水组成,不能加入NaCl增强水的导电性的理由是___________________。电解水的化学方程式为________________________________。
图2
17. (7分)杜鹃花为江西省的省花。如图所示的杜鹃花中花瓣A~E均为初中化学常见的5种物质,它们之间的转化关系如图所示(“―→”表示转化关
系,所涉及反应均为初中常见的化学反应),A、D常温下均为黑色固体,C是一种有毒气体,E是紫红色固体。请回答下列问题:
(1)C的化学式是________;
(2)B的一种用途是____________________;
(3)D的物质类别是____________(填“单质”“氧化物”“酸”“碱”或“盐”)。
(4)B―→C反应的化学方程式为____________________________;
E―→A反应的化学方程式为____________________________
四、探究题(本大题共2 小题,共16分)
19. (8分)根据下列装置图,回答有关问题:
(1)图中标号仪器的名称:①________。
(2)利用上图中、装置的组合可以制取某种气体,实验室制取该气体的化学方程式是________________________________,看到有____________________现象发生时,说明气体已经集满集气瓶。
(3)实验室通常利用上图中装置与________的组合制取二氧化碳(选填字母),该反应的化学方程式为________________________________。若用装置代替装置进行实验,优点为________________________________。
(4)为了得到纯净、干燥的二氧化碳气体,除杂装置(如下图)的导管按气流方向连接顺序是________。(选填字母)。
. .
. .
20.(8分)在学习了单质碳的化学性质后,某化学兴趣小组的同学对含碳化合物燃烧后的产物进行了探究。
【提出问题】乙醇燃烧后的产物是什么?
【查阅资料】①无水硫酸铜为白色粉末,遇水会变蓝;②氯化钙有吸水性,可做干燥剂。
【做出猜想】猜想一:产物中含有CO、H2O;猜想二:产物中含有CO2、H2O;
猜想三:产物中含有(1)_______________________________。
【进行实验】同学们设计了如图的实验:检查装置气密性后,将乙醇燃烧的产物依次通过如图所示的装置进行验证;(部分夹持固定装置省略;B、D、G装置中均为澄清的石灰水)
(2)装置B的作用是_______________________________。
(3)F装置中若发生反应,则化学方程式是_______________________________。
【解释与结论】经过实验,同学们认为猜想三成立。
(4)实验中能观察到的现象是①_______________________________;装置C中发生反应的化学方程式为②_______________________________。
【反思与评价】实验结束后,由于小丽同学的操作不当造成了仪器损坏,小组内同学针对这个事故,进行了分析和讨论。
(1)为了避免此事故再次发生,同学们对该装置进行了创新和改进,你认为他们的改进是 _________________(文字说明或画图都可)。
五、计算题(本大题共 1 小题,共10分)
20. (10分)钢铁的生产和使用是人类文明和社会进步的一个重要标志。为测定某钢铁厂生铁样品中的含碳量,小科取样品进行实验:向四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加入200 g溶质质量分数相同的稀硫酸,充分反应后,测得的实验数据如表
实验序号 1 2 3 4
生铁样品的质量/g 20 40 60 80
生成气体的总质量/g 0.7 1.4 1.5 m
(1)每年钢铁锈蚀都会造成巨大的经济损失,铁制品锈蚀的主要原因是________。
(2)表格中m值为________。
(3)计算该生铁样品中碳单质的质量分数。(写出计算过程)
(4)请设计其他方案测定生铁样品中的含碳量_____________________________(简要说明操作步骤)。
参考答案
序号 1 2 3 4 5 6 7 8 9 10
答案 A B B D C A A B C A
11、 C 作燃料
12、A -3
13、B 二氧化碳不支持燃烧
14. (6分)(1)涂油(合理即可)(1分) 肥皂水(1分) (2)分子在不断地运动(1分) 蛋白质(1分)
(3)CO2+Ca(OH)2 === CaCO3↓+H2O(2分)
15. (4分)(1)+4(1分) (2)常温下不活泼(或常温下稳定)(1分) (3)延展(1分) (4)O2
16、 3:7 CO2+3H2→CH3OH+H2O H2O
17 ① 步骤简单 3 加氯化钠会生成氯气,干扰实验结果 2H2O2H2↑+O2↑
18. (7分)(1)CO (2)作气体肥料(或灭火等合理即可)
(3)单质 (4)CO2+C===CO 2Cu+O22CuO
19.
【答案】
(1)酒精灯
(2) ,气泡冒出
(3), ,随时控制反应的发生和停止(或随开随用、随关随停)
(4),
20. (10分)(1)铁与空气中的氧气和水蒸气共同作用(1分) (2)1.5(1分)
(3)解:设20 g生铁样品中含铁的质量为x
Fe+H2SO4=== FeSO4+H2↑(1分)
56 2
x 0.7 g(1分)
= (1分) x=19.6 g(1分)
则生铁样品中碳单质的质量分数为×100%=2%(1分)
答:该生铁样品中碳单质的质量分数为2%。(设、答全对得1分)
(4)向一定量生铁样品中滴加稀硫酸,直至没有气泡产生,过滤、洗涤、干燥、称量剩余固体的质量(合理即可)(2分)
(考试范围:第一到第九单元2022.2.17)
本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 P-31 Cl-35.5 K-39 Fe-56 Ag-108
一、单项选择题(本大题包括10小题,前5题每题1分,后5题每小题2分,共15分。)
序号 1 2 3 4 5 6 7 8 9 10
答案
1.第24届冬季奥运会将于2022年在北京举办,为落实“绿色冬奥”的理念,冬奥会使用的汽车燃料从环保的角度考虑,最理想的是( ) A.氢气B.天然气C.酒精 D.汽油
2.燃烧与人类的生活以及社会的发展有着密切的联系。下列有关燃烧和灭火的说法错误的是( )A. 釜底抽薪——移除可燃物 B. 电器着火——用水浇灭
C. 钻木取火——使温度达到可燃物的着火点以上
D. 架空篝火——使木材与空气有足够大的接触面积
3.下列选项中,对相应实验的描述正确的是( )
A.甲烷燃烧生成二氧化碳和水 B.铁能在氧气中燃烧
C.红磷的着火点比白磷的低 D.用于除去二氧化碳中的水蒸气
4.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测定反应前后各物质的质量如下表,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 25 15 1 5
反应后的质量/g 11 X 1 22
A、X 值为 3g B、乙全部发生了反应
C、丙一定是催化剂 D、 甲与乙反应的质量比为 14:3
选项 X Y Z
A 纯净物 氧化物 氯酸钾
B 可再生能源 化石燃料 天然气
C 空气 稀有气体 Ne
D 灭火原理 隔绝氧气 高压水枪灭火
5. 分类是研究物质的常用方法,X、Y、Z之间的形象关系如图所示 ,则下列选项符合该关系的是( )
6.现有某铁样品5.6 g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示,
则下列结论正确的个数是( )
①恰好完全反应时,一定没有固体剩余 ②x的值为0.2
③铁样品中可能含有镁 ④M点对应的溶液中含有2种或3种溶质
1个 B. 2个 C.3个 D.4个
7.60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图1。结合图2,下列说法正确的是( )
图1 图2
A. 加入的KNO3质量为41.6 g B. 降温过程中KNO3溶液始终为饱和溶液
C. 蒸发溶剂可将M点的溶液转化到N点
D. 20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
8.下列实验设计不合理的是( )
A. 探究CO2的密度大于空气 B. 探究铁、镁金属活动性强弱
C. 探究不同溶质在同种溶剂中的溶解性 D. 探究MnO2可催化H2O2溶液
9.下列实验方案设计合理的是( )
选项 实验目的 实验方案
A 检验空气中是否含有氧气 将带火星的木条伸入集气瓶中
B 除去硝酸铜溶液中的少量硝酸银 取样,加入适量的镁
C 鉴别硬水和软水 取样,加入肥皂水振荡
D 分离CaCO3和CaO 加水溶解、过滤
A.A B.B C.C D.D
10. 下列图像与对应的叙述相符合的是( )
A. 化学反应中,原子总数随时间的变化 B. 将浓盐酸露置在空气中一段时间
C. 加热一定质量的氯酸钾和二氧化锰的混合物
D. 向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
二、选择填空题(本大题共 3 小题,共 6分)
11.根据物质的性质与用途,下列对应关系正确的是( )
A.石墨硬度小—一作润滑剂 B.氦气化学性质不活泼——作霓虹灯
C.活性炭具有吸附性一一冰箱除异味 D.一氧化碳具有可燃性一一
12.氮化镓是生产5G芯片的关键材料之一。氮的原子结构示意图和镓在元素周期表中的信息如图所示,下列说法正确的是( )
A. 镓是金属元素 B. 氮原子的核内质子数为5
C. 镓元素的相对原子质量是69.72 g
D. 氮化镓中氮元素的化合价为_ __
13.用如图装置验证二氧化碳的性质。打开K,一段时间后,观察到纸花变红且短蜡烛熄灭,关闭K,片刻后长蜡烛熄灭。由该实验得出的结论正确的是( )
A. 二氧化碳的密度比空气小 B. 二氧化碳能与水发生反应
C. 二氧化碳气体显酸性 D.
三、填空题(共 23 分)
14. (6分)弘扬传统文化,建设大美江西。
(1)红色文化:瑞金陈列馆展出苏区时期造币厂使用的冲锤,冲锤用铁铸成,请提出防止铁生锈的一种方法______________________;游红井景区、饮红井水,检验红井水是否为硬水所用的物质是__________________。
(2)山水文化:庐山云雾茶飘香四溢,其微观解释是______________________;鄱阳湖特产银鱼中富含的营养素是______________。
(3)江右文化:青砖灰瓦是赣派建筑的一大亮点,而徽派建筑的主要特点是白墙青瓦。白墙是指在墙壁上粉刷一层石灰浆,从而能让墙壁变的“又白又硬”,原因是_________________ ________________________ (用化学方程式表示)。
15. (4分)如图是2021年央视春晚《国宝回家》节目展示的四件回归文物。
(1)龙山石窟的岩石中含有二氧化硅(SiO2),二氧化硅中硅元素的化合价为______。
(2)用墨绘制的《五牛图》从古代保存至今仍不变色,是因为碳的化学性质________。
(3)金可加工成秦公鸷鸟形金饰片主要利用了金的________性。
(4)圆明园青铜虎蓥的主要成分是青铜,我国古代“火法炼铜”中用辉铜矿(主要成分为Cu2S)炼铜的反应原理之一是:其中X的化学式为________。
16.(6分)某同学设计的工业制备氢氧化钠的流程如图
资料:,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)工业生产中应选择途径______(“①”或“②”),理由是_________________________.
(2)Cl2可用于生产84消毒液(有效成分 NaClO),反应原理为:Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有______种。
(3)图2实验测定水组成,不能加入NaCl增强水的导电性的理由是___________________。电解水的化学方程式为________________________________。
图2
17. (7分)杜鹃花为江西省的省花。如图所示的杜鹃花中花瓣A~E均为初中化学常见的5种物质,它们之间的转化关系如图所示(“―→”表示转化关
系,所涉及反应均为初中常见的化学反应),A、D常温下均为黑色固体,C是一种有毒气体,E是紫红色固体。请回答下列问题:
(1)C的化学式是________;
(2)B的一种用途是____________________;
(3)D的物质类别是____________(填“单质”“氧化物”“酸”“碱”或“盐”)。
(4)B―→C反应的化学方程式为____________________________;
E―→A反应的化学方程式为____________________________
四、探究题(本大题共2 小题,共16分)
19. (8分)根据下列装置图,回答有关问题:
(1)图中标号仪器的名称:①________。
(2)利用上图中、装置的组合可以制取某种气体,实验室制取该气体的化学方程式是________________________________,看到有____________________现象发生时,说明气体已经集满集气瓶。
(3)实验室通常利用上图中装置与________的组合制取二氧化碳(选填字母),该反应的化学方程式为________________________________。若用装置代替装置进行实验,优点为________________________________。
(4)为了得到纯净、干燥的二氧化碳气体,除杂装置(如下图)的导管按气流方向连接顺序是________。(选填字母)。
. .
. .
20.(8分)在学习了单质碳的化学性质后,某化学兴趣小组的同学对含碳化合物燃烧后的产物进行了探究。
【提出问题】乙醇燃烧后的产物是什么?
【查阅资料】①无水硫酸铜为白色粉末,遇水会变蓝;②氯化钙有吸水性,可做干燥剂。
【做出猜想】猜想一:产物中含有CO、H2O;猜想二:产物中含有CO2、H2O;
猜想三:产物中含有(1)_______________________________。
【进行实验】同学们设计了如图的实验:检查装置气密性后,将乙醇燃烧的产物依次通过如图所示的装置进行验证;(部分夹持固定装置省略;B、D、G装置中均为澄清的石灰水)
(2)装置B的作用是_______________________________。
(3)F装置中若发生反应,则化学方程式是_______________________________。
【解释与结论】经过实验,同学们认为猜想三成立。
(4)实验中能观察到的现象是①_______________________________;装置C中发生反应的化学方程式为②_______________________________。
【反思与评价】实验结束后,由于小丽同学的操作不当造成了仪器损坏,小组内同学针对这个事故,进行了分析和讨论。
(1)为了避免此事故再次发生,同学们对该装置进行了创新和改进,你认为他们的改进是 _________________(文字说明或画图都可)。
五、计算题(本大题共 1 小题,共10分)
20. (10分)钢铁的生产和使用是人类文明和社会进步的一个重要标志。为测定某钢铁厂生铁样品中的含碳量,小科取样品进行实验:向四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加入200 g溶质质量分数相同的稀硫酸,充分反应后,测得的实验数据如表
实验序号 1 2 3 4
生铁样品的质量/g 20 40 60 80
生成气体的总质量/g 0.7 1.4 1.5 m
(1)每年钢铁锈蚀都会造成巨大的经济损失,铁制品锈蚀的主要原因是________。
(2)表格中m值为________。
(3)计算该生铁样品中碳单质的质量分数。(写出计算过程)
(4)请设计其他方案测定生铁样品中的含碳量_____________________________(简要说明操作步骤)。
参考答案
序号 1 2 3 4 5 6 7 8 9 10
答案 A B B D C A A B C A
11、 C 作燃料
12、A -3
13、B 二氧化碳不支持燃烧
14. (6分)(1)涂油(合理即可)(1分) 肥皂水(1分) (2)分子在不断地运动(1分) 蛋白质(1分)
(3)CO2+Ca(OH)2 === CaCO3↓+H2O(2分)
15. (4分)(1)+4(1分) (2)常温下不活泼(或常温下稳定)(1分) (3)延展(1分) (4)O2
16、 3:7 CO2+3H2→CH3OH+H2O H2O
17 ① 步骤简单 3 加氯化钠会生成氯气,干扰实验结果 2H2O2H2↑+O2↑
18. (7分)(1)CO (2)作气体肥料(或灭火等合理即可)
(3)单质 (4)CO2+C===CO 2Cu+O22CuO
19.
【答案】
(1)酒精灯
(2) ,气泡冒出
(3), ,随时控制反应的发生和停止(或随开随用、随关随停)
(4),
20. (10分)(1)铁与空气中的氧气和水蒸气共同作用(1分) (2)1.5(1分)
(3)解:设20 g生铁样品中含铁的质量为x
Fe+H2SO4=== FeSO4+H2↑(1分)
56 2
x 0.7 g(1分)
= (1分) x=19.6 g(1分)
则生铁样品中碳单质的质量分数为×100%=2%(1分)
答:该生铁样品中碳单质的质量分数为2%。(设、答全对得1分)
(4)向一定量生铁样品中滴加稀硫酸,直至没有气泡产生,过滤、洗涤、干燥、称量剩余固体的质量(合理即可)(2分)
同课章节目录
