安徽省宣城市第六中学2021-2022学年下学期九年级开学考试化学试题(Word版含答案)
文档属性
| 名称 | 安徽省宣城市第六中学2021-2022学年下学期九年级开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 14:56:20 | ||
图片预览

文档简介
2021—2022学年度第二学期九年级开学考试
化 学 试 题
注意事项:
1.化学试卷共两大题17小题,满分40分。化学与物理的考试时间共120分钟。
2.请务必在“答题卷”上答题,在“试题卷”上答题无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Na-23 Zn-65 S-32 Ni -59
一、选择题(每小题只有一个合理答案,共12分)
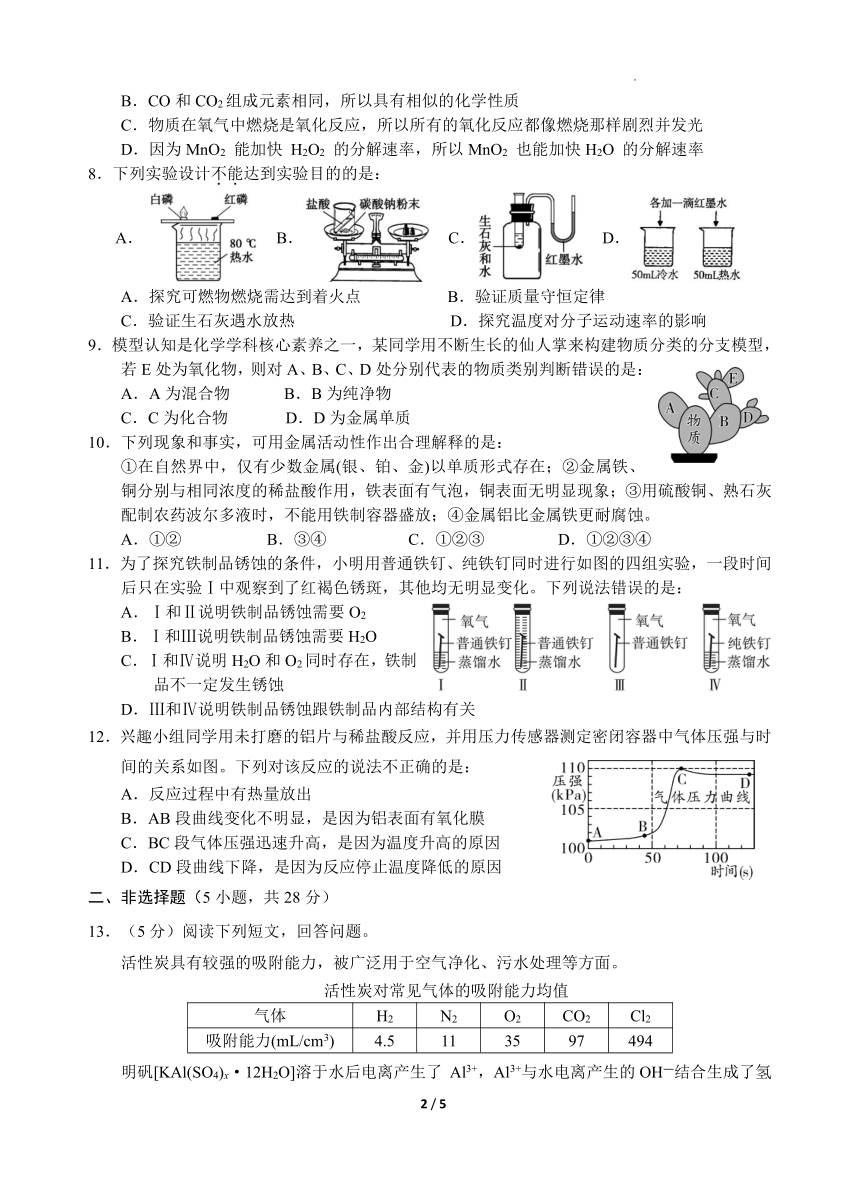
1. 下列生产、生活中的变化,属于化学变化的是:
A.冰雪融化 B.水的净化 C.燃料燃烧 D.风力发电
2.2020年6月,我国北斗三号全球卫星导航系统星座部署完美收官。该导航系统应用了星载氢原子钟和铷原子钟。铷在元素周期表中的信息如右图所示,下列有关铷的说法错误的是:
A.属于金属元素 B.元素符号是Rb
C.相对原子质量为85.47 D.中子数为37
3.下列实验操作中,有错误的一项是:
A. 取用液体 B. 过滤 C.氧气验满 D.装置气密性良好
4. 抗击新冠肺炎疫情过程中,84消毒液起了重要的作用,它的主要成分是次氯酸钠(NaClO)。下列关于次氯酸钠的说法正确的是:
A.次氯酸钠是一种氧化物 B.次氯酸钠中钠、氯、氧元素质量之比为1∶1∶1
C.次氯酸钠中氯元素为―1价 D.次氯酸钠中氧元素质量分数最小
5.二氧化碳能转化为甲醇(CH3OH),其反应的微观示意图如下。下列说法不正确的是:
A.反应后,氢原子数目增加 B.催化剂可以改变化学反应速率
C.丁中含有 3 种元素 D.此反应为缓解温室效应提供了新途径
参加反应的甲、乙的分子个数比为 1:1丙的化学式为 H2O
6.“超临界水”因具有优良特性而被科学家追捧,它是指当温度和压强达到一定值时,水的液态和气态完全交融在一起的流体。下列有关“超临界水”的说法正确的是:
A. 分子不再运动 B. 分子之间没有间隔
C. 氢、氧两种原子的个数比为2∶1 D. 化学性质与普通水不同
7.推理是一种重要的化学思维方法,以下推理合理的是:
A.因为蜡烛燃烧生成 CO2和H2O,所以蜡烛组成里一定含有碳元素和氢元素
B.CO和CO2组成元素相同,所以具有相似的化学性质
C.物质在氧气中燃烧是氧化反应,所以所有的氧化反应都像燃烧那样剧烈并发光
D.因为MnO2 能加快 H2O2 的分解速率,所以MnO2 也能加快H2O 的分解速率
8.下列实验设计不能达到实验目的的是:
A. B. C. D.
A.探究可燃物燃烧需达到着火点 B.验证质量守恒定律
C.验证生石灰遇水放热 D.探究温度对分子运动速率的影响
9.模型认知是化学学科核心素养之一,某同学用不断生长的仙人掌来构建物质分类的分支模型,若E处为氧化物,则对A、B、C、D处分别代表的物质类别判断错误的是:
A.A为混合物 B.B为纯净物
C.C为化合物 D.D为金属单质
10.下列现象和事实,可用金属活动性作出合理解释的是:
①在自然界中,仅有少数金属(银、铂、金)以单质形式存在;②金属铁、铜分别与相同浓度的稀盐酸作用,铁表面有气泡,铜表面无明显现象;③用硫酸铜、熟石灰配制农药波尔多液时,不能用铁制容器盛放;④金属铝比金属铁更耐腐蚀。
A.①② B.③④ C.①②③ D.①②③④
11.为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行如图的四组实验,一段时间后只在实验Ⅰ中观察到了红褐色锈斑,其他均无明显变化。下列说法错误的是:
A.Ⅰ和Ⅱ说明铁制品锈蚀需要O2
B.Ⅰ和Ⅲ说明铁制品锈蚀需要H2O
C.Ⅰ和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀
D.Ⅲ和Ⅳ说明铁制品锈蚀跟铁制品内部结构有关
12.兴趣小组同学用未打磨的铝片与稀盐酸反应,并用压力传感器测定密闭容器中气体压强与时间的关系如图。下列对该反应的说法不正确的是:
A.反应过程中有热量放出
B.AB段曲线变化不明显,是因为铝表面有氧化膜
C.BC段气体压强迅速升高,是因为温度升高的原因
D.CD段曲线下降,是因为反应停止温度降低的原因
二、非选择题(5小题,共28分)
13.(5分)阅读下列短文,回答问题。
活性炭具有较强的吸附能力,被广泛用于空气净化、污水处理等方面。
活性炭对常见气体的吸附能力均值
气体 H2 N2 O2 CO2 Cl2
吸附能力(mL/cm3) 4.5 11 35 97 494
明矾[KAl(SO4)x·12H2O]溶于水后电离产生了 Al3+,Al3+与水电离产生的OH―结合生成了氢氧化铝,氢氧化铝胶体粒子带有正电荷,与带负电的泥沙胶粒相遇,彼此电荷被中和。失去了电荷的胶粒,很快就会聚结在一起,粒子越结越大,终于沉入水底,水就变得清澈干净了。
(1)活性炭因为_______________的结构而具有吸附性,可用于水的净化。上表中,活性炭对__________的吸附能力最强。
(2)明矾 [KAl(SO4)x·12H2O] 中x=________,写出氢氧化铝的化学式____________。
(3)净化水时加入明矾的目的是________________________________________。
14.(6分)某工厂从含有CuSO4的废液中回收金属铜,并得到工业原料FeSO4,工业流程如图。
(1)操作Ⅰ的名称是_____________,该操作需要的金属仪器是_______________。
(2)加入过量A物质是___________。
(3)加入适量B物质时反应的化学方程式是___________________________________,该反应的基本类型是_________________。
15.(6分)下列装置常用于实验室制取气体。请根据给出的装置回答下列问题。
(1)写出仪器①的名称:________________。
(2)实验室用A装置加热氯酸钾制取氧气,常能够闻到一股刺鼻的气味,产生刺鼻气味的气体可能是 ___________。(填字母代号)
A.氧气 B.氨气 C.氯化氢 D.氯气
(3)实验室用B作为制取CO2的发生装置,其突出优点是_______________________________,反应的化学方程式为__________________________________________。一般不用C装置收集二氧化碳的原因是________________________。
16.(6分)某古玩市场展示一款黄金饰物,化学兴趣小组为鉴别其真假进行了如下探究活动。
【查阅资料】①铜锌合金外观和黄金相似,常被不法商贩以假乱真。
②标准状况下,氢气密度ρ≈0.09g/L。
【进行实验】同学们设计了如下不同的探究方案,请帮他们完成实验报告。
方案 实验步骤 实验现象
1 将小块黄金样品放在酒精灯上加热 ____________________
2 取小块黄金样品于试管中,加入一定量稀硫酸 有气泡产生
3 取小块黄金样品于另一支试管中,加入适量硫酸铜溶液 ____________________
【实验结论】该样品是假黄金。写出方案3中反应的化学方程式__________________________。
【深入探究】为进一步定量分析黄金饰物中金属锌的质量分数,小明同学利用上述方案2设计了如下实验:
Ⅰ.检查A装置气密性的方法是_____________________
______________________________________。
Ⅱ.向锥形瓶中加入5.0g黄金样品,注射器中吸入25mL稀硫酸,连接A、B、C装置,_______(填“a”或“b”)与c相连接。
(注意:答对以下小题,奖励3分,化学试卷总分不超过40分)
Ⅲ.将注射器中的稀硫酸平均分5次推入锥形瓶中,每次推入稀硫酸待不再产生气泡后,记录收集标准状况下气体的总体积(忽略其他因素对测量结果造成的影响),数据如下表。
次数 第1次 第2次 第3次 第4次 第5次
收集气体的总体积/mL 200 400 515 x 525
上表中的数据x=___________。 分析数据,完全反应后生成氢气的总体积=___________mL。 试计算此黄金饰物中锌的质量分数=___________。
17.(5分)白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活动性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
(1)合金中镍的质量为____________。
(2)求稀硫酸中硫酸的质量分数(写出计算过程)
(提示:Ni+ H2SO4= NiSO4+H2↑)
化学参考答案
一、选择题(每小题只有一个合理答案,共12分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 C D B D A C A B D C D C
二、非选择题(5小题,共28分)
13.(1)疏松多孔 Cl2 (2)2 Al(OH)3
(3)产生氢氧化铝胶体,吸附悬浮杂质,加快沉降
14.(1)过滤 铁架台 (2)铁(或Fe)
(3)H2SO4+Fe == FeSO4 +H2↑ 置换反应
15.(1)长颈漏斗 (2)D
(3)可控制反应的发生和停止 CaCO3 + 2HCl == CaCl2 + H2O+ CO2↑ CO2能溶于水
16.【进行实验】黄金样品表面变黑 有红色固体生成,溶液由蓝色变为无色
【实验结论】Zn+Cu SO4 == Cu +ZnSO4
【深入探究】Ⅰ. 用弹簧夹夹紧导管口,用手紧捂锥形瓶,若注射器活塞上移,说明装置气密性良好。(用弹簧夹夹紧导管口,轻压注射器活塞,松手,若注射器活塞回到原位,说明装置气密性良好。)
Ⅱ. a Ⅲ. 520 500 29.25%
17.(1)20g―17.05g=2.95g (1分)
(2)设H2SO4质量为x
Ni + H2SO4 = NiSO4 + H2↑
59 98
2.95g x
,解得x=4.9g, H2SO4质量分数为=9.8%。
答:H2SO4质量分数为9.8%。 2 / 2
化 学 试 题
注意事项:
1.化学试卷共两大题17小题,满分40分。化学与物理的考试时间共120分钟。
2.请务必在“答题卷”上答题,在“试题卷”上答题无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Na-23 Zn-65 S-32 Ni -59
一、选择题(每小题只有一个合理答案,共12分)
1. 下列生产、生活中的变化,属于化学变化的是:
A.冰雪融化 B.水的净化 C.燃料燃烧 D.风力发电
2.2020年6月,我国北斗三号全球卫星导航系统星座部署完美收官。该导航系统应用了星载氢原子钟和铷原子钟。铷在元素周期表中的信息如右图所示,下列有关铷的说法错误的是:
A.属于金属元素 B.元素符号是Rb
C.相对原子质量为85.47 D.中子数为37
3.下列实验操作中,有错误的一项是:
A. 取用液体 B. 过滤 C.氧气验满 D.装置气密性良好
4. 抗击新冠肺炎疫情过程中,84消毒液起了重要的作用,它的主要成分是次氯酸钠(NaClO)。下列关于次氯酸钠的说法正确的是:
A.次氯酸钠是一种氧化物 B.次氯酸钠中钠、氯、氧元素质量之比为1∶1∶1
C.次氯酸钠中氯元素为―1价 D.次氯酸钠中氧元素质量分数最小
5.二氧化碳能转化为甲醇(CH3OH),其反应的微观示意图如下。下列说法不正确的是:
A.反应后,氢原子数目增加 B.催化剂可以改变化学反应速率
C.丁中含有 3 种元素 D.此反应为缓解温室效应提供了新途径
参加反应的甲、乙的分子个数比为 1:1丙的化学式为 H2O
6.“超临界水”因具有优良特性而被科学家追捧,它是指当温度和压强达到一定值时,水的液态和气态完全交融在一起的流体。下列有关“超临界水”的说法正确的是:
A. 分子不再运动 B. 分子之间没有间隔
C. 氢、氧两种原子的个数比为2∶1 D. 化学性质与普通水不同
7.推理是一种重要的化学思维方法,以下推理合理的是:
A.因为蜡烛燃烧生成 CO2和H2O,所以蜡烛组成里一定含有碳元素和氢元素
B.CO和CO2组成元素相同,所以具有相似的化学性质
C.物质在氧气中燃烧是氧化反应,所以所有的氧化反应都像燃烧那样剧烈并发光
D.因为MnO2 能加快 H2O2 的分解速率,所以MnO2 也能加快H2O 的分解速率
8.下列实验设计不能达到实验目的的是:
A. B. C. D.
A.探究可燃物燃烧需达到着火点 B.验证质量守恒定律
C.验证生石灰遇水放热 D.探究温度对分子运动速率的影响
9.模型认知是化学学科核心素养之一,某同学用不断生长的仙人掌来构建物质分类的分支模型,若E处为氧化物,则对A、B、C、D处分别代表的物质类别判断错误的是:
A.A为混合物 B.B为纯净物
C.C为化合物 D.D为金属单质
10.下列现象和事实,可用金属活动性作出合理解释的是:
①在自然界中,仅有少数金属(银、铂、金)以单质形式存在;②金属铁、铜分别与相同浓度的稀盐酸作用,铁表面有气泡,铜表面无明显现象;③用硫酸铜、熟石灰配制农药波尔多液时,不能用铁制容器盛放;④金属铝比金属铁更耐腐蚀。
A.①② B.③④ C.①②③ D.①②③④
11.为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行如图的四组实验,一段时间后只在实验Ⅰ中观察到了红褐色锈斑,其他均无明显变化。下列说法错误的是:
A.Ⅰ和Ⅱ说明铁制品锈蚀需要O2
B.Ⅰ和Ⅲ说明铁制品锈蚀需要H2O
C.Ⅰ和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀
D.Ⅲ和Ⅳ说明铁制品锈蚀跟铁制品内部结构有关
12.兴趣小组同学用未打磨的铝片与稀盐酸反应,并用压力传感器测定密闭容器中气体压强与时间的关系如图。下列对该反应的说法不正确的是:
A.反应过程中有热量放出
B.AB段曲线变化不明显,是因为铝表面有氧化膜
C.BC段气体压强迅速升高,是因为温度升高的原因
D.CD段曲线下降,是因为反应停止温度降低的原因
二、非选择题(5小题,共28分)
13.(5分)阅读下列短文,回答问题。
活性炭具有较强的吸附能力,被广泛用于空气净化、污水处理等方面。
活性炭对常见气体的吸附能力均值
气体 H2 N2 O2 CO2 Cl2
吸附能力(mL/cm3) 4.5 11 35 97 494
明矾[KAl(SO4)x·12H2O]溶于水后电离产生了 Al3+,Al3+与水电离产生的OH―结合生成了氢氧化铝,氢氧化铝胶体粒子带有正电荷,与带负电的泥沙胶粒相遇,彼此电荷被中和。失去了电荷的胶粒,很快就会聚结在一起,粒子越结越大,终于沉入水底,水就变得清澈干净了。
(1)活性炭因为_______________的结构而具有吸附性,可用于水的净化。上表中,活性炭对__________的吸附能力最强。
(2)明矾 [KAl(SO4)x·12H2O] 中x=________,写出氢氧化铝的化学式____________。
(3)净化水时加入明矾的目的是________________________________________。
14.(6分)某工厂从含有CuSO4的废液中回收金属铜,并得到工业原料FeSO4,工业流程如图。
(1)操作Ⅰ的名称是_____________,该操作需要的金属仪器是_______________。
(2)加入过量A物质是___________。
(3)加入适量B物质时反应的化学方程式是___________________________________,该反应的基本类型是_________________。
15.(6分)下列装置常用于实验室制取气体。请根据给出的装置回答下列问题。
(1)写出仪器①的名称:________________。
(2)实验室用A装置加热氯酸钾制取氧气,常能够闻到一股刺鼻的气味,产生刺鼻气味的气体可能是 ___________。(填字母代号)
A.氧气 B.氨气 C.氯化氢 D.氯气
(3)实验室用B作为制取CO2的发生装置,其突出优点是_______________________________,反应的化学方程式为__________________________________________。一般不用C装置收集二氧化碳的原因是________________________。
16.(6分)某古玩市场展示一款黄金饰物,化学兴趣小组为鉴别其真假进行了如下探究活动。
【查阅资料】①铜锌合金外观和黄金相似,常被不法商贩以假乱真。
②标准状况下,氢气密度ρ≈0.09g/L。
【进行实验】同学们设计了如下不同的探究方案,请帮他们完成实验报告。
方案 实验步骤 实验现象
1 将小块黄金样品放在酒精灯上加热 ____________________
2 取小块黄金样品于试管中,加入一定量稀硫酸 有气泡产生
3 取小块黄金样品于另一支试管中,加入适量硫酸铜溶液 ____________________
【实验结论】该样品是假黄金。写出方案3中反应的化学方程式__________________________。
【深入探究】为进一步定量分析黄金饰物中金属锌的质量分数,小明同学利用上述方案2设计了如下实验:
Ⅰ.检查A装置气密性的方法是_____________________
______________________________________。
Ⅱ.向锥形瓶中加入5.0g黄金样品,注射器中吸入25mL稀硫酸,连接A、B、C装置,_______(填“a”或“b”)与c相连接。
(注意:答对以下小题,奖励3分,化学试卷总分不超过40分)
Ⅲ.将注射器中的稀硫酸平均分5次推入锥形瓶中,每次推入稀硫酸待不再产生气泡后,记录收集标准状况下气体的总体积(忽略其他因素对测量结果造成的影响),数据如下表。
次数 第1次 第2次 第3次 第4次 第5次
收集气体的总体积/mL 200 400 515 x 525
上表中的数据x=___________。 分析数据,完全反应后生成氢气的总体积=___________mL。 试计算此黄金饰物中锌的质量分数=___________。
17.(5分)白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活动性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
(1)合金中镍的质量为____________。
(2)求稀硫酸中硫酸的质量分数(写出计算过程)
(提示:Ni+ H2SO4= NiSO4+H2↑)
化学参考答案
一、选择题(每小题只有一个合理答案,共12分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 C D B D A C A B D C D C
二、非选择题(5小题,共28分)
13.(1)疏松多孔 Cl2 (2)2 Al(OH)3
(3)产生氢氧化铝胶体,吸附悬浮杂质,加快沉降
14.(1)过滤 铁架台 (2)铁(或Fe)
(3)H2SO4+Fe == FeSO4 +H2↑ 置换反应
15.(1)长颈漏斗 (2)D
(3)可控制反应的发生和停止 CaCO3 + 2HCl == CaCl2 + H2O+ CO2↑ CO2能溶于水
16.【进行实验】黄金样品表面变黑 有红色固体生成,溶液由蓝色变为无色
【实验结论】Zn+Cu SO4 == Cu +ZnSO4
【深入探究】Ⅰ. 用弹簧夹夹紧导管口,用手紧捂锥形瓶,若注射器活塞上移,说明装置气密性良好。(用弹簧夹夹紧导管口,轻压注射器活塞,松手,若注射器活塞回到原位,说明装置气密性良好。)
Ⅱ. a Ⅲ. 520 500 29.25%
17.(1)20g―17.05g=2.95g (1分)
(2)设H2SO4质量为x
Ni + H2SO4 = NiSO4 + H2↑
59 98
2.95g x
,解得x=4.9g, H2SO4质量分数为=9.8%。
答:H2SO4质量分数为9.8%。 2 / 2
同课章节目录
