广东省珠海市2021-2022学年高三上学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 广东省珠海市2021-2022学年高三上学期期末考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 21:49:33 | ||
图片预览



文档简介
绝密★启用前
珠海市2021~2022学年度第一学期期末普通高中学生学业质量监测
高三化学
可能用到的相对原子质量:
第Ⅰ卷 选择题(共44分)
一、选择题:(本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求。)
1.2021年10月16日,“神舟十三号”顺利将翟志刚、王亚平、叶志富送到中国空间站,这是中国航天事业的巨大成功。下列说法不正确的是( )。
A.“神舟十三号”使用的液氢燃料具有高效能、无污染的特点
B.空间站使用石墨烯存储器,所用材料石墨烯与金刚石互为同素异形体
C.飞船返回舱表面是耐高温陶瓷材料,属于传统无机非金属材料
D.空间站使用的钛镁合金属于金属材料
2.正确掌握化学用语是学好化学的基础。下列化学用语正确的是( )。
A.2-甲基戊烷的键线式:
B.的结构示意图:
C.乙烯的球棍模型:
D.氧化生成单质硫:
3.化学与生产生活及环境密切相关。下列说法正确的是( )。
A.过期药品和纸箱均应投入到可回收垃圾箱内
B.新冠变异病毒奥密克戎毒株中的蛋白质属于高分子化合物
c.屠呦呦团队用乙醚从黄花蒿中萃取青蒿素的过程,属于化学变化
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
4.中华优秀文化源远流长。下列说法不正确的是( )。
A.石溪公园亦兰亭“石溪曲水兰亭意,寂寂千年寂寂名”,曲水暗含美酒,酒是由淀粉水解而成
B.苏曼殊《柬法忍》“来醉茎深露,胭脂画牡丹”,牡丹花“香”是因为花中含有挥发性有机物
C.珠海菉猗堂蚝壳墙是富有地方特色的岭南建筑,蚝壳主要成分是
D.画家古元擅长水彩画,所用宣纸的主要成分是纤维素,属于糖类
5.司替戊醇是一种新型抗癫痫、抗惊厥药物,其结构简式如图所示,下列叙述不正确的是( )。
A.该有机物属于芳香烃
B.该有机物可发生取代反应、氧化反应和加聚反应
C.1mol该有机物最多与发生加成反应
D.该有机物可使溴水和酸性高锰酸钾溶液褪色
6.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受生活”。下列做法与此不相符合的是( )。
A.推广新能源电车,减少燃油车的使用
B.采取“静电除尘”、“燃煤固硫”等方法提高空气质量
C.燃烧煤比燃烧天然气更环保
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
7.设为阿伏加德罗常数的值,下列叙述正确的是( )。
A.中,含有电子的数目为
B.的溶液中,所含数目小于
C.标准状况下,中含有键的数目为
D.含有阴离子的数目为
8.宏观辨识与微观探析是化学学科核心素养之一。下列关于离子反应或离子共存的说法正确的是( )。
A.Cu与溶液:
B.与溶液反应:
C.常温下,的溶液:、、、能大量共存
D.常温下,由水电离出的:、、、能大量共存
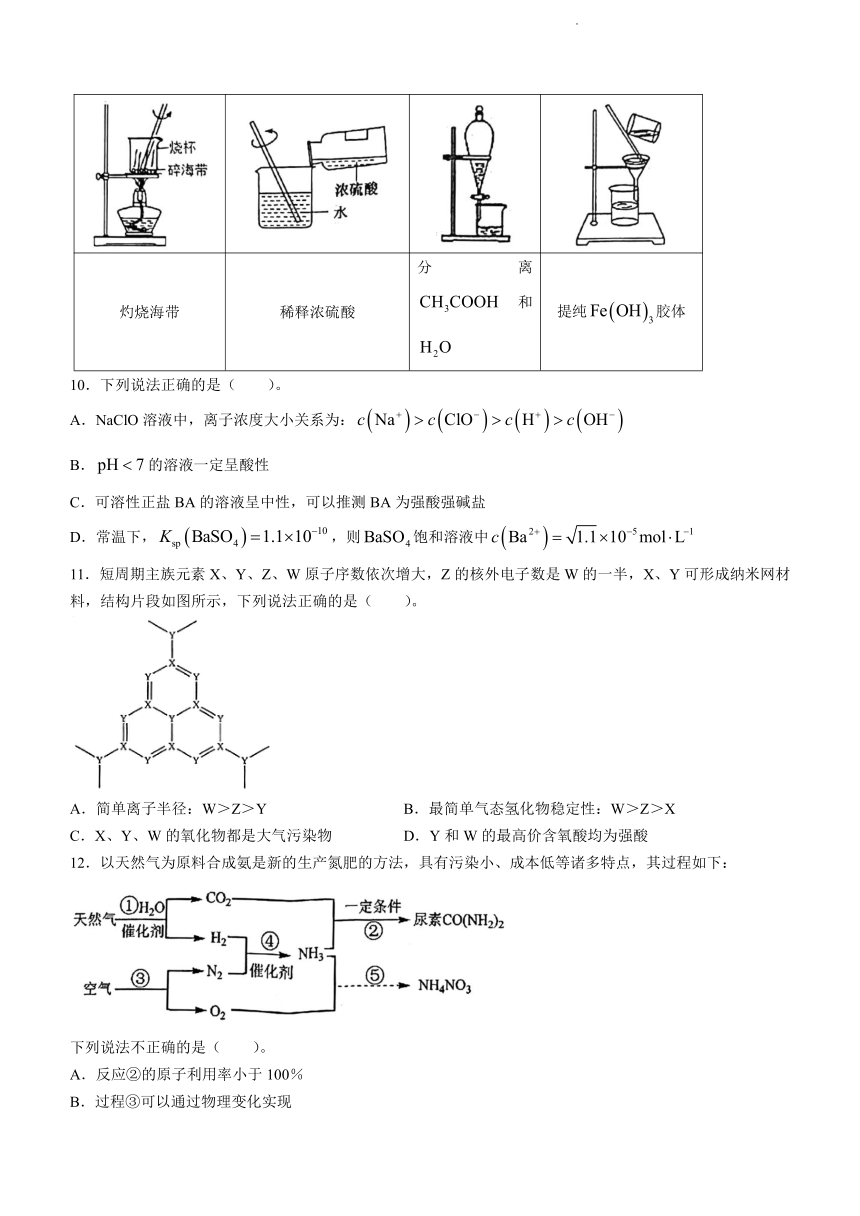
9.下列实验装置与操作都正确的是( )。
A B C D
灼烧海带 稀释浓硫酸 分离和 提纯胶体
10.下列说法正确的是( )。
A.NaClO溶液中,离子浓度大小关系为:
B.的溶液一定呈酸性
C.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐
D.常温下,,则饱和溶液中
11.短周期主族元素X、Y、Z、W原子序数依次增大,Z的核外电子数是W的一半,X、Y可形成纳米网材料,结构片段如图所示,下列说法正确的是( )。
A.简单离子半径:W>Z>Y B.最简单气态氢化物稳定性:W>Z>X
C.X、Y、W的氧化物都是大气污染物 D.Y和W的最高价含氧酸均为强酸
12.以天然气为原料合成氨是新的生产氮肥的方法,具有污染小、成本低等诸多特点,其过程如下:
下列说法不正确的是( )。
A.反应②的原子利用率小于100%
B.过程③可以通过物理变化实现
C.过程④采取高温条件的目的是为了提高平衡转化率
D.过程⑤理论上当时,恰好完全反应
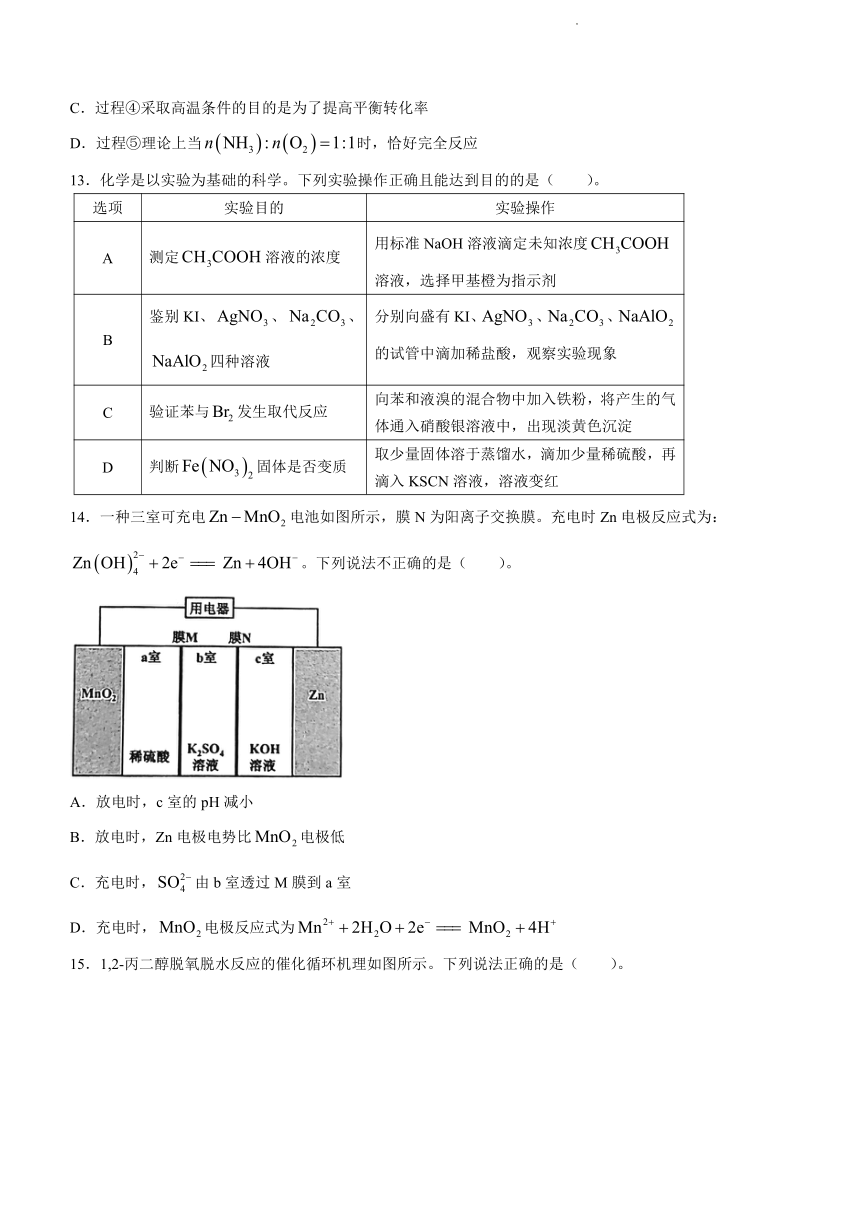
13.化学是以实验为基础的科学。下列实验操作正确且能达到目的的是( )。
选项 实验目的 实验操作
A 测定溶液的浓度 用标准NaOH溶液滴定未知浓度溶液,选择甲基橙为指示剂
B 鉴别KI、、、四种溶液 分别向盛有KI、、、的试管中滴加稀盐酸,观察实验现象
C 验证苯与发生取代反应 向苯和液溴的混合物中加入铁粉,将产生的气体通入硝酸银溶液中,出现淡黄色沉淀
D 判断固体是否变质 取少量固体溶于蒸馏水,滴加少量稀硫酸,再滴入KSCN溶液,溶液变红
14.一种三室可充电电池如图所示,膜N为阳离子交换膜。充电时Zn电极反应式为:。下列说法不正确的是( )。
A.放电时,c室的pH减小
B.放电时,Zn电极电势比电极低
C.充电时,由b室透过M膜到a室
D.充电时,电极反应式为
15.1,2-丙二醇脱氧脱水反应的催化循环机理如图所示。下列说法正确的是( )。
A.过程①②均有键断裂,过程③④均有键断裂
B.丙烯与HBr发生加成反应只得到一种产物
C.该过程中催化剂通过增大反应的活化能来提高化学反应速率
D.该过程的化学方程式为
16.利用酸碱中和滴定过程中溶液电导变化的转折来确定滴定终点的方法称为电导滴定。某同学用的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是( )。
A.A点:
B.B点溶液中:
C.C点溶液中:
D.水的电离程度:B>C>A
第Ⅱ卷 非选择题(共56分)
注意事项:本卷须用黑色签字笔在答题卡上书写作答,在试卷上作答,答案无效。
二、非选择题:包括必考题和选考题两部分。第17题~第19题为必考题,每个试题考生都必须作答。第20题~第21题为选考题,考生根据要求作答。
(一)必考题(共42分)
17.(14分)
碘酸钾是重要的分析试剂。某研究小组设计实验制备,并进行相关探究。
Ⅰ.制备
制备实验装置如下:
查阅资料:为白色固体,能溶于水,难溶于四氯化碳:溶于水,难溶于乙醇。
(1)橡胶管a的作用是______。
(2)装置B中的作用是______。
(3)装置B中制取的化学反应方程式为______。
Ⅱ.制备
(4)从B中分离出溶液,加入KOH溶液中和制得溶液,再加入适量______,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得晶体。
Ⅲ.实验探究
为探究溶液和溶液的反应,该小组设计了实验A:向足量的酸性溶液滴入数滴淀粉溶液,再加入溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(5)溶液变蓝,表明体现了______性。
(6)针对T秒前溶液未变蓝,小组做出如下猜想:
①猜想a:T秒前未生成,是由于反应的活化能______(填“大”或“小”),反应速率______(填“快”或“慢”)导致的。
②猜想b:T秒前生成了,但由于存在,迅速被消耗,反应为______(用离子方程式表示)。
(7)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入______,蓝色迅速消失,后再次变蓝。
18.(14分)
锗是重要的半导体材料,但Ge是地球上最分散的元素之一,被称为“稀散金属”。现利用云南临沧地区富锗的褐煤矿(锗质量分数约为0.01%~0.05%)提取高纯二氧化锗,其工艺流程如图所示:
已知含锗化合物的物理性质如下表:
物质 GeO
熔点/℃ 700(升华) 1116
沸点/℃ - 1200 86.5
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是______。
(2)对富锗褐煤矿进行“粉碎”的目的是______。
(3)高温焙烧过程中,可将转化为GeO,同时生成,试写出该转化过程的化学方程式______。高温焙烧过程中加入的目的是______。
(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为______。
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将转化为外,还能______,从而提高的产率。
(6)操作A的名称为______。
19.(14分)
近年来,碳中和、碳达峰成为热点。以二氧化碳为原料生产甲醇是一种有效利用二氧化碳的途径。
(1)已知:反应Ⅰ
反应Ⅱ
反应Ⅲ
若某反应的平衡常数表达式为,根据反应Ⅰ~Ⅲ,请写出此反应的热化学方程式______。
(2)在一定条件下(温度为℃),往恒容密闭容器中充入和,发生反应Ⅰ,初始压强为,5min达到平衡,压强为。
①的平衡转化率______。
②若该反应的速率方程,k为常数,p为平衡时气体分压,则该反应的速率v=______(用含k的式子表示,分压=总压×物质的量分数)。
(3)工业中,对于反应Ⅰ,通常同时存在副反应Ⅳ: 。在一定条件下,在合成塔中充入一定量和。不同压强时,的平衡转化率如图(a)所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图(b)所示。
①图(a)中,相同温度下,压强越大,的平衡转化率越大,其原因是______;
②由图(b)可知______0(填“>”或“<”或“=”);的物质的量分数随温度升高而增大的原因是______。
(4)研究HCHO燃料电池和氯碱工业联合应用装置如图所示,两极间用阳离子交换膜隔开,左右两侧分别是NaOH溶液和NaCl稀溶液。电极b为______极,a极的电极反应式为______。
(二)选考题(共14分)
以下两题为选做题,考试任选一题作答,并把答题卡对应的题号涂黑,如果不涂,则默认选做第20题。
20.(14分)[物质结构与性质]
近年来,新能源汽车不断得到推广,其所用能源锂电池。其中钴酸锂、磷酸铁锂等正极材料研究不断在发展。回答下列问题:
(1)基态钴原子价电子排布式为______。
(2)氯化铁蒸汽状态下以双聚分子的形式存在,其结构式为______,其中Fe的配位数为______。
(3)中心原子的价层电子对数为______、杂化轨道类型为______,的空间构型为______。
(4)与的键角比较:______,分析原因:______。
(5)以下表格中的氧化物的熔点缺乏数据:
氧化物 MgO
熔点/℃
请根据所学知识比较它们的熔点相对大小,并解释表中氧化物之间熔点差异的原因______。
(6)具有反萤石结构,晶胞如图所示。已知晶胞参数为466.5pm,阿伏加德罗常数为,则的密度为______(列出计算式)。
21.(14分)[有机化学基础]
化合物G是一种抗肿瘤新药的中间体,其合成路线如下:
已知:(1)
(2)
请回答下列问题:
(1)A中的含氧官能团名称为______和______。
(2)B的结构简式为______。
(3)C→D的反应方程式为______。
(4)E转化为F的过程称为黄鸣龙反应,该反应类型为______。
(5)化合物F的同系物J比F多一个碳原子,J有多种同分异构体,符合以下条件的有______种(不考虑立体异构)。
①苯环上仅有2个取代基
②能与氯化铁溶液发生显色反应
③能发生银镜反应
其中核磁共振氢谱有五组峰,且峰面积之比为6∶2∶2∶1∶1的结构简式为:______。
(6)已知羧酸和酚很难直接反应生成酯。结合题目信息,以甲苯和苯酚为有机原料,写出合成的路线(无机试剂任选)。
珠海市2021~2022学年度第一学期期末普通高中学生
学业质量监测高三化学参考答案及评分标准
一、选择题(1-10题,每题2分;11-16题,每题4分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C C B A A C A D B D
题号 11 12 13 14 15 16
答案 D C B D D B
二、非选择题(共56分)
(一)必考题(共42分)
17.(14分)
(1)平衡气压,使分液漏斗中浓盐酸能顺利滴下(2分)
(2)①和均易溶于,增大了反应物浓度,加快化学反应速率;
②能溶于水,难溶于,有利于从有机层转入水层,促使反应正向进行(2分,答对一点即可得分)
(3)(2分)
(4)乙醇(1分)
(5)还原(1分)
(6)①大(1分),慢(1分); ②(2分)
(7)少量(2分,没有答“少量”扣1分)
18.(14分)
(1)第四周期、第ⅣA族(2分)
(2)增大矿物表面积,提高焙烧效率(2分)
(3)。(2分,缺少“高温”扣1分)
将还原为GeO,使含锗物质更易挥发,减少焙烧过程的能耗(2分)
(4)(2分)
(5)增大溶液中,抑制水解(2分)
(6)蒸馏(2分)
19.(14分)
(1) (2分)
(2)①50%(2分) ②(2分)
(3)①增大压强,反应Ⅳ不移动,反应Ⅰ向正反应方向移动;(2分)
②>(1分)温度升高时,反应Ⅰ向左移动增加的的量大于反应Ⅳ向右移动减少的的量。(2分)
(4)正(1分) (2分)
(二)选考题(共14分)以下两题为选做题,考试任选一题作答。
20.(14分)
(1)(1分)
(2)(2分) 4(1分)
(3)正四面体形(1分) 4(1分) (1分)
(4)<(1分),含有一对孤对电子,而含有两对孤对电子,中的孤对电子对成键电子对的排斥作用较大。(1分)
(5)由于、MgO为离子晶体,、为分子晶体。离子晶体熔点比分子晶体要高。晶格能,分子间作用力(相对分子质量),所以熔点大小顺序是。(2分)
(6)(3分)
21.(14分)
(1)羧基、羟基(2分)
(2)(2分)
(3)(2分)
(4)还原反应(1分)
(5)15种(2分) (2分)
(6)
(3分,写对1步给1分,写对2步和3步都给2分,4步都对才给3分。)
珠海市2021~2022学年度第一学期期末普通高中学生学业质量监测
高三化学
可能用到的相对原子质量:
第Ⅰ卷 选择题(共44分)
一、选择题:(本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求。)
1.2021年10月16日,“神舟十三号”顺利将翟志刚、王亚平、叶志富送到中国空间站,这是中国航天事业的巨大成功。下列说法不正确的是( )。
A.“神舟十三号”使用的液氢燃料具有高效能、无污染的特点
B.空间站使用石墨烯存储器,所用材料石墨烯与金刚石互为同素异形体
C.飞船返回舱表面是耐高温陶瓷材料,属于传统无机非金属材料
D.空间站使用的钛镁合金属于金属材料
2.正确掌握化学用语是学好化学的基础。下列化学用语正确的是( )。
A.2-甲基戊烷的键线式:
B.的结构示意图:
C.乙烯的球棍模型:
D.氧化生成单质硫:
3.化学与生产生活及环境密切相关。下列说法正确的是( )。
A.过期药品和纸箱均应投入到可回收垃圾箱内
B.新冠变异病毒奥密克戎毒株中的蛋白质属于高分子化合物
c.屠呦呦团队用乙醚从黄花蒿中萃取青蒿素的过程,属于化学变化
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
4.中华优秀文化源远流长。下列说法不正确的是( )。
A.石溪公园亦兰亭“石溪曲水兰亭意,寂寂千年寂寂名”,曲水暗含美酒,酒是由淀粉水解而成
B.苏曼殊《柬法忍》“来醉茎深露,胭脂画牡丹”,牡丹花“香”是因为花中含有挥发性有机物
C.珠海菉猗堂蚝壳墙是富有地方特色的岭南建筑,蚝壳主要成分是
D.画家古元擅长水彩画,所用宣纸的主要成分是纤维素,属于糖类
5.司替戊醇是一种新型抗癫痫、抗惊厥药物,其结构简式如图所示,下列叙述不正确的是( )。
A.该有机物属于芳香烃
B.该有机物可发生取代反应、氧化反应和加聚反应
C.1mol该有机物最多与发生加成反应
D.该有机物可使溴水和酸性高锰酸钾溶液褪色
6.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受生活”。下列做法与此不相符合的是( )。
A.推广新能源电车,减少燃油车的使用
B.采取“静电除尘”、“燃煤固硫”等方法提高空气质量
C.燃烧煤比燃烧天然气更环保
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
7.设为阿伏加德罗常数的值,下列叙述正确的是( )。
A.中,含有电子的数目为
B.的溶液中,所含数目小于
C.标准状况下,中含有键的数目为
D.含有阴离子的数目为
8.宏观辨识与微观探析是化学学科核心素养之一。下列关于离子反应或离子共存的说法正确的是( )。
A.Cu与溶液:
B.与溶液反应:
C.常温下,的溶液:、、、能大量共存
D.常温下,由水电离出的:、、、能大量共存
9.下列实验装置与操作都正确的是( )。
A B C D
灼烧海带 稀释浓硫酸 分离和 提纯胶体
10.下列说法正确的是( )。
A.NaClO溶液中,离子浓度大小关系为:
B.的溶液一定呈酸性
C.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐
D.常温下,,则饱和溶液中
11.短周期主族元素X、Y、Z、W原子序数依次增大,Z的核外电子数是W的一半,X、Y可形成纳米网材料,结构片段如图所示,下列说法正确的是( )。
A.简单离子半径:W>Z>Y B.最简单气态氢化物稳定性:W>Z>X
C.X、Y、W的氧化物都是大气污染物 D.Y和W的最高价含氧酸均为强酸
12.以天然气为原料合成氨是新的生产氮肥的方法,具有污染小、成本低等诸多特点,其过程如下:
下列说法不正确的是( )。
A.反应②的原子利用率小于100%
B.过程③可以通过物理变化实现
C.过程④采取高温条件的目的是为了提高平衡转化率
D.过程⑤理论上当时,恰好完全反应
13.化学是以实验为基础的科学。下列实验操作正确且能达到目的的是( )。
选项 实验目的 实验操作
A 测定溶液的浓度 用标准NaOH溶液滴定未知浓度溶液,选择甲基橙为指示剂
B 鉴别KI、、、四种溶液 分别向盛有KI、、、的试管中滴加稀盐酸,观察实验现象
C 验证苯与发生取代反应 向苯和液溴的混合物中加入铁粉,将产生的气体通入硝酸银溶液中,出现淡黄色沉淀
D 判断固体是否变质 取少量固体溶于蒸馏水,滴加少量稀硫酸,再滴入KSCN溶液,溶液变红
14.一种三室可充电电池如图所示,膜N为阳离子交换膜。充电时Zn电极反应式为:。下列说法不正确的是( )。
A.放电时,c室的pH减小
B.放电时,Zn电极电势比电极低
C.充电时,由b室透过M膜到a室
D.充电时,电极反应式为
15.1,2-丙二醇脱氧脱水反应的催化循环机理如图所示。下列说法正确的是( )。
A.过程①②均有键断裂,过程③④均有键断裂
B.丙烯与HBr发生加成反应只得到一种产物
C.该过程中催化剂通过增大反应的活化能来提高化学反应速率
D.该过程的化学方程式为
16.利用酸碱中和滴定过程中溶液电导变化的转折来确定滴定终点的方法称为电导滴定。某同学用的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是( )。
A.A点:
B.B点溶液中:
C.C点溶液中:
D.水的电离程度:B>C>A
第Ⅱ卷 非选择题(共56分)
注意事项:本卷须用黑色签字笔在答题卡上书写作答,在试卷上作答,答案无效。
二、非选择题:包括必考题和选考题两部分。第17题~第19题为必考题,每个试题考生都必须作答。第20题~第21题为选考题,考生根据要求作答。
(一)必考题(共42分)
17.(14分)
碘酸钾是重要的分析试剂。某研究小组设计实验制备,并进行相关探究。
Ⅰ.制备
制备实验装置如下:
查阅资料:为白色固体,能溶于水,难溶于四氯化碳:溶于水,难溶于乙醇。
(1)橡胶管a的作用是______。
(2)装置B中的作用是______。
(3)装置B中制取的化学反应方程式为______。
Ⅱ.制备
(4)从B中分离出溶液,加入KOH溶液中和制得溶液,再加入适量______,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得晶体。
Ⅲ.实验探究
为探究溶液和溶液的反应,该小组设计了实验A:向足量的酸性溶液滴入数滴淀粉溶液,再加入溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(5)溶液变蓝,表明体现了______性。
(6)针对T秒前溶液未变蓝,小组做出如下猜想:
①猜想a:T秒前未生成,是由于反应的活化能______(填“大”或“小”),反应速率______(填“快”或“慢”)导致的。
②猜想b:T秒前生成了,但由于存在,迅速被消耗,反应为______(用离子方程式表示)。
(7)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入______,蓝色迅速消失,后再次变蓝。
18.(14分)
锗是重要的半导体材料,但Ge是地球上最分散的元素之一,被称为“稀散金属”。现利用云南临沧地区富锗的褐煤矿(锗质量分数约为0.01%~0.05%)提取高纯二氧化锗,其工艺流程如图所示:
已知含锗化合物的物理性质如下表:
物质 GeO
熔点/℃ 700(升华) 1116
沸点/℃ - 1200 86.5
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是______。
(2)对富锗褐煤矿进行“粉碎”的目的是______。
(3)高温焙烧过程中,可将转化为GeO,同时生成,试写出该转化过程的化学方程式______。高温焙烧过程中加入的目的是______。
(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为______。
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将转化为外,还能______,从而提高的产率。
(6)操作A的名称为______。
19.(14分)
近年来,碳中和、碳达峰成为热点。以二氧化碳为原料生产甲醇是一种有效利用二氧化碳的途径。
(1)已知:反应Ⅰ
反应Ⅱ
反应Ⅲ
若某反应的平衡常数表达式为,根据反应Ⅰ~Ⅲ,请写出此反应的热化学方程式______。
(2)在一定条件下(温度为℃),往恒容密闭容器中充入和,发生反应Ⅰ,初始压强为,5min达到平衡,压强为。
①的平衡转化率______。
②若该反应的速率方程,k为常数,p为平衡时气体分压,则该反应的速率v=______(用含k的式子表示,分压=总压×物质的量分数)。
(3)工业中,对于反应Ⅰ,通常同时存在副反应Ⅳ: 。在一定条件下,在合成塔中充入一定量和。不同压强时,的平衡转化率如图(a)所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图(b)所示。
①图(a)中,相同温度下,压强越大,的平衡转化率越大,其原因是______;
②由图(b)可知______0(填“>”或“<”或“=”);的物质的量分数随温度升高而增大的原因是______。
(4)研究HCHO燃料电池和氯碱工业联合应用装置如图所示,两极间用阳离子交换膜隔开,左右两侧分别是NaOH溶液和NaCl稀溶液。电极b为______极,a极的电极反应式为______。
(二)选考题(共14分)
以下两题为选做题,考试任选一题作答,并把答题卡对应的题号涂黑,如果不涂,则默认选做第20题。
20.(14分)[物质结构与性质]
近年来,新能源汽车不断得到推广,其所用能源锂电池。其中钴酸锂、磷酸铁锂等正极材料研究不断在发展。回答下列问题:
(1)基态钴原子价电子排布式为______。
(2)氯化铁蒸汽状态下以双聚分子的形式存在,其结构式为______,其中Fe的配位数为______。
(3)中心原子的价层电子对数为______、杂化轨道类型为______,的空间构型为______。
(4)与的键角比较:______,分析原因:______。
(5)以下表格中的氧化物的熔点缺乏数据:
氧化物 MgO
熔点/℃
请根据所学知识比较它们的熔点相对大小,并解释表中氧化物之间熔点差异的原因______。
(6)具有反萤石结构,晶胞如图所示。已知晶胞参数为466.5pm,阿伏加德罗常数为,则的密度为______(列出计算式)。
21.(14分)[有机化学基础]
化合物G是一种抗肿瘤新药的中间体,其合成路线如下:
已知:(1)
(2)
请回答下列问题:
(1)A中的含氧官能团名称为______和______。
(2)B的结构简式为______。
(3)C→D的反应方程式为______。
(4)E转化为F的过程称为黄鸣龙反应,该反应类型为______。
(5)化合物F的同系物J比F多一个碳原子,J有多种同分异构体,符合以下条件的有______种(不考虑立体异构)。
①苯环上仅有2个取代基
②能与氯化铁溶液发生显色反应
③能发生银镜反应
其中核磁共振氢谱有五组峰,且峰面积之比为6∶2∶2∶1∶1的结构简式为:______。
(6)已知羧酸和酚很难直接反应生成酯。结合题目信息,以甲苯和苯酚为有机原料,写出合成的路线(无机试剂任选)。
珠海市2021~2022学年度第一学期期末普通高中学生
学业质量监测高三化学参考答案及评分标准
一、选择题(1-10题,每题2分;11-16题,每题4分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C C B A A C A D B D
题号 11 12 13 14 15 16
答案 D C B D D B
二、非选择题(共56分)
(一)必考题(共42分)
17.(14分)
(1)平衡气压,使分液漏斗中浓盐酸能顺利滴下(2分)
(2)①和均易溶于,增大了反应物浓度,加快化学反应速率;
②能溶于水,难溶于,有利于从有机层转入水层,促使反应正向进行(2分,答对一点即可得分)
(3)(2分)
(4)乙醇(1分)
(5)还原(1分)
(6)①大(1分),慢(1分); ②(2分)
(7)少量(2分,没有答“少量”扣1分)
18.(14分)
(1)第四周期、第ⅣA族(2分)
(2)增大矿物表面积,提高焙烧效率(2分)
(3)。(2分,缺少“高温”扣1分)
将还原为GeO,使含锗物质更易挥发,减少焙烧过程的能耗(2分)
(4)(2分)
(5)增大溶液中,抑制水解(2分)
(6)蒸馏(2分)
19.(14分)
(1) (2分)
(2)①50%(2分) ②(2分)
(3)①增大压强,反应Ⅳ不移动,反应Ⅰ向正反应方向移动;(2分)
②>(1分)温度升高时,反应Ⅰ向左移动增加的的量大于反应Ⅳ向右移动减少的的量。(2分)
(4)正(1分) (2分)
(二)选考题(共14分)以下两题为选做题,考试任选一题作答。
20.(14分)
(1)(1分)
(2)(2分) 4(1分)
(3)正四面体形(1分) 4(1分) (1分)
(4)<(1分),含有一对孤对电子,而含有两对孤对电子,中的孤对电子对成键电子对的排斥作用较大。(1分)
(5)由于、MgO为离子晶体,、为分子晶体。离子晶体熔点比分子晶体要高。晶格能,分子间作用力(相对分子质量),所以熔点大小顺序是。(2分)
(6)(3分)
21.(14分)
(1)羧基、羟基(2分)
(2)(2分)
(3)(2分)
(4)还原反应(1分)
(5)15种(2分) (2分)
(6)
(3分,写对1步给1分,写对2步和3步都给2分,4步都对才给3分。)
同课章节目录
