云南省玉溪三高2021-2022学年高三上学期期末考试理综化学试题(Word版含答案)
文档属性
| 名称 | 云南省玉溪三高2021-2022学年高三上学期期末考试理综化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 94.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-12 22:11:46 | ||
图片预览


文档简介
玉溪三高2021-2022学年高三上学期期末考试
理综化学
一、单选题(共7小题,每小题6.0分,共42分)
7.某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜。下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
A. 方案Ⅱ比方案Ⅰ操作简便
B. 等质量的锌,相同条件下在方案Ⅰ和方案Ⅱ中制得的铜的质量相同
C. 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少
D. 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜
8.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是(
A. 升高温度,溶液的pH增大
B. 室温时,此酸的电离平衡常数约为1×10-7
C. 该溶液的pH=4
D. 升高温度,电离平衡常数增大
9.有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
10.下列说法正确的是( )
A. 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2OHCO3-+OH-向正反应方向移动,则溶液pH增大
B. 室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
D. 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值
11.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
12.有关化学用语的表达正确的是( )
A. Na2O2电子式
B. 二氧化硅的分子式SiO2
C. 乙烯的结构简式CH2CH2
D. 硫原子的最外层电子排布式3s23p4
13.下列关于溶液和胶体的叙述,正确的是( )
A. 溶液是电中性的,胶体是带电的
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
二、非选择题
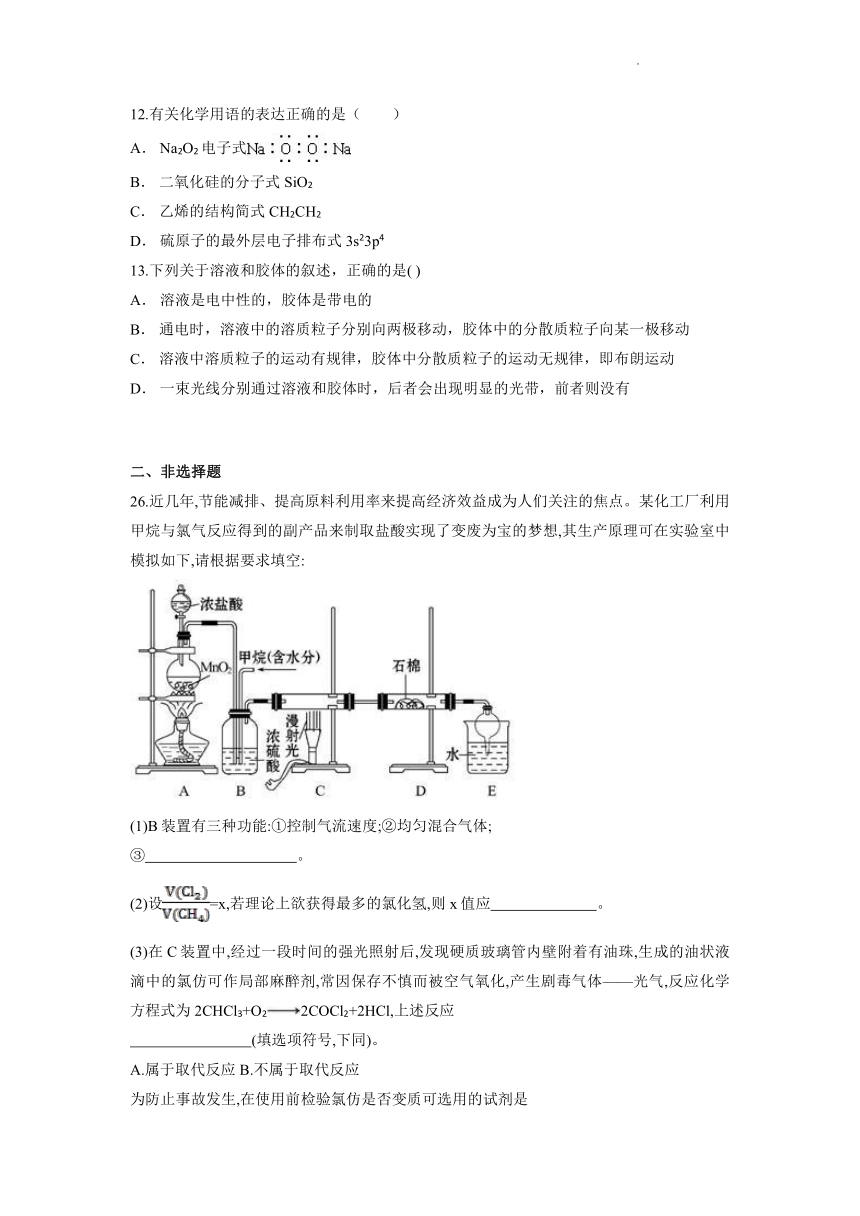
26.近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如下,请根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;
③ 。
(2)设=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O22COCl2+2HCl,上述反应
(填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是 。
(5)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为____________
(填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3⑤CCl4
27.某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率。
[实验用品] 锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1的H2SO4、4 mol·L-1的H2SO4。
[实验步骤]
(1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
(2)乙同学取另一套同样的装置,加入40 mL 4 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为_______________________________________
________________________________________________________________________。
(2)收集10 mL H2所需时间:甲________(填“大于”“小于”或“等于”)乙。反应速率:甲________(填“大于”“小于”或“等于”)乙。
(3)下列说法正确的是________(填字母)。
A.本实验中甲、乙两同学所用锌粒的表面积要相同
B.装置气密性要好
C.40 mL的H2SO4要迅速加入
D.测量气体体积还可以用排水法
E.若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:
①____________________; ②________________。
28.铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___________________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_____________________________________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为________,阴极产生的物质A的化学式为________。
(5)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_________________________________________________。
【化学选修:物质结构与性质】15分
35.原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号,下同),第一电离能最小的是 ;
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质棕色的烟绿色溶液蓝色沉淀蓝色溶液黑色沉淀
请书写第⑤步反应的离子方程式: 。
【化学选修:有机化学基础】15分
36.近来有报道,碘代化合物E与化合物H在Cr—Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知:RCHO+CH3CHOR—CH===CH—CHO+H2O
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为____________________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为__________________________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr—Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式____________________________。
答案
一、选择题部分
题号 7 8 9 10 11 12 13
答案 B A D B C D D
二、必考题非选择题
26.(1)干燥混合气体
(2)大于或等于4
(3)B B、E
(4)吸收过量的氯气
(5)C、D
(6)分液 ①、②
27.(1)Zn+2H+===Zn2++H2↑
(2)大于 小于
(3)ABCD
(4)测定等质量的Zn完全溶解所需要的时间 单位时间内H2SO4浓度的变化
28(1)Al2O3+2OH-===2AlO+H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4CO+2H2O-4e-===4HCO+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
35.(1)Cl Cu
HCl
sp2
(4)①②③
(5)[Cu(NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
36 (1)丙炔
(2)CH≡CCH2Cl+NaCNCH≡CCH2CN+NaCl
(3)取代反应 加成反应
(4)HC≡CCH2COOC2H5
(5)羟基、酯基
(6)
(7)、、、、、(任写3种)
理综化学
一、单选题(共7小题,每小题6.0分,共42分)
7.某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜。下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
A. 方案Ⅱ比方案Ⅰ操作简便
B. 等质量的锌,相同条件下在方案Ⅰ和方案Ⅱ中制得的铜的质量相同
C. 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少
D. 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜
8.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是(
A. 升高温度,溶液的pH增大
B. 室温时,此酸的电离平衡常数约为1×10-7
C. 该溶液的pH=4
D. 升高温度,电离平衡常数增大
9.有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
10.下列说法正确的是( )
A. 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2OHCO3-+OH-向正反应方向移动,则溶液pH增大
B. 室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
D. 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值
11.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
12.有关化学用语的表达正确的是( )
A. Na2O2电子式
B. 二氧化硅的分子式SiO2
C. 乙烯的结构简式CH2CH2
D. 硫原子的最外层电子排布式3s23p4
13.下列关于溶液和胶体的叙述,正确的是( )
A. 溶液是电中性的,胶体是带电的
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
二、非选择题
26.近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如下,请根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;
③ 。
(2)设=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O22COCl2+2HCl,上述反应
(填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是 。
(5)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为____________
(填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3⑤CCl4
27.某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率。
[实验用品] 锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1的H2SO4、4 mol·L-1的H2SO4。
[实验步骤]
(1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
(2)乙同学取另一套同样的装置,加入40 mL 4 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为_______________________________________
________________________________________________________________________。
(2)收集10 mL H2所需时间:甲________(填“大于”“小于”或“等于”)乙。反应速率:甲________(填“大于”“小于”或“等于”)乙。
(3)下列说法正确的是________(填字母)。
A.本实验中甲、乙两同学所用锌粒的表面积要相同
B.装置气密性要好
C.40 mL的H2SO4要迅速加入
D.测量气体体积还可以用排水法
E.若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:
①____________________; ②________________。
28.铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___________________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_____________________________________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为________,阴极产生的物质A的化学式为________。
(5)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_________________________________________________。
【化学选修:物质结构与性质】15分
35.原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号,下同),第一电离能最小的是 ;
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质棕色的烟绿色溶液蓝色沉淀蓝色溶液黑色沉淀
请书写第⑤步反应的离子方程式: 。
【化学选修:有机化学基础】15分
36.近来有报道,碘代化合物E与化合物H在Cr—Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知:RCHO+CH3CHOR—CH===CH—CHO+H2O
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为____________________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为__________________________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr—Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式____________________________。
答案
一、选择题部分
题号 7 8 9 10 11 12 13
答案 B A D B C D D
二、必考题非选择题
26.(1)干燥混合气体
(2)大于或等于4
(3)B B、E
(4)吸收过量的氯气
(5)C、D
(6)分液 ①、②
27.(1)Zn+2H+===Zn2++H2↑
(2)大于 小于
(3)ABCD
(4)测定等质量的Zn完全溶解所需要的时间 单位时间内H2SO4浓度的变化
28(1)Al2O3+2OH-===2AlO+H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4CO+2H2O-4e-===4HCO+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
35.(1)Cl Cu
HCl
sp2
(4)①②③
(5)[Cu(NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
36 (1)丙炔
(2)CH≡CCH2Cl+NaCNCH≡CCH2CN+NaCl
(3)取代反应 加成反应
(4)HC≡CCH2COOC2H5
(5)羟基、酯基
(6)
(7)、、、、、(任写3种)
同课章节目录
