天津市河西区2021-2022学年高三上学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 天津市河西区2021-2022学年高三上学期期末考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 249.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-13 12:15:32 | ||
图片预览

文档简介
河西区2021- 2022 学年度第一学期高三年级期末形成性质量调查
化 学 试 卷
可能用到的相对原子质量:HI1 C 12 N 14 O 16 Na 23 S 32
本试卷分为第I卷(选择题)、第II卷(非选择题)两部分。试卷满分100分。考试时间60分钟。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并在规定的位置粘贴考试用条形码。答卷时,考生务必将答案涂写答题卡上,答在试卷上的无效。昔试结束后,将本试卷和答题卡一并交回。
第I卷(选择题 共36分)
本卷包括12小题,每小题3分,共36分。在每题列出的四个选项中,只有一项是最符合题目要求的。
1.下列发电厂、电站的电能由化学能直接转化而成的是
A.水力发电站 B.地热发电厂
C.风力发电厂 D.燃料电池发电站
2.下列叙述不正确的是
A.二氧化硫可用于杀菌、消毒
B.电解饱和食盐水可得金属钠
C.家用电热水器不锈钢内胆镶嵌镁棒是为防止内胆腐蚀
D.碳素钢中加入适量铬等改变其组织结构而具有强抗腐蚀等性能
3.下列物质变化只是通过改变分子间作用力实现的是
A.干冰升华 B.钢铁熔化
C. KCl熔融 D.过氧化钠溶于水
4.常溫下,下列各组离子在指定溶液中一定能够大量共存的是
A.无色透明溶液中: Fe3+、H+、NO3-
B. pH=2 的溶液中: NH4+、Mg2+、SO42-
C. 1 mol·L-1的AlCl3溶液中: Na+、Ca2+、HCO3-
D.由水电离出的c(H+)= 1 ×10-13mol·L-1的溶液中: K+、 Cl-、ClO-
5.下列有机反应中,C-H键发生断裂的是
A.甲烷与氯气在光照条件下反应
B.乙烯与溴的四氯化碳溶液反应
C.苯与氢气在催化剂和加热条件下反应
D.乙炔与氯化氢在催化剂和加热条件下反应
6.下列事实与化学用语的表述对应正确的是
A.钢铁吸氧腐蚀中的正极反应: 4OH- -4e-= 2H2O + O2↑
B.室温下醋酸钠溶液的pH> 7: CH3COONa = CH3COO-+Na+
C.用Na2CO3溶液处理锅炉水垢中的CaSO4: Ca2++ CO32-= CaCO3↓
D.用AlCl3溶液和氨水制备Al(OH)3: Al3++3NH3·H2O =Al(OH)3↓+3NH4+
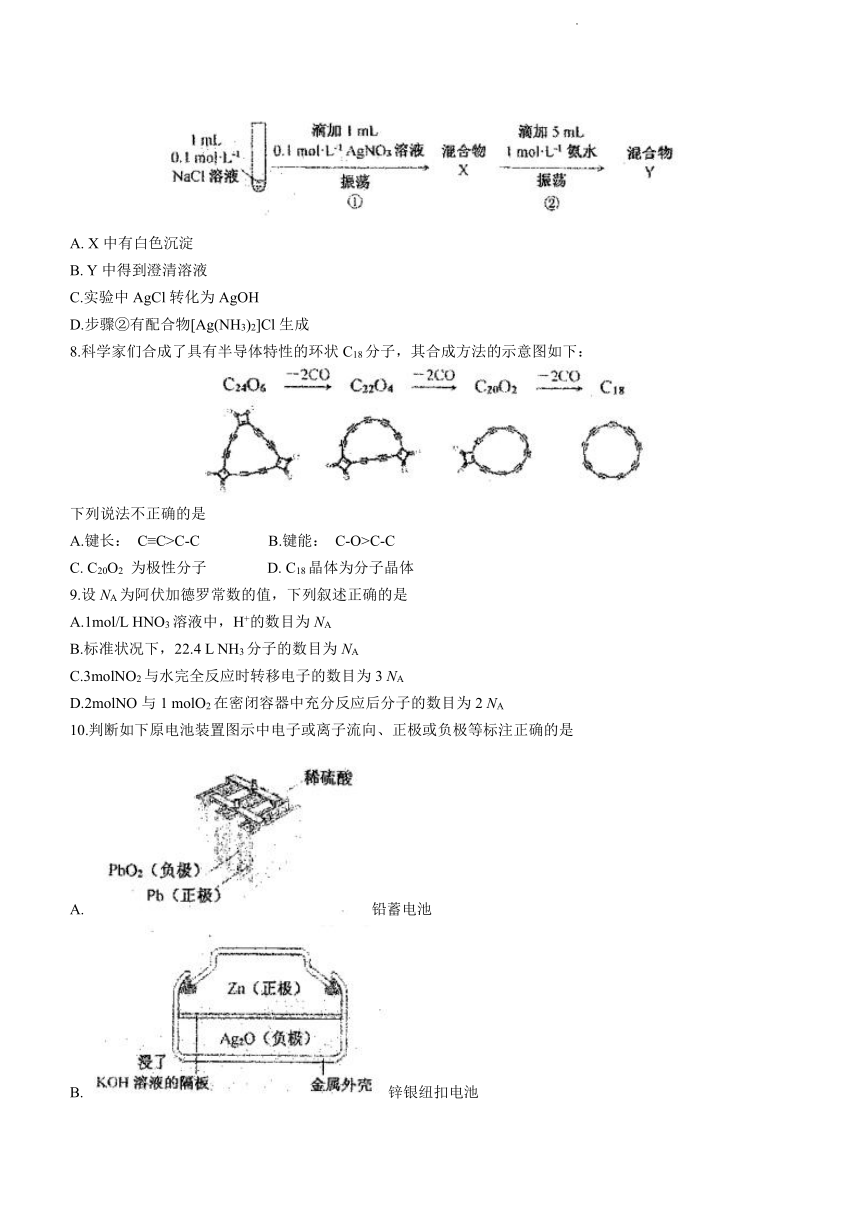
7.有关下列实验的叙述不正确的是
A. X中有白色沉淀
B. Y中得到澄清溶液
C.实验中AgCl转化为AgOH
D.步骤②有配合物[Ag(NH3)2]Cl生成
8.科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如下:
下列说法不正确的是
A.键长: C≡C>C-C B.键能: C-O>C-C
C. C20O2 为极性分子 D. C18晶体为分子晶体
9.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol/L HNO3溶液中,H+的数目为NA
B.标准状况下,22.4 L NH3分子的数目为NA
C.3molNO2与水完全反应时转移电子的数目为3 NA
D.2molNO与1 molO2在密闭容器中充分反应后分子的数目为2 NA
10.判断如下原电池装置图示中电子或离子流向、正极或负极等标注正确的是
A. 铅蓄电池
B. 锌银纽扣电池
C. 燃料电池
D. 锌铜原电池
11.某科研团队设计了负载有Ru纳米颗粒且具有三维多孔结构的石墨烯基电极“Na-SO2”电池,以添加了乙二胺的有机溶剂为电解质溶液,其简单示意图如下。下列有关说法中正确的是
A.组装电池时,乙二胺的有机溶剂可改为乙二胺的水溶液
B.放电时,负极上的电极反应式: 2Na++ 2SO2+ 2e- = Na2S2O4
C、充电时,每转移0.1 mole-,在阳极可生成标准状况下2.24 L SO2
D.该电池多孔石墨烯电极有利于气体、电极和电解质溶液充分接触
12.某实验测得0.1 mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线如下图所示。下列说法正确的是
A. a点溶液中,> Ka2(H2CO3)
B. b点溶液中,c(Na+)= c(HCO3- )+c (CO32- )
C. a点与c点溶液中的c(OH- )相等
D. ab段,升温,pH减小,说明抑制了HCO3-的水解
第II卷(非选择题共64 分)
本卷包括4小题,共64分。
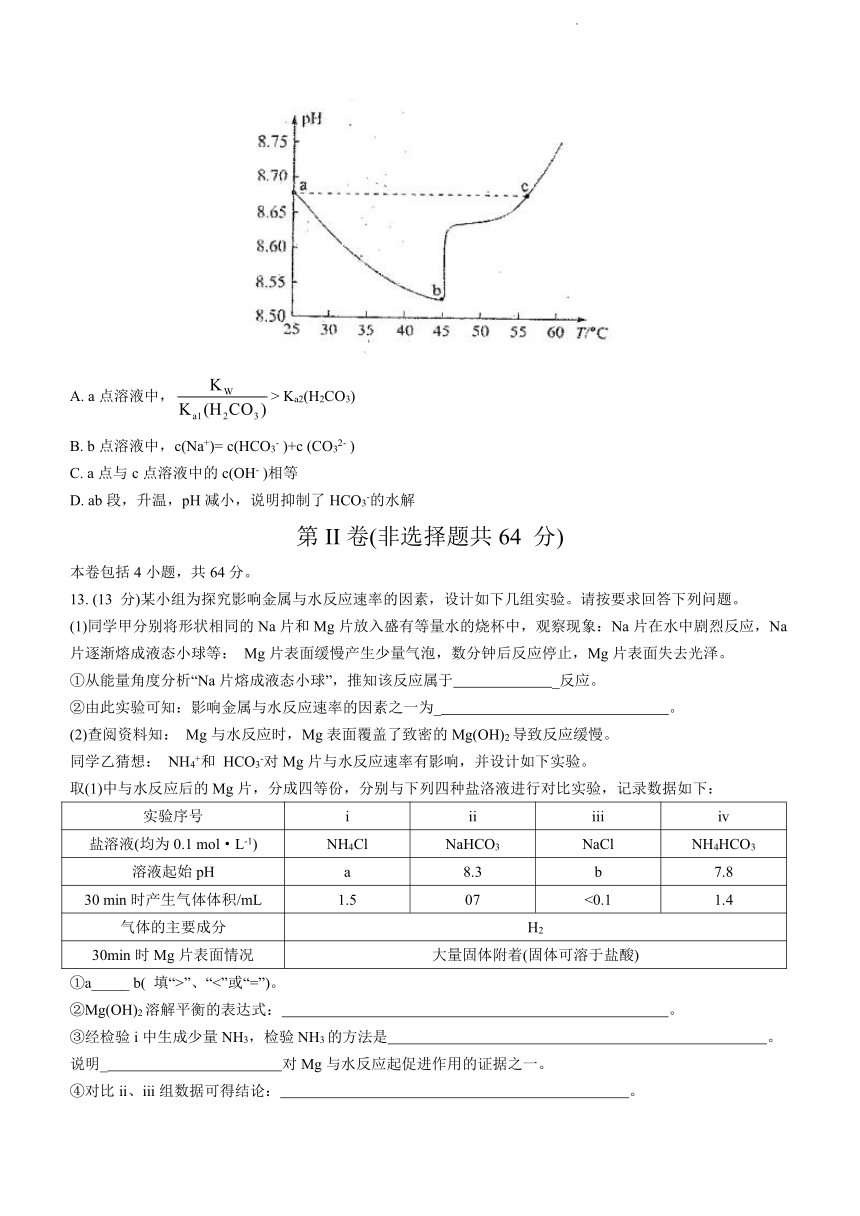
13. (13 分)某小组为探究影响金属与水反应速率的因素,设计如下几组实验。请按要求回答下列问题。
(1)同学甲分别将形状相同的Na片和Mg片放入盛有等量水的烧杯中,观察现象:Na片在水中剧烈反应,Na片逐渐熔成液态小球等: Mg片表面缓慢产生少量气泡,数分钟后反应停止,Mg片表面失去光泽。
①从能量角度分析“Na片熔成液态小球”,推知该反应属于 _反应。
②由此实验可知:影响金属与水反应速率的因素之一为_ 。
(2)查阅资料知: Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢。
同学乙猜想: NH4+和 HCO3-对Mg片与水反应速率有影响,并设计如下实验。
取(1)中与水反应后的Mg片,分成四等份,分别与下列四种盐洛液进行对比实验,记录数据如下:
实验序号 i ii iii iv
盐溶液(均为0.1 mol·L-1) NH4Cl NaHCO3 NaCl NH4HCO3
溶液起始pH a 8.3 b 7.8
30 min时产生气体体积/mL 1.5 07 <0.1 1.4
气体的主要成分 H2
30min时Mg片表面情况 大量固体附着(固体可溶于盐酸)
①a_____ b( 填“>”、“<”或“=”)。
②Mg(OH)2溶解平衡的表达式: 。
③经检验i中生成少量NH3,检验NH3的方法是 。
说明_ 对Mg与水反应起促进作用的证据之一。
④对比ii、iii组数据可得结论: 。
⑤检验ii、iv 所得固体为Mg2(OH)2CO3,写出生成该固体的离子方程式:
。
⑥分析上表数据中还可获得的结论为同浓度NH4+、HCO3-, _对Mg与水反应起促进作用更大,也对Mg(OH)2的溶解效果更好。
14. (22分)硫元素及其化合物在工农业生产中有重要应用。请按要求回答下列问题。
(1)基态S原子的价电子排布式为_ __。 SO2为__ _ (填“极性”或“非极性”)分子,其中心原子的杂化类型为 ;其分子的VSEPR模型为 形,分子的空间结构为__
形,其晶体类型为_ 。
(2)燃煤废气(含N2、 O2、SO2、 CO2、H2O、NO2等)可与H2S反应转化为S,实现废物利用、保护环境的目的。写出其中两个反应的化学方程式
、 。
(3)化工原料CS2可利用硫(沸点为445°C)与CH4(g)为原料制备。在某温度下,S8分解为S2,与CH4(g)发生反应: 2S2(g)+CH4(g) CS2(g)+2H2S(g)。
①初始时n(S2) :nCH4)=2: 1,当CH4的转化率为60%时,CS2的体积分数为_ __。
②写出可判断该反应达到平衡的一项标志: 。
③)在恒温密闭容器中一定条件下,CH4与S2反应中CH4的平衡转化率、S8 分解产生S2的体积分数随温度的变化曲线如右图所示。
i.据图分析,可得出生成CS2的反应ΔH 0( 填“>”、“<”或“=”)。
ii.工业上通常采用在600~650°C的条件下进行此反应,而不采用低于600°C的原因是__
。
(4)探究S2-的化学性质
①同学甲向CuCl2溶液中滴入Na2S溶液,观察有黑色沉淀生成。写出该反应的离子方程式为
。
②同学乙设计如右图所示实验,静置一周过程中观察蛋壳内溶液无明显现象;烧杯内溶液渐渐褪色且有淡
黄色浑浊。已知Ksp(CuS)=6.3 × 10-35。
i.可预测蛋壳外c(S2-)< mol/L。
ii.解释观察到现象可能的原因是S2-可通过蛋壳上的微孔。Cu2+不能:还可能是
。
15. (16分)为助力碳达峰、碳中和,加强对CO2资源化利用的研究成为热点。请按要求回答下列问题。
(1) CO2的主要来源分析
CO2源于煤、石油及其他含碳化合物的燃烧。25°C时,H2(g)、 C(石墨,s)、 C6H6(l)的燃烧热分别为a kJ·mol-1、b kJ·mol-1、c kJ· mol-1。25°C时, H2(g)和1 C(石墨,s)生成C6H6(l)是吸热反应,该热化学方程式为
。
(2)大气中CO2的吸收
I.海洋是重要的“碳仓库”
①CO2溶于海水,表层水酸性越来越大,其理由如下所示,请将步骤iii 补充完整。
i. CO2(g) CO2(aq)
ii. CO2(aq)+H2O(l)H2CO3(aq)
iii.
iv.HCO3-(aq) H+(aq)+CO32- (aq)
设25°C时,iii 式平衡常数为K mol/L ,溶液中c(H2CO3)= x mol/L,忽略步骤iv, 则c(H+)=
mol·L-1
②由大陆上风化的石灰石会中和①中的酸,从而形成了一个适合生物生存的微妙化学平衡海洋环境。写出石灰石在该平衡体系中变化的离子方程式:
。
③有科学家预测到本世纪末海洋的pH将减小0.4,即c(H+)将变为原来的______倍,但这将对海洋生物带来巨大变化。因此我们要大力发展低碳经济。
II.电化学转化法
Li-CO2电池工作时最终产物为Li2CO3和C,其正极按如下四步骤进行:
i. ii.C2O42-= CO2+ CO22-
iii.CO2+ 2CO22-= 2CO32-+C iv.CO32- + 2Li+= Li2CO3
①电池的负极反应物为 ;
②步骤i的反应式为 。
16. (13分)阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷() ;具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9°C,沸点197.3 °C;能与水、丙酮等互溶。
iii.汽车铝制水箱( 即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108°C,冰点为-38° C;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv. 25 °C H3PO4 Ka1=6.9 ×10-3, Ka2=6.2 ×10-8, Ka3=4.8 ×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式: ,其含有的官能团名称: 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
_ 。
(3)结合ii、iii、 iv 中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为_ _;
故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为_ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2CH2OHCH2OH
②CH2=CH2CH2OHCH2OH
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
。
河西区2021- 2022 学年度第一学期高三年级期末形成性质量调查
化学试题参考答案及评分标准
第I卷(选择题共36分)
本卷包括18小题,每小题2分,共36分。
1D 2B 3A 4B 5A 6D 7C 8A 9B 10C 11D 12A
第II卷(非选择题共 64分)
13. (!3分)
(1)①放热(2分)
②金属本身(或金属原子结构) (1分)
(2)①< (2 分)
②Mg(OH)2(s) Mg2+(ag)+2OH-(ag)(2分)
③将湿润的红色石蕊试纸放在试管口,观察试纸变蓝(1分) NH4+ (1分)
④HCO3-对Mg与水反应起促进作用(1 分)
⑤2Mg(OH)2+2HCO3-= Mg2(OH)2CO3+2H2O+CO32-
(或2Mg+2H2O+2HCO3- = Mg2(OH)2CO3+CO32-+2H2↑) (2 分)
⑥NH4+ (1 分)
14. (22分)
(1) 3s23p4 极性 sp2杂化 平面三角 V 分子晶体 (6分)
(2) 2H2S+SO2=3S+2H2O 2H2S+O2=2S+2H2O 4H2S+2NO2= 4S+4H2O+N2 (任意2个,合理即可给分,2分)
(3)①20% (2 分)
②CS2的体积分数不再改变(合理即可给分,2分)
③i.< (2分)
ii. 600°C时甲烷平衡转化率高达9%,低于600°C时,S2 浓度明显偏小,且反应速率慢(2分)
(4)①Cu2++S2-=CuS↓(2分)
②i.6.3 ×10-34 (2分)
ii. S2-被Cu2+氧化了或S2-被Cu2+和O2氧化了(合理即可给分,2分)
15. (16分)
(1) 6C(石墨,s) + 3H2(g) = C6H6(l) △H = +(-3a-6b+c) kJ·mol-1 (4分)
(2) I.①H2CO3(aq) H+(aq)+HCO3-(aq) (2分) (x·K)1/2 (2 分)
②CaCO3(S) +CO2(aq)+H2O(l) Ca2+ (aq)+2HCO3- (ag) (合理即可给分,2分)
③100.4 (2分)
II .①Li (2 分)
②2CO2+2e-=C2O42- (2 分)
16. (13分)
(1) C2H4O (2分) 醚键(2 分)
(2)二者分子间形成氢键(1 分)
(3)①因为H2PO4-的Ka2=6.2 ×10-8 H2PO4- +H2O H3PO4+OH- Kh=10-14/6.9× 10-3
H2PO4-的电离能力大于其水解能力(1 分)
②乙二醇与氧气反应,生成微量乙二酸(合理即可给分, 1 分)
(4) ①CH2ClCH2Cl (2分)
②(3分)
从原子利用率的角度考虑,路线①第二步的取代反应有副产物,原子利用率低,而路线②的原子利用率较高
(从环境保护的角度考虑,路线①使用了有毒的Cl2和有腐蚀性的NaOH,对环境不够友好。或从原料成本的角度考虑,路线①使用了Cl2和NaOH,而路线②使用了O2和H2O,成本更低)(1分)
化 学 试 卷
可能用到的相对原子质量:HI1 C 12 N 14 O 16 Na 23 S 32
本试卷分为第I卷(选择题)、第II卷(非选择题)两部分。试卷满分100分。考试时间60分钟。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并在规定的位置粘贴考试用条形码。答卷时,考生务必将答案涂写答题卡上,答在试卷上的无效。昔试结束后,将本试卷和答题卡一并交回。
第I卷(选择题 共36分)
本卷包括12小题,每小题3分,共36分。在每题列出的四个选项中,只有一项是最符合题目要求的。
1.下列发电厂、电站的电能由化学能直接转化而成的是
A.水力发电站 B.地热发电厂
C.风力发电厂 D.燃料电池发电站
2.下列叙述不正确的是
A.二氧化硫可用于杀菌、消毒
B.电解饱和食盐水可得金属钠
C.家用电热水器不锈钢内胆镶嵌镁棒是为防止内胆腐蚀
D.碳素钢中加入适量铬等改变其组织结构而具有强抗腐蚀等性能
3.下列物质变化只是通过改变分子间作用力实现的是
A.干冰升华 B.钢铁熔化
C. KCl熔融 D.过氧化钠溶于水
4.常溫下,下列各组离子在指定溶液中一定能够大量共存的是
A.无色透明溶液中: Fe3+、H+、NO3-
B. pH=2 的溶液中: NH4+、Mg2+、SO42-
C. 1 mol·L-1的AlCl3溶液中: Na+、Ca2+、HCO3-
D.由水电离出的c(H+)= 1 ×10-13mol·L-1的溶液中: K+、 Cl-、ClO-
5.下列有机反应中,C-H键发生断裂的是
A.甲烷与氯气在光照条件下反应
B.乙烯与溴的四氯化碳溶液反应
C.苯与氢气在催化剂和加热条件下反应
D.乙炔与氯化氢在催化剂和加热条件下反应
6.下列事实与化学用语的表述对应正确的是
A.钢铁吸氧腐蚀中的正极反应: 4OH- -4e-= 2H2O + O2↑
B.室温下醋酸钠溶液的pH> 7: CH3COONa = CH3COO-+Na+
C.用Na2CO3溶液处理锅炉水垢中的CaSO4: Ca2++ CO32-= CaCO3↓
D.用AlCl3溶液和氨水制备Al(OH)3: Al3++3NH3·H2O =Al(OH)3↓+3NH4+
7.有关下列实验的叙述不正确的是
A. X中有白色沉淀
B. Y中得到澄清溶液
C.实验中AgCl转化为AgOH
D.步骤②有配合物[Ag(NH3)2]Cl生成
8.科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如下:
下列说法不正确的是
A.键长: C≡C>C-C B.键能: C-O>C-C
C. C20O2 为极性分子 D. C18晶体为分子晶体
9.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol/L HNO3溶液中,H+的数目为NA
B.标准状况下,22.4 L NH3分子的数目为NA
C.3molNO2与水完全反应时转移电子的数目为3 NA
D.2molNO与1 molO2在密闭容器中充分反应后分子的数目为2 NA
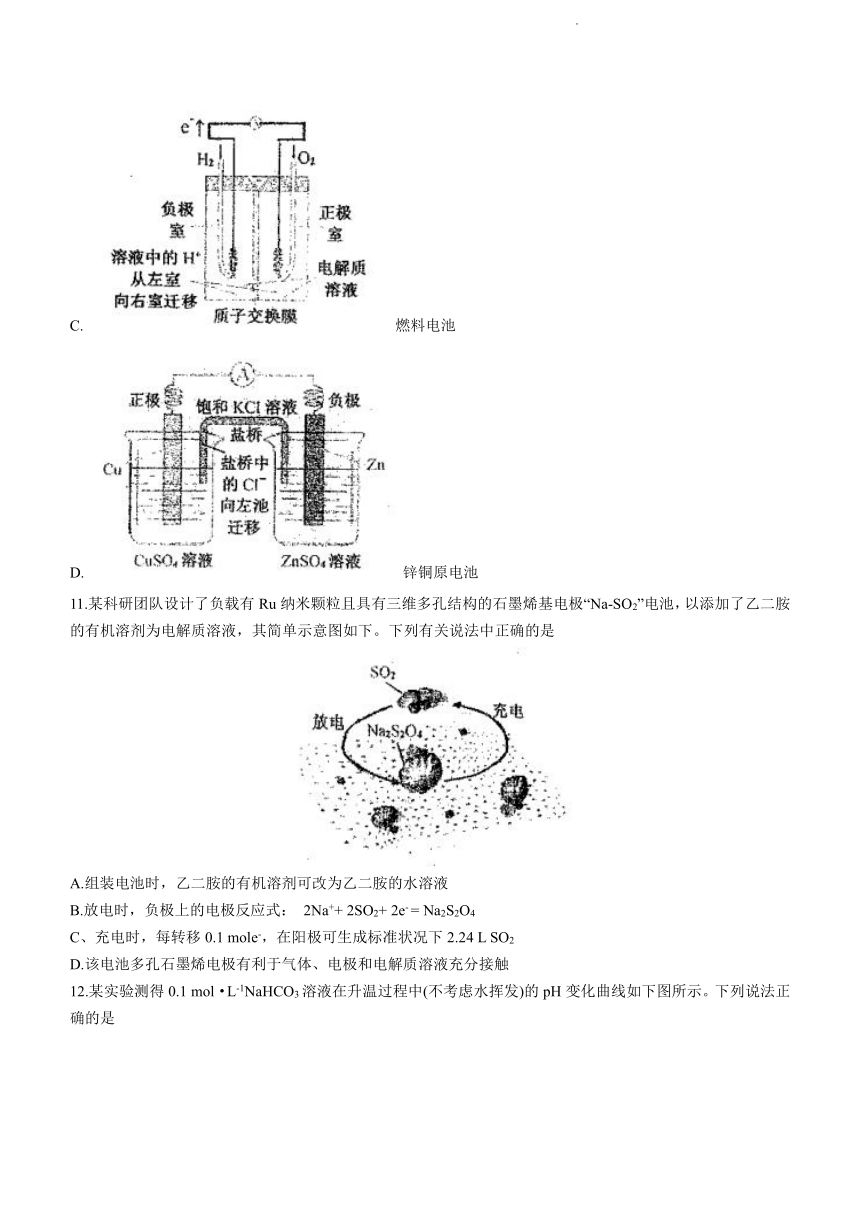
10.判断如下原电池装置图示中电子或离子流向、正极或负极等标注正确的是
A. 铅蓄电池
B. 锌银纽扣电池
C. 燃料电池
D. 锌铜原电池
11.某科研团队设计了负载有Ru纳米颗粒且具有三维多孔结构的石墨烯基电极“Na-SO2”电池,以添加了乙二胺的有机溶剂为电解质溶液,其简单示意图如下。下列有关说法中正确的是
A.组装电池时,乙二胺的有机溶剂可改为乙二胺的水溶液
B.放电时,负极上的电极反应式: 2Na++ 2SO2+ 2e- = Na2S2O4
C、充电时,每转移0.1 mole-,在阳极可生成标准状况下2.24 L SO2
D.该电池多孔石墨烯电极有利于气体、电极和电解质溶液充分接触
12.某实验测得0.1 mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线如下图所示。下列说法正确的是
A. a点溶液中,> Ka2(H2CO3)
B. b点溶液中,c(Na+)= c(HCO3- )+c (CO32- )
C. a点与c点溶液中的c(OH- )相等
D. ab段,升温,pH减小,说明抑制了HCO3-的水解
第II卷(非选择题共64 分)
本卷包括4小题,共64分。
13. (13 分)某小组为探究影响金属与水反应速率的因素,设计如下几组实验。请按要求回答下列问题。
(1)同学甲分别将形状相同的Na片和Mg片放入盛有等量水的烧杯中,观察现象:Na片在水中剧烈反应,Na片逐渐熔成液态小球等: Mg片表面缓慢产生少量气泡,数分钟后反应停止,Mg片表面失去光泽。
①从能量角度分析“Na片熔成液态小球”,推知该反应属于 _反应。
②由此实验可知:影响金属与水反应速率的因素之一为_ 。
(2)查阅资料知: Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢。
同学乙猜想: NH4+和 HCO3-对Mg片与水反应速率有影响,并设计如下实验。
取(1)中与水反应后的Mg片,分成四等份,分别与下列四种盐洛液进行对比实验,记录数据如下:
实验序号 i ii iii iv
盐溶液(均为0.1 mol·L-1) NH4Cl NaHCO3 NaCl NH4HCO3
溶液起始pH a 8.3 b 7.8
30 min时产生气体体积/mL 1.5 07 <0.1 1.4
气体的主要成分 H2
30min时Mg片表面情况 大量固体附着(固体可溶于盐酸)
①a_____ b( 填“>”、“<”或“=”)。
②Mg(OH)2溶解平衡的表达式: 。
③经检验i中生成少量NH3,检验NH3的方法是 。
说明_ 对Mg与水反应起促进作用的证据之一。
④对比ii、iii组数据可得结论: 。
⑤检验ii、iv 所得固体为Mg2(OH)2CO3,写出生成该固体的离子方程式:
。
⑥分析上表数据中还可获得的结论为同浓度NH4+、HCO3-, _对Mg与水反应起促进作用更大,也对Mg(OH)2的溶解效果更好。
14. (22分)硫元素及其化合物在工农业生产中有重要应用。请按要求回答下列问题。
(1)基态S原子的价电子排布式为_ __。 SO2为__ _ (填“极性”或“非极性”)分子,其中心原子的杂化类型为 ;其分子的VSEPR模型为 形,分子的空间结构为__
形,其晶体类型为_ 。
(2)燃煤废气(含N2、 O2、SO2、 CO2、H2O、NO2等)可与H2S反应转化为S,实现废物利用、保护环境的目的。写出其中两个反应的化学方程式
、 。
(3)化工原料CS2可利用硫(沸点为445°C)与CH4(g)为原料制备。在某温度下,S8分解为S2,与CH4(g)发生反应: 2S2(g)+CH4(g) CS2(g)+2H2S(g)。
①初始时n(S2) :nCH4)=2: 1,当CH4的转化率为60%时,CS2的体积分数为_ __。
②写出可判断该反应达到平衡的一项标志: 。
③)在恒温密闭容器中一定条件下,CH4与S2反应中CH4的平衡转化率、S8 分解产生S2的体积分数随温度的变化曲线如右图所示。
i.据图分析,可得出生成CS2的反应ΔH 0( 填“>”、“<”或“=”)。
ii.工业上通常采用在600~650°C的条件下进行此反应,而不采用低于600°C的原因是__
。
(4)探究S2-的化学性质
①同学甲向CuCl2溶液中滴入Na2S溶液,观察有黑色沉淀生成。写出该反应的离子方程式为
。
②同学乙设计如右图所示实验,静置一周过程中观察蛋壳内溶液无明显现象;烧杯内溶液渐渐褪色且有淡
黄色浑浊。已知Ksp(CuS)=6.3 × 10-35。
i.可预测蛋壳外c(S2-)< mol/L。
ii.解释观察到现象可能的原因是S2-可通过蛋壳上的微孔。Cu2+不能:还可能是
。
15. (16分)为助力碳达峰、碳中和,加强对CO2资源化利用的研究成为热点。请按要求回答下列问题。
(1) CO2的主要来源分析
CO2源于煤、石油及其他含碳化合物的燃烧。25°C时,H2(g)、 C(石墨,s)、 C6H6(l)的燃烧热分别为a kJ·mol-1、b kJ·mol-1、c kJ· mol-1。25°C时, H2(g)和1 C(石墨,s)生成C6H6(l)是吸热反应,该热化学方程式为
。
(2)大气中CO2的吸收
I.海洋是重要的“碳仓库”
①CO2溶于海水,表层水酸性越来越大,其理由如下所示,请将步骤iii 补充完整。
i. CO2(g) CO2(aq)
ii. CO2(aq)+H2O(l)H2CO3(aq)
iii.
iv.HCO3-(aq) H+(aq)+CO32- (aq)
设25°C时,iii 式平衡常数为K mol/L ,溶液中c(H2CO3)= x mol/L,忽略步骤iv, 则c(H+)=
mol·L-1
②由大陆上风化的石灰石会中和①中的酸,从而形成了一个适合生物生存的微妙化学平衡海洋环境。写出石灰石在该平衡体系中变化的离子方程式:
。
③有科学家预测到本世纪末海洋的pH将减小0.4,即c(H+)将变为原来的______倍,但这将对海洋生物带来巨大变化。因此我们要大力发展低碳经济。
II.电化学转化法
Li-CO2电池工作时最终产物为Li2CO3和C,其正极按如下四步骤进行:
i. ii.C2O42-= CO2+ CO22-
iii.CO2+ 2CO22-= 2CO32-+C iv.CO32- + 2Li+= Li2CO3
①电池的负极反应物为 ;
②步骤i的反应式为 。
16. (13分)阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷() ;具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9°C,沸点197.3 °C;能与水、丙酮等互溶。
iii.汽车铝制水箱( 即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108°C,冰点为-38° C;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv. 25 °C H3PO4 Ka1=6.9 ×10-3, Ka2=6.2 ×10-8, Ka3=4.8 ×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式: ,其含有的官能团名称: 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
_ 。
(3)结合ii、iii、 iv 中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为_ _;
故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为_ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2CH2OHCH2OH
②CH2=CH2CH2OHCH2OH
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
。
河西区2021- 2022 学年度第一学期高三年级期末形成性质量调查
化学试题参考答案及评分标准
第I卷(选择题共36分)
本卷包括18小题,每小题2分,共36分。
1D 2B 3A 4B 5A 6D 7C 8A 9B 10C 11D 12A
第II卷(非选择题共 64分)
13. (!3分)
(1)①放热(2分)
②金属本身(或金属原子结构) (1分)
(2)①< (2 分)
②Mg(OH)2(s) Mg2+(ag)+2OH-(ag)(2分)
③将湿润的红色石蕊试纸放在试管口,观察试纸变蓝(1分) NH4+ (1分)
④HCO3-对Mg与水反应起促进作用(1 分)
⑤2Mg(OH)2+2HCO3-= Mg2(OH)2CO3+2H2O+CO32-
(或2Mg+2H2O+2HCO3- = Mg2(OH)2CO3+CO32-+2H2↑) (2 分)
⑥NH4+ (1 分)
14. (22分)
(1) 3s23p4 极性 sp2杂化 平面三角 V 分子晶体 (6分)
(2) 2H2S+SO2=3S+2H2O 2H2S+O2=2S+2H2O 4H2S+2NO2= 4S+4H2O+N2 (任意2个,合理即可给分,2分)
(3)①20% (2 分)
②CS2的体积分数不再改变(合理即可给分,2分)
③i.< (2分)
ii. 600°C时甲烷平衡转化率高达9%,低于600°C时,S2 浓度明显偏小,且反应速率慢(2分)
(4)①Cu2++S2-=CuS↓(2分)
②i.6.3 ×10-34 (2分)
ii. S2-被Cu2+氧化了或S2-被Cu2+和O2氧化了(合理即可给分,2分)
15. (16分)
(1) 6C(石墨,s) + 3H2(g) = C6H6(l) △H = +(-3a-6b+c) kJ·mol-1 (4分)
(2) I.①H2CO3(aq) H+(aq)+HCO3-(aq) (2分) (x·K)1/2 (2 分)
②CaCO3(S) +CO2(aq)+H2O(l) Ca2+ (aq)+2HCO3- (ag) (合理即可给分,2分)
③100.4 (2分)
II .①Li (2 分)
②2CO2+2e-=C2O42- (2 分)
16. (13分)
(1) C2H4O (2分) 醚键(2 分)
(2)二者分子间形成氢键(1 分)
(3)①因为H2PO4-的Ka2=6.2 ×10-8 H2PO4- +H2O H3PO4+OH- Kh=10-14/6.9× 10-3
H2PO4-的电离能力大于其水解能力(1 分)
②乙二醇与氧气反应,生成微量乙二酸(合理即可给分, 1 分)
(4) ①CH2ClCH2Cl (2分)
②(3分)
从原子利用率的角度考虑,路线①第二步的取代反应有副产物,原子利用率低,而路线②的原子利用率较高
(从环境保护的角度考虑,路线①使用了有毒的Cl2和有腐蚀性的NaOH,对环境不够友好。或从原料成本的角度考虑,路线①使用了Cl2和NaOH,而路线②使用了O2和H2O,成本更低)(1分)
同课章节目录
