2022届高三化学高考备考二轮复习——实验题(PDF版含答案)
文档属性
| 名称 | 2022届高三化学高考备考二轮复习——实验题(PDF版含答案) | 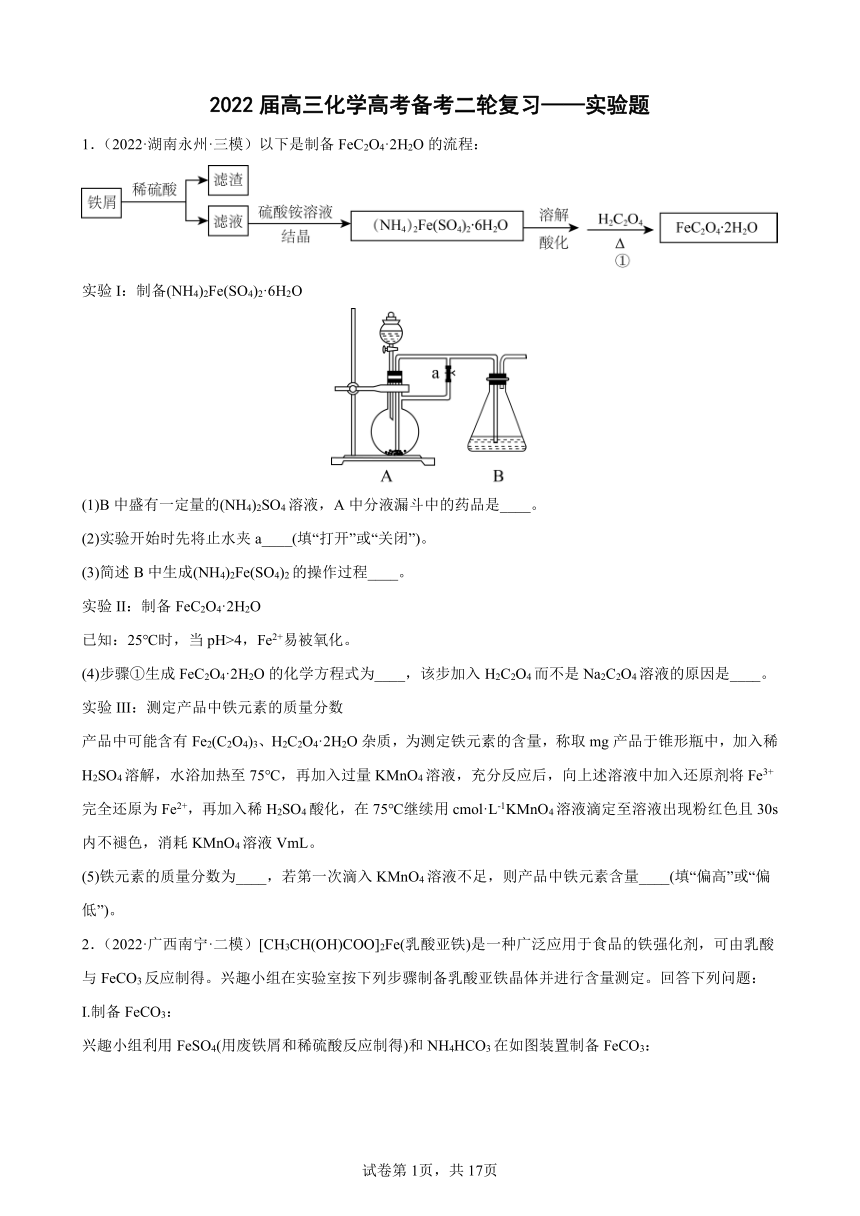 | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-10 10:06:39 | ||
图片预览


文档简介
2022届高三化学高考备考二轮复习——实验题
1.(2022·湖南永州·三模)以下是制备FeC2O4·2H2O的流程:
实验I:制备(NH4)2Fe(SO4)2·6H2O
(1)B中盛有一定量的(NH4)2SO4溶液,A中分液漏斗中的药品是____。
(2)实验开始时先将止水夹a____(填“打开”或“关闭”)。
(3)简述B中生成(NH4)2Fe(SO4)2的操作过程____。
实验II:制备FeC2O4·2H2O
已知:25℃时,当pH>4,Fe2+易被氧化。
(4)步骤①生成FeC2O4·2H2O的化学方程式为____,该步加入H2C2O4而不是Na2C2O4溶液的原因是____。
实验III:测定产品中铁元素的质量分数
产品中可能含有Fe2(C2O4)3、H2C2O4·2H2O杂质,为测定铁元素的含量,称取mg产品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃,再加入过量KMnO4溶液,充分反应后,向上述溶液中加入还原剂将Fe3+完全还原为Fe2+,再加入稀H2SO4酸化,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液VmL。
(5)铁元素的质量分数为____,若第一次滴入KMnO4溶液不足,则产品中铁元素含量____(填“偏高”或“偏低”)。
2.(2022·广西南宁·二模)[CH3CH(OH)COO]2Fe(乳酸亚铁)是一种广泛应用于食品的铁强化剂,可由乳酸与FeCO3反应制得。兴趣小组在实验室按下列步骤制备乳酸亚铁晶体并进行含量测定。回答下列问题:
I.制备FeCO3:
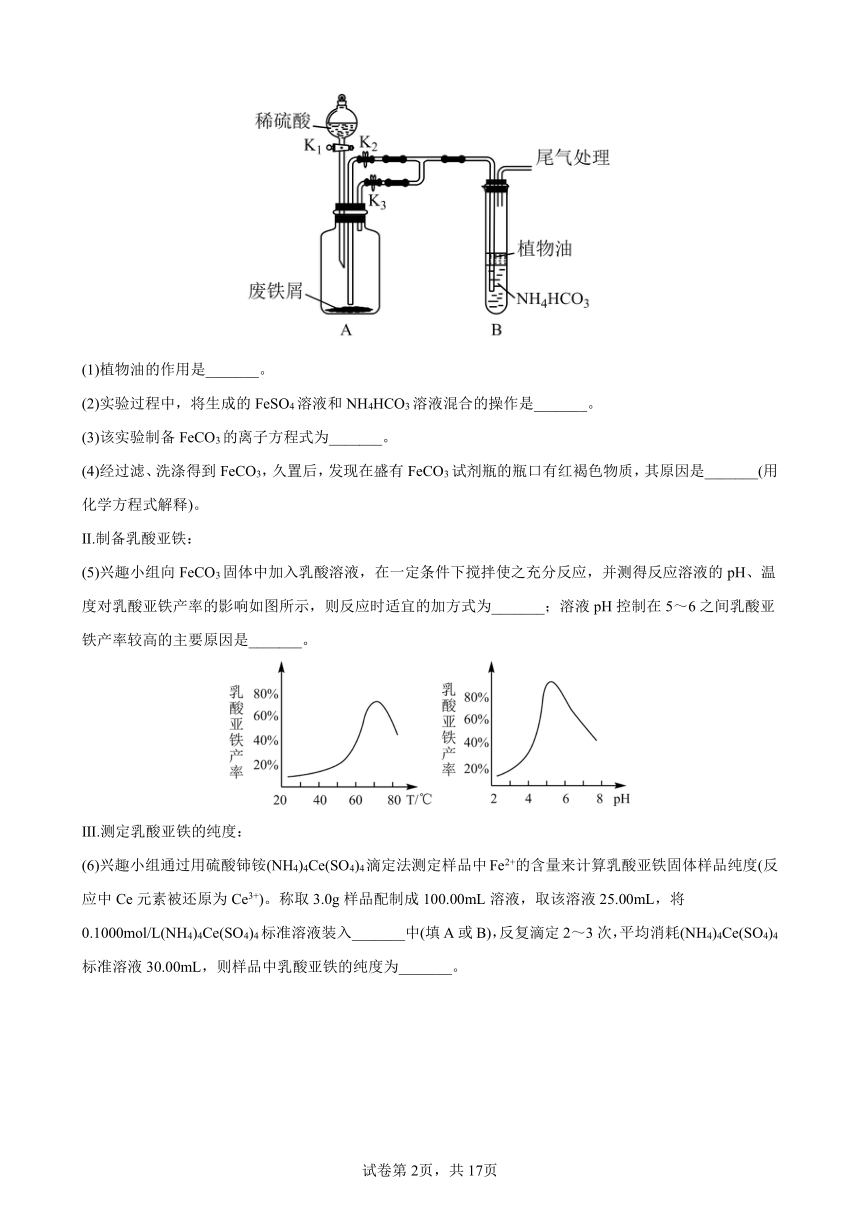
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:
(1)植物油的作用是_______。
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是_______。
(3)该实验制备FeCO3的离子方程式为_______。
(4)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是_______(用化学方程式解释)。
Ⅱ.制备乳酸亚铁:
(5)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,则反应时适宜的加方式为_______;溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是_______。
Ⅲ.测定乳酸亚铁的纯度:
(6)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取3.0g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入_______中(填A或B),反复滴定2~3次,平均消耗(NH4)4Ce(SO4)4标准溶液30.00mL,则样品中乳酸亚铁的纯度为_______。
A.B.
3.(2022·河北·石家庄二中模拟预测)叠氮化钠(NaN3)是一种防腐剂和分析试剂,在有机合成和汽车行业也有重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
I.氨基钠(NaNH2)熔点为208℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸
II.2HNO3+8HCl+4SnCl2=4SnCl4+5H2O+N2O↑,2NaNH2+N2ONaN3+NaOH+NH3。
回答下列问题:
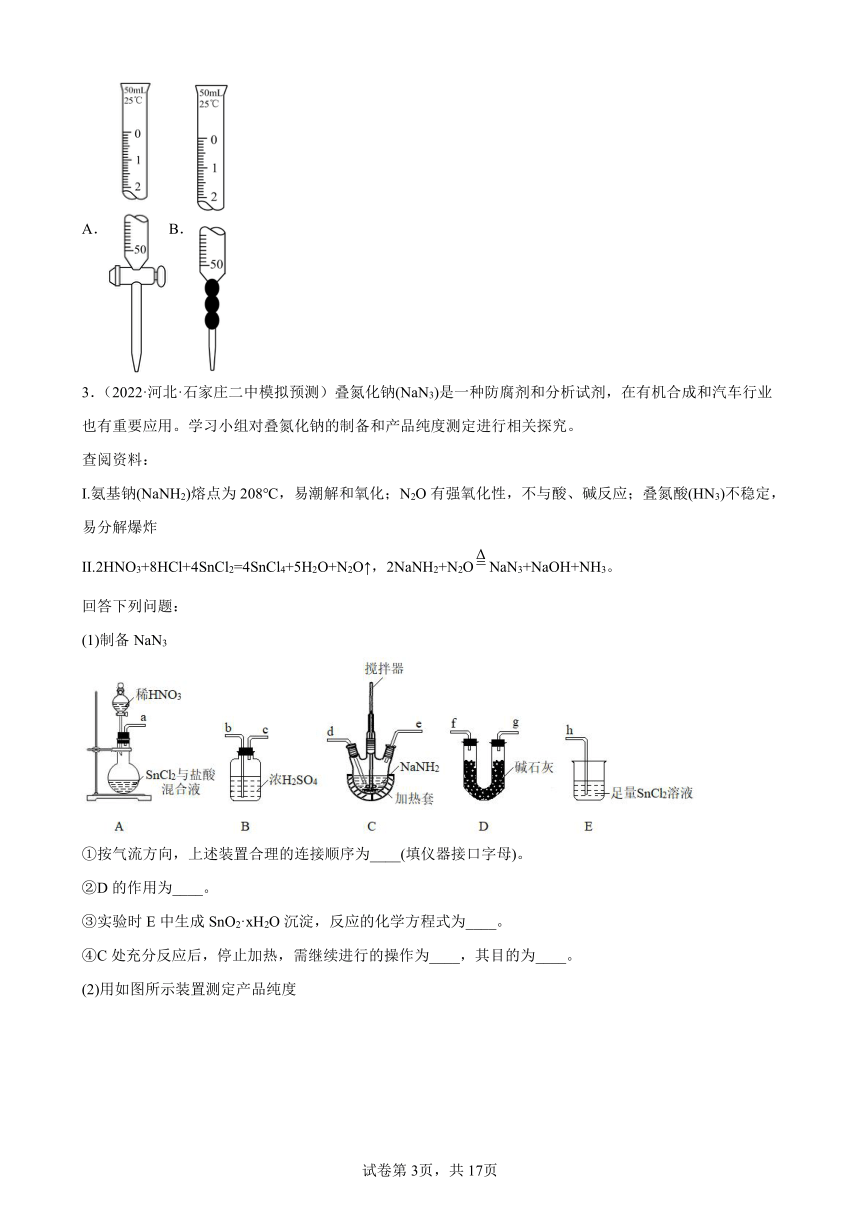
(1)制备NaN3
①按气流方向,上述装置合理的连接顺序为____(填仪器接口字母)。
②D的作用为____。
③实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为____。
④C处充分反应后,停止加热,需继续进行的操作为____,其目的为____。
(2)用如图所示装置测定产品纯度
①仪器F的名称为____;其中反应的离子方程式为____。
②管q的作用为____。
③若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VmL·mol-1,则产品中NaN3的质量分数为____。
4.(2022·湖南·雅礼中学一模)肉桂酸乙酯是高级防晒霜中必不可少的成分之一、由于其分子中存在碳碳双键,稳定性较差。研究肉桂酸乙酯的合成一直是热点,制备原理:
+CH3CH2OH+H2O
已知:Ⅰ.物理常数
有机物 相对分子质量 性状 熔点/℃ 沸点/℃ 密度/(g/mL) 溶解度
水 乙醇 乙醚
肉桂酸 148 白色晶体 135 300 1.25 微溶 溶 溶
肉桂酸乙酯 176 无色油状 12 271.5 1.05 不溶 溶 溶
Ⅱ.三元共沸物的组成和沸点
物质 水 乙醇 环己烷 共沸物
沸点/℃(1at) 100 78.3 80.8 62.6
质量分数/% 4.8 19.7 75.5 ----------
分水器内液体组成 上层 0.2 5.2 94.6 ---------------
下层 10.4 18.4 71.2
Ⅲ.实验步骤:
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层,过程中不断将上层液体流回圆底烧瓶,将下层液体放出;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤干燥,过滤;
⑥首先低温蒸出乙醚,再改用减压蒸馏(水浴加热即可)得到产品肉桂酸乙酯的体积为35.2mL。回答下列问题:
(1)蒸馏装置中,选用的冷凝管为_______(填标号)。
A.空气冷凝管 B.球形冷凝管 C.直形冷凝管 D.蛇形冷凝管
(2)本实验中,分水器的作用是_______。
(3)步骤③加入碳酸钠粉末的作用是_______。
(4)步骤⑤合适的干燥剂为_______(填标号);
A.浓硫酸 B.无水氯化钙 C.氧化钙 D.氢氧化钠
采用减压蒸馏的原因是_______。
(5)已知无水乙醇的密度为0.79 g·mL 1,该实验中肉桂酸乙酯的产率为_______。
(6)产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L 1的盐酸滴定,消耗盐酸的体积为V mL,该样品的纯度为_______(用代数式表示,无需化简)。
5.(2022·河北秦皇岛·二模)三氯化硼()用于制备光导纤维和有机硼化物等,制备原理:。某小组据此设计实验制备并测定其纯度,装置如图:
已知的熔点为-107.3℃,沸点为12.5℃,极易水解产生[或]和HCl。
实验(一):制备。
(1)水浴R选择_______(填“热水浴”或“冰水浴”),装碱石灰的仪器是_______(填名称)。
(2)F装置的作用是_______。
(3)已知:A装置中还原产物为,其离子方程式为_______。
实验(二):探究的性质。
据文献资料显示,在乙醇中剧烈反应生成硼酸酯和“白雾”,与在水中发生水解相似。
(4)写出三氯化硼与乙醇反应的化学方程式:_______。
实验(三):测定产品的纯度。
①准确称取wg产品,置于蒸馏水中,完全水解,并配成250mL溶液。
②准确量取25.00mL溶液于锥形瓶中。
③向其中加入液至沉淀完全,然后加入3mL硝基苯(常温常压下,密度为),振荡。
④向锥形瓶中滴加3滴溶液,然后逐滴加入标准溶液滴定过量的溶液,消耗KSCN溶液的体积为mL。已知:。
(5)步骤③加入硝基苯的目的是_______;滴定终点时的现象是_______。
(6)该产品中的质量分数为_______%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中的质量分数_______(“偏高”、“偏低”或“无影响”)。
6.(2022·湖北·模拟预测)Ⅰ.钼(Mo)为人体必需微量元素,是一种重要的过渡金属,在工业上主要用于制造合金钢等,下图为用CO制备单质Mo的实验装置图,回答下列问题。
(1)装置①的名称是_______;装置Ⅱ、装置Ⅲ中所装溶液依次为:_______、_______。
(2)实验操作中,先点燃装置_______处酒精灯(填“Ⅳ”或“Ⅴ”)。
(3)某同学认为装置Ⅵ中盛装的澄清石灰水变浑浊,也不能说明装置Ⅴ中被CO还原,理由是_______。
(4)从绿色化学角度,请指出该实验装置的一处缺陷_______。
Ⅱ.近日郑州大学发明专利,用液态锌做阴极,石墨做阳极,熔融盐为电解质,在石墨与液态锌接触区域放置二硫化钼(,Mo为+4价),将其还原为单质钼,装置如图:
(5)请写出该装置中二硫化钼上发生的电极反应方程式:_______,氩气的作用是:_______。
(6)已知,,若不纯的溶液中含少量的可溶性硫酸盐杂质、可加入固体除去,当开始沉淀时,溶液中_______(保留2位有效数字)。
7.(2022·江苏南通·模拟预测)实验小组以某铜渣(主要成分、,含少量和)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[]。实验包括如下过程:
(1)浸取。
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量,过滤。
①已知浸取时无S和SO2生成,写出浸取时所发生反应的离子方程式:_______。
②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是_______。
③当观察到_______,可以停止鼓入O2。
④加入的目的是_______。[已知]
(2)制取。
向滤液中加入溶液调节范围为_______,过滤;向滤渣中加入稀硫酸至滤渣恰好完全溶解,得溶液。{设、开始沉淀时,沉淀完全时。,}
(3)制。
已知的产率{}随起始与的比值和溶液pH的关系如图2所示。
①补充完整制取的实验方案:向烧杯中加入溶液,将烧杯置于70℃的水浴中,_______,低温烘干,得到。(实验中可选用的试剂或仪器:溶液、溶液、溶液、盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得的产率偏低,但Cu元素含量偏大,原因是_______。
8.(2022·天津·模拟预测)葡萄糖酸锌[Zn(C6H11O7)2相对分子质量455],是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100°C即开始分解。实验室制备葡萄糖酸锌装置如图1(夹持、控温装置略):
(1)图1中支管a的作用是_______,X处为冷凝回流装置,图2中仪器使用正确且效果最好的是_______。(填字母)。
(2)该反应需控制温度在90°C左右,其原因为_______,可采用的加热方式是_______。
(3)三颈烧瓶中发生反应的化学方程式为_______。
(4)反应完毕后,再经过一系列实验操作得到葡萄糖酸锌粗品。粗品含少量难溶于水的杂质,纯化粗品的合理操作顺序是_______(填字母序号)。
A.待晶体充分析出后,减压过滤
B.在50°C下用恒温干燥箱烘干
C.趁热减压过滤,除去不溶物
D.将滤液冷却至室温,加入10mL95%乙醇溶液并搅拌促进晶体析出
E.取烧杯加入10mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液
(5)测定产品纯度:取mg提纯后的产品溶于水配制成100.00mL溶液,取25.00mL置于锥形瓶中,向其中滴入少量EBT作为指示剂(遇Zn2+生成Zn-EBT),再加入过量的V1mLc1mol/LEDTA无色溶液(遇Zn2+生成Zn-EDTA),同时发生反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA(无色)+EBT(蓝色)。再用c2mol/LZn2+标准溶液滴定至终点。三次滴定平均消耗锌标准溶液V2mL。
①滴定终点的现象为_______。
②该产品的纯度为_______。(用含m,c1、c2,V1、V2的代数式表示)
9.(2021·新疆乌鲁木齐·二模)硫代硫酸钠晶体(Na2S2O3 5H2O)易溶于水,在中性、碱性溶液中很稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。回答下列问题:
已知:2S2O+I2=S4O+2I﹣;M(Na2S2O3 5H2O)=248g mol﹣1。
(1)写出仪器a的名称___________。
(2)已知Na2S和Na2CO3按物质的量之比2:1混合,则锥形瓶中制备Na2S2O3的化学方程式为___________;装置C的作用是___________。
(3)一段时间后,锥形瓶内有大量浅黄色浑浊的中间产物生成,需用电磁搅拌器快速搅拌,其目的是___________。
(4)反应结束时,必须控制溶液的pH≥7,理由是___________(用离子方程式表示)。
(5)将反应后的混合液过滤,从滤液中获得Na2S2O3 5H2O晶体的方法是___________。
(6)样品纯度测定
称取0.50g硫代硫酸钠晶体样品加水溶解,加几滴淀粉溶液,然后用0.1000mol L﹣1的碘标准溶液滴定,终点现象为___________。测得消耗碘标准溶液的体积为9.50mL,则该晶体样品(Na2S2O3 5H2O)的纯度为___________%。
10.(2021·新疆·三模)甘氨酸亚铁是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。已知:甘氨酸亚铁的化学式为[(H2NCH2COO)2Fe,摩尔质量204g mol-1]。实验室模拟其合成方法如图1所示:
已知:
甘氨酸(H2NCH2COOH) 异抗坏血酸 甘氨酸亚铁 FeSO4 7H2O. FeCl2 4H2O
易溶于水,微溶于乙醇 易溶于水和乙醇有弱酸性和强还原性 易溶于水,难溶于乙醇 易溶于水,难溶于乙醇 易溶于水,易溶于乙醇
请回答:
(1)如图2所示合成装置中仪器b的名称是____。
(2)步骤Ⅱ加热的方法可采用____;为了防止Fe2+被氧化,本实验设计的步骤中,采取的措施有____。
(3)下列说法正确的是____。A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4 7H2O
C.步骤Ⅲ中的分离方法是过滤。
D.步骤Ⅳ,提纯操作中的干燥过程最好选用真空干燥
(4)写出合成甘氨酸亚铁的化学方程式是____。合成过程需控制pH=5.5,试说明理由____。
(5)步骤Ⅲ加入无水乙醇的目的是____。
(6)若甘氨酸的投料量为20.0g,得到纯品23.2g,则产品的产率为____%。(保留一位小数)
11.(2022·湖南湘西·三模)硫化锂(Li2S)易潮解,加热条件下易被空气中的氧化。某小组选择下列装置(装置可重复使用)制备。回答下列问题:
已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为。
(1)装置A的名称是_______,停止装置A中反应的操作是_______(填“打开”或“关闭”)K。
(2)气流从左至右,导管口连接顺序是a→_______→_______→_______→_______→d→e→_______→_______。_______
(3)其他条件相同,粗锌与稀硫酸反应比纯锌_______(填“快”或“慢”),实验中观察到装置D中产生黑色沉淀,其离子方程式为_______。
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾 ()。
下列有关说法正确的是_______(填标号)。
A.选择图1装置过滤的优点是避免析出
B.选择图1装置过滤,主要是分离和溶液
C.粗皓矾中可能含胆矾
D.选择图2装置过滤的优点是过滤速率快
(5)探究产品成分:
实验 操作与现象 结论
Ⅰ 取少量样品溶于水,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 样品中含
Ⅱ 向实验Ⅰ的溶液中滴加溶液,产生白色沉淀 样品中含_______
①由实验Ⅱ知,样品中还含有_______(填化学式),产生该杂质的可能原因是_______(填标号)。
A.通入的氢气过量 B.未反应完 C.温度过高
②测定产品纯度:向wg样品(设杂质只有)中加入过量的稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准的NaOH溶液滴定过量的硫酸,消耗NaOH溶液。样品的纯度为_______(列出计算式)。
12.(2022·上海·模拟预测)实验室模拟拉希法用氨和次氯酸钠反应制备肼,并探究肼的性质。制备装置如下图所示。
已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)装置A试管中的试剂为_______,仪器a的作用是_______。
(2)装置B中制备肼的化学方程式为_______。
(3)装置C中仪器b的名称是_______,该仪器中导管的作用为_______。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是_______。
(5)①探究性质。取装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子反应方程式_______。
②测定产品中肼的质量分数。称取m g装置B中溶液,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定过程中指示剂可选用_______,滴定终点平均消耗标准溶液V mL,产品中肼质量分数的表达式为_______。
13.(2022·云南·一模)乙酸酐在有机合成工业中有广泛的应用。实验室利用如下方法制备少量乙酸酐。实验原理(反应1、反应2已配平):
反应1:CH3COOH+SOCl2→CH3COC1+X↑+Y↑ ΔH<0
反应2:CH3COC1+CH3COOH→(CH3CO)2O+HC1↑ ΔH<0
已知:有关物质的部分信息如下。
物质 沸点/℃ 相对分子质量 理化性质
乙酸(CH3COOH) 118 60 易溶于水和有机溶剂
二氯亚砜(SOCl2) 79 119 遇水水解,受热易分解
乙酰氯(CH3COCl) 51 78.5 遇水或乙醇剧烈分解
乙酸酐[(CH3CO)2O] 139.6 102 遇水形成乙酸,易溶于有机溶剂
实验步骤:
I.将21.0g冰醋酸加入到三颈烧瓶中,再分批缓慢加入21.0gSOCl2,控制反应温度35℃,搅拌回流2小时。
II.将三颈烧瓶中的混合物转移至另一烧瓶中,提纯,收集到较纯的乙酸酐12.0g(其中乙酸酐占90.0%)。
实验装置如图所示:
回答下列问题:
(1)仪器c的名称是___________,冷凝管的进水口是___________(填字母)。
(2)反应1生成的X和Y均为酸性气体,其化学式为___________和___________。
(3)步骤I中,控制反应温度在35℃左右,不宜过高的原因是___________。
(4)c中盛放无水氯化钙,主要作用是___________,d中盛放的试剂是___________。
(5)步骤II中,从混合物中提纯乙酸酐应采取的操作名称是___________。
(6)该方法制得乙酸酐的产率是___________%(保留1位小数)。
14.(2022·陕西·西安中学三模)据古籍记载,焙烧绿矾()矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如图所示。
回答下列问题:
(1)证明该样品未变质的实验操作和现象是_______。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式_______。
(3)装置中冷水的作用是_______。
(4)为防止倒吸,停止实验时应进行的操作是_______。
(5)用滴定法测定绿矾的纯度。称取绿矾样品,配制成溶液,量取待测液于锥形瓶中,用酸性溶液滴定,反应消耗酸性溶液体积的平均值为。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、_______。
②该实验滴定终点时的现象为_______。
③该绿矾样品中的质量分数为_______(计算结果保留3位有效数字)。
15.(2022·辽宁·东北育才学校三模)过氧化钙(CaO2)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30%H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
(1)第②步反应的化学方程式为_______。
(2)检验CaO2·8H2O是否洗净的方法是:_______。
(3)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是_______、_______。
(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取0.1g CaO2产品于锥形瓶中,加入30 mL蒸馏水和10mL 2 mol·L-1 HCl,完全溶解后加入几滴0.1mol·L-1 MnSO4溶液,用0.02mol·L-1 KMnO4标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
试验次数 一 二 三
V(KMnO4)/mL 23.02 23.05 23.04
①滴定的终点现象是_______。
②滴定过程中加入标准溶液发生反应的离子方程式为_______,过氧化钙的质量分数为_______(保留两位有效数字)。
16.(2022·上海·模拟预测)1,2-二氯乙烷(CH2ClCH2Cl)是重要的有机化工原料,不溶于水,常用作有机溶剂,沸点83.6°C,实验室可用“乙烯液相直接氯化法”来制备:
C2H5OHCH2=CH2↑+H2O
Cl2(g)+CH2=CH2(g)→CH2ClCH2Cl(l) H<0
(1)关于乙装置及其中的反应填空:
①仪器A的名称:_______。
②乙装置控制反应温度在50℃~70℃(加热装置已省略),控制在此温度范围的原因:_______。
③乙装置在通入气体前,加入适量的二氯乙烷,其作用是 _______。
④若反应气(Cl2和CH2=CH2)中混有水,则可能发生的化学反应方程式为 _______。
(2)根据实验原理,该装置的连接顺序为:a→_______→bc←_______←j(按接口顺序连接,装置可重复使用)。
(3)产品提纯:由于有副反应存在,该方法获得的1,2-二氯乙烷(CH2ClCH2Cl)还含有少量的多氯化物和HCl。下列提纯操作的顺序是:用水洗涤,静置,分去水层;_______(填序号);干燥 ;精馏。
① 蒸馏脱去大部分水,获得共沸物
② 加碱闪蒸除去酸性物质及部分高沸物
③ 用水洗涤余碱至中性
④ 将馏分静置、分液
(4)产品纯度的测定:量取5.0mL产品,密度为0.44g·mL-1,加足量稀NaOH水溶液,加热充分反应得到250mL水解液。取25.00mL水解液先用稀硝酸中和至酸性,然后加入过量的50.00mL0.1000mol/LAgNO3溶液,充分反应后再加入硝基苯,用力摇动。用0.1000mol/LNH4SCN标准液滴定过量的AgNO3溶液,重复实验三次,平均消耗标准液10.00mL。已知:Ag++SCN-=AgSCN↓(白色沉淀),Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
①滴定时,应选用的指示剂为_______(填标号)。
A.FeSO4 B.FeCl3 C.Fe(NO3)3 D.甲基橙
②产品中1,2-二氯乙烷的纯度为_______%。
③实验中加入硝基苯的作用是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)稀H2SO4
(2)打开
(3)待装置A中反应一段时间后关闭止水夹a,产生的H2将FeSO4溶液压入B中(NH4)2SO4与进行反应
(4) FeSO4+H2C2O4+2H2OFeC2O4·2H2O↓+H2SO4 草酸钠溶液呈碱性,使得Fe2+易被氧气氧化,降低了二水合草酸亚铁的产率
(5) % 偏高
【解析】
(1)
由制备FeC2O4·2H2O的流程图可知A中分液漏斗中的药品稀H2SO4;
(2)
实验开始时先将止水夹a打开使产生的H2将装置A和B中的空气排空,避免Fe2+被空气中的O2氧化;
(3)
待装置A中反应一段时间后关闭止水夹a,产生的H2将FeSO4溶液压入B中(NH4)2SO4与进行反应;
(4)
FeSO4+H2C2O4+2H2OFeC2O4·2H2O↓+H2SO4;草酸钠溶液呈碱性,使得Fe2+易被氧气氧化,降低了二水合草酸亚铁的产率;
2.(1)隔绝氧气,防止Fe2+被氧化
(2)打开K2、关闭K3
(3)Fe2++2HCO= FeCO3↓+ H2O+CO2↑
(4)4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2
(5) 温度为70℃、pH=5 pH较低时不利于FeCO3固体溶解生成Fe2+,pH较高时Fe2+会形成沉淀,产率都会减小
(6) A 93.6%
【解析】亚铁离子易被氧气氧化,制备过程应在无氧环境中进行,装置A用废铁屑和稀硫酸反应生成FeSO4和氢气,利用产生的氢气排尽装置内空气,且使装置A内气压增大,将制备的硫酸亚铁溶液压入装置B内,与NH4HCO3反应制备FeCO3,反应的离子方程式为:Fe2++2HCO= FeCO3↓+ H2O+CO2↑;
(1)
试管B中用FeSO4和NH4HCO3制备FeCO3,由于亚铁离子易被氧化,则植物油的作用是隔绝氧气,防止Fe2+被氧化;
(2)
装置A中用废铁屑和稀硫酸反应生成FeSO4和氢气,可利用压强差将A中生成的FeSO4溶液通过导管压至试管B内,操作是打开K2、关闭K3;
(3)
用FeSO4和NH4HCO3制备FeCO3,反应的离子方程式为:Fe2++2HCO= FeCO3↓+ H2O+CO2↑;
(4)
久置后,FeCO3试剂瓶的瓶口有红褐色物质即Fe(OH)3,是FeCO3被氧气氧化生成Fe(OH)3,反应的方程式为:4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2;
(5)
由图知温度为70℃、pH=5时乳酸亚铁产率最大,为适宜的反应条件;溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是:pH较低时不利于FeCO3固体溶解生成Fe2+,pH较高时Fe2+会形成沉淀,产率都会减小;
(6)
已知反应中Ce元素被还原为Ce3+,则(NH4)4Ce(SO4)4做氧化剂,具有氧化性,(NH4)4Ce(SO4)4标准溶液装入酸式滴定管,即选:A;(NH4)4Ce(SO4)4中Ce为+4价,被还原为Ce3+则Ce元素得到一个电子,Fe2+被氧化为Fe3+则Fe元素失去一个电子,则n(Fe2+)= n[(NH4)4Ce(SO4)4]=cV=0.1000mol/L×30.00×10-3L=3×10-3mol,则3.0g样品中乳酸亚铁质量为m=nM=3×10-3mol234g/mol=2.808g,纯度为。
3.(1) afg(或gf)debch 吸收N2O中混有的HNO3和水蒸气 SnCl2+N2O+(x+1)H2O=SnO2·xH2O↓+N2+2HCl 继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞 防止E中液体倒吸入B中
(2) 蒸馏烧瓶 ClO-+2+H2O=Cl-+3N2↑+2OH- 平衡压强、使液体容易流下;减小测定气体体积时的误差 ×100%
【解析】根据反应原理,利用盐酸与混合液中加入稀硝酸反应产生一氧化二氮,利用D中的碱石灰吸收N2O中混有的HNO3和水蒸气,进入装置C中与NaNH2反应制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理,进而对产品的纯度进行探究。
(1)
①由实验目的和原理知,A用于制备N2O,D用于吸收N2O中混有的HNO3和水蒸气,C用于制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理。则按气流方向,上述装置合理的连接顺序为afg(或gf)debch;
②D的作用为吸收N2O中混有的HNO3和水蒸气;
③由信息,N2O有强氧化性,故E中生成SnO2·xH2O沉淀的化学方程式为SnCl2+N2O+(x+1)H2O=SnO2·xH2O↓+N2+2HCl;
④C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞;
(2)
①由装置图知,仪器F的名称为蒸馏烧瓶;其中发生NaClO与NaN3生成N2的反应,离子方程式为ClO-+2+H2O=Cl-+3N2↑+2OH-;
②管q可以平衡压强、使液体容易流下和减小测定气体体积时误差的作用。
③由数据信息知,生成N2体积为(V1-V2)mL,由关系式2NaN3~3N2列式得产品中NaN3的质量分数为×100%=×100%。
4.(1)C
(2)分离出反应生成的水,促使平衡正向移动,提高产率
(3)除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度
(4) B 碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生
(5)70%
(6)
【解析】44.4g肉桂酸、25mL无水乙醇和25mL环己烷,3mL浓硫酸混合加热,肉桂酸乙酯沸点较高,在有碳碳双键的存在的情况下,高温易发生副反应,采用减压蒸馏可以降低沸点,在较低的温度下进行蒸馏,减少副反应的发生,提高产率,反应中乙醇过量,按44.4g肉桂酸计算理论产量,计算产率;肉桂酸乙酯与氢氧化钠发生水解反应,反应比例为1:1,过量的氢氧化钠与盐酸1:1反应,则n(肉桂酸乙酯)=,求解n(肉桂酸乙酯)后继续计算产率,滴定重点溶液变为碱性,使用酚酞作为指示剂。
(1)
蒸馏装置中,选用的冷凝管为直形冷凝管。故选C;故答案为:C;
(2)
本实验中,分水器的作用是分离出反应生成的水,促使平衡正向移动,提高产率。故答案为:分离出反应生成的水,促使平衡正向移动,提高产率;
(3)
步骤③加入碳酸钠粉末的作用是除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度。故答案为:除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度;
(4)
A.除去有机层中的水,使用浓硫酸不能过滤分离,故A不选;B.无水氯化钙,能干燥,可通过过滤分离,故B选; C.氧化钙与水反应生成氢氧化钙,促进酯水解,故C不选; D.氢氧化钠是碱能促进酯水解,故D不选;故选B。采用减压蒸馏的原因是碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生。故答案为:B;碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生;
(5)
产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L 1的盐酸滴定,消耗盐酸的体积为V mL,肉桂酸乙酯的物质的量为 , =该样品的纯度为(用代数式表示,无需化简)。故答案为:。
5.(1) 冰水浴 (球形)干燥管
(2)吸收CO
(3)
(4)
(5) 覆盖AgCl,避免AgCl转化成AgSCN 滴入最后一滴(或半滴)KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色
(6) 偏低
【解析】
装置A中浓盐酸与K2Cr2O7反应制备氯气,装置B中的浓硫酸除去氯气中的水蒸气,干燥的氯气通入装置C中与B2O3、C加热条件下反应生成和CO,的熔点为-107.3℃,沸点为12.5℃,装置D中冰水浴收集,氯气、一氧化碳有毒,会污染环境,装置E中碱石灰用于吸收氯气并防止装置F中的水蒸气进入装置D中使水解,装置F用于吸收一氧化碳。
(1)
的熔点为-107.3℃,沸点为12.5℃,应选择冰水浴冷凝三氯化硼,装碱石灰的仪器为:(球形)干燥管。
(2)
一氧化碳有毒,会污染环境,装置F用于吸收一氧化碳。
(3)
装置A中浓盐酸与K2Cr2O7反应制备氯气,A装置中还原产物为,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为:。
(4)
极易水解产生[或]和HCl,在乙醇中剧烈反应生成硼酸酯和“白雾”,与在水中发生水解相似,则在乙醇中反应生成和HCl,反应的化学方程式为:。
(5)
已知:,因此步骤③加入硝基苯的目的是:覆盖AgCl,避免AgCl转化成AgSCN,使滴定终点不准确;根据滴定原理,当KSCN标准液将过量的硝酸银溶液反应完,就会与氯化铁反应显红色,因此滴定终点时的现象是:当滴入最后一滴(或半滴)KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色。
(6)
根据离子反应可知:n(Ag+)=n(Cl-)+n(SCN-),25.0mL溶液中含n(Cl-)=n(Ag+)-n(SCN-)=c1V110-3mol-c2V210-3mol,则wg产品中的质量分数为;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,则KSCN溶液浓度偏低,测得的过量的硝酸银的含量偏高,算得的转化为氯化银的硝酸银的含量偏低,测得产品中的质量分数偏低。
6.(1) 恒压滴液漏斗 饱和碳酸氢钠溶液 浓硫酸
(2)Ⅳ
(3)可能是未反应完的使澄清石灰水变浑浊
(4)缺少尾气处理装置
(5) 做保护气,防止金属单质被氧化
(6)
【解析】
装置I中稀盐酸和碳酸钙反应生成二氧化碳,装置II中盛放饱和碳酸氢钠溶液除去二氧化碳中的氯化氢,装置III中盛放浓硫酸除去二氧化碳中的水,纯净、干燥的二氧化碳通入装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,一氧化碳在装置V中与MoO3反应制备Mo,装置VI中盛放澄清石灰水检验二氧化碳,但石灰水变浑浊也不能说明装置Ⅴ中被CO还原,有可能是未反应完的使澄清石灰水变浑浊,一氧化碳有毒,最后要进行尾气处理。
(1)
装置①的名称是:恒压滴液漏斗,由分析可知,装置II中盛放饱和碳酸氢钠溶液除去二氧化碳中的氯化氢,装置III中盛放浓硫酸除去二氧化碳中的水。
(2)
装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,一氧化碳在装置V中与MoO3反应制备Mo,应先制备一氧化碳,因此应先点燃装置IV处酒精灯。
(3)
装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,但二氧化碳可能未反应完,也能使装置VI中澄清石灰水变浑浊,因此不能说明装置Ⅴ中被CO还原。
(4)
一氧化碳有毒,排放到空气中会污染空气,要进行尾气处理,因此装置的缺陷是:缺少尾气处理装置。
(5)
由题意和装置图可知,二硫化钼在阴极得电子生成单质Mo,电极反应式为:,液态锌以及生成的单质钼容易被氧气氧化,氩气的作用是:做保护气,防止金属单质被氧化。
(6)
已知:<,所以先沉淀的是硫酸钡,当开始沉淀时,硫酸钡已经沉淀完全,所以溶液对于两种沉淀来说都是饱和溶液,其中的离子浓度都符合沉淀的Ksp表达式:===≈。
7.(1) 3Cu2S+16H++10NO6Cu2++3+10NO↑+8H2O 将生成的NO气体转化为硝酸,减小硝酸的消耗 鼓入O2气体不再出现红棕色 将硫酸银转化为更难溶的氯化银沉淀,将溶液中Ag+除尽
(2)6.5<pH<7.5
(3) 边搅拌边加入25mL0.5mol·L-1CuSO4溶液,在pH计测定溶液pH条件下,用0.1mol·L-1NaOH溶液或0.1mol·L-1盐酸调节溶液pH约为9,充分反应后,过滤,洗涤沉淀至最后一次洗涤滤液滴加BaCl2溶液无沉淀生成 pH过大,反应生成了Cu(OH)2沉淀,Cu(OH)2的Cu元素含量高于Cu2(OH)2CO3
【解析】
整个实验过程分为三步:
第一步浸取,目的是让铜渣和混合酸反应,使铜渣溶解,得到以硫酸铜为主的混合溶液,为了充分利用稀硝酸,在反应过程中不时的通入氧气,使生成的NO气体转化为硝酸,减小硝酸的消耗。由于杂质也能被硝酸溶解氧化,为了能把反应后溶液中的Ag+完全除去,在反应后的溶液中,加入少量,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,以除去银离子。
第二步制取硫酸铜,反应过程中,杂质也会被氧化溶解,生成硫酸盐,因此第一步过滤后的溶液中还含有反应生成的硫酸锰,利用Cu(OH)2和Mn(OH)2的溶度积差异,通过向滤液中加入溶液调节控制溶液的值,使Cu2+离子完全转化为Cu(OH)2沉淀,实现、Cu2+分离,过滤得到Cu(OH)2,然后和稀硫酸反应得到溶液。
第三步制备,通过图2可知,与的比值是1.2和溶液pH=9时,的产率最高,据此分析解答。
(1)
①渣铜被酸浸取时无S和SO2生成,说明杂质中的硫离子被硝酸氧化成硫酸,反应的化学方程式是Cu2S+3H2SO4+10HNO36CuSO4+10NO↑+8H2O,则其反应的离子方程式是3Cu2S+16H++10NO6Cu2++3+10NO↑+8H2O。
②由于硝酸被还原时生成了NO气体,为了充分利用硝酸,可向反应装置中不时的通入氧气,使其转化为硝酸,提高硝酸的利用率。
③当鼓入O2后,装置中气体不再出现红棕色,说明装置中就没有NO气体了,此时可停止鼓入O2。
④经分析,杂质也能被硝酸溶解氧化,为了能把反应后的溶液中Ag+完全除去,可利用氯化银比硫酸银的溶度积更小,在反应后的溶液中,加入少量,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,以除去银离子。
(2)
经分析,为了使滤液中的、Cu2+分开,可利用Cu(OH)2和Mn(OH)2的溶度积差异,通过向滤液中加入溶液调节控制溶液的值,使Cu2+离子完全转化为Cu(OH)2沉淀,以实现两种离子分开。题目假设、Cu2+开始沉淀时,沉淀完全时,为了使Cu2+完全沉淀,则根据,解得溶液中的c(OH-)的浓度是110-7.5,即pH=6.5时, Cu2+完全沉淀,同理,根据,可得开始沉淀时的 c(OH-)=,即pH=7.5时,开始沉淀,则为了使Cu2+完全沉淀,而不沉淀,则向滤液中加入溶液调节范围应为6.5<pH<7.5。
(3)
①通过图2可知,与的比值是1.2和溶液pH=9时,的产率最高。若向烧杯中加入溶液,根据与的比值是1.2,可得关系式 V0.5mol·L-11.2=30ml0.5mol·L-1,解得V=25ml,则还需向烧杯中加入25mL0.5mol·L-1CuSO4溶液,为了使溶液的pH=9,还需通过提供的pH计测定溶液pH,用0.1mol·L-1NaOH溶液或0.1mol·L-1盐酸调节溶液pH约为9,才能使的产率最高。沉淀是否洗涤干净,可检验沉淀是否还附有硫酸根离子,故沉淀后过滤、洗涤,洗涤沉淀至最后一次洗涤滤液滴加BaCl2溶液无沉淀生成。
②若反应时溶液pH过大,根据图2可知的产率偏低,沉淀中含有Cu(OH)2沉淀,而Cu(OH)2中铜元素的质量分数大于,故反应时溶液pH过大,所得的产率偏低,但Cu元素含量偏大。
8.(1) 平衡压强,使液体能顺利流下 A
(2) 温度过低葡萄糖酸锌会析出,且反应速率较慢,温度过高葡萄糖酸锌容易分解 水浴加热
(3)Ca(C6H11O7)2+ ZnSO4= Zn(C6H11O7)2+CaSO4↓
(4)ECDAB
(5) 滴入最后一滴标准液后, 溶液恰好由蓝色变为酒红色,且保持半分钟不变色
【解析】
(1)
图中带支管的装置为恒压分液漏斗,支管的作用为平衡压强,使液体能顺利流下;X装置为冷凝回流装置,应该选用球形冷凝管,冷凝水流向为下进上出,故选A;
(2)
根据题中信息,葡萄糖酸锌易溶于热水,温度低时反应速率慢,且易析出;温度高于100oC葡萄糖酸锌开始分解,故温度过低葡萄糖酸锌会析出,且反应速率较慢,温度过高葡萄糖酸锌容易分解,因此反应控制温度在90°C左右,采用水浴加热方式;
(3)
三颈烧瓶中是利用硫酸锌和葡萄糖酸钙制备葡萄糖酸锌,化学方程式为:Ca(C6H11O7)2+ ZnSO4= Zn(C6H11O7)2+CaSO4↓;
(4)
葡萄糖酸锌易溶于热水,故先将葡萄糖酸锌溶于沸水中,后趁热过滤除去不溶物;降低温度同时加入乙醇溶液,葡萄糖酸锌溶解度降低,晶体析出,减压过滤后在低温下烘干,防止葡萄糖酸锌受热分解,故正确的顺序为:ECDAB;
(5)
整个滴定过程中EDTA与锌离子反应,锌离子来源为两部分:一部分来自产品配成的溶液,另一部分为锌离子标准溶液。开始滴定时溶液中成分为Zn-EDTA(无色)、EDTA、EBT,故溶液颜色为蓝色;用锌离子标准溶液滴定时,到达滴定终点会生成Zn-EBT(酒红色),即到终点颜色变化为蓝色变为酒红色。到达滴定终点的现象为:滴入最后一滴标准液后,溶液恰好由蓝色变为酒红色,且保持半分钟不变色;
Zn2++EDTA=Zn-EDTA,可找到关系式:
,
即25mL溶液中 ,100mL样品中,样品的纯度为:。
9.(1)分液漏斗
(2) 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 吸收SO2等气体,防止污染空气
(3)使生成的S与反应物充分混合,提高产率
(4)S2O+2H+=S↓+SO2↑+H2O
(5)蒸发浓缩、冷却结晶
(6) 溶液由无色变为蓝色,且半分钟内不褪色即达到滴定终点 94.24%
【解析】
将装置A中利用浓硫酸和Na2SO3固体反应生成的SO2气体通入到盛有Na2S和Na2CO3混合溶液的锥形瓶中,在搅拌的条件下反应生成Na2S2O3,装置C的作用是尾气处理,待完全反应后将B中溶液蒸发浓缩、冷却结晶即可获得Na2S2O3 5H2O。
(1)
仪器a的名称是分液漏斗,
故答案为:分液漏斗;
(2)
Na2S和Na2CO3按物质的量之比2:1混合,通入SO2气体后锥形瓶中生成Na2S2O3,同时有CO2气体生成,利用电子守恒配平得发生反应的化学方程式2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;C装置是最后一个装置,且在发生装置后的,根据反应后可能出来的气体判断,主要是防止污染空气,而污染性气体主要是二氧化硫,
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;吸收SO2等气体,防止污染空气;
(3)
搅拌的目的是增大接触面积,使反应更充分,根据浅黄色浑浊判断中间产物是硫单质,
故答案为:使生成的S与反应物充分混合,提高产率;
(4)
根据题目中硫代硫酸钠晶体在中性、碱性溶液中很稳定,在酸性条件下应该不稳定,易生成S和SO2,故pH不能小于7,发生反应的离子方程式为S2O+2H+=S↓+SO2↑+H2O,
故答案为:S2O+2H+=S↓+SO2↑+H2O;
(5)
将反应后的混合液过滤,从滤液中获得Na2S2O3 5H2O晶体的方法是蒸发浓缩、冷却结晶,再过滤、洗涤、干燥即可,
故答案为:蒸发浓缩、冷却结晶;
(6)
利用淀粉遇碘单质变蓝,当滴入最后1滴碘标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色即达到滴定终点;滴定过程中消耗0.100mol L﹣1的碘标准溶液9.50mL,含有I2的物质的量为0.100mol L﹣1×9.50×10-3L=0.95×10-3mol,根据关系式2S2O~I2可知n(S2O)=2×0.95×10﹣3mol=1.9×10-3mol,则样品的纯度为=94.24%,
故答案为:94.24%。
10.(1)三颈烧瓶
(2) 水浴加热 通入氮气,加入异抗坏血酸
(3)CD
(4) FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O pH过低使产率下降的原因是H+会与H2NCH2COOH中的氨基反应;pH过高会生产沉淀
(5)降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率
(6)85.3
【解析】
本题实验目的是制备甘氨酸亚铁,实验原理是FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O,把握题中所给信息,同时制备过程中不能引入新的杂质,据此分析;
(1)
根据图示,合成装置中仪器b为三颈烧瓶,故答案为:三颈烧瓶;
(2)
步骤Ⅱ加热的温度为50℃,可采取水浴加热的方法,甘氨酸饱和溶液中通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌可以加快化学反应速率,同时除去溶液中溶解的氧气,加入异抗坏血酸,异抗坏血酸介于弱酸性和强还原性,都能防止亚铁离子被氧气氧化,故答案为:水浴加热;通入氮气,加入异抗坏血酸;
(3)
A.装置中使用的是恒压滴液漏斗,滴入液体前,无需打开滴液漏斗a的上口玻璃塞,故A错误;
B.FeSO4 7H2O易溶于水,难溶于乙醇,在加入乙醇析出甘氨酸亚铁时会混入杂质,而FeCl2 4H2O易溶于乙醇,不会引入杂质,因此亚铁盐应选用FeCl2 4H2O,故B错误;
C.加入乙醇析出甘氨酸亚铁,步骤Ⅲ为分离液体和固体的操作,分离方法是过滤,故C正确;
D.步骤Ⅳ中,用蒸馏水洗涤除去乙醇,得到纯净的甘氨酸亚铁,甘氨酸亚铁容易被氧化,因此干燥过程最好选用真空干燥,故D正确;
故答案为:CD;
(4)
合成合成甘氨酸亚铁的反应物是H2NCH2COOH、氢氧化钠和FeCl2 4H2O,化学方程式为FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O,pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀,因此合成过程需控制pH=5.5,故答案为:FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O;pH过低使产率下降的原因是H+会与H2NCH2COOH中的氨基反应:pH过高会生产沉淀;
(5)
甘氨酸亚铁易溶于水,难溶于乙醇,步骤Ⅲ加入无水乙醇,降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;同时除去杂质,提高甘氨酸亚铁的产率和纯度,故答案为:降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率;
(6)
甘氨酸的投料量为20g,甘氨酸的物质的量n==mol,生成n[(NH2CH2COO)2Fe]=mol,理论的产量为mol×204g/mol=27.2g,产率为×100%=×100%≈85.3%,故答案为:85.3。
11.(1) 启普发生器 关闭
(2)a→g→f→b→c→d→e→b→c
(3) 快
(4)AD
(5) B
【解析】
由实验装置图可知,装置A中锌粒与稀硫酸反应制备氢气,由于锌粒含有硫化亚铁,硫化亚铁与稀硫酸反应生成的硫化氢气体会混入制得的氢气中,装置D中盛有的硫酸铜溶液用于除去硫化氢气体,装置B中盛有的浓硫酸用于干燥氢气,装置C中氢气与硫酸锂与氢气共热反应制备硫化锂,为防止空气中氧气进入C中导致硫化锂被氧化,装置C后应连接一个B装置,防止空气中的氧气加入,则装置的连接顺序为ADBCB,导管口连接顺序为a→g→f→b→c→d→e→b→c,该装置的设计缺陷是没有氢气的尾气处理装置。
(1)
由实验装置图可知,装置A为启普发生器,实验时关闭活塞K,用反应生成的氢气增大装置中的压强,使液面与锌粒脱离就能停止装置A中反应,故答案为:启普发生器;关闭;
(2)
由分析可知,气流从左至右,导管口连接顺序是a→g→f→b→c→d→e→b→c,故答案为:a→g→f→b→c→d→e→b→c;
(3)
原电池反应能加快锌粒与稀硫酸的反应,粗锌中含有的铜能与锌在稀硫酸中构成原电池,使反应速率快于纯锌与稀硫酸的反应;由分析可知,装置D中盛有的硫酸铜溶液用于除去硫化氢气体,反应的离子方程式为,故答案为:快于;;
(4)
A.由锌粒的成分可知,实验完毕后,装置A中可能得到含有铜、锌、硫酸锌、硫酸亚铁的混合物,在加热条件下过滤混合物,可以增大硫酸锌在溶液中的溶解度,避免析出七水硫酸锌,故正确;
B.由锌粒的成分可知,实验完毕后,装置A中可能得到含有铜、锌、硫酸锌、硫酸亚铁的混合物,在加热条件下过滤混合物,可以除去铜和未反应的锌,故错误;
C.铜与稀硫酸不反应,则制得的七水硫酸锌中不可能含有胆矾,故错误;
D.用抽滤的方法得到粗皓矾可以加快过滤得速率,防止七水硫酸锌溶解造成产率降低,故正确;
故选AD;
(5)
①由实验Ⅱ可知,制得的硫化锂中混有未反应的硫酸锂,故答案为:;B;
②设样品中硫化锂为amol、亚硫酸锂为bmol,由样品的质量可得:46a+94b=W,由消耗稀硫酸的体积可得:a+b=(c1×10—3V1—×c2×10—3V2),解得a=,则硫化锂的质量分数为,故答案为:。
12.(1) 氯化铵和氢氧化钙固体 导气,防止倒吸
(2)
(3) 滴液恒压漏斗 平衡气压,使浓盐酸顺利滴下
(4)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(5) 淀粉溶液
【解析】
实验室模拟拉希法用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,装置C为生成氯气装置,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠再和氨生成肼;
(1)
实验室模拟拉希法用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,且反应为固体加热反应,则试管中的试剂为氯化铵和氢氧化钙固体,两者反应生成氨气和氯化钙、水;氨气极易溶于水,仪器a的作用是将氨气通入装置B中,且球形部分可以防止倒吸;
(2)
装置B中氨和次氯酸钠反应生成肼,氮元素化合价升高,次氯酸具有氧化性则氯元素化合价降低生成氯化钠,;
(3)
装置C中仪器b的名称是滴液恒压漏斗,该仪器中导管的作用为平衡漏斗与烧瓶中气压,使浓盐酸顺利滴下;
(4)
装置C反应生成氯气,浓盐酸具有挥发性,导致氯气不纯,氯化氢会和装置B中氢氧化钠溶液反应,导致肼的产率降低,改进方法是在装置B、C之间加装盛有饱和食盐水的洗气瓶,除去氯化氢气体;
(5)
①已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水;装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,则反应为肼和稀硫酸生成硫酸肼晶体:;
②碘溶液能使淀粉变蓝色,故滴定过程中指示剂可选用淀粉溶液;
滴定过程中有无色无味无毒气体产生,碘具有氧化性,则碘和肼发生氧化还原反应生成碘离子和氮气,根据电子守恒可知,2I2~4e-~N2H4,则产品中的质量为,质量分数的表达式为。
13.(1) 球形干燥管 a
(2) SO2 HCl
(3)温度过高则冰醋酸、二氯亚砜会挥发且二氯亚砜会分解,导致产品产率降低
(4) 做干燥剂,防止空气中水进入装置 氢氧化钠溶液
(5)蒸馏
(6)60.5
【解析】
冰醋酸加入到三颈烧瓶中,再分批缓慢加入SOCl2,水浴加热控制反应温度35℃,搅拌回流2小时,反应生成乙酸酐,利用各物质沸点不同,进行蒸馏分离提纯得到较纯乙酸酐,通过计算可求理论产品质量,然后通过实际质量求出产品产率。
(1)
仪器c的名称是球形干燥管;冷凝管的进水方向为下进上出,进水口是a;
(2)
反应1:CH3COOH+SOCl2→CH3COCl+X↑+Y↑,根据质量守恒可知,生成气体为二氧化硫、氯化氢气体,化学式为SO2、HCl;
(3)
冰醋酸沸点为118℃,SOCl2沸点为79℃且受热易分解,控制反应温度在35℃左右,不宜过高,温度过高则冰醋酸、二氯亚砜会挥发且二氯亚砜会分解,导致产品产率降低;
(4)
反应物中二氯亚砜遇水水解、生成物中乙酰氯遇水或乙醇剧烈分解,c中盛放无水氯化钙,无水氯化钙可以做干燥剂,防止空气中水进入装置;反应生成二氧化硫气体有毒会污染空气,d中盛放的试剂是氢氧化钠,氢氧化钠可以吸收二氧化硫减少污染;
(5)
由图表信息可知,四种物质的沸点不同,则步骤II中从混合物中提纯乙酸酐应采取的操作为蒸馏提纯;
(6)
由反应:CH3COOH+SOCl2→CH3COCl+X↑+Y↑、CH3COCl+CH3COOH→(CH3CO)2O+HCl↑,可知2CH3COOH~SOCl2~(CH3CO)2O;21.0g CH3COOH的物质的量为21.0g÷60g/mol=0.35mol,21.0gSOCl2的物质的量为21.0g÷119g/mol≈0.176mol,0.176×2>0.35,则CH3COOH量不足,完全反应理论上生成(CH3CO)2O的质量为0.35mol÷2×102g/mol=17.85g,故该方法制得乙酸酐的产率是 。
14.(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,无明显现象,证明该样品未变质
(2)
(3)水和三氧化硫的反应是放热反应,降低温度有利于三氧化硫的吸收
(4)熄灭酒精喷灯,继续通入空气至冷却到室温
(5) 250mL容量瓶、胶头滴管 溶液的颜色变为浅红色 97.5%
【解析】
(1)
若该样品变质,会含有Fe3+,Fe3+与KSCN发生络合反应生成血红色的氰化铁,因此在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,无明显现象,再向试管中加入适量氯水(或双氧水),溶液变血红色,说明该样品未变质;
(2)
通入空气焙烧绿矾,绿矾中的Fe2+元素被氧化成Fe3+,根据氧化还原的规律可知,只有S元素的化合价能够升高,因此绿矾充分焙烧的过程中生成的酸性气体为SO3,则焙烧绿矾的化学方程式为;
(3)
H2O和SO3的反应是放热反应,降低温度有利于三氧化硫的吸收,装置B中冷水的作用是:将SO3和水蒸气冷凝,有利于SO3被水吸收生成H2SO4;
(4)
为防止倒吸,应先熄灭酒精喷灯,冷却后再停止通空气,具体操作是:熄灭酒精喷灯,继续通入空气至冷却到室温;
(5)
①用固体配制一定物质的量浓度溶液时的步骤是:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所需要的玻璃仪器为:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
②达到滴定终点时,滴入的KMnO4恰好被消耗完,因此当滴入最后一滴KMnO4溶液时,溶液变成粉(浅)红色且半分钟内无变化,说明达到滴定终点;
③滴定过程中有关系式:,设25.00mL待测液中含有的绿矾晶体的物质的量为x mol,根据得失电子数守恒可知,故样品中的质量分数为。
15.(1)
(2)取少量最后一次洗涤液,加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,若产生白色沉淀就证明没有洗涤干净,否则洗涤干净
(3) 通入氧气能抑制过氧化钙分解 防止过氧化钙与二氧化碳反应
(4) 滴入最后半滴标准溶液时溶液变粉红色,且30秒不褪色 83%
【解析】
制取CaO2的过程是:在NH4Cl溶液中加入Ca(OH)2,两者反应生成CaCl2和NH3·H2O,不断搅拌的同时加入30%H2O2,反应生成CaO2·8H2O沉淀,经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)
加入的30%H2O2和CaCl2、NH3 H2O反应生成CaO2·8H2O沉淀,同时还生成NH4Cl,反应的化学方程式为:CaCl2+H2O2+2NH3 H2O+6H2O=CaO2 8H2O↓+2NH4Cl。
(2)
CaO2·8H2O沉淀是从含有Cl-的溶液中过滤出来的,检验CaO2·8H2O是否洗净可以检验最后一次洗涤液中是否含有Cl-,操作是:取少量最后一次洗涤液,加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,若产生白色沉淀就证明没有洗涤干净,否则洗涤干净。
(3)
CaO2在350℃迅速分解生成CaO和O2,CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,一方面是通入的氧气能抑制过氧化钙分解,另一方面是可以防止过氧化钙与二氧化碳反应。
(4)
①KMnO4溶液是紫红色的,当溶液中含有H2O2时,滴入的KMnO4溶液被还原为Mn2+,溶液是无色的,当H2O2被消耗完,再滴入KMnO4溶液时,KMnO4溶液的颜色不褪去,所以滴定终点的现象是:滴入最后半滴标准溶液时溶液变粉红色,且30秒不褪色。
②CaO2和盐酸反应生成H2O2,H2O2和KMnO4溶液反应生成氧气和Mn2+,反应的离子方程式为:2+5H2O2+6H+=2Mn2++5O2↑+8H2O。根据三次实验得到的KMnO4溶液的体积,可以求出消耗的KMnO4溶液的体积的平均值为23.04mL,根据反应的方程式可计算CaO2的物质的量:n(CaO2)=5n(KMnO4)/2=23.04×10-3L×0.02mol/L×5÷2=1.152×10-3mol,则m(CaO2)=1.152×10-3mol×72g/mol=0.083g,则CaO2的质量分数为×100%=83%。
16.(1) 三颈烧瓶 防止CH2ClCH2Cl挥发 溶解Cl2和乙烯,促进气体反应物间的接触 ,
(2) fghi ihed
(3)②③①④
(4) C 90% 防止在滴加NH4SCN溶液时,AgCl沉淀转化为AgSCN沉淀
【解析】
(1)
①由图可知,装置A的名称为三颈烧瓶;
②根据题干信息可知,1,2-二氯乙烷的沸点为83.6°C,为了防止1,2-二氯乙烷挥发,乙装置应采用水浴加热的方式控制反应温度在50℃~70℃;
③乙装置在通入气体前,加入适量的1,2-二氯乙烷液体,其作用是溶解Cl2和乙烯,促进气体反应物间的接触;
④若反应气(Cl2和CH2=CH2)中混有水,Cl2和水会发生反应:, CH2=CH2和水会发生加成反应生成乙醇,反应的化学方程式为;
(2)
利用甲装置生成氯气,生成的氯气通过饱和食盐水除去HCl,经过浓硫酸干燥后通入装置乙,装置戊中加热乙醇得到乙烯,通过水除去挥发的乙醇,再经浓硫酸干燥后通入装置乙与氯气发生反应生成1,2-二氯乙烷,因此装置的连接顺序为a→f→g→h→i→bc←i←h←e←d←j。
(3)
由于有副反应存在,该方法获得的1,2-二氯乙烷(CH2ClCH2Cl)还含有少量的多氯化物和HCl,可通过以下操作提纯1,2-二氯乙烷:用水洗涤,静置,分去水层;加入碱性物质蒸除去酸性物质及部分高沸物,用水洗涤多余的碱,再蒸馏脱去水,得到共沸物,然后将馏分静置、分液、干燥后进行精馏,因此操作的顺序为②③①④;
(4)
①达到滴定终点时SCN-开始过量,SCN-与铁离子发生显色反应,应选择含铁离子的物质作为指示剂,由于氯化铁会影响后续氯离子测定,应使用Fe(NO3)3作为指示剂,故选C;
②量取5.0mL产品,密度为0.44g·mL-1,其质量为0.44 g mL-1×5.0 mL=2.2g,加足量稀NaOH溶液,发生的反应为,取25.00mL水解液先用稀硝酸中和至酸性,然后加入过量的50.00mL0.1000mol/LAgNO3溶液,发生反应,充分反应后再加入硝基苯,用力摇动,用0.1000mol/LNH4SCN标准液滴定过量的AgNO3溶液,重复实验三次,平均消耗标准液10.00mL,则25.00mL水解液中,所以产品中,根据氯原子守恒可知,,则产品1,2-二氯乙烷的纯度为;
③防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,因此实验中加入硝基苯的作用是防止在滴加NH4SCN溶液时,AgCl沉淀转化为AgSCN沉淀。
答案第1页,共2页
答案第1页,共2页
1.(2022·湖南永州·三模)以下是制备FeC2O4·2H2O的流程:
实验I:制备(NH4)2Fe(SO4)2·6H2O
(1)B中盛有一定量的(NH4)2SO4溶液,A中分液漏斗中的药品是____。
(2)实验开始时先将止水夹a____(填“打开”或“关闭”)。
(3)简述B中生成(NH4)2Fe(SO4)2的操作过程____。
实验II:制备FeC2O4·2H2O
已知:25℃时,当pH>4,Fe2+易被氧化。
(4)步骤①生成FeC2O4·2H2O的化学方程式为____,该步加入H2C2O4而不是Na2C2O4溶液的原因是____。
实验III:测定产品中铁元素的质量分数
产品中可能含有Fe2(C2O4)3、H2C2O4·2H2O杂质,为测定铁元素的含量,称取mg产品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃,再加入过量KMnO4溶液,充分反应后,向上述溶液中加入还原剂将Fe3+完全还原为Fe2+,再加入稀H2SO4酸化,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液VmL。
(5)铁元素的质量分数为____,若第一次滴入KMnO4溶液不足,则产品中铁元素含量____(填“偏高”或“偏低”)。
2.(2022·广西南宁·二模)[CH3CH(OH)COO]2Fe(乳酸亚铁)是一种广泛应用于食品的铁强化剂,可由乳酸与FeCO3反应制得。兴趣小组在实验室按下列步骤制备乳酸亚铁晶体并进行含量测定。回答下列问题:
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:
(1)植物油的作用是_______。
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是_______。
(3)该实验制备FeCO3的离子方程式为_______。
(4)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是_______(用化学方程式解释)。
Ⅱ.制备乳酸亚铁:
(5)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,则反应时适宜的加方式为_______;溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是_______。
Ⅲ.测定乳酸亚铁的纯度:
(6)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取3.0g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入_______中(填A或B),反复滴定2~3次,平均消耗(NH4)4Ce(SO4)4标准溶液30.00mL,则样品中乳酸亚铁的纯度为_______。
A.B.
3.(2022·河北·石家庄二中模拟预测)叠氮化钠(NaN3)是一种防腐剂和分析试剂,在有机合成和汽车行业也有重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
I.氨基钠(NaNH2)熔点为208℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸
II.2HNO3+8HCl+4SnCl2=4SnCl4+5H2O+N2O↑,2NaNH2+N2ONaN3+NaOH+NH3。
回答下列问题:
(1)制备NaN3
①按气流方向,上述装置合理的连接顺序为____(填仪器接口字母)。
②D的作用为____。
③实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为____。
④C处充分反应后,停止加热,需继续进行的操作为____,其目的为____。
(2)用如图所示装置测定产品纯度
①仪器F的名称为____;其中反应的离子方程式为____。
②管q的作用为____。
③若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VmL·mol-1,则产品中NaN3的质量分数为____。
4.(2022·湖南·雅礼中学一模)肉桂酸乙酯是高级防晒霜中必不可少的成分之一、由于其分子中存在碳碳双键,稳定性较差。研究肉桂酸乙酯的合成一直是热点,制备原理:
+CH3CH2OH+H2O
已知:Ⅰ.物理常数
有机物 相对分子质量 性状 熔点/℃ 沸点/℃ 密度/(g/mL) 溶解度
水 乙醇 乙醚
肉桂酸 148 白色晶体 135 300 1.25 微溶 溶 溶
肉桂酸乙酯 176 无色油状 12 271.5 1.05 不溶 溶 溶
Ⅱ.三元共沸物的组成和沸点
物质 水 乙醇 环己烷 共沸物
沸点/℃(1at) 100 78.3 80.8 62.6
质量分数/% 4.8 19.7 75.5 ----------
分水器内液体组成 上层 0.2 5.2 94.6 ---------------
下层 10.4 18.4 71.2
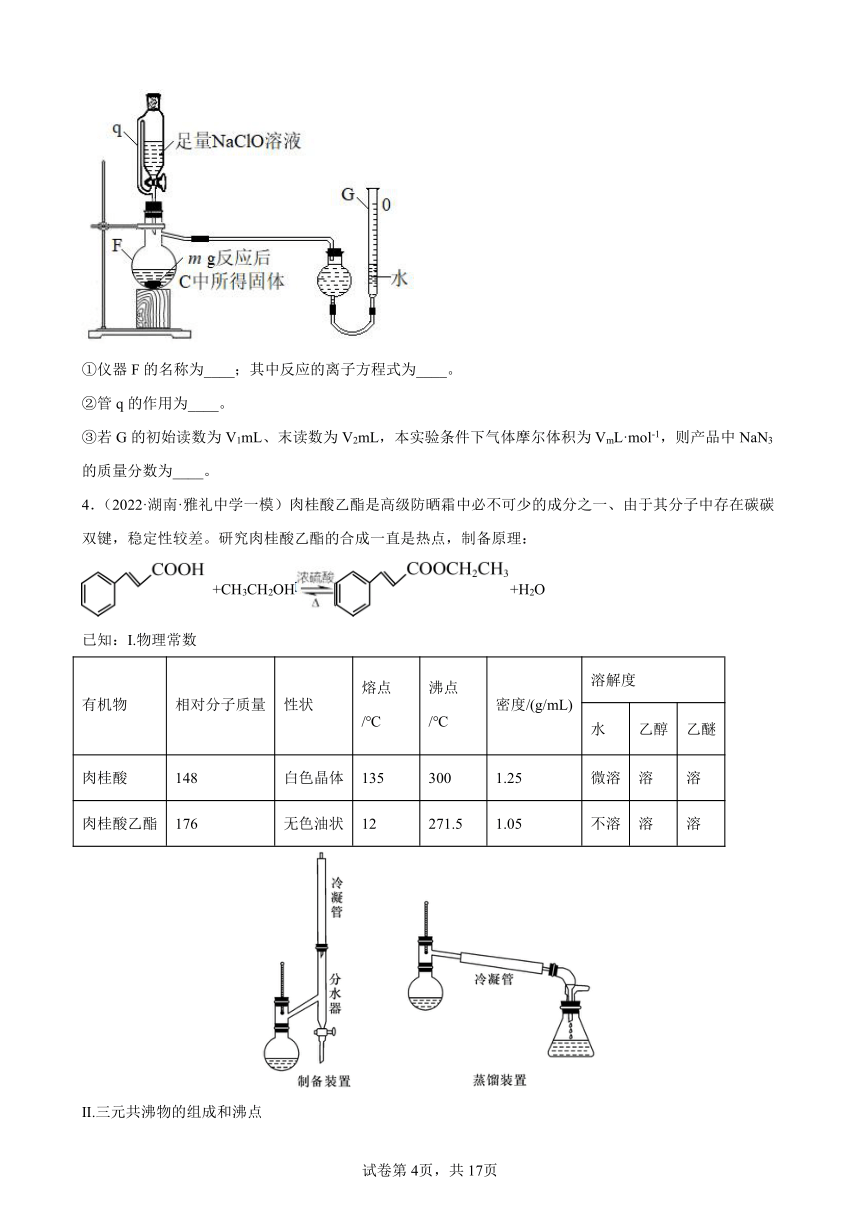
Ⅲ.实验步骤:
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层,过程中不断将上层液体流回圆底烧瓶,将下层液体放出;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤干燥,过滤;
⑥首先低温蒸出乙醚,再改用减压蒸馏(水浴加热即可)得到产品肉桂酸乙酯的体积为35.2mL。回答下列问题:
(1)蒸馏装置中,选用的冷凝管为_______(填标号)。
A.空气冷凝管 B.球形冷凝管 C.直形冷凝管 D.蛇形冷凝管
(2)本实验中,分水器的作用是_______。
(3)步骤③加入碳酸钠粉末的作用是_______。
(4)步骤⑤合适的干燥剂为_______(填标号);
A.浓硫酸 B.无水氯化钙 C.氧化钙 D.氢氧化钠
采用减压蒸馏的原因是_______。
(5)已知无水乙醇的密度为0.79 g·mL 1,该实验中肉桂酸乙酯的产率为_______。
(6)产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L 1的盐酸滴定,消耗盐酸的体积为V mL,该样品的纯度为_______(用代数式表示,无需化简)。
5.(2022·河北秦皇岛·二模)三氯化硼()用于制备光导纤维和有机硼化物等,制备原理:。某小组据此设计实验制备并测定其纯度,装置如图:
已知的熔点为-107.3℃,沸点为12.5℃,极易水解产生[或]和HCl。
实验(一):制备。
(1)水浴R选择_______(填“热水浴”或“冰水浴”),装碱石灰的仪器是_______(填名称)。
(2)F装置的作用是_______。
(3)已知:A装置中还原产物为,其离子方程式为_______。
实验(二):探究的性质。
据文献资料显示,在乙醇中剧烈反应生成硼酸酯和“白雾”,与在水中发生水解相似。
(4)写出三氯化硼与乙醇反应的化学方程式:_______。
实验(三):测定产品的纯度。
①准确称取wg产品,置于蒸馏水中,完全水解,并配成250mL溶液。
②准确量取25.00mL溶液于锥形瓶中。
③向其中加入液至沉淀完全,然后加入3mL硝基苯(常温常压下,密度为),振荡。
④向锥形瓶中滴加3滴溶液,然后逐滴加入标准溶液滴定过量的溶液,消耗KSCN溶液的体积为mL。已知:。
(5)步骤③加入硝基苯的目的是_______;滴定终点时的现象是_______。
(6)该产品中的质量分数为_______%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中的质量分数_______(“偏高”、“偏低”或“无影响”)。
6.(2022·湖北·模拟预测)Ⅰ.钼(Mo)为人体必需微量元素,是一种重要的过渡金属,在工业上主要用于制造合金钢等,下图为用CO制备单质Mo的实验装置图,回答下列问题。
(1)装置①的名称是_______;装置Ⅱ、装置Ⅲ中所装溶液依次为:_______、_______。
(2)实验操作中,先点燃装置_______处酒精灯(填“Ⅳ”或“Ⅴ”)。
(3)某同学认为装置Ⅵ中盛装的澄清石灰水变浑浊,也不能说明装置Ⅴ中被CO还原,理由是_______。
(4)从绿色化学角度,请指出该实验装置的一处缺陷_______。
Ⅱ.近日郑州大学发明专利,用液态锌做阴极,石墨做阳极,熔融盐为电解质,在石墨与液态锌接触区域放置二硫化钼(,Mo为+4价),将其还原为单质钼,装置如图:
(5)请写出该装置中二硫化钼上发生的电极反应方程式:_______,氩气的作用是:_______。
(6)已知,,若不纯的溶液中含少量的可溶性硫酸盐杂质、可加入固体除去,当开始沉淀时,溶液中_______(保留2位有效数字)。
7.(2022·江苏南通·模拟预测)实验小组以某铜渣(主要成分、,含少量和)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[]。实验包括如下过程:
(1)浸取。
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量,过滤。
①已知浸取时无S和SO2生成,写出浸取时所发生反应的离子方程式:_______。
②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是_______。
③当观察到_______,可以停止鼓入O2。
④加入的目的是_______。[已知]
(2)制取。
向滤液中加入溶液调节范围为_______,过滤;向滤渣中加入稀硫酸至滤渣恰好完全溶解,得溶液。{设、开始沉淀时,沉淀完全时。,}
(3)制。
已知的产率{}随起始与的比值和溶液pH的关系如图2所示。
①补充完整制取的实验方案:向烧杯中加入溶液,将烧杯置于70℃的水浴中,_______,低温烘干,得到。(实验中可选用的试剂或仪器:溶液、溶液、溶液、盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得的产率偏低,但Cu元素含量偏大,原因是_______。
8.(2022·天津·模拟预测)葡萄糖酸锌[Zn(C6H11O7)2相对分子质量455],是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100°C即开始分解。实验室制备葡萄糖酸锌装置如图1(夹持、控温装置略):
(1)图1中支管a的作用是_______,X处为冷凝回流装置,图2中仪器使用正确且效果最好的是_______。(填字母)。
(2)该反应需控制温度在90°C左右,其原因为_______,可采用的加热方式是_______。
(3)三颈烧瓶中发生反应的化学方程式为_______。
(4)反应完毕后,再经过一系列实验操作得到葡萄糖酸锌粗品。粗品含少量难溶于水的杂质,纯化粗品的合理操作顺序是_______(填字母序号)。
A.待晶体充分析出后,减压过滤
B.在50°C下用恒温干燥箱烘干
C.趁热减压过滤,除去不溶物
D.将滤液冷却至室温,加入10mL95%乙醇溶液并搅拌促进晶体析出
E.取烧杯加入10mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液
(5)测定产品纯度:取mg提纯后的产品溶于水配制成100.00mL溶液,取25.00mL置于锥形瓶中,向其中滴入少量EBT作为指示剂(遇Zn2+生成Zn-EBT),再加入过量的V1mLc1mol/LEDTA无色溶液(遇Zn2+生成Zn-EDTA),同时发生反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA(无色)+EBT(蓝色)。再用c2mol/LZn2+标准溶液滴定至终点。三次滴定平均消耗锌标准溶液V2mL。
①滴定终点的现象为_______。
②该产品的纯度为_______。(用含m,c1、c2,V1、V2的代数式表示)
9.(2021·新疆乌鲁木齐·二模)硫代硫酸钠晶体(Na2S2O3 5H2O)易溶于水,在中性、碱性溶液中很稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。回答下列问题:
已知:2S2O+I2=S4O+2I﹣;M(Na2S2O3 5H2O)=248g mol﹣1。
(1)写出仪器a的名称___________。
(2)已知Na2S和Na2CO3按物质的量之比2:1混合,则锥形瓶中制备Na2S2O3的化学方程式为___________;装置C的作用是___________。
(3)一段时间后,锥形瓶内有大量浅黄色浑浊的中间产物生成,需用电磁搅拌器快速搅拌,其目的是___________。
(4)反应结束时,必须控制溶液的pH≥7,理由是___________(用离子方程式表示)。
(5)将反应后的混合液过滤,从滤液中获得Na2S2O3 5H2O晶体的方法是___________。
(6)样品纯度测定
称取0.50g硫代硫酸钠晶体样品加水溶解,加几滴淀粉溶液,然后用0.1000mol L﹣1的碘标准溶液滴定,终点现象为___________。测得消耗碘标准溶液的体积为9.50mL,则该晶体样品(Na2S2O3 5H2O)的纯度为___________%。
10.(2021·新疆·三模)甘氨酸亚铁是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。已知:甘氨酸亚铁的化学式为[(H2NCH2COO)2Fe,摩尔质量204g mol-1]。实验室模拟其合成方法如图1所示:
已知:
甘氨酸(H2NCH2COOH) 异抗坏血酸 甘氨酸亚铁 FeSO4 7H2O. FeCl2 4H2O
易溶于水,微溶于乙醇 易溶于水和乙醇有弱酸性和强还原性 易溶于水,难溶于乙醇 易溶于水,难溶于乙醇 易溶于水,易溶于乙醇
请回答:
(1)如图2所示合成装置中仪器b的名称是____。
(2)步骤Ⅱ加热的方法可采用____;为了防止Fe2+被氧化,本实验设计的步骤中,采取的措施有____。
(3)下列说法正确的是____。A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4 7H2O
C.步骤Ⅲ中的分离方法是过滤。
D.步骤Ⅳ,提纯操作中的干燥过程最好选用真空干燥
(4)写出合成甘氨酸亚铁的化学方程式是____。合成过程需控制pH=5.5,试说明理由____。
(5)步骤Ⅲ加入无水乙醇的目的是____。
(6)若甘氨酸的投料量为20.0g,得到纯品23.2g,则产品的产率为____%。(保留一位小数)
11.(2022·湖南湘西·三模)硫化锂(Li2S)易潮解,加热条件下易被空气中的氧化。某小组选择下列装置(装置可重复使用)制备。回答下列问题:
已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为。
(1)装置A的名称是_______,停止装置A中反应的操作是_______(填“打开”或“关闭”)K。
(2)气流从左至右,导管口连接顺序是a→_______→_______→_______→_______→d→e→_______→_______。_______
(3)其他条件相同,粗锌与稀硫酸反应比纯锌_______(填“快”或“慢”),实验中观察到装置D中产生黑色沉淀,其离子方程式为_______。
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾 ()。
下列有关说法正确的是_______(填标号)。
A.选择图1装置过滤的优点是避免析出
B.选择图1装置过滤,主要是分离和溶液
C.粗皓矾中可能含胆矾
D.选择图2装置过滤的优点是过滤速率快
(5)探究产品成分:
实验 操作与现象 结论
Ⅰ 取少量样品溶于水,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 样品中含
Ⅱ 向实验Ⅰ的溶液中滴加溶液,产生白色沉淀 样品中含_______
①由实验Ⅱ知,样品中还含有_______(填化学式),产生该杂质的可能原因是_______(填标号)。
A.通入的氢气过量 B.未反应完 C.温度过高
②测定产品纯度:向wg样品(设杂质只有)中加入过量的稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准的NaOH溶液滴定过量的硫酸,消耗NaOH溶液。样品的纯度为_______(列出计算式)。
12.(2022·上海·模拟预测)实验室模拟拉希法用氨和次氯酸钠反应制备肼,并探究肼的性质。制备装置如下图所示。
已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)装置A试管中的试剂为_______,仪器a的作用是_______。
(2)装置B中制备肼的化学方程式为_______。
(3)装置C中仪器b的名称是_______,该仪器中导管的作用为_______。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是_______。
(5)①探究性质。取装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子反应方程式_______。
②测定产品中肼的质量分数。称取m g装置B中溶液,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定过程中指示剂可选用_______,滴定终点平均消耗标准溶液V mL,产品中肼质量分数的表达式为_______。
13.(2022·云南·一模)乙酸酐在有机合成工业中有广泛的应用。实验室利用如下方法制备少量乙酸酐。实验原理(反应1、反应2已配平):
反应1:CH3COOH+SOCl2→CH3COC1+X↑+Y↑ ΔH<0
反应2:CH3COC1+CH3COOH→(CH3CO)2O+HC1↑ ΔH<0
已知:有关物质的部分信息如下。
物质 沸点/℃ 相对分子质量 理化性质
乙酸(CH3COOH) 118 60 易溶于水和有机溶剂
二氯亚砜(SOCl2) 79 119 遇水水解,受热易分解
乙酰氯(CH3COCl) 51 78.5 遇水或乙醇剧烈分解
乙酸酐[(CH3CO)2O] 139.6 102 遇水形成乙酸,易溶于有机溶剂
实验步骤:
I.将21.0g冰醋酸加入到三颈烧瓶中,再分批缓慢加入21.0gSOCl2,控制反应温度35℃,搅拌回流2小时。
II.将三颈烧瓶中的混合物转移至另一烧瓶中,提纯,收集到较纯的乙酸酐12.0g(其中乙酸酐占90.0%)。
实验装置如图所示:
回答下列问题:
(1)仪器c的名称是___________,冷凝管的进水口是___________(填字母)。
(2)反应1生成的X和Y均为酸性气体,其化学式为___________和___________。
(3)步骤I中,控制反应温度在35℃左右,不宜过高的原因是___________。
(4)c中盛放无水氯化钙,主要作用是___________,d中盛放的试剂是___________。
(5)步骤II中,从混合物中提纯乙酸酐应采取的操作名称是___________。
(6)该方法制得乙酸酐的产率是___________%(保留1位小数)。
14.(2022·陕西·西安中学三模)据古籍记载,焙烧绿矾()矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如图所示。
回答下列问题:
(1)证明该样品未变质的实验操作和现象是_______。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式_______。
(3)装置中冷水的作用是_______。
(4)为防止倒吸,停止实验时应进行的操作是_______。
(5)用滴定法测定绿矾的纯度。称取绿矾样品,配制成溶液,量取待测液于锥形瓶中,用酸性溶液滴定,反应消耗酸性溶液体积的平均值为。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、_______。
②该实验滴定终点时的现象为_______。
③该绿矾样品中的质量分数为_______(计算结果保留3位有效数字)。
15.(2022·辽宁·东北育才学校三模)过氧化钙(CaO2)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30%H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
(1)第②步反应的化学方程式为_______。
(2)检验CaO2·8H2O是否洗净的方法是:_______。
(3)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是_______、_______。
(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取0.1g CaO2产品于锥形瓶中,加入30 mL蒸馏水和10mL 2 mol·L-1 HCl,完全溶解后加入几滴0.1mol·L-1 MnSO4溶液,用0.02mol·L-1 KMnO4标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
试验次数 一 二 三
V(KMnO4)/mL 23.02 23.05 23.04
①滴定的终点现象是_______。
②滴定过程中加入标准溶液发生反应的离子方程式为_______,过氧化钙的质量分数为_______(保留两位有效数字)。
16.(2022·上海·模拟预测)1,2-二氯乙烷(CH2ClCH2Cl)是重要的有机化工原料,不溶于水,常用作有机溶剂,沸点83.6°C,实验室可用“乙烯液相直接氯化法”来制备:
C2H5OHCH2=CH2↑+H2O
Cl2(g)+CH2=CH2(g)→CH2ClCH2Cl(l) H<0
(1)关于乙装置及其中的反应填空:
①仪器A的名称:_______。
②乙装置控制反应温度在50℃~70℃(加热装置已省略),控制在此温度范围的原因:_______。
③乙装置在通入气体前,加入适量的二氯乙烷,其作用是 _______。
④若反应气(Cl2和CH2=CH2)中混有水,则可能发生的化学反应方程式为 _______。
(2)根据实验原理,该装置的连接顺序为:a→_______→bc←_______←j(按接口顺序连接,装置可重复使用)。
(3)产品提纯:由于有副反应存在,该方法获得的1,2-二氯乙烷(CH2ClCH2Cl)还含有少量的多氯化物和HCl。下列提纯操作的顺序是:用水洗涤,静置,分去水层;_______(填序号);干燥 ;精馏。
① 蒸馏脱去大部分水,获得共沸物
② 加碱闪蒸除去酸性物质及部分高沸物
③ 用水洗涤余碱至中性
④ 将馏分静置、分液
(4)产品纯度的测定:量取5.0mL产品,密度为0.44g·mL-1,加足量稀NaOH水溶液,加热充分反应得到250mL水解液。取25.00mL水解液先用稀硝酸中和至酸性,然后加入过量的50.00mL0.1000mol/LAgNO3溶液,充分反应后再加入硝基苯,用力摇动。用0.1000mol/LNH4SCN标准液滴定过量的AgNO3溶液,重复实验三次,平均消耗标准液10.00mL。已知:Ag++SCN-=AgSCN↓(白色沉淀),Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
①滴定时,应选用的指示剂为_______(填标号)。
A.FeSO4 B.FeCl3 C.Fe(NO3)3 D.甲基橙
②产品中1,2-二氯乙烷的纯度为_______%。
③实验中加入硝基苯的作用是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)稀H2SO4
(2)打开
(3)待装置A中反应一段时间后关闭止水夹a,产生的H2将FeSO4溶液压入B中(NH4)2SO4与进行反应
(4) FeSO4+H2C2O4+2H2OFeC2O4·2H2O↓+H2SO4 草酸钠溶液呈碱性,使得Fe2+易被氧气氧化,降低了二水合草酸亚铁的产率
(5) % 偏高
【解析】
(1)
由制备FeC2O4·2H2O的流程图可知A中分液漏斗中的药品稀H2SO4;
(2)
实验开始时先将止水夹a打开使产生的H2将装置A和B中的空气排空,避免Fe2+被空气中的O2氧化;
(3)
待装置A中反应一段时间后关闭止水夹a,产生的H2将FeSO4溶液压入B中(NH4)2SO4与进行反应;
(4)
FeSO4+H2C2O4+2H2OFeC2O4·2H2O↓+H2SO4;草酸钠溶液呈碱性,使得Fe2+易被氧气氧化,降低了二水合草酸亚铁的产率;
2.(1)隔绝氧气,防止Fe2+被氧化
(2)打开K2、关闭K3
(3)Fe2++2HCO= FeCO3↓+ H2O+CO2↑
(4)4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2
(5) 温度为70℃、pH=5 pH较低时不利于FeCO3固体溶解生成Fe2+,pH较高时Fe2+会形成沉淀,产率都会减小
(6) A 93.6%
【解析】亚铁离子易被氧气氧化,制备过程应在无氧环境中进行,装置A用废铁屑和稀硫酸反应生成FeSO4和氢气,利用产生的氢气排尽装置内空气,且使装置A内气压增大,将制备的硫酸亚铁溶液压入装置B内,与NH4HCO3反应制备FeCO3,反应的离子方程式为:Fe2++2HCO= FeCO3↓+ H2O+CO2↑;
(1)
试管B中用FeSO4和NH4HCO3制备FeCO3,由于亚铁离子易被氧化,则植物油的作用是隔绝氧气,防止Fe2+被氧化;
(2)
装置A中用废铁屑和稀硫酸反应生成FeSO4和氢气,可利用压强差将A中生成的FeSO4溶液通过导管压至试管B内,操作是打开K2、关闭K3;
(3)
用FeSO4和NH4HCO3制备FeCO3,反应的离子方程式为:Fe2++2HCO= FeCO3↓+ H2O+CO2↑;
(4)
久置后,FeCO3试剂瓶的瓶口有红褐色物质即Fe(OH)3,是FeCO3被氧气氧化生成Fe(OH)3,反应的方程式为:4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2;
(5)
由图知温度为70℃、pH=5时乳酸亚铁产率最大,为适宜的反应条件;溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是:pH较低时不利于FeCO3固体溶解生成Fe2+,pH较高时Fe2+会形成沉淀,产率都会减小;
(6)
已知反应中Ce元素被还原为Ce3+,则(NH4)4Ce(SO4)4做氧化剂,具有氧化性,(NH4)4Ce(SO4)4标准溶液装入酸式滴定管,即选:A;(NH4)4Ce(SO4)4中Ce为+4价,被还原为Ce3+则Ce元素得到一个电子,Fe2+被氧化为Fe3+则Fe元素失去一个电子,则n(Fe2+)= n[(NH4)4Ce(SO4)4]=cV=0.1000mol/L×30.00×10-3L=3×10-3mol,则3.0g样品中乳酸亚铁质量为m=nM=3×10-3mol234g/mol=2.808g,纯度为。
3.(1) afg(或gf)debch 吸收N2O中混有的HNO3和水蒸气 SnCl2+N2O+(x+1)H2O=SnO2·xH2O↓+N2+2HCl 继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞 防止E中液体倒吸入B中
(2) 蒸馏烧瓶 ClO-+2+H2O=Cl-+3N2↑+2OH- 平衡压强、使液体容易流下;减小测定气体体积时的误差 ×100%
【解析】根据反应原理,利用盐酸与混合液中加入稀硝酸反应产生一氧化二氮,利用D中的碱石灰吸收N2O中混有的HNO3和水蒸气,进入装置C中与NaNH2反应制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理,进而对产品的纯度进行探究。
(1)
①由实验目的和原理知,A用于制备N2O,D用于吸收N2O中混有的HNO3和水蒸气,C用于制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理。则按气流方向,上述装置合理的连接顺序为afg(或gf)debch;
②D的作用为吸收N2O中混有的HNO3和水蒸气;
③由信息,N2O有强氧化性,故E中生成SnO2·xH2O沉淀的化学方程式为SnCl2+N2O+(x+1)H2O=SnO2·xH2O↓+N2+2HCl;
④C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞;
(2)
①由装置图知,仪器F的名称为蒸馏烧瓶;其中发生NaClO与NaN3生成N2的反应,离子方程式为ClO-+2+H2O=Cl-+3N2↑+2OH-;
②管q可以平衡压强、使液体容易流下和减小测定气体体积时误差的作用。
③由数据信息知,生成N2体积为(V1-V2)mL,由关系式2NaN3~3N2列式得产品中NaN3的质量分数为×100%=×100%。
4.(1)C
(2)分离出反应生成的水,促使平衡正向移动,提高产率
(3)除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度
(4) B 碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生
(5)70%
(6)
【解析】44.4g肉桂酸、25mL无水乙醇和25mL环己烷,3mL浓硫酸混合加热,肉桂酸乙酯沸点较高,在有碳碳双键的存在的情况下,高温易发生副反应,采用减压蒸馏可以降低沸点,在较低的温度下进行蒸馏,减少副反应的发生,提高产率,反应中乙醇过量,按44.4g肉桂酸计算理论产量,计算产率;肉桂酸乙酯与氢氧化钠发生水解反应,反应比例为1:1,过量的氢氧化钠与盐酸1:1反应,则n(肉桂酸乙酯)=,求解n(肉桂酸乙酯)后继续计算产率,滴定重点溶液变为碱性,使用酚酞作为指示剂。
(1)
蒸馏装置中,选用的冷凝管为直形冷凝管。故选C;故答案为:C;
(2)
本实验中,分水器的作用是分离出反应生成的水,促使平衡正向移动,提高产率。故答案为:分离出反应生成的水,促使平衡正向移动,提高产率;
(3)
步骤③加入碳酸钠粉末的作用是除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度。故答案为:除去过量的肉桂酸、硫酸,降低肉桂酸乙酯的溶解度;
(4)
A.除去有机层中的水,使用浓硫酸不能过滤分离,故A不选;B.无水氯化钙,能干燥,可通过过滤分离,故B选; C.氧化钙与水反应生成氢氧化钙,促进酯水解,故C不选; D.氢氧化钠是碱能促进酯水解,故D不选;故选B。采用减压蒸馏的原因是碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生。故答案为:B;碳碳双键的稳定性较差,高温下肉桂酸乙酯易发生副反应,采用减压蒸馏可以降低沸点,减小副反应的发生;
(5)
产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L 1的盐酸滴定,消耗盐酸的体积为V mL,肉桂酸乙酯的物质的量为 , =该样品的纯度为(用代数式表示,无需化简)。故答案为:。
5.(1) 冰水浴 (球形)干燥管
(2)吸收CO
(3)
(4)
(5) 覆盖AgCl,避免AgCl转化成AgSCN 滴入最后一滴(或半滴)KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色
(6) 偏低
【解析】
装置A中浓盐酸与K2Cr2O7反应制备氯气,装置B中的浓硫酸除去氯气中的水蒸气,干燥的氯气通入装置C中与B2O3、C加热条件下反应生成和CO,的熔点为-107.3℃,沸点为12.5℃,装置D中冰水浴收集,氯气、一氧化碳有毒,会污染环境,装置E中碱石灰用于吸收氯气并防止装置F中的水蒸气进入装置D中使水解,装置F用于吸收一氧化碳。
(1)
的熔点为-107.3℃,沸点为12.5℃,应选择冰水浴冷凝三氯化硼,装碱石灰的仪器为:(球形)干燥管。
(2)
一氧化碳有毒,会污染环境,装置F用于吸收一氧化碳。
(3)
装置A中浓盐酸与K2Cr2O7反应制备氯气,A装置中还原产物为,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为:。
(4)
极易水解产生[或]和HCl,在乙醇中剧烈反应生成硼酸酯和“白雾”,与在水中发生水解相似,则在乙醇中反应生成和HCl,反应的化学方程式为:。
(5)
已知:,因此步骤③加入硝基苯的目的是:覆盖AgCl,避免AgCl转化成AgSCN,使滴定终点不准确;根据滴定原理,当KSCN标准液将过量的硝酸银溶液反应完,就会与氯化铁反应显红色,因此滴定终点时的现象是:当滴入最后一滴(或半滴)KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色。
(6)
根据离子反应可知:n(Ag+)=n(Cl-)+n(SCN-),25.0mL溶液中含n(Cl-)=n(Ag+)-n(SCN-)=c1V110-3mol-c2V210-3mol,则wg产品中的质量分数为;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,则KSCN溶液浓度偏低,测得的过量的硝酸银的含量偏高,算得的转化为氯化银的硝酸银的含量偏低,测得产品中的质量分数偏低。
6.(1) 恒压滴液漏斗 饱和碳酸氢钠溶液 浓硫酸
(2)Ⅳ
(3)可能是未反应完的使澄清石灰水变浑浊
(4)缺少尾气处理装置
(5) 做保护气,防止金属单质被氧化
(6)
【解析】
装置I中稀盐酸和碳酸钙反应生成二氧化碳,装置II中盛放饱和碳酸氢钠溶液除去二氧化碳中的氯化氢,装置III中盛放浓硫酸除去二氧化碳中的水,纯净、干燥的二氧化碳通入装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,一氧化碳在装置V中与MoO3反应制备Mo,装置VI中盛放澄清石灰水检验二氧化碳,但石灰水变浑浊也不能说明装置Ⅴ中被CO还原,有可能是未反应完的使澄清石灰水变浑浊,一氧化碳有毒,最后要进行尾气处理。
(1)
装置①的名称是:恒压滴液漏斗,由分析可知,装置II中盛放饱和碳酸氢钠溶液除去二氧化碳中的氯化氢,装置III中盛放浓硫酸除去二氧化碳中的水。
(2)
装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,一氧化碳在装置V中与MoO3反应制备Mo,应先制备一氧化碳,因此应先点燃装置IV处酒精灯。
(3)
装置IV中,碳与二氧化碳高温条件下反应生成一氧化碳,但二氧化碳可能未反应完,也能使装置VI中澄清石灰水变浑浊,因此不能说明装置Ⅴ中被CO还原。
(4)
一氧化碳有毒,排放到空气中会污染空气,要进行尾气处理,因此装置的缺陷是:缺少尾气处理装置。
(5)
由题意和装置图可知,二硫化钼在阴极得电子生成单质Mo,电极反应式为:,液态锌以及生成的单质钼容易被氧气氧化,氩气的作用是:做保护气,防止金属单质被氧化。
(6)
已知:<,所以先沉淀的是硫酸钡,当开始沉淀时,硫酸钡已经沉淀完全,所以溶液对于两种沉淀来说都是饱和溶液,其中的离子浓度都符合沉淀的Ksp表达式:===≈。
7.(1) 3Cu2S+16H++10NO6Cu2++3+10NO↑+8H2O 将生成的NO气体转化为硝酸,减小硝酸的消耗 鼓入O2气体不再出现红棕色 将硫酸银转化为更难溶的氯化银沉淀,将溶液中Ag+除尽
(2)6.5<pH<7.5
(3) 边搅拌边加入25mL0.5mol·L-1CuSO4溶液,在pH计测定溶液pH条件下,用0.1mol·L-1NaOH溶液或0.1mol·L-1盐酸调节溶液pH约为9,充分反应后,过滤,洗涤沉淀至最后一次洗涤滤液滴加BaCl2溶液无沉淀生成 pH过大,反应生成了Cu(OH)2沉淀,Cu(OH)2的Cu元素含量高于Cu2(OH)2CO3
【解析】
整个实验过程分为三步:
第一步浸取,目的是让铜渣和混合酸反应,使铜渣溶解,得到以硫酸铜为主的混合溶液,为了充分利用稀硝酸,在反应过程中不时的通入氧气,使生成的NO气体转化为硝酸,减小硝酸的消耗。由于杂质也能被硝酸溶解氧化,为了能把反应后溶液中的Ag+完全除去,在反应后的溶液中,加入少量,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,以除去银离子。
第二步制取硫酸铜,反应过程中,杂质也会被氧化溶解,生成硫酸盐,因此第一步过滤后的溶液中还含有反应生成的硫酸锰,利用Cu(OH)2和Mn(OH)2的溶度积差异,通过向滤液中加入溶液调节控制溶液的值,使Cu2+离子完全转化为Cu(OH)2沉淀,实现、Cu2+分离,过滤得到Cu(OH)2,然后和稀硫酸反应得到溶液。
第三步制备,通过图2可知,与的比值是1.2和溶液pH=9时,的产率最高,据此分析解答。
(1)
①渣铜被酸浸取时无S和SO2生成,说明杂质中的硫离子被硝酸氧化成硫酸,反应的化学方程式是Cu2S+3H2SO4+10HNO36CuSO4+10NO↑+8H2O,则其反应的离子方程式是3Cu2S+16H++10NO6Cu2++3+10NO↑+8H2O。
②由于硝酸被还原时生成了NO气体,为了充分利用硝酸,可向反应装置中不时的通入氧气,使其转化为硝酸,提高硝酸的利用率。
③当鼓入O2后,装置中气体不再出现红棕色,说明装置中就没有NO气体了,此时可停止鼓入O2。
④经分析,杂质也能被硝酸溶解氧化,为了能把反应后的溶液中Ag+完全除去,可利用氯化银比硫酸银的溶度积更小,在反应后的溶液中,加入少量,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,以除去银离子。
(2)
经分析,为了使滤液中的、Cu2+分开,可利用Cu(OH)2和Mn(OH)2的溶度积差异,通过向滤液中加入溶液调节控制溶液的值,使Cu2+离子完全转化为Cu(OH)2沉淀,以实现两种离子分开。题目假设、Cu2+开始沉淀时,沉淀完全时,为了使Cu2+完全沉淀,则根据,解得溶液中的c(OH-)的浓度是110-7.5,即pH=6.5时, Cu2+完全沉淀,同理,根据,可得开始沉淀时的 c(OH-)=,即pH=7.5时,开始沉淀,则为了使Cu2+完全沉淀,而不沉淀,则向滤液中加入溶液调节范围应为6.5<pH<7.5。
(3)
①通过图2可知,与的比值是1.2和溶液pH=9时,的产率最高。若向烧杯中加入溶液,根据与的比值是1.2,可得关系式 V0.5mol·L-11.2=30ml0.5mol·L-1,解得V=25ml,则还需向烧杯中加入25mL0.5mol·L-1CuSO4溶液,为了使溶液的pH=9,还需通过提供的pH计测定溶液pH,用0.1mol·L-1NaOH溶液或0.1mol·L-1盐酸调节溶液pH约为9,才能使的产率最高。沉淀是否洗涤干净,可检验沉淀是否还附有硫酸根离子,故沉淀后过滤、洗涤,洗涤沉淀至最后一次洗涤滤液滴加BaCl2溶液无沉淀生成。
②若反应时溶液pH过大,根据图2可知的产率偏低,沉淀中含有Cu(OH)2沉淀,而Cu(OH)2中铜元素的质量分数大于,故反应时溶液pH过大,所得的产率偏低,但Cu元素含量偏大。
8.(1) 平衡压强,使液体能顺利流下 A
(2) 温度过低葡萄糖酸锌会析出,且反应速率较慢,温度过高葡萄糖酸锌容易分解 水浴加热
(3)Ca(C6H11O7)2+ ZnSO4= Zn(C6H11O7)2+CaSO4↓
(4)ECDAB
(5) 滴入最后一滴标准液后, 溶液恰好由蓝色变为酒红色,且保持半分钟不变色
【解析】
(1)
图中带支管的装置为恒压分液漏斗,支管的作用为平衡压强,使液体能顺利流下;X装置为冷凝回流装置,应该选用球形冷凝管,冷凝水流向为下进上出,故选A;
(2)
根据题中信息,葡萄糖酸锌易溶于热水,温度低时反应速率慢,且易析出;温度高于100oC葡萄糖酸锌开始分解,故温度过低葡萄糖酸锌会析出,且反应速率较慢,温度过高葡萄糖酸锌容易分解,因此反应控制温度在90°C左右,采用水浴加热方式;
(3)
三颈烧瓶中是利用硫酸锌和葡萄糖酸钙制备葡萄糖酸锌,化学方程式为:Ca(C6H11O7)2+ ZnSO4= Zn(C6H11O7)2+CaSO4↓;
(4)
葡萄糖酸锌易溶于热水,故先将葡萄糖酸锌溶于沸水中,后趁热过滤除去不溶物;降低温度同时加入乙醇溶液,葡萄糖酸锌溶解度降低,晶体析出,减压过滤后在低温下烘干,防止葡萄糖酸锌受热分解,故正确的顺序为:ECDAB;
(5)
整个滴定过程中EDTA与锌离子反应,锌离子来源为两部分:一部分来自产品配成的溶液,另一部分为锌离子标准溶液。开始滴定时溶液中成分为Zn-EDTA(无色)、EDTA、EBT,故溶液颜色为蓝色;用锌离子标准溶液滴定时,到达滴定终点会生成Zn-EBT(酒红色),即到终点颜色变化为蓝色变为酒红色。到达滴定终点的现象为:滴入最后一滴标准液后,溶液恰好由蓝色变为酒红色,且保持半分钟不变色;
Zn2++EDTA=Zn-EDTA,可找到关系式:
,
即25mL溶液中 ,100mL样品中,样品的纯度为:。
9.(1)分液漏斗
(2) 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 吸收SO2等气体,防止污染空气
(3)使生成的S与反应物充分混合,提高产率
(4)S2O+2H+=S↓+SO2↑+H2O
(5)蒸发浓缩、冷却结晶
(6) 溶液由无色变为蓝色,且半分钟内不褪色即达到滴定终点 94.24%
【解析】
将装置A中利用浓硫酸和Na2SO3固体反应生成的SO2气体通入到盛有Na2S和Na2CO3混合溶液的锥形瓶中,在搅拌的条件下反应生成Na2S2O3,装置C的作用是尾气处理,待完全反应后将B中溶液蒸发浓缩、冷却结晶即可获得Na2S2O3 5H2O。
(1)
仪器a的名称是分液漏斗,
故答案为:分液漏斗;
(2)
Na2S和Na2CO3按物质的量之比2:1混合,通入SO2气体后锥形瓶中生成Na2S2O3,同时有CO2气体生成,利用电子守恒配平得发生反应的化学方程式2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;C装置是最后一个装置,且在发生装置后的,根据反应后可能出来的气体判断,主要是防止污染空气,而污染性气体主要是二氧化硫,
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;吸收SO2等气体,防止污染空气;
(3)
搅拌的目的是增大接触面积,使反应更充分,根据浅黄色浑浊判断中间产物是硫单质,
故答案为:使生成的S与反应物充分混合,提高产率;
(4)
根据题目中硫代硫酸钠晶体在中性、碱性溶液中很稳定,在酸性条件下应该不稳定,易生成S和SO2,故pH不能小于7,发生反应的离子方程式为S2O+2H+=S↓+SO2↑+H2O,
故答案为:S2O+2H+=S↓+SO2↑+H2O;
(5)
将反应后的混合液过滤,从滤液中获得Na2S2O3 5H2O晶体的方法是蒸发浓缩、冷却结晶,再过滤、洗涤、干燥即可,
故答案为:蒸发浓缩、冷却结晶;
(6)
利用淀粉遇碘单质变蓝,当滴入最后1滴碘标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色即达到滴定终点;滴定过程中消耗0.100mol L﹣1的碘标准溶液9.50mL,含有I2的物质的量为0.100mol L﹣1×9.50×10-3L=0.95×10-3mol,根据关系式2S2O~I2可知n(S2O)=2×0.95×10﹣3mol=1.9×10-3mol,则样品的纯度为=94.24%,
故答案为:94.24%。
10.(1)三颈烧瓶
(2) 水浴加热 通入氮气,加入异抗坏血酸
(3)CD
(4) FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O pH过低使产率下降的原因是H+会与H2NCH2COOH中的氨基反应;pH过高会生产沉淀
(5)降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率
(6)85.3
【解析】
本题实验目的是制备甘氨酸亚铁,实验原理是FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O,把握题中所给信息,同时制备过程中不能引入新的杂质,据此分析;
(1)
根据图示,合成装置中仪器b为三颈烧瓶,故答案为:三颈烧瓶;
(2)
步骤Ⅱ加热的温度为50℃,可采取水浴加热的方法,甘氨酸饱和溶液中通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌可以加快化学反应速率,同时除去溶液中溶解的氧气,加入异抗坏血酸,异抗坏血酸介于弱酸性和强还原性,都能防止亚铁离子被氧气氧化,故答案为:水浴加热;通入氮气,加入异抗坏血酸;
(3)
A.装置中使用的是恒压滴液漏斗,滴入液体前,无需打开滴液漏斗a的上口玻璃塞,故A错误;
B.FeSO4 7H2O易溶于水,难溶于乙醇,在加入乙醇析出甘氨酸亚铁时会混入杂质,而FeCl2 4H2O易溶于乙醇,不会引入杂质,因此亚铁盐应选用FeCl2 4H2O,故B错误;
C.加入乙醇析出甘氨酸亚铁,步骤Ⅲ为分离液体和固体的操作,分离方法是过滤,故C正确;
D.步骤Ⅳ中,用蒸馏水洗涤除去乙醇,得到纯净的甘氨酸亚铁,甘氨酸亚铁容易被氧化,因此干燥过程最好选用真空干燥,故D正确;
故答案为:CD;
(4)
合成合成甘氨酸亚铁的反应物是H2NCH2COOH、氢氧化钠和FeCl2 4H2O,化学方程式为FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O,pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀,因此合成过程需控制pH=5.5,故答案为:FeCl2 4H2O+2H2NCH2COOH+2NaOH=(H2NCH2COO)2Fe+2NaCl+6H2O;pH过低使产率下降的原因是H+会与H2NCH2COOH中的氨基反应:pH过高会生产沉淀;
(5)
甘氨酸亚铁易溶于水,难溶于乙醇,步骤Ⅲ加入无水乙醇,降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;同时除去杂质,提高甘氨酸亚铁的产率和纯度,故答案为:降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率;
(6)
甘氨酸的投料量为20g,甘氨酸的物质的量n==mol,生成n[(NH2CH2COO)2Fe]=mol,理论的产量为mol×204g/mol=27.2g,产率为×100%=×100%≈85.3%,故答案为:85.3。
11.(1) 启普发生器 关闭
(2)a→g→f→b→c→d→e→b→c
(3) 快
(4)AD
(5) B
【解析】
由实验装置图可知,装置A中锌粒与稀硫酸反应制备氢气,由于锌粒含有硫化亚铁,硫化亚铁与稀硫酸反应生成的硫化氢气体会混入制得的氢气中,装置D中盛有的硫酸铜溶液用于除去硫化氢气体,装置B中盛有的浓硫酸用于干燥氢气,装置C中氢气与硫酸锂与氢气共热反应制备硫化锂,为防止空气中氧气进入C中导致硫化锂被氧化,装置C后应连接一个B装置,防止空气中的氧气加入,则装置的连接顺序为ADBCB,导管口连接顺序为a→g→f→b→c→d→e→b→c,该装置的设计缺陷是没有氢气的尾气处理装置。
(1)
由实验装置图可知,装置A为启普发生器,实验时关闭活塞K,用反应生成的氢气增大装置中的压强,使液面与锌粒脱离就能停止装置A中反应,故答案为:启普发生器;关闭;
(2)
由分析可知,气流从左至右,导管口连接顺序是a→g→f→b→c→d→e→b→c,故答案为:a→g→f→b→c→d→e→b→c;
(3)
原电池反应能加快锌粒与稀硫酸的反应,粗锌中含有的铜能与锌在稀硫酸中构成原电池,使反应速率快于纯锌与稀硫酸的反应;由分析可知,装置D中盛有的硫酸铜溶液用于除去硫化氢气体,反应的离子方程式为,故答案为:快于;;
(4)
A.由锌粒的成分可知,实验完毕后,装置A中可能得到含有铜、锌、硫酸锌、硫酸亚铁的混合物,在加热条件下过滤混合物,可以增大硫酸锌在溶液中的溶解度,避免析出七水硫酸锌,故正确;
B.由锌粒的成分可知,实验完毕后,装置A中可能得到含有铜、锌、硫酸锌、硫酸亚铁的混合物,在加热条件下过滤混合物,可以除去铜和未反应的锌,故错误;
C.铜与稀硫酸不反应,则制得的七水硫酸锌中不可能含有胆矾,故错误;
D.用抽滤的方法得到粗皓矾可以加快过滤得速率,防止七水硫酸锌溶解造成产率降低,故正确;
故选AD;
(5)
①由实验Ⅱ可知,制得的硫化锂中混有未反应的硫酸锂,故答案为:;B;
②设样品中硫化锂为amol、亚硫酸锂为bmol,由样品的质量可得:46a+94b=W,由消耗稀硫酸的体积可得:a+b=(c1×10—3V1—×c2×10—3V2),解得a=,则硫化锂的质量分数为,故答案为:。
12.(1) 氯化铵和氢氧化钙固体 导气,防止倒吸
(2)
(3) 滴液恒压漏斗 平衡气压,使浓盐酸顺利滴下
(4)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(5) 淀粉溶液
【解析】
实验室模拟拉希法用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,装置C为生成氯气装置,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠再和氨生成肼;
(1)
实验室模拟拉希法用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,且反应为固体加热反应,则试管中的试剂为氯化铵和氢氧化钙固体,两者反应生成氨气和氯化钙、水;氨气极易溶于水,仪器a的作用是将氨气通入装置B中,且球形部分可以防止倒吸;
(2)
装置B中氨和次氯酸钠反应生成肼,氮元素化合价升高,次氯酸具有氧化性则氯元素化合价降低生成氯化钠,;
(3)
装置C中仪器b的名称是滴液恒压漏斗,该仪器中导管的作用为平衡漏斗与烧瓶中气压,使浓盐酸顺利滴下;
(4)
装置C反应生成氯气,浓盐酸具有挥发性,导致氯气不纯,氯化氢会和装置B中氢氧化钠溶液反应,导致肼的产率降低,改进方法是在装置B、C之间加装盛有饱和食盐水的洗气瓶,除去氯化氢气体;
(5)
①已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水;装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,则反应为肼和稀硫酸生成硫酸肼晶体:;
②碘溶液能使淀粉变蓝色,故滴定过程中指示剂可选用淀粉溶液;
滴定过程中有无色无味无毒气体产生,碘具有氧化性,则碘和肼发生氧化还原反应生成碘离子和氮气,根据电子守恒可知,2I2~4e-~N2H4,则产品中的质量为,质量分数的表达式为。
13.(1) 球形干燥管 a
(2) SO2 HCl
(3)温度过高则冰醋酸、二氯亚砜会挥发且二氯亚砜会分解,导致产品产率降低
(4) 做干燥剂,防止空气中水进入装置 氢氧化钠溶液
(5)蒸馏
(6)60.5
【解析】
冰醋酸加入到三颈烧瓶中,再分批缓慢加入SOCl2,水浴加热控制反应温度35℃,搅拌回流2小时,反应生成乙酸酐,利用各物质沸点不同,进行蒸馏分离提纯得到较纯乙酸酐,通过计算可求理论产品质量,然后通过实际质量求出产品产率。
(1)
仪器c的名称是球形干燥管;冷凝管的进水方向为下进上出,进水口是a;
(2)
反应1:CH3COOH+SOCl2→CH3COCl+X↑+Y↑,根据质量守恒可知,生成气体为二氧化硫、氯化氢气体,化学式为SO2、HCl;
(3)
冰醋酸沸点为118℃,SOCl2沸点为79℃且受热易分解,控制反应温度在35℃左右,不宜过高,温度过高则冰醋酸、二氯亚砜会挥发且二氯亚砜会分解,导致产品产率降低;
(4)
反应物中二氯亚砜遇水水解、生成物中乙酰氯遇水或乙醇剧烈分解,c中盛放无水氯化钙,无水氯化钙可以做干燥剂,防止空气中水进入装置;反应生成二氧化硫气体有毒会污染空气,d中盛放的试剂是氢氧化钠,氢氧化钠可以吸收二氧化硫减少污染;
(5)
由图表信息可知,四种物质的沸点不同,则步骤II中从混合物中提纯乙酸酐应采取的操作为蒸馏提纯;
(6)
由反应:CH3COOH+SOCl2→CH3COCl+X↑+Y↑、CH3COCl+CH3COOH→(CH3CO)2O+HCl↑,可知2CH3COOH~SOCl2~(CH3CO)2O;21.0g CH3COOH的物质的量为21.0g÷60g/mol=0.35mol,21.0gSOCl2的物质的量为21.0g÷119g/mol≈0.176mol,0.176×2>0.35,则CH3COOH量不足,完全反应理论上生成(CH3CO)2O的质量为0.35mol÷2×102g/mol=17.85g,故该方法制得乙酸酐的产率是 。
14.(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,无明显现象,证明该样品未变质
(2)
(3)水和三氧化硫的反应是放热反应,降低温度有利于三氧化硫的吸收
(4)熄灭酒精喷灯,继续通入空气至冷却到室温
(5) 250mL容量瓶、胶头滴管 溶液的颜色变为浅红色 97.5%
【解析】
(1)
若该样品变质,会含有Fe3+,Fe3+与KSCN发生络合反应生成血红色的氰化铁,因此在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,无明显现象,再向试管中加入适量氯水(或双氧水),溶液变血红色,说明该样品未变质;
(2)
通入空气焙烧绿矾,绿矾中的Fe2+元素被氧化成Fe3+,根据氧化还原的规律可知,只有S元素的化合价能够升高,因此绿矾充分焙烧的过程中生成的酸性气体为SO3,则焙烧绿矾的化学方程式为;
(3)
H2O和SO3的反应是放热反应,降低温度有利于三氧化硫的吸收,装置B中冷水的作用是:将SO3和水蒸气冷凝,有利于SO3被水吸收生成H2SO4;
(4)
为防止倒吸,应先熄灭酒精喷灯,冷却后再停止通空气,具体操作是:熄灭酒精喷灯,继续通入空气至冷却到室温;
(5)
①用固体配制一定物质的量浓度溶液时的步骤是:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所需要的玻璃仪器为:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
②达到滴定终点时,滴入的KMnO4恰好被消耗完,因此当滴入最后一滴KMnO4溶液时,溶液变成粉(浅)红色且半分钟内无变化,说明达到滴定终点;
③滴定过程中有关系式:,设25.00mL待测液中含有的绿矾晶体的物质的量为x mol,根据得失电子数守恒可知,故样品中的质量分数为。
15.(1)
(2)取少量最后一次洗涤液,加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,若产生白色沉淀就证明没有洗涤干净,否则洗涤干净
(3) 通入氧气能抑制过氧化钙分解 防止过氧化钙与二氧化碳反应
(4) 滴入最后半滴标准溶液时溶液变粉红色,且30秒不褪色 83%
【解析】
制取CaO2的过程是:在NH4Cl溶液中加入Ca(OH)2,两者反应生成CaCl2和NH3·H2O,不断搅拌的同时加入30%H2O2,反应生成CaO2·8H2O沉淀,经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)
加入的30%H2O2和CaCl2、NH3 H2O反应生成CaO2·8H2O沉淀,同时还生成NH4Cl,反应的化学方程式为:CaCl2+H2O2+2NH3 H2O+6H2O=CaO2 8H2O↓+2NH4Cl。
(2)
CaO2·8H2O沉淀是从含有Cl-的溶液中过滤出来的,检验CaO2·8H2O是否洗净可以检验最后一次洗涤液中是否含有Cl-,操作是:取少量最后一次洗涤液,加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,若产生白色沉淀就证明没有洗涤干净,否则洗涤干净。
(3)
CaO2在350℃迅速分解生成CaO和O2,CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,一方面是通入的氧气能抑制过氧化钙分解,另一方面是可以防止过氧化钙与二氧化碳反应。
(4)
①KMnO4溶液是紫红色的,当溶液中含有H2O2时,滴入的KMnO4溶液被还原为Mn2+,溶液是无色的,当H2O2被消耗完,再滴入KMnO4溶液时,KMnO4溶液的颜色不褪去,所以滴定终点的现象是:滴入最后半滴标准溶液时溶液变粉红色,且30秒不褪色。
②CaO2和盐酸反应生成H2O2,H2O2和KMnO4溶液反应生成氧气和Mn2+,反应的离子方程式为:2+5H2O2+6H+=2Mn2++5O2↑+8H2O。根据三次实验得到的KMnO4溶液的体积,可以求出消耗的KMnO4溶液的体积的平均值为23.04mL,根据反应的方程式可计算CaO2的物质的量:n(CaO2)=5n(KMnO4)/2=23.04×10-3L×0.02mol/L×5÷2=1.152×10-3mol,则m(CaO2)=1.152×10-3mol×72g/mol=0.083g,则CaO2的质量分数为×100%=83%。
16.(1) 三颈烧瓶 防止CH2ClCH2Cl挥发 溶解Cl2和乙烯,促进气体反应物间的接触 ,
(2) fghi ihed
(3)②③①④
(4) C 90% 防止在滴加NH4SCN溶液时,AgCl沉淀转化为AgSCN沉淀
【解析】
(1)
①由图可知,装置A的名称为三颈烧瓶;
②根据题干信息可知,1,2-二氯乙烷的沸点为83.6°C,为了防止1,2-二氯乙烷挥发,乙装置应采用水浴加热的方式控制反应温度在50℃~70℃;
③乙装置在通入气体前,加入适量的1,2-二氯乙烷液体,其作用是溶解Cl2和乙烯,促进气体反应物间的接触;
④若反应气(Cl2和CH2=CH2)中混有水,Cl2和水会发生反应:, CH2=CH2和水会发生加成反应生成乙醇,反应的化学方程式为;
(2)
利用甲装置生成氯气,生成的氯气通过饱和食盐水除去HCl,经过浓硫酸干燥后通入装置乙,装置戊中加热乙醇得到乙烯,通过水除去挥发的乙醇,再经浓硫酸干燥后通入装置乙与氯气发生反应生成1,2-二氯乙烷,因此装置的连接顺序为a→f→g→h→i→bc←i←h←e←d←j。
(3)
由于有副反应存在,该方法获得的1,2-二氯乙烷(CH2ClCH2Cl)还含有少量的多氯化物和HCl,可通过以下操作提纯1,2-二氯乙烷:用水洗涤,静置,分去水层;加入碱性物质蒸除去酸性物质及部分高沸物,用水洗涤多余的碱,再蒸馏脱去水,得到共沸物,然后将馏分静置、分液、干燥后进行精馏,因此操作的顺序为②③①④;
(4)
①达到滴定终点时SCN-开始过量,SCN-与铁离子发生显色反应,应选择含铁离子的物质作为指示剂,由于氯化铁会影响后续氯离子测定,应使用Fe(NO3)3作为指示剂,故选C;
②量取5.0mL产品,密度为0.44g·mL-1,其质量为0.44 g mL-1×5.0 mL=2.2g,加足量稀NaOH溶液,发生的反应为,取25.00mL水解液先用稀硝酸中和至酸性,然后加入过量的50.00mL0.1000mol/LAgNO3溶液,发生反应,充分反应后再加入硝基苯,用力摇动,用0.1000mol/LNH4SCN标准液滴定过量的AgNO3溶液,重复实验三次,平均消耗标准液10.00mL,则25.00mL水解液中,所以产品中,根据氯原子守恒可知,,则产品1,2-二氯乙烷的纯度为;
③防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,因此实验中加入硝基苯的作用是防止在滴加NH4SCN溶液时,AgCl沉淀转化为AgSCN沉淀。
答案第1页,共2页
答案第1页,共2页
同课章节目录
