2022届高三化学高考备考二轮复习必刷题——工业流程题(Word版含答案)
文档属性
| 名称 | 2022届高三化学高考备考二轮复习必刷题——工业流程题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-18 16:25:11 | ||
图片预览



文档简介
2022届高三化学高考备考二轮复习必刷题——工业流程题
1.(2022·山东日照·模拟预测)是一种前景很好的锂离子电池电极材料。以废旧锂离子电池为原料回收合成的工艺如下。
回答下列问题:
(1)溶液中金属离子浓度用表示,随溶液变化如图所示。当溶液中某离子浓度小于时认为沉淀完全。
①“酸浸”后滤液中含有、、、,滤渣1成分为_______。
②如果“调”后溶液中浓度为,则“调”的范围是_______;下列试剂最适合作为物质X的是_______(填字母)。
a.双氧水 b.氨水 c.盐酸 d.
(2)“除锰”反应的离子方程式为_______。
(3)“合成”过程发生反应的化学方程式为_______。
(4)一种薄膜(只允许通过)锂离子电池的充电过程如图所示。该电池放电时的正极反应式为_______。放电时,当外电路通过电子时,非晶硅薄膜上质量变化_______g。
2.(2022·河南·三模)三氯化钌(RuCl3 )和硫化铋(Bi2S3)用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、Bi2O3、SiO2)回收RuCl3和Bi2S3的工艺流程如下:
已知:
I.滤液1中溶质的主要成分为Na2 RuO4、NaBiO2、NaCl和Na2SiO3;
Ⅱ.RuO4的沸点为40℃,易挥发,微溶于水,极易溶于CCl4,RuO4有强氧化性,超过100℃时,RuO4就爆炸分解,室温下与乙醇接触也易爆炸;
Ⅲ.Ksp(Bi2S3)=1.0×10-20。
回答下列问题:
(1)“氧化碱浸”时,为提高反应速率,可采取的措施有_______ (写出两条)。
(2)向滤液1中加入乙醇生成Ru(OH)4沉淀和乙醛,则“转化”过程中乙醇作_______(填“氧化剂”或“还原剂”)。
(3)①Ru(OH)4与NaClO发生反应的化学方程式为_______;反应过程中NaClO的利用率与温度的关系如图所示,温度高于25℃时NaClO的利用率开始下降,主要原因可能是_______。
②“蒸馏”过程中常采用的加热方式为_______。
(4)盐酸“吸收”RuO4过程中产生的Cl2经进一步处理可以转化为_______、 _______(填两种物质的名称),在本工艺流程中循环利用。
(5)滤渣3的主要成分为_______(填化学式)。
(6)“沉淀”时,向1L 1.0 mol· L-1BiCl3溶液中加入0.2L Na2S溶液,反应后混合溶液中c(S2-)为1×10-6mol·L-1,则Bi3+的沉淀率为_______(忽略溶液体积变化)。
3.(2022·山东·新泰市第一中学二模)天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是_______。
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是_______。液体a的电子式是_______。
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是_______。
(4)“还原”中氧化剂是_______(填化学式)。
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用_______
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是_______。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是_______。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是_______。
4.(2022·福建·模拟预测)用黄铁矿(主要成分FeS2)还原硫酸渣制备铁黄颜料(主要成分为FeOOH),工业流程如下:
c(Fe2+)或c(Fe3+)浓度分别为 1 mol L-1,形成对应沉淀的pH范围如下表:
Fe(OH)2 FeOOH
开始沉淀的pH 5.8 1.2
沉淀完全的pH 8.3 2.8
(1)步骤②被氧化的元素是_______。
(2)碱性锌锰电池使用时会产生与FeOOH同类物质,该物质化学式是_______。
(3)制备晶种:将NaOH按一定计量比加入到FeSO4溶液中,产生白色沉淀。调至pH约为6时,开始通入空气并记录pH 变化如图。
① pH约为6时,通入空气前,铁元素的主要存在形式是_______;0~t1时段,白色沉淀发生变化,pH 基本不变的原因是_______(用化学方程式说明)。
②pH 约为4时制得铁黄晶种。若继续通空气,t3后pH 几乎不变,此时c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。请结合方程式说明原因:_______。
(4)二次氧化时,溶液的pH 应控制在3~4,过低会造成铁黄质量降低,原因可能是_______。
(5)步骤④中证明洗涤完全的方法是_______。
(6)称取铁黄产品1.000 g,用稀硫酸溶解并配成200 mL溶液,每次取20.00 mL,调节合适的pH,用0.1 000 mol/L的磺基水杨酸(H2Y)标准溶液滴定,三次滴定平均消耗体积为22.00 mL,则该产品纯度为_______%。 (已知:Fe3++2H2Y=[FeY2]-+4H+)
5.(2022·辽宁·二模)锡是一种质地较软的金属,可塑性强,能制成多种款式的产品。工业上常从锡矿中冶炼锡,其工艺流程如下:
已知:
I.锡精矿:含Sn40~70%,还含有W、S、Si、Cu、Pb、Fe、Zn等元素
II.滤渣的成分为:SnO2、Fe2O3、SiO2等
III.硬头:Sn 46%、Fe 44%等
按要求回答下列问题:
(1)Sn为50号元素,请写出Sn在元素周期表的位置_______。
(2)氧化焙烧产生的气体为_______,其可造成的环境污染是_______。
(3)加Na2CO3焙烧时,Na2CO3与WO3反应的化学方程式为_______。
(4)操作1的名称是_______。洗涤CaWO4沉淀,判断是否洗净的方法是_______。
(5)还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体,写出该反应的化学方程式_______。
(6)“熔析”时吹入空气或水蒸气,使铁、锌、铅形成浮渣而上浮。Fe在高温时可与水蒸气反应,其化学方程式为_______。
(7)用含SnSiF6、H2SiF6、H2SO4的混合液作电解液电解精炼Sn时,粗锡作_______极。维持电流强度为10A,电解池工作五分钟,理论产生Sn_______g(保留3位有效数字)。(已知:F=96500C/mol)
6.(2022·江西上饶·模拟预测)五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、SiO2等)来制备V2O5的一种工艺流程如下:
已知:①含钒离子在溶液中的主要存在形式与溶液pH的关系:
溶液pH <4.0 6.0-8.0 8.0-10.0
钒元素主要存在形式 VO VO V2O
②溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全。Fe3+、A13+、Cu2+沉淀完全的pH分别为:3.2、4.7、6.4
③VO和VO之间存在转化关系:VO+H2OVO+2H+
请回答下列问题:
(1)滤渣1主要成分是_______(写名称)
(2)“酸浸氧化”后钒元素主要以VO形式存在,请写出V2O3溶解过程中发生的离子反应方程式_______。
(3)加入氨水调pH=7时,溶液中会产生大量的VO。请用平衡移动原理进行解释_______。
(4)沉钒后所得沉淀要进行洗涤,检验沉淀是否洗净的方法是_______。
(5)已知NH4VO3难溶于水,常温时Ksp=3.0×10-8,向10mL0.2mol·L-1NaVO3的滤液中加入等体积的(NH4)2SO4溶液(忽略混合过程中的体积变化),欲使VO沉淀完全,则(NH4)2SO4溶液的最小浓度为_______(保留三位有效数字)。
(6)“煅烧”过程中的化学反应方程式_______副产物可在_______过程中循环使用。
7.(2022·辽宁·模拟预测)柠檬酸亚铁(FeC6H6O7,摩尔质量:246g/mol)是一种易被人体吸收的高效铁制剂,某研究团队用硫铁矿(成分为60%FeS2、Al2O3、SiO2及其他杂质)为原料来制备柠檬酸亚铁,其流程如下图:
已知:(1)“焙烧”生成了铁红;
(2)常温下,柠檬酸()电离常数: ,, , Ksp(Al(OH)3)=1.3×10-33
(1)焙烧时气体与矿料逆流而行,目的是___________,“焙烧”过程中氧化剂和还原剂的物质的量之比为___________。
(2)已知:FeS2与H2SO4不反应。则“还原”时FeS2发生反应的离子方程式为___________。
(3)柠檬酸亚铁(FeC6H6O7)是一种___________盐(填“正”“酸式”或“碱式”),0.1mol/LNa2C6H6O7溶液呈___________性。(填“酸”、“碱”或“中”)
(4)若铝离子浓度为0.1mol/L,通过计算判断,“除铝”中调节pH=2时是否产生氢氧化铝沉淀___________。(写出计算过程)
(5)“沉铁”时需控制温度在32℃左右,其可能的原因是___________。
(6)某工厂用1kg硫铁矿经上述流程制得1.6kg柠檬酸亚铁,则柠檬酸亚铁的产率为______。(保留四位有效数字)
8.(2022·上海·模拟预测)铋主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为Bi2O3,含有PbO、Ag2O、CuO)为原料提取Bi的工艺流程如图:
已知:Ⅰ.BiCl3可水解生成不溶于水的BiOCl
Ⅱ.25℃时,Ksp[Cu(OH)2]=1.2×10-20;Ksp(PbCl2)=1.17×10-5
回答下列问题:
(1)“浸出”时,若c(HCl)=1mol/L时,铋的浸出率和Cl-浓度的关系如图所示,其中NaCl的作用是____;若升高温度,反应相同的时间,铋的浸出率先升高后降低,则浸出率下降的主要原因可能是____和____。
(2)“滤渣Ⅰ”的成分为____(填化学式)。
(3)“沉铜”时向“滤液Ⅱ”中加入NaOH溶液,可促进Cu2+水解生成Cu3(OCl)2沉淀,请写出“沉铜”的离子方程式____。若“滤液Ⅱ”中c(Cu2+)为0.01mol·L-1,常温下加入等体积的NaOH溶液使pH恰好为6时,出现Cu(OH)2沉淀,此时Cu2+的去除率为____(忽略溶液体积变化)。
(4)可循环利用的物质是____。
(5)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
水解工序时Bi3+发生反应的离子方程式为____。
9.(2022·重庆·二模)铝在我国储量居世界前列,被广泛应用于钢铁、石油、化工、电气和电子技术、医药和农业等领域。钼酸钠晶体()是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是,含少量等)为原料生产钼酸钠晶体的工艺流程图。
请回答下列问题:
(1)气体A的主要成分是_______(填化学式),为了提高浸取率所采取的措施是_______(写一条即可)。
(2)在焙烧炉中焙烧时,采用多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧,采用“多层逆流”的目的是_______。
(3)“焙烧”时转化为,浸取过程中含钼化合物发生反应的离子方程式为_______。
(4)在加入除时,若溶液较小,会产生的不良后果是_______,原因是_______(用平衡移动原理解释)。
(5)流程中“…”在实验室的操作为_______、_______、过滤、洗涤、干燥。
(6)分析化学上测定钼的含量,通常是把经过一系列变化得的方法来测定。实验室称量钼精矿,经过一系列变化得到,则理论上钼精矿中钼的百分含量为_______。
10.(2022·辽宁·模拟预测)高铁酸钾()是一种新型水处理剂,既能杀菌又能生成胶体吸附悬浮物,其制备流程如图所示:
已知:①的溶解度大于;②在碱性条件更稳定。回答以下问题:
(1)高铁酸钾()中铁元素在周期表的位置是第_______周期第_______列。
(2)写出“常温氧化”的离子方程式_______。
(3)若在“水溶混合”和“常温氧化”过程中分别加入和,则在“浸洗溶解”过程之前需发生反应的化学方程式是_______。
(4)“洗涤烘干”过程中使用乙醇洗涤,其目的是_______(答两点)。
(5)“常温氧化”过程中,测得氧化时间、氧化剂浓度与产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在_______min,氧化剂浓度应控制在_______。
(6)高铁酸钾产品纯度测定方法如下(杂质不参与反应):在一定条件下,将1.32g样品与过量溶液反应后配成溶液,每次取10.00mL于锥形瓶中,加入指示剂后,用的标准溶液滴定,则终点的操作和现象是_______。
(7)还有一种电解法制备高铁酸盐。以多孔的磁铁矿代替纯铁电极作阳极,写出以此材料在碱性条件下制备高铁酸盐的电极反应式_______。
11.(2022·黑龙江·哈九中二模)工业上常采用堆浸-反萃取-电积法从锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图所示。
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH较高时,氢氧化氧铁为胶状沉淀;③在我国,富矿少、贫矿多,品位低于5%的矿山属于贫矿。回答下列问题:
(1)“堆浸渣”的主要成分为_______,“堆浸”时为了提高反应速率,可以采取的措施为_______ (填标号)。
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,Zn2+、Cu2+、Ni2+的去除率均升高,原因可能为_______。
(3)“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为_______。
(4)“萃取”时需要进行多次萃取且合并萃取液,其目的是_______ ,操作③的名称为_______,此流程中可循环利用的物质有锌、萃取剂和_______。
(5)反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为_______ ,灼烧时需要借助马弗炉(Mufflefurnace,一种通用的加热设备,通常叫电炉等)和下列哪些仪器_______(填标号)共同完成。
(6)“电积”时在_______极获得锌,得到的锌的质量分数为96.0% 。某企业利用上述流程从1600吨锌矿中可获得此种锌的质量为80吨,已知上述流程的总损耗率约为2%,则该锌矿为_______ (填“富矿”或“贫矿”)。
12.(2022·广东·执信中学模拟预测)碳酸镍是合成纳米镍的一种前驱体。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高的碳酸镍的工艺流程如图:
已知:H2S的电离常数,,;
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸:
①金属镍溶解的离子方程式是_______。
②“酸溶”时产生的废渣成分有_______。
③该过程控制温度70℃-80℃的原因是_______。
(2)“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀对后续操作较为有利:
①黄钠铁矾中Fe元素的化合价为_______。
②“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是_______。
(3)“除铜”后,溶液中c(H2S)=0.1mol·L-1,c(Ni2+)=0.1mol·L-1,溶液中c(H+) ≥_______mo1·L-1(列计算式)才不会使Ni2+形成NiS沉淀。
(4)“沉镍”后,滤液的主要成分是_______。
(5)“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为_______。
13.(2022·重庆·西南大学附中模拟预测)三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化。实验室制备三氯化铬的流程如下:
还原反应在图甲所示装置中进行,制备过程在图乙所示装置中进行:
(1)图甲中仪器b的主要作用除导气外,还有___________。
(2)“还原”过程中会有CO2产生,请写出该反应的离子方程式:___________。
(3)A中的试剂为___________;无水CaCl2的作用是___________;反应结束后继续通入一段时间氮气,主要目的是___________。
(4)装置E用来收集产物,实验过程中若D处出现堵塞,可通过___________(填操作),使实验能继续进行。
(5)样品中三氯化铬质量分数的测定
已知:CrCl3在水中易形成稳定的络离子[Cr(H2O)5Cl]2+;(白色沉淀);三氯化铬样品中的杂质不参与反应。
实验步骤如下:
①称取a g样品于锥形瓶中,加入水配成溶液。
②向锥形瓶中加入b mol/L的AgNO3溶液c mL,使溶液中Cl-完全沉淀。
③过滤除去AgCl沉淀,并用稀HNO3洗涤沉淀,将洗涤液合并在滤液中。
④加入2~3滴Fe(NO3)3溶液做指示剂,用d mol/L NH4SCN标准溶液反滴定过量Ag+至终点,记下所用NH4SCN溶液的体积为e mL。
Ⅰ.确定步骤②中Cl-已经完全沉淀的操作与现象为___________。
Ⅱ.若步骤③中未用稀HNO3洗涤沉淀,则测定的三氯化铬质量分数将___________(填“偏大”“偏小”或“无法确定”)。
Ⅲ.样品中三氯化铬的质量分数为___________(用含a、b、c、d、e的代数式表示)。
14.(2022·四川·成都七中模拟预测)软锰矿-硫铁矿制取电池级二氧化锰的工艺流程如下图:
回答下列问题:
(1)“浸取”过程主要反应3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O,则氧化剂与还原剂物质的量之比为_______。
(2)“氧化i”过程软锰矿的作用是_______。
(3)“除铁”后溶液中残留的c(Fe3+)=_______mol·L-1。[25℃时,Fe(OH)3的Ksp为1.0×10-39]
(4)“沉锰”过程Mn2+转化为MnCO3的离子方程式为_______;NH3·H2O的作用是_______。
(5)“焙烧”过程MnCO3转化为MnO2的化学方程式为_______。
(6)“氧化ii”过程中,将Mn(II)转化为Mn(IV)的最适宜氧化剂是_______(填标号)。
a.H2O2 b.Cl2 c.KClO3
(7)将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为:,放电时正极的电极反应式为_______。
15.(2022·江苏·一模)电池级碳酸锂是制造LiCoO2等锂离子电池必不可少的原材料。以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、等)制取电池级Li2CO3的工艺流程如下:
已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生反应:Fe3++3HR FeR3+3H+,生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:
(1)HR萃取剂使用前先用一定量的NaOH进行处理的目的是___________。
(2)沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:___________。
(3)过滤1后所得沉淀用热水洗涤的目的是___________。
(4)其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是___________。
16.(2022·湖南常德·模拟预测)以经焙烧处理的锌冶炼钴渣(主要含有、、、,少量、、、、、等杂质)为原料制备电池级、混合液的工艺流程如下:
已知:常温下,,。
回答下列问题:
(1)“浸渣”的主要成分是___________。
(2)“浸出”时,转化为,写出该反应的离子方程式___________。
(3)若溶液中金属离子浓度为,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保恰好沉淀完全而不沉淀,的值有何要求?___________(列式计算说明)。
(4)“氟化物”为___________(填标号)。
A. B. C. D.
(5)萃取时,发生反应:。采取“逆流萃取”的作用是___________,有机相可通过硫酸处理后得到的副产品为___________(填化学式)。
17.(2022·福建·模拟预测)实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:
(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4),待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________(写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
a.不使用Na2CO3溶液的原因是___________。
b.不使用NH4HCO3溶液的原因是___________。
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 、 d
(2)
(3)
(4) 1.4
【解析】
加入硫酸酸浸,滤液中含有、、、,后面一步是除锰,说明调pH除去的是、,则滤渣1为、,加入使转化为MnO2除去,加入NaOH生成Ni(OH) 2,过滤分离得到Ni(OH) 2,Ni(OH) 2和LiOH、氧气反应生成。
(1)
①由上述分析可知,调pH除去的是、,则滤渣1为、,故答案为:、;
②由图可知,Al3+完全沉淀时,Fe3+已经完全沉淀,因此pH最小值应为4.7,当Ni2+完全沉淀时,pH=8.8,则,,则的,如果“调”后溶液中浓度为,溶液中,,,pH=6.3,因此“调pH”的范围是;试剂X用于调pH除去、,为了不引入杂化,最适合作为物质X的是NiO,故选d,故答案为:;d;
(2)
加入使转化为MnO2除去,发生的反应为,故答案为:;
(3)
Ni(OH) 2和LiOH、氧气反应生成,则“合成”过程发生反应的化学方程式为,故答案为:;
(4)
由图可知,充电时,a极发生反应,该反应为还原反应,则a为阴极,b为阳极,阳极上LiNiO2失去电子转化成,电极反应式为,则放电时a为负极,电极反应式为,b为正极,正极的电极反应式为 ;放电时,a极的电极反应式为,非晶硅薄膜上变化的质量为Li+的质量,当外电路通过电子0.2mol时,非晶硅薄膜上的质量变化为,故答案为:;1.4。
2.(1)适当升高温度、减小废催化剂颗粒直径(或适当增加氢氧化钠和次氯酸钠溶液的浓度、搅拌等)
(2)还原剂
(3) Ru(OH)4+2NaClO=RuO4 +2NaCl +2H2O 温度高于25℃时,次氯酸钠的水解程度增大,产生的次氯酸受热分解,导致NaClO的利用率下降 水浴加热
(4) 次氯酸钠 盐酸
(5)H4SiO4(或H2SiO3)
(6)88%
【解析】
题给流程可知,含钌的废料中加入氢氧化钠溶液和次氯酸钠溶液氧化碱浸时,Ru和Pb被氧化为RuO和NaHPbO2,SiO2和Bi2O3与氢氧化钠溶液反应生成Na2SiO3和NaBiO2,过滤得到含有RuO、NaBiO2、NaHPbO2和Na2SiO3的滤液1;向滤液1中加入乙醇,将RuO还原为Ru(OH)4沉淀,过滤得到滤液2和Ru(OH)4;Ru(OH)4在蒸馏条件下被氯酸钾氧化为RuO4,RuO4与盐酸反应生成RuCl3、Cl2和H2O,RuCl3溶液经结晶得到RuCl3;滤液2加入盐酸酸化,得到含有乙醛、BiCl3、NaCl的溶液和H4SiO4(或H2SiO3)的沉淀,向溶液中加入Na2S沉淀BiCl3得到Bi2S3,据此分析解答。
(1)
含钌、铋的废催化剂在“氧化碱浸”时为提高反应速率,可采取的措施有适当升高温度、减小废催化剂颗粒直径、适当增加氢氧化钠和氧化剂溶液的浓度、搅拌等;
(2)
由分析可知,滤液1中含有Na2RuO4、NaBiO2、NaCl和Na2SiO3,加入乙醇,溶液中的RuO与乙醇反应生成Ru(OH)4沉淀和乙醛,钌元素化合价降低,RuO作氧化剂,则乙醇作还原剂;
(3)
①Ru(OH)4与NaClO发生反应生成RuO4、NaCl和H2O,其化学方程式为Ru(OH)4+2NaClO=RuO4+2NaCl+2H2O;温度高于25℃时,次氯酸钠的水解程度增大,产生的次氯酸受热分解,总反应为2NaClO2NaCl+O2↑,导致NaClO的利用率下降;
②RuO4的沸点为40℃,超过100℃时,RuO4就爆炸分解,故“蒸馏”过程中应用温度稍高于40℃的水浴加热;
(4)
结合流程图,盐酸“吸收”RuO4过程中产生的Cl2经进一步处理可以转化为次氯酸钠、盐酸,循环利用;
(5)
滤液2中含有乙醛、NaBiO2、NaCl和Na2SiO3,加入盐酸生成硅酸沉淀和含有乙醛、BiCl3、NaCl的溶液,故滤渣3的主要成分为H4SiO4或H2SiO3;
(6)
混合溶液中c(S2-)为1×10-6mol/L,由Ksp(Bi2S3)=1.0×10-20=c2(Bi3+)·c3(S2-),可知c(Bi3+)=0.1 mol/L,则混合溶液中n(Bi3+)=0.1 mol/L×1.2L=0.12 mol,沉淀的Bi3+的物质的量为1 mol-0.12 mol=0.88 mol,Bi3+的沉淀率为×100%=88%。
3.(1)ZrSiO4+ 4C+3Cl2ZrCl2↑+SiCl4↑ +4CO↑
(2) 保持干燥
(3)向漏斗中加浓盐酸至没过沉淀,让溶液自然流下,重复2-3次
(4)ZrO2
(5) 重结晶 锆、铪配离子[MF6]2-与阴离子交换树脂的结合能力不同 萃取 3K2ZrF6+4Al6KF+4AlF3+3Zr
【解析】
锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气和足量的焦炭反应,ZrSiO4转化为ZrCl4,加水水解,ZrCl4转化为ZrOCl2·8H2O,900℃加热分解,得到二氧化锆,加入镁置换得到海绵锆,据此分析解题。
(1)
“高温气化”中可发生多个反应,主要反应为ZrSiO4与足量的氯气和足量的焦炭反应生成ZrCl2、SiCl2、CO,化学方程式是:ZrSiO4+ 4C+3Cl2ZrCl2↑+SiCl4↑ +4CO↑;
(2)
分馏过程中,为防止产品变质,ZrCl4遇水强烈水解,过程中一定需要注意的是保持干燥。高温气化生成杂质SiCl4,ZrCl4是白色固体,液体a为SiCl4,电子式是 ;
(3)
在浓盐酸中会析出ZrOCl2·8H2O沉淀,实验室中洗涤ZrOCl2·8H2O沉淀操作是向漏斗中加浓盐酸至没过沉淀,让溶液自然流下,重复2-3次;
(4)
900℃加热分解,得到二氧化锆,加入镁置换得到海绵锆,Zr的化合价降低,二氧化锆为氧化剂;
(5)
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用重结晶方法进行分离;
②离子交换法:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是锆、铪配离子[MF6]2-与阴离子交换树脂的结合能力不同;
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离,这种分离方法是萃取,利用溶液度的不同;在高温条件下,加入铝将制得的K2ZrF6还原可得锆,根据元素守恒,反应的化学方程式是:3K2ZrF6+4Al6KF+4AlF3+3Zr。
4.(1)S(或硫)
(2)
(3) Fe2+或FeSO4、Fe(OH)2 溶液中存在两个氧化反应和,因此c(Fe2+)降低量大于c(Fe3+)增加量
(4)pH过低会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,铁黄产品质量降低
(5)取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净
(6)97.9
【解析】
硫酸渣加入硫酸酸溶得到含Fe3+悬浊液,加入FeS2将溶液中的Fe3+还原为Fe2+并得到S,过滤得到硫磺和含Fe2+的溶液,向滤液中加入NaOH、通入空气,得到晶种,然后把晶种加入到二次氧化的铁黄浆料,得到FeOOH,过滤得到湿铁黄,然后经过洗涤干燥得到产品。
(1)
步骤②中加入FeS2将溶液中的Fe3+还原为Fe2+,经过滤得到硫磺,生成了S,反应过程中,S元素的化合价升高,被氧化,故答案为:S(或硫);
(2)
碱性锌锰电池使用时,发生的反应为,生成的与FeOOH同类的物质为,故答案为:;
(3)
①将NaOH按一定计量比加入到FeSO4溶液中,产生白色沉淀,该白色沉淀为Fe(OH)2,则通入空气前,铁元素的主要存在形式是Fe2+或FeSO4、Fe(OH)2;0~t1时段,通入氧气后,Fe(OH)2被氧化成Fe(OH)3,反应的化学方程式为,该反应既不消耗氢离子或氢氧根离子,也不产生氢离子或氢氧根离子,不影响溶液的pH,所以该过程中pH 基本不变,故答案为:;
②溶液中存在两个反应和,总反应为,反应过程中氢离子和氢氧根离子浓度没有变化,因此t3后溶液的pH几乎不变,该反应消耗的Fe2+大于生成的Fe3+,因此c(Fe2+)降低量大于c(Fe3+)增加量,故答案为:溶液中存在两个氧化反应和,因此c(Fe2+)降低量大于c(Fe3+)增加量;
(4)
根据表中数据可知,FeOOH开始沉淀的pH=1.2,完全沉淀时pH=2.8,若pH过低,会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,导致铁黄产品质量降低,因此二次氧化时,溶液的pH 应控制在3~4,故答案为:pH过低会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,铁黄产品质量降低;
(5)
步骤④若未洗涤完全,产品中会含有硫酸根离子,因此证明洗涤完全只需证明产品中不含硫酸根离子,具体方法为:取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净,故答案为:取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净;
(6)
滴定时20.00 mL产品消耗的H2Y的物质的量为22×10-3L×0.1 000 mol/L=0.0022mol,根据Fe3++2H2Y=[FeY2]-+4H+可知,200 mL溶液产品中n(Fe3+)=0.0011×10=0.011mol,则该产品纯度为,故答案为:97.9。
5.(1)第5周期第IVA族
(2) SO2 酸雨
(3)Na2CO3+WO3Na2WO4+CO2↑
(4) 过滤 取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净
(5)SnO2+2CSn+2CO
(6)3Fe+4H2O(g) Fe3O4+4H2
(7) 阳 1.85
【解析】
由题干流程图可知,“氧化焙烧”是将锡精矿中Sn、W、S、Si、Cu、Pb、Fe、Zn等元素分别氧化为SnO2、WO3、SO2、SiO2、CuO、PbO2、Fe2O3、ZnO,在与Na2CO3一起焙烧,得到Na2WO4,Na2SiO3,加水溶解并过滤得到滤液主要是Na2WO4溶液,和滤渣主要成分为SnO2、Fe2O3、SiO2等,滤渣与C和CaCO3还原熔炼,则将SnO2、Fe2O3还原成Sn和Fe,SiO2与CaCO3转化为CaSiO3,经过对硬头进行进一步提出得到粗锡,再熔析除去Fe、Zn、Pb等,得到97%的粗锡,然后进行电解精炼即可得到精锡,据此分析解题。
(1)
由题干信息可知Sn为50号元素,36<50<54,说明Sn在第5周期第50-36=14列,即第IVA族,即Sn在元素周期表的位置为第5周期第IVA族,故答案为:第5周期第IVA族;
(2)
由题干信息I可知,精锡矿的的主要成分中只有S粉燃烧可以转化为气体SO2,则氧化焙烧产生的气体为SO2,SO2可造成的环境污染是酸雨,故答案为:SO2;酸雨;
(3)
根据流程图可知,加Na2CO3焙烧时,Na2CO3与WO3反应生成Na2WO4,故该反应的化学方程式为Na2CO3+WO3Na2WO4+CO2↑,故答案为:Na2CO3+WO3Na2WO4+CO2↑;
(4)
由题干流程图可知,操作1分离不溶性固体和溶液,则操作1的名称是过滤,洗涤CaWO4沉淀,判断是否洗净的方法是检验最后一次洗涤滤液中是否含有Cl-即可,故检验的方法为:取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净,故答案为:过滤;取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净;
(5)
由题干流程图可知,还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体即为CO,即SnO2和C反应生成Sn和CO,根据氧化还原反应配平可得,该反应的化学方程式为:SnO2+2CSn+2CO,故答案为:SnO2+2CSn+2CO;
(6)
已知Fe在高温时可与水蒸气反应生成Fe3O4和H2,则该反应的化学方程式为3Fe+4H2O(g) Fe3O4+4H2,故答案为:3Fe+4H2O(g) Fe3O4+4H2;
6.(1)二氧化硅
(2)V2O3+2H2O2+2H+=2VO+3H2O
(3)加入氨水,消耗H+,c(H+)减小,使得可逆反应VO+H2OVO+2H+平衡正向移动,故溶液中会产生大量的VO
(4)取最后一次洗涤液少量于试管中,滴加BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净
(5)0.103mol·L-1
(6) 2NH4VO32NH3↑+V2O5+H2O 调pH
【解析】
含钒废料(含V2O3、Fe2O3、Al2O3、CuO、SiO2等)研磨后加入硫酸酸溶,双氧水氧化,得到滤渣1为SiO2,滤液加入适量氨水调节pH可生成氢氧化铁、氢氧化铝、氢氧化铜沉淀,同时将溶液中的VO转化为VO,过滤后滤液加入硫酸铵,可得到NH4VO3,煅烧可生成V2O5,以此解答该题。
(1)
根据以上分析可知滤渣1主要成分是SiO2;
(2)
“酸浸氧化”后钒元素主要以VO形式存在,这说明V2O3被双氧水氧化,则V2O3溶解过程中发生的离子反应方程式为V2O3+2H2O2+2H+=2VO+3H2O;
(3)
由于加入氨水,消耗H+,c(H+)减小,使得可逆反应VO+H2OVO+2H+平衡正向移动,故溶液中会产生大量的VO;
(4)
若NH4VO3未洗涤干净,则固体上会附着硫酸根离子,因此检验NH4VO3已洗涤干净,只要检验最后一次洗涤液中没有硫酸根离子即可,则检验沉淀是否洗净的方法是取最后一次洗涤液少量于试管中,滴加BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净;
(5)
二者反应时需要10mL0.1 mol/L硫酸铵,VO沉淀完全后溶液中铵根浓度是mol/L=0.003 mol/L,则对应硫酸铵的浓度是=0.003 mol/L,所以(NH4)2SO4溶液的最小浓度为0.003 mol/L+0.1mol/L=0.103mol/L。
(6)
依据原子守恒可知“煅烧”过程中的化学反应方程式为2NH4VO32NH3↑+V2O5+H2O,副产物是氨气,则副产物可在调pH过程中循环使用。
7.(1) 增大固体与气体的接触面积,提高焙烧速率 11:4
(2)FeS2+2Fe3+=3Fe2++2S
(3) 酸式 酸
(4)没有沉淀产生,因为常温下,Qc=0.1×(10-12)3=10-37<Ksp(Al(OH)3)=1.3×10-33
(5)温度太低了,反应速率慢;温度高了,NH4HCO3发生分解
(6)86.72%
【解析】
硫铁矿(主要成分为FeS2、SiO2、Al2O3)煅烧生成氧化铁和二氧化硫,用稀硫酸酸浸,二氧化硅不溶,过量得到滤渣1,溶液中含有硫酸铁、硫酸铝,加入FeS2还原铁离子得到单质硫沉淀,滤液调节pH除去铝,过滤,向滤液中加入碳酸氢铵沉铁,过滤得到碳酸亚铁,然后经过一系列操作得到柠檬酸亚铁(FeC6H6O7),据此解答。
(1)
焙烧时气体与矿料逆流而行,可以增大固体与气体的接触面积,提高焙烧速率,根据以上分析可知“焙烧”过程中发生反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,反应中O2为氧化剂,FeS2为还原剂,则“焙烧”过程中氧化剂和还原剂的物质的量之比为11:4,故答案为:增大固体与气体的接触面积,提高焙烧速率;11:4;
(2)
FeS2与H2SO4不反应,“还原”时FeS2被铁离子氧化,发生反应的离子方程式为FeS2+2Fe3+=3Fe2++2S,故答案为:FeS2+2Fe3+=3Fe2++2S;
(3)
由题干信息可知,柠檬酸是一种三元酸,故柠檬酸亚铁(FeC6H6O7)是一种酸式盐,由题干信息可知,常温下,柠檬酸()电离常数,,, ,Kh2===5.78×10-8小于Ka3,即的电离大于水解,故0.1mol/LNa2C6H6O7溶液呈酸性,故答案为:酸式;酸性;
(4)
若铝离子浓度为0.1mol/L, “除铝”中调节pH=2时即溶液中的c(OH-)=10-12mol/L,通过计算判断可知,c(Al3+)c3(OH-)=0.1×(10-12)3=10-37<1.3×10-33,则不产生氢氧化铝沉淀,故答案为:没有沉淀产生,因为常温下,Qc=0.1×(10-12)3=10-37<Ksp(Al(OH)3)=1.3×10-33;
(5)
温度太低了,反应速率慢;温度高了,NH4HCO3发生分解,故“沉铁”时需控制温度在32℃左右,故答案为:温度太低了,反应速率慢;温度高了,NH4HCO3发生分解;
7.(1) 增大Cl-浓度,提高浸出率 HCl挥发 Bi3+水解程度增大,生成难溶的BiOCl
(2)AgCl、PbCl2
(3) 3Cu2++ 4OH-+2Cl-=Cu3(OCl)2+2H2O 97.6%
(4)NaCl
(5)Bi3++Cl-+H2O=BiOCl+2H+
【解析】
氧化铋渣的主要成分为,含有、、杂质,由流程可知,加盐酸、饱和食盐水分离出滤渣Ⅰ为、,过滤后滤液加生成,滤液Ⅱ含铜离子,再加生成,滤液Ⅲ含,可在浸出步骤中循环使用,中加入热发生,高温下C与熔炼生成,以此来解答。
(1)
铋的浸出率随浓度增大而增大,因此的作用是增大浓度,提高浸出率;由于升高温度,受热会发,且水解程度增大,生成难溶的,因此浸出率下降;
(2)
根据以上分析可知“滤渣Ⅰ”的成分为、;
(3)
“沉铜”时,向“滤液Ⅱ”中加入溶液调节pH,生成,离子方程式为;若“滤液II”中为,常温下加入等体积的溶液使pH恰好为6时,出现沉淀,根据4的溶度积常数可知,且等体积混合,此时的去除率为;
(4)
“滤液Ⅲ”中含,经加热浓缩后可返回浸出工序循环使用;
(5)
由流程图可知水解工序时Bi3+和氯离子和水反应生成BiOCl,故其对应的离子方程式为:Bi3++Cl-+H2O=BiOCl+2H+。
9.(1) SO2 粉碎矿石
(2)增加固体和气体的接触面积,加快反应速率,使原料尽可能反应提高原料利用率
(3)MoO3+ CO= MoO+CO2↑
(4) PbS的沉淀不完全 PbSPb2++S2-,若溶液较小,则氢离子浓度较大,氢离子与硫离子生成硫化氢,导致硫离子浓度减小,PbS的沉淀溶解平衡正向移动
(5) 蒸发浓缩 降温结晶
(6)30
【解析】
(1)
钼精矿(主要成分是,含少量等),在空气中焙烧硫元素会转化为二氧化硫气体,故气体A的主要成分是SO2;对于固体来说,粉碎可以增大接触面积,从而加快反应速度,提高反应效率;
(2)
采用“多层逆流”的目的是增加固体和气体的接触面积,加快反应速率,使原料尽可能反应提高原料利用率;
(3)
由流程可知,浸取过程中生成二氧化碳,反应中各元素化合价没有改变,钼元素转化为MoO,反应为MoO3+ CO= MoO+CO2↑;
(4)
PbSPb2++S2-,若溶液较小,则氢离子浓度较大,氢离子与硫离子生成硫化氢,导致硫离子浓度减小,PbS的沉淀溶解平衡正向移动,导致PbS的沉淀不完全;
(5)
流程中“…”得到钼酸钠晶体,在实验室的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(6)
反应前后元素种类不变,则理论上钼精矿中钼的百分含量为。
10.(1) 四 8
(2)
(3)
(4)除去杂质,减少的溶解,提高产率,易快速干燥
(5) 60 1.1
(6)当加入最后半滴时,溶液由蓝色变为无色,且半分钟不变化
(7)
【解析】
(1)
铁在周期表的第四周期第8列(新周期表中的族第Ⅷ族为副族但不标B,主张族以列为好)
(2)
“常温氧化”中氧化剂是,还原剂是,碱性条件
(3)
若是改用钠盐的话,生成的,需要转化为钾盐,题中信息说明钾盐比钠盐溶解度小,所以钠盐可以转化钾盐。
(4)
“洗涤烘干”由于能溶于水,不能用水洗,选用乙醇洗,既可减少钾盐的溶解,提高钾盐的产率,乙醇易挥发,可以更快地挥发并带走水份,易快速干燥。
(5)
为了获取更纯的高铁酸钾,根据图和图可知,反应时间应控制在,氧化剂浓度应控制在,故答案为:;;
(6)
碘与淀粉相遇变蓝,用的标准溶液滴定,当加入最后半滴时,溶液由蓝色变为无色,且半分钟不变化即为滴定终点;
(7)
根据题意可知, 做电极材料,电解过程中,转化为,电极方程式为:。
【点睛】
本题考查无机化学工艺、物质的分离和提纯实验操作、电解质溶液离子浓度大小比较、元素守恒和元素守恒的计算,综合性较强,侧重于实验能力、计算能力、理论应用能力的考查,题目难度中等。
11.(1) SiO2 AD
(2)有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高
(3)5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O
(4) 充分萃取,提高Zn2+的萃取率、以提高Zn2+的利用率 分液 H2SO4
(5) ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O e
(6) 阴 贫矿
【解析】
锌矿(主要成分为ZnS以及FeS2、CuS、NiS、SiO2等)中加入野外细菌堆浸,金属硫化物转化为硫酸盐,SiO2不反应,堆浸渣中含有SiO2等难溶物,堆浸液中含有硫酸锌、硫酸铜、硫酸镍、硫酸亚铁等物质;堆浸液中加入H2O2是为了将Fe2+转化为Fe3+,加入NaOH溶液为了将Fe3+转化为FeOOH沉淀而除去,过滤出FeOOH沉淀,滤液中主要含有Cu2+、Ni2+和Zn2+,向其中加入适量的Zn粉,是将Cu2+置换出来而除去,过滤出Cu,后滤液中主要含有Zn2+和Ni2+,有机相萃取剂萃取Zn2+,分液得到的有机相含有锌,含有Zn的有机相经过反萃取获得含有Zn2+的反萃液,最后电解反萃液提取金属锌,据此分析解题。
(1)
由分析可知,“堆浸渣”的主要成分为SiO2,将锌矿粉碎,增大接触面积,可以加快反应速率,大幅度升温,将使细菌失去活性,反应速率减慢,延长堆浸时间,可以通过浸取率,但不能加快反应速率,将锌矿充分暴露,增大与O2的接触面积,加快反应速率,故答案为:SiO2;AD;
(2)
“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高,故答案为:有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高;
(3)
“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为:5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O,故答案为:5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O;
(4)
“萃取”时需要进行多次萃取且合并萃取液,其目的是充分萃取;提高Zn2+的萃取率、以提高Zn2+的利用率,由题干信息可知,操作③分离两种互不相容的液体,则该分离操作的的名称为分液,电解反萃液是电解硫酸锌溶液,得到Zn和H2SO4,此流程中可循环利用的物质有锌、萃取剂和H2SO4,故答案为:充分萃取;提高Zn2+的萃取率、以提高Zn2+的利用率;分液;H2SO4;
(5)
反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为:ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O,灼烧时需要借助马弗炉(Mufflefurnace,一种通用的加热设备,通常叫电炉等),灼烧固体应该在坩埚中进行,故答案为:ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O;e;
12.(1) 5Ni2++12H++2=5Ni2++N2↑+6H2O SiO2和CaSO4 在保证反应速率的同时减少硝酸挥发和分解
(2) +3 Na++3Fe3++2 +6H2O=[NaFe3(SO4)2(OH)6]↓+6H+
(3)
(4)(NH4)2SO4
(5)Ni(OH)2
【解析】
废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni,反应方程式有:Fe+H2SO4=FeSO4+H2↑,5Ni+5H2SO4+2HNO3=5NiSO4+N2↑+6H2O,CuO+H2SO4=CuSO4+H2O,CaO+H2SO4=CaSO4↓+H2O,MgO+H2SO4=MgSO4+H2O,过滤除去废渣,则滤渣的成分是SiO2,滤液中加入过氧化氢,氧化亚铁离子为铁离子,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入碳酸钠调节溶液pH除去铁离子,过滤得到滤渣主要成分为黄钠铁矾[NaFe3(SO4)2(OH)6],反应离子方程式为:Na++3Fe3++2+6H2O=[NaFe3(SO4)2(OH)6]↓+6H+,再向滤液中加入H2S沉淀铜离子,反应原理为:Cu2++H2S=CuS↓+2H+,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入碳酸氢铵溶液沉淀镍离子生成碳酸镍固体,过滤得沉淀NiCO3和滤液,主要成分为硫酸铵,据此分析解题。
(1)
①镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平化学方程式为:5Ni2++12H++2=5Ni2++N2↑+6H2O,故答案为:5Ni2++12H++2=5Ni2++N2↑+6H2O;
②由分析可知,酸溶过程中,二氧化硅不参与反应,故废渣的主要成分为二氧化硅,和生成的硫酸钙是微溶物质,故滤渣的成分有SiO2和CaSO4,故答案为:SiO2和CaSO4;
③温度过低,反应速率太慢,温度过高,硝酸易挥发且发生分解,故该过程控制温度70℃-80℃的原因是在保证反应速率的同时减少硝酸挥发和分解,故答案为:在保证反应速率的同时减少硝酸挥发和分解;
(2)
①由黄钠铁矾的化学式[NaFe3(SO4)2(OH)6]可知,其中Fe元素的化合价为+3价,故答案为:+3;
②由分析可知,“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是Na++3Fe3++2 +6H2O=[NaFe3(SO4)2(OH)6]↓+6H+,故答案为:Na++3Fe3++2+6H2O=[NaFe3(SO4)2(OH)6]↓+6H+;
(3)
当溶液中的c(Ni2+)=0.1mol·L-1时,c(S2-)<=3.0×10-18mol/L,“除铜”后,溶液中c(H2S)=0.1mol·L-1,则有:Ka1(H2S)Ka2(H2S)=,则1×10-7×7.0×10-15=,若要使c(S2-)<3.0×10-18mol/L,则溶液中c(H+) ≥mo1·L-1(列计算式)才不会使Ni2+形成NiS沉淀,故答案为:;
(4)
由分析可知,“沉镍”后,滤液的主要成分是(NH4)2SO4,故答案为:(NH4)2SO4;
(5)
由于碳酸钠溶液因碳酸根离子水解呈碱性,能与Ni2+反应生成Ni(OH)2,故“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为Ni(OH)2,故答案为:Ni(OH)2。
13.(1)冷凝回流
(2)2+CH3OH+10H+=2Cr3++CO2↑+7H2O
(3) 浓硫酸 干燥吸水 使滞留在装置的COCl2被NaOH溶液充分吸收,防止大气污染
(4)对D装置进行加热
(5) 继续滴加AgNO3溶液,不产生白色沉淀 偏大
【解析】
NaCrO4在酸性条件下与CH3OH发生氧化还原反应产生CrCl3,然后加入NaOH使CrCl3转化为Cr(OH)3,加热Cr(OH)3分解产生Cr2O3,在通入N2和CCl4条件下Cr2O3反应转化了CrCl3、COCl2,该反应方程式为:Cr2O3+3CCl4=2CrCl3+3COCl2。
(1)
根据图示可知:在图甲中仪器b的主要作用除导气外,还起冷凝回流作用;
(2)
在“还原”过程中NaCrO4在酸性条件下与CH3OH发生氧化还原反应产生CrCl3,CH3OH被氧化为CO2气体,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式为:2+CH3OH+10H+=2Cr3++CO2↑+7H2O;
(3)
反应产生CrCl3易水解,且在高温下易被氧气氧化,通入干燥的N2可以将装置中的空气排出,防止三氯化铬易水解及氧化变质,能够使反应物进入管式炉中进行反应。制备CrCl3时产生的COCl2有毒且易水解,因此通入的N2要先进行干燥处理,A中液体的试剂是干燥剂,可以为浓硫酸;为防止反应制取的CrCl3发生水解反应,尾气通入NaOH溶液前边应该有吸水装置,无水CaCl2的作用是吸收水分,防止水蒸气通过导气管进入收集产物的E装置;反应结束后继续通入一段时间氮气,主要目的是使滞留在装置的COCl2被NaOH溶液充分吸收,防止大气污染,该反应的化学方程式为:COCl2+4NaOH=Na2CO3+2NaCl+2H2O;
(4)
装置E用来收集产物,实验过程中若D处出现堵塞,可根据CrCl3易升华的特点,对D装置进行加热,CrCl3升华进入E装置,就可以使实验能继续进行;
(5)
若步骤②中Cl-已经完全沉淀,则再滴入AgNO3溶液时不产生白色沉淀,据此判断;
加入HNO3酸化,可以使避免杂质离子的干扰,若步骤③中未用稀HNO3洗涤沉淀,则会导致测定的三氯化铬质量分数将偏大;
根据物质反应转化关系可知:CrCl3+5H2O[Cr(H2O)5Cl]2++2Cl-,Cl-+Ag+=AgCl↓,过量Ag+用NH4SCN进行滴定,则根据中物质反应关系可知过量Ag+的物质的量为n(Ag+)(过量)=de×10-3 mol,则发生反应Cl-+Ag+=AgCl↓的Ag+的物质的量为n(Ag+) =(bc-de)×10-3 mol,因此n(CrCl3)=n(Cl-)=n(Ag+)=(bc-de)×10-3 mol,故样品中CrCl3的质量分数为:。
14.(1)3:2
(2)使Fe2+全部转化为Fe3+
(3)
(4) 调节pH
(5)
(6)c
(7)
【解析】
硫铁矿和软锰矿加入硫酸进行“浸取”,所得溶液中含有大量亚铁离子,加入软锰矿,将亚铁离子氧化成铁离子,调节pH使铁离子沉淀除去,再加入碳酸氢铵和氨水将溶液中的锰离子转化为碳酸锰,在空气中焙烧后得到二氧化锰,经过“氧化ii”、过滤、干燥得到二氧化锰纯品。
(1)
根据反应可知,反应的过程中,锰元素的化合价由+4价降低到+2价,则二氧化锰为该反应的氧化剂,Fe元素的化合价由+2价升高到+3价,S元素的化合价由-1价升高到0价,则硫化亚铁为该反应的还原剂,因此氧化剂和还原剂的物质的量之比为3:2;
(2)
由上述分析可知,“浸取”后的溶液中含有大量Fe2+,Fe2+沉淀的pH过高,因此将其氧化成Fe3+后再沉淀除去,则“氧化i”过程软锰矿的作用是使Fe2+全部转化为Fe3+;
(3)
根据题干信息可知,“除铁”时溶液的pH=5.5,则,,则“除铁”后溶液中残留的;
(4)
“沉锰”过程,加入碳酸氢铵和氨水,将溶液中的锰离子转化成碳酸锰,反应的离子方程式为;由图可知,“沉锰”过程中,需要调节溶液的pH=6.5~7,氨水的作用是调节溶液的pH;
(5)
“焙烧”过程中,MnCO3与空气中的氧气反应生成MnO2,反应的化学方程式为;
(6)
Mn(Ⅳ)的氧化性比和都强(例如,MnO2能将过氧化氢氧化生成氧气,实验室用MnO2和浓盐酸加热反应制取氯气),用或不能将Mn(Ⅱ)氧化为Mn(Ⅳ),而在酸性条件下能将Mn(Ⅱ)氧化为Mn(Ⅳ),故选用最适宜氧化剂是,答案选c。
(7)
根据总反应可知,放电时,作正极,发生还原反应,则放电时正极的电极反应为。
15.(1)NaOH会消耗萃取反应时生成的H+,促进萃取反应的正向进行,提高萃取效果
(2)2Al3++3+3H2O=2Al(OH)3↓+3CO2↑
(3)洗去沉淀表面的杂质离子,减少Li2CO3的溶解损失,提高Li2CO3的纯度和产率
(4)固液比越小,去离子水体积越多,碳化反应后生成及溶解的LiHCO3越多,热分解时会生成更多的Li2CO3
【解析】
此题目的以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、SO等)制取电池级Li2CO3,锂云母加入HR,Fe3++3HR FeR3+3H+,生成的FeR3可溶解在HR中分液有机层为FeR3,水溶液为(Li+、Al3+、Ca2+、SO),沉锂加入碳酸钠生成Li2CO3、CaCO3和Al(OH)3沉淀,Li2CO3、CaCO3和Al(OH)3加入去离子水二氧化碳,碳化反应,碳酸锂和和水和二氧化碳生成碳酸氢锂,过滤,滤渣为碳酸钙和氢氧化铝,滤液为碳酸氢锂,碳酸氢锂热分解生成电池级的碳酸锂,以此来解析;
(1)
根据Fe3++3HR FeR3+3H+,Fe3+易与R-结合FeR3,NaOH会消耗萃取反应时生成的H+,促进萃取反应的正向进行,提高萃取效果;
(2)
铝离子和碳酸根离子双水解生成二氧化碳和氢氧化铝,根据电荷守恒和原子守恒,可得反应的离子方程式为:2Al3++3CO+3H2O=2Al(OH)3↓+3CO2↑;
(3)
根据图片1的信息可知碳酸锂的溶解度随着温度的升高而降低,温度越高溶解度越小,用热水洗涤能降低碳酸锂在水中溶解的量,过滤1后所得沉淀用热水洗涤的目的是洗去沉淀表面的杂质离子,减少Li2CO3的溶解损失,提高Li2CO3的纯度和产率;
(4)
固液比越小,去离子水体积越多,碳化反应后生成及溶解的LiHCO3越多,热分解时会生成更多的Li2CO3,所以Li2CO3产率随固液比减小而增加;
16.(1)CaSO4和SiO2
(2)Co3O4+4H++SO2=3Co2++2H2O+
(4)C
(5) 增大接触面积,使萃取充分 ZnSO4
【解析】
本题为工艺流程题,是以锌冶炼钴渣为原料来制备电池级CoSO4、MnSO4混合液,“浸出”是用硫酸、SO2来浸出,反应原理有:ZnO+H2SO4=ZnSO4+H2O、MnO+H2SO4=MnSO4+H2O、CdO+H2SO4=CdSO4+H2O、FeO+H2SO4=FeSO4+H2O、CaO+H2SO4=CaSO4↓+H2O、MgO+H2SO4=MgSO4+H2O、Co2O3+H2SO4+SO2=2CoSO4+H2O、Fe2O3+H2SO4+SO2=2FeSO4+H2O、Co3O4+2H2SO4+SO2=3CoSO4+2H2O,过滤得滤渣,则滤渣得主要成分为CaSO4和SiO2,滤液中加入MnS得到CdS沉淀,过滤出CdS后,向滤液中加入H2O2将Fe2+氧化为Fe3+,在加入MnCO3调节pH以析出Fe(OH)3沉淀,来除去铁,过滤,继续向滤液中加入氟化物X,析出MgF2、CaF2沉淀,过滤得滤液3,通过加入有机萃取剂HA进行逆流萃取来除去Mn2+,最后得到水层溶液即为电池级CoSO4、MnSO4混合液,据此分析解题。
(1)
由分析可知,“浸渣”的主要成分是CaSO4和SiO2,故答案为:CaSO4和SiO2;
(2)
由分析可知,“浸出”时,转化为的反应方程式为Co3O4+2H2SO4+SO2=3CoSO4+2H2O,则该反应的离子方程式为:Co3O4+4H++SO2=3Co2++2H2O+,故答案为:Co3O4+4H++SO2=3Co2++2H2O+;
(3)
若溶液中金属离子浓度为,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保恰好沉淀完全而不沉淀,此时c(S2-)≥ ==8.0×10-21mol/L,c(S2-)<Ksp(ZnS),故c(S2-)<=2.5×10-2mol/L,故答案为:为了确保恰好沉淀完全而不沉淀,此时c(S2-)≥ ==8.0×10-21mol/L,c(S2-)<Ksp(ZnS),故c(S2-)<=2.5×10-2mol/L;
(4)
由于NaF、KF将引入新的杂质离子Na+、K+很难除去,而MgF2不能用于除去Mg2+,故“氟化物”为MnF2,故答案为:C;
(5)
萃取时,发生反应:。采取“逆流萃取”的作用是增大接触面积,使萃取充分,由分析可知,有机相中含有Zn2+,可通过硫酸处理后使得上述平衡逆向移动,故得到的副产品为ZnSO4,故答案为:增大接触面积,使萃取充分;ZnSO4。
17.(1)MnCO3+(NH4)2SO4MnSO4+2NH3↑+CO2↑+H2O
(2)34.5%
(3) Na2CO3溶液碱性较强,会有部分Mn(OH)2沉淀生成,所得MnCO3不纯,Mn的利用率降低 使用NH4HCO3溶液会有CO2气体放出,NH4HCO3的利用率低 边搅拌边向混合溶液中加入90mL 1.0mol·L-1的NaOH溶液,充分反应后过滤,向滤渣中边搅拌边加入适量1.0mol·L-1 H2SO4溶液,当固体不再减少时,过滤,用蒸馏水多次洗涤滤渣,直至取最后一次洗涤滤液加入1.0mol·L-1 BaCl2溶液无沉淀生成,过滤,干燥
【解析】
根据碳酸锰矿中所含成分,以及流程图可知,碳酸锰与硫酸铵反应生成硫酸锰、氨气和二氧化碳,铁的氧化物、氧化铝、二氧化硅不与硫酸铵反应,加水溶解后,得到含硫酸锰溶液,据此分析。
(1)
根据上述分析,碳酸锰与硫酸铵反应生成硫酸锰、氨气和二氧化碳,其反应方程式为MnCO3+(NH4)2SO4MnSO4+2NH3↑+CO2↑+H2O。
(2)
Mn(PO4)与Fe2+反应存在化合价的变化,属于氧化还原反应,根据得失电子数目守恒,Mn(PO4)与Fe2+反应物质的量之比为1∶1,根据元素守恒,建立关系式为MnCO3~Mn2+~Mn(PO4)~Fe2+,因此有n(MnCO3)=n(Fe2+),碳酸锰的质量含量为=34.5%。
(3)
①a.Na2CO3属于强碱弱酸盐,溶液显碱性,Na2CO3的碱性较强,会有部分Mn元素转化成Mn(OH)2沉淀,所得MnCO3不纯,Mn的利用率降低。
b.NH4HCO3为弱酸弱碱盐,Mn2+与HCO电离产生CO结合成MnCO3,促使HCO电离,c(H+)增大,H+与HCO反应生成CO2,造成NH4HCO3的利用率降低。
②根据图像可知,当NaOH与MnSO4的物质的量之比为4.5时,Mn的转化率、MnO2的含量达到最大,当加入20mL 1.0mol·L-1的MnSO4时需要加入90mL 0.1mol·L-1 NaOH溶液,过滤,向滤渣中加入适量的硫酸,将Mn(OH)2转化成MnSO4,当固体质量不再减少时,过滤,洗涤滤渣;具体操作是边搅拌边向混合溶液中加入90mL 1.0mol·L-1的NaOH溶液,充分反应后过滤,向滤渣中边搅拌边加入适量1.0mol·L-1 H2SO4溶液,当固体不再减少时,过滤,用蒸馏水多次洗涤滤渣,直至取最后一次洗涤滤液加入1.0mol·L-1 BaCl2溶液无沉淀生成,过滤,干燥。
答案第1页,共2页
答案第1页,共2页
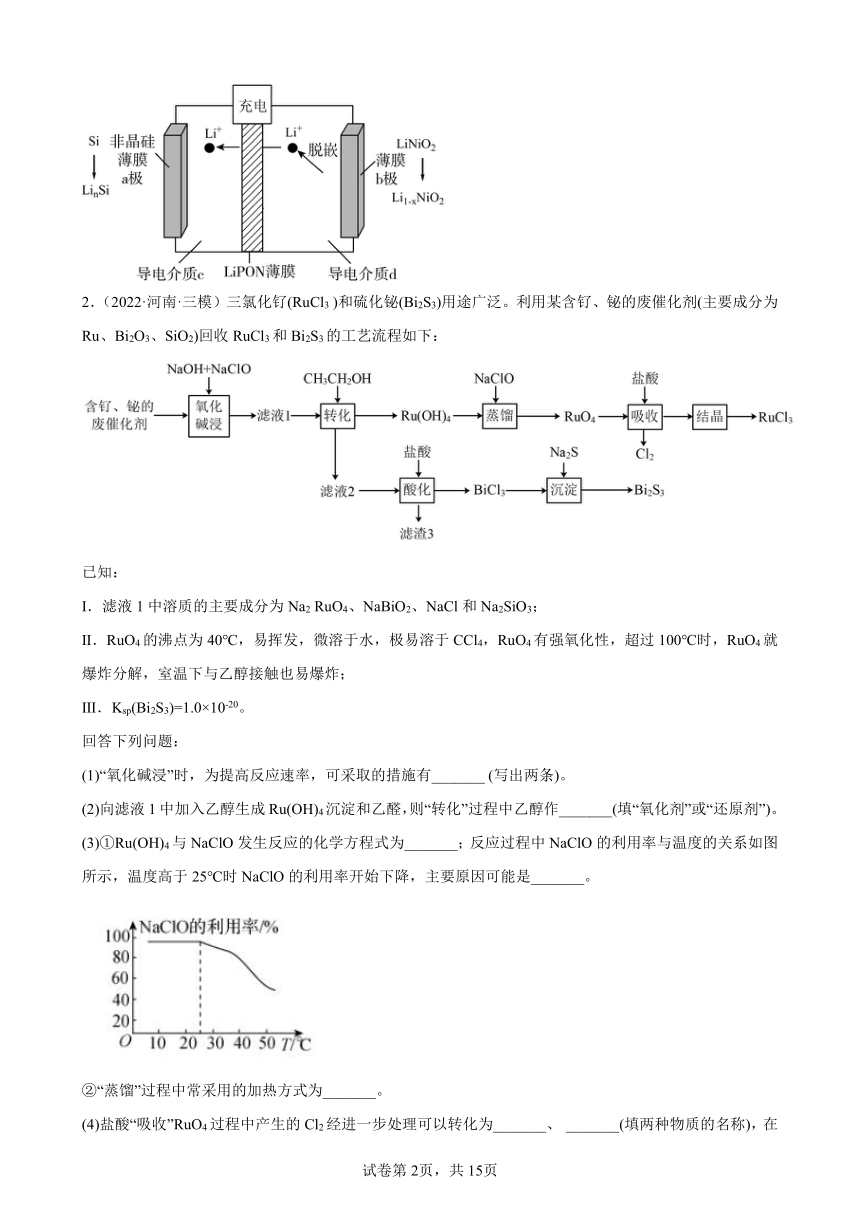
1.(2022·山东日照·模拟预测)是一种前景很好的锂离子电池电极材料。以废旧锂离子电池为原料回收合成的工艺如下。
回答下列问题:
(1)溶液中金属离子浓度用表示,随溶液变化如图所示。当溶液中某离子浓度小于时认为沉淀完全。
①“酸浸”后滤液中含有、、、,滤渣1成分为_______。
②如果“调”后溶液中浓度为,则“调”的范围是_______;下列试剂最适合作为物质X的是_______(填字母)。
a.双氧水 b.氨水 c.盐酸 d.
(2)“除锰”反应的离子方程式为_______。
(3)“合成”过程发生反应的化学方程式为_______。
(4)一种薄膜(只允许通过)锂离子电池的充电过程如图所示。该电池放电时的正极反应式为_______。放电时,当外电路通过电子时,非晶硅薄膜上质量变化_______g。
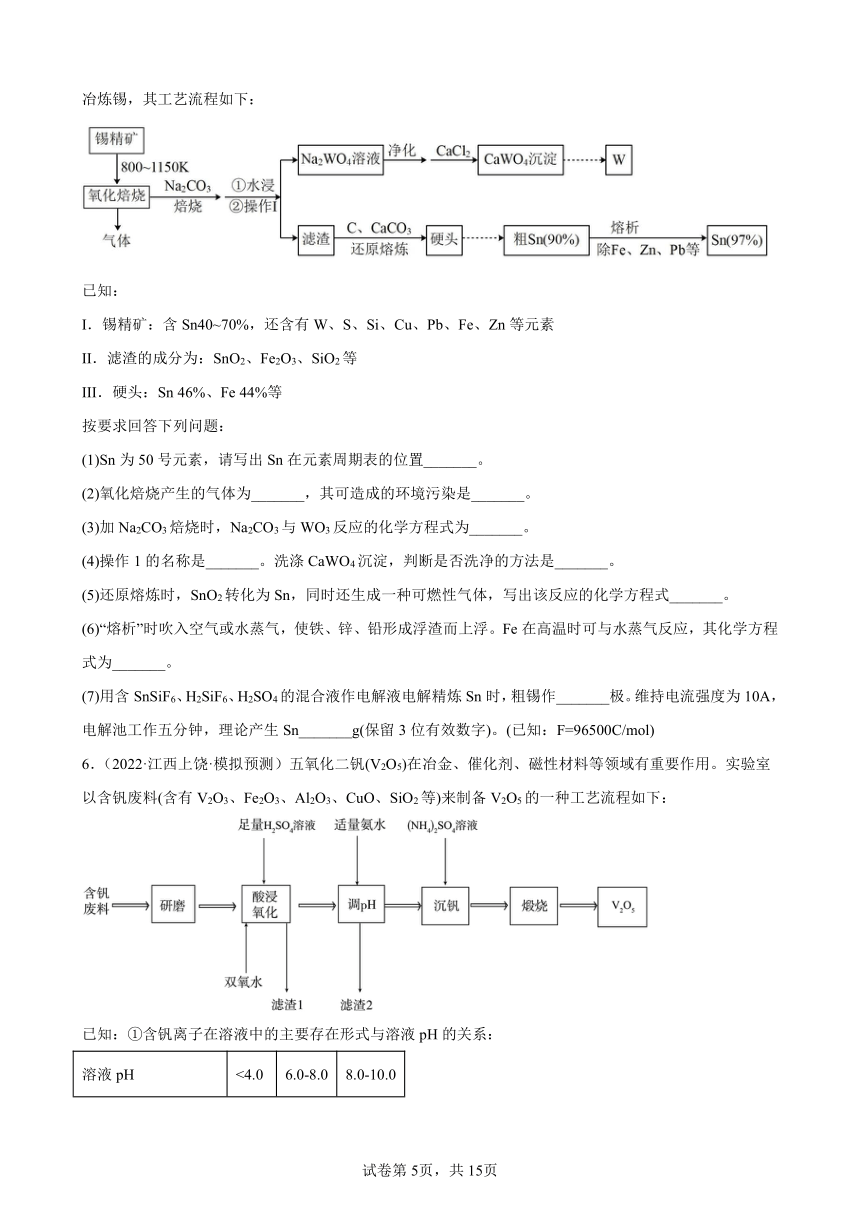
2.(2022·河南·三模)三氯化钌(RuCl3 )和硫化铋(Bi2S3)用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、Bi2O3、SiO2)回收RuCl3和Bi2S3的工艺流程如下:
已知:
I.滤液1中溶质的主要成分为Na2 RuO4、NaBiO2、NaCl和Na2SiO3;
Ⅱ.RuO4的沸点为40℃,易挥发,微溶于水,极易溶于CCl4,RuO4有强氧化性,超过100℃时,RuO4就爆炸分解,室温下与乙醇接触也易爆炸;
Ⅲ.Ksp(Bi2S3)=1.0×10-20。
回答下列问题:
(1)“氧化碱浸”时,为提高反应速率,可采取的措施有_______ (写出两条)。
(2)向滤液1中加入乙醇生成Ru(OH)4沉淀和乙醛,则“转化”过程中乙醇作_______(填“氧化剂”或“还原剂”)。
(3)①Ru(OH)4与NaClO发生反应的化学方程式为_______;反应过程中NaClO的利用率与温度的关系如图所示,温度高于25℃时NaClO的利用率开始下降,主要原因可能是_______。
②“蒸馏”过程中常采用的加热方式为_______。
(4)盐酸“吸收”RuO4过程中产生的Cl2经进一步处理可以转化为_______、 _______(填两种物质的名称),在本工艺流程中循环利用。
(5)滤渣3的主要成分为_______(填化学式)。
(6)“沉淀”时,向1L 1.0 mol· L-1BiCl3溶液中加入0.2L Na2S溶液,反应后混合溶液中c(S2-)为1×10-6mol·L-1,则Bi3+的沉淀率为_______(忽略溶液体积变化)。
3.(2022·山东·新泰市第一中学二模)天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是_______。
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是_______。液体a的电子式是_______。
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是_______。
(4)“还原”中氧化剂是_______(填化学式)。
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用_______
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是_______。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是_______。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是_______。
4.(2022·福建·模拟预测)用黄铁矿(主要成分FeS2)还原硫酸渣制备铁黄颜料(主要成分为FeOOH),工业流程如下:
c(Fe2+)或c(Fe3+)浓度分别为 1 mol L-1,形成对应沉淀的pH范围如下表:
Fe(OH)2 FeOOH
开始沉淀的pH 5.8 1.2
沉淀完全的pH 8.3 2.8
(1)步骤②被氧化的元素是_______。
(2)碱性锌锰电池使用时会产生与FeOOH同类物质,该物质化学式是_______。
(3)制备晶种:将NaOH按一定计量比加入到FeSO4溶液中,产生白色沉淀。调至pH约为6时,开始通入空气并记录pH 变化如图。
① pH约为6时,通入空气前,铁元素的主要存在形式是_______;0~t1时段,白色沉淀发生变化,pH 基本不变的原因是_______(用化学方程式说明)。
②pH 约为4时制得铁黄晶种。若继续通空气,t3后pH 几乎不变,此时c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。请结合方程式说明原因:_______。
(4)二次氧化时,溶液的pH 应控制在3~4,过低会造成铁黄质量降低,原因可能是_______。
(5)步骤④中证明洗涤完全的方法是_______。
(6)称取铁黄产品1.000 g,用稀硫酸溶解并配成200 mL溶液,每次取20.00 mL,调节合适的pH,用0.1 000 mol/L的磺基水杨酸(H2Y)标准溶液滴定,三次滴定平均消耗体积为22.00 mL,则该产品纯度为_______%。 (已知:Fe3++2H2Y=[FeY2]-+4H+)
5.(2022·辽宁·二模)锡是一种质地较软的金属,可塑性强,能制成多种款式的产品。工业上常从锡矿中冶炼锡,其工艺流程如下:
已知:
I.锡精矿:含Sn40~70%,还含有W、S、Si、Cu、Pb、Fe、Zn等元素
II.滤渣的成分为:SnO2、Fe2O3、SiO2等
III.硬头:Sn 46%、Fe 44%等
按要求回答下列问题:
(1)Sn为50号元素,请写出Sn在元素周期表的位置_______。
(2)氧化焙烧产生的气体为_______,其可造成的环境污染是_______。
(3)加Na2CO3焙烧时,Na2CO3与WO3反应的化学方程式为_______。
(4)操作1的名称是_______。洗涤CaWO4沉淀,判断是否洗净的方法是_______。
(5)还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体,写出该反应的化学方程式_______。
(6)“熔析”时吹入空气或水蒸气,使铁、锌、铅形成浮渣而上浮。Fe在高温时可与水蒸气反应,其化学方程式为_______。
(7)用含SnSiF6、H2SiF6、H2SO4的混合液作电解液电解精炼Sn时,粗锡作_______极。维持电流强度为10A,电解池工作五分钟,理论产生Sn_______g(保留3位有效数字)。(已知:F=96500C/mol)
6.(2022·江西上饶·模拟预测)五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、SiO2等)来制备V2O5的一种工艺流程如下:
已知:①含钒离子在溶液中的主要存在形式与溶液pH的关系:
溶液pH <4.0 6.0-8.0 8.0-10.0
钒元素主要存在形式 VO VO V2O
②溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全。Fe3+、A13+、Cu2+沉淀完全的pH分别为:3.2、4.7、6.4
③VO和VO之间存在转化关系:VO+H2OVO+2H+
请回答下列问题:
(1)滤渣1主要成分是_______(写名称)
(2)“酸浸氧化”后钒元素主要以VO形式存在,请写出V2O3溶解过程中发生的离子反应方程式_______。
(3)加入氨水调pH=7时,溶液中会产生大量的VO。请用平衡移动原理进行解释_______。
(4)沉钒后所得沉淀要进行洗涤,检验沉淀是否洗净的方法是_______。
(5)已知NH4VO3难溶于水,常温时Ksp=3.0×10-8,向10mL0.2mol·L-1NaVO3的滤液中加入等体积的(NH4)2SO4溶液(忽略混合过程中的体积变化),欲使VO沉淀完全,则(NH4)2SO4溶液的最小浓度为_______(保留三位有效数字)。
(6)“煅烧”过程中的化学反应方程式_______副产物可在_______过程中循环使用。
7.(2022·辽宁·模拟预测)柠檬酸亚铁(FeC6H6O7,摩尔质量:246g/mol)是一种易被人体吸收的高效铁制剂,某研究团队用硫铁矿(成分为60%FeS2、Al2O3、SiO2及其他杂质)为原料来制备柠檬酸亚铁,其流程如下图:
已知:(1)“焙烧”生成了铁红;
(2)常温下,柠檬酸()电离常数: ,, , Ksp(Al(OH)3)=1.3×10-33
(1)焙烧时气体与矿料逆流而行,目的是___________,“焙烧”过程中氧化剂和还原剂的物质的量之比为___________。
(2)已知:FeS2与H2SO4不反应。则“还原”时FeS2发生反应的离子方程式为___________。
(3)柠檬酸亚铁(FeC6H6O7)是一种___________盐(填“正”“酸式”或“碱式”),0.1mol/LNa2C6H6O7溶液呈___________性。(填“酸”、“碱”或“中”)
(4)若铝离子浓度为0.1mol/L,通过计算判断,“除铝”中调节pH=2时是否产生氢氧化铝沉淀___________。(写出计算过程)
(5)“沉铁”时需控制温度在32℃左右,其可能的原因是___________。
(6)某工厂用1kg硫铁矿经上述流程制得1.6kg柠檬酸亚铁,则柠檬酸亚铁的产率为______。(保留四位有效数字)
8.(2022·上海·模拟预测)铋主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为Bi2O3,含有PbO、Ag2O、CuO)为原料提取Bi的工艺流程如图:
已知:Ⅰ.BiCl3可水解生成不溶于水的BiOCl
Ⅱ.25℃时,Ksp[Cu(OH)2]=1.2×10-20;Ksp(PbCl2)=1.17×10-5
回答下列问题:
(1)“浸出”时,若c(HCl)=1mol/L时,铋的浸出率和Cl-浓度的关系如图所示,其中NaCl的作用是____;若升高温度,反应相同的时间,铋的浸出率先升高后降低,则浸出率下降的主要原因可能是____和____。
(2)“滤渣Ⅰ”的成分为____(填化学式)。
(3)“沉铜”时向“滤液Ⅱ”中加入NaOH溶液,可促进Cu2+水解生成Cu3(OCl)2沉淀,请写出“沉铜”的离子方程式____。若“滤液Ⅱ”中c(Cu2+)为0.01mol·L-1,常温下加入等体积的NaOH溶液使pH恰好为6时,出现Cu(OH)2沉淀,此时Cu2+的去除率为____(忽略溶液体积变化)。
(4)可循环利用的物质是____。
(5)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
水解工序时Bi3+发生反应的离子方程式为____。
9.(2022·重庆·二模)铝在我国储量居世界前列,被广泛应用于钢铁、石油、化工、电气和电子技术、医药和农业等领域。钼酸钠晶体()是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是,含少量等)为原料生产钼酸钠晶体的工艺流程图。
请回答下列问题:
(1)气体A的主要成分是_______(填化学式),为了提高浸取率所采取的措施是_______(写一条即可)。
(2)在焙烧炉中焙烧时,采用多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧,采用“多层逆流”的目的是_______。
(3)“焙烧”时转化为,浸取过程中含钼化合物发生反应的离子方程式为_______。
(4)在加入除时,若溶液较小,会产生的不良后果是_______,原因是_______(用平衡移动原理解释)。
(5)流程中“…”在实验室的操作为_______、_______、过滤、洗涤、干燥。
(6)分析化学上测定钼的含量,通常是把经过一系列变化得的方法来测定。实验室称量钼精矿,经过一系列变化得到,则理论上钼精矿中钼的百分含量为_______。
10.(2022·辽宁·模拟预测)高铁酸钾()是一种新型水处理剂,既能杀菌又能生成胶体吸附悬浮物,其制备流程如图所示:
已知:①的溶解度大于;②在碱性条件更稳定。回答以下问题:
(1)高铁酸钾()中铁元素在周期表的位置是第_______周期第_______列。
(2)写出“常温氧化”的离子方程式_______。
(3)若在“水溶混合”和“常温氧化”过程中分别加入和,则在“浸洗溶解”过程之前需发生反应的化学方程式是_______。
(4)“洗涤烘干”过程中使用乙醇洗涤,其目的是_______(答两点)。
(5)“常温氧化”过程中,测得氧化时间、氧化剂浓度与产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在_______min,氧化剂浓度应控制在_______。
(6)高铁酸钾产品纯度测定方法如下(杂质不参与反应):在一定条件下,将1.32g样品与过量溶液反应后配成溶液,每次取10.00mL于锥形瓶中,加入指示剂后,用的标准溶液滴定,则终点的操作和现象是_______。
(7)还有一种电解法制备高铁酸盐。以多孔的磁铁矿代替纯铁电极作阳极,写出以此材料在碱性条件下制备高铁酸盐的电极反应式_______。
11.(2022·黑龙江·哈九中二模)工业上常采用堆浸-反萃取-电积法从锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图所示。
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH较高时,氢氧化氧铁为胶状沉淀;③在我国,富矿少、贫矿多,品位低于5%的矿山属于贫矿。回答下列问题:
(1)“堆浸渣”的主要成分为_______,“堆浸”时为了提高反应速率,可以采取的措施为_______ (填标号)。
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,Zn2+、Cu2+、Ni2+的去除率均升高,原因可能为_______。
(3)“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为_______。
(4)“萃取”时需要进行多次萃取且合并萃取液,其目的是_______ ,操作③的名称为_______,此流程中可循环利用的物质有锌、萃取剂和_______。
(5)反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为_______ ,灼烧时需要借助马弗炉(Mufflefurnace,一种通用的加热设备,通常叫电炉等)和下列哪些仪器_______(填标号)共同完成。
(6)“电积”时在_______极获得锌,得到的锌的质量分数为96.0% 。某企业利用上述流程从1600吨锌矿中可获得此种锌的质量为80吨,已知上述流程的总损耗率约为2%,则该锌矿为_______ (填“富矿”或“贫矿”)。
12.(2022·广东·执信中学模拟预测)碳酸镍是合成纳米镍的一种前驱体。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高的碳酸镍的工艺流程如图:
已知:H2S的电离常数,,;
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸:
①金属镍溶解的离子方程式是_______。
②“酸溶”时产生的废渣成分有_______。
③该过程控制温度70℃-80℃的原因是_______。
(2)“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀对后续操作较为有利:
①黄钠铁矾中Fe元素的化合价为_______。
②“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是_______。
(3)“除铜”后,溶液中c(H2S)=0.1mol·L-1,c(Ni2+)=0.1mol·L-1,溶液中c(H+) ≥_______mo1·L-1(列计算式)才不会使Ni2+形成NiS沉淀。
(4)“沉镍”后,滤液的主要成分是_______。
(5)“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为_______。
13.(2022·重庆·西南大学附中模拟预测)三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化。实验室制备三氯化铬的流程如下:
还原反应在图甲所示装置中进行,制备过程在图乙所示装置中进行:
(1)图甲中仪器b的主要作用除导气外,还有___________。
(2)“还原”过程中会有CO2产生,请写出该反应的离子方程式:___________。
(3)A中的试剂为___________;无水CaCl2的作用是___________;反应结束后继续通入一段时间氮气,主要目的是___________。
(4)装置E用来收集产物,实验过程中若D处出现堵塞,可通过___________(填操作),使实验能继续进行。
(5)样品中三氯化铬质量分数的测定
已知:CrCl3在水中易形成稳定的络离子[Cr(H2O)5Cl]2+;(白色沉淀);三氯化铬样品中的杂质不参与反应。
实验步骤如下:
①称取a g样品于锥形瓶中,加入水配成溶液。
②向锥形瓶中加入b mol/L的AgNO3溶液c mL,使溶液中Cl-完全沉淀。
③过滤除去AgCl沉淀,并用稀HNO3洗涤沉淀,将洗涤液合并在滤液中。
④加入2~3滴Fe(NO3)3溶液做指示剂,用d mol/L NH4SCN标准溶液反滴定过量Ag+至终点,记下所用NH4SCN溶液的体积为e mL。
Ⅰ.确定步骤②中Cl-已经完全沉淀的操作与现象为___________。
Ⅱ.若步骤③中未用稀HNO3洗涤沉淀,则测定的三氯化铬质量分数将___________(填“偏大”“偏小”或“无法确定”)。
Ⅲ.样品中三氯化铬的质量分数为___________(用含a、b、c、d、e的代数式表示)。
14.(2022·四川·成都七中模拟预测)软锰矿-硫铁矿制取电池级二氧化锰的工艺流程如下图:
回答下列问题:
(1)“浸取”过程主要反应3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O,则氧化剂与还原剂物质的量之比为_______。
(2)“氧化i”过程软锰矿的作用是_______。
(3)“除铁”后溶液中残留的c(Fe3+)=_______mol·L-1。[25℃时,Fe(OH)3的Ksp为1.0×10-39]
(4)“沉锰”过程Mn2+转化为MnCO3的离子方程式为_______;NH3·H2O的作用是_______。
(5)“焙烧”过程MnCO3转化为MnO2的化学方程式为_______。
(6)“氧化ii”过程中,将Mn(II)转化为Mn(IV)的最适宜氧化剂是_______(填标号)。
a.H2O2 b.Cl2 c.KClO3
(7)将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为:,放电时正极的电极反应式为_______。
15.(2022·江苏·一模)电池级碳酸锂是制造LiCoO2等锂离子电池必不可少的原材料。以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、等)制取电池级Li2CO3的工艺流程如下:
已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生反应:Fe3++3HR FeR3+3H+,生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:
(1)HR萃取剂使用前先用一定量的NaOH进行处理的目的是___________。
(2)沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:___________。
(3)过滤1后所得沉淀用热水洗涤的目的是___________。
(4)其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是___________。
16.(2022·湖南常德·模拟预测)以经焙烧处理的锌冶炼钴渣(主要含有、、、,少量、、、、、等杂质)为原料制备电池级、混合液的工艺流程如下:
已知:常温下,,。
回答下列问题:
(1)“浸渣”的主要成分是___________。
(2)“浸出”时,转化为,写出该反应的离子方程式___________。
(3)若溶液中金属离子浓度为,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保恰好沉淀完全而不沉淀,的值有何要求?___________(列式计算说明)。
(4)“氟化物”为___________(填标号)。
A. B. C. D.
(5)萃取时,发生反应:。采取“逆流萃取”的作用是___________,有机相可通过硫酸处理后得到的副产品为___________(填化学式)。
17.(2022·福建·模拟预测)实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:
(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4),待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________(写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
a.不使用Na2CO3溶液的原因是___________。
b.不使用NH4HCO3溶液的原因是___________。
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 、 d
(2)
(3)
(4) 1.4
【解析】
加入硫酸酸浸,滤液中含有、、、,后面一步是除锰,说明调pH除去的是、,则滤渣1为、,加入使转化为MnO2除去,加入NaOH生成Ni(OH) 2,过滤分离得到Ni(OH) 2,Ni(OH) 2和LiOH、氧气反应生成。
(1)
①由上述分析可知,调pH除去的是、,则滤渣1为、,故答案为:、;
②由图可知,Al3+完全沉淀时,Fe3+已经完全沉淀,因此pH最小值应为4.7,当Ni2+完全沉淀时,pH=8.8,则,,则的,如果“调”后溶液中浓度为,溶液中,,,pH=6.3,因此“调pH”的范围是;试剂X用于调pH除去、,为了不引入杂化,最适合作为物质X的是NiO,故选d,故答案为:;d;
(2)
加入使转化为MnO2除去,发生的反应为,故答案为:;
(3)
Ni(OH) 2和LiOH、氧气反应生成,则“合成”过程发生反应的化学方程式为,故答案为:;
(4)
由图可知,充电时,a极发生反应,该反应为还原反应,则a为阴极,b为阳极,阳极上LiNiO2失去电子转化成,电极反应式为,则放电时a为负极,电极反应式为,b为正极,正极的电极反应式为 ;放电时,a极的电极反应式为,非晶硅薄膜上变化的质量为Li+的质量,当外电路通过电子0.2mol时,非晶硅薄膜上的质量变化为,故答案为:;1.4。
2.(1)适当升高温度、减小废催化剂颗粒直径(或适当增加氢氧化钠和次氯酸钠溶液的浓度、搅拌等)
(2)还原剂
(3) Ru(OH)4+2NaClO=RuO4 +2NaCl +2H2O 温度高于25℃时,次氯酸钠的水解程度增大,产生的次氯酸受热分解,导致NaClO的利用率下降 水浴加热
(4) 次氯酸钠 盐酸
(5)H4SiO4(或H2SiO3)
(6)88%
【解析】
题给流程可知,含钌的废料中加入氢氧化钠溶液和次氯酸钠溶液氧化碱浸时,Ru和Pb被氧化为RuO和NaHPbO2,SiO2和Bi2O3与氢氧化钠溶液反应生成Na2SiO3和NaBiO2,过滤得到含有RuO、NaBiO2、NaHPbO2和Na2SiO3的滤液1;向滤液1中加入乙醇,将RuO还原为Ru(OH)4沉淀,过滤得到滤液2和Ru(OH)4;Ru(OH)4在蒸馏条件下被氯酸钾氧化为RuO4,RuO4与盐酸反应生成RuCl3、Cl2和H2O,RuCl3溶液经结晶得到RuCl3;滤液2加入盐酸酸化,得到含有乙醛、BiCl3、NaCl的溶液和H4SiO4(或H2SiO3)的沉淀,向溶液中加入Na2S沉淀BiCl3得到Bi2S3,据此分析解答。
(1)
含钌、铋的废催化剂在“氧化碱浸”时为提高反应速率,可采取的措施有适当升高温度、减小废催化剂颗粒直径、适当增加氢氧化钠和氧化剂溶液的浓度、搅拌等;
(2)
由分析可知,滤液1中含有Na2RuO4、NaBiO2、NaCl和Na2SiO3,加入乙醇,溶液中的RuO与乙醇反应生成Ru(OH)4沉淀和乙醛,钌元素化合价降低,RuO作氧化剂,则乙醇作还原剂;
(3)
①Ru(OH)4与NaClO发生反应生成RuO4、NaCl和H2O,其化学方程式为Ru(OH)4+2NaClO=RuO4+2NaCl+2H2O;温度高于25℃时,次氯酸钠的水解程度增大,产生的次氯酸受热分解,总反应为2NaClO2NaCl+O2↑,导致NaClO的利用率下降;
②RuO4的沸点为40℃,超过100℃时,RuO4就爆炸分解,故“蒸馏”过程中应用温度稍高于40℃的水浴加热;
(4)
结合流程图,盐酸“吸收”RuO4过程中产生的Cl2经进一步处理可以转化为次氯酸钠、盐酸,循环利用;
(5)
滤液2中含有乙醛、NaBiO2、NaCl和Na2SiO3,加入盐酸生成硅酸沉淀和含有乙醛、BiCl3、NaCl的溶液,故滤渣3的主要成分为H4SiO4或H2SiO3;
(6)
混合溶液中c(S2-)为1×10-6mol/L,由Ksp(Bi2S3)=1.0×10-20=c2(Bi3+)·c3(S2-),可知c(Bi3+)=0.1 mol/L,则混合溶液中n(Bi3+)=0.1 mol/L×1.2L=0.12 mol,沉淀的Bi3+的物质的量为1 mol-0.12 mol=0.88 mol,Bi3+的沉淀率为×100%=88%。
3.(1)ZrSiO4+ 4C+3Cl2ZrCl2↑+SiCl4↑ +4CO↑
(2) 保持干燥
(3)向漏斗中加浓盐酸至没过沉淀,让溶液自然流下,重复2-3次
(4)ZrO2
(5) 重结晶 锆、铪配离子[MF6]2-与阴离子交换树脂的结合能力不同 萃取 3K2ZrF6+4Al6KF+4AlF3+3Zr
【解析】
锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气和足量的焦炭反应,ZrSiO4转化为ZrCl4,加水水解,ZrCl4转化为ZrOCl2·8H2O,900℃加热分解,得到二氧化锆,加入镁置换得到海绵锆,据此分析解题。
(1)
“高温气化”中可发生多个反应,主要反应为ZrSiO4与足量的氯气和足量的焦炭反应生成ZrCl2、SiCl2、CO,化学方程式是:ZrSiO4+ 4C+3Cl2ZrCl2↑+SiCl4↑ +4CO↑;
(2)
分馏过程中,为防止产品变质,ZrCl4遇水强烈水解,过程中一定需要注意的是保持干燥。高温气化生成杂质SiCl4,ZrCl4是白色固体,液体a为SiCl4,电子式是 ;
(3)
在浓盐酸中会析出ZrOCl2·8H2O沉淀,实验室中洗涤ZrOCl2·8H2O沉淀操作是向漏斗中加浓盐酸至没过沉淀,让溶液自然流下,重复2-3次;
(4)
900℃加热分解,得到二氧化锆,加入镁置换得到海绵锆,Zr的化合价降低,二氧化锆为氧化剂;
(5)
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用重结晶方法进行分离;
②离子交换法:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是锆、铪配离子[MF6]2-与阴离子交换树脂的结合能力不同;
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离,这种分离方法是萃取,利用溶液度的不同;在高温条件下,加入铝将制得的K2ZrF6还原可得锆,根据元素守恒,反应的化学方程式是:3K2ZrF6+4Al6KF+4AlF3+3Zr。
4.(1)S(或硫)
(2)
(3) Fe2+或FeSO4、Fe(OH)2 溶液中存在两个氧化反应和,因此c(Fe2+)降低量大于c(Fe3+)增加量
(4)pH过低会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,铁黄产品质量降低
(5)取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净
(6)97.9
【解析】
硫酸渣加入硫酸酸溶得到含Fe3+悬浊液,加入FeS2将溶液中的Fe3+还原为Fe2+并得到S,过滤得到硫磺和含Fe2+的溶液,向滤液中加入NaOH、通入空气,得到晶种,然后把晶种加入到二次氧化的铁黄浆料,得到FeOOH,过滤得到湿铁黄,然后经过洗涤干燥得到产品。
(1)
步骤②中加入FeS2将溶液中的Fe3+还原为Fe2+,经过滤得到硫磺,生成了S,反应过程中,S元素的化合价升高,被氧化,故答案为:S(或硫);
(2)
碱性锌锰电池使用时,发生的反应为,生成的与FeOOH同类的物质为,故答案为:;
(3)
①将NaOH按一定计量比加入到FeSO4溶液中,产生白色沉淀,该白色沉淀为Fe(OH)2,则通入空气前,铁元素的主要存在形式是Fe2+或FeSO4、Fe(OH)2;0~t1时段,通入氧气后,Fe(OH)2被氧化成Fe(OH)3,反应的化学方程式为,该反应既不消耗氢离子或氢氧根离子,也不产生氢离子或氢氧根离子,不影响溶液的pH,所以该过程中pH 基本不变,故答案为:;
②溶液中存在两个反应和,总反应为,反应过程中氢离子和氢氧根离子浓度没有变化,因此t3后溶液的pH几乎不变,该反应消耗的Fe2+大于生成的Fe3+,因此c(Fe2+)降低量大于c(Fe3+)增加量,故答案为:溶液中存在两个氧化反应和,因此c(Fe2+)降低量大于c(Fe3+)增加量;
(4)
根据表中数据可知,FeOOH开始沉淀的pH=1.2,完全沉淀时pH=2.8,若pH过低,会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,导致铁黄产品质量降低,因此二次氧化时,溶液的pH 应控制在3~4,故答案为:pH过低会导致FeOOH溶解产生游离的Fe3+或晶体生长速度变缓,铁黄产品质量降低;
(5)
步骤④若未洗涤完全,产品中会含有硫酸根离子,因此证明洗涤完全只需证明产品中不含硫酸根离子,具体方法为:取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净,故答案为:取最后一次洗涤液,先加稀盐酸酸化,再加入BaCl2溶液,无沉淀生成,证明洗涤干净;
(6)
滴定时20.00 mL产品消耗的H2Y的物质的量为22×10-3L×0.1 000 mol/L=0.0022mol,根据Fe3++2H2Y=[FeY2]-+4H+可知,200 mL溶液产品中n(Fe3+)=0.0011×10=0.011mol,则该产品纯度为,故答案为:97.9。
5.(1)第5周期第IVA族
(2) SO2 酸雨
(3)Na2CO3+WO3Na2WO4+CO2↑
(4) 过滤 取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净
(5)SnO2+2CSn+2CO
(6)3Fe+4H2O(g) Fe3O4+4H2
(7) 阳 1.85
【解析】
由题干流程图可知,“氧化焙烧”是将锡精矿中Sn、W、S、Si、Cu、Pb、Fe、Zn等元素分别氧化为SnO2、WO3、SO2、SiO2、CuO、PbO2、Fe2O3、ZnO,在与Na2CO3一起焙烧,得到Na2WO4,Na2SiO3,加水溶解并过滤得到滤液主要是Na2WO4溶液,和滤渣主要成分为SnO2、Fe2O3、SiO2等,滤渣与C和CaCO3还原熔炼,则将SnO2、Fe2O3还原成Sn和Fe,SiO2与CaCO3转化为CaSiO3,经过对硬头进行进一步提出得到粗锡,再熔析除去Fe、Zn、Pb等,得到97%的粗锡,然后进行电解精炼即可得到精锡,据此分析解题。
(1)
由题干信息可知Sn为50号元素,36<50<54,说明Sn在第5周期第50-36=14列,即第IVA族,即Sn在元素周期表的位置为第5周期第IVA族,故答案为:第5周期第IVA族;
(2)
由题干信息I可知,精锡矿的的主要成分中只有S粉燃烧可以转化为气体SO2,则氧化焙烧产生的气体为SO2,SO2可造成的环境污染是酸雨,故答案为:SO2;酸雨;
(3)
根据流程图可知,加Na2CO3焙烧时,Na2CO3与WO3反应生成Na2WO4,故该反应的化学方程式为Na2CO3+WO3Na2WO4+CO2↑,故答案为:Na2CO3+WO3Na2WO4+CO2↑;
(4)
由题干流程图可知,操作1分离不溶性固体和溶液,则操作1的名称是过滤,洗涤CaWO4沉淀,判断是否洗净的方法是检验最后一次洗涤滤液中是否含有Cl-即可,故检验的方法为:取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净,故答案为:过滤;取最后一次洗涤滤液少许于一试管中,加入硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤沉淀干净;
(5)
由题干流程图可知,还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体即为CO,即SnO2和C反应生成Sn和CO,根据氧化还原反应配平可得,该反应的化学方程式为:SnO2+2CSn+2CO,故答案为:SnO2+2CSn+2CO;
(6)
已知Fe在高温时可与水蒸气反应生成Fe3O4和H2,则该反应的化学方程式为3Fe+4H2O(g) Fe3O4+4H2,故答案为:3Fe+4H2O(g) Fe3O4+4H2;
6.(1)二氧化硅
(2)V2O3+2H2O2+2H+=2VO+3H2O
(3)加入氨水,消耗H+,c(H+)减小,使得可逆反应VO+H2OVO+2H+平衡正向移动,故溶液中会产生大量的VO
(4)取最后一次洗涤液少量于试管中,滴加BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净
(5)0.103mol·L-1
(6) 2NH4VO32NH3↑+V2O5+H2O 调pH
【解析】
含钒废料(含V2O3、Fe2O3、Al2O3、CuO、SiO2等)研磨后加入硫酸酸溶,双氧水氧化,得到滤渣1为SiO2,滤液加入适量氨水调节pH可生成氢氧化铁、氢氧化铝、氢氧化铜沉淀,同时将溶液中的VO转化为VO,过滤后滤液加入硫酸铵,可得到NH4VO3,煅烧可生成V2O5,以此解答该题。
(1)
根据以上分析可知滤渣1主要成分是SiO2;
(2)
“酸浸氧化”后钒元素主要以VO形式存在,这说明V2O3被双氧水氧化,则V2O3溶解过程中发生的离子反应方程式为V2O3+2H2O2+2H+=2VO+3H2O;
(3)
由于加入氨水,消耗H+,c(H+)减小,使得可逆反应VO+H2OVO+2H+平衡正向移动,故溶液中会产生大量的VO;
(4)
若NH4VO3未洗涤干净,则固体上会附着硫酸根离子,因此检验NH4VO3已洗涤干净,只要检验最后一次洗涤液中没有硫酸根离子即可,则检验沉淀是否洗净的方法是取最后一次洗涤液少量于试管中,滴加BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净;
(5)
二者反应时需要10mL0.1 mol/L硫酸铵,VO沉淀完全后溶液中铵根浓度是mol/L=0.003 mol/L,则对应硫酸铵的浓度是=0.003 mol/L,所以(NH4)2SO4溶液的最小浓度为0.003 mol/L+0.1mol/L=0.103mol/L。
(6)
依据原子守恒可知“煅烧”过程中的化学反应方程式为2NH4VO32NH3↑+V2O5+H2O,副产物是氨气,则副产物可在调pH过程中循环使用。
7.(1) 增大固体与气体的接触面积,提高焙烧速率 11:4
(2)FeS2+2Fe3+=3Fe2++2S
(3) 酸式 酸
(4)没有沉淀产生,因为常温下,Qc=0.1×(10-12)3=10-37<Ksp(Al(OH)3)=1.3×10-33
(5)温度太低了,反应速率慢;温度高了,NH4HCO3发生分解
(6)86.72%
【解析】
硫铁矿(主要成分为FeS2、SiO2、Al2O3)煅烧生成氧化铁和二氧化硫,用稀硫酸酸浸,二氧化硅不溶,过量得到滤渣1,溶液中含有硫酸铁、硫酸铝,加入FeS2还原铁离子得到单质硫沉淀,滤液调节pH除去铝,过滤,向滤液中加入碳酸氢铵沉铁,过滤得到碳酸亚铁,然后经过一系列操作得到柠檬酸亚铁(FeC6H6O7),据此解答。
(1)
焙烧时气体与矿料逆流而行,可以增大固体与气体的接触面积,提高焙烧速率,根据以上分析可知“焙烧”过程中发生反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,反应中O2为氧化剂,FeS2为还原剂,则“焙烧”过程中氧化剂和还原剂的物质的量之比为11:4,故答案为:增大固体与气体的接触面积,提高焙烧速率;11:4;
(2)
FeS2与H2SO4不反应,“还原”时FeS2被铁离子氧化,发生反应的离子方程式为FeS2+2Fe3+=3Fe2++2S,故答案为:FeS2+2Fe3+=3Fe2++2S;
(3)
由题干信息可知,柠檬酸是一种三元酸,故柠檬酸亚铁(FeC6H6O7)是一种酸式盐,由题干信息可知,常温下,柠檬酸()电离常数,,, ,Kh2===5.78×10-8小于Ka3,即的电离大于水解,故0.1mol/LNa2C6H6O7溶液呈酸性,故答案为:酸式;酸性;
(4)
若铝离子浓度为0.1mol/L, “除铝”中调节pH=2时即溶液中的c(OH-)=10-12mol/L,通过计算判断可知,c(Al3+)c3(OH-)=0.1×(10-12)3=10-37<1.3×10-33,则不产生氢氧化铝沉淀,故答案为:没有沉淀产生,因为常温下,Qc=0.1×(10-12)3=10-37<Ksp(Al(OH)3)=1.3×10-33;
(5)
温度太低了,反应速率慢;温度高了,NH4HCO3发生分解,故“沉铁”时需控制温度在32℃左右,故答案为:温度太低了,反应速率慢;温度高了,NH4HCO3发生分解;
7.(1) 增大Cl-浓度,提高浸出率 HCl挥发 Bi3+水解程度增大,生成难溶的BiOCl
(2)AgCl、PbCl2
(3) 3Cu2++ 4OH-+2Cl-=Cu3(OCl)2+2H2O 97.6%
(4)NaCl
(5)Bi3++Cl-+H2O=BiOCl+2H+
【解析】
氧化铋渣的主要成分为,含有、、杂质,由流程可知,加盐酸、饱和食盐水分离出滤渣Ⅰ为、,过滤后滤液加生成,滤液Ⅱ含铜离子,再加生成,滤液Ⅲ含,可在浸出步骤中循环使用,中加入热发生,高温下C与熔炼生成,以此来解答。
(1)
铋的浸出率随浓度增大而增大,因此的作用是增大浓度,提高浸出率;由于升高温度,受热会发,且水解程度增大,生成难溶的,因此浸出率下降;
(2)
根据以上分析可知“滤渣Ⅰ”的成分为、;
(3)
“沉铜”时,向“滤液Ⅱ”中加入溶液调节pH,生成,离子方程式为;若“滤液II”中为,常温下加入等体积的溶液使pH恰好为6时,出现沉淀,根据4的溶度积常数可知,且等体积混合,此时的去除率为;
(4)
“滤液Ⅲ”中含,经加热浓缩后可返回浸出工序循环使用;
(5)
由流程图可知水解工序时Bi3+和氯离子和水反应生成BiOCl,故其对应的离子方程式为:Bi3++Cl-+H2O=BiOCl+2H+。
9.(1) SO2 粉碎矿石
(2)增加固体和气体的接触面积,加快反应速率,使原料尽可能反应提高原料利用率
(3)MoO3+ CO= MoO+CO2↑
(4) PbS的沉淀不完全 PbSPb2++S2-,若溶液较小,则氢离子浓度较大,氢离子与硫离子生成硫化氢,导致硫离子浓度减小,PbS的沉淀溶解平衡正向移动
(5) 蒸发浓缩 降温结晶
(6)30
【解析】
(1)
钼精矿(主要成分是,含少量等),在空气中焙烧硫元素会转化为二氧化硫气体,故气体A的主要成分是SO2;对于固体来说,粉碎可以增大接触面积,从而加快反应速度,提高反应效率;
(2)
采用“多层逆流”的目的是增加固体和气体的接触面积,加快反应速率,使原料尽可能反应提高原料利用率;
(3)
由流程可知,浸取过程中生成二氧化碳,反应中各元素化合价没有改变,钼元素转化为MoO,反应为MoO3+ CO= MoO+CO2↑;
(4)
PbSPb2++S2-,若溶液较小,则氢离子浓度较大,氢离子与硫离子生成硫化氢,导致硫离子浓度减小,PbS的沉淀溶解平衡正向移动,导致PbS的沉淀不完全;
(5)
流程中“…”得到钼酸钠晶体,在实验室的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(6)
反应前后元素种类不变,则理论上钼精矿中钼的百分含量为。
10.(1) 四 8
(2)
(3)
(4)除去杂质,减少的溶解,提高产率,易快速干燥
(5) 60 1.1
(6)当加入最后半滴时,溶液由蓝色变为无色,且半分钟不变化
(7)
【解析】
(1)
铁在周期表的第四周期第8列(新周期表中的族第Ⅷ族为副族但不标B,主张族以列为好)
(2)
“常温氧化”中氧化剂是,还原剂是,碱性条件
(3)
若是改用钠盐的话,生成的,需要转化为钾盐,题中信息说明钾盐比钠盐溶解度小,所以钠盐可以转化钾盐。
(4)
“洗涤烘干”由于能溶于水,不能用水洗,选用乙醇洗,既可减少钾盐的溶解,提高钾盐的产率,乙醇易挥发,可以更快地挥发并带走水份,易快速干燥。
(5)
为了获取更纯的高铁酸钾,根据图和图可知,反应时间应控制在,氧化剂浓度应控制在,故答案为:;;
(6)
碘与淀粉相遇变蓝,用的标准溶液滴定,当加入最后半滴时,溶液由蓝色变为无色,且半分钟不变化即为滴定终点;
(7)
根据题意可知, 做电极材料,电解过程中,转化为,电极方程式为:。
【点睛】
本题考查无机化学工艺、物质的分离和提纯实验操作、电解质溶液离子浓度大小比较、元素守恒和元素守恒的计算,综合性较强,侧重于实验能力、计算能力、理论应用能力的考查,题目难度中等。
11.(1) SiO2 AD
(2)有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高
(3)5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O
(4) 充分萃取,提高Zn2+的萃取率、以提高Zn2+的利用率 分液 H2SO4
(5) ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O e
(6) 阴 贫矿
【解析】
锌矿(主要成分为ZnS以及FeS2、CuS、NiS、SiO2等)中加入野外细菌堆浸,金属硫化物转化为硫酸盐,SiO2不反应,堆浸渣中含有SiO2等难溶物,堆浸液中含有硫酸锌、硫酸铜、硫酸镍、硫酸亚铁等物质;堆浸液中加入H2O2是为了将Fe2+转化为Fe3+,加入NaOH溶液为了将Fe3+转化为FeOOH沉淀而除去,过滤出FeOOH沉淀,滤液中主要含有Cu2+、Ni2+和Zn2+,向其中加入适量的Zn粉,是将Cu2+置换出来而除去,过滤出Cu,后滤液中主要含有Zn2+和Ni2+,有机相萃取剂萃取Zn2+,分液得到的有机相含有锌,含有Zn的有机相经过反萃取获得含有Zn2+的反萃液,最后电解反萃液提取金属锌,据此分析解题。
(1)
由分析可知,“堆浸渣”的主要成分为SiO2,将锌矿粉碎,增大接触面积,可以加快反应速率,大幅度升温,将使细菌失去活性,反应速率减慢,延长堆浸时间,可以通过浸取率,但不能加快反应速率,将锌矿充分暴露,增大与O2的接触面积,加快反应速率,故答案为:SiO2;AD;
(2)
“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高,故答案为:有Fe3+存在时,pH升高,能够形成Fe(OH)3胶体具有很强的吸附性,能吸附Zn2+、Cu2+、Ni2+,从而使它们的去除率均升高;
(3)
“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为:5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O,故答案为:5Zn+2Ni2++6H++Sb2O3=2NiSb+5Zn2++3H2O;
(4)
“萃取”时需要进行多次萃取且合并萃取液,其目的是充分萃取;提高Zn2+的萃取率、以提高Zn2+的利用率,由题干信息可知,操作③分离两种互不相容的液体,则该分离操作的的名称为分液,电解反萃液是电解硫酸锌溶液,得到Zn和H2SO4,此流程中可循环利用的物质有锌、萃取剂和H2SO4,故答案为:充分萃取;提高Zn2+的萃取率、以提高Zn2+的利用率;分液;H2SO4;
(5)
反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为:ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O,灼烧时需要借助马弗炉(Mufflefurnace,一种通用的加热设备,通常叫电炉等),灼烧固体应该在坩埚中进行,故答案为:ZnFe2(C2O4)3·6H2OZnFe2O4+4CO↑+2CO2↑+6H2O;e;
12.(1) 5Ni2++12H++2=5Ni2++N2↑+6H2O SiO2和CaSO4 在保证反应速率的同时减少硝酸挥发和分解
(2) +3 Na++3Fe3++2 +6H2O=[NaFe3(SO4)2(OH)6]↓+6H+
(3)
(4)(NH4)2SO4
(5)Ni(OH)2
【解析】
废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni,反应方程式有:Fe+H2SO4=FeSO4+H2↑,5Ni+5H2SO4+2HNO3=5NiSO4+N2↑+6H2O,CuO+H2SO4=CuSO4+H2O,CaO+H2SO4=CaSO4↓+H2O,MgO+H2SO4=MgSO4+H2O,过滤除去废渣,则滤渣的成分是SiO2,滤液中加入过氧化氢,氧化亚铁离子为铁离子,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入碳酸钠调节溶液pH除去铁离子,过滤得到滤渣主要成分为黄钠铁矾[NaFe3(SO4)2(OH)6],反应离子方程式为:Na++3Fe3++2+6H2O=[NaFe3(SO4)2(OH)6]↓+6H+,再向滤液中加入H2S沉淀铜离子,反应原理为:Cu2++H2S=CuS↓+2H+,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入碳酸氢铵溶液沉淀镍离子生成碳酸镍固体,过滤得沉淀NiCO3和滤液,主要成分为硫酸铵,据此分析解题。
(1)
①镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平化学方程式为:5Ni2++12H++2=5Ni2++N2↑+6H2O,故答案为:5Ni2++12H++2=5Ni2++N2↑+6H2O;
②由分析可知,酸溶过程中,二氧化硅不参与反应,故废渣的主要成分为二氧化硅,和生成的硫酸钙是微溶物质,故滤渣的成分有SiO2和CaSO4,故答案为:SiO2和CaSO4;
③温度过低,反应速率太慢,温度过高,硝酸易挥发且发生分解,故该过程控制温度70℃-80℃的原因是在保证反应速率的同时减少硝酸挥发和分解,故答案为:在保证反应速率的同时减少硝酸挥发和分解;
(2)
①由黄钠铁矾的化学式[NaFe3(SO4)2(OH)6]可知,其中Fe元素的化合价为+3价,故答案为:+3;
②由分析可知,“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是Na++3Fe3++2 +6H2O=[NaFe3(SO4)2(OH)6]↓+6H+,故答案为:Na++3Fe3++2+6H2O=[NaFe3(SO4)2(OH)6]↓+6H+;
(3)
当溶液中的c(Ni2+)=0.1mol·L-1时,c(S2-)<=3.0×10-18mol/L,“除铜”后,溶液中c(H2S)=0.1mol·L-1,则有:Ka1(H2S)Ka2(H2S)=,则1×10-7×7.0×10-15=,若要使c(S2-)<3.0×10-18mol/L,则溶液中c(H+) ≥mo1·L-1(列计算式)才不会使Ni2+形成NiS沉淀,故答案为:;
(4)
由分析可知,“沉镍”后,滤液的主要成分是(NH4)2SO4,故答案为:(NH4)2SO4;
(5)
由于碳酸钠溶液因碳酸根离子水解呈碱性,能与Ni2+反应生成Ni(OH)2,故“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为Ni(OH)2,故答案为:Ni(OH)2。
13.(1)冷凝回流
(2)2+CH3OH+10H+=2Cr3++CO2↑+7H2O
(3) 浓硫酸 干燥吸水 使滞留在装置的COCl2被NaOH溶液充分吸收,防止大气污染
(4)对D装置进行加热
(5) 继续滴加AgNO3溶液,不产生白色沉淀 偏大
【解析】
NaCrO4在酸性条件下与CH3OH发生氧化还原反应产生CrCl3,然后加入NaOH使CrCl3转化为Cr(OH)3,加热Cr(OH)3分解产生Cr2O3,在通入N2和CCl4条件下Cr2O3反应转化了CrCl3、COCl2,该反应方程式为:Cr2O3+3CCl4=2CrCl3+3COCl2。
(1)
根据图示可知:在图甲中仪器b的主要作用除导气外,还起冷凝回流作用;
(2)
在“还原”过程中NaCrO4在酸性条件下与CH3OH发生氧化还原反应产生CrCl3,CH3OH被氧化为CO2气体,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式为:2+CH3OH+10H+=2Cr3++CO2↑+7H2O;
(3)
反应产生CrCl3易水解,且在高温下易被氧气氧化,通入干燥的N2可以将装置中的空气排出,防止三氯化铬易水解及氧化变质,能够使反应物进入管式炉中进行反应。制备CrCl3时产生的COCl2有毒且易水解,因此通入的N2要先进行干燥处理,A中液体的试剂是干燥剂,可以为浓硫酸;为防止反应制取的CrCl3发生水解反应,尾气通入NaOH溶液前边应该有吸水装置,无水CaCl2的作用是吸收水分,防止水蒸气通过导气管进入收集产物的E装置;反应结束后继续通入一段时间氮气,主要目的是使滞留在装置的COCl2被NaOH溶液充分吸收,防止大气污染,该反应的化学方程式为:COCl2+4NaOH=Na2CO3+2NaCl+2H2O;
(4)
装置E用来收集产物,实验过程中若D处出现堵塞,可根据CrCl3易升华的特点,对D装置进行加热,CrCl3升华进入E装置,就可以使实验能继续进行;
(5)
若步骤②中Cl-已经完全沉淀,则再滴入AgNO3溶液时不产生白色沉淀,据此判断;
加入HNO3酸化,可以使避免杂质离子的干扰,若步骤③中未用稀HNO3洗涤沉淀,则会导致测定的三氯化铬质量分数将偏大;
根据物质反应转化关系可知:CrCl3+5H2O[Cr(H2O)5Cl]2++2Cl-,Cl-+Ag+=AgCl↓,过量Ag+用NH4SCN进行滴定,则根据中物质反应关系可知过量Ag+的物质的量为n(Ag+)(过量)=de×10-3 mol,则发生反应Cl-+Ag+=AgCl↓的Ag+的物质的量为n(Ag+) =(bc-de)×10-3 mol,因此n(CrCl3)=n(Cl-)=n(Ag+)=(bc-de)×10-3 mol,故样品中CrCl3的质量分数为:。
14.(1)3:2
(2)使Fe2+全部转化为Fe3+
(3)
(4) 调节pH
(5)
(6)c
(7)
【解析】
硫铁矿和软锰矿加入硫酸进行“浸取”,所得溶液中含有大量亚铁离子,加入软锰矿,将亚铁离子氧化成铁离子,调节pH使铁离子沉淀除去,再加入碳酸氢铵和氨水将溶液中的锰离子转化为碳酸锰,在空气中焙烧后得到二氧化锰,经过“氧化ii”、过滤、干燥得到二氧化锰纯品。
(1)
根据反应可知,反应的过程中,锰元素的化合价由+4价降低到+2价,则二氧化锰为该反应的氧化剂,Fe元素的化合价由+2价升高到+3价,S元素的化合价由-1价升高到0价,则硫化亚铁为该反应的还原剂,因此氧化剂和还原剂的物质的量之比为3:2;
(2)
由上述分析可知,“浸取”后的溶液中含有大量Fe2+,Fe2+沉淀的pH过高,因此将其氧化成Fe3+后再沉淀除去,则“氧化i”过程软锰矿的作用是使Fe2+全部转化为Fe3+;
(3)
根据题干信息可知,“除铁”时溶液的pH=5.5,则,,则“除铁”后溶液中残留的;
(4)
“沉锰”过程,加入碳酸氢铵和氨水,将溶液中的锰离子转化成碳酸锰,反应的离子方程式为;由图可知,“沉锰”过程中,需要调节溶液的pH=6.5~7,氨水的作用是调节溶液的pH;
(5)
“焙烧”过程中,MnCO3与空气中的氧气反应生成MnO2,反应的化学方程式为;
(6)
Mn(Ⅳ)的氧化性比和都强(例如,MnO2能将过氧化氢氧化生成氧气,实验室用MnO2和浓盐酸加热反应制取氯气),用或不能将Mn(Ⅱ)氧化为Mn(Ⅳ),而在酸性条件下能将Mn(Ⅱ)氧化为Mn(Ⅳ),故选用最适宜氧化剂是,答案选c。
(7)
根据总反应可知,放电时,作正极,发生还原反应,则放电时正极的电极反应为。
15.(1)NaOH会消耗萃取反应时生成的H+,促进萃取反应的正向进行,提高萃取效果
(2)2Al3++3+3H2O=2Al(OH)3↓+3CO2↑
(3)洗去沉淀表面的杂质离子,减少Li2CO3的溶解损失,提高Li2CO3的纯度和产率
(4)固液比越小,去离子水体积越多,碳化反应后生成及溶解的LiHCO3越多,热分解时会生成更多的Li2CO3
【解析】
此题目的以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、SO等)制取电池级Li2CO3,锂云母加入HR,Fe3++3HR FeR3+3H+,生成的FeR3可溶解在HR中分液有机层为FeR3,水溶液为(Li+、Al3+、Ca2+、SO),沉锂加入碳酸钠生成Li2CO3、CaCO3和Al(OH)3沉淀,Li2CO3、CaCO3和Al(OH)3加入去离子水二氧化碳,碳化反应,碳酸锂和和水和二氧化碳生成碳酸氢锂,过滤,滤渣为碳酸钙和氢氧化铝,滤液为碳酸氢锂,碳酸氢锂热分解生成电池级的碳酸锂,以此来解析;
(1)
根据Fe3++3HR FeR3+3H+,Fe3+易与R-结合FeR3,NaOH会消耗萃取反应时生成的H+,促进萃取反应的正向进行,提高萃取效果;
(2)
铝离子和碳酸根离子双水解生成二氧化碳和氢氧化铝,根据电荷守恒和原子守恒,可得反应的离子方程式为:2Al3++3CO+3H2O=2Al(OH)3↓+3CO2↑;
(3)
根据图片1的信息可知碳酸锂的溶解度随着温度的升高而降低,温度越高溶解度越小,用热水洗涤能降低碳酸锂在水中溶解的量,过滤1后所得沉淀用热水洗涤的目的是洗去沉淀表面的杂质离子,减少Li2CO3的溶解损失,提高Li2CO3的纯度和产率;
(4)
固液比越小,去离子水体积越多,碳化反应后生成及溶解的LiHCO3越多,热分解时会生成更多的Li2CO3,所以Li2CO3产率随固液比减小而增加;
16.(1)CaSO4和SiO2
(2)Co3O4+4H++SO2=3Co2++2H2O+
(4)C
(5) 增大接触面积,使萃取充分 ZnSO4
【解析】
本题为工艺流程题,是以锌冶炼钴渣为原料来制备电池级CoSO4、MnSO4混合液,“浸出”是用硫酸、SO2来浸出,反应原理有:ZnO+H2SO4=ZnSO4+H2O、MnO+H2SO4=MnSO4+H2O、CdO+H2SO4=CdSO4+H2O、FeO+H2SO4=FeSO4+H2O、CaO+H2SO4=CaSO4↓+H2O、MgO+H2SO4=MgSO4+H2O、Co2O3+H2SO4+SO2=2CoSO4+H2O、Fe2O3+H2SO4+SO2=2FeSO4+H2O、Co3O4+2H2SO4+SO2=3CoSO4+2H2O,过滤得滤渣,则滤渣得主要成分为CaSO4和SiO2,滤液中加入MnS得到CdS沉淀,过滤出CdS后,向滤液中加入H2O2将Fe2+氧化为Fe3+,在加入MnCO3调节pH以析出Fe(OH)3沉淀,来除去铁,过滤,继续向滤液中加入氟化物X,析出MgF2、CaF2沉淀,过滤得滤液3,通过加入有机萃取剂HA进行逆流萃取来除去Mn2+,最后得到水层溶液即为电池级CoSO4、MnSO4混合液,据此分析解题。
(1)
由分析可知,“浸渣”的主要成分是CaSO4和SiO2,故答案为:CaSO4和SiO2;
(2)
由分析可知,“浸出”时,转化为的反应方程式为Co3O4+2H2SO4+SO2=3CoSO4+2H2O,则该反应的离子方程式为:Co3O4+4H++SO2=3Co2++2H2O+,故答案为:Co3O4+4H++SO2=3Co2++2H2O+;
(3)
若溶液中金属离子浓度为,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保恰好沉淀完全而不沉淀,此时c(S2-)≥ ==8.0×10-21mol/L,c(S2-)<Ksp(ZnS),故c(S2-)<=2.5×10-2mol/L,故答案为:为了确保恰好沉淀完全而不沉淀,此时c(S2-)≥ ==8.0×10-21mol/L,c(S2-)<Ksp(ZnS),故c(S2-)<=2.5×10-2mol/L;
(4)
由于NaF、KF将引入新的杂质离子Na+、K+很难除去,而MgF2不能用于除去Mg2+,故“氟化物”为MnF2,故答案为:C;
(5)
萃取时,发生反应:。采取“逆流萃取”的作用是增大接触面积,使萃取充分,由分析可知,有机相中含有Zn2+,可通过硫酸处理后使得上述平衡逆向移动,故得到的副产品为ZnSO4,故答案为:增大接触面积,使萃取充分;ZnSO4。
17.(1)MnCO3+(NH4)2SO4MnSO4+2NH3↑+CO2↑+H2O
(2)34.5%
(3) Na2CO3溶液碱性较强,会有部分Mn(OH)2沉淀生成,所得MnCO3不纯,Mn的利用率降低 使用NH4HCO3溶液会有CO2气体放出,NH4HCO3的利用率低 边搅拌边向混合溶液中加入90mL 1.0mol·L-1的NaOH溶液,充分反应后过滤,向滤渣中边搅拌边加入适量1.0mol·L-1 H2SO4溶液,当固体不再减少时,过滤,用蒸馏水多次洗涤滤渣,直至取最后一次洗涤滤液加入1.0mol·L-1 BaCl2溶液无沉淀生成,过滤,干燥
【解析】
根据碳酸锰矿中所含成分,以及流程图可知,碳酸锰与硫酸铵反应生成硫酸锰、氨气和二氧化碳,铁的氧化物、氧化铝、二氧化硅不与硫酸铵反应,加水溶解后,得到含硫酸锰溶液,据此分析。
(1)
根据上述分析,碳酸锰与硫酸铵反应生成硫酸锰、氨气和二氧化碳,其反应方程式为MnCO3+(NH4)2SO4MnSO4+2NH3↑+CO2↑+H2O。
(2)
Mn(PO4)与Fe2+反应存在化合价的变化,属于氧化还原反应,根据得失电子数目守恒,Mn(PO4)与Fe2+反应物质的量之比为1∶1,根据元素守恒,建立关系式为MnCO3~Mn2+~Mn(PO4)~Fe2+,因此有n(MnCO3)=n(Fe2+),碳酸锰的质量含量为=34.5%。
(3)
①a.Na2CO3属于强碱弱酸盐,溶液显碱性,Na2CO3的碱性较强,会有部分Mn元素转化成Mn(OH)2沉淀,所得MnCO3不纯,Mn的利用率降低。
b.NH4HCO3为弱酸弱碱盐,Mn2+与HCO电离产生CO结合成MnCO3,促使HCO电离,c(H+)增大,H+与HCO反应生成CO2,造成NH4HCO3的利用率降低。
②根据图像可知,当NaOH与MnSO4的物质的量之比为4.5时,Mn的转化率、MnO2的含量达到最大,当加入20mL 1.0mol·L-1的MnSO4时需要加入90mL 0.1mol·L-1 NaOH溶液,过滤,向滤渣中加入适量的硫酸,将Mn(OH)2转化成MnSO4,当固体质量不再减少时,过滤,洗涤滤渣;具体操作是边搅拌边向混合溶液中加入90mL 1.0mol·L-1的NaOH溶液,充分反应后过滤,向滤渣中边搅拌边加入适量1.0mol·L-1 H2SO4溶液,当固体不再减少时,过滤,用蒸馏水多次洗涤滤渣,直至取最后一次洗涤滤液加入1.0mol·L-1 BaCl2溶液无沉淀生成,过滤,干燥。
答案第1页,共2页
答案第1页,共2页
同课章节目录
