黑龙江省佳木斯市佳市八中2021-2022学年高三上学期期末考试理综化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省佳木斯市佳市八中2021-2022学年高三上学期期末考试理综化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 406.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-21 11:17:31 | ||
图片预览

文档简介
佳市八中2021-2022学年高三上学期期末考试
理科综合化学试卷
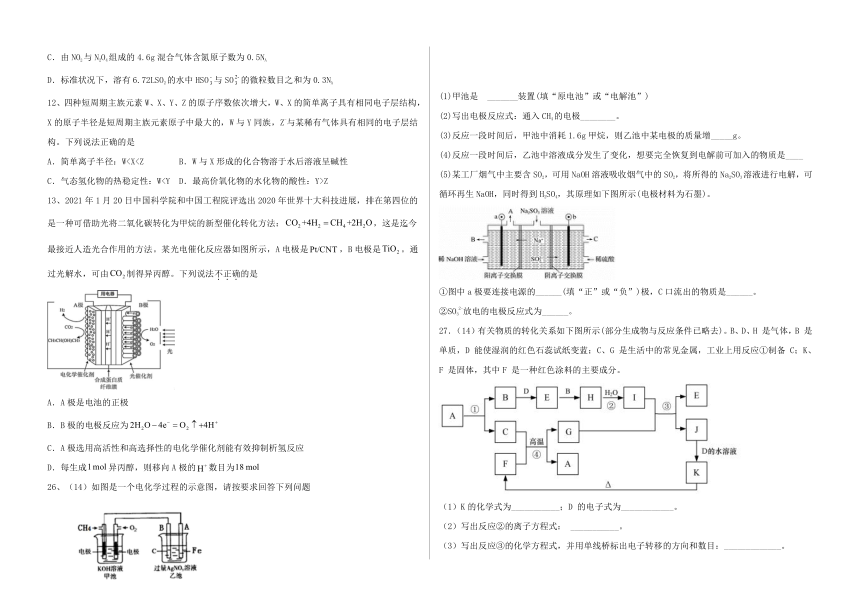
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
选择题:本题共13道小题,每小题6分,共78分。在每个小题给出的四个选项中,只有一项符合题目要求。
7、化学与生产、生活密切相关。下列叙述错误的是
A.提高燃料利用率和寻找新能源已成为能源研究热点
B.采取节能低碳生活方式是实现“碳中和”的途径之一
C.兵马俑用陶土烧制而成,属于硅酸盐产品
D.硅单质可用于制作光导纤维
8、下列方案设计、现象和结论都正确的是
目的 方案设计 现象和结论
A 检验海带中的碘元素 将海带灰溶解并过滤,取少量滤液,酸化后加入过量的H2O2或新制氯水,振荡,再加入1-2滴淀粉溶液 若溶液变蓝,则海带中含有碘元素
B 检验NaNO2溶液的还原性 取一定量的NaNO2溶液于试管中,再加入少量稀H2SO4酸化的K2Cr2O7溶液 若溶液由橙色变为绿色,证明NaNO2具有还原性
C 探究不同沉淀之间的转化 往5mL0.1mol L-1的AgNO3溶液中加入2mL0.1mol L-1的NaCl溶液,再加入2mL0.1mol L-1的NaI溶液 若产生的白色沉淀转变为黄色,则说明AgCl可转变为AgI
D 检验某有机物是否含醛基 向其中先加入1mL0.1mol L-1NaOH溶液,再加入2mL0.1mol L-1的CuSO4溶液,混合加热 若有砖红色沉淀产生,则含有醛基
A.A B.B C.C D.D
9、由铁及其化合物可制得FeSO4·7H2O、FeCl3、K2FeO4等化工产品,它们在生产、生活中具有 广泛应用。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1。下列由废铁屑制取FeSO4·7H2O的实验原理与装置不能达到实验目的的是
A.用装置甲除去废铁屑表面的油污 B.用装置乙加快废铁屑的溶解
C.用装置丙过滤得到FeSO4溶液 D.用装置丁蒸干溶液获得FeSO4·7H2O
10、下列离子反应方程式正确的是
A.NH4HCO3稀溶液与过量的KOH溶液反应:HCO+OH﹣=CO+H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO沉淀完全:
2Al3++3SO+3Ba2++6OH﹣=2Al(OH)3↓+3BaSO4↓
C.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时:3Fe+2NO+8H+=3Fe2++2NO↑+4H2O
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO刚好沉淀完全:
2H++SO+Ba2++2OH﹣=2H2O+BaSO4↓
11、NA是阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳含共价键总数为0.4NA
B.由H218O与D216O组成的4.0g混合物含中子数为2NA
C.由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
D.标准状况下,溶有6.72LSO2的水中HSO与SO的微粒数目之和为0.3NA
12、四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z-与某稀有气体具有相同的电子层结构。下列说法正确的是
A.简单离子半径:WC.气态氢化物的热稳定性:WZ
13、2021年1月20日中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:,这是迄今最接近人造光合作用的方法。某光电催化反应器如图所示,A电极是,B电极是。通过光解水,可由制得异丙醇。下列说法不正确的是
A.A极是电池的正极
B.B极的电极反应为
C.A极选用高活性和高选择性的电化学催化剂能有效抑制析氢反应
D.每生成异丙醇,则移向A极的数目为
26、(14)如图是一个电化学过程的示意图,请按要求回答下列问题
(1)甲池是 _______装置(填“原电池”或“电解池”)
(2)写出电极反应式:通入CH4的电极________。
(3)反应一段时间后,甲池中消耗1.6g甲烷,则乙池中某电极的质量增_____g。
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是____
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
①图中a极要连接电源的______(填“正”或“负”)极,C口流出的物质是______。
②SO32-放电的电极反应式为______。
27.(14)有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。B、D、H 是气体,B 是单质,D 能使湿润的红色石蕊试纸变蓝;C、G 是生活中的常见金属,工业上用反应①制备 C;K、F 是固体,其中F 是一种红色涂料的主要成分。
(1)K的化学式为___________;D 的电子式为____________。
(2)写出反应②的离子方程式: ___________。
(3)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目:_____________。
(4)物质J 常用作催化剂,媒染剂,放射性物质吸附剂。从J的溶液得到J的晶体的操作依次为_____________、冰水洗涤、减压烘干。冰水洗涤的目的___________。
(5)反应③常通过微热来加快反应的速率,加热时温度不能过高的原因是_________。
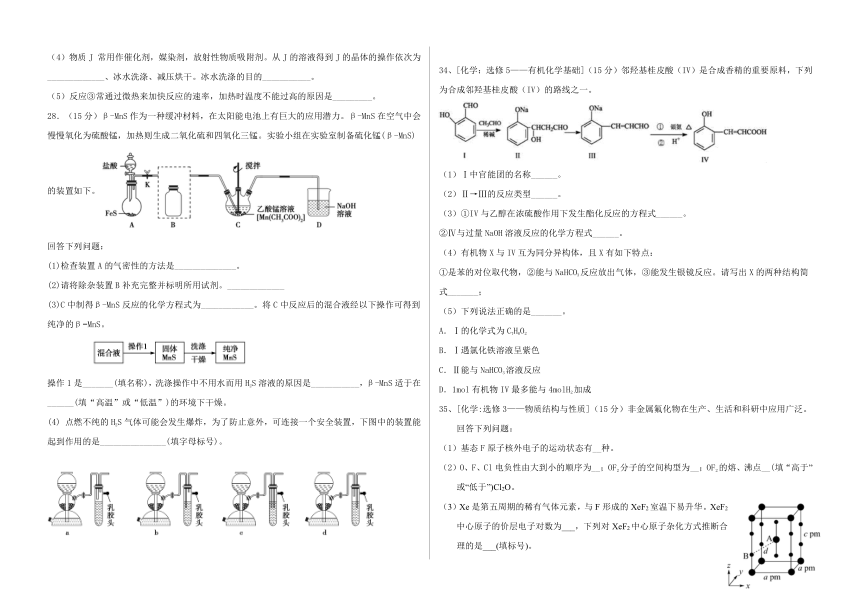
28.(15分)β-MnS作为一种缓冲材料,在太阳能电池上有巨大的应用潜力。β-MnS在空气中会慢慢氧化为硫酸锰,加热则生成二氧化硫和四氧化三锰。实验小组在实验室制备硫化锰(β-MnS)的装置如下。
回答下列问题:
(1)检查装置A的气密性的方法是______________。
(2)请将除杂装置B补充完整并标明所用试剂。_____________
(3)C中制得β-MnS反应的化学方程式为____________。将C中反应后的混合液经以下操作可得到纯净的β MnS。
操作1是_______(填名称),洗涤操作中不用水而用H2S溶液的原因是___________,β-MnS适于在______(填“高温”或“低温”)的环境下干燥。
点燃不纯的H2S气体可能会发生爆炸,为了防止意外,可连接一个安全装置,下图中的装置能起到作用的是_______________(填字母标号)。
34、[化学:选修5——有机化学基础](15分)邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。
(1)Ⅰ中官能团的名称______。
(2)Ⅱ→Ⅲ的反应类型______。
(3)①IV与乙醇在浓硫酸作用下发生酯化反应的方程式______。
②Ⅳ与过量NaOH溶液反应的化学方程式______。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出X的两种结构简式_______;
(5)下列说法正确的是_______。
A.Ⅰ的化学式为C7H8O2
B.Ⅰ遇氯化铁溶液呈紫色
C.Ⅱ能与NaHCO3溶液反应
D.1mol有机物IV最多能与4molH2加成
35、[化学:选修3——物质结构与性质](15分)非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有__种。
(2)O、F、Cl电负性由大到小的顺序为__;OF2分子的空间构型为__;OF2的熔、沸点__(填“高于”或“低于”)Cl2O。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___,下列对XeF2中心原子杂化方式推断合理的是___(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有__个XeF2分子。
化学答案
选择题
7—13 DBDCBBD
填空题
26、原电池 CH4-8e-+10OH-=CO32-+ 7H2O 86.4g Ag2O 负 较浓的硫酸 SO32--2e-= SO42-+2H+
27、Fe(OH)3 3NO2 +H2O=2H++2NO3+NO 蒸发(加热)浓缩、冷却结晶、过滤 减少晶体的溶解损耗 硝酸在较高温度下(易挥发)易分解
28、关闭止水夹K,从分液漏斗口注水,当分液漏斗内水面不再下降,表明装置气密性好 H2S + Mn(CH3COO)2=MnS↓ + 2CH3COOH 过滤 减少沉淀的溶解损失 低温 b
34、羟基、醛基 消去 +CH3CH2OH+H2O +2NaOH+2H2O 和 BD
35、 (1)9
F>O>Cl;角(V)型;低于
5;D
2
理科综合化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
选择题:本题共13道小题,每小题6分,共78分。在每个小题给出的四个选项中,只有一项符合题目要求。
7、化学与生产、生活密切相关。下列叙述错误的是
A.提高燃料利用率和寻找新能源已成为能源研究热点
B.采取节能低碳生活方式是实现“碳中和”的途径之一
C.兵马俑用陶土烧制而成,属于硅酸盐产品
D.硅单质可用于制作光导纤维
8、下列方案设计、现象和结论都正确的是
目的 方案设计 现象和结论
A 检验海带中的碘元素 将海带灰溶解并过滤,取少量滤液,酸化后加入过量的H2O2或新制氯水,振荡,再加入1-2滴淀粉溶液 若溶液变蓝,则海带中含有碘元素
B 检验NaNO2溶液的还原性 取一定量的NaNO2溶液于试管中,再加入少量稀H2SO4酸化的K2Cr2O7溶液 若溶液由橙色变为绿色,证明NaNO2具有还原性
C 探究不同沉淀之间的转化 往5mL0.1mol L-1的AgNO3溶液中加入2mL0.1mol L-1的NaCl溶液,再加入2mL0.1mol L-1的NaI溶液 若产生的白色沉淀转变为黄色,则说明AgCl可转变为AgI
D 检验某有机物是否含醛基 向其中先加入1mL0.1mol L-1NaOH溶液,再加入2mL0.1mol L-1的CuSO4溶液,混合加热 若有砖红色沉淀产生,则含有醛基
A.A B.B C.C D.D
9、由铁及其化合物可制得FeSO4·7H2O、FeCl3、K2FeO4等化工产品,它们在生产、生活中具有 广泛应用。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1。下列由废铁屑制取FeSO4·7H2O的实验原理与装置不能达到实验目的的是
A.用装置甲除去废铁屑表面的油污 B.用装置乙加快废铁屑的溶解
C.用装置丙过滤得到FeSO4溶液 D.用装置丁蒸干溶液获得FeSO4·7H2O
10、下列离子反应方程式正确的是
A.NH4HCO3稀溶液与过量的KOH溶液反应:HCO+OH﹣=CO+H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO沉淀完全:
2Al3++3SO+3Ba2++6OH﹣=2Al(OH)3↓+3BaSO4↓
C.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时:3Fe+2NO+8H+=3Fe2++2NO↑+4H2O
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO刚好沉淀完全:
2H++SO+Ba2++2OH﹣=2H2O+BaSO4↓
11、NA是阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳含共价键总数为0.4NA
B.由H218O与D216O组成的4.0g混合物含中子数为2NA
C.由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
D.标准状况下,溶有6.72LSO2的水中HSO与SO的微粒数目之和为0.3NA
12、四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z-与某稀有气体具有相同的电子层结构。下列说法正确的是
A.简单离子半径:W
13、2021年1月20日中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:,这是迄今最接近人造光合作用的方法。某光电催化反应器如图所示,A电极是,B电极是。通过光解水,可由制得异丙醇。下列说法不正确的是
A.A极是电池的正极
B.B极的电极反应为
C.A极选用高活性和高选择性的电化学催化剂能有效抑制析氢反应
D.每生成异丙醇,则移向A极的数目为
26、(14)如图是一个电化学过程的示意图,请按要求回答下列问题
(1)甲池是 _______装置(填“原电池”或“电解池”)
(2)写出电极反应式:通入CH4的电极________。
(3)反应一段时间后,甲池中消耗1.6g甲烷,则乙池中某电极的质量增_____g。
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是____
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
①图中a极要连接电源的______(填“正”或“负”)极,C口流出的物质是______。
②SO32-放电的电极反应式为______。
27.(14)有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。B、D、H 是气体,B 是单质,D 能使湿润的红色石蕊试纸变蓝;C、G 是生活中的常见金属,工业上用反应①制备 C;K、F 是固体,其中F 是一种红色涂料的主要成分。
(1)K的化学式为___________;D 的电子式为____________。
(2)写出反应②的离子方程式: ___________。
(3)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目:_____________。
(4)物质J 常用作催化剂,媒染剂,放射性物质吸附剂。从J的溶液得到J的晶体的操作依次为_____________、冰水洗涤、减压烘干。冰水洗涤的目的___________。
(5)反应③常通过微热来加快反应的速率,加热时温度不能过高的原因是_________。
28.(15分)β-MnS作为一种缓冲材料,在太阳能电池上有巨大的应用潜力。β-MnS在空气中会慢慢氧化为硫酸锰,加热则生成二氧化硫和四氧化三锰。实验小组在实验室制备硫化锰(β-MnS)的装置如下。
回答下列问题:
(1)检查装置A的气密性的方法是______________。
(2)请将除杂装置B补充完整并标明所用试剂。_____________
(3)C中制得β-MnS反应的化学方程式为____________。将C中反应后的混合液经以下操作可得到纯净的β MnS。
操作1是_______(填名称),洗涤操作中不用水而用H2S溶液的原因是___________,β-MnS适于在______(填“高温”或“低温”)的环境下干燥。
点燃不纯的H2S气体可能会发生爆炸,为了防止意外,可连接一个安全装置,下图中的装置能起到作用的是_______________(填字母标号)。
34、[化学:选修5——有机化学基础](15分)邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。
(1)Ⅰ中官能团的名称______。
(2)Ⅱ→Ⅲ的反应类型______。
(3)①IV与乙醇在浓硫酸作用下发生酯化反应的方程式______。
②Ⅳ与过量NaOH溶液反应的化学方程式______。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出X的两种结构简式_______;
(5)下列说法正确的是_______。
A.Ⅰ的化学式为C7H8O2
B.Ⅰ遇氯化铁溶液呈紫色
C.Ⅱ能与NaHCO3溶液反应
D.1mol有机物IV最多能与4molH2加成
35、[化学:选修3——物质结构与性质](15分)非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有__种。
(2)O、F、Cl电负性由大到小的顺序为__;OF2分子的空间构型为__;OF2的熔、沸点__(填“高于”或“低于”)Cl2O。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___,下列对XeF2中心原子杂化方式推断合理的是___(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有__个XeF2分子。
化学答案
选择题
7—13 DBDCBBD
填空题
26、原电池 CH4-8e-+10OH-=CO32-+ 7H2O 86.4g Ag2O 负 较浓的硫酸 SO32--2e-= SO42-+2H+
27、Fe(OH)3 3NO2 +H2O=2H++2NO3+NO 蒸发(加热)浓缩、冷却结晶、过滤 减少晶体的溶解损耗 硝酸在较高温度下(易挥发)易分解
28、关闭止水夹K,从分液漏斗口注水,当分液漏斗内水面不再下降,表明装置气密性好 H2S + Mn(CH3COO)2=MnS↓ + 2CH3COOH 过滤 减少沉淀的溶解损失 低温 b
34、羟基、醛基 消去 +CH3CH2OH+H2O +2NaOH+2H2O 和 BD
35、 (1)9
F>O>Cl;角(V)型;低于
5;D
2
同课章节目录
