福建省荷山中学2013年高二化学会考专题练习:物质结构、元素周期律、化学反应中的能量变化、化学反应速率与化学平衡
文档属性
| 名称 | 福建省荷山中学2013年高二化学会考专题练习:物质结构、元素周期律、化学反应中的能量变化、化学反应速率与化学平衡 |  | |
| 格式 | zip | ||
| 文件大小 | 497.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-25 22:22:24 | ||
图片预览


文档简介
2013荷山中学会考专题练习
1。设NA代表阿伏加德罗常数,下列说法中,正确的是
A.2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol)
B.17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol)
C.2g氢气所含原子数目为NA (提示:M(H2)=2g/mol)
D.常温常压下,11.2L氮气所含的原子数目为NA
2.“低能耗、低污染、低排放”是低碳经济的重要标志,也是2010上海世博会的亮点之一。其中“低排放”主要指减少排放
A.N2 B.O2 C.CO2 D.S02
3.我国“西气东输”工程输送的化石燃料主要是
A.水煤气 B.天然气 C.焦炉气 D.石油气
4.下列物质中,属于非电解质的是
A.蔗糖 B.金属镁 C.氧气 D.氯化钠
5.工业上从海水中提取金属镁所发生的化学反应中,不涉及的物质是
A.H2SO4 B.MgCl2 C.Ca(OH)2 D.HCl
6.决定主族元素在元素周期表中所处位置的是该元素原子的
A.质量数 B.中子数 C.次外层电子数 D.电子层数和最外层电子数
7。2012年 11月有媒体报道,我国内蒙古发现了世界级铀矿,内含可用作核反应堆燃料的U.U原子核内的质子数为
A.92 B.143 C.235 D.327
8.下列各组物质中,互为同分异构体的是
A.O2与O3 B.与
C.CH2Cl2与CHCl3 D.
9。下列各组物质中,不互为同素异形体的是
A.金刚石和C60 B.红磷和P4 C.O2和O3 D.CH3CH3和CH4
10。下列物质互为同素异形体的是
A.126C和146C B.氧气和臭氧 C.甲烷和乙烷 D.正丁烷和异丁烷
11.下列物质中,属于离子化合物的是
A.NH3 B.CO2 C.HCl D.MgCl2
12.下列物质中,既有离子键,又有共价键的是
A.MgCl2 B.KOH C.NH3 D.H2O2
13。 下列物质中,既有离子键,又有共价键的是
? A.KCl?????????? B.NH4Cl?????????? C.H2O?????????? D.CH4
14.下列说法中不正确的是
A.在共价化合物中不可能含有离子键 B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物 D.含有离子键的化合物一定是离子化合物
15.下列叙述中,不正确的是
A.N、0、F三种元素的非金属性依次减弱
B.Na、Mg、Al三种元素的原子半径依次减小
C.F、Cl、Br三种原子的核外电子层数依次增多
D.P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强
16。下列各项比较中,正确的是
A. 原子半径:N<O<F B. 热稳定性:HCl<HBr<HI
C. 元素的金属性:Na<Mg<Al D. 酸性:H2SiO3<H3PO4<H2SO4
17.下列各项比较中,正确的是
A.原子核外电子数:H>O>Al B.元素非金属性:F>Cl>Br
C.热稳定性:PH3>H2S>HC1 D.碱性:LiOH>NaOH>KOH
18.下列实验操作或方法中,正确的是
19.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
20.下列关于元素周期表和元素周期律的说法不正确的是
A.第ⅦA族从氟到碘,其氢化物的稳定性逐渐减弱
B.同周期,从左到右,元素金属性逐渐减弱,非金属性逐渐增强(稀有气体元素除外)
C.因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强
D.氧与硫为同主族元素,硫比氧的原子半径大,氧比硫的非金属性强
21.短周期元素X最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X C.XH4 D.XH3
22。 日常生活中,常用到化学知识。下列说法不正确的是
A.某些铁盐溶于水生成的Fe(OH)3胶体,可除去水中的悬浮颗粒等杂质 B.维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜 C.构成人体蛋白质的20多种氨基酸都能通过人体自身合成 D.可用燃烧的方法鉴别真丝围巾和合成纤维围巾
23.下列说法正确的是
A.化学反应都是吸热反应 B.化学反应都是放热反应
C.物质发生化学反应都伴随着能量变化 D.有能量变化的物质变化都是化学变化
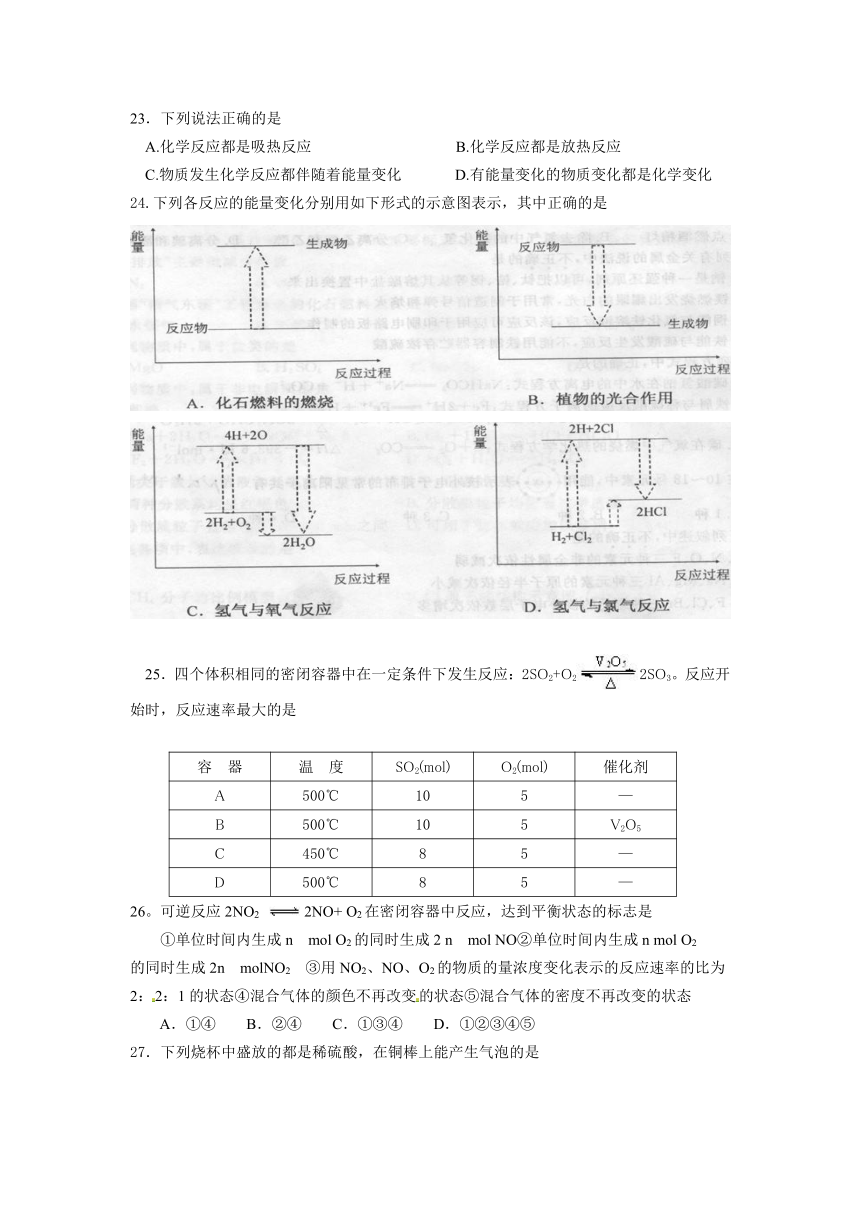
24.下列各反应的能量变化分别用如下形式的示意图表示,其中正确的是
25.四个体积相同的密闭容器中在一定条件下发生反应:2SO2+O22SO3。反应开始时,反应速率最大的是
容 器
温 度
SO2(mol)
O2(mol)
催化剂
A
500℃
10
5
—
B
500℃
10
5
V2O5
C
450℃
8
5
—
D
500℃
8
5
—
26。可逆反应2NO2 2NO+ O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2 n mol NO②单位时间内生成n mol O2
的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为
2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
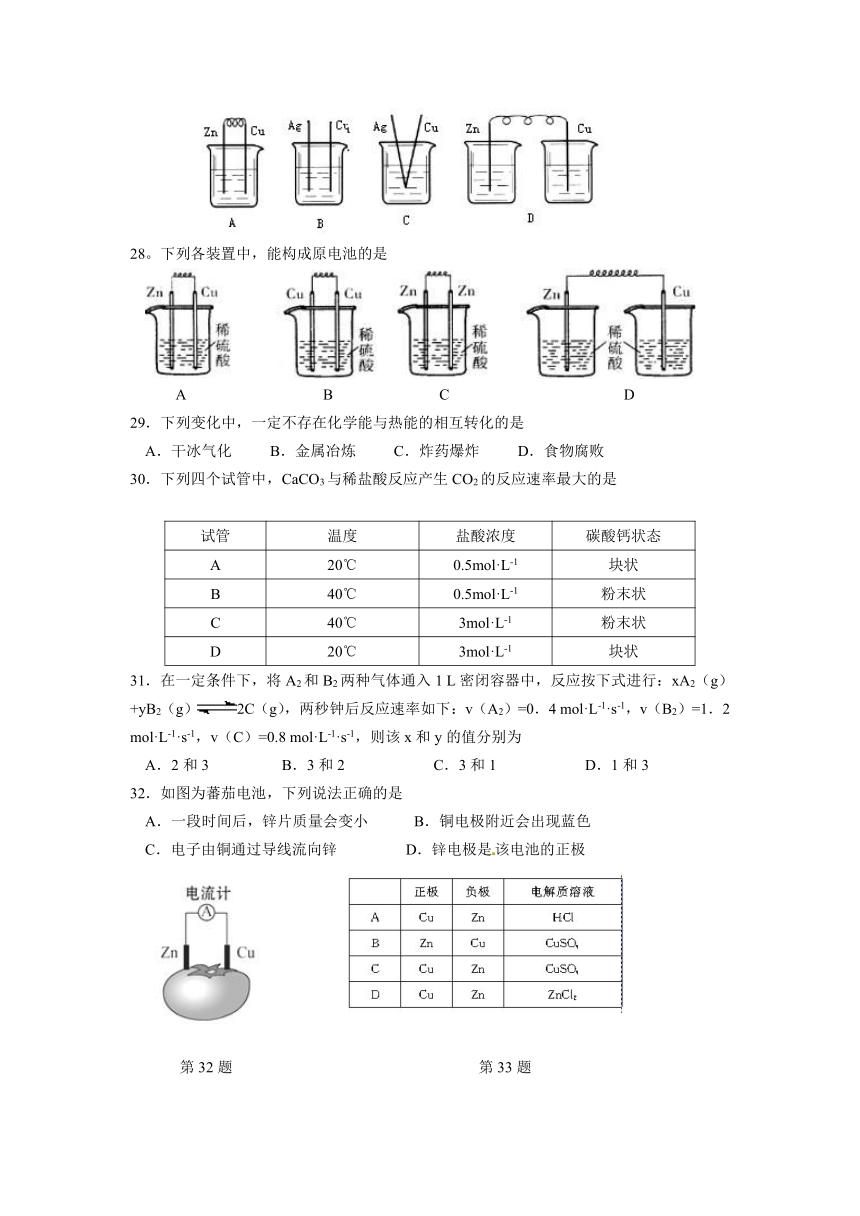
27.下列烧杯中盛放的都是稀硫酸,在铜棒上能产生气泡的是
28。下列各装置中,能构成原电池的是
A B C D 29.下列变化中,一定不存在化学能与热能的相互转化的是
A.干冰气化 B.金属冶炼 C.炸药爆炸 D.食物腐败
30.下列四个试管中,CaCO3与稀盐酸反应产生CO2的反应速率最大的是
试管
温度
盐酸浓度
碳酸钙状态
A
20℃
0.5mol·L-1
块状
B
40℃
0.5mol·L-1
粉末状
C
40℃
3mol·L-1
粉末状
D
20℃
3mol·L-1
块状
31.在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:xA2(g)+yB2(g)2C(g),两秒钟后反应速率如下:v(A2)=0.4 mol·L-1·s-1,v(B2)=1.2 mol·L-1·s-1,v(C)=0.8 mol·L-1·s-1,则该x和y的值分别为
A.2和3 B.3和2 C.3和1 D.1和3
32.如图为蕃茄电池,下列说法正确的是
A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
33.某原电池的总反应的离子方程式是:Zn+Cu2+==Zn2++Cu,此反应的原电池的组成正确的是上表中的
34.关于反应速率、反应限度的下列说法中错误的是
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
35.对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液:A.①③④⑤???? B.①②④⑤???? C.①②③④????? D.①②④
班级: 姓名: 座号:
选择题答题处:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
题号
25
26
27
28
29
30
31
32
33
34
35
3
答案
36.(1)下列五种物质中①Ne ②H2O ③NH3 ④KOH⑤ Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是 ,仅发生离子键破坏的是 ,仅发生共价键破坏的是 。(填写序号)
37.五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X
Y
Z
W
M
(1)请写出元素名称:X__________Y__________W__________
(2)元素Z位于周期表中第_________周期________族;
(3)元素Z可以形成多种单质,其中最常见两种名称分别是_________和__ ;
(4)Y的最高价氧化物的化学式为_______;M的最高价氧化物水化物名称为_______。
(5)W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为____________。
38。下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求
回答下列问题。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
④
⑥
3
①
②
③
⑤
⑦
⑧
4
⑨
⑩
(1)化学性质最不活泼的元素符号是___ __。
(2)元素①的单质在氧气中燃烧形成的氧化物的化学式是 ,该化合物呈_ 色
(3)第3周期主族元素中,原子半径最小的是 (填序号)。
(4)元素⑦的单质和石灰乳作用可制取漂白粉, 该反应的化学方程式为
。
(5)医学证明, 人体缺钙易患多种疾病, 特别是儿童和中老年人应经常补钙, 上表10种元素中 (填序号)为钙元素,在各种补钙制剂中钙元素呈___ (填“游离”或“化合”) 态。
(6)元素⑤的氧化物常用于制造 (填一种高性能的现代通讯材料的名称)。
(7)元素⑦、⑩中,化学性质较活泼的元素是__ ___, 通过比较它们
能证明你的结论。
39。下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族
周期
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
Ⅶ
0
2
④
⑦
3
①
②
③
⑤
⑥
⑧
⑨
⑩
(1)这10种元素中,形成化合物种类最多的元素是 (写元素名称)。
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是_____ ____。
写出实验室制取该物质,反应的离子方程式为:
。
(3)在检验某溶液是否含有①元素时,常用 反应。
(4)④和⑦形成化合物的化学键为: 。
(5)元素⑥、⑨最高价氧化物的化学式分别为: 、 ;
40。下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。 (1)第3周期中金属性最强的元素是??????? ????????(填元素名称); (2)S原子结构示意图为??????? ????????; (3)第3周期元素中,最高价氧化物对应水化物酸性最强的是??????? (填化学式); (4)C、N和O原子半径由小到大的顺序的是?????????????????? ; (5)第3周期中气态氢化物最稳定的是?????????????????? ; (6)Si是带来人类文明的重要元素之一,其氧化物化学式是??????????,常用于制造??????????? (填一种高性能的现代通讯材料的名称); (7)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为????????????????????????????????? (8)N元素形成的一种氢化物的化学式是?????????? ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应?????????????????????????????????
41。A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:
。
(3)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示) 。
42。A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。(填写相应的元素符号)
D元素的最高价氧化物的水化物是 。
(2)写出A、B的化合物与C的最高价氧化物对应水化物反应的化学方程式:
。
(3)A、B两元素形成化合物属 ( “离子”或“共价”)化合物。
(4)写出D元素的最高价氧化物的水化物和A反应的化学方程式:
。
参考答案:
选择题答题处:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
B
A
A
D
A
D
D
B
D
B
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
B
B
A
D
B
B
C
C
D
C
C
C
题号
25
26
27
28
29
30
31
32
33
34
35
答案
B
B
A
A
A
C
D
A
C
D
D
36.(1)②③;⑤;④;①(2)①⑤;②③;④
37.(1)氧;氮;硫 (2)三;ⅤA
(3)红磷;白磷 (4)N2O5;高氯酸(5)N4S4
38。(1)Ar (2)Na2O2;淡黄
(3)⑦ (4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(5)⑨;化合 (6)光导纤维
(7)⑦(或Cl );酸性:HClO4 >HBrO4
39。(1)碳 (2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)焰色 (4)共价键 (5)H3PO4 、HClO4
40。(1)钠 (2)略 (3)HClO4
(4)O(7)2Al+Fe2O3Al2O3+2Fe (8)NH3;3NO2+H2O=2HNO3+NO
41。(1)Na;Al;Si;P;Cl
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)HCl >PH3> SiH4
42。(1)C、O、Na;H2SO4
(2)CO2+2NaOH === Na2CO3+ H2O
(3)共价
(4)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
1。设NA代表阿伏加德罗常数,下列说法中,正确的是
A.2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol)
B.17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol)
C.2g氢气所含原子数目为NA (提示:M(H2)=2g/mol)
D.常温常压下,11.2L氮气所含的原子数目为NA
2.“低能耗、低污染、低排放”是低碳经济的重要标志,也是2010上海世博会的亮点之一。其中“低排放”主要指减少排放
A.N2 B.O2 C.CO2 D.S02
3.我国“西气东输”工程输送的化石燃料主要是
A.水煤气 B.天然气 C.焦炉气 D.石油气
4.下列物质中,属于非电解质的是
A.蔗糖 B.金属镁 C.氧气 D.氯化钠
5.工业上从海水中提取金属镁所发生的化学反应中,不涉及的物质是
A.H2SO4 B.MgCl2 C.Ca(OH)2 D.HCl
6.决定主族元素在元素周期表中所处位置的是该元素原子的
A.质量数 B.中子数 C.次外层电子数 D.电子层数和最外层电子数
7。2012年 11月有媒体报道,我国内蒙古发现了世界级铀矿,内含可用作核反应堆燃料的U.U原子核内的质子数为
A.92 B.143 C.235 D.327
8.下列各组物质中,互为同分异构体的是
A.O2与O3 B.与
C.CH2Cl2与CHCl3 D.
9。下列各组物质中,不互为同素异形体的是
A.金刚石和C60 B.红磷和P4 C.O2和O3 D.CH3CH3和CH4
10。下列物质互为同素异形体的是
A.126C和146C B.氧气和臭氧 C.甲烷和乙烷 D.正丁烷和异丁烷
11.下列物质中,属于离子化合物的是
A.NH3 B.CO2 C.HCl D.MgCl2
12.下列物质中,既有离子键,又有共价键的是
A.MgCl2 B.KOH C.NH3 D.H2O2
13。 下列物质中,既有离子键,又有共价键的是
? A.KCl?????????? B.NH4Cl?????????? C.H2O?????????? D.CH4
14.下列说法中不正确的是
A.在共价化合物中不可能含有离子键 B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物 D.含有离子键的化合物一定是离子化合物
15.下列叙述中,不正确的是
A.N、0、F三种元素的非金属性依次减弱
B.Na、Mg、Al三种元素的原子半径依次减小
C.F、Cl、Br三种原子的核外电子层数依次增多
D.P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强
16。下列各项比较中,正确的是
A. 原子半径:N<O<F B. 热稳定性:HCl<HBr<HI
C. 元素的金属性:Na<Mg<Al D. 酸性:H2SiO3<H3PO4<H2SO4
17.下列各项比较中,正确的是
A.原子核外电子数:H>O>Al B.元素非金属性:F>Cl>Br
C.热稳定性:PH3>H2S>HC1 D.碱性:LiOH>NaOH>KOH
18.下列实验操作或方法中,正确的是
19.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
20.下列关于元素周期表和元素周期律的说法不正确的是
A.第ⅦA族从氟到碘,其氢化物的稳定性逐渐减弱
B.同周期,从左到右,元素金属性逐渐减弱,非金属性逐渐增强(稀有气体元素除外)
C.因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强
D.氧与硫为同主族元素,硫比氧的原子半径大,氧比硫的非金属性强
21.短周期元素X最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X C.XH4 D.XH3
22。 日常生活中,常用到化学知识。下列说法不正确的是
A.某些铁盐溶于水生成的Fe(OH)3胶体,可除去水中的悬浮颗粒等杂质 B.维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜 C.构成人体蛋白质的20多种氨基酸都能通过人体自身合成 D.可用燃烧的方法鉴别真丝围巾和合成纤维围巾
23.下列说法正确的是
A.化学反应都是吸热反应 B.化学反应都是放热反应
C.物质发生化学反应都伴随着能量变化 D.有能量变化的物质变化都是化学变化
24.下列各反应的能量变化分别用如下形式的示意图表示,其中正确的是
25.四个体积相同的密闭容器中在一定条件下发生反应:2SO2+O22SO3。反应开始时,反应速率最大的是
容 器
温 度
SO2(mol)
O2(mol)
催化剂
A
500℃
10
5
—
B
500℃
10
5
V2O5
C
450℃
8
5
—
D
500℃
8
5
—
26。可逆反应2NO2 2NO+ O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2 n mol NO②单位时间内生成n mol O2
的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为
2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
27.下列烧杯中盛放的都是稀硫酸,在铜棒上能产生气泡的是
28。下列各装置中,能构成原电池的是
A B C D 29.下列变化中,一定不存在化学能与热能的相互转化的是
A.干冰气化 B.金属冶炼 C.炸药爆炸 D.食物腐败
30.下列四个试管中,CaCO3与稀盐酸反应产生CO2的反应速率最大的是
试管
温度
盐酸浓度
碳酸钙状态
A
20℃
0.5mol·L-1
块状
B
40℃
0.5mol·L-1
粉末状
C
40℃
3mol·L-1
粉末状
D
20℃
3mol·L-1
块状
31.在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:xA2(g)+yB2(g)2C(g),两秒钟后反应速率如下:v(A2)=0.4 mol·L-1·s-1,v(B2)=1.2 mol·L-1·s-1,v(C)=0.8 mol·L-1·s-1,则该x和y的值分别为
A.2和3 B.3和2 C.3和1 D.1和3
32.如图为蕃茄电池,下列说法正确的是
A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
33.某原电池的总反应的离子方程式是:Zn+Cu2+==Zn2++Cu,此反应的原电池的组成正确的是上表中的
34.关于反应速率、反应限度的下列说法中错误的是
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
35.对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液:A.①③④⑤???? B.①②④⑤???? C.①②③④????? D.①②④
班级: 姓名: 座号:
选择题答题处:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
题号
25
26
27
28
29
30
31
32
33
34
35
3
答案
36.(1)下列五种物质中①Ne ②H2O ③NH3 ④KOH⑤ Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是 ,仅发生离子键破坏的是 ,仅发生共价键破坏的是 。(填写序号)
37.五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X
Y
Z
W
M
(1)请写出元素名称:X__________Y__________W__________
(2)元素Z位于周期表中第_________周期________族;
(3)元素Z可以形成多种单质,其中最常见两种名称分别是_________和__ ;
(4)Y的最高价氧化物的化学式为_______;M的最高价氧化物水化物名称为_______。
(5)W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为____________。
38。下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求
回答下列问题。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
④
⑥
3
①
②
③
⑤
⑦
⑧
4
⑨
⑩
(1)化学性质最不活泼的元素符号是___ __。
(2)元素①的单质在氧气中燃烧形成的氧化物的化学式是 ,该化合物呈_ 色
(3)第3周期主族元素中,原子半径最小的是 (填序号)。
(4)元素⑦的单质和石灰乳作用可制取漂白粉, 该反应的化学方程式为
。
(5)医学证明, 人体缺钙易患多种疾病, 特别是儿童和中老年人应经常补钙, 上表10种元素中 (填序号)为钙元素,在各种补钙制剂中钙元素呈___ (填“游离”或“化合”) 态。
(6)元素⑤的氧化物常用于制造 (填一种高性能的现代通讯材料的名称)。
(7)元素⑦、⑩中,化学性质较活泼的元素是__ ___, 通过比较它们
能证明你的结论。
39。下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族
周期
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
Ⅶ
0
2
④
⑦
3
①
②
③
⑤
⑥
⑧
⑨
⑩
(1)这10种元素中,形成化合物种类最多的元素是 (写元素名称)。
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是_____ ____。
写出实验室制取该物质,反应的离子方程式为:
。
(3)在检验某溶液是否含有①元素时,常用 反应。
(4)④和⑦形成化合物的化学键为: 。
(5)元素⑥、⑨最高价氧化物的化学式分别为: 、 ;
40。下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。 (1)第3周期中金属性最强的元素是??????? ????????(填元素名称); (2)S原子结构示意图为??????? ????????; (3)第3周期元素中,最高价氧化物对应水化物酸性最强的是??????? (填化学式); (4)C、N和O原子半径由小到大的顺序的是?????????????????? ; (5)第3周期中气态氢化物最稳定的是?????????????????? ; (6)Si是带来人类文明的重要元素之一,其氧化物化学式是??????????,常用于制造??????????? (填一种高性能的现代通讯材料的名称); (7)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为????????????????????????????????? (8)N元素形成的一种氢化物的化学式是?????????? ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应?????????????????????????????????
41。A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:
。
(3)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示) 。
42。A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。(填写相应的元素符号)
D元素的最高价氧化物的水化物是 。
(2)写出A、B的化合物与C的最高价氧化物对应水化物反应的化学方程式:
。
(3)A、B两元素形成化合物属 ( “离子”或“共价”)化合物。
(4)写出D元素的最高价氧化物的水化物和A反应的化学方程式:
。
参考答案:
选择题答题处:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
B
A
A
D
A
D
D
B
D
B
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
B
B
A
D
B
B
C
C
D
C
C
C
题号
25
26
27
28
29
30
31
32
33
34
35
答案
B
B
A
A
A
C
D
A
C
D
D
36.(1)②③;⑤;④;①(2)①⑤;②③;④
37.(1)氧;氮;硫 (2)三;ⅤA
(3)红磷;白磷 (4)N2O5;高氯酸(5)N4S4
38。(1)Ar (2)Na2O2;淡黄
(3)⑦ (4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(5)⑨;化合 (6)光导纤维
(7)⑦(或Cl );酸性:HClO4 >HBrO4
39。(1)碳 (2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)焰色 (4)共价键 (5)H3PO4 、HClO4
40。(1)钠 (2)略 (3)HClO4
(4)O
41。(1)Na;Al;Si;P;Cl
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)HCl >PH3> SiH4
42。(1)C、O、Na;H2SO4
(2)CO2+2NaOH === Na2CO3+ H2O
(3)共价
(4)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
同课章节目录
