2008-2013年福建省学业基础会考化学试题分类汇编---实验探究题部分
文档属性
| 名称 | 2008-2013年福建省学业基础会考化学试题分类汇编---实验探究题部分 |  | |
| 格式 | zip | ||
| 文件大小 | 760.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-10 19:02:30 | ||
图片预览

文档简介
高中学业基础考试(化学科)分类试题
(实验题)
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
29.(2008福建会考)
实验要求
化学试剂
检验酒精中是否有水
D
验证味精是否有食盐
B
区别蔗糖和葡萄糖
A
证明地瓜粉中含有淀粉
C
供选择的化学试剂
A.新制氢氧化铜悬浊液
B.硝酸银溶液和硝酸
C.碘水
D.无水硫酸铜粉末
29.(2009福建会考)
实验要求
化学试剂
检验酒精中是否有水
D
区别CH4和C2H4两种无色气体
A
验证味精是否有食盐
B
除去Fe2O3中的Al2O3
C
供选择的化学试剂:
A.酸性高锰酸钾
B.硝酸银溶液和硝酸
C.氢氧化钠溶液
D.无水硫酸铜粉末
29. (2010-1福建会考)
实验目的
实验方法
鉴别甲烷和乙烯
C
除去NO气体中的少量NO2
A
除去FeCl2溶液中的少量FeCl3
B
鉴别Na2SO4溶液和NaCl溶液
D
供选择的实验方法:
A.通入水中,排水收集
B.加入足量铁粉,过滤
C.通入酸性KMnO4溶液中,观察现象
D.加入氯化钡溶液和盐酸,观察现象
29. (2010-6福建会考)
实验要求
试剂及方法
鉴别Na2SO4溶液和NaCl溶液
A
证明盐酸溶液呈酸性
D
鉴别真丝围巾和纯棉围巾
B
检验淘米水中是否含有淀粉
C
供选择的选项:
A.分别加入氯化钡溶液,观察现象
B.点燃,闻其气味
C.加入几滴碘水,观察现象
D.将溶液滴在pH试纸上,对照标准比色卡
29.(2011-1福建会考)
29. (2011-6福建会考)
实验目的
实验方法
除去Na2CO3固体中少量的NaHCO3
B
检验自来水中是否含有Cl-
C
证明NaOH溶液呈碱性
D
除去FeCl2溶液中少量的FeCl3
A
实验方法:
A.加入足量铁粉,过滤
B.加热
C.加入硝酸银溶液
D.滴入酚酞市试液
29.(2012-1福建会考)
实验要求
试剂及方法
鉴别CuSO4、Na2SO4两种粉末
B
检验自来水中是否含有Cl-
C
证明Na2CO3溶液具有碱性
A
除去铁粉中混有少量铝粉
D
30.(2008福建会考)下表是甲城市某日空气质量报告:
城市
污染指数
首要污染物
空气质量级别
空气质量状况
甲
55
SO2
II
良
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
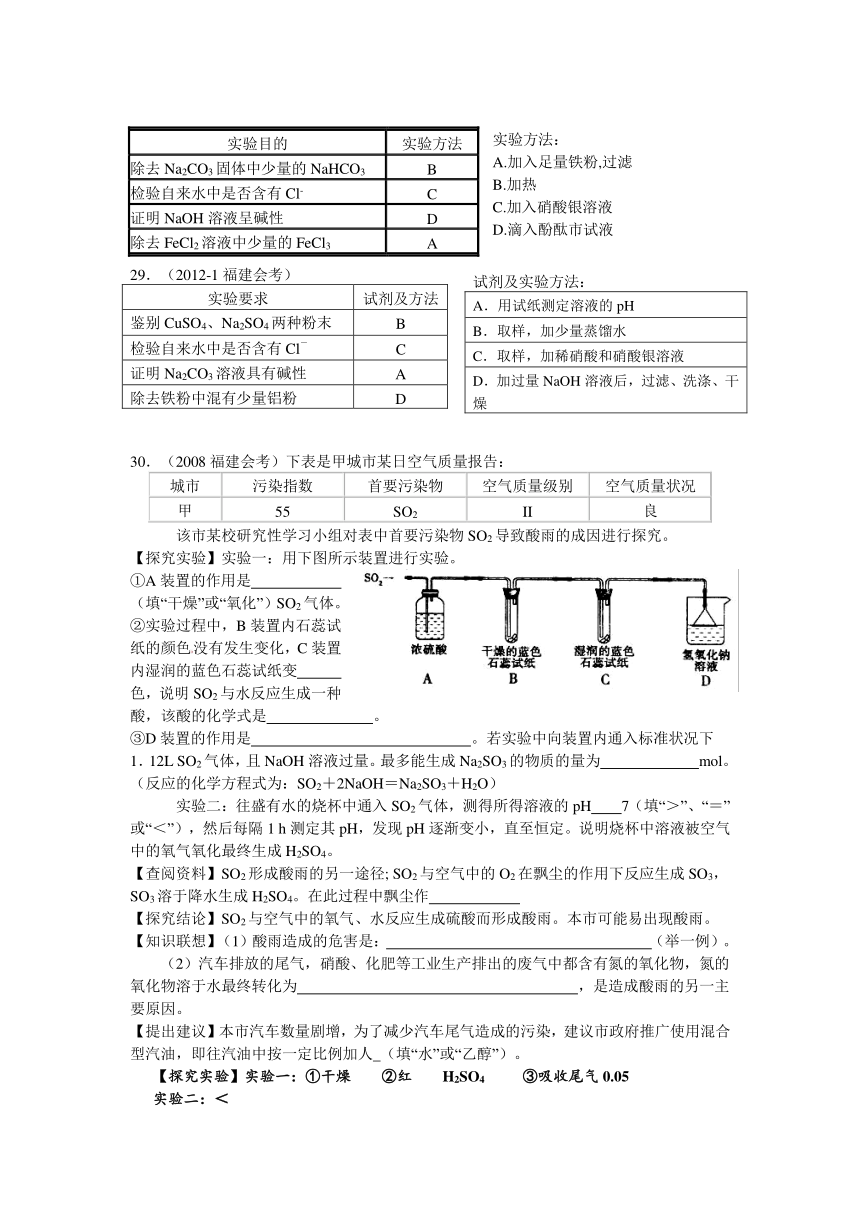
【探究实验】实验一:用下图所示装置进行实验。
①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下1.12L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”、“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人 (填“水”或“乙醇”)。
【探究实验】实验一:①干燥 ②红 H2SO4 ③吸收尾气0.05
实验二:<
【查阅资料】催化剂
【知识联想】(1)树木枯萎(或河水酸化、毁坏建筑物等合理答案)
(2)HNO3(或硝酸) 乙醇
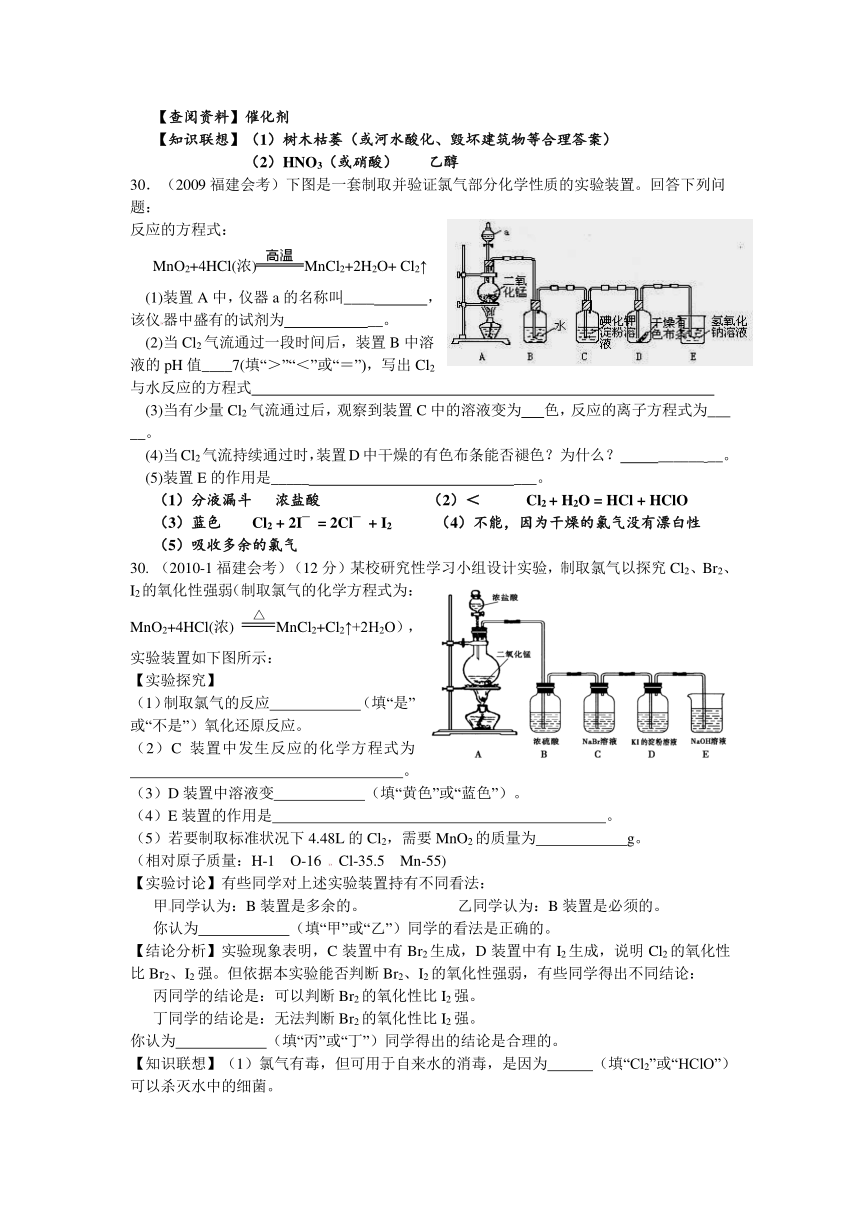
30.(2009福建会考)下图是一套制取并验证氯气部分化学性质的实验装置。回答下列问题:
反应的方程式:
MnO2+4HCl(浓)MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a的名称叫____ ,该仪器中盛有的试剂为 __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为___ __。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? ______ __。
(5)装置E的作用是_____ ___。
(1)分液漏斗? 浓盐酸 (2)<???Cl2 + H2O = HCl + HClO
(3)蓝色? Cl2 + 2I— = 2Cl— + I2 ? (4)不能,因为干燥的氯气没有漂白性
(5)吸收多余的氯气
30. (2010-1福建会考)(12分)某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O),实验装置如下图所示:
【实验探究】
(1)制取氯气的反应??????(填“是”或“不是”)氧化还原反应。
(2)C装置中发生反应的化学方程式为??????????????????。
(3)D装置中溶液变??????(填“黄色”或“蓝色”)。
(4)E装置的作用是??????????????????????。
(5)若要制取标准状况下4.48L的Cl2,需要MnO2的质量为??????g。
(相对原子质量:H-1 O-16 Cl-35.5 Mn-55)
【实验讨论】有些同学对上述实验装置持有不同看法:
甲同学认为:B装置是多余的。 乙同学认为:B装置是必须的。
你认为??????(填“甲”或“乙”)同学的看法是正确的。
【结论分析】实验现象表明,C装置中有Br2生成,D装置中有I2生成,说明Cl2的氧化性比Br2、I2强。但依据本实验能否判断Br2、I2的氧化性强弱,有些同学得出不同结论:
丙同学的结论是:可以判断Br2的氧化性比I2强。
丁同学的结论是:无法判断Br2的氧化性比I2强。
你认为??????(填“丙”或“丁”)同学得出的结论是合理的。
【知识联想】(1)氯气有毒,但可用于自来水的消毒,是因为???(填“Cl2”或“HClO”)可以杀灭水中的细菌。
(2)如果要用氯气消毒过的自来水来养金鱼,你认为应该如何对自来水进行处理:??????????????? ?????(写一种有效的处理方法)。
30.【实验探究】(1)是 (2)Cl2 + 2NaBr = 2NaCl + Br2 (3)蓝色
(4)吸收多余氯气,防止污染空气(其他合理答案均给分) (5)17.4
【实验讨论】甲 【结论分析】丁
【知识联想】(1)HClO (2)①将自来水放在阳光下暴晒; ②用强光照射自来水; ③用紫外线照射自来水(以上任选其一或其他合理答案均给分)
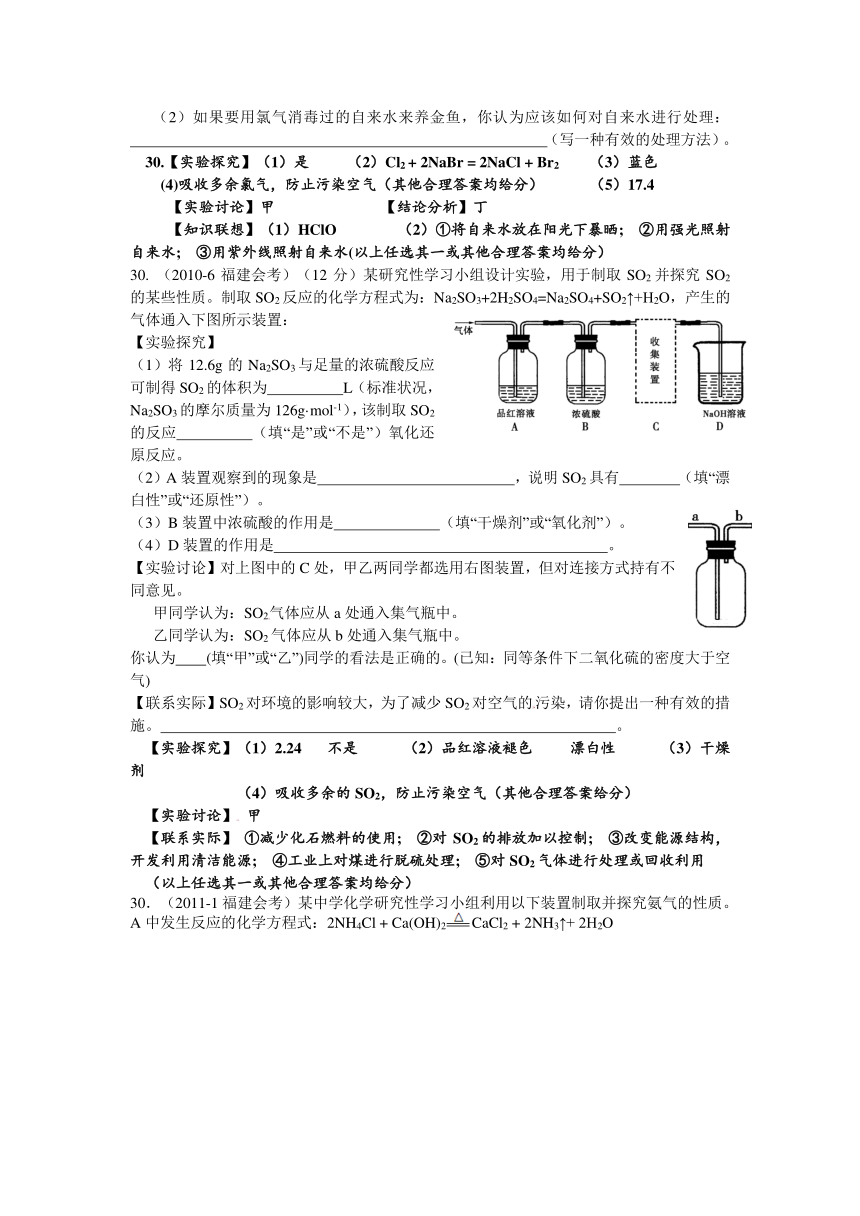
30. (2010-6福建会考)(12分)某研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入下图所示装置:
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为?????L(标准状况,Na2SO3的摩尔质量为126g·mol-1),该制取SO2的反应?????(填“是”或“不是”)氧化还原反应。
(2)A装置观察到的现象是?????????????,说明SO2具有????(填“漂白性”或“还原性”)。
(3)B装置中浓硫酸的作用是???????(填“干燥剂”或“氧化剂”)。
(4)D装置的作用是??????????????????????。
【实验讨论】对上图中的C处,甲乙两同学都选用右图装置,但对连接方式持有不同意见。
甲同学认为:SO2气体应从a处通入集气瓶中。
乙同学认为:SO2气体应从b处通入集气瓶中。
你认为??(填“甲”或“乙”)同学的看法是正确的。(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施。??????????????????????????????。
【实验探究】(1)2.24 不是 (2)品红溶液褪色 漂白性 (3)干燥剂
(4)吸收多余的SO2,防止污染空气(其他合理答案给分)
【实验讨论】 甲
【联系实际】 ①减少化石燃料的使用; ②对SO2的排放加以控制; ③改变能源结构,开发利用清洁能源; ④工业上对煤进行脱硫处理; ⑤对SO2气体进行处理或回收利用
(以上任选其一或其他合理答案均给分)
30.(2011-1福建会考)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+ 2H2O
【实验探究】
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列
物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】(9)2010 年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。
(1)不是 (2)O2(或氧气,其他合理答案也给分) (3)4.48
(4)向下排空气法 (5)D (6)有白烟生成 (7)F (8)A B
(9)①用湿毛巾捂住口鼻,并迅速撤离。②低头弯腰,往低处跑,迅速撤离。③逆风奔跑,迅速撤离。④戴上防毒面具,迅速撤离。(以上任选其一或其他合理答案也给分)
30(2011-6福建会考)某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:
C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + H2O其中浓硫酸所起的作用是? ? (填“氧化剂”或“还原剂”)。若有0.2摩尔的硫酸完全参加反应,则消耗碳的质量是?? ? ? g.(碳的摩尔质量为12 g·mol-1)
(2)A装置中品红溶液颜色?? ? ?(填“褪色”或“不褪色”),证明含有?? ? ? 气体。
(3)B装置的作用是利用足量的酸性高锰酸钾溶液除尽SO2气体。
(4)C装置中的澄清石灰水是用来检验CO2气体,现象是产生?? ? ?沉淀(填“白色”或“黄色”)
【实验讨论】(5)有同学对B装置能否除尽SO2气体有疑义,你认为应该在B、C装置之间连接右图中????? 装置,以确定SO2是否除尽。
【联系实际】(6)煤和石油的燃烧过程中,都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是?? ,二氧化碳造成的环境影响主要是?? 。(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应
(7)目前,发展低碳经济、倡导低碳生活成为国民的共识。请你举出一个体现低碳理念的事例 。
【实验探究】(1)氧化剂 1.2 (2)褪色 SO2(或二氧化硫) (4) 白色
【实验讨论】(5)a 【联系实际】(6)A C
(7)①使用公共交通工具、骑自行车或步行方式出行,少用私家车; ②节约用水用电; ③改变能源结构,开发利用清洁能源;(开发无污染的太阳能、风能、地热能等)(以上任选其一或其他符合低碳节能环保理念的合理答案均给分)
30.(2012-1福建会考)某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,
充分反应后,烧瓶中残留的固体是????????。
(2)收集氯气应将图1导管的a接口与图2的导管的????接口连接(填“b”或“c”)
(3)若生成标准状况下11.2LCl2,则参加反应的MnO2的物质的量为????mol。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是? ??。
(5)按图3进行实验,观察到B中的有色布条不退色,C中的有色布条退色。由此得出的结论是: ?。 图3
(6)写出C中反应的化学方程式:?? ??。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号)。
A.将人群向高处疏散 B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
【制取气体】(1)SiO2或二氧化硅 (2)b (3)0.5
【实验探究】(4)2Fe + 3Cl2 ===2FeCl3 (5)干燥的氯气没有漂白作用
(6)Cl2 + H2O = HCl + HClO 【联系实际】(7)A C
30(2012-6福建会考)
(1)碱石灰 B (2)O2(或氧气) (3)5.35 (4)不能
(5)③ (6)瓶内产生白烟 (7)保存在阴暗处
(2013-6福建会考)为达到下表中的实验目的,请选择合适的试剂用实验方法,将其标号填入对应的空格。
(2013-6福建会考)某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑ + 2H2O)
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是
。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 溶液(填“NaOH”或“H2SO4”)
(5)用8.7gMnO2与足量浓盐酸反应,理论上可以生成标准状况下的Cl2 L。
【知识拓展】
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4 + 16HCl(浓) ==== 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O),该反应的氧化剂是 (填“KMnO4”或“HCl”)
【知识应用】
(7)洪灾过后,饮用水的消毒杀菌是抑制大规模传染疾病爆发的重要措施之一。请你列举一例对饮用水进行消毒杀菌的合理方法:
(实验题)
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
29.(2008福建会考)
实验要求
化学试剂
检验酒精中是否有水
D
验证味精是否有食盐
B
区别蔗糖和葡萄糖
A
证明地瓜粉中含有淀粉
C
供选择的化学试剂
A.新制氢氧化铜悬浊液
B.硝酸银溶液和硝酸
C.碘水
D.无水硫酸铜粉末
29.(2009福建会考)
实验要求
化学试剂
检验酒精中是否有水
D
区别CH4和C2H4两种无色气体
A
验证味精是否有食盐
B
除去Fe2O3中的Al2O3
C
供选择的化学试剂:
A.酸性高锰酸钾
B.硝酸银溶液和硝酸
C.氢氧化钠溶液
D.无水硫酸铜粉末
29. (2010-1福建会考)
实验目的
实验方法
鉴别甲烷和乙烯
C
除去NO气体中的少量NO2
A
除去FeCl2溶液中的少量FeCl3
B
鉴别Na2SO4溶液和NaCl溶液
D
供选择的实验方法:
A.通入水中,排水收集
B.加入足量铁粉,过滤
C.通入酸性KMnO4溶液中,观察现象
D.加入氯化钡溶液和盐酸,观察现象
29. (2010-6福建会考)
实验要求
试剂及方法
鉴别Na2SO4溶液和NaCl溶液
A
证明盐酸溶液呈酸性
D
鉴别真丝围巾和纯棉围巾
B
检验淘米水中是否含有淀粉
C
供选择的选项:
A.分别加入氯化钡溶液,观察现象
B.点燃,闻其气味
C.加入几滴碘水,观察现象
D.将溶液滴在pH试纸上,对照标准比色卡
29.(2011-1福建会考)
29. (2011-6福建会考)
实验目的
实验方法
除去Na2CO3固体中少量的NaHCO3
B
检验自来水中是否含有Cl-
C
证明NaOH溶液呈碱性
D
除去FeCl2溶液中少量的FeCl3
A
实验方法:
A.加入足量铁粉,过滤
B.加热
C.加入硝酸银溶液
D.滴入酚酞市试液
29.(2012-1福建会考)
实验要求
试剂及方法
鉴别CuSO4、Na2SO4两种粉末
B
检验自来水中是否含有Cl-
C
证明Na2CO3溶液具有碱性
A
除去铁粉中混有少量铝粉
D
30.(2008福建会考)下表是甲城市某日空气质量报告:
城市
污染指数
首要污染物
空气质量级别
空气质量状况
甲
55
SO2
II
良
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】实验一:用下图所示装置进行实验。
①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下1.12L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”、“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人 (填“水”或“乙醇”)。
【探究实验】实验一:①干燥 ②红 H2SO4 ③吸收尾气0.05
实验二:<
【查阅资料】催化剂
【知识联想】(1)树木枯萎(或河水酸化、毁坏建筑物等合理答案)
(2)HNO3(或硝酸) 乙醇
30.(2009福建会考)下图是一套制取并验证氯气部分化学性质的实验装置。回答下列问题:
反应的方程式:
MnO2+4HCl(浓)MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a的名称叫____ ,该仪器中盛有的试剂为 __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为___ __。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? ______ __。
(5)装置E的作用是_____ ___。
(1)分液漏斗? 浓盐酸 (2)<???Cl2 + H2O = HCl + HClO
(3)蓝色? Cl2 + 2I— = 2Cl— + I2 ? (4)不能,因为干燥的氯气没有漂白性
(5)吸收多余的氯气
30. (2010-1福建会考)(12分)某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O),实验装置如下图所示:
【实验探究】
(1)制取氯气的反应??????(填“是”或“不是”)氧化还原反应。
(2)C装置中发生反应的化学方程式为??????????????????。
(3)D装置中溶液变??????(填“黄色”或“蓝色”)。
(4)E装置的作用是??????????????????????。
(5)若要制取标准状况下4.48L的Cl2,需要MnO2的质量为??????g。
(相对原子质量:H-1 O-16 Cl-35.5 Mn-55)
【实验讨论】有些同学对上述实验装置持有不同看法:
甲同学认为:B装置是多余的。 乙同学认为:B装置是必须的。
你认为??????(填“甲”或“乙”)同学的看法是正确的。
【结论分析】实验现象表明,C装置中有Br2生成,D装置中有I2生成,说明Cl2的氧化性比Br2、I2强。但依据本实验能否判断Br2、I2的氧化性强弱,有些同学得出不同结论:
丙同学的结论是:可以判断Br2的氧化性比I2强。
丁同学的结论是:无法判断Br2的氧化性比I2强。
你认为??????(填“丙”或“丁”)同学得出的结论是合理的。
【知识联想】(1)氯气有毒,但可用于自来水的消毒,是因为???(填“Cl2”或“HClO”)可以杀灭水中的细菌。
(2)如果要用氯气消毒过的自来水来养金鱼,你认为应该如何对自来水进行处理:??????????????? ?????(写一种有效的处理方法)。
30.【实验探究】(1)是 (2)Cl2 + 2NaBr = 2NaCl + Br2 (3)蓝色
(4)吸收多余氯气,防止污染空气(其他合理答案均给分) (5)17.4
【实验讨论】甲 【结论分析】丁
【知识联想】(1)HClO (2)①将自来水放在阳光下暴晒; ②用强光照射自来水; ③用紫外线照射自来水(以上任选其一或其他合理答案均给分)
30. (2010-6福建会考)(12分)某研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入下图所示装置:
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为?????L(标准状况,Na2SO3的摩尔质量为126g·mol-1),该制取SO2的反应?????(填“是”或“不是”)氧化还原反应。
(2)A装置观察到的现象是?????????????,说明SO2具有????(填“漂白性”或“还原性”)。
(3)B装置中浓硫酸的作用是???????(填“干燥剂”或“氧化剂”)。
(4)D装置的作用是??????????????????????。
【实验讨论】对上图中的C处,甲乙两同学都选用右图装置,但对连接方式持有不同意见。
甲同学认为:SO2气体应从a处通入集气瓶中。
乙同学认为:SO2气体应从b处通入集气瓶中。
你认为??(填“甲”或“乙”)同学的看法是正确的。(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施。??????????????????????????????。
【实验探究】(1)2.24 不是 (2)品红溶液褪色 漂白性 (3)干燥剂
(4)吸收多余的SO2,防止污染空气(其他合理答案给分)
【实验讨论】 甲
【联系实际】 ①减少化石燃料的使用; ②对SO2的排放加以控制; ③改变能源结构,开发利用清洁能源; ④工业上对煤进行脱硫处理; ⑤对SO2气体进行处理或回收利用
(以上任选其一或其他合理答案均给分)
30.(2011-1福建会考)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+ 2H2O
【实验探究】
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列
物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】(9)2010 年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。
(1)不是 (2)O2(或氧气,其他合理答案也给分) (3)4.48
(4)向下排空气法 (5)D (6)有白烟生成 (7)F (8)A B
(9)①用湿毛巾捂住口鼻,并迅速撤离。②低头弯腰,往低处跑,迅速撤离。③逆风奔跑,迅速撤离。④戴上防毒面具,迅速撤离。(以上任选其一或其他合理答案也给分)
30(2011-6福建会考)某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:
C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + H2O其中浓硫酸所起的作用是? ? (填“氧化剂”或“还原剂”)。若有0.2摩尔的硫酸完全参加反应,则消耗碳的质量是?? ? ? g.(碳的摩尔质量为12 g·mol-1)
(2)A装置中品红溶液颜色?? ? ?(填“褪色”或“不褪色”),证明含有?? ? ? 气体。
(3)B装置的作用是利用足量的酸性高锰酸钾溶液除尽SO2气体。
(4)C装置中的澄清石灰水是用来检验CO2气体,现象是产生?? ? ?沉淀(填“白色”或“黄色”)
【实验讨论】(5)有同学对B装置能否除尽SO2气体有疑义,你认为应该在B、C装置之间连接右图中????? 装置,以确定SO2是否除尽。
【联系实际】(6)煤和石油的燃烧过程中,都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是?? ,二氧化碳造成的环境影响主要是?? 。(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应
(7)目前,发展低碳经济、倡导低碳生活成为国民的共识。请你举出一个体现低碳理念的事例 。
【实验探究】(1)氧化剂 1.2 (2)褪色 SO2(或二氧化硫) (4) 白色
【实验讨论】(5)a 【联系实际】(6)A C
(7)①使用公共交通工具、骑自行车或步行方式出行,少用私家车; ②节约用水用电; ③改变能源结构,开发利用清洁能源;(开发无污染的太阳能、风能、地热能等)(以上任选其一或其他符合低碳节能环保理念的合理答案均给分)
30.(2012-1福建会考)某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,
充分反应后,烧瓶中残留的固体是????????。
(2)收集氯气应将图1导管的a接口与图2的导管的????接口连接(填“b”或“c”)
(3)若生成标准状况下11.2LCl2,则参加反应的MnO2的物质的量为????mol。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是? ??。
(5)按图3进行实验,观察到B中的有色布条不退色,C中的有色布条退色。由此得出的结论是: ?。 图3
(6)写出C中反应的化学方程式:?? ??。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号)。
A.将人群向高处疏散 B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
【制取气体】(1)SiO2或二氧化硅 (2)b (3)0.5
【实验探究】(4)2Fe + 3Cl2 ===2FeCl3 (5)干燥的氯气没有漂白作用
(6)Cl2 + H2O = HCl + HClO 【联系实际】(7)A C
30(2012-6福建会考)
(1)碱石灰 B (2)O2(或氧气) (3)5.35 (4)不能
(5)③ (6)瓶内产生白烟 (7)保存在阴暗处
(2013-6福建会考)为达到下表中的实验目的,请选择合适的试剂用实验方法,将其标号填入对应的空格。
(2013-6福建会考)某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑ + 2H2O)
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是
。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 溶液(填“NaOH”或“H2SO4”)
(5)用8.7gMnO2与足量浓盐酸反应,理论上可以生成标准状况下的Cl2 L。
【知识拓展】
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4 + 16HCl(浓) ==== 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O),该反应的氧化剂是 (填“KMnO4”或“HCl”)
【知识应用】
(7)洪灾过后,饮用水的消毒杀菌是抑制大规模传染疾病爆发的重要措施之一。请你列举一例对饮用水进行消毒杀菌的合理方法:
同课章节目录
