2023年江苏合格考考点各个击破 课时16 化学综合实验(含答案)
文档属性
| 名称 | 2023年江苏合格考考点各个击破 课时16 化学综合实验(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 428.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-26 21:30:49 | ||
图片预览


文档简介
课时16 化学综合实验
考点各个击破
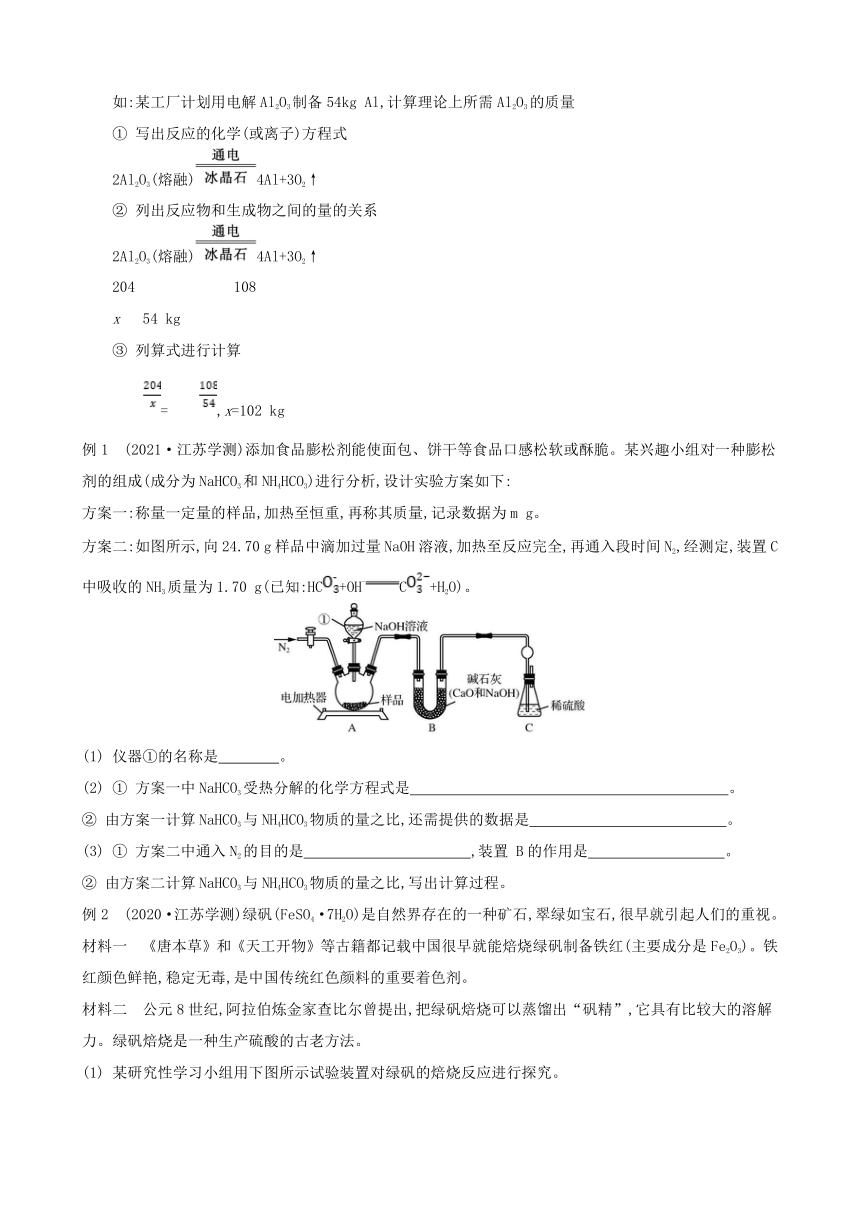
装置气密性的检查
装置图或操作方法
分段法检验装置的气密性
A 关闭K1、K2,打开分液漏斗的活塞向三颈烧瓶中加水,若分液漏斗颈出现一段稳定的水柱,证明A装置不漏气
A和B 按装置图组装好A、B装置,将导气管末端插入水中,用酒精灯(或用手、热毛巾捂)微热,导管末端有气泡产生,撤离酒精灯(或松开手)后,导管末端又有一段水柱形成,证明装置不漏气(A、B、C、D气密性检查类似)
常见装置的作用
装置图
作用 增大气体与液体的接触面积,使吸收更充分 防倒吸 氯气的尾气处理 ① 干燥气体② 除杂③ 防止空气中的水蒸气或CO2进入装置中 处理可燃性的尾气,如H2、CO、CH4
实验现象——物质颜色的变化
常见有颜色物质的转变 现象
FeSO4·7H2OFe2O3 绿色晶体变红棕色粉末
NaNa2O2 银白色变为淡黄色
Fe3++KSCNFe(SCN)3 溶液由黄色变为红色
CuOCu 黑色固体变为红色
Fe(OH)2Fe(OH)3 白色变为灰绿色最终变为红褐色
淀粉溶液加入碘水 溶液由无色变为蓝色
酸性高锰酸钾溶液滴定亚铁离子 溶液由浅绿色变为浅红色
淀粉作指示剂用Na2S2O3溶液滴定碘水 溶液由蓝色变为无色
常考离子的检验
S:先加入 ,无现象,再加入氯化钡溶液生成白色沉淀,证明溶液中含有硫酸根离子。
Fe3+:往溶液中滴入 溶液,若溶液变红色,则说明溶液中含有Fe3+。
Cl-:往溶液中滴入硝酸酸化的硝酸银,有白色沉淀生成,说明含有Cl-。
N:加入NaOH溶液并加热,若产生能使 的气体,则说明原溶液中含有N。
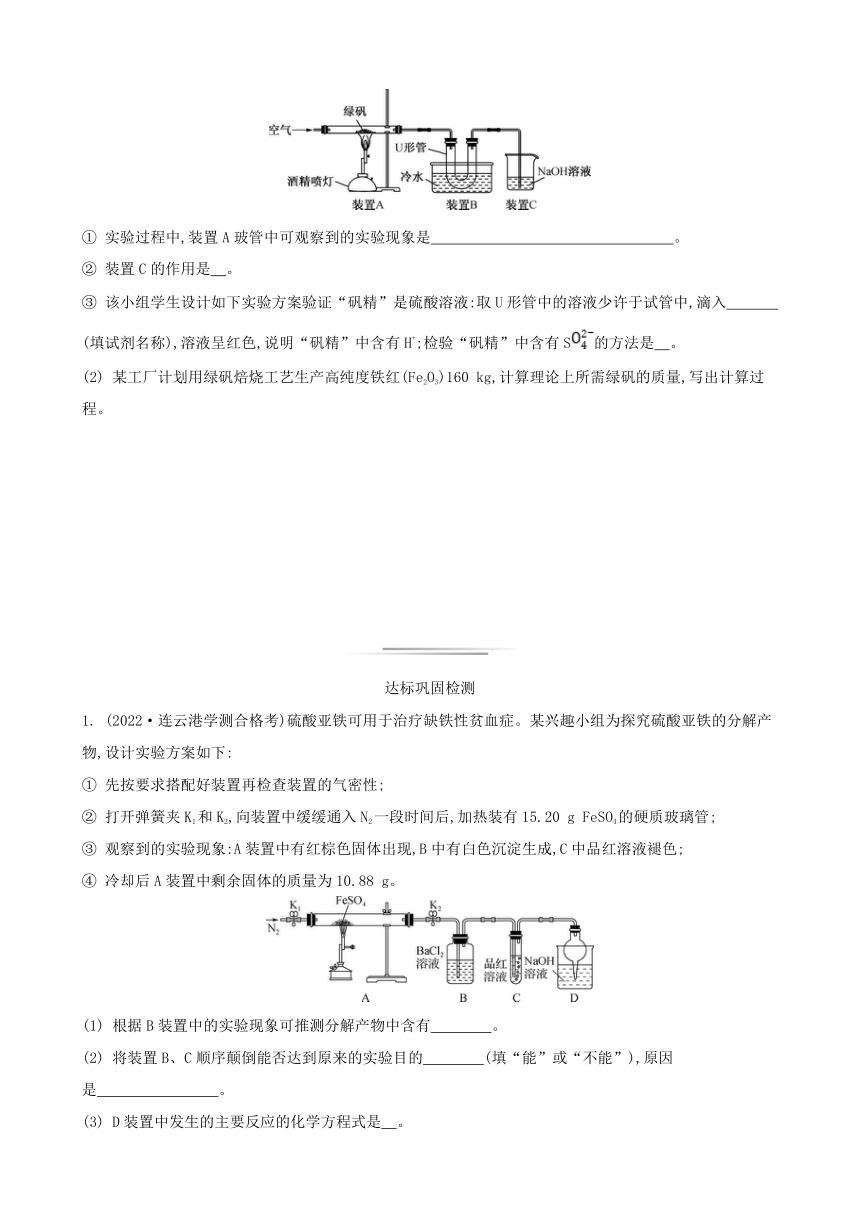
化学综合计算题的分类
类型 解题方法
物质含量计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ① 根据题给信息,计算出有关物质的物质的量;② 根据电荷守恒,确定出未知离子的物质的量;③ 根据质量守恒,确定出结晶水的物质的量;④ 各粒子的物质的量之比即为物质化学式的下标比
热重曲线计算 ① 设晶体为1 mol;② 失重一般是先失水、再失气态非金属氧化物;③ 计算每步的m余,=固体残留率;④ 晶体中金属质量不减少,仍在m余中;⑤ 失重最后一般为金属氧化物,由质量守恒得mO,由n金属:nO即可求出失重后物质的化学式
多步滴定计算 复杂的滴定可分为两类:(1) 连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量(2) 返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
常见的计算方法
1. 关系式法
其本质是根据反应的化学方程式进行定量关系计算,这是计算的通法。主要有:
(1) 从滴定类型来分类:中和滴定、沉淀滴定、氧化还原滴定、配位滴定等。
(2) 从反应过程来分类:多步计算、返滴定计算、连续滴定计算等。
滴定计算中要注意结合守恒法:元素守恒、电荷守恒、得失电子守恒。
2. 守恒法
(1) 质量守恒法:本质是化学方程式的计算。
(2) 得失电子守恒法:本质是氧化还原反应方程式的计算。
(3) 溶液中离子电荷守恒法:溶液中阴、阳离子的物质的量的定量关系计算。
3. 方程组法
如:某工厂计划用电解Al2O3制备54kg Al,计算理论上所需Al2O3的质量
① 写出反应的化学(或离子)方程式
2Al2O3(熔融)4Al+3O2↑
② 列出反应物和生成物之间的量的关系
2Al2O3(熔融)4Al+3O2↑
204 108
x 54 kg
③ 列算式进行计算
=,x=102 kg
例1 (2021·江苏学测)添加食品膨松剂能使面包、饼干等食品口感松软或酥脆。某兴趣小组对一种膨松剂的组成(成分为NaHCO3和NH4HCO3)进行分析,设计实验方案如下:
方案一:称量一定量的样品,加热至恒重,再称其质量,记录数据为m g。
方案二:如图所示,向24.70 g样品中滴加过量NaOH溶液,加热至反应完全,再通入段时间N2,经测定,装置C中吸收的NH3质量为1.70 g(已知:HC+OH-C+H2O)。
(1) 仪器①的名称是 。
(2) ① 方案一中NaHCO3受热分解的化学方程式是 。
② 由方案一计算NaHCO3与NH4HCO3物质的量之比,还需提供的数据是 。
(3) ① 方案二中通入N2的目的是 ,装置 B的作用是 。
② 由方案二计算NaHCO3与NH4HCO3物质的量之比,写出计算过程。
例2 (2020·江苏学测)绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1) 某研究性学习小组用下图所示试验装置对绿矾的焙烧反应进行探究。
① 实验过程中,装置A玻管中可观察到的实验现象是 。
② 装置C的作用是 。
③ 该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入 (填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有S的方法是 。
(2) 某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160 kg,计算理论上所需绿矾的质量,写出计算过程。
达标巩固检测
1. (2022·连云港学测合格考)硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
① 先按要求搭配好装置再检查装置的气密性;
② 打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有15.20 g FeSO4的硬质玻璃管;
③ 观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④ 冷却后A装置中剩余固体的质量为10.88 g。
(1) 根据B装置中的实验现象可推测分解产物中含有 。
(2) 将装置B、C顺序颠倒能否达到原来的实验目的 (填“能”或“不能”),原因是 。
(3) D装置中发生的主要反应的化学方程式是 。
(4) 通过计算确定已分解的FeSO4物质的量,写出计算过程。
2. (2022·盐城学测合格考)侯氏制碱法的主要产品是Na2CO3(可能含有碳酸氢钠杂质)。某兴趣小组为测定制得纯碱样品中碳酸钠的质量分数,设计了如下所示的实验方案:
方案一:采用如图所示实验装置,加热m g样品至恒重,测定相关数据。
方案二:称量3.600 g样品,配制成100 mL溶液;取其中20.00 mL 溶液置于锥形瓶中,滴加甲基橙做指示剂;用 1 moL/L 的盐酸标准溶液滴定,达滴定终点时消耗盐酸体积为13.00 mL。回答下列问题:
(1) 方案一中:① X气体选择N2、不选空气的原因是 。
② 仪器a的名称是 。
③ 实验需先通一段时间X气体,再加热样品。若要准确计算样品中碳酸钠的质量分数,还需要提供一个数据,它可以是 (填标号)。
A. 加热前后,甲装置的质量变化
B. 加热前后,乙、丙装置的质量变化总和
C. 加热前后,a处的质量变化
(2) 方案二中:① 发生反应的化学程式是
(写出一种即可)。
② 根据该实验方案计算样品中碳酸钠的质量分数,写出计算过程(结果保留一位小数)。
3. (2022·扬州学测合格考)以FeSO4为原料制备柠檬酸亚铁(FeC6H6O7)的反应有FeSO4+ Na2CO3Na2SO4+ FeCO3↓、FeCO3+ C6H8O7 FeC6H6O7+ CO2↑+ H2O。实验步骤如下:
(1) 边搅拌边将Na2CO3溶液缓慢加入盛有FeSO4溶液的反应容器中。
(2) 充分反应后,过滤,并洗涤生成的FeCO3沉淀。检验洗涤是否完全的方法是 。
(3) 将洗净后的FeCO3加入足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。① 铁粉的作用是 。
② 反应结束后,为提高柠檬酸亚铁的产率,不采取过滤的方法,处理过量铁粉的方案是 。
(4) 溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。加入无水乙醇的目的是 。
(5)为测定步骤(1)所用FeSO4溶液中FeSO4的浓度进行如下实验:取20 mL上述FeSO4溶液,向其中滴加0.02 mol/L KMnO4酸性溶液,当消耗KMnO4酸性溶液20 mL时,两者恰好完全反应(反应过程中Mn被还原为Mn2+)。计算上述FeSO4溶液中FeSO4的物质的量浓度(写出计算过程)。
4. (2021·徐州合格考一模)氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
已知:① SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。
② 三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2CuCl2+2SO2↑+4HCl↑
(1) 仪器a的名称是 ,锥形瓶中得到的物质X的化学式为 。
(2) 碱石灰中含有CaO和NaOH,碱石灰的作用是 。
(3) 某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.280 0 g 试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.100 0 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2S4+2I-)。
① 滴定到终点时的现象是 。
② 计算该试样中铜元素的百分含量(写出计算过程)。
5. (2021·盐城合格考模拟)蒸馏碘滴定法可测量中药材中SO2是否超标(亚硫酸盐折算成SO2)。原理是利用如图所示的装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液(发生反应:SO2+I2+2H2OH2SO4+2HI)。
实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加入某待测中药材粉末10 g、蒸馏水300 mL;仪器C中加入蒸馏水25 mL和淀粉试液1 mL作为吸收液;打开冷凝水,通入N2,一段时间后,滴入6 mol/L盐酸10 mL;加热烧瓶A并保持微沸约3 min后,用0.010 00 mol/L碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1 mL。
Ⅱ. 空白实验
烧瓶A中只加入300 mL蒸馏水,重复上述操作,消耗碘标准溶液的体积为V0 mL。
(1) 仪器C的名称是 。
(2) 滴入盐酸前先通入一段时间N2,其目的是 。
(3) 配制0.010 00 mol/L碘标准溶液,需要用到的玻璃仪器有 (填序号)。
A. 天平 B. 烧杯 C. 玻璃棒 D. 一定规格的容量瓶
(4) 设计空白实验的目的是 。
(5) 求该中药材中SO2含量为多少mg/kg(写出计算过程)
课时16 化学综合实验
【考点各个击破】
考点4 盐酸 KSCN 湿润红色石蕊试纸变蓝
例1 (1) 分液漏斗 (2) ① 2NaHCO3Na2CO3+H2O+CO2↑ ② 所称样品的质量 (3) ① 将生成的氨气全部赶出被稀硫酸吸收 干燥氨气 ② 2∶1
n(NH4HCO3)= n(NH3)==0.1 mol,
m(NH4HCO3)=0.1 mol×79 g/mol=7.9 g
m(NaHCO3)=24.7 g-7.9 g=16.8 g,
n(NaHCO3)=0.2 mol,
则n(NaHCO3)∶n(NH4HCO3)=
0.2 mol∶0.1 mol=2∶1
解析:(2) ② 方案二称量一定量样品,加热至恒重,再称其质量,可知剩余物为Na2CO3,根据2NaHCO3Na2CO3+H2O+CO2↑,可计算出m(NaHCO3),要知道样品的总质量才能求出m(NH4HCO3)。
例2 (1) ① 绿色晶体变红棕色粉末 ② 吸收尾气SO2,防止污染环境 ③ 紫色石蕊试液 先加入盐酸,无现象,再加入氯化钡溶液生成白色沉淀,证明“矾精”中存在硫酸根离子
(2) 2FeSO4·7H2O ~ Fe2O3
2×278 160
m(FeSO4·7H2O) 160 kg
m(FeSO4·7H2O)=556 kg
解析:(1) ① 绿矾(FeSO4·7H2O)为绿色,反应生成铁红(主要成分是Fe2O3),反应的现象是绿色晶体变红棕色粉末; ② 根据质量守恒可知还有SO2生成,则要用NaOH吸收尾气中的SO2,防止污染环境;③ 酸能使紫色石蕊试液变红,可用紫色的石蕊试液检验H+;检验S可用氯化钡溶液。
【达标巩固检测】
1. (1) SO3 (2) 不能 SO3可溶于品红溶液中 (3) SO2+2NaOHNa2SO3+H2O
(4) 2FeSO4Fe2O3+SO2↑+SO3↑ 固体减少量
2×152 144
m(FeSO4) 15.20 g-10.88 g
m(FeSO4)=9.12 g
n(FeSO4)=0.06 mol
解析:A装置中有红棕色固体出现,说明有Fe2O3生成,B中有白色沉淀生成,说明生成物中含有SO3,C中品红溶液褪色,说明生成物中含有SO2; 装置B、C顺序颠倒不能达到原来的实验目的,因为SO3可溶于品红溶液中,根据实验现象可知FeSO4分解生成Fe2O3、SO2、SO3,则反应的化学方程式为FeSO4Fe2O3+SO2↑+SO3↑。
2. (1) ① 空气中含有的CO2、H2O等会影响实验数据测定结果准确性 ② 球形干燥管 ③ A或B
(2) ① Na2CO3+2HCl2NaCl+H2O+CO2↑或NaHCO3+HClNaCl+H2O+CO2↑
② 设3.600 g样品中含有Na2CO3 x mol;NaHCO3 y mol
列方程组:
解方程组: x=0.03 mol y=0.005 mol
样品中Na2CO3的质量分数为×100%≈88.3%
3. (2) 取最后一次的洗涤滤液12 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 (3) ① 防止+2价的铁元素被氧化 ② 加入适量柠檬酸让铁粉反应完全 (4) 降低柠檬酸亚铁在水中的溶解量,有利于晶体析出 (5)0.1 mol/L
解析:(2) 沉淀中含有硫酸根离子,检验滤液中是否存在硫酸根离子即可。(3) ① FeC6H6O7易被氧化加入铁粉,防止+2价的铁元素被氧化;② 加入适量柠檬酸让铁粉反应完全,可除去铁粉。(4) 加入适量无水乙醇、静置、过滤,获得柠檬酸亚铁晶体。加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出。
(5) 根据离子方程式Mn+5Fe2++8H+Mn2++5Fe3++4H2O,
得关系式:Mn 5Fe2+
1 5
0.0200 L×0.02 mol/L 0.020 0 L×c(Fe2+)
解得:c(Fe2+)=0.1 mol/L
4. (1) 冷凝管 SOCl2 (2) 防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体 (3) ① 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色 ② 45.71%
解析:(3) ② 根据方程式:2CuCl2+4KI2CuI↓+I2+4KCl,I2+2Na2S2O3Na2S4O6+2NaI,得关系式:CuCl2Na2S2O3,n(Cu)=n(CuCl2)=n(Na2S2O3)=0.100 0 mol/L×20.00 mL×10-3 L/mL=2.0×10-3 mol w(Cu)=×100%≈45.71%
5. (1) 锥形瓶 (2) 排尽装置内空气,避免空气中的O2对SO2含量测定的干扰 (3) BCD (4) 消除其他试剂、实验操作等因素引起的误差 (5)64(V1-V0) 解析:(5) 滴定过程中发生反应:
SO2+I2+2H2OH2SO4+2HI
根据I2~SO2关系,n(SO2)=n(I2)
用于氧化SO2的碘标准液体积为(V1-V0) mL,
n(I2)=(V1-V0)×10-5 mol
所以10 g中药材粉末中n(SO2)=(V1-V0)×10-5 mol
m(SO2)=64(V1-V0)×10-5g
所以1 kg中药材中m(SO2)=64(V1-V0)mg
。
考点各个击破
装置气密性的检查
装置图或操作方法
分段法检验装置的气密性
A 关闭K1、K2,打开分液漏斗的活塞向三颈烧瓶中加水,若分液漏斗颈出现一段稳定的水柱,证明A装置不漏气
A和B 按装置图组装好A、B装置,将导气管末端插入水中,用酒精灯(或用手、热毛巾捂)微热,导管末端有气泡产生,撤离酒精灯(或松开手)后,导管末端又有一段水柱形成,证明装置不漏气(A、B、C、D气密性检查类似)
常见装置的作用
装置图
作用 增大气体与液体的接触面积,使吸收更充分 防倒吸 氯气的尾气处理 ① 干燥气体② 除杂③ 防止空气中的水蒸气或CO2进入装置中 处理可燃性的尾气,如H2、CO、CH4
实验现象——物质颜色的变化
常见有颜色物质的转变 现象
FeSO4·7H2OFe2O3 绿色晶体变红棕色粉末
NaNa2O2 银白色变为淡黄色
Fe3++KSCNFe(SCN)3 溶液由黄色变为红色
CuOCu 黑色固体变为红色
Fe(OH)2Fe(OH)3 白色变为灰绿色最终变为红褐色
淀粉溶液加入碘水 溶液由无色变为蓝色
酸性高锰酸钾溶液滴定亚铁离子 溶液由浅绿色变为浅红色
淀粉作指示剂用Na2S2O3溶液滴定碘水 溶液由蓝色变为无色
常考离子的检验
S:先加入 ,无现象,再加入氯化钡溶液生成白色沉淀,证明溶液中含有硫酸根离子。
Fe3+:往溶液中滴入 溶液,若溶液变红色,则说明溶液中含有Fe3+。
Cl-:往溶液中滴入硝酸酸化的硝酸银,有白色沉淀生成,说明含有Cl-。
N:加入NaOH溶液并加热,若产生能使 的气体,则说明原溶液中含有N。
化学综合计算题的分类
类型 解题方法
物质含量计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ① 根据题给信息,计算出有关物质的物质的量;② 根据电荷守恒,确定出未知离子的物质的量;③ 根据质量守恒,确定出结晶水的物质的量;④ 各粒子的物质的量之比即为物质化学式的下标比
热重曲线计算 ① 设晶体为1 mol;② 失重一般是先失水、再失气态非金属氧化物;③ 计算每步的m余,=固体残留率;④ 晶体中金属质量不减少,仍在m余中;⑤ 失重最后一般为金属氧化物,由质量守恒得mO,由n金属:nO即可求出失重后物质的化学式
多步滴定计算 复杂的滴定可分为两类:(1) 连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量(2) 返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
常见的计算方法
1. 关系式法
其本质是根据反应的化学方程式进行定量关系计算,这是计算的通法。主要有:
(1) 从滴定类型来分类:中和滴定、沉淀滴定、氧化还原滴定、配位滴定等。
(2) 从反应过程来分类:多步计算、返滴定计算、连续滴定计算等。
滴定计算中要注意结合守恒法:元素守恒、电荷守恒、得失电子守恒。
2. 守恒法
(1) 质量守恒法:本质是化学方程式的计算。
(2) 得失电子守恒法:本质是氧化还原反应方程式的计算。
(3) 溶液中离子电荷守恒法:溶液中阴、阳离子的物质的量的定量关系计算。
3. 方程组法
如:某工厂计划用电解Al2O3制备54kg Al,计算理论上所需Al2O3的质量
① 写出反应的化学(或离子)方程式
2Al2O3(熔融)4Al+3O2↑
② 列出反应物和生成物之间的量的关系
2Al2O3(熔融)4Al+3O2↑
204 108
x 54 kg
③ 列算式进行计算
=,x=102 kg
例1 (2021·江苏学测)添加食品膨松剂能使面包、饼干等食品口感松软或酥脆。某兴趣小组对一种膨松剂的组成(成分为NaHCO3和NH4HCO3)进行分析,设计实验方案如下:
方案一:称量一定量的样品,加热至恒重,再称其质量,记录数据为m g。
方案二:如图所示,向24.70 g样品中滴加过量NaOH溶液,加热至反应完全,再通入段时间N2,经测定,装置C中吸收的NH3质量为1.70 g(已知:HC+OH-C+H2O)。
(1) 仪器①的名称是 。
(2) ① 方案一中NaHCO3受热分解的化学方程式是 。
② 由方案一计算NaHCO3与NH4HCO3物质的量之比,还需提供的数据是 。
(3) ① 方案二中通入N2的目的是 ,装置 B的作用是 。
② 由方案二计算NaHCO3与NH4HCO3物质的量之比,写出计算过程。
例2 (2020·江苏学测)绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1) 某研究性学习小组用下图所示试验装置对绿矾的焙烧反应进行探究。
① 实验过程中,装置A玻管中可观察到的实验现象是 。
② 装置C的作用是 。
③ 该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入 (填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有S的方法是 。
(2) 某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160 kg,计算理论上所需绿矾的质量,写出计算过程。
达标巩固检测
1. (2022·连云港学测合格考)硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
① 先按要求搭配好装置再检查装置的气密性;
② 打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有15.20 g FeSO4的硬质玻璃管;
③ 观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④ 冷却后A装置中剩余固体的质量为10.88 g。
(1) 根据B装置中的实验现象可推测分解产物中含有 。
(2) 将装置B、C顺序颠倒能否达到原来的实验目的 (填“能”或“不能”),原因是 。
(3) D装置中发生的主要反应的化学方程式是 。
(4) 通过计算确定已分解的FeSO4物质的量,写出计算过程。
2. (2022·盐城学测合格考)侯氏制碱法的主要产品是Na2CO3(可能含有碳酸氢钠杂质)。某兴趣小组为测定制得纯碱样品中碳酸钠的质量分数,设计了如下所示的实验方案:
方案一:采用如图所示实验装置,加热m g样品至恒重,测定相关数据。
方案二:称量3.600 g样品,配制成100 mL溶液;取其中20.00 mL 溶液置于锥形瓶中,滴加甲基橙做指示剂;用 1 moL/L 的盐酸标准溶液滴定,达滴定终点时消耗盐酸体积为13.00 mL。回答下列问题:
(1) 方案一中:① X气体选择N2、不选空气的原因是 。
② 仪器a的名称是 。
③ 实验需先通一段时间X气体,再加热样品。若要准确计算样品中碳酸钠的质量分数,还需要提供一个数据,它可以是 (填标号)。
A. 加热前后,甲装置的质量变化
B. 加热前后,乙、丙装置的质量变化总和
C. 加热前后,a处的质量变化
(2) 方案二中:① 发生反应的化学程式是
(写出一种即可)。
② 根据该实验方案计算样品中碳酸钠的质量分数,写出计算过程(结果保留一位小数)。
3. (2022·扬州学测合格考)以FeSO4为原料制备柠檬酸亚铁(FeC6H6O7)的反应有FeSO4+ Na2CO3Na2SO4+ FeCO3↓、FeCO3+ C6H8O7 FeC6H6O7+ CO2↑+ H2O。实验步骤如下:
(1) 边搅拌边将Na2CO3溶液缓慢加入盛有FeSO4溶液的反应容器中。
(2) 充分反应后,过滤,并洗涤生成的FeCO3沉淀。检验洗涤是否完全的方法是 。
(3) 将洗净后的FeCO3加入足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。① 铁粉的作用是 。
② 反应结束后,为提高柠檬酸亚铁的产率,不采取过滤的方法,处理过量铁粉的方案是 。
(4) 溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。加入无水乙醇的目的是 。
(5)为测定步骤(1)所用FeSO4溶液中FeSO4的浓度进行如下实验:取20 mL上述FeSO4溶液,向其中滴加0.02 mol/L KMnO4酸性溶液,当消耗KMnO4酸性溶液20 mL时,两者恰好完全反应(反应过程中Mn被还原为Mn2+)。计算上述FeSO4溶液中FeSO4的物质的量浓度(写出计算过程)。
4. (2021·徐州合格考一模)氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
已知:① SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。
② 三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2CuCl2+2SO2↑+4HCl↑
(1) 仪器a的名称是 ,锥形瓶中得到的物质X的化学式为 。
(2) 碱石灰中含有CaO和NaOH,碱石灰的作用是 。
(3) 某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.280 0 g 试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.100 0 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2S4+2I-)。
① 滴定到终点时的现象是 。
② 计算该试样中铜元素的百分含量(写出计算过程)。
5. (2021·盐城合格考模拟)蒸馏碘滴定法可测量中药材中SO2是否超标(亚硫酸盐折算成SO2)。原理是利用如图所示的装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液(发生反应:SO2+I2+2H2OH2SO4+2HI)。
实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加入某待测中药材粉末10 g、蒸馏水300 mL;仪器C中加入蒸馏水25 mL和淀粉试液1 mL作为吸收液;打开冷凝水,通入N2,一段时间后,滴入6 mol/L盐酸10 mL;加热烧瓶A并保持微沸约3 min后,用0.010 00 mol/L碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1 mL。
Ⅱ. 空白实验
烧瓶A中只加入300 mL蒸馏水,重复上述操作,消耗碘标准溶液的体积为V0 mL。
(1) 仪器C的名称是 。
(2) 滴入盐酸前先通入一段时间N2,其目的是 。
(3) 配制0.010 00 mol/L碘标准溶液,需要用到的玻璃仪器有 (填序号)。
A. 天平 B. 烧杯 C. 玻璃棒 D. 一定规格的容量瓶
(4) 设计空白实验的目的是 。
(5) 求该中药材中SO2含量为多少mg/kg(写出计算过程)
课时16 化学综合实验
【考点各个击破】
考点4 盐酸 KSCN 湿润红色石蕊试纸变蓝
例1 (1) 分液漏斗 (2) ① 2NaHCO3Na2CO3+H2O+CO2↑ ② 所称样品的质量 (3) ① 将生成的氨气全部赶出被稀硫酸吸收 干燥氨气 ② 2∶1
n(NH4HCO3)= n(NH3)==0.1 mol,
m(NH4HCO3)=0.1 mol×79 g/mol=7.9 g
m(NaHCO3)=24.7 g-7.9 g=16.8 g,
n(NaHCO3)=0.2 mol,
则n(NaHCO3)∶n(NH4HCO3)=
0.2 mol∶0.1 mol=2∶1
解析:(2) ② 方案二称量一定量样品,加热至恒重,再称其质量,可知剩余物为Na2CO3,根据2NaHCO3Na2CO3+H2O+CO2↑,可计算出m(NaHCO3),要知道样品的总质量才能求出m(NH4HCO3)。
例2 (1) ① 绿色晶体变红棕色粉末 ② 吸收尾气SO2,防止污染环境 ③ 紫色石蕊试液 先加入盐酸,无现象,再加入氯化钡溶液生成白色沉淀,证明“矾精”中存在硫酸根离子
(2) 2FeSO4·7H2O ~ Fe2O3
2×278 160
m(FeSO4·7H2O) 160 kg
m(FeSO4·7H2O)=556 kg
解析:(1) ① 绿矾(FeSO4·7H2O)为绿色,反应生成铁红(主要成分是Fe2O3),反应的现象是绿色晶体变红棕色粉末; ② 根据质量守恒可知还有SO2生成,则要用NaOH吸收尾气中的SO2,防止污染环境;③ 酸能使紫色石蕊试液变红,可用紫色的石蕊试液检验H+;检验S可用氯化钡溶液。
【达标巩固检测】
1. (1) SO3 (2) 不能 SO3可溶于品红溶液中 (3) SO2+2NaOHNa2SO3+H2O
(4) 2FeSO4Fe2O3+SO2↑+SO3↑ 固体减少量
2×152 144
m(FeSO4) 15.20 g-10.88 g
m(FeSO4)=9.12 g
n(FeSO4)=0.06 mol
解析:A装置中有红棕色固体出现,说明有Fe2O3生成,B中有白色沉淀生成,说明生成物中含有SO3,C中品红溶液褪色,说明生成物中含有SO2; 装置B、C顺序颠倒不能达到原来的实验目的,因为SO3可溶于品红溶液中,根据实验现象可知FeSO4分解生成Fe2O3、SO2、SO3,则反应的化学方程式为FeSO4Fe2O3+SO2↑+SO3↑。
2. (1) ① 空气中含有的CO2、H2O等会影响实验数据测定结果准确性 ② 球形干燥管 ③ A或B
(2) ① Na2CO3+2HCl2NaCl+H2O+CO2↑或NaHCO3+HClNaCl+H2O+CO2↑
② 设3.600 g样品中含有Na2CO3 x mol;NaHCO3 y mol
列方程组:
解方程组: x=0.03 mol y=0.005 mol
样品中Na2CO3的质量分数为×100%≈88.3%
3. (2) 取最后一次的洗涤滤液12 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 (3) ① 防止+2价的铁元素被氧化 ② 加入适量柠檬酸让铁粉反应完全 (4) 降低柠檬酸亚铁在水中的溶解量,有利于晶体析出 (5)0.1 mol/L
解析:(2) 沉淀中含有硫酸根离子,检验滤液中是否存在硫酸根离子即可。(3) ① FeC6H6O7易被氧化加入铁粉,防止+2价的铁元素被氧化;② 加入适量柠檬酸让铁粉反应完全,可除去铁粉。(4) 加入适量无水乙醇、静置、过滤,获得柠檬酸亚铁晶体。加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出。
(5) 根据离子方程式Mn+5Fe2++8H+Mn2++5Fe3++4H2O,
得关系式:Mn 5Fe2+
1 5
0.0200 L×0.02 mol/L 0.020 0 L×c(Fe2+)
解得:c(Fe2+)=0.1 mol/L
4. (1) 冷凝管 SOCl2 (2) 防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体 (3) ① 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色 ② 45.71%
解析:(3) ② 根据方程式:2CuCl2+4KI2CuI↓+I2+4KCl,I2+2Na2S2O3Na2S4O6+2NaI,得关系式:CuCl2Na2S2O3,n(Cu)=n(CuCl2)=n(Na2S2O3)=0.100 0 mol/L×20.00 mL×10-3 L/mL=2.0×10-3 mol w(Cu)=×100%≈45.71%
5. (1) 锥形瓶 (2) 排尽装置内空气,避免空气中的O2对SO2含量测定的干扰 (3) BCD (4) 消除其他试剂、实验操作等因素引起的误差 (5)64(V1-V0) 解析:(5) 滴定过程中发生反应:
SO2+I2+2H2OH2SO4+2HI
根据I2~SO2关系,n(SO2)=n(I2)
用于氧化SO2的碘标准液体积为(V1-V0) mL,
n(I2)=(V1-V0)×10-5 mol
所以10 g中药材粉末中n(SO2)=(V1-V0)×10-5 mol
m(SO2)=64(V1-V0)×10-5g
所以1 kg中药材中m(SO2)=64(V1-V0)mg
。
同课章节目录
