山东省菏泽市曹县2022-2023学年高三上学期期末模拟训练化学试题(Word版含答案)
文档属性
| 名称 | 山东省菏泽市曹县2022-2023学年高三上学期期末模拟训练化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 22:49:41 | ||
图片预览



文档简介
曹县2022-2023学年高三上学期期末模拟训练 化学
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学对提高人类生活质量、促进社会发展和科技创新有重要作用,下列叙述错误的是A.“天和核心舱”电推进系统中,腔体采用的氮化硼陶瓷属于新型无机非金属材料
B.维生素C和细铁粉均可作食品脱氧剂;二氧化硫常用作葡萄酒的抗氧化剂
C.纳米铁粉主要通过物理吸附作用除去污水中的Cu2+、Ag+、Hg2+
D.聚乙炔塑料可导电;碳纤维属于无机高分子材料
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.25g质量分数为46%的乙醇水溶液中含有的氢原子数为3
B. 2molNO与1mol在密闭容器中充分反应后的分子数为2
C. 电解精炼铜过程中当电路中通过0.5电子时,阳极有16gCu转化为
D. 的溶液显中性,1L该溶液中含数为0.1
3.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家。脯氨酸(结构如图)可参与诱导不对称催化反应。下列关于脯氨酸的说法错误的是( )
可发生取代、氧化反应 B.饱和碳原子上的二氯代物有8种
C.能形成分子间氢键 D.与互为同分异构体
4. 下列说法错误的是( )
A. 因H-Br键能大于H-Cl键能,故HBr的沸点高于HCl
B. 配离子中各元素第一电离能:
C. N与N的π键比P与P的强,可推断的稳定性比的高
D. 中的键角大于中的键角
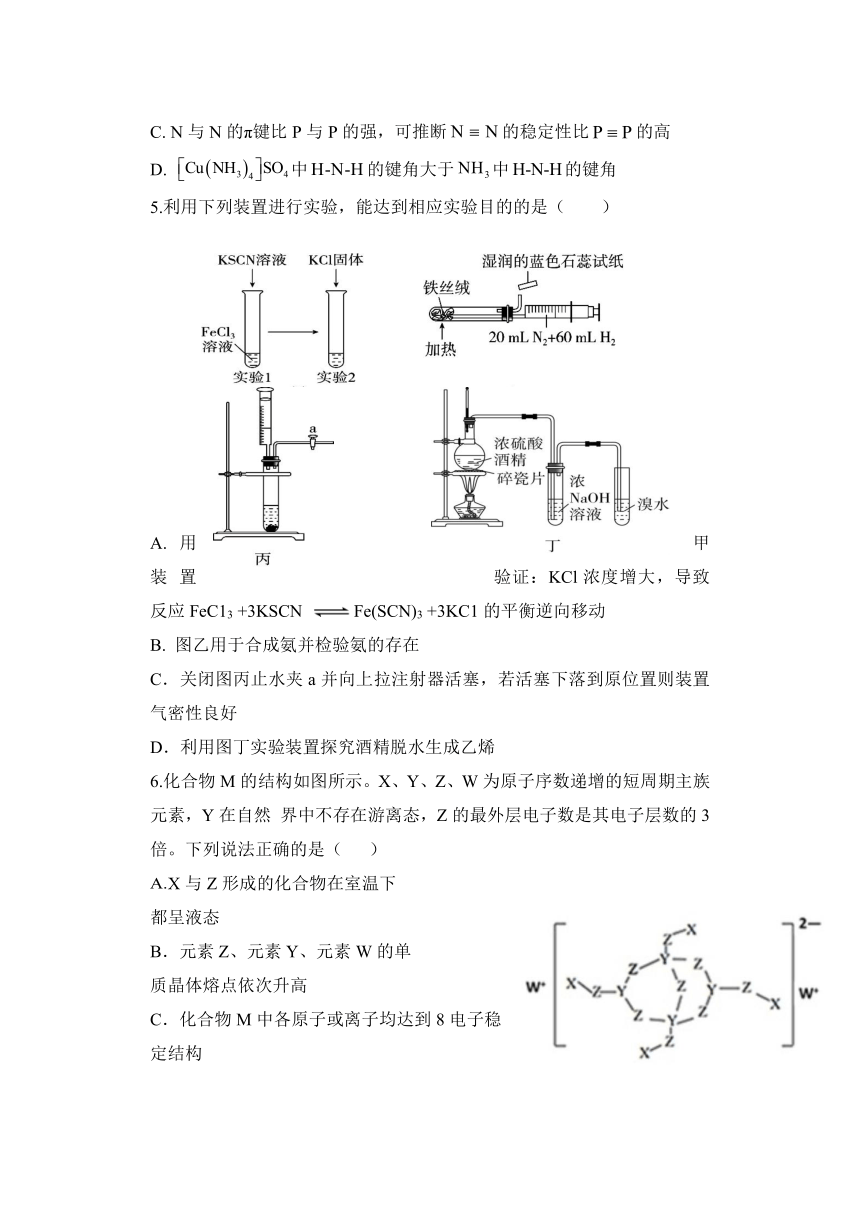
5.利用下列装置进行实验,能达到相应实验目的的是( )
A.用甲装置验证:KCl浓度增大,导致反应FeC13 +3KSCN Fe(SCN)3 +3KC1的平衡逆向移动
B. 图乙用于合成氨并检验氨的存在
C.关闭图丙止水夹a并向上拉注射器活塞,若活塞下落到原位置则装置气密性良好
D.利用图丁实验装置探究酒精脱水生成乙烯
(
2-
)6.化合物M的结构如图所示。X、Y、Z、W为原子序数递增的短周期主族元素,Y在自然 界中不存在游离态,Z的最外层电子数是其电子层数的3倍。下列说法正确的是( )
A.X与Z形成的化合物在室温下
都呈液态
元素Z、元素Y、元素W的单
质晶体熔点依次升高
C.化合物M中各原子或离子均达到8电子稳定结构
D.因X3YZ3分子间存在氢键,故X3YZ3分子很稳定
7.药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:
则下列说法正确的是( )
A.X最多15原子共平面 B.X的沸点低于其同分异构体
C.1molZ最多与6mol发生加成反应
D.Y属于羧酸的同分异构体有13种(不考虑空间异构)
8.第VIII族元素(Co、Rh、Ir)的一些配合物是反应CH3OH + CO=CH3COOH良好催化剂。
以[ Rh(CO)2I2]- -为催化剂、以碘甲烷为助催化剂合成乙酸(Monsanto法)的示意图如下
下列说法错误的是( )
生成CH3COOH总反应的原子利用率为100%
B.该催化循环中Rh的化合价未发生变化
C.E生成CH3COOH的反应为:CH3COI + H2O→CH3COOH + HI
D.该催化剂可有效提高反应物的平衡转化率
9.已知[Co(H2O)6]2+呈粉红色、[CoCl4]2--呈蓝色、[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:
装置 序号 操作 现象
① 将试管置于冰水浴中 溶液均呈粉红色
② 加水稀释
③ 加少量ZnCl2固体
以下结论和解释正确的是
A.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为3:2
B.由实验①可知:△H<0,由实验②可推知加水稀释,浓度熵QC.由实验③可知:Zn2+络合Cl-能力比Co2+络合Cl-能力弱
D.实验①②③可知:配合物的形成与温度、配体的浓度及配体的种类等有关
10.钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含K2NiFeO4、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
巳知: I.放电时负极的电极反应式为:KxC6-xe-=C6+xK+;
Ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,当溶液中某离子浓度低于1×10-5mol/L时,认为该离子已沉淀完全。
下列说法正确的是( )
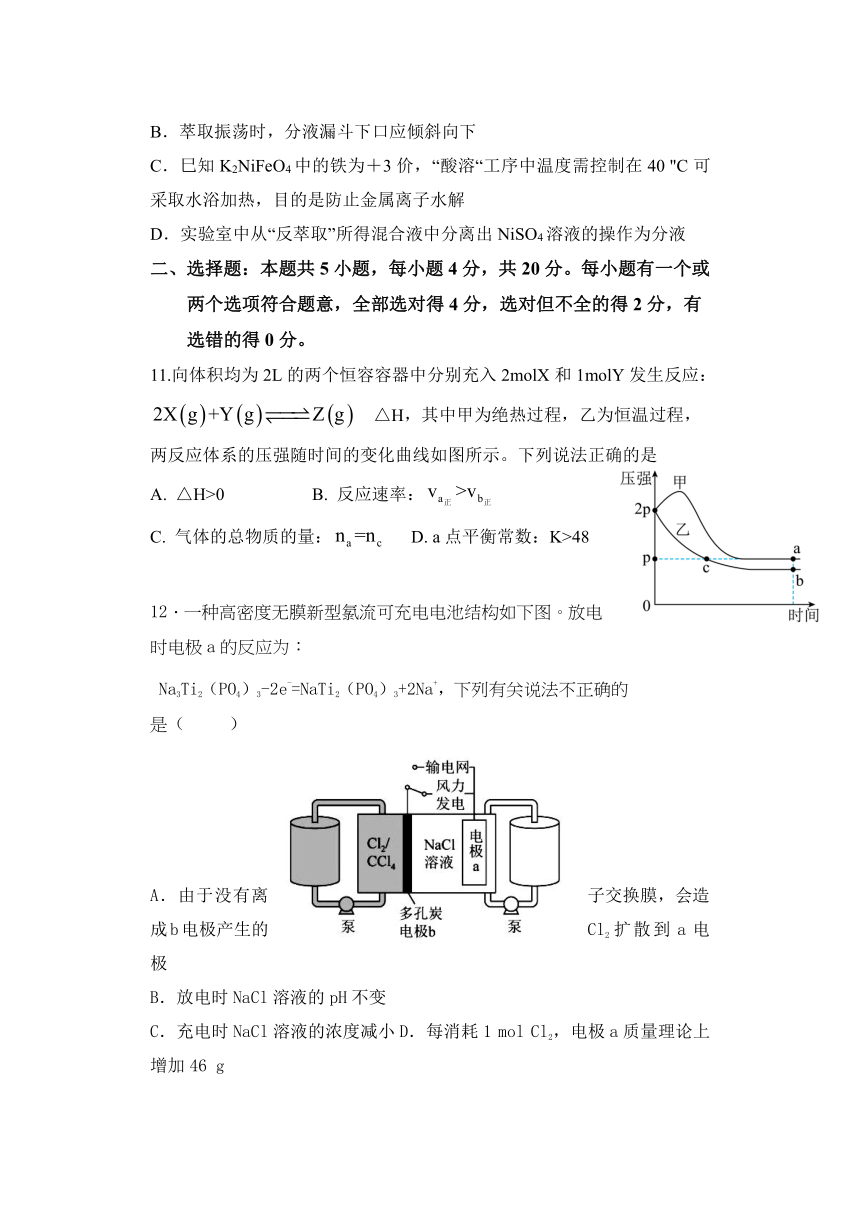
A.实验室进行正极焙烧操作用到的主要仪器:蒸发皿、泥三角、三脚架和洒精灯
B.萃取振荡时,分液漏斗下口应倾斜向下
C.巳知K2NiFeO4中的铁为+3价,“酸溶“工序中温度需控制在40 "C可采取水浴加热,目的是防止金属离子水解
D.实验室中从“反萃取”所得混合液中分离出NiSO4溶液的操作为分液
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.向体积均为2L的两个恒容容器中分别充入2molX和1molY发生反应: △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. △H>0 B. 反应速率:
C. 气体的总物质的量: D. a点平衡常数:K>48
12.一种高密度无膜新型氯流可充电电池结构如下图。放电时电极a的反应为:
Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+,下列有关说法不正确的是( )
A.由于没有离子交换膜,会造成b电极产生的Cl2扩散到a电极
B.放电时NaCl溶液的pH不变
C.充电时NaCl溶液的浓度减小D.每消耗1 mol Cl2,电极a质量理论上增加46 g
13.2022年5月10日报道了天舟四号货运飞船发射。报道说,天舟四号货运飞船装载了神舟十四号3名航天员6个月在轨驻留物资以及实验设备和维持空间站运行的备品备件等。空间站的水气整合系统利用“萨巴蒂尔反应”,萨巴蒂尔反应为:CO2(g)+4H2(g)CH4(g) +2H2O(g) △H,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。下列说法正确的( )
A.从物质吸附在催化剂表面到形成过渡态的过程会放出热量
B.反应历程中最小能垒(活化能)为0.6eV
C.此反应的决速步为·CO2(g) +·H =·HOCO
D.反应过程中只断裂化学键H-H键
14.配合物的稳定性可以用稳定常数K来衡量,如,其稳定常数表达式为。已知:溶于水呈亮绿色。下表中的实验操作或实验现象能达到实验目的或得出相应结论的是
选项 实验操作或实验现象 实验目的或结论
A 常温下,向100mL浓度分别为0.10mol/L的K2C2O4和KSCN混合溶液中滴加几滴氯化铁溶液,观察到溶液变为亮绿色 常温下,稳定性:
B 取少量C2H5Br与NaOH溶液共热,待溶液不分层后,再滴加AgNO3溶液 检验中C2H5Br的溴元素
C 向氯化亚铁溶液中滴加酸性高锰酸钾溶液 检验溶液中的
D 向淀粉溶液中滴加稀硫酸,加热一段时间后,加入NaOH溶液至碱性,再加入碘水,观察溶液是否变蓝 检验淀粉是否水解
15.亚磷酸(H3P03)在生产、生活及医药方面有广泛用途。常温下,已知溶液中含磷微粒的浓度之和为0.1mol/L,溶液中各含磷微粒的pc-pOH[pc=-lgc,pOH=-lgc(OH-)]关系如图所示。
已知:x、z两点的坐标为x(7.3,1.3)、y(l0.0,4.0)、
z(l2.6,1.3)。
下列说法正确的是( )
A.H3PO3的Ka1数量级为10-13
B.表示pc(H2PO3-)随pOH变化的曲线是②
C.常温下,NaH2PO3溶液中的C (HPO32-) > C (H3PO3)
D.H3PO3与足量的NaOH溶液反应的离子方程式为:H3PO3 +20H-=HPO32-+2H2O
三、非选择题:本题共5小题,共60分。
16.新一代脱硝催化剂SCR(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
已知①NH4VO3难溶于水,Ksp= 3. 0 ×10-8
②VO2+ + 2OH-=VO3- + H2O
③Na2TiO3难溶于水。
④.V2O5是两性氧化物,在弱碱性条件下即可生成NaVO3
回答下列问题:
(1)“转化”时的离子方程式为 。
(2)“沉铝“过程中得到的沉淀主要成分是 (填化学式)。
(3)NH4VO3煅烧脱氨可得V2O5。在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,反应的离子方程式为
(4)向10ml0.1mol/LNaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化)欲使VO3- 沉淀完全,则NH4Cl溶液的最小浓度为 (溶液中某离子浓度≤1 x 1 0-5mol L-1时,认为该离子沉淀完全)
(5)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如左图,温度超过80℃ 以后,沉钒率下降的可能原因是: (写出一条即可)
(6)煅烧偏钒酸铵(NH4VO3)时,固体(取2. 340 g NH4VO3)质量的减少量随温度变化的曲线如右图所示:l00~200℃时产物除NH3外另一种物质的化学式为
17.无水FeC13常作有机合成催化剂,还可作水处理剂等。氯化亚砜(SOCl2)可作为制取无
水FeC13的脱水剂,已知SOCl2熔点-101 ℃,沸点为76℃,遇水极易反应生成两种酸性气体。工业上以废铁屑(含有少量碳和SiO2等杂质)为原料制备无水FeC13,其流程如下:
回答问题:
(1)用Na2CO3溶液浸取废铁屑的作用是
(2)为避免引入新的杂质,试剂B可以选用
A.KMnO4溶液 B.氯水 C .稀硝酸 D. H2O2
(3)已知FeC13 6H2O在水中的溶解度如下表:
温度℃ 0 10 20 30 50 80 100
溶解度(g/100gH2O) 74.4 81.9 91.8 106.8 315.1 525.8 535.7
由C溶液得到FeC13 6H2O晶体的方法为 最后过滤、洗涤、干燥。
(4)实验室利用FeC13·6H2O和亚硫酰氯(SOCl2)制备无水FeC13的装置如图所示(加热及夹持装置略)
①仪器D的名称是
②反应开始应先加热装置 (填“B”或“C”)。装置C内发生反应的化学方程式为 该反应过程中产生少量亚铁盐,写出一种可能的还原剂 ,请设计实验验证是该还原剂将Fe3+还原:
③下列装置可用于装置单元E的是
B. C.
(5)FeC13产品纯度常用碘量法测定:称取5. 0 g无水氯化铁样品,溶于稀盐酸,再配成250 mL溶液,取出25. 00mL待测液于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液作指示剂,用0. 1 mol L-I Na2S2O3标准溶液滴定消耗标准溶液的平均体积为30mL(已知:I2 +2Na2S2O3=2Nal + Na2S4O6),计算该FeC13产品纯度 。
18. 2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Ti原子的空间运动状态有 种,Co2+、Co3+能与NH3、H2O、SCN-等形成配合物,上述配位体中的第二周期元素电负性从小到大顺序是
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
I1(Cu)(填“大于”或“小于")。原因是
(3)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示
离子 Sc3+ Cr3+ Fe2+ Zn2+
水合离子的颜色 无色 绿色 浅绿色 无色
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(4)复兴号高铁车体材质用到Mn、Co等元素
①基态Mn原子的价层电子排布图为
核外电子占据的最高电子层的符号是
②已知r(Co2+) = 65 pm, r(Mn2 +) = 67 pm,推测MnCO3比CoCO3的分解温度 (填“高”或“低”)解释原因
(5)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞边长)为aD(lD =10-10m),其中阴离子(N3-)采用面心立方最密堆积方式,则r(Ti3+)为 D,该氮化钛的密度为 g cm-3(列出计算式即可)。
19.“碳达峰、碳中和”的战略目标,是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研究合理利用CO2和CO以减少碳的排放。CO2减排策略主要有三种:减少排放、捕集封存、转化利用。
Ⅰ.其中CO2转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。甲醇和甲烷都是燃料电池的常用燃料,也是有机合成的重要化工原料。
(1)已知25℃时,甲醇、氢气燃烧热分别为726. 1 kJ mol-l、285. 8 kJ mo1-1,1 mol甲醇蒸气、水蒸气液化分别放出35. 2 kJ、42.37 kJ的热量。则CO2与H2反应生成甲醇蒸气和水蒸气的热化学方程式为
(2) CO2 (g)和H2(g)合成CH4(g)的热化学方程式
CO2(g)+4H2(g) CH4(g) +2H2O(g) △H1 = - 164. 9 kJ/mol,
其副反应:CO2(g) +H2(g) CO(g) + H2O(g) △H2 = +41. 2 kJ/mol。
①将n(CO2): n(H2) =1:4的混合气体充入密闭容器中发生上述反应,在不同温度和压强时,CO2的平衡转化率如图所示。0.1 MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是
②CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是
A.催化过程使用的催化剂为La2O3和La2O2CO3
B.La2O2CO3可以释放出CO2*(活化分子)
C.H2经过Ni活性中心断键裂解产生活化态H*的
过程为放热过程
D.CO2加氢制备CH4的过程需要La2O3和Ni共同完成
③CO2加氢制备CH4过程中发生如下反应:
I. CO2 (g)+ 4H2 (g) CH4 (g) + 2H2O(g) △H1
Ⅱ. CO2 (g) + H2 (g)CO(g) +H2O(g) △H2,反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式Rlnk=-Ea/T+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea= kJ/mol。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是 。
图1
(
^
) (
2
-
UIUl
.
Io
u IU
l
)II. CO2捕获和转化可减少CO2排放并实现资源利用,原理如图2所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
图3
(
图
)(3)反应②的化学反应方程式:
(4)t1~ t3, n(H2)比n(CO)多,可能发生副反应的化学方程式为 。
(5)t2时刻,副反应生成H2的速率 反应②生成H2速率(填 “>” “<”或“=”)。
20.有机化合物G是抗炎症、抗肿瘤的药物。以有机化合物A和醛X为原料制备该药物的合成路线如下:
已知:Ⅰ.;
Ⅱ.R-COOH+R’-NH2+H2O;
Ⅲ.R-CN
回答下列问题:
(1)醛X的名称是_______,F中的官能团名称是_______。
(2)C的结构简式是_______,C生成D的反应类型是_______。
(3)E的同分异构体中,满足下列条件的同分异构体(不考虑立体异构)有_______种,其中有5种不同化学环境的H,且个数比为2∶2∶1∶1∶1的同分异构体的结构简式是 。
①含氰基 ②属于芳香族化合物 ③与溶液反应放出气体
(4)写出以苯甲醇()为原料制备的合成路线(其他无机试剂任选): 。
参考答案
1~5 C A B A C 6~10 A B D D D
11~15 B AD C A D
16.(12 分)(l)Na2 TiO3 +(x-1)H2 O+2H +=TiO2·xH2O+2Na+(2 分)
(2) Al(OH)3、H2SiO3(2 分)
(3) V2O5 +H2C2O4 +4H + =2VO2+ +2CO2 ↑+3H2O(2 分)
(4) 0. 106 mol/L(2 分)
(5) 温度升高,NH4 VO3溶解度增大,沉钒率下降或温度升高,氨水受热分解逸出NH3, 使NH4 +浓度下降,沉钒率下降(2分)
(6) HVO3(2 分)
17.(12分)(1)除去铁屑表面的油污(1分)
(2) BD( 1 分)
(3) 加入适量的盐酸(通入HC1气流),蒸发浓缩,冷却结晶(1分)
(4) ①球形冷凝管(1分)
SO2(1分)将C中固体溶于稀盐酸,加入BaCl2,若产生白色沉淀,证明是SO2将Fe3 + 还原(1分)③B(1分) (5)97.5%(2 分)
18.(12 分)(1)12(1 分) C<N<O(1 分)
(2)大于(1分) Zn核外电子排布为全满稳定结构,较难失电子(1分)
(3) 3d轨道上没有未成对电子(或3d轨道全空或全满状态)(1分)
(4)
②高(1分) 相比Mn2+,半径更小的Co2+与碳酸根离子中的氧离子作用力更强,更利于碳酸根分解为CO2(1分)
(5)
19.(12 分)(l)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = -53.73 kJ·mol-1 (2分)
(2) ①反应I的△H1<0,反应II的△H2>0,600℃之后,温度升高,反应II向右移动, 二氧化碳减少的量比反应I向左移动二氧化碳增加的量多(2分)
②BD(1分) ③31 (2分) 使用更高效的催化剂(增大催化剂比表面积)(1分)
(3)CaCO3 +CH4 CaO +2CO +2H2(2 分)(4)CH4 C + 2H2 (1 分)
(5) <(1 分
20.(1) ①. 甲醛 ②. 醚键、羧基
(2) ①. ②. 取代反应
(3) ①. 17 ②.
(4)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学对提高人类生活质量、促进社会发展和科技创新有重要作用,下列叙述错误的是A.“天和核心舱”电推进系统中,腔体采用的氮化硼陶瓷属于新型无机非金属材料
B.维生素C和细铁粉均可作食品脱氧剂;二氧化硫常用作葡萄酒的抗氧化剂
C.纳米铁粉主要通过物理吸附作用除去污水中的Cu2+、Ag+、Hg2+
D.聚乙炔塑料可导电;碳纤维属于无机高分子材料
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.25g质量分数为46%的乙醇水溶液中含有的氢原子数为3
B. 2molNO与1mol在密闭容器中充分反应后的分子数为2
C. 电解精炼铜过程中当电路中通过0.5电子时,阳极有16gCu转化为
D. 的溶液显中性,1L该溶液中含数为0.1
3.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家。脯氨酸(结构如图)可参与诱导不对称催化反应。下列关于脯氨酸的说法错误的是( )
可发生取代、氧化反应 B.饱和碳原子上的二氯代物有8种
C.能形成分子间氢键 D.与互为同分异构体
4. 下列说法错误的是( )
A. 因H-Br键能大于H-Cl键能,故HBr的沸点高于HCl
B. 配离子中各元素第一电离能:
C. N与N的π键比P与P的强,可推断的稳定性比的高
D. 中的键角大于中的键角
5.利用下列装置进行实验,能达到相应实验目的的是( )
A.用甲装置验证:KCl浓度增大,导致反应FeC13 +3KSCN Fe(SCN)3 +3KC1的平衡逆向移动
B. 图乙用于合成氨并检验氨的存在
C.关闭图丙止水夹a并向上拉注射器活塞,若活塞下落到原位置则装置气密性良好
D.利用图丁实验装置探究酒精脱水生成乙烯
(
2-
)6.化合物M的结构如图所示。X、Y、Z、W为原子序数递增的短周期主族元素,Y在自然 界中不存在游离态,Z的最外层电子数是其电子层数的3倍。下列说法正确的是( )
A.X与Z形成的化合物在室温下
都呈液态
元素Z、元素Y、元素W的单
质晶体熔点依次升高
C.化合物M中各原子或离子均达到8电子稳定结构
D.因X3YZ3分子间存在氢键,故X3YZ3分子很稳定
7.药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:
则下列说法正确的是( )
A.X最多15原子共平面 B.X的沸点低于其同分异构体
C.1molZ最多与6mol发生加成反应
D.Y属于羧酸的同分异构体有13种(不考虑空间异构)
8.第VIII族元素(Co、Rh、Ir)的一些配合物是反应CH3OH + CO=CH3COOH良好催化剂。
以[ Rh(CO)2I2]- -为催化剂、以碘甲烷为助催化剂合成乙酸(Monsanto法)的示意图如下
下列说法错误的是( )
生成CH3COOH总反应的原子利用率为100%
B.该催化循环中Rh的化合价未发生变化
C.E生成CH3COOH的反应为:CH3COI + H2O→CH3COOH + HI
D.该催化剂可有效提高反应物的平衡转化率
9.已知[Co(H2O)6]2+呈粉红色、[CoCl4]2--呈蓝色、[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:
装置 序号 操作 现象
① 将试管置于冰水浴中 溶液均呈粉红色
② 加水稀释
③ 加少量ZnCl2固体
以下结论和解释正确的是
A.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为3:2
B.由实验①可知:△H<0,由实验②可推知加水稀释,浓度熵Q
D.实验①②③可知:配合物的形成与温度、配体的浓度及配体的种类等有关
10.钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含K2NiFeO4、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
巳知: I.放电时负极的电极反应式为:KxC6-xe-=C6+xK+;
Ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,当溶液中某离子浓度低于1×10-5mol/L时,认为该离子已沉淀完全。
下列说法正确的是( )
A.实验室进行正极焙烧操作用到的主要仪器:蒸发皿、泥三角、三脚架和洒精灯
B.萃取振荡时,分液漏斗下口应倾斜向下
C.巳知K2NiFeO4中的铁为+3价,“酸溶“工序中温度需控制在40 "C可采取水浴加热,目的是防止金属离子水解
D.实验室中从“反萃取”所得混合液中分离出NiSO4溶液的操作为分液
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.向体积均为2L的两个恒容容器中分别充入2molX和1molY发生反应: △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. △H>0 B. 反应速率:
C. 气体的总物质的量: D. a点平衡常数:K>48
12.一种高密度无膜新型氯流可充电电池结构如下图。放电时电极a的反应为:
Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+,下列有关说法不正确的是( )
A.由于没有离子交换膜,会造成b电极产生的Cl2扩散到a电极
B.放电时NaCl溶液的pH不变
C.充电时NaCl溶液的浓度减小D.每消耗1 mol Cl2,电极a质量理论上增加46 g
13.2022年5月10日报道了天舟四号货运飞船发射。报道说,天舟四号货运飞船装载了神舟十四号3名航天员6个月在轨驻留物资以及实验设备和维持空间站运行的备品备件等。空间站的水气整合系统利用“萨巴蒂尔反应”,萨巴蒂尔反应为:CO2(g)+4H2(g)CH4(g) +2H2O(g) △H,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。下列说法正确的( )
A.从物质吸附在催化剂表面到形成过渡态的过程会放出热量
B.反应历程中最小能垒(活化能)为0.6eV
C.此反应的决速步为·CO2(g) +·H =·HOCO
D.反应过程中只断裂化学键H-H键
14.配合物的稳定性可以用稳定常数K来衡量,如,其稳定常数表达式为。已知:溶于水呈亮绿色。下表中的实验操作或实验现象能达到实验目的或得出相应结论的是
选项 实验操作或实验现象 实验目的或结论
A 常温下,向100mL浓度分别为0.10mol/L的K2C2O4和KSCN混合溶液中滴加几滴氯化铁溶液,观察到溶液变为亮绿色 常温下,稳定性:
B 取少量C2H5Br与NaOH溶液共热,待溶液不分层后,再滴加AgNO3溶液 检验中C2H5Br的溴元素
C 向氯化亚铁溶液中滴加酸性高锰酸钾溶液 检验溶液中的
D 向淀粉溶液中滴加稀硫酸,加热一段时间后,加入NaOH溶液至碱性,再加入碘水,观察溶液是否变蓝 检验淀粉是否水解
15.亚磷酸(H3P03)在生产、生活及医药方面有广泛用途。常温下,已知溶液中含磷微粒的浓度之和为0.1mol/L,溶液中各含磷微粒的pc-pOH[pc=-lgc,pOH=-lgc(OH-)]关系如图所示。
已知:x、z两点的坐标为x(7.3,1.3)、y(l0.0,4.0)、
z(l2.6,1.3)。
下列说法正确的是( )
A.H3PO3的Ka1数量级为10-13
B.表示pc(H2PO3-)随pOH变化的曲线是②
C.常温下,NaH2PO3溶液中的C (HPO32-) > C (H3PO3)
D.H3PO3与足量的NaOH溶液反应的离子方程式为:H3PO3 +20H-=HPO32-+2H2O
三、非选择题:本题共5小题,共60分。
16.新一代脱硝催化剂SCR(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
已知①NH4VO3难溶于水,Ksp= 3. 0 ×10-8
②VO2+ + 2OH-=VO3- + H2O
③Na2TiO3难溶于水。
④.V2O5是两性氧化物,在弱碱性条件下即可生成NaVO3
回答下列问题:
(1)“转化”时的离子方程式为 。
(2)“沉铝“过程中得到的沉淀主要成分是 (填化学式)。
(3)NH4VO3煅烧脱氨可得V2O5。在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,反应的离子方程式为
(4)向10ml0.1mol/LNaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化)欲使VO3- 沉淀完全,则NH4Cl溶液的最小浓度为 (溶液中某离子浓度≤1 x 1 0-5mol L-1时,认为该离子沉淀完全)
(5)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如左图,温度超过80℃ 以后,沉钒率下降的可能原因是: (写出一条即可)
(6)煅烧偏钒酸铵(NH4VO3)时,固体(取2. 340 g NH4VO3)质量的减少量随温度变化的曲线如右图所示:l00~200℃时产物除NH3外另一种物质的化学式为
17.无水FeC13常作有机合成催化剂,还可作水处理剂等。氯化亚砜(SOCl2)可作为制取无
水FeC13的脱水剂,已知SOCl2熔点-101 ℃,沸点为76℃,遇水极易反应生成两种酸性气体。工业上以废铁屑(含有少量碳和SiO2等杂质)为原料制备无水FeC13,其流程如下:
回答问题:
(1)用Na2CO3溶液浸取废铁屑的作用是
(2)为避免引入新的杂质,试剂B可以选用
A.KMnO4溶液 B.氯水 C .稀硝酸 D. H2O2
(3)已知FeC13 6H2O在水中的溶解度如下表:
温度℃ 0 10 20 30 50 80 100
溶解度(g/100gH2O) 74.4 81.9 91.8 106.8 315.1 525.8 535.7
由C溶液得到FeC13 6H2O晶体的方法为 最后过滤、洗涤、干燥。
(4)实验室利用FeC13·6H2O和亚硫酰氯(SOCl2)制备无水FeC13的装置如图所示(加热及夹持装置略)
①仪器D的名称是
②反应开始应先加热装置 (填“B”或“C”)。装置C内发生反应的化学方程式为 该反应过程中产生少量亚铁盐,写出一种可能的还原剂 ,请设计实验验证是该还原剂将Fe3+还原:
③下列装置可用于装置单元E的是
B. C.
(5)FeC13产品纯度常用碘量法测定:称取5. 0 g无水氯化铁样品,溶于稀盐酸,再配成250 mL溶液,取出25. 00mL待测液于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液作指示剂,用0. 1 mol L-I Na2S2O3标准溶液滴定消耗标准溶液的平均体积为30mL(已知:I2 +2Na2S2O3=2Nal + Na2S4O6),计算该FeC13产品纯度 。
18. 2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Ti原子的空间运动状态有 种,Co2+、Co3+能与NH3、H2O、SCN-等形成配合物,上述配位体中的第二周期元素电负性从小到大顺序是
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
I1(Cu)(填“大于”或“小于")。原因是
(3)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示
离子 Sc3+ Cr3+ Fe2+ Zn2+
水合离子的颜色 无色 绿色 浅绿色 无色
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(4)复兴号高铁车体材质用到Mn、Co等元素
①基态Mn原子的价层电子排布图为
核外电子占据的最高电子层的符号是
②已知r(Co2+) = 65 pm, r(Mn2 +) = 67 pm,推测MnCO3比CoCO3的分解温度 (填“高”或“低”)解释原因
(5)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞边长)为aD(lD =10-10m),其中阴离子(N3-)采用面心立方最密堆积方式,则r(Ti3+)为 D,该氮化钛的密度为 g cm-3(列出计算式即可)。
19.“碳达峰、碳中和”的战略目标,是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研究合理利用CO2和CO以减少碳的排放。CO2减排策略主要有三种:减少排放、捕集封存、转化利用。
Ⅰ.其中CO2转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。甲醇和甲烷都是燃料电池的常用燃料,也是有机合成的重要化工原料。
(1)已知25℃时,甲醇、氢气燃烧热分别为726. 1 kJ mol-l、285. 8 kJ mo1-1,1 mol甲醇蒸气、水蒸气液化分别放出35. 2 kJ、42.37 kJ的热量。则CO2与H2反应生成甲醇蒸气和水蒸气的热化学方程式为
(2) CO2 (g)和H2(g)合成CH4(g)的热化学方程式
CO2(g)+4H2(g) CH4(g) +2H2O(g) △H1 = - 164. 9 kJ/mol,
其副反应:CO2(g) +H2(g) CO(g) + H2O(g) △H2 = +41. 2 kJ/mol。
①将n(CO2): n(H2) =1:4的混合气体充入密闭容器中发生上述反应,在不同温度和压强时,CO2的平衡转化率如图所示。0.1 MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是
②CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是
A.催化过程使用的催化剂为La2O3和La2O2CO3
B.La2O2CO3可以释放出CO2*(活化分子)
C.H2经过Ni活性中心断键裂解产生活化态H*的
过程为放热过程
D.CO2加氢制备CH4的过程需要La2O3和Ni共同完成
③CO2加氢制备CH4过程中发生如下反应:
I. CO2 (g)+ 4H2 (g) CH4 (g) + 2H2O(g) △H1
Ⅱ. CO2 (g) + H2 (g)CO(g) +H2O(g) △H2,反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式Rlnk=-Ea/T+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea= kJ/mol。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是 。
图1
(
^
) (
2
-
UIUl
.
Io
u IU
l
)II. CO2捕获和转化可减少CO2排放并实现资源利用,原理如图2所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
图3
(
图
)(3)反应②的化学反应方程式:
(4)t1~ t3, n(H2)比n(CO)多,可能发生副反应的化学方程式为 。
(5)t2时刻,副反应生成H2的速率 反应②生成H2速率(填 “>” “<”或“=”)。
20.有机化合物G是抗炎症、抗肿瘤的药物。以有机化合物A和醛X为原料制备该药物的合成路线如下:
已知:Ⅰ.;
Ⅱ.R-COOH+R’-NH2+H2O;
Ⅲ.R-CN
回答下列问题:
(1)醛X的名称是_______,F中的官能团名称是_______。
(2)C的结构简式是_______,C生成D的反应类型是_______。
(3)E的同分异构体中,满足下列条件的同分异构体(不考虑立体异构)有_______种,其中有5种不同化学环境的H,且个数比为2∶2∶1∶1∶1的同分异构体的结构简式是 。
①含氰基 ②属于芳香族化合物 ③与溶液反应放出气体
(4)写出以苯甲醇()为原料制备的合成路线(其他无机试剂任选): 。
参考答案
1~5 C A B A C 6~10 A B D D D
11~15 B AD C A D
16.(12 分)(l)Na2 TiO3 +(x-1)H2 O+2H +=TiO2·xH2O+2Na+(2 分)
(2) Al(OH)3、H2SiO3(2 分)
(3) V2O5 +H2C2O4 +4H + =2VO2+ +2CO2 ↑+3H2O(2 分)
(4) 0. 106 mol/L(2 分)
(5) 温度升高,NH4 VO3溶解度增大,沉钒率下降或温度升高,氨水受热分解逸出NH3, 使NH4 +浓度下降,沉钒率下降(2分)
(6) HVO3(2 分)
17.(12分)(1)除去铁屑表面的油污(1分)
(2) BD( 1 分)
(3) 加入适量的盐酸(通入HC1气流),蒸发浓缩,冷却结晶(1分)
(4) ①球形冷凝管(1分)
SO2(1分)将C中固体溶于稀盐酸,加入BaCl2,若产生白色沉淀,证明是SO2将Fe3 + 还原(1分)③B(1分) (5)97.5%(2 分)
18.(12 分)(1)12(1 分) C<N<O(1 分)
(2)大于(1分) Zn核外电子排布为全满稳定结构,较难失电子(1分)
(3) 3d轨道上没有未成对电子(或3d轨道全空或全满状态)(1分)
(4)
②高(1分) 相比Mn2+,半径更小的Co2+与碳酸根离子中的氧离子作用力更强,更利于碳酸根分解为CO2(1分)
(5)
19.(12 分)(l)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = -53.73 kJ·mol-1 (2分)
(2) ①反应I的△H1<0,反应II的△H2>0,600℃之后,温度升高,反应II向右移动, 二氧化碳减少的量比反应I向左移动二氧化碳增加的量多(2分)
②BD(1分) ③31 (2分) 使用更高效的催化剂(增大催化剂比表面积)(1分)
(3)CaCO3 +CH4 CaO +2CO +2H2(2 分)(4)CH4 C + 2H2 (1 分)
(5) <(1 分
20.(1) ①. 甲醛 ②. 醚键、羧基
(2) ①. ②. 取代反应
(3) ①. 17 ②.
(4)
同课章节目录
