吉林省白山市抚松县第一高级中学2022-2023学年高三上学期期末考试化学试题(PDF版含答案)
文档属性
| 名称 | 吉林省白山市抚松县第一高级中学2022-2023学年高三上学期期末考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 954.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 15:54:17 | ||
图片预览



文档简介
抚松县第一高级中学2022-2023学年高三上学期期末考试
说明: 1.测试时间:90分钟 总分: 100 分
2.客观题涂在答题纸上,主观题答在答题纸的相应位置上
45
可能用到的相对原子质量:
H:1 Li:7 C:12 N:14 O: 16 Na:23 Mg :24 S:32 Fe:56 Zn:65 Pb:207
一、选择题:(每题只有一个正确选项,每题 3分)
1.下列材料说法错误的是
A. 建筑上的材料花岗岩属于无机非金属材料
B. 故宫琉璃瓦和光导纤维属于主要成分相同的一种无机非金属材料
C. 冬奥会火炬“飞扬”使用的碳纤维不属于有机高分子材料
D. 北京冬奥会“同心”金属奖牌属于合金材料
2. 下列图示或化学用语表达不正确的是
A.过氧化氢的空间填充模型:
B.中子数为 20的氯原子: 3717Cl
C.基态24Cr 原子的价层电子轨道表示式:
D.次氯酸的结构式: H—O—Cl
3.设 NA表示阿伏加德罗常数的值,下列说法错误的是
A. 6g (CH3)2NNH2 (偏二甲肼) 中 sp3杂化的原子数为 0.2NA
B. 1.9g D +3O ,含质子数 1.1NA
C. 叠氮化铵(NH4N3)可发生爆炸反应:NH4N3=2N2↑+2H2↑,则每收集标准状况下 89.6L
气 体转移电子数为 4NA
D. 1L 0.1mol/L的氨水中 NH 、NH +3 4 、NH3 H2O的粒子总数为 0.1NA
4.2021年 9月 17日,神舟十二号载人飞船返回舱平安着陆。为了确保航天员的安全, 搜索
人员手提箱中准备了必要的药品。某药品中含有四种原子序数依次增大的短周期主族元素
W、X、Y、Z,其最外层电子数之和为 19。W、X、Y所在的族不相邻, 族序数按 Y、W、
X、Z 的顺序依次增大。下列说法正确的是
A. 简单离子半径大小顺序: Z>Y>X
B. 四种元素的单质中能导电的只有一种
C. X、Z 可以组成多种离子
D. Z的非金属性强于 W,故常温下 Z的单质能置换出 W的简单氢化物中的 W
1
5.常温下,下列各组离子在指定溶液中一定能够大量共存的是
A.c H c OH 3 的溶液中Na 、Fe 、SO Cl
B.c OH 1 10 13mol/L的溶液中: NH 2 4、Ca 、 Cl 、NO
C.水电离的c H 1 10 13mol/L的溶液中: K 、Na 、AlO 、CO 23
D.与 Al反应能放出H 的溶液中: Ca2 2 、K 、NO 、SO
2
4
6.下列实验中, 现象及推论都正确是
选
实验 现象 推论
项
A 常温下将 Ba(OH)2 ·8H2O晶体与 NH4Cl晶 该反应的熵变烧杯壁变凉
体 小烧杯中混合 △S<0
B 向 FeCl2和 KSCN 的混合溶液中滴入硝酸 生成沉淀且溶液变 氧化性:Fe3+<Ag+
酸化的 AgNO3溶液 红
C 向 KI- 可用过氧化氢标准淀粉溶液中滴加过氧化氢 溶液变蓝
溶液滴定 I 含量
D 分别向盛有 0.1 mol/L 醋酸和饱和硼酸溶 前者产生无色气泡, 酸性: 醋酸>碳酸>
液的试管中滴加等浓度 Na2CO3溶液 后者无明显现象 硼酸
A. A B. B C. C D. D
7. 中国科学家构建水系级联二次电池,实现了在同一个反应腔体中耦合不同的氧化还原反
应。如图所示电池以 S、Zn为电极,以 CuSO4溶液和 ZnSO4溶液为离子导体,分两步放电,
在 a极首先生成 Cu2S,后生成 Cu。下列说法正确的是
A.放电过程中, 每生成 1molCu2S的同时消耗 1molZn
B.充电时 SO 24 通过隔膜向 b极移动
C.充电时 a作阳极, Cu和 Cu2S失电子生成单质硫和 Cu2+
D.用此电池为铅酸蓄电池充电,电极 a应连接铅电极
8.常温常压下, 1 mol CH3OH与O2发生反应时, 生成 CO或 HCHO的能量变化图(反应
物 O2和生成物水略去),下列说法正确的是
2
A.加入催化剂后, 生成 CO的热效应变大, 生成 HCHO的热效应变小
B.加入催化剂后, 生成 HCHO的速率变大, 单位时间内生成 HCHO量变多
C. CH3OH 的燃烧热为393 kJ/mol
D. 生成 HCHO 的热化学方程式为2CH3OH+O2 =2HCHO+2H2O ΔH=-316 kJ/mol
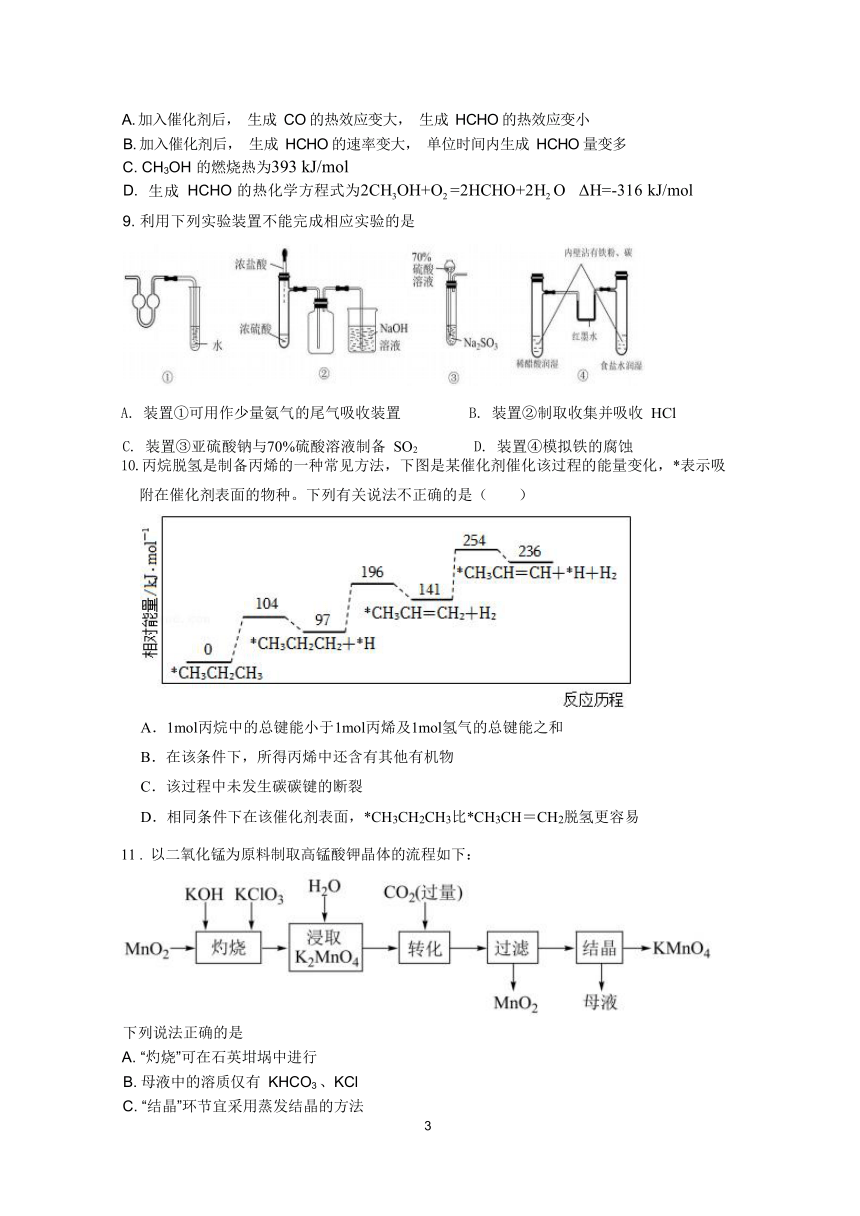
9. 利用下列实验装置不能完成相应实验的是
A. 装置①可用作少量氨气的尾气吸收装置 B. 装置②制取收集并吸收 HCl
C. 装置③亚硫酸钠与70%硫酸溶液制备 SO2 D. 装置④模拟铁的腐蚀
10.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸
附在催化剂表面的物种。下列有关说法不正确的是( )
A.1mol丙烷中的总键能小于1mol丙烯及1mol氢气的总键能之和
B.在该条件下,所得丙烯中还含有其他有机物
C.该过程中未发生碳碳键的断裂
D.相同条件下在该催化剂表面,*CH3CH2CH3比*CH3CH=CH2脱氢更容易
11 . 以二氧化锰为原料制取高锰酸钾晶体的流程如下:
下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B.母液中的溶质仅有 KHCO3、KCl
C. “结晶”环节宜采用蒸发结晶的方法
3
D. “转化”中的反应方程式为: 3K2MnO4+4CO2+2H2O=MnO2↓+2KMnO4+4KHCO3
12.关于反应 Cl2(g)+H2O(l) HClO(aq)+H+(aq)+Cl— (aq) Δ H法错误的是
A.升高温度, 氯水中的c(HClO)减小
B.取两份氯水,分别滴加AgNO3溶液和淀粉 KI溶液,若前者有白色沉淀, 后者溶液变蓝
色,可以证明上述反应存在限度
C. c Cl-取氯水稀释, /c(HClO) 增大
D. 氯水中加入少量醋酸钠固体或石灰石,上述平衡均正向移动,且c(HClO) 增大
13.氨的催化氧化是工业制硝酸的基础,其反应机理如图 1;在 1L密闭容器中充入 1molNH3
和 2molO2,测得有关产物的物质的量与温度的关系如图 2。
下列说法错误的是
A. 加入 Pt—Rh合金的目的是提高反应的速率
B. 氨的催化氧化最佳温度应控制在 840℃左右
C. 520℃时, NH3的转化率为 40%
D. 840℃以上, 发生了反应: 2NO(g) O2(g)+N2(g) ΔH>0
4
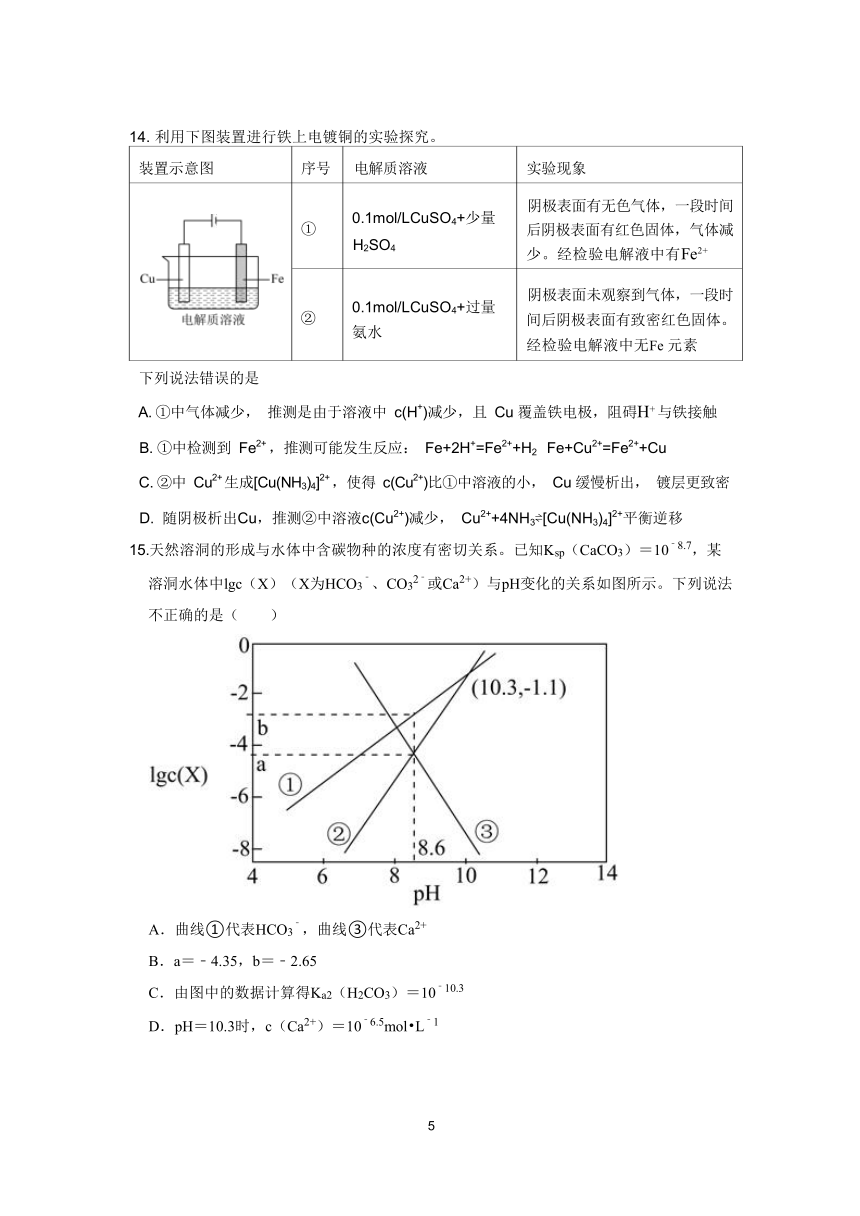
14. 利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
阴极表面有无色气体,一段时间
0.1mol/LCuSO4+少量
① 后阴极表面有红色固体,气体减
H2SO4
少。经检验电解液中有Fe2+
阴极表面未观察到气体,一段时
0.1mol/LCuSO4+过量
② 间后阴极表面有致密红色固体。
氨水
经检验电解液中无Fe元素
下列说法错误的是
A.①中气体减少, 推测是由于溶液中 c(H+)减少,且 Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到 Fe2+,推测可能发生反应: Fe+2H+=Fe2++H2 Fe+Cu2+=Fe2++Cu
C.②中 Cu2+生成[Cu(NH 2+3)4] ,使得 c(Cu2+)比①中溶液的小, Cu缓慢析出, 镀层更致密
D. 随阴极析出Cu,推测②中溶液c(Cu2+)减少, Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
15. ﹣天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10 8.7,某
溶洞水体中lgc(X)(X为HCO ﹣3 、CO 2﹣3 或Ca2+)与pH变化的关系如图所示。下列说法
不正确的是( )
A.曲线①代表HCO ﹣3 ,曲线③代表Ca2+
B.a=﹣4.35,b=﹣2.65
C ﹣.由图中的数据计算得Ka2(H2CO3)=10 10.3
D.pH=10.3时,c(Ca2+ ﹣)=10 6.5mol L﹣1
5
55
16. (15 分)氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在
现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式 ;基态
铬、氮原子的未成对电子数之比为 。
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反
应机理如图1所示(其中H2O和NaCl略去)。NaClO氧化NH3的总反应化学方程式为
(3)改变 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的
影响如图2所示,则除氨气过程中最佳的 值约为 。
﹣
(4)室温下,用水稀释0.1mol L 1氨水,溶液中随着水量的增加而减小的是 。
A. B.
C.c(H+) D.
(5)25℃时,将amolNH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,滴加氨水的
过程中水的电离平衡将 (填“正向”、“逆向”或“不”)移动。
(6) 某种离子型铁的氧化物晶胞如图所示,它由 A、B 方块组成。已知该晶体的密度为
dg / cm3,阿伏加德罗常数的值为NA,下列说法中正确的是
6
A.该铁的氧化物化学式为Fe3O4 B.距离 Fe3+最近的O2 有 6个
C.晶体中的 O2-只能构成正四面体空隙 D.晶胞的边长为
107 nm
17. (14分) 某研究性学习小组利用氯型阴离子交换树脂(RCl)从海带中提取 I2,并测定反应
I2(aq)+I— (aq) I —3 (aq)的平衡常数。
Ⅰ .离子交换法提取 I2的流程如下:
已知: ①交换吸附发生反应: RCl+I —3 RI —3+Cl ,RCl+I— RI+Cl—;
②吸附I 和 I 达饱和的树脂分别呈淡黄色和黑红色。
③IO-不稳定,易歧化成+5 价含氧酸根离子
(1) “氧化”时I 转化为 I ,反应的离子方程式为 。
(2) “一次洗脱”已经完成的现象是 。
3 1 6mol L 1( )向洗脱液 中加入 H2SO4,可析出碘晶体,写出对应的离子方程
式 。
(4) 将分离出碘晶体的洗脱液合并, 置于 _(填仪器名称)中, 加入乙
醚,振荡, 静置, 分液。后经 (填操作名称)回收乙醚。
Ⅱ.测定反应 I —2(aq)+I (aq) I ―3 (aq)的平衡常数 K
常温下,取 2 个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用
0.0500mol L 1Na2S2O3溶液进行滴定, 测定 I2和 I
―
3 的总浓度。
编号 250mL 碘量瓶① 250mL碘量瓶②
0.5g研细的碘 0.5g研细的碘
药品
60mL 0.010mol L-1KI 60 mLH2O
I ―2和 I3 的总浓度 0.0050mol L-1 0.0012mol L-1
7
(5) 不能用普通锥形瓶代替碘量瓶的原因______ _____。
(6) 0.5g 的碘的不需要精确称取的理由是_________ __。
(7) 碘量瓶①平衡体系中c I2 与②中c I2 接近。K=___________(写出计算式)。
18. (11分)苯乙烯是重要的有机合成单体,常用乙苯为原料合成。
(1)以CO2和乙苯为原料合成苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的
两种推测:则 的K3=
(用含K1、K2的代数式表达)。
8
(2)向刚性容器中充入10molCO2和10mol乙苯,发生途径1的反应,在不同温度下测得平衡
时各物质的体积分数如图2。可知ΔH3 0(填>或<)。相同温度下CO2转化率低于乙苯,
推知发生了副反应CO(g)+H2O(g) CO2(g)+H2(g),由图象知该反应ΔH 0
(填>或<)。
(3)某研究团队找到乙苯直接脱氢的高效催化剂,反应原理如图:
ΔH1
①已知部分化学键键能数据如表所示:则ΔH1= 。
共价键 C﹣C C﹣H C=C H﹣H
键能/(kJ/mol) 347.7 413.4 615 436
②实际过程中,通常向乙苯中掺入水蒸气,保持体系总压为100kPa的条件下进行。乙苯
平衡转化率与温度、投料比m[m= ]的关系如图3。则投料比m1、m2、m3由大
到小的关系为 。
③若m2=5:1,则A点温度下,该反应的平衡常数Kp= 。若其他条件不变,将恒
压调整为恒容状态,则A点对应的乙苯的平衡转化率 (填“增大”、“不变”或
“减小”)。
(4)实验测得,乙苯脱氢的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为
速率常数,只与温度有关),图4中③代表lgk逆随 的变化关系,则能代表lgk正随 的变化
关系的是 。
9
19.(15分)
回答下列问题:
(1)A中含氧官能团的名称为 .
(2)由B→C的反应类型为 .
(3)D的分子式为C10H11NO4,D能发生银镜反应,则D的结构简式为
(4)F的分子式为 .
(5)加热条件下,G与新制的碱性Cu(OH)2悬浊液发生反应的化学方程式为
(6)B的一种同分异构体X同时满足下列条件,则X的结构简式为 (写出一种).
①苯环上有4个取代基,其中1个取代基是氨基;
②X既能与盐酸反应,又能与NaHCO3溶液反应;
③X分子中不同化学环境的氢原子个数比是3:2:2:2.
(7)已知:
.设计由
和(CH3)2SO4制备 的合成路线: (无机试剂任选).
10
化学答案
一、选择题(每题 3 分,共 45 分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B A A C B D C B B A D B C D D
16.
(1) ; 2:1 。
(2) 3NaClO+3NH3═N2↑+3NaCl+3H2O 。
(3) 1.5 。
(4) BD 。
(5) 逆向
(6)ABD (3 分) 错选 0 分,少选每个 1 分
17.
18.
(1) K1×K2
(2)ΔH3 > 0, > 0。
(3) ①ΔH1= +123.5kJ/mol 。
②m3>m2>m1 。
③Kp= 50kPa 。 减小
(4) ④ 。
19.
(1)A中含氧官能团的名称为 羧基、羟基、硝基 .
1
(2)由 B→C的反应类型为 还原反应 .
(3) .
(4) C12H14N2O2 .
(5) +2Cu(OH)2 +Cu2O↓+2H2O .
(6) (或 ) (写出一种).
(7)
2
说明: 1.测试时间:90分钟 总分: 100 分
2.客观题涂在答题纸上,主观题答在答题纸的相应位置上
45
可能用到的相对原子质量:
H:1 Li:7 C:12 N:14 O: 16 Na:23 Mg :24 S:32 Fe:56 Zn:65 Pb:207
一、选择题:(每题只有一个正确选项,每题 3分)
1.下列材料说法错误的是
A. 建筑上的材料花岗岩属于无机非金属材料
B. 故宫琉璃瓦和光导纤维属于主要成分相同的一种无机非金属材料
C. 冬奥会火炬“飞扬”使用的碳纤维不属于有机高分子材料
D. 北京冬奥会“同心”金属奖牌属于合金材料
2. 下列图示或化学用语表达不正确的是
A.过氧化氢的空间填充模型:
B.中子数为 20的氯原子: 3717Cl
C.基态24Cr 原子的价层电子轨道表示式:
D.次氯酸的结构式: H—O—Cl
3.设 NA表示阿伏加德罗常数的值,下列说法错误的是
A. 6g (CH3)2NNH2 (偏二甲肼) 中 sp3杂化的原子数为 0.2NA
B. 1.9g D +3O ,含质子数 1.1NA
C. 叠氮化铵(NH4N3)可发生爆炸反应:NH4N3=2N2↑+2H2↑,则每收集标准状况下 89.6L
气 体转移电子数为 4NA
D. 1L 0.1mol/L的氨水中 NH 、NH +3 4 、NH3 H2O的粒子总数为 0.1NA
4.2021年 9月 17日,神舟十二号载人飞船返回舱平安着陆。为了确保航天员的安全, 搜索
人员手提箱中准备了必要的药品。某药品中含有四种原子序数依次增大的短周期主族元素
W、X、Y、Z,其最外层电子数之和为 19。W、X、Y所在的族不相邻, 族序数按 Y、W、
X、Z 的顺序依次增大。下列说法正确的是
A. 简单离子半径大小顺序: Z>Y>X
B. 四种元素的单质中能导电的只有一种
C. X、Z 可以组成多种离子
D. Z的非金属性强于 W,故常温下 Z的单质能置换出 W的简单氢化物中的 W
1
5.常温下,下列各组离子在指定溶液中一定能够大量共存的是
A.c H c OH 3 的溶液中Na 、Fe 、SO Cl
B.c OH 1 10 13mol/L的溶液中: NH 2 4、Ca 、 Cl 、NO
C.水电离的c H 1 10 13mol/L的溶液中: K 、Na 、AlO 、CO 23
D.与 Al反应能放出H 的溶液中: Ca2 2 、K 、NO 、SO
2
4
6.下列实验中, 现象及推论都正确是
选
实验 现象 推论
项
A 常温下将 Ba(OH)2 ·8H2O晶体与 NH4Cl晶 该反应的熵变烧杯壁变凉
体 小烧杯中混合 △S<0
B 向 FeCl2和 KSCN 的混合溶液中滴入硝酸 生成沉淀且溶液变 氧化性:Fe3+<Ag+
酸化的 AgNO3溶液 红
C 向 KI- 可用过氧化氢标准淀粉溶液中滴加过氧化氢 溶液变蓝
溶液滴定 I 含量
D 分别向盛有 0.1 mol/L 醋酸和饱和硼酸溶 前者产生无色气泡, 酸性: 醋酸>碳酸>
液的试管中滴加等浓度 Na2CO3溶液 后者无明显现象 硼酸
A. A B. B C. C D. D
7. 中国科学家构建水系级联二次电池,实现了在同一个反应腔体中耦合不同的氧化还原反
应。如图所示电池以 S、Zn为电极,以 CuSO4溶液和 ZnSO4溶液为离子导体,分两步放电,
在 a极首先生成 Cu2S,后生成 Cu。下列说法正确的是
A.放电过程中, 每生成 1molCu2S的同时消耗 1molZn
B.充电时 SO 24 通过隔膜向 b极移动
C.充电时 a作阳极, Cu和 Cu2S失电子生成单质硫和 Cu2+
D.用此电池为铅酸蓄电池充电,电极 a应连接铅电极
8.常温常压下, 1 mol CH3OH与O2发生反应时, 生成 CO或 HCHO的能量变化图(反应
物 O2和生成物水略去),下列说法正确的是
2
A.加入催化剂后, 生成 CO的热效应变大, 生成 HCHO的热效应变小
B.加入催化剂后, 生成 HCHO的速率变大, 单位时间内生成 HCHO量变多
C. CH3OH 的燃烧热为393 kJ/mol
D. 生成 HCHO 的热化学方程式为2CH3OH+O2 =2HCHO+2H2O ΔH=-316 kJ/mol
9. 利用下列实验装置不能完成相应实验的是
A. 装置①可用作少量氨气的尾气吸收装置 B. 装置②制取收集并吸收 HCl
C. 装置③亚硫酸钠与70%硫酸溶液制备 SO2 D. 装置④模拟铁的腐蚀
10.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸
附在催化剂表面的物种。下列有关说法不正确的是( )
A.1mol丙烷中的总键能小于1mol丙烯及1mol氢气的总键能之和
B.在该条件下,所得丙烯中还含有其他有机物
C.该过程中未发生碳碳键的断裂
D.相同条件下在该催化剂表面,*CH3CH2CH3比*CH3CH=CH2脱氢更容易
11 . 以二氧化锰为原料制取高锰酸钾晶体的流程如下:
下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B.母液中的溶质仅有 KHCO3、KCl
C. “结晶”环节宜采用蒸发结晶的方法
3
D. “转化”中的反应方程式为: 3K2MnO4+4CO2+2H2O=MnO2↓+2KMnO4+4KHCO3
12.关于反应 Cl2(g)+H2O(l) HClO(aq)+H+(aq)+Cl— (aq) Δ H
A.升高温度, 氯水中的c(HClO)减小
B.取两份氯水,分别滴加AgNO3溶液和淀粉 KI溶液,若前者有白色沉淀, 后者溶液变蓝
色,可以证明上述反应存在限度
C. c Cl-取氯水稀释, /c(HClO) 增大
D. 氯水中加入少量醋酸钠固体或石灰石,上述平衡均正向移动,且c(HClO) 增大
13.氨的催化氧化是工业制硝酸的基础,其反应机理如图 1;在 1L密闭容器中充入 1molNH3
和 2molO2,测得有关产物的物质的量与温度的关系如图 2。
下列说法错误的是
A. 加入 Pt—Rh合金的目的是提高反应的速率
B. 氨的催化氧化最佳温度应控制在 840℃左右
C. 520℃时, NH3的转化率为 40%
D. 840℃以上, 发生了反应: 2NO(g) O2(g)+N2(g) ΔH>0
4
14. 利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
阴极表面有无色气体,一段时间
0.1mol/LCuSO4+少量
① 后阴极表面有红色固体,气体减
H2SO4
少。经检验电解液中有Fe2+
阴极表面未观察到气体,一段时
0.1mol/LCuSO4+过量
② 间后阴极表面有致密红色固体。
氨水
经检验电解液中无Fe元素
下列说法错误的是
A.①中气体减少, 推测是由于溶液中 c(H+)减少,且 Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到 Fe2+,推测可能发生反应: Fe+2H+=Fe2++H2 Fe+Cu2+=Fe2++Cu
C.②中 Cu2+生成[Cu(NH 2+3)4] ,使得 c(Cu2+)比①中溶液的小, Cu缓慢析出, 镀层更致密
D. 随阴极析出Cu,推测②中溶液c(Cu2+)减少, Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
15. ﹣天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10 8.7,某
溶洞水体中lgc(X)(X为HCO ﹣3 、CO 2﹣3 或Ca2+)与pH变化的关系如图所示。下列说法
不正确的是( )
A.曲线①代表HCO ﹣3 ,曲线③代表Ca2+
B.a=﹣4.35,b=﹣2.65
C ﹣.由图中的数据计算得Ka2(H2CO3)=10 10.3
D.pH=10.3时,c(Ca2+ ﹣)=10 6.5mol L﹣1
5
55
16. (15 分)氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在
现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式 ;基态
铬、氮原子的未成对电子数之比为 。
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反
应机理如图1所示(其中H2O和NaCl略去)。NaClO氧化NH3的总反应化学方程式为
(3)改变 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的
影响如图2所示,则除氨气过程中最佳的 值约为 。
﹣
(4)室温下,用水稀释0.1mol L 1氨水,溶液中随着水量的增加而减小的是 。
A. B.
C.c(H+) D.
(5)25℃时,将amolNH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,滴加氨水的
过程中水的电离平衡将 (填“正向”、“逆向”或“不”)移动。
(6) 某种离子型铁的氧化物晶胞如图所示,它由 A、B 方块组成。已知该晶体的密度为
dg / cm3,阿伏加德罗常数的值为NA,下列说法中正确的是
6
A.该铁的氧化物化学式为Fe3O4 B.距离 Fe3+最近的O2 有 6个
C.晶体中的 O2-只能构成正四面体空隙 D.晶胞的边长为
107 nm
17. (14分) 某研究性学习小组利用氯型阴离子交换树脂(RCl)从海带中提取 I2,并测定反应
I2(aq)+I— (aq) I —3 (aq)的平衡常数。
Ⅰ .离子交换法提取 I2的流程如下:
已知: ①交换吸附发生反应: RCl+I —3 RI —3+Cl ,RCl+I— RI+Cl—;
②吸附I 和 I 达饱和的树脂分别呈淡黄色和黑红色。
③IO-不稳定,易歧化成+5 价含氧酸根离子
(1) “氧化”时I 转化为 I ,反应的离子方程式为 。
(2) “一次洗脱”已经完成的现象是 。
3 1 6mol L 1( )向洗脱液 中加入 H2SO4,可析出碘晶体,写出对应的离子方程
式 。
(4) 将分离出碘晶体的洗脱液合并, 置于 _(填仪器名称)中, 加入乙
醚,振荡, 静置, 分液。后经 (填操作名称)回收乙醚。
Ⅱ.测定反应 I —2(aq)+I (aq) I ―3 (aq)的平衡常数 K
常温下,取 2 个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用
0.0500mol L 1Na2S2O3溶液进行滴定, 测定 I2和 I
―
3 的总浓度。
编号 250mL 碘量瓶① 250mL碘量瓶②
0.5g研细的碘 0.5g研细的碘
药品
60mL 0.010mol L-1KI 60 mLH2O
I ―2和 I3 的总浓度 0.0050mol L-1 0.0012mol L-1
7
(5) 不能用普通锥形瓶代替碘量瓶的原因______ _____。
(6) 0.5g 的碘的不需要精确称取的理由是_________ __。
(7) 碘量瓶①平衡体系中c I2 与②中c I2 接近。K=___________(写出计算式)。
18. (11分)苯乙烯是重要的有机合成单体,常用乙苯为原料合成。
(1)以CO2和乙苯为原料合成苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的
两种推测:则 的K3=
(用含K1、K2的代数式表达)。
8
(2)向刚性容器中充入10molCO2和10mol乙苯,发生途径1的反应,在不同温度下测得平衡
时各物质的体积分数如图2。可知ΔH3 0(填>或<)。相同温度下CO2转化率低于乙苯,
推知发生了副反应CO(g)+H2O(g) CO2(g)+H2(g),由图象知该反应ΔH 0
(填>或<)。
(3)某研究团队找到乙苯直接脱氢的高效催化剂,反应原理如图:
ΔH1
①已知部分化学键键能数据如表所示:则ΔH1= 。
共价键 C﹣C C﹣H C=C H﹣H
键能/(kJ/mol) 347.7 413.4 615 436
②实际过程中,通常向乙苯中掺入水蒸气,保持体系总压为100kPa的条件下进行。乙苯
平衡转化率与温度、投料比m[m= ]的关系如图3。则投料比m1、m2、m3由大
到小的关系为 。
③若m2=5:1,则A点温度下,该反应的平衡常数Kp= 。若其他条件不变,将恒
压调整为恒容状态,则A点对应的乙苯的平衡转化率 (填“增大”、“不变”或
“减小”)。
(4)实验测得,乙苯脱氢的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为
速率常数,只与温度有关),图4中③代表lgk逆随 的变化关系,则能代表lgk正随 的变化
关系的是 。
9
19.(15分)
回答下列问题:
(1)A中含氧官能团的名称为 .
(2)由B→C的反应类型为 .
(3)D的分子式为C10H11NO4,D能发生银镜反应,则D的结构简式为
(4)F的分子式为 .
(5)加热条件下,G与新制的碱性Cu(OH)2悬浊液发生反应的化学方程式为
(6)B的一种同分异构体X同时满足下列条件,则X的结构简式为 (写出一种).
①苯环上有4个取代基,其中1个取代基是氨基;
②X既能与盐酸反应,又能与NaHCO3溶液反应;
③X分子中不同化学环境的氢原子个数比是3:2:2:2.
(7)已知:
.设计由
和(CH3)2SO4制备 的合成路线: (无机试剂任选).
10
化学答案
一、选择题(每题 3 分,共 45 分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B A A C B D C B B A D B C D D
16.
(1) ; 2:1 。
(2) 3NaClO+3NH3═N2↑+3NaCl+3H2O 。
(3) 1.5 。
(4) BD 。
(5) 逆向
(6)ABD (3 分) 错选 0 分,少选每个 1 分
17.
18.
(1) K1×K2
(2)ΔH3 > 0, > 0。
(3) ①ΔH1= +123.5kJ/mol 。
②m3>m2>m1 。
③Kp= 50kPa 。 减小
(4) ④ 。
19.
(1)A中含氧官能团的名称为 羧基、羟基、硝基 .
1
(2)由 B→C的反应类型为 还原反应 .
(3) .
(4) C12H14N2O2 .
(5) +2Cu(OH)2 +Cu2O↓+2H2O .
(6) (或 ) (写出一种).
(7)
2
同课章节目录
