海南省2022-2023学年高三上学期期末学业水平诊断化学试题(含答案)
文档属性
| 名称 | 海南省2022-2023学年高三上学期期末学业水平诊断化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-16 15:23:33 | ||
图片预览



文档简介
绝密★启用前
海南省2022-2023学年高三上学期期末学业水平诊断
化学
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Al 27 S 32
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与日常生活、学习密切相关,下列说法错误的是( )
A.食盐、味精的主要成分均为盐类 B.树干表面涂抹石硫合剂能预防虫害
C.学生用的铅笔芯的主要成分是Pb D.古字画不褪色的原因之一是所用的墨中含碳
2.下列有关钠、硫单质及其化合物的叙述正确的是( )
A.中阳离子与阴离子的个数比为2∶1 B.常温时,硫化钠水溶液的
C.硫在足量中燃烧生成 D.利用饱和溶液可除去中混有的HCl
3.下列实验操作方法正确的是( )
A.向试管中添加液体 B.称取21.6gNaOH C.检验装置气密性 D.分液放出下层液体
4.“价-类”二维图是学习元素化合物的重要载体,下图是短周期某一卤族元素的“价-类”二维图。下列说法正确的是( )
A.该元素是卤族元素中的氟 B.a的浓溶液分别与h、i反应均可生成b
C.c具有较强氧化性,是e的酸酐 D.酸性:d5.氮、氧分别是空气中和地壳中含量最多的两种元素。下列说法正确的是( )
A.电负性:N>O B.活泼性:
C.第一电离能:N>O D.熔沸点:
6.下列实验操作对应的实验现象错误的是( )
选项 实验操作 实验现象
A 向KI溶液中滴加淀粉溶液 溶液变蓝
B 向溶液中滴加NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀
C 向饱和溶液中加入少量纯碱粉末 生成白色沉淀
D 向酸性溶液中加入过量甲苯,振荡 溶液的紫红色消失
7.在2.7gAl粉中加入过量NaOH溶液,发生反应:。设代表阿伏加德罗常数的值,下列说法正确的是( )
A.溶液中的数为 B.该反应中转移的电子数为
C.该反应的氧化产物是 D.该反应中生成3.36L
8.一定温度下,在某密闭容器中的和发生下列反应,并达到平衡状态: 。下列说法正确的是( )
A.升高温度,
B.加入,平衡正向移动,平衡常数增大
C.使用合适的催化剂,可提高的平衡转化率
D.压缩容器的容积,平衡时的物质的量增大
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.某工业碱性废水中含,利用下列装置可将其转化为FeS。下列说法正确的是( )
A.Fe棒连接电源的正极 B.b电极一定是惰性材料
C.阳极反应式为 D.气体X可能是
10.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是目前形成化合物种类最多的元素,Y元素在同周期主族元素中非金属性最强,Z元素在同周期主族元素中原子半径最大,W元素原子的最外层电子数等于Y、Z元素原子的最外层电子数之差。下列判断正确的是( )
A.非金属性:X>W B.最高正化合价:Y>W
C.Z的氧化物中只含离子键 D.简单氢化物稳定性:Y>W
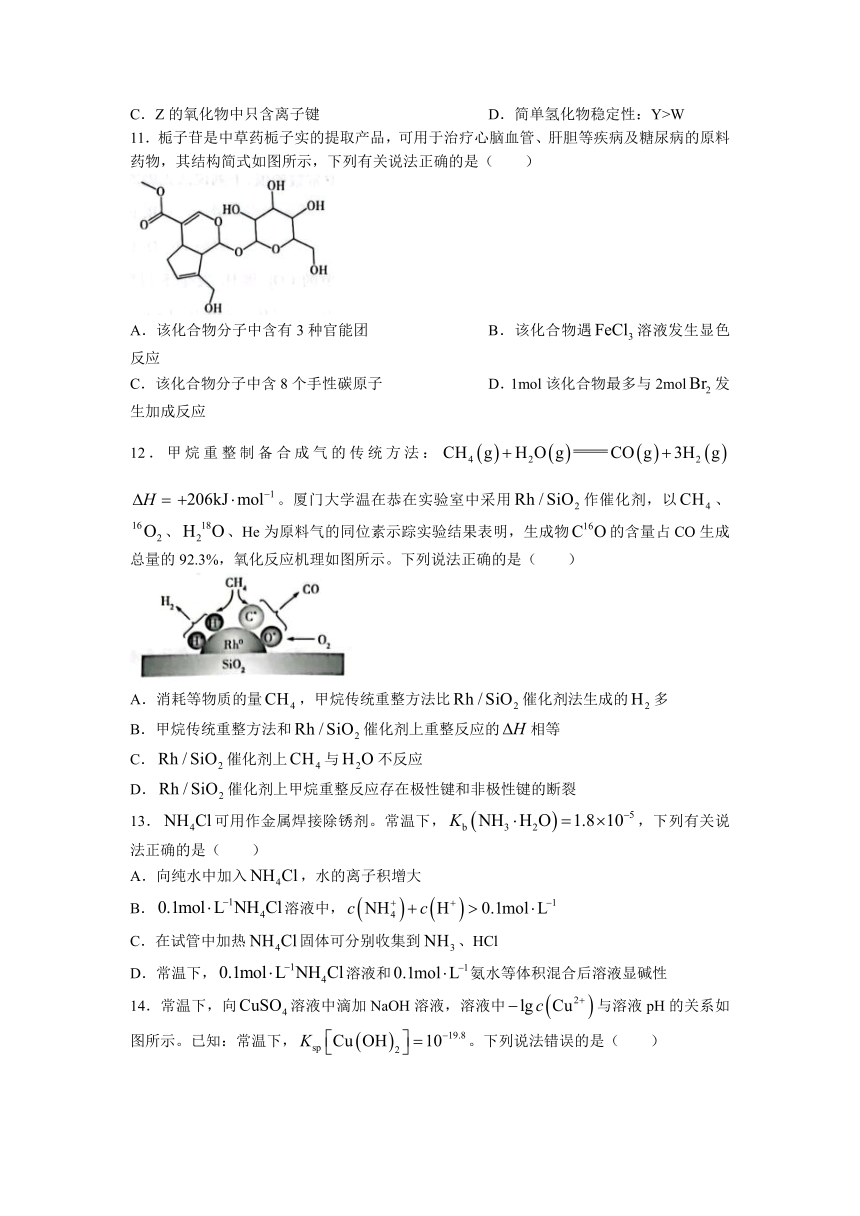
11.栀子苷是中草药栀子实的提取产品,可用于治疗心脑血管、肝胆等疾病及糖尿病的原料药物,其结构简式如图所示,下列有关说法正确的是( )
A.该化合物分子中含有3种官能团 B.该化合物遇溶液发生显色反应
C.该化合物分子中含8个手性碳原子 D.1mol该化合物最多与2mol发生加成反应
12.甲烷重整制备合成气的传统方法: 。厦门大学温在恭在实验室中采用作催化剂,以、、、He为原料气的同位素示踪实验结果表明,生成物的含量占CO生成总量的92.3%,氧化反应机理如图所示。下列说法正确的是( )
A.消耗等物质的量,甲烷传统重整方法比催化剂法生成的多
B.甲烷传统重整方法和催化剂上重整反应的相等
C.催化剂上与不反应
D.催化剂上甲烷重整反应存在极性键和非极性键的断裂
13.可用作金属焊接除锈剂。常温下,,下列有关说法正确的是( )
A.向纯水中加入,水的离子积增大
B.溶液中,
C.在试管中加热固体可分别收集到、HCl
D.常温下,溶液和氨水等体积混合后溶液显碱性
14.常温下,向溶液中滴加NaOH溶液,溶液中与溶液pH的关系如图所示。已知:常温下,。下列说法错误的是( )
A.随着NaOH溶液的滴入,溶液中变小
B.N点横坐标的数值为4.1
C.M点水的电离程度小于N点
D.M点存在关系:
三、非选择题:本题共5小题,共60分。
15.(10分)金属钨是一种银白色金属,主要用于优质钢的冶炼和制造钨丝等。一种以黑钨矿(主要成分是和,还含有少量杂质)为原料制备金属钨的工业流程如图所示。
已知:焙烧得到的产物的主要成分为、、、。
回答下列问题:
(1)“焙烧”时需对黑钨矿进行粉碎,其目的是______。
(2)写出“焙烧”过程中与纯碱反应的化学方程式:______。“滤渣1”的主要成分为______(填化学式)。
(3)“调pH”时发生主要反应的离子方程式为______。
(4)实验室由制备时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、______。
16.(10分)以为原料可制备绿色能源甲醇,从而实现“碳达峰”“碳中和”的承诺。制备的反应为 。回答下列问题:
(1)的燃烧热,则完全燃烧生成5.6L(标准状况)和一定量液态水时放出的热量为______kJ。
(2)在恒容密闭容器中充入一定量、的混合物,只发生上述反应,相同时间内测得容器中的浓度与反应温度(T)变化的关系如图1所示。
①该条件下,制备甲醇选取的最佳温度约为______K。
②随着温度的升高,该密闭容器中甲醇浓度先增大后减小的原因是______。
(3)以、为原料合成,除发生上述反应外,还发生反应: 。两个反应的平衡常数的自然对数()随温度倒数()变化的关系如图2所示。
①图2中,表示反应 的是直线______(填“甲”或“乙”)。
②计算1250K时,反应的平衡常数______。
③在图3中补充完成 反应过程中的能量变化曲线。
17.(12分)硫酸锰可为动植物提供微量元素,还可用作工业催化剂等。用还原可制备硫酸锰,装置如图所示(夹持装置已省略)。
回答下列问题:
(1)实验室中常用70%的浓硫酸和制备,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为)______mL(保留一位小数)来配制。这种方法制备的化学方程式为______。
(2)实验中通入的作用是______。
(3)装置甲为制备的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是______。
(4)装置甲中还原的离子方程式是______。
(5)装置乙的作用是防止逸出对实验者造成毒害,则该装置中的试剂是______。
(6)若检测到制备后的溶液中,原因可能是______。
18.(14分)化合物G是一种抗炎镇痛药,其合成路线如图所示:
回答下列问题:
(1)A的化学名称是______。
(2)写出下列反应类型:A→B______,C→D______。
(3)E的结构简式是______。
(4)F中含有官能团的名称是______。
(5)一定条件下,1molG与发生加成反应,最多需要消耗______mol
(6)X是B的同分异构体,符合下列条件的X的结构简式为______。
①含苯环,且苯环上有两个取代基
②能发生银镜反应,但不能与溶液发生显色反应
③核磁共振氢谱中有五组峰
(7)根据上述流程,设计以甲苯为原料合成的路线:______(其他试剂任选)。
19.(14分)石墨烯在材料学、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。回答下列问题:
(1)构成石墨烯的元素是碳元素,基态碳原子价层电子轨道表示式为______,其中未成对电子有______个。
(2)石墨烯的结构如图所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),则石墨烯中碳原子的杂化方式为______,石墨烯导电的原因是______。
(3)石墨烯的某种氧化物的结构如图所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:______。
(4)石墨烷是石墨烯与发生加成反应的产物,完全氢化的石墨烷具有______(填“导电性”“绝缘性”或“半导体性”)。
(5)石墨烯可作电池材料。某锂离子电池的负极材料是将嵌入到两层石墨烯层中间,石墨烯层间距为ccm,其晶胞结构如图所示。其中一个晶胞的质量m=______g(用表示阿伏加德罗常数的值)。
海南省2022-2023学年高三上学期期末学业水平诊断
化学·答案
1~8小题,每小题2分,共16分。
1.C 2.A 3.C 4.B 5.C 6.A 7.B 8.D
9~14小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.AC 10.D 11.CD 12.AD 13.BD 14.D
15.(1)增大反应物的接触面积,加快反应速率,提高利用率(合理即可,2分)
(2)(2分)和(2分)
(3)(2分)
(4)坩埚、泥三角(2分)
16.(1)181.7(2分)
(2)①500(合理即可,1分)
②500K前反应未达到平衡,升高温度,反应一直正向进行;至500K左右反应达到平衡,升高温度,平衡逆向移动(合理即可,2分)
(3)①甲(1分) ②1(2分) ③如图所示(2分)
17.(1)19.4(2分)(2分)
(2)稀释防止倒吸(合理即可,2分)
(3)受热均匀、平缓,便于控制温度(合理即可,1分)
(4)(2分)
(5)NaOH溶液(合理即可,1分)
(6)溶液中的被空气中的氧化成硫酸(合理即可,2分)
18.(1)间二甲苯(或1,3-二甲苯)(1分)
(2)氧化反应(1分)取代反应(1分)
(3)(2分)
(4)酮羰基、氰基(2分)
(5)7(2分)
(6)(2分)
(7)(合理即可,3分)
19.(1)(2分)2(2分)
(2)(2分)p轨道相互平行而且相互重叠,使p轨道中的电子可在整个石墨烯中运动,通电后能定向移动(合理即可,2分)
(3)石墨烯的氧化物中含大量亲水基团(羧基、羟基),易与水形成分子间氢键,而石墨烯不含亲水基团,且是非极性结构(合理即可,2分)
(4)绝缘性(2分)
(5)(2分)
海南省2022-2023学年高三上学期期末学业水平诊断
化学
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Al 27 S 32
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与日常生活、学习密切相关,下列说法错误的是( )
A.食盐、味精的主要成分均为盐类 B.树干表面涂抹石硫合剂能预防虫害
C.学生用的铅笔芯的主要成分是Pb D.古字画不褪色的原因之一是所用的墨中含碳
2.下列有关钠、硫单质及其化合物的叙述正确的是( )
A.中阳离子与阴离子的个数比为2∶1 B.常温时,硫化钠水溶液的
C.硫在足量中燃烧生成 D.利用饱和溶液可除去中混有的HCl
3.下列实验操作方法正确的是( )
A.向试管中添加液体 B.称取21.6gNaOH C.检验装置气密性 D.分液放出下层液体
4.“价-类”二维图是学习元素化合物的重要载体,下图是短周期某一卤族元素的“价-类”二维图。下列说法正确的是( )
A.该元素是卤族元素中的氟 B.a的浓溶液分别与h、i反应均可生成b
C.c具有较强氧化性,是e的酸酐 D.酸性:d
A.电负性:N>O B.活泼性:
C.第一电离能:N>O D.熔沸点:
6.下列实验操作对应的实验现象错误的是( )
选项 实验操作 实验现象
A 向KI溶液中滴加淀粉溶液 溶液变蓝
B 向溶液中滴加NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀
C 向饱和溶液中加入少量纯碱粉末 生成白色沉淀
D 向酸性溶液中加入过量甲苯,振荡 溶液的紫红色消失
7.在2.7gAl粉中加入过量NaOH溶液,发生反应:。设代表阿伏加德罗常数的值,下列说法正确的是( )
A.溶液中的数为 B.该反应中转移的电子数为
C.该反应的氧化产物是 D.该反应中生成3.36L
8.一定温度下,在某密闭容器中的和发生下列反应,并达到平衡状态: 。下列说法正确的是( )
A.升高温度,
B.加入,平衡正向移动,平衡常数增大
C.使用合适的催化剂,可提高的平衡转化率
D.压缩容器的容积,平衡时的物质的量增大
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.某工业碱性废水中含,利用下列装置可将其转化为FeS。下列说法正确的是( )
A.Fe棒连接电源的正极 B.b电极一定是惰性材料
C.阳极反应式为 D.气体X可能是
10.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是目前形成化合物种类最多的元素,Y元素在同周期主族元素中非金属性最强,Z元素在同周期主族元素中原子半径最大,W元素原子的最外层电子数等于Y、Z元素原子的最外层电子数之差。下列判断正确的是( )
A.非金属性:X>W B.最高正化合价:Y>W
C.Z的氧化物中只含离子键 D.简单氢化物稳定性:Y>W
11.栀子苷是中草药栀子实的提取产品,可用于治疗心脑血管、肝胆等疾病及糖尿病的原料药物,其结构简式如图所示,下列有关说法正确的是( )
A.该化合物分子中含有3种官能团 B.该化合物遇溶液发生显色反应
C.该化合物分子中含8个手性碳原子 D.1mol该化合物最多与2mol发生加成反应
12.甲烷重整制备合成气的传统方法: 。厦门大学温在恭在实验室中采用作催化剂,以、、、He为原料气的同位素示踪实验结果表明,生成物的含量占CO生成总量的92.3%,氧化反应机理如图所示。下列说法正确的是( )
A.消耗等物质的量,甲烷传统重整方法比催化剂法生成的多
B.甲烷传统重整方法和催化剂上重整反应的相等
C.催化剂上与不反应
D.催化剂上甲烷重整反应存在极性键和非极性键的断裂
13.可用作金属焊接除锈剂。常温下,,下列有关说法正确的是( )
A.向纯水中加入,水的离子积增大
B.溶液中,
C.在试管中加热固体可分别收集到、HCl
D.常温下,溶液和氨水等体积混合后溶液显碱性
14.常温下,向溶液中滴加NaOH溶液,溶液中与溶液pH的关系如图所示。已知:常温下,。下列说法错误的是( )
A.随着NaOH溶液的滴入,溶液中变小
B.N点横坐标的数值为4.1
C.M点水的电离程度小于N点
D.M点存在关系:
三、非选择题:本题共5小题,共60分。
15.(10分)金属钨是一种银白色金属,主要用于优质钢的冶炼和制造钨丝等。一种以黑钨矿(主要成分是和,还含有少量杂质)为原料制备金属钨的工业流程如图所示。
已知:焙烧得到的产物的主要成分为、、、。
回答下列问题:
(1)“焙烧”时需对黑钨矿进行粉碎,其目的是______。
(2)写出“焙烧”过程中与纯碱反应的化学方程式:______。“滤渣1”的主要成分为______(填化学式)。
(3)“调pH”时发生主要反应的离子方程式为______。
(4)实验室由制备时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、______。
16.(10分)以为原料可制备绿色能源甲醇,从而实现“碳达峰”“碳中和”的承诺。制备的反应为 。回答下列问题:
(1)的燃烧热,则完全燃烧生成5.6L(标准状况)和一定量液态水时放出的热量为______kJ。
(2)在恒容密闭容器中充入一定量、的混合物,只发生上述反应,相同时间内测得容器中的浓度与反应温度(T)变化的关系如图1所示。
①该条件下,制备甲醇选取的最佳温度约为______K。
②随着温度的升高,该密闭容器中甲醇浓度先增大后减小的原因是______。
(3)以、为原料合成,除发生上述反应外,还发生反应: 。两个反应的平衡常数的自然对数()随温度倒数()变化的关系如图2所示。
①图2中,表示反应 的是直线______(填“甲”或“乙”)。
②计算1250K时,反应的平衡常数______。
③在图3中补充完成 反应过程中的能量变化曲线。
17.(12分)硫酸锰可为动植物提供微量元素,还可用作工业催化剂等。用还原可制备硫酸锰,装置如图所示(夹持装置已省略)。
回答下列问题:
(1)实验室中常用70%的浓硫酸和制备,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为)______mL(保留一位小数)来配制。这种方法制备的化学方程式为______。
(2)实验中通入的作用是______。
(3)装置甲为制备的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是______。
(4)装置甲中还原的离子方程式是______。
(5)装置乙的作用是防止逸出对实验者造成毒害,则该装置中的试剂是______。
(6)若检测到制备后的溶液中,原因可能是______。
18.(14分)化合物G是一种抗炎镇痛药,其合成路线如图所示:
回答下列问题:
(1)A的化学名称是______。
(2)写出下列反应类型:A→B______,C→D______。
(3)E的结构简式是______。
(4)F中含有官能团的名称是______。
(5)一定条件下,1molG与发生加成反应,最多需要消耗______mol
(6)X是B的同分异构体,符合下列条件的X的结构简式为______。
①含苯环,且苯环上有两个取代基
②能发生银镜反应,但不能与溶液发生显色反应
③核磁共振氢谱中有五组峰
(7)根据上述流程,设计以甲苯为原料合成的路线:______(其他试剂任选)。
19.(14分)石墨烯在材料学、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。回答下列问题:
(1)构成石墨烯的元素是碳元素,基态碳原子价层电子轨道表示式为______,其中未成对电子有______个。
(2)石墨烯的结构如图所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),则石墨烯中碳原子的杂化方式为______,石墨烯导电的原因是______。
(3)石墨烯的某种氧化物的结构如图所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:______。
(4)石墨烷是石墨烯与发生加成反应的产物,完全氢化的石墨烷具有______(填“导电性”“绝缘性”或“半导体性”)。
(5)石墨烯可作电池材料。某锂离子电池的负极材料是将嵌入到两层石墨烯层中间,石墨烯层间距为ccm,其晶胞结构如图所示。其中一个晶胞的质量m=______g(用表示阿伏加德罗常数的值)。
海南省2022-2023学年高三上学期期末学业水平诊断
化学·答案
1~8小题,每小题2分,共16分。
1.C 2.A 3.C 4.B 5.C 6.A 7.B 8.D
9~14小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.AC 10.D 11.CD 12.AD 13.BD 14.D
15.(1)增大反应物的接触面积,加快反应速率,提高利用率(合理即可,2分)
(2)(2分)和(2分)
(3)(2分)
(4)坩埚、泥三角(2分)
16.(1)181.7(2分)
(2)①500(合理即可,1分)
②500K前反应未达到平衡,升高温度,反应一直正向进行;至500K左右反应达到平衡,升高温度,平衡逆向移动(合理即可,2分)
(3)①甲(1分) ②1(2分) ③如图所示(2分)
17.(1)19.4(2分)(2分)
(2)稀释防止倒吸(合理即可,2分)
(3)受热均匀、平缓,便于控制温度(合理即可,1分)
(4)(2分)
(5)NaOH溶液(合理即可,1分)
(6)溶液中的被空气中的氧化成硫酸(合理即可,2分)
18.(1)间二甲苯(或1,3-二甲苯)(1分)
(2)氧化反应(1分)取代反应(1分)
(3)(2分)
(4)酮羰基、氰基(2分)
(5)7(2分)
(6)(2分)
(7)(合理即可,3分)
19.(1)(2分)2(2分)
(2)(2分)p轨道相互平行而且相互重叠,使p轨道中的电子可在整个石墨烯中运动,通电后能定向移动(合理即可,2分)
(3)石墨烯的氧化物中含大量亲水基团(羧基、羟基),易与水形成分子间氢键,而石墨烯不含亲水基团,且是非极性结构(合理即可,2分)
(4)绝缘性(2分)
(5)(2分)
同课章节目录
