江苏省南通市如皋市2022-2023学年高三上学期期末教学质量调研化学试题(PDF版含答案)
文档属性
| 名称 | 江苏省南通市如皋市2022-2023学年高三上学期期末教学质量调研化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-16 22:28:12 | ||
图片预览



文档简介
2022-2023学年度高三年级第一学期期末教学质量调研
化 学 试 题
总分:100分 考试时间:75分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Ce 140
单项选择题:本题包括 13 小题,每小题 3 分,共计 39 分。每小题只有一项符合题意。
1.C60属于富勒烯中的一种,其结构与足球结构相似,如下图所示。下列关于 C60说法正确
的是
A.属于烃类 B.晶体类型为共价晶体
C.与金刚石互为同素异形体 D.易溶于水
2.碱式碳酸氧钒铵晶体[(NH4)5(VO)6(CO3)4(OH)9 10H2O]是制备多种含钒产品的原料。下列
有关说法不.正.确.的是
A.NH +4的空间构型为正四面体形 B.基态 V4+的核外电子排布式为[Ar]3d1
C.CO 2-3 中 C的轨道杂化类型为 sp2杂化 D.H2O是非极性分子
3.黑火药是中国古代四大发明之一,其爆炸反应为 2KNO3+S+3C=K2S+N2↑+3CO2↑。下
列说法正确的是
A.半径:r(K+)>r(S2—) B.第一电离能:I1(N)>I1(S)
C.电负性:χ(C)>χ(O) D.酸性:H2CO3>H2SO4
阅读下列材料,完成 4~6题:含硫矿物是多种化工生产的原料,主要有硫磺、黄铁矿(FeS2)、
辉铜矿(Cu2S)、明矾[KAl(SO4)2·12H2O]、绿矾(FeSO4·7H2O)、胆矾(CuSO4·5H2O)、重晶石(BaSO4)
煅烧
等。硫磺、黄铁矿可作为工业制硫酸的原料,辉铜矿煅烧时可发生反应:Cu2S+O2====2Cu
+SO2。SO2直接排放会造成环境污染,可将其转化,或用石灰乳、H2S等物质进行回收再利
用。
4.下列硫酸盐性质与用途具有对应关系的是
A.KAl(SO4)2·12H2O能水解形成胶体,可用作净水剂
B.FeSO4具有还原性,可作治疗贫血药剂
C.CuSO4水溶液呈酸性,可用作杀菌剂
D.BaSO4难溶于水,可用于制取 BaS
5.硫及其化合物的转化具有重要作用,下列说法不.正.确.的是
A.石灰乳吸收 SO2可生成 CaSO3
B.硫磺在过量氧气中燃烧的产物是 SO3
C.用 SO2水溶液吸收海水中吹出来的溴蒸汽生成 HBr和 H2SO4
D.辉铜矿煅烧时,每消耗 1 mol O2,反应共转移 6 mol电子
6.对于反应 16H2S(g)+8SO2(g) 3S8(s)+16H2O (g) ΔH<0,下列说法正确的是
A.该反应ΔS>0
3
B.反应平衡常数 K= c (S8)
·c16(H2O)
c16(H2S)·c8(SO2)
C.其他条件一定,增大体系的压强可以增大反应的平衡转化率
D.其他条件一定,升高温度可以增大反应的平衡常数
高三化学 第 1 页 共 6 页
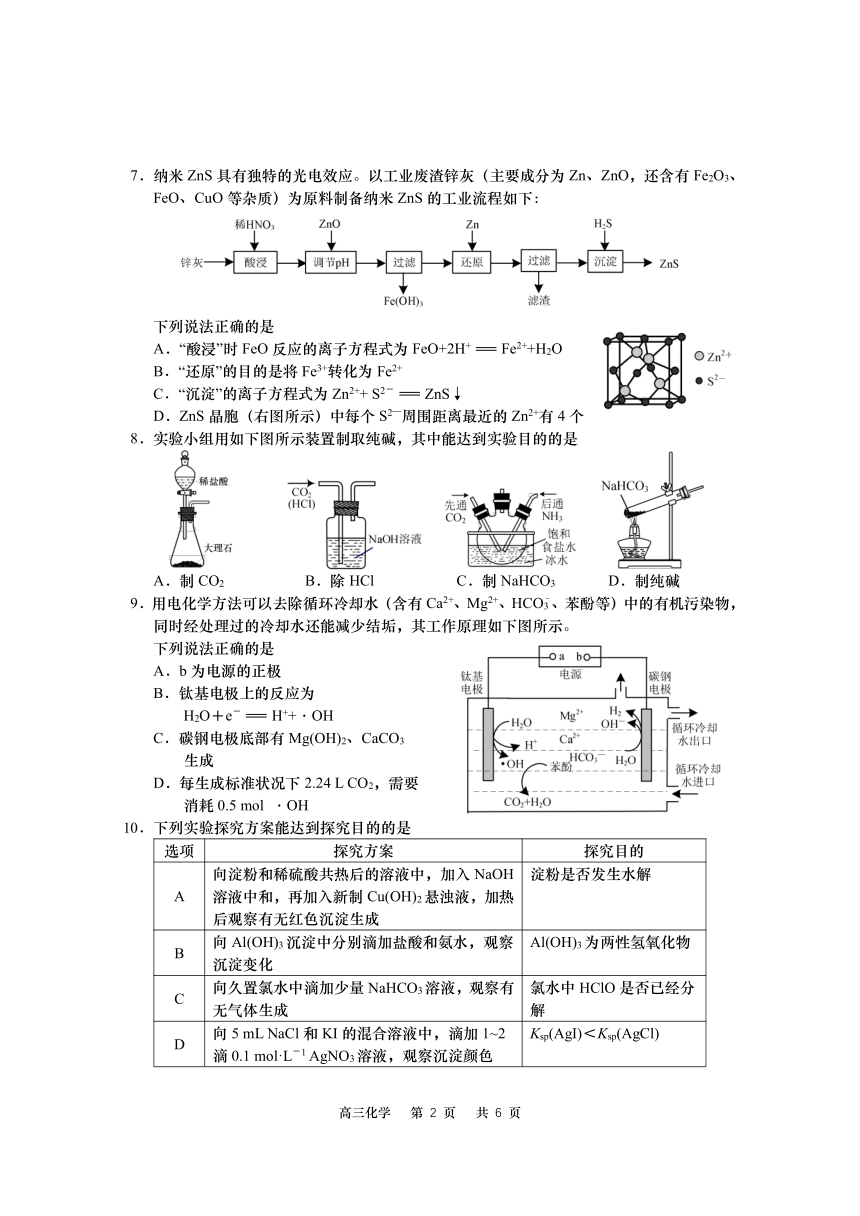
7.纳米 ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为 Zn、ZnO,还含有 Fe2O3、
FeO、CuO等杂质)为原料制备纳米 ZnS的工业流程如下:
下列说法正确的是
A.“酸浸”时 FeO反应的离子方程式为 FeO+2H+=Fe2++H2O
B.“还原”的目的是将 Fe3+转化为 Fe2+
C.“沉淀”的离子方程式为 Zn2++ S2-=ZnS↓
D.ZnS晶胞(右图所示)中每个 S2—周围距离最近的 Zn2+有 4个
8.实验小组用如下图所示装置制取纯碱,其中能达到实验目的的是
A.制 CO2 B.除 HCl C.制 NaHCO3 D.制纯碱
9.用电化学方法可以去除循环冷却水(含有 Ca2+、Mg2+、HCO-3、苯酚等)中的有机污染物,
同时经处理过的冷却水还能减少结垢,其工作原理如下图所示。
下列说法正确的是
A.b为电源的正极
B.钛基电极上的反应为
H -2O+e =H++·OH
C.碳钢电极底部有Mg(OH)2、CaCO3
生成
D.每生成标准状况下 2.24 L CO2,需要
消耗 0.5 mol ·OH
10.下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
向淀粉和稀硫酸共热后的溶液中,加入 NaOH 淀粉是否发生水解
A 溶液中和,再加入新制 Cu(OH)2悬浊液,加热
后观察有无红色沉淀生成
向 Al(OH)3沉淀中分别滴加盐酸和氨水,观察 Al(OH)3为两性氢氧化物
B
沉淀变化
向久置氯水中滴加少量 NaHCO3溶液,观察有 氯水中 HClO是否已经分
C
无气体生成 解
向 5 mL NaCl和 KI的混合溶液中,滴加 1~2 Ksp(AgI)<Ksp(AgCl)D
滴 0.1 mol·L-1AgNO3溶液,观察沉淀颜色
高三化学 第 2 页 共 6 页
11.化合物 Z是一种治疗脂蛋白紊乱的药物,其合成路线如下。下列说法不.正.确.的是
A.X分子中所有碳原子可能在同一平面
B.Y与浓硫酸共热可以发生消去反应
C.可以用 NaHCO3溶液鉴别物质 Y和 Z
D.1分子 Z中含 10个 sp2杂化的碳原子
12.某实验室回收废水中苯酚的过程如下图所示。已知:苯酚的电离常数 Ka=1.0×10-10, H2CO3
的电离常数 Ka1=4.4×10-7, Ka2=5.6×10-11。
下列有关说法正确的是
A.0.1 mol·L-1Na2CO3溶液中存在:c(OH—)+c(CO32-)=c(H+)+c(H2CO3)
B.若反应 1后溶液中存在 c(Na+)=2c(C H O-6 5 )+2c(C6H5OH),此时溶液中
c(C H O-6 5 )>c(HCO-3 )
C.反应 2通入少量 CO2时,离子方程式为 C -6H5O +CO2+H2O=C6H5OH+CO32-
D.反应 2中通入 CO2至溶液 pH=10时,此时溶液中存在 c(C -6H5O )=c(C6H5OH)
13.烷烃与 CO2耦合反应可以制取烯烃。丙烷与 CO2耦合制丙烯时发生的反应如下:
主反应:C -3H8(g) C3H6(g)+H2(g) ΔH=+123.8 kJ·mol 1
3CO2(g)+9H2(g) C3H6(g)+6H2O(g) ΔH=-250.2 kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
C3H8(g) C2H4(g)+CH4(g) ΔH=+81.3 kJ·mol-1
向装有催化剂的密闭容器中充入体积比为 1∶4的 C3H8与 CO2混合气体,其他条件一定,
反应相同时间,测得 C3H8和 CO2的转化率、C3H6和 CO的选择性与温度的关系如下图所
示。
C H 的选择性= 3n(C3H6)3 6 ×100%
3n(C3H8)反应+n(CO2)反应
n(CO)
CO的选择性= ×100%
3n(C3H8)反应+n(CO2)反应
下列说法正确的是
A.反应C2H4(g)+CH4(g)+6H2O(g) 3CO2(g)+10H2(g)
的ΔH=-292.7 kJ·mol-1
B.430℃时,容器中气体体积分数最大的气体是 C3H6
C.490℃~580℃,温度越高,容器中 C2H4的体积分数越大
D.580℃时,使用对C3H6的选择性高的催化剂,能提高平衡时C3H6的产率
高三化学 第 3 页 共 6 页
非选择题(61 分)
14.(15分)磷酸铁(FePO4)主要用于制造磷酸铁锂电池材料。以硫铁矿烧渣(主要成分是
Fe2O3,含少量 Al2O3、SiO2和 Fe3O4)为原料制备磷酸铁的工艺流程如下:
⑴焙烧。将硫铁矿烧渣与蔗糖(C12H22O11)一起焙烧,可生成 FeO与 CO2。写出焙烧时
Fe2O3所发生反应的化学方程式: ▲ 。
⑵还原。将焙烧后的固体用稀硫酸浸取,所得溶液主要含 FeSO4,还含少量 Al2(SO4)3和
Fe2(SO4)3。向酸浸后所得溶液中加入 FeS2固体,充分搅拌至溶液中 Fe3+全部被还原并
生成 SO2-4 。理论上完全反应需要消耗的 n(FeS2)∶n(Fe3+)= ▲ 。
⑶制备 FePO4。向 FeSO4溶液中加入足量的 30% H2O2溶液与 1 mol·L-1 Na2HPO4溶液,
控制溶液的 pH约为 1.5,充分反应可得 FePO4沉淀。
①写出生成 FePO4反应的化学方程式: ▲ 。
②反应 Fe3++HPO -42 =FePO4↓+H+的平衡常数 K= ▲ 。
[已知:K -sp(FePO4)=1.5×10 22,Ka1(H3PO4)=7.1×10-3,Ka2(H3PO4)=6.2×10-8,
K -a3(H3PO4)=4.5×10 13]
⑷其他条件一定,制备 FePO4时测得 Fe的有效转化率
[ n(FePO4)--n-(-F-e-)---×100%]与溶液 pH的关系如右图所示。总
①pH<1.5时,pH越大,Fe的有效转化率越大的原因
是 ▲ 。
②pH>1.5时,pH越大,Fe的有效转化率越低的原因
是 ▲ 。
15.(16分)化合物 G是一种抗肿瘤药的中间体,其合成路线如下:
⑴B的结构简式为 ▲ 。
⑵D→E的反应类型为 ▲ 反应。
⑶D→E时可能生成一种与 E互为同分异构体的副产物,该副产物的结构简式为
▲ 。
⑷B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
Ⅰ.含有苯环,能发生银镜反应;
Ⅱ.能发生水解反应,水解后的有机产物有 2种,一种具有酸性,一种具有碱性,每
种产物均含有 2种化学环境不同的氢原子。
高三化学 第 4 页 共 6 页
⑸已知:①R-X NaCN-----→R-CN(R表示烃基);
② 。
O
NH
写出以H3C N O、CH3CHO为原料制备 的合成路线流程图H3C N
O
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(18分)硝酸铈铵[(NH4)2Ce(NO3)6]、二氧化铈(CeO2)均是常见的强氧化剂,可以以 Ce2(CO3)3
为原料进行制取。
⑴“沉淀 1”时,溶液中 Ce(NO3)3转化为 Ce(OH)3(HO2)沉淀。写出沉淀 1反应的化学方程
式: ▲ 。
⑵“酸溶 2”时,控制反应温度为 80℃,硝酸与 Ce(OH)3(HO2)分解产生的 Ce(OH)4反应生
成 H2Ce(NO3)6,反应过程中有少量红棕色气体逸出。“酸溶 2”时需控制硝酸的温度为
80℃,同时将 Ce(OH)4分批加入硝酸中,原因是 ▲ 。
⑶“沉淀 2”时,控制其他条件一定,改变加入 NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉
淀的收率如题 16图-1所示。“沉淀 2”时,不是采用反应计量数之比,而是控制加入
n(NH4NO3)∶n(Ce)=4∶1的目的是 ▲ 。
题 16图-1 题 16图-2
⑷实验小组以 Ce2(CO3)3为原料制取 CeO2,请补充完整实验方案:将 Ce2(CO3)3完全溶解
于盐酸中, ▲ ,得 CeO2固体。[已知:4Ce(OH)3(白色沉淀)+O2+2H2O=
4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如题 16图-2所示。
可选用的仪器和试剂:2 mol·L-1氨水、O2、1 mol·L-1 HNO3、1 mol·L-1AgNO3溶液、
马弗炉(可用于固体的高温加热)]
⑸实验制得的硝酸铈铵(摩尔质量为 548 g·mol-1)含量可用如下方法测定:准确称取 16.0g
硝酸铈铵样品,加水充分溶解,并转移至 100 mL 容量瓶中定容、摇匀,得硝酸铈铵溶
液试样。准确量取 5 mL 的硝酸铈铵溶液试样,移入 250 mL锥形瓶中,加入适量硫酸
和磷酸,并加入 2滴 0.25%邻二氮杂菲指示剂,用 0.05000 mol·L-1硫酸亚铁铵[(NH4)2Fe
(SO4)2]标准溶液滴定至终点(滴定过程中 Ce4+被还原为 Ce3+),消耗标准溶液 24.00 mL。
计算该样品中硝酸铈铵的质量分数。
高三化学 第 5 页 共 6 页
17.(12分)铁系纳米复合材料可以去除水体中的硝酸盐污染物。
⑴Fe-Ag金属复合材料去除某 pH=2的废水中 NO -3的反应历程如题 17图-1所示(吸附
在金属复合材料表面的物种用﹡标注)。
题 17图-1 题 17图-2 题 17图-3
①题 17图-1中 NO -3的去除机理可描述为 ▲ 。
②其他条件一定,反应相同时间,溶液的 pH越大,NO -3的去除率越低的原因是
▲ 。
⑵控制其他条件一定,反应相同时间,不同 Ag负载比[ m(Ag) ×100%]的 Fe-Ag金属复
m(Fe-Ag)
合材料对 NO -3的去除率影响如题 17图-2所示。Ag负载比小于 3%时,NO -3的去除率
较低的原因是 ▲ 。
⑶其他条件一定,反应相同时间,分别用含铁质量相等的纳米铁粉、Cu负载比为 4%的
Fe-Cu金属复合材料、Ag负载比为 3%的 Fe-Ag金属复合材料去除溶液中 NO-3,反应
后残留的 NO-、生成的 NH +3 4和 N2的物质的量如题 17图-3所示。
①与其他材料相比,Fe-Ag金属复合材料去除 NO -3的优点是 ▲ 。
②用纳米铁粉去除 NO -3时,反应过程中的物种及能量变化如题 17图-4所示,用纳米
铁粉去除 NO -3时生成 N2的量极少的原因是 ▲ 。
题 17图-4
高三化学 第 6 页 共 6 页
2022-2023学年度高三年级第一学期期末教学质量调研
化学参考答案
单项选择题:本题包括 13 小题,每小题 3 分,共计 39 分。每小题只有一项符合题意。
1.2.3.4.5.6.7.8.9.10.11.12.13.
14. ⑴ 24Fe2O3+ C12H22O1148FeO+12CO2↑+11H2O(3分)
⑵1:14(2分)
⑶①2FeSO4+ H2O2+ 2Na2HPO4=2FePO4↓+ 2Na2SO4+2H2O(3分)
②3.5×109(3分)
⑷①pH<1.5时,pH + - -越大,c(H )越小,促进了 HPO 24 的电离,生成了更多的 PO43 ,
促进反应 Fe3++PO3-4 FePO4的正向进行。(或 pH<1.5时,pH +越大,c(H )越小,促进反
应 Fe3++HPO2-4 =FePO4↓+H+的正向进行)(2分)
②pH>1.5时,pH越大,c(OH—)越大,部分 Fe3+生成 Fe(OH)3(2分)
(共 15分)
15.⑴ (3分)
(2)加成(2分)
(3) (3分)
⑷ (3分)
(5)
(5分)
(共 16分)
16. ⑴2Ce(NO3)3+3H2O2+4H2O=2 Ce(OH)3(HO2)↓+6HNO3(3分)
(2)控制硝酸的温度为 80℃的目的是加快化学反应速率的同时减少硝酸的挥发和分解;
将 Ce(OH)4分批加入硝酸中,可以防止反应过于剧烈。(3分)
(3)增加 NH +4的浓度,加快反应的速率;此时(NH4)2Ce(NO3)6沉淀的收率较高(3分)
⑷向所得溶液中加入 2 mol·L-1氨水,至静置后向上层清液中加入氨水不再产生沉淀,
向浊液中边搅拌边通入 O2至沉淀完全变为黄色,洗涤滤渣,至最后一次洗涤滤液加入 1
mol·L-1 HNO3酸化后再加入 1 mol·L-1AgNO3溶液不再产生沉淀,向将沉淀放入马弗炉中,
控制温度为 500℃下焙烧至固体质量不再减少(5分)
(5)n(Fe2+)= 0.05mol·L-1×24.00×10-3L=1.2×10-3mol (1分)
Ce4++Fe2+=Fe3++ Ce3+
n(Ce4+)=1.2×10-3mol (1分)
n[(NH4)2Ce(NO3)6]=1.2×10-3mol
样品硝酸铈铵的质量分数为
1.2×10-3mol×20×548g·mol—1×100%=82.2% (2分)
16.0g
(共 18分)
17. ⑴①Fe 失去电子生成 Fe2+,H+在 Fe表面得电子生成氢原子并吸附在金属 Ag的表面;
氢原子失去电子给吸附在 Ag表面的 NO -3 和 NO-2;NO -3得电子生成 NO- -2,NO 2得电子生成
NH +4或 N2。 (3分)
②pH越大,氢离子浓度越小,得到的氢原子浓度越小,氢原子还原 NO3—、NO -2的速率越
低(2分)
⑵当 Ag 负载量小于 3%时,吸附于 Ag 表面的 NO3—较少,当 Ag负载量大于 3%时,与 Fe
反应生成并吸附于 Ag表面的氢原子较少(3分)
⑶①硝酸盐去除效率高,生成氮气较多,减少了溶液中氨氮的二次污染。(2分)
②生成 N2过程中 N原子和 NO反应生成 N2O所需的活化能较高,反应较困难,生成 N2含
量少。(2分)
(共 12分)
化 学 试 题
总分:100分 考试时间:75分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Ce 140
单项选择题:本题包括 13 小题,每小题 3 分,共计 39 分。每小题只有一项符合题意。
1.C60属于富勒烯中的一种,其结构与足球结构相似,如下图所示。下列关于 C60说法正确
的是
A.属于烃类 B.晶体类型为共价晶体
C.与金刚石互为同素异形体 D.易溶于水
2.碱式碳酸氧钒铵晶体[(NH4)5(VO)6(CO3)4(OH)9 10H2O]是制备多种含钒产品的原料。下列
有关说法不.正.确.的是
A.NH +4的空间构型为正四面体形 B.基态 V4+的核外电子排布式为[Ar]3d1
C.CO 2-3 中 C的轨道杂化类型为 sp2杂化 D.H2O是非极性分子
3.黑火药是中国古代四大发明之一,其爆炸反应为 2KNO3+S+3C=K2S+N2↑+3CO2↑。下
列说法正确的是
A.半径:r(K+)>r(S2—) B.第一电离能:I1(N)>I1(S)
C.电负性:χ(C)>χ(O) D.酸性:H2CO3>H2SO4
阅读下列材料,完成 4~6题:含硫矿物是多种化工生产的原料,主要有硫磺、黄铁矿(FeS2)、
辉铜矿(Cu2S)、明矾[KAl(SO4)2·12H2O]、绿矾(FeSO4·7H2O)、胆矾(CuSO4·5H2O)、重晶石(BaSO4)
煅烧
等。硫磺、黄铁矿可作为工业制硫酸的原料,辉铜矿煅烧时可发生反应:Cu2S+O2====2Cu
+SO2。SO2直接排放会造成环境污染,可将其转化,或用石灰乳、H2S等物质进行回收再利
用。
4.下列硫酸盐性质与用途具有对应关系的是
A.KAl(SO4)2·12H2O能水解形成胶体,可用作净水剂
B.FeSO4具有还原性,可作治疗贫血药剂
C.CuSO4水溶液呈酸性,可用作杀菌剂
D.BaSO4难溶于水,可用于制取 BaS
5.硫及其化合物的转化具有重要作用,下列说法不.正.确.的是
A.石灰乳吸收 SO2可生成 CaSO3
B.硫磺在过量氧气中燃烧的产物是 SO3
C.用 SO2水溶液吸收海水中吹出来的溴蒸汽生成 HBr和 H2SO4
D.辉铜矿煅烧时,每消耗 1 mol O2,反应共转移 6 mol电子
6.对于反应 16H2S(g)+8SO2(g) 3S8(s)+16H2O (g) ΔH<0,下列说法正确的是
A.该反应ΔS>0
3
B.反应平衡常数 K= c (S8)
·c16(H2O)
c16(H2S)·c8(SO2)
C.其他条件一定,增大体系的压强可以增大反应的平衡转化率
D.其他条件一定,升高温度可以增大反应的平衡常数
高三化学 第 1 页 共 6 页
7.纳米 ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为 Zn、ZnO,还含有 Fe2O3、
FeO、CuO等杂质)为原料制备纳米 ZnS的工业流程如下:
下列说法正确的是
A.“酸浸”时 FeO反应的离子方程式为 FeO+2H+=Fe2++H2O
B.“还原”的目的是将 Fe3+转化为 Fe2+
C.“沉淀”的离子方程式为 Zn2++ S2-=ZnS↓
D.ZnS晶胞(右图所示)中每个 S2—周围距离最近的 Zn2+有 4个
8.实验小组用如下图所示装置制取纯碱,其中能达到实验目的的是
A.制 CO2 B.除 HCl C.制 NaHCO3 D.制纯碱
9.用电化学方法可以去除循环冷却水(含有 Ca2+、Mg2+、HCO-3、苯酚等)中的有机污染物,
同时经处理过的冷却水还能减少结垢,其工作原理如下图所示。
下列说法正确的是
A.b为电源的正极
B.钛基电极上的反应为
H -2O+e =H++·OH
C.碳钢电极底部有Mg(OH)2、CaCO3
生成
D.每生成标准状况下 2.24 L CO2,需要
消耗 0.5 mol ·OH
10.下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
向淀粉和稀硫酸共热后的溶液中,加入 NaOH 淀粉是否发生水解
A 溶液中和,再加入新制 Cu(OH)2悬浊液,加热
后观察有无红色沉淀生成
向 Al(OH)3沉淀中分别滴加盐酸和氨水,观察 Al(OH)3为两性氢氧化物
B
沉淀变化
向久置氯水中滴加少量 NaHCO3溶液,观察有 氯水中 HClO是否已经分
C
无气体生成 解
向 5 mL NaCl和 KI的混合溶液中,滴加 1~2 Ksp(AgI)<Ksp(AgCl)D
滴 0.1 mol·L-1AgNO3溶液,观察沉淀颜色
高三化学 第 2 页 共 6 页
11.化合物 Z是一种治疗脂蛋白紊乱的药物,其合成路线如下。下列说法不.正.确.的是
A.X分子中所有碳原子可能在同一平面
B.Y与浓硫酸共热可以发生消去反应
C.可以用 NaHCO3溶液鉴别物质 Y和 Z
D.1分子 Z中含 10个 sp2杂化的碳原子
12.某实验室回收废水中苯酚的过程如下图所示。已知:苯酚的电离常数 Ka=1.0×10-10, H2CO3
的电离常数 Ka1=4.4×10-7, Ka2=5.6×10-11。
下列有关说法正确的是
A.0.1 mol·L-1Na2CO3溶液中存在:c(OH—)+c(CO32-)=c(H+)+c(H2CO3)
B.若反应 1后溶液中存在 c(Na+)=2c(C H O-6 5 )+2c(C6H5OH),此时溶液中
c(C H O-6 5 )>c(HCO-3 )
C.反应 2通入少量 CO2时,离子方程式为 C -6H5O +CO2+H2O=C6H5OH+CO32-
D.反应 2中通入 CO2至溶液 pH=10时,此时溶液中存在 c(C -6H5O )=c(C6H5OH)
13.烷烃与 CO2耦合反应可以制取烯烃。丙烷与 CO2耦合制丙烯时发生的反应如下:
主反应:C -3H8(g) C3H6(g)+H2(g) ΔH=+123.8 kJ·mol 1
3CO2(g)+9H2(g) C3H6(g)+6H2O(g) ΔH=-250.2 kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
C3H8(g) C2H4(g)+CH4(g) ΔH=+81.3 kJ·mol-1
向装有催化剂的密闭容器中充入体积比为 1∶4的 C3H8与 CO2混合气体,其他条件一定,
反应相同时间,测得 C3H8和 CO2的转化率、C3H6和 CO的选择性与温度的关系如下图所
示。
C H 的选择性= 3n(C3H6)3 6 ×100%
3n(C3H8)反应+n(CO2)反应
n(CO)
CO的选择性= ×100%
3n(C3H8)反应+n(CO2)反应
下列说法正确的是
A.反应C2H4(g)+CH4(g)+6H2O(g) 3CO2(g)+10H2(g)
的ΔH=-292.7 kJ·mol-1
B.430℃时,容器中气体体积分数最大的气体是 C3H6
C.490℃~580℃,温度越高,容器中 C2H4的体积分数越大
D.580℃时,使用对C3H6的选择性高的催化剂,能提高平衡时C3H6的产率
高三化学 第 3 页 共 6 页
非选择题(61 分)
14.(15分)磷酸铁(FePO4)主要用于制造磷酸铁锂电池材料。以硫铁矿烧渣(主要成分是
Fe2O3,含少量 Al2O3、SiO2和 Fe3O4)为原料制备磷酸铁的工艺流程如下:
⑴焙烧。将硫铁矿烧渣与蔗糖(C12H22O11)一起焙烧,可生成 FeO与 CO2。写出焙烧时
Fe2O3所发生反应的化学方程式: ▲ 。
⑵还原。将焙烧后的固体用稀硫酸浸取,所得溶液主要含 FeSO4,还含少量 Al2(SO4)3和
Fe2(SO4)3。向酸浸后所得溶液中加入 FeS2固体,充分搅拌至溶液中 Fe3+全部被还原并
生成 SO2-4 。理论上完全反应需要消耗的 n(FeS2)∶n(Fe3+)= ▲ 。
⑶制备 FePO4。向 FeSO4溶液中加入足量的 30% H2O2溶液与 1 mol·L-1 Na2HPO4溶液,
控制溶液的 pH约为 1.5,充分反应可得 FePO4沉淀。
①写出生成 FePO4反应的化学方程式: ▲ 。
②反应 Fe3++HPO -42 =FePO4↓+H+的平衡常数 K= ▲ 。
[已知:K -sp(FePO4)=1.5×10 22,Ka1(H3PO4)=7.1×10-3,Ka2(H3PO4)=6.2×10-8,
K -a3(H3PO4)=4.5×10 13]
⑷其他条件一定,制备 FePO4时测得 Fe的有效转化率
[ n(FePO4)--n-(-F-e-)---×100%]与溶液 pH的关系如右图所示。总
①pH<1.5时,pH越大,Fe的有效转化率越大的原因
是 ▲ 。
②pH>1.5时,pH越大,Fe的有效转化率越低的原因
是 ▲ 。
15.(16分)化合物 G是一种抗肿瘤药的中间体,其合成路线如下:
⑴B的结构简式为 ▲ 。
⑵D→E的反应类型为 ▲ 反应。
⑶D→E时可能生成一种与 E互为同分异构体的副产物,该副产物的结构简式为
▲ 。
⑷B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
Ⅰ.含有苯环,能发生银镜反应;
Ⅱ.能发生水解反应,水解后的有机产物有 2种,一种具有酸性,一种具有碱性,每
种产物均含有 2种化学环境不同的氢原子。
高三化学 第 4 页 共 6 页
⑸已知:①R-X NaCN-----→R-CN(R表示烃基);
② 。
O
NH
写出以H3C N O、CH3CHO为原料制备 的合成路线流程图H3C N
O
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(18分)硝酸铈铵[(NH4)2Ce(NO3)6]、二氧化铈(CeO2)均是常见的强氧化剂,可以以 Ce2(CO3)3
为原料进行制取。
⑴“沉淀 1”时,溶液中 Ce(NO3)3转化为 Ce(OH)3(HO2)沉淀。写出沉淀 1反应的化学方程
式: ▲ 。
⑵“酸溶 2”时,控制反应温度为 80℃,硝酸与 Ce(OH)3(HO2)分解产生的 Ce(OH)4反应生
成 H2Ce(NO3)6,反应过程中有少量红棕色气体逸出。“酸溶 2”时需控制硝酸的温度为
80℃,同时将 Ce(OH)4分批加入硝酸中,原因是 ▲ 。
⑶“沉淀 2”时,控制其他条件一定,改变加入 NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉
淀的收率如题 16图-1所示。“沉淀 2”时,不是采用反应计量数之比,而是控制加入
n(NH4NO3)∶n(Ce)=4∶1的目的是 ▲ 。
题 16图-1 题 16图-2
⑷实验小组以 Ce2(CO3)3为原料制取 CeO2,请补充完整实验方案:将 Ce2(CO3)3完全溶解
于盐酸中, ▲ ,得 CeO2固体。[已知:4Ce(OH)3(白色沉淀)+O2+2H2O=
4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如题 16图-2所示。
可选用的仪器和试剂:2 mol·L-1氨水、O2、1 mol·L-1 HNO3、1 mol·L-1AgNO3溶液、
马弗炉(可用于固体的高温加热)]
⑸实验制得的硝酸铈铵(摩尔质量为 548 g·mol-1)含量可用如下方法测定:准确称取 16.0g
硝酸铈铵样品,加水充分溶解,并转移至 100 mL 容量瓶中定容、摇匀,得硝酸铈铵溶
液试样。准确量取 5 mL 的硝酸铈铵溶液试样,移入 250 mL锥形瓶中,加入适量硫酸
和磷酸,并加入 2滴 0.25%邻二氮杂菲指示剂,用 0.05000 mol·L-1硫酸亚铁铵[(NH4)2Fe
(SO4)2]标准溶液滴定至终点(滴定过程中 Ce4+被还原为 Ce3+),消耗标准溶液 24.00 mL。
计算该样品中硝酸铈铵的质量分数。
高三化学 第 5 页 共 6 页
17.(12分)铁系纳米复合材料可以去除水体中的硝酸盐污染物。
⑴Fe-Ag金属复合材料去除某 pH=2的废水中 NO -3的反应历程如题 17图-1所示(吸附
在金属复合材料表面的物种用﹡标注)。
题 17图-1 题 17图-2 题 17图-3
①题 17图-1中 NO -3的去除机理可描述为 ▲ 。
②其他条件一定,反应相同时间,溶液的 pH越大,NO -3的去除率越低的原因是
▲ 。
⑵控制其他条件一定,反应相同时间,不同 Ag负载比[ m(Ag) ×100%]的 Fe-Ag金属复
m(Fe-Ag)
合材料对 NO -3的去除率影响如题 17图-2所示。Ag负载比小于 3%时,NO -3的去除率
较低的原因是 ▲ 。
⑶其他条件一定,反应相同时间,分别用含铁质量相等的纳米铁粉、Cu负载比为 4%的
Fe-Cu金属复合材料、Ag负载比为 3%的 Fe-Ag金属复合材料去除溶液中 NO-3,反应
后残留的 NO-、生成的 NH +3 4和 N2的物质的量如题 17图-3所示。
①与其他材料相比,Fe-Ag金属复合材料去除 NO -3的优点是 ▲ 。
②用纳米铁粉去除 NO -3时,反应过程中的物种及能量变化如题 17图-4所示,用纳米
铁粉去除 NO -3时生成 N2的量极少的原因是 ▲ 。
题 17图-4
高三化学 第 6 页 共 6 页
2022-2023学年度高三年级第一学期期末教学质量调研
化学参考答案
单项选择题:本题包括 13 小题,每小题 3 分,共计 39 分。每小题只有一项符合题意。
1.2.3.4.5.6.7.8.9.10.11.12.13.
14. ⑴ 24Fe2O3+ C12H22O1148FeO+12CO2↑+11H2O(3分)
⑵1:14(2分)
⑶①2FeSO4+ H2O2+ 2Na2HPO4=2FePO4↓+ 2Na2SO4+2H2O(3分)
②3.5×109(3分)
⑷①pH<1.5时,pH + - -越大,c(H )越小,促进了 HPO 24 的电离,生成了更多的 PO43 ,
促进反应 Fe3++PO3-4 FePO4的正向进行。(或 pH<1.5时,pH +越大,c(H )越小,促进反
应 Fe3++HPO2-4 =FePO4↓+H+的正向进行)(2分)
②pH>1.5时,pH越大,c(OH—)越大,部分 Fe3+生成 Fe(OH)3(2分)
(共 15分)
15.⑴ (3分)
(2)加成(2分)
(3) (3分)
⑷ (3分)
(5)
(5分)
(共 16分)
16. ⑴2Ce(NO3)3+3H2O2+4H2O=2 Ce(OH)3(HO2)↓+6HNO3(3分)
(2)控制硝酸的温度为 80℃的目的是加快化学反应速率的同时减少硝酸的挥发和分解;
将 Ce(OH)4分批加入硝酸中,可以防止反应过于剧烈。(3分)
(3)增加 NH +4的浓度,加快反应的速率;此时(NH4)2Ce(NO3)6沉淀的收率较高(3分)
⑷向所得溶液中加入 2 mol·L-1氨水,至静置后向上层清液中加入氨水不再产生沉淀,
向浊液中边搅拌边通入 O2至沉淀完全变为黄色,洗涤滤渣,至最后一次洗涤滤液加入 1
mol·L-1 HNO3酸化后再加入 1 mol·L-1AgNO3溶液不再产生沉淀,向将沉淀放入马弗炉中,
控制温度为 500℃下焙烧至固体质量不再减少(5分)
(5)n(Fe2+)= 0.05mol·L-1×24.00×10-3L=1.2×10-3mol (1分)
Ce4++Fe2+=Fe3++ Ce3+
n(Ce4+)=1.2×10-3mol (1分)
n[(NH4)2Ce(NO3)6]=1.2×10-3mol
样品硝酸铈铵的质量分数为
1.2×10-3mol×20×548g·mol—1×100%=82.2% (2分)
16.0g
(共 18分)
17. ⑴①Fe 失去电子生成 Fe2+,H+在 Fe表面得电子生成氢原子并吸附在金属 Ag的表面;
氢原子失去电子给吸附在 Ag表面的 NO -3 和 NO-2;NO -3得电子生成 NO- -2,NO 2得电子生成
NH +4或 N2。 (3分)
②pH越大,氢离子浓度越小,得到的氢原子浓度越小,氢原子还原 NO3—、NO -2的速率越
低(2分)
⑵当 Ag 负载量小于 3%时,吸附于 Ag 表面的 NO3—较少,当 Ag负载量大于 3%时,与 Fe
反应生成并吸附于 Ag表面的氢原子较少(3分)
⑶①硝酸盐去除效率高,生成氮气较多,减少了溶液中氨氮的二次污染。(2分)
②生成 N2过程中 N原子和 NO反应生成 N2O所需的活化能较高,反应较困难,生成 N2含
量少。(2分)
(共 12分)
同课章节目录
