四川省内江市名校2022-2023学年九年级下学期入学考试化学试卷(Word版含答案)
文档属性
| 名称 | 四川省内江市名校2022-2023学年九年级下学期入学考试化学试卷(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 219.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 16:38:03 | ||
图片预览


文档简介
内江市名校2022-2023学年九年级下学期入学考试
化学试卷
可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40
一、单选题(共每小题3分,共36分)
1.下列历史典故中发生了化学变化的是( )
A.杯弓蛇影 B.火烧赤壁 C.刻舟求剑 D.破釜沉舟
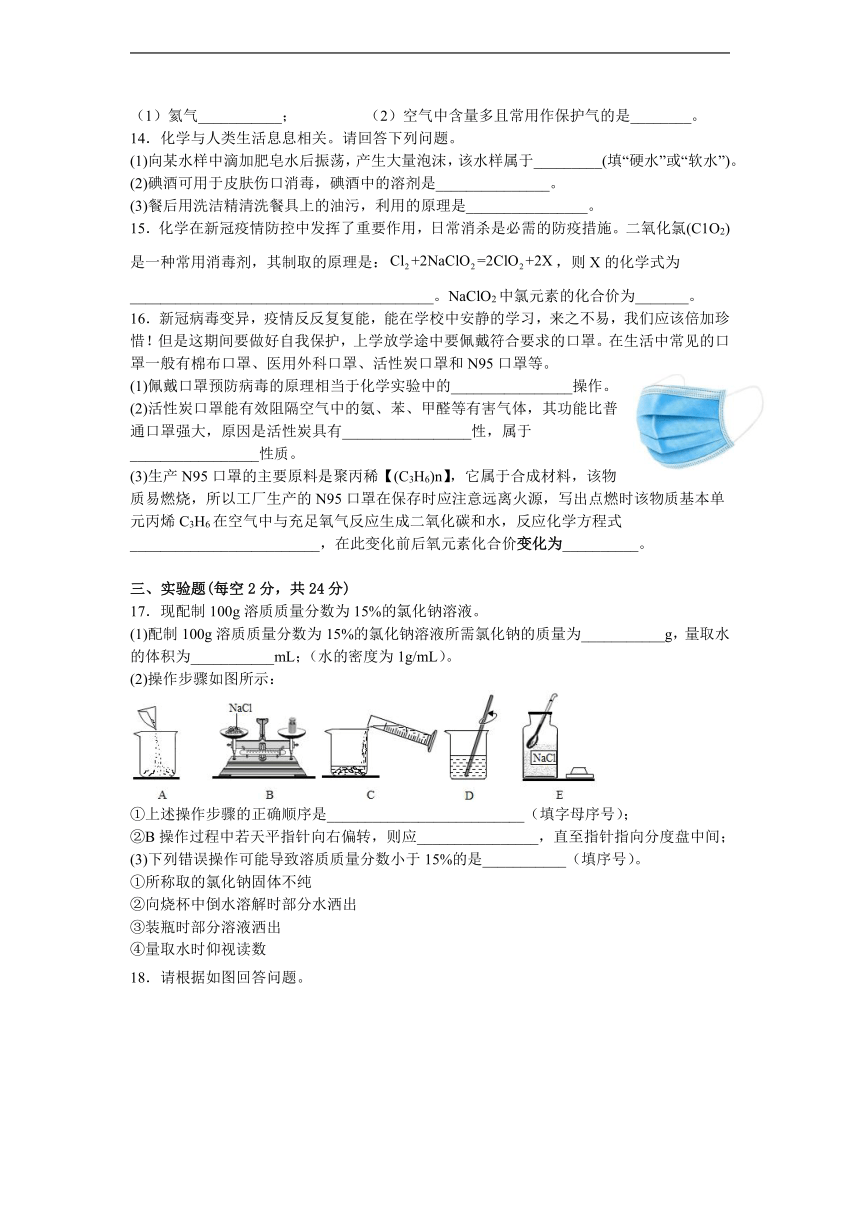
2.学习化学的一个重要途径是科学探究,实验是科学探究的重要手段,下列化学实验操作正确的是( )
A.闻药品气味 B.给液体加热 C. 量取液体 D. 过滤
3.物质的性质决定其用途,下列因果关系不成立的是( )
A.金刚石硬度大,可用于切割玻璃
B.氧气具有氧化性,可作为燃料
C.稀有气体通电能发不同颜色光,用作霓虹灯
D.氮气的化学性质不活泼,可用于填充灯泡
4. 下列有关饱和溶液说法正确的是( )
A.饱和溶液浓度一定比不饱和溶液的大
B.不饱和溶液转化为饱和溶液,溶质的质量一定增大
C.降温时,饱和溶液可能不析出固体
D.饱和澄清石灰水加入少量生石灰,恢复到原来温度,石灰水溶液质量增大
5.冠心病是老年人经常出现的一种心血管疾病,心酮胺是医学上治疗冠心病的主要药物,心酮胺的化学式为C19H 23NO3,下列说法错误的是( )
A.每个心酮胺分子46个原子构成
B.心酮胺由4种元素组成
C.心酮胺中各元素的质量比为19:23:1:3
D.心酮胺中氮元素质量分数最小
6.下列有关化学用语的描述,正确的是( )
A.2H表示两个氢分子
B.CO2中数字“2”表示两个氧原子
C.Fe2+表示铁元素的化合价为+2价
D.如图粒子结构示意图表示一种阳离子
7.金属钛被誉为“未来金属”,在航天、航空、精密仪器等方面有广阔前景。下图是钛元素在元素周期表中的信息。则下列说法不正确的是( )
A.钛元素的相对原子质量为47.87 B.钛属于金属元素
C.钛离子Ti3+中含有19个电子 D.钛原子的中子数为22
8.已知离子的核外电子数为18,其相对原子质量为35,则R的中子数为( )
A.16 B.17 C.18 D.19
9.高铁酸钾是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其化学式是 K2FeO4,根据化学式可推算出其中铁元素的化合价为( )
A.+3 B.+2 C.+4 D.+6
10.下图是测定空气中氧气体积分数的实验装置图,下列说法正确的是( )
A.图I中,红磷燃烧产生大量的白色烟雾
B.图I中,红磷熄灭后可立即打开弹簧夹
C.图Ⅱ中来回推动针筒活塞的目的是调节装置气压
D.图Ⅱ与图I装置比较,测定结果更准确
11.下图为制备有机物X的微观过程。下列说法正确的是( )
A.反应前后分子和原子的数目都不变
B.有机物X的化学式CH3O
C.该反应有元素化合价的改变
D.参加反应的和分子个数比为4:1
12.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质质量如图所示,下列说法错误的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 2 1 15
反应后质量/g 15 22 1 X
A.甲一定是单质 B.X的值为0
C.参加反应的甲、丁的质量比为1:3 D.该反应属于化合反应
二、填空题(每空2分,共24分)
13.写出下列微粒的化学符号或化学符号中数字的含义:
(1)氦气___________; (2)空气中含量多且常用作保护气的是________。
14.化学与人类生活息息相关。请回答下列问题。
(1)向某水样中滴加肥皂水后振荡,产生大量泡沫,该水样属于_________(填“硬水”或“软水”)。
(2)碘酒可用于皮肤伤口消毒,碘酒中的溶剂是_______________。
(3)餐后用洗洁精清洗餐具上的油污,利用的原理是________________。
15.化学在新冠疫情防控中发挥了重要作用,日常消杀是必需的防疫措施。二氧化氯(C1O2)是一种常用消毒剂,其制取的原理是:,则X的化学式为________________________________________。NaClO2中氯元素的化合价为_______。
16.新冠病毒变异,疫情反反复复能,能在学校中安静的学习,来之不易,我们应该倍加珍惜!但是这期间要做好自我保护,上学放学途中要佩戴符合要求的口罩。在生活中常见的口罩一般有棉布口罩、医用外科口罩、活性炭口罩和N95口罩等。
(1)佩戴口罩预防病毒的原理相当于化学实验中的________________操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有_________________性,属于_________________性质。
(3)生产N95口罩的主要原料是聚丙稀【(C3H6)n】,它属于合成材料,该物质易燃烧,所以工厂生产的N95口罩在保存时应注意远离火源,写出点燃时该物质基本单元丙烯C3H6在空气中与充足氧气反应生成二氧化碳和水,反应化学方程式_________________________,在此变化前后氧元素化合价变化为__________。
三、实验题(每空2分,共24分)
17.现配制100g溶质质量分数为15%的氯化钠溶液。
(1)配制100g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为___________g,量取水的体积为___________mL;(水的密度为1g/mL)。
(2)操作步骤如图所示:
①上述操作步骤的正确顺序是__________________________(填字母序号);
②B操作过程中若天平指针向右偏转,则应________________,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是___________(填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水洒出
③装瓶时部分溶液洒出
④量取水时仰视读数
18.请根据如图回答问题。
(1)仪器①的名称是____________。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为_______________________________________。若用图E装置收集氧气,当观察到导管口的气泡____________________时,再把导管伸入盛满水的集气瓶口。
(3)用收集的氧气完成木炭燃烧的实验(如图F所示),观察到的现象是_____________________________,该反应属于________________反应(反应类型)。
(4)通常状况下,甲烷是一种无色无味的气体,难溶于水,密度比空气小。实验室常用醋酸钠和碱石灰两种固体混合物加热制得甲烷气体。制取甲烷的发生装置可选用________(填字母,下同),收集装置可选用__________。
四、科学探究题(每空2分,共10分)
19.实验是进行科学探究的重要方式。某同学设计如下图所示实验,探究二氧化碳的有关性质。请填空:
(1)实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是____________________,该反应的化学方程式是_________________________。(2)实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第_____(填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是_____________________。
(4)实验3中说明二氧化碳所具有的性质为________________________________________。
五、计算题(共8分)
20.鸡蛋壳的主要成分是碳酸钙(其他成分不与水和盐酸反应)。在鸡蛋壳中加入了一定量的稀盐酸后,恰好完全反应,数据如下图所示。请回答下列问题:
(1)生成二氧化碳的质量为_______
(2)计算鸡蛋壳中碳酸钙的质量分数
试卷第4页,共4页
参考答案:
一、单选题(共每小题3分,共36分)
1-5:B、A、B、C、C 6-10:D、D、C、D、D| 11-12:C、A
二、填空题(每空2分,共24分)
13. (1)He (2)N2
14. (1)软水 (2)酒精 (3)乳化作用
15. NaCl +3
16. (1)过滤
(2)吸附 物理
(3) 0价变为-2价
三、实验题(每空2分,共24分)
17. (1) 15 85
(2) EBACD 增加氯化钠
(3)①④
18. (1) 锥形瓶
(2) 连续均匀冒出
(3) 燃烧更旺、发出白光 化合
(4) A D或E
四、科学探究题(每空2分,共10分)
19. (1) 纸花由紫色变成红色 CO+H2O=H2CO3
(2) ④ 二氧化碳的密度比空气大 二氧化碳的密度大于空气,不能燃烧也不能支持燃烧
五、计算题(共6分)
20. (1)8.8g;````````````````````````````````````````````(1’)
(2)解:设参加反应的碳酸钙质量为x
碳酸钙的质量分数为:
答:鸡蛋壳中碳酸钙的质量分数80%。
化学试卷
可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40
一、单选题(共每小题3分,共36分)
1.下列历史典故中发生了化学变化的是( )
A.杯弓蛇影 B.火烧赤壁 C.刻舟求剑 D.破釜沉舟
2.学习化学的一个重要途径是科学探究,实验是科学探究的重要手段,下列化学实验操作正确的是( )
A.闻药品气味 B.给液体加热 C. 量取液体 D. 过滤
3.物质的性质决定其用途,下列因果关系不成立的是( )
A.金刚石硬度大,可用于切割玻璃
B.氧气具有氧化性,可作为燃料
C.稀有气体通电能发不同颜色光,用作霓虹灯
D.氮气的化学性质不活泼,可用于填充灯泡
4. 下列有关饱和溶液说法正确的是( )
A.饱和溶液浓度一定比不饱和溶液的大
B.不饱和溶液转化为饱和溶液,溶质的质量一定增大
C.降温时,饱和溶液可能不析出固体
D.饱和澄清石灰水加入少量生石灰,恢复到原来温度,石灰水溶液质量增大
5.冠心病是老年人经常出现的一种心血管疾病,心酮胺是医学上治疗冠心病的主要药物,心酮胺的化学式为C19H 23NO3,下列说法错误的是( )
A.每个心酮胺分子46个原子构成
B.心酮胺由4种元素组成
C.心酮胺中各元素的质量比为19:23:1:3
D.心酮胺中氮元素质量分数最小
6.下列有关化学用语的描述,正确的是( )
A.2H表示两个氢分子
B.CO2中数字“2”表示两个氧原子
C.Fe2+表示铁元素的化合价为+2价
D.如图粒子结构示意图表示一种阳离子
7.金属钛被誉为“未来金属”,在航天、航空、精密仪器等方面有广阔前景。下图是钛元素在元素周期表中的信息。则下列说法不正确的是( )
A.钛元素的相对原子质量为47.87 B.钛属于金属元素
C.钛离子Ti3+中含有19个电子 D.钛原子的中子数为22
8.已知离子的核外电子数为18,其相对原子质量为35,则R的中子数为( )
A.16 B.17 C.18 D.19
9.高铁酸钾是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其化学式是 K2FeO4,根据化学式可推算出其中铁元素的化合价为( )
A.+3 B.+2 C.+4 D.+6
10.下图是测定空气中氧气体积分数的实验装置图,下列说法正确的是( )
A.图I中,红磷燃烧产生大量的白色烟雾
B.图I中,红磷熄灭后可立即打开弹簧夹
C.图Ⅱ中来回推动针筒活塞的目的是调节装置气压
D.图Ⅱ与图I装置比较,测定结果更准确
11.下图为制备有机物X的微观过程。下列说法正确的是( )
A.反应前后分子和原子的数目都不变
B.有机物X的化学式CH3O
C.该反应有元素化合价的改变
D.参加反应的和分子个数比为4:1
12.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质质量如图所示,下列说法错误的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 2 1 15
反应后质量/g 15 22 1 X
A.甲一定是单质 B.X的值为0
C.参加反应的甲、丁的质量比为1:3 D.该反应属于化合反应
二、填空题(每空2分,共24分)
13.写出下列微粒的化学符号或化学符号中数字的含义:
(1)氦气___________; (2)空气中含量多且常用作保护气的是________。
14.化学与人类生活息息相关。请回答下列问题。
(1)向某水样中滴加肥皂水后振荡,产生大量泡沫,该水样属于_________(填“硬水”或“软水”)。
(2)碘酒可用于皮肤伤口消毒,碘酒中的溶剂是_______________。
(3)餐后用洗洁精清洗餐具上的油污,利用的原理是________________。
15.化学在新冠疫情防控中发挥了重要作用,日常消杀是必需的防疫措施。二氧化氯(C1O2)是一种常用消毒剂,其制取的原理是:,则X的化学式为________________________________________。NaClO2中氯元素的化合价为_______。
16.新冠病毒变异,疫情反反复复能,能在学校中安静的学习,来之不易,我们应该倍加珍惜!但是这期间要做好自我保护,上学放学途中要佩戴符合要求的口罩。在生活中常见的口罩一般有棉布口罩、医用外科口罩、活性炭口罩和N95口罩等。
(1)佩戴口罩预防病毒的原理相当于化学实验中的________________操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有_________________性,属于_________________性质。
(3)生产N95口罩的主要原料是聚丙稀【(C3H6)n】,它属于合成材料,该物质易燃烧,所以工厂生产的N95口罩在保存时应注意远离火源,写出点燃时该物质基本单元丙烯C3H6在空气中与充足氧气反应生成二氧化碳和水,反应化学方程式_________________________,在此变化前后氧元素化合价变化为__________。
三、实验题(每空2分,共24分)
17.现配制100g溶质质量分数为15%的氯化钠溶液。
(1)配制100g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为___________g,量取水的体积为___________mL;(水的密度为1g/mL)。
(2)操作步骤如图所示:
①上述操作步骤的正确顺序是__________________________(填字母序号);
②B操作过程中若天平指针向右偏转,则应________________,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是___________(填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水洒出
③装瓶时部分溶液洒出
④量取水时仰视读数
18.请根据如图回答问题。
(1)仪器①的名称是____________。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为_______________________________________。若用图E装置收集氧气,当观察到导管口的气泡____________________时,再把导管伸入盛满水的集气瓶口。
(3)用收集的氧气完成木炭燃烧的实验(如图F所示),观察到的现象是_____________________________,该反应属于________________反应(反应类型)。
(4)通常状况下,甲烷是一种无色无味的气体,难溶于水,密度比空气小。实验室常用醋酸钠和碱石灰两种固体混合物加热制得甲烷气体。制取甲烷的发生装置可选用________(填字母,下同),收集装置可选用__________。
四、科学探究题(每空2分,共10分)
19.实验是进行科学探究的重要方式。某同学设计如下图所示实验,探究二氧化碳的有关性质。请填空:
(1)实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是____________________,该反应的化学方程式是_________________________。(2)实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第_____(填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是_____________________。
(4)实验3中说明二氧化碳所具有的性质为________________________________________。
五、计算题(共8分)
20.鸡蛋壳的主要成分是碳酸钙(其他成分不与水和盐酸反应)。在鸡蛋壳中加入了一定量的稀盐酸后,恰好完全反应,数据如下图所示。请回答下列问题:
(1)生成二氧化碳的质量为_______
(2)计算鸡蛋壳中碳酸钙的质量分数
试卷第4页,共4页
参考答案:
一、单选题(共每小题3分,共36分)
1-5:B、A、B、C、C 6-10:D、D、C、D、D| 11-12:C、A
二、填空题(每空2分,共24分)
13. (1)He (2)N2
14. (1)软水 (2)酒精 (3)乳化作用
15. NaCl +3
16. (1)过滤
(2)吸附 物理
(3) 0价变为-2价
三、实验题(每空2分,共24分)
17. (1) 15 85
(2) EBACD 增加氯化钠
(3)①④
18. (1) 锥形瓶
(2) 连续均匀冒出
(3) 燃烧更旺、发出白光 化合
(4) A D或E
四、科学探究题(每空2分,共10分)
19. (1) 纸花由紫色变成红色 CO+H2O=H2CO3
(2) ④ 二氧化碳的密度比空气大 二氧化碳的密度大于空气,不能燃烧也不能支持燃烧
五、计算题(共6分)
20. (1)8.8g;````````````````````````````````````````````(1’)
(2)解:设参加反应的碳酸钙质量为x
碳酸钙的质量分数为:
答:鸡蛋壳中碳酸钙的质量分数80%。
同课章节目录
