新疆昌吉州行知高级中学校2022-2023学年高三上学期期末考试化学试题(含答案)
文档属性
| 名称 | 新疆昌吉州行知高级中学校2022-2023学年高三上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 08:59:20 | ||
图片预览



文档简介
行知高级中学校2022-2023学年高三上学期期末考试
化学
可能用到的相对原子量:H-1 D-2 C-12 O-16 N-14 Na-23 P-31 S--32 Cl-35.5 Ni-59 Cu-64 Zn-65 Br-80 Cd-112 Cr-52
一、选择题(本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。)
1.【单选题】《本草图经》有关“不灰木”有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”主要成分可能是( )
A.纤维素
B.硅酸盐
C.氧化铁
D.蛋白质
2.【单选题】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.10gD218O中含有的中子数为6NA
B.标准状况下,11.2LHF含有的分子数为0.5NA
C.向100mL0.2mol/L的醋酸溶液中加入醋酸钠固体至溶液恰好呈中性,C(CH3COO-)=C(Na+)
D.1L0.1mol·L-1的K2Cr2O7溶液中C2O的数目为0.1NA
3 【单选题】下列有关物质性质,说法正确的是( )
A. 电解熔融Al2O3可以得到Al
B. 铁与碘反应易生成碘化铁
C. 用生石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D. 青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式表示为Al2O3 SiO2 2H2O
4. 【单选题】常温下,下列离子一定能大量存在于相应溶液中的是( )
A. 能使淀粉-KI试纸变蓝色的溶液:Na+、NH、S2-、Cl-
B. 能使酚酞变深红色的溶液:K+、Ba2+、NO、HCO
C. 能使Al转化为AlO的溶液:Na+、K+、NO、Cl-
D. 水电离出的c(OH-)=1×10-13mol L-1的溶液:K+、Na+、CO、Cl-
5. 【单选题】利用下列装置进行实验;操作规范且能达到实验目的的是( )
装置①配制0.10mol●L-1NaCl溶液
B.装置②蒸干CuSO4溶液得到CuSO4●5H2O固体
装置③收集SO2并吸收尾气
D.装置④验证C、Cl、Si的非金属性强弱
6. 【单选题】下列离子方程式中,对事实的表述正确的是( )
A. NH4HCO3溶液中加入足量NaOH溶液:HCO+OH-=CO+H2O
B. 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
D. 过量小苏打与澄清石灰水:2HCO+2OH-+Ca2+=CaCO3↓+CO+2H2O
7. 【单选题】下列与实验相关的叙述正确的是( )
A. 碳酸钠溶液应保存在带有玻璃塞的试剂瓶中
B. 将氯化铁溶液直接加热蒸干制得氯化铁晶体
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+,无K+
D. 配制0.1mol/L的H2SO4溶液,用量筒量取浓硫酸时,仰视读数,使结果偏高
8. 【单选题】将过量的CO2分别通入下列溶液中:①CaCl2溶液②Na2SiO3溶液③Ca(ClO)2溶液④饱和Na2CO3溶液,最终溶液中有白色沉淀析出的是( )
A. ①②③④
B. ②④
C. ①②③
D. ②③④
9. 【单选题】下列实验操作和实验现象不相匹配的是( )
实验操作 实验现象
A 将一小块钠投入硫酸铜溶液中 有气泡冒出,产生蓝色沉淀
B 将Na2O2加入适量水中,滴入几滴酚酞 溶液先变红后褪色,有气泡产生
C 向重铬酸钾溶液中滴加几滴浓硫酸 随着浓硫酸加入,溶液颜色变浅
D 将铜丝在盛满氯气的烧瓶中点燃 烧瓶中充满棕黄色的烟
10.【单选题】NO2和N2O4存在平衡:2NO2(g)N2O4(g) ΔH <0。下列分析正确的是( )
A.1 mol平衡混合气体中含1 mol N原子
B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
11.【单选题】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程表示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
12. 【单选题】如图为电解饱和食盐水的装置,下列有关说法不正确的是( )
A.左侧电极上发生氧化反应
B.右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C.电解一段时间后,B口排出NaOH溶液
D.电解饱和食盐水的离子方程式:2Cl- + 2H2O === 2OH- + Cl2 ↑+H2↑
13. 【单选题】下列实验方案设计中,能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Fe2+具有还原性 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,观察到KMnO4溶液紫色褪去
B 探究浓度对化学反应速率的影响 用两支试管各取5mL0.2mol/L的H2C2O4(草酸)溶液,分别加入5mL0.1mol/L和0.2mol/L的KMnO4溶液,记录溶液褪色所需的时间
C 证明淀粉在酸性条件下发生了水解 向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再加入新制Cu(OH)2溶液共热,产生砖红色沉淀
D 证明AgI可以转化成为Ag2S 向1mL0.2mol/LAgNO3溶液中滴加1mL0.1mol/LKI溶液产生黄色沉淀,向所得浊液中再滴加0.1mol/LNa2S溶液,生成黑色沉淀
14. 【单选题】常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
第II卷(非选择题,共52分)
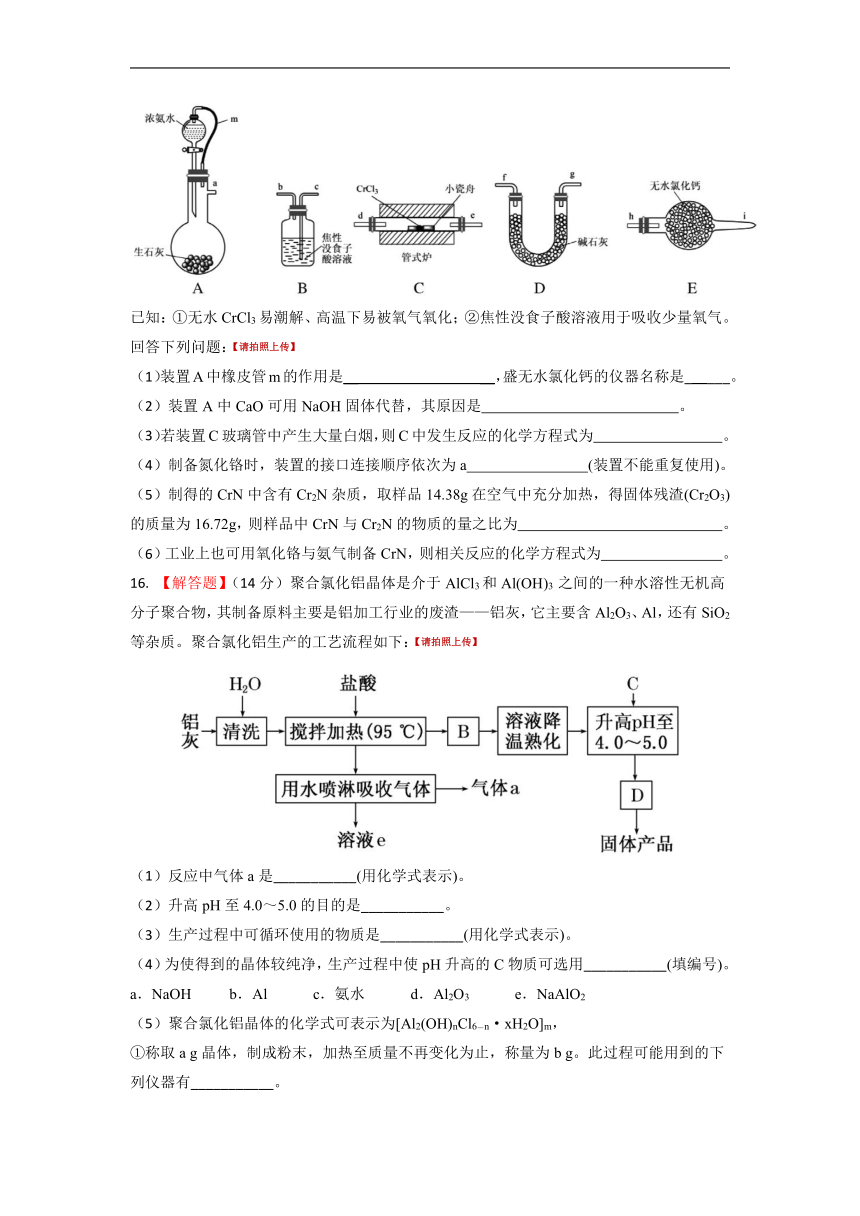
15. 【解答题】(12分)氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:【请拍照上传】
(1)装置A中橡皮管m的作用是__ __,盛无水氯化钙的仪器名称是_ ___。
(2)装置A中CaO可用NaOH固体代替,其原因是 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为 。
(4)制备氮化铬时,装置的接口连接顺序依次为a (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为 。
16. 【解答题】(14分)聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:【请拍照上传】
(1)反应中气体a是___________(用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________。
(3)生产过程中可循环使用的物质是___________(用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________(填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________(填试剂名称),C操作为___________(填操作名称)
17. 【解答题】(14分)我国的能源以煤炭为主,燃煤烟气中等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。【请拍照上传】
(1)已知常温常压下,的燃烧热为,CO(g)的燃烧热为,则CO还原脱除:_______。
(2)在某温度时,进行CO还原脱除:。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是_______。
B.CO与SO2的浓度之比不再改变
容器内的压强不再改变
D.的值不再改变
②若控制进料比(物质的量)为4∶1,反应达平衡时,混合气体中的体积分数为5%,则该反应在此温度下的平衡常数为_______。
(3)已知:N2(g)+3H2(g)2NH3(g) ΔH <0。在密闭容器中,充入2 mol N2和6 mol H2使之发生反应:
①当反应达到平衡时,N2和H2的转化率之比是____________。
②当达到平衡时,保持体积不变充入氩气,平衡将________(填“向左”“向右”或“不”,下同)移动。
③当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减半,平衡将________移动。
④在密闭容器中进行反应2NO(g)+O2(g)2NO2(g) ΔH <0。该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是________(填字母)。
a.在t1~t2时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
18.【解答题】(10分)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:【请拍照上传】
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为________________________________________________。
(3)当乙池中B电极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况下),丙池中 (A B C D)电极析出 g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”)。
行知高级中学校2022-2023学年高三上学期期末考试
化学 答案
可能用到的相对原子量:H-1 D-2 C-12 O-16 N-14 Na-23 P-31 S--32 Cl-35.5 Ni-59 Cu-64 Zn-65 Br-80 Cd-112 Cr-52
一、选择题(本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。)
1.【单选题】《本草图经》有关“不灰木”有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”主要成分可能是( )
A.纤维素
B.硅酸盐
C.氧化铁
D.蛋白质
答案:B
难易程度:易
2.【单选题】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.10gD218O中含有的中子数为6NA
B.标准状况下,11.2LHF含有的分子数为0.5NA
C.向100mL0.2mol/L的醋酸溶液中加入醋酸钠固体至溶液恰好呈中性,C(CH3COO-)=C(Na+)
D.1L0.1mol·L-1的K2Cr2O7溶液中C2O的数目为0.1NA
答案:C
难易程度:易
3 【单选题】下列有关物质性质,说法正确的是( )
A. 电解熔融Al2O3可以得到Al
B. 铁与碘反应易生成碘化铁
C. 用生石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D. 青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式表示为Al2O3 SiO2 2H2O
答案:A
难易程度:易
4. 【单选题】常温下,下列离子一定能大量存在于相应溶液中的是( )
A. 能使淀粉-KI试纸变蓝色的溶液:Na+、NH、S2-、Cl-
B. 能使酚酞变深红色的溶液:K+、Ba2+、NO、HCO
C. 能使Al转化为AlO的溶液:Na+、K+、NO、Cl-
D. 水电离出的c(OH-)=1×10-13mol L-1的溶液:K+、Na+、CO、Cl-
答案:C
难易程度:易
5. 【单选题】利用下列装置进行实验;操作规范且能达到实验目的的是( )
装置①配制0.10mol●L-1NaCl溶液
B.装置②蒸干CuSO4溶液得到CuSO4●5H2O固体
装置③收集SO2并吸收尾气
D.装置④验证C、Cl、Si的非金属性强弱
答案:C
难易程度:易
6. 【单选题】下列离子方程式中,对事实的表述正确的是( )
A. NH4HCO3溶液中加入足量NaOH溶液:HCO+OH-=CO+H2O
B. 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
D. 过量小苏打与澄清石灰水:2HCO+2OH-+Ca2+=CaCO3↓+CO+2H2O
答案:D
难易程度:中
7. 【单选题】下列与实验相关的叙述正确的是( )
A. 碳酸钠溶液应保存在带有玻璃塞的试剂瓶中
B. 将氯化铁溶液直接加热蒸干制得氯化铁晶体
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+,无K+
D. 配制0.1mol/L的H2SO4溶液,用量筒量取浓硫酸时,仰视读数,使结果偏高
答案:D
难易程度:中
8. 【单选题】将过量的CO2分别通入下列溶液中:①CaCl2溶液②Na2SiO3溶液③Ca(ClO)2溶液④饱和Na2CO3溶液,最终溶液中有白色沉淀析出的是( )
A. ①②③④
B. ②④
C. ①②③
D. ②③④
答案:B
难易程度:中
9. 【单选题】下列实验操作和实验现象不相匹配的是( )
实验操作 实验现象
A 将一小块钠投入硫酸铜溶液中 有气泡冒出,产生蓝色沉淀
B 将Na2O2加入适量水中,滴入几滴酚酞 溶液先变红后褪色,有气泡产生
C 向重铬酸钾溶液中滴加几滴浓硫酸 随着浓硫酸加入,溶液颜色变浅
D 将铜丝在盛满氯气的烧瓶中点燃 烧瓶中充满棕黄色的烟
答案:C
难易程度:中
10.【单选题】NO2和N2O4存在平衡:2NO2(g)N2O4(g) ΔH <0。下列分析正确的是( )
A.1 mol平衡混合气体中含1 mol N原子
B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
答案:B
难易程度:难
11.【单选题】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程表示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
答案:D
难易程度:中
12. 【单选题】如图为电解饱和食盐水的装置,下列有关说法不正确的是( )
A.左侧电极上发生氧化反应
B.右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C.电解一段时间后,B口排出NaOH溶液
D.电解饱和食盐水的离子方程式:2Cl- + 2H2O === 2OH- + Cl2 ↑+H2↑
答案:B
难易程度:难
13. 【单选题】下列实验方案设计中,能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Fe2+具有还原性 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,观察到KMnO4溶液紫色褪去
B 探究浓度对化学反应速率的影响 用两支试管各取5mL0.2mol/L的H2C2O4(草酸)溶液,分别加入5mL0.1mol/L和0.2mol/L的KMnO4溶液,记录溶液褪色所需的时间
C 证明淀粉在酸性条件下发生了水解 向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再加入新制Cu(OH)2溶液共热,产生砖红色沉淀
D 证明AgI可以转化成为Ag2S 向1mL0.2mol/LAgNO3溶液中滴加1mL0.1mol/LKI溶液产生黄色沉淀,向所得浊液中再滴加0.1mol/LNa2S溶液,生成黑色沉淀
答案:C
难易程度:难
14. 【单选题】常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
答案:C
难易程度:难
第II卷(非选择题,共52分)
15. 【解答题】(12分)氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:【请拍照上传】
(1)装置A中橡皮管m的作用是__ __,盛无水氯化钙的仪器名称是_ ___。
(2)装置A中CaO可用NaOH固体代替,其原因是 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为 。
(4)制备氮化铬时,装置的接口连接顺序依次为a (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为 。
答案:(1)①平衡气压,便于液体流下的作用 ②球形干燥管
(2)NaOH溶于水放热,且电离出OH-,促使NH3 H2O分解生成NH3
(3)4NH3+CrCl3CrN+3NH4Cl
(4)acbfgdehi
(5)20:1 (6)Cr2O3+2NH32CrN+3H2O
难易程度:中
16. 【解答题】(14分)聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:【请拍照上传】
(1)反应中气体a是___________(用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________。
(3)生产过程中可循环使用的物质是___________(用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________(填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________(填试剂名称),C操作为___________(填操作名称)
答案:(1)H2 (2)促进AlCl3的水解,使晶体析出
(3)HCl (4)bd
(5)①. bc ②. 硝酸 ③. 过滤、洗涤
难易程度:中
17. 【解答题】(14分)我国的能源以煤炭为主,燃煤烟气中等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。【请拍照上传】
(1)已知常温常压下,的燃烧热为,CO(g)的燃烧热为,则CO还原脱除:_______。
(2)在某温度时,进行CO还原脱除:。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是_______。
B.CO与SO2的浓度之比不再改变
容器内的压强不再改变
D.的值不再改变
②若控制进料比(物质的量)为4∶1,反应达平衡时,混合气体中的体积分数为5%,则该反应在此温度下的平衡常数为_______。
(3)已知:N2(g)+3H2(g)2NH3(g) ΔH <0。在密闭容器中,充入2 mol N2和6 mol H2使之发生反应:
①当反应达到平衡时,N2和H2的转化率之比是____________。
②当达到平衡时,保持体积不变充入氩气,平衡将________(填“向左”“向右”或“不”,下同)移动。
③当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减半,平衡将________移动。
④在密闭容器中进行反应2NO(g)+O2(g)2NO2(g) ΔH <0。该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是________(填字母)。
a.在t1~t2时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
答案:(1)-268.8kJ/mol
(2) ①. AD ②. 1.08
(3)①1∶1 ②不 ③向左 ④a
难易程度:中
18.【解答题】(10分)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:【请拍照上传】
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为________________________________________________。
(3)当乙池中B电极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况下),丙池中 (A B C D)电极析出 g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”)。
答案:(1)原电池 CH3OH-6e-+8OH-===CO+6H2O
(2)阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3)280. D 1.60
(4)减小 增大
难易程度:难
化学
可能用到的相对原子量:H-1 D-2 C-12 O-16 N-14 Na-23 P-31 S--32 Cl-35.5 Ni-59 Cu-64 Zn-65 Br-80 Cd-112 Cr-52
一、选择题(本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。)
1.【单选题】《本草图经》有关“不灰木”有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”主要成分可能是( )
A.纤维素
B.硅酸盐
C.氧化铁
D.蛋白质
2.【单选题】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.10gD218O中含有的中子数为6NA
B.标准状况下,11.2LHF含有的分子数为0.5NA
C.向100mL0.2mol/L的醋酸溶液中加入醋酸钠固体至溶液恰好呈中性,C(CH3COO-)=C(Na+)
D.1L0.1mol·L-1的K2Cr2O7溶液中C2O的数目为0.1NA
3 【单选题】下列有关物质性质,说法正确的是( )
A. 电解熔融Al2O3可以得到Al
B. 铁与碘反应易生成碘化铁
C. 用生石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D. 青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式表示为Al2O3 SiO2 2H2O
4. 【单选题】常温下,下列离子一定能大量存在于相应溶液中的是( )
A. 能使淀粉-KI试纸变蓝色的溶液:Na+、NH、S2-、Cl-
B. 能使酚酞变深红色的溶液:K+、Ba2+、NO、HCO
C. 能使Al转化为AlO的溶液:Na+、K+、NO、Cl-
D. 水电离出的c(OH-)=1×10-13mol L-1的溶液:K+、Na+、CO、Cl-
5. 【单选题】利用下列装置进行实验;操作规范且能达到实验目的的是( )
装置①配制0.10mol●L-1NaCl溶液
B.装置②蒸干CuSO4溶液得到CuSO4●5H2O固体
装置③收集SO2并吸收尾气
D.装置④验证C、Cl、Si的非金属性强弱
6. 【单选题】下列离子方程式中,对事实的表述正确的是( )
A. NH4HCO3溶液中加入足量NaOH溶液:HCO+OH-=CO+H2O
B. 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
D. 过量小苏打与澄清石灰水:2HCO+2OH-+Ca2+=CaCO3↓+CO+2H2O
7. 【单选题】下列与实验相关的叙述正确的是( )
A. 碳酸钠溶液应保存在带有玻璃塞的试剂瓶中
B. 将氯化铁溶液直接加热蒸干制得氯化铁晶体
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+,无K+
D. 配制0.1mol/L的H2SO4溶液,用量筒量取浓硫酸时,仰视读数,使结果偏高
8. 【单选题】将过量的CO2分别通入下列溶液中:①CaCl2溶液②Na2SiO3溶液③Ca(ClO)2溶液④饱和Na2CO3溶液,最终溶液中有白色沉淀析出的是( )
A. ①②③④
B. ②④
C. ①②③
D. ②③④
9. 【单选题】下列实验操作和实验现象不相匹配的是( )
实验操作 实验现象
A 将一小块钠投入硫酸铜溶液中 有气泡冒出,产生蓝色沉淀
B 将Na2O2加入适量水中,滴入几滴酚酞 溶液先变红后褪色,有气泡产生
C 向重铬酸钾溶液中滴加几滴浓硫酸 随着浓硫酸加入,溶液颜色变浅
D 将铜丝在盛满氯气的烧瓶中点燃 烧瓶中充满棕黄色的烟
10.【单选题】NO2和N2O4存在平衡:2NO2(g)N2O4(g) ΔH <0。下列分析正确的是( )
A.1 mol平衡混合气体中含1 mol N原子
B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
11.【单选题】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程表示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
12. 【单选题】如图为电解饱和食盐水的装置,下列有关说法不正确的是( )
A.左侧电极上发生氧化反应
B.右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C.电解一段时间后,B口排出NaOH溶液
D.电解饱和食盐水的离子方程式:2Cl- + 2H2O === 2OH- + Cl2 ↑+H2↑
13. 【单选题】下列实验方案设计中,能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Fe2+具有还原性 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,观察到KMnO4溶液紫色褪去
B 探究浓度对化学反应速率的影响 用两支试管各取5mL0.2mol/L的H2C2O4(草酸)溶液,分别加入5mL0.1mol/L和0.2mol/L的KMnO4溶液,记录溶液褪色所需的时间
C 证明淀粉在酸性条件下发生了水解 向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再加入新制Cu(OH)2溶液共热,产生砖红色沉淀
D 证明AgI可以转化成为Ag2S 向1mL0.2mol/LAgNO3溶液中滴加1mL0.1mol/LKI溶液产生黄色沉淀,向所得浊液中再滴加0.1mol/LNa2S溶液,生成黑色沉淀
14. 【单选题】常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
第II卷(非选择题,共52分)
15. 【解答题】(12分)氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:【请拍照上传】
(1)装置A中橡皮管m的作用是__ __,盛无水氯化钙的仪器名称是_ ___。
(2)装置A中CaO可用NaOH固体代替,其原因是 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为 。
(4)制备氮化铬时,装置的接口连接顺序依次为a (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为 。
16. 【解答题】(14分)聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:【请拍照上传】
(1)反应中气体a是___________(用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________。
(3)生产过程中可循环使用的物质是___________(用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________(填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________(填试剂名称),C操作为___________(填操作名称)
17. 【解答题】(14分)我国的能源以煤炭为主,燃煤烟气中等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。【请拍照上传】
(1)已知常温常压下,的燃烧热为,CO(g)的燃烧热为,则CO还原脱除:_______。
(2)在某温度时,进行CO还原脱除:。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是_______。
B.CO与SO2的浓度之比不再改变
容器内的压强不再改变
D.的值不再改变
②若控制进料比(物质的量)为4∶1,反应达平衡时,混合气体中的体积分数为5%,则该反应在此温度下的平衡常数为_______。
(3)已知:N2(g)+3H2(g)2NH3(g) ΔH <0。在密闭容器中,充入2 mol N2和6 mol H2使之发生反应:
①当反应达到平衡时,N2和H2的转化率之比是____________。
②当达到平衡时,保持体积不变充入氩气,平衡将________(填“向左”“向右”或“不”,下同)移动。
③当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减半,平衡将________移动。
④在密闭容器中进行反应2NO(g)+O2(g)2NO2(g) ΔH <0。该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是________(填字母)。
a.在t1~t2时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
18.【解答题】(10分)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:【请拍照上传】
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为________________________________________________。
(3)当乙池中B电极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况下),丙池中 (A B C D)电极析出 g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”)。
行知高级中学校2022-2023学年高三上学期期末考试
化学 答案
可能用到的相对原子量:H-1 D-2 C-12 O-16 N-14 Na-23 P-31 S--32 Cl-35.5 Ni-59 Cu-64 Zn-65 Br-80 Cd-112 Cr-52
一、选择题(本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。)
1.【单选题】《本草图经》有关“不灰木”有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”主要成分可能是( )
A.纤维素
B.硅酸盐
C.氧化铁
D.蛋白质
答案:B
难易程度:易
2.【单选题】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.10gD218O中含有的中子数为6NA
B.标准状况下,11.2LHF含有的分子数为0.5NA
C.向100mL0.2mol/L的醋酸溶液中加入醋酸钠固体至溶液恰好呈中性,C(CH3COO-)=C(Na+)
D.1L0.1mol·L-1的K2Cr2O7溶液中C2O的数目为0.1NA
答案:C
难易程度:易
3 【单选题】下列有关物质性质,说法正确的是( )
A. 电解熔融Al2O3可以得到Al
B. 铁与碘反应易生成碘化铁
C. 用生石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D. 青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式表示为Al2O3 SiO2 2H2O
答案:A
难易程度:易
4. 【单选题】常温下,下列离子一定能大量存在于相应溶液中的是( )
A. 能使淀粉-KI试纸变蓝色的溶液:Na+、NH、S2-、Cl-
B. 能使酚酞变深红色的溶液:K+、Ba2+、NO、HCO
C. 能使Al转化为AlO的溶液:Na+、K+、NO、Cl-
D. 水电离出的c(OH-)=1×10-13mol L-1的溶液:K+、Na+、CO、Cl-
答案:C
难易程度:易
5. 【单选题】利用下列装置进行实验;操作规范且能达到实验目的的是( )
装置①配制0.10mol●L-1NaCl溶液
B.装置②蒸干CuSO4溶液得到CuSO4●5H2O固体
装置③收集SO2并吸收尾气
D.装置④验证C、Cl、Si的非金属性强弱
答案:C
难易程度:易
6. 【单选题】下列离子方程式中,对事实的表述正确的是( )
A. NH4HCO3溶液中加入足量NaOH溶液:HCO+OH-=CO+H2O
B. 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
D. 过量小苏打与澄清石灰水:2HCO+2OH-+Ca2+=CaCO3↓+CO+2H2O
答案:D
难易程度:中
7. 【单选题】下列与实验相关的叙述正确的是( )
A. 碳酸钠溶液应保存在带有玻璃塞的试剂瓶中
B. 将氯化铁溶液直接加热蒸干制得氯化铁晶体
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+,无K+
D. 配制0.1mol/L的H2SO4溶液,用量筒量取浓硫酸时,仰视读数,使结果偏高
答案:D
难易程度:中
8. 【单选题】将过量的CO2分别通入下列溶液中:①CaCl2溶液②Na2SiO3溶液③Ca(ClO)2溶液④饱和Na2CO3溶液,最终溶液中有白色沉淀析出的是( )
A. ①②③④
B. ②④
C. ①②③
D. ②③④
答案:B
难易程度:中
9. 【单选题】下列实验操作和实验现象不相匹配的是( )
实验操作 实验现象
A 将一小块钠投入硫酸铜溶液中 有气泡冒出,产生蓝色沉淀
B 将Na2O2加入适量水中,滴入几滴酚酞 溶液先变红后褪色,有气泡产生
C 向重铬酸钾溶液中滴加几滴浓硫酸 随着浓硫酸加入,溶液颜色变浅
D 将铜丝在盛满氯气的烧瓶中点燃 烧瓶中充满棕黄色的烟
答案:C
难易程度:中
10.【单选题】NO2和N2O4存在平衡:2NO2(g)N2O4(g) ΔH <0。下列分析正确的是( )
A.1 mol平衡混合气体中含1 mol N原子
B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
答案:B
难易程度:难
11.【单选题】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程表示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
答案:D
难易程度:中
12. 【单选题】如图为电解饱和食盐水的装置,下列有关说法不正确的是( )
A.左侧电极上发生氧化反应
B.右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C.电解一段时间后,B口排出NaOH溶液
D.电解饱和食盐水的离子方程式:2Cl- + 2H2O === 2OH- + Cl2 ↑+H2↑
答案:B
难易程度:难
13. 【单选题】下列实验方案设计中,能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Fe2+具有还原性 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,观察到KMnO4溶液紫色褪去
B 探究浓度对化学反应速率的影响 用两支试管各取5mL0.2mol/L的H2C2O4(草酸)溶液,分别加入5mL0.1mol/L和0.2mol/L的KMnO4溶液,记录溶液褪色所需的时间
C 证明淀粉在酸性条件下发生了水解 向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再加入新制Cu(OH)2溶液共热,产生砖红色沉淀
D 证明AgI可以转化成为Ag2S 向1mL0.2mol/LAgNO3溶液中滴加1mL0.1mol/LKI溶液产生黄色沉淀,向所得浊液中再滴加0.1mol/LNa2S溶液,生成黑色沉淀
答案:C
难易程度:难
14. 【单选题】常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
答案:C
难易程度:难
第II卷(非选择题,共52分)
15. 【解答题】(12分)氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:【请拍照上传】
(1)装置A中橡皮管m的作用是__ __,盛无水氯化钙的仪器名称是_ ___。
(2)装置A中CaO可用NaOH固体代替,其原因是 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为 。
(4)制备氮化铬时,装置的接口连接顺序依次为a (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为 。
答案:(1)①平衡气压,便于液体流下的作用 ②球形干燥管
(2)NaOH溶于水放热,且电离出OH-,促使NH3 H2O分解生成NH3
(3)4NH3+CrCl3CrN+3NH4Cl
(4)acbfgdehi
(5)20:1 (6)Cr2O3+2NH32CrN+3H2O
难易程度:中
16. 【解答题】(14分)聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:【请拍照上传】
(1)反应中气体a是___________(用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________。
(3)生产过程中可循环使用的物质是___________(用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________(填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________(填试剂名称),C操作为___________(填操作名称)
答案:(1)H2 (2)促进AlCl3的水解,使晶体析出
(3)HCl (4)bd
(5)①. bc ②. 硝酸 ③. 过滤、洗涤
难易程度:中
17. 【解答题】(14分)我国的能源以煤炭为主,燃煤烟气中等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。【请拍照上传】
(1)已知常温常压下,的燃烧热为,CO(g)的燃烧热为,则CO还原脱除:_______。
(2)在某温度时,进行CO还原脱除:。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是_______。
B.CO与SO2的浓度之比不再改变
容器内的压强不再改变
D.的值不再改变
②若控制进料比(物质的量)为4∶1,反应达平衡时,混合气体中的体积分数为5%,则该反应在此温度下的平衡常数为_______。
(3)已知:N2(g)+3H2(g)2NH3(g) ΔH <0。在密闭容器中,充入2 mol N2和6 mol H2使之发生反应:
①当反应达到平衡时,N2和H2的转化率之比是____________。
②当达到平衡时,保持体积不变充入氩气,平衡将________(填“向左”“向右”或“不”,下同)移动。
③当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减半,平衡将________移动。
④在密闭容器中进行反应2NO(g)+O2(g)2NO2(g) ΔH <0。该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是________(填字母)。
a.在t1~t2时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
答案:(1)-268.8kJ/mol
(2) ①. AD ②. 1.08
(3)①1∶1 ②不 ③向左 ④a
难易程度:中
18.【解答题】(10分)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:【请拍照上传】
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为________________________________________________。
(3)当乙池中B电极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况下),丙池中 (A B C D)电极析出 g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”)。
答案:(1)原电池 CH3OH-6e-+8OH-===CO+6H2O
(2)阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3)280. D 1.60
(4)减小 增大
难易程度:难
同课章节目录
