河北省唐山市2022-2023学年高三上学期期末学业水平调研考试化学试题(含答案)
文档属性
| 名称 | 河北省唐山市2022-2023学年高三上学期期末学业水平调研考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 15:05:14 | ||
图片预览

文档简介
唐山市2022-2023学年高三上学期期末学业水平调研考试
化学
可能用到的相对原子质量:H1 C12 O16 F19 Na23 K39 Ca 40
Ⅰ卷(共43分)
一、单项选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
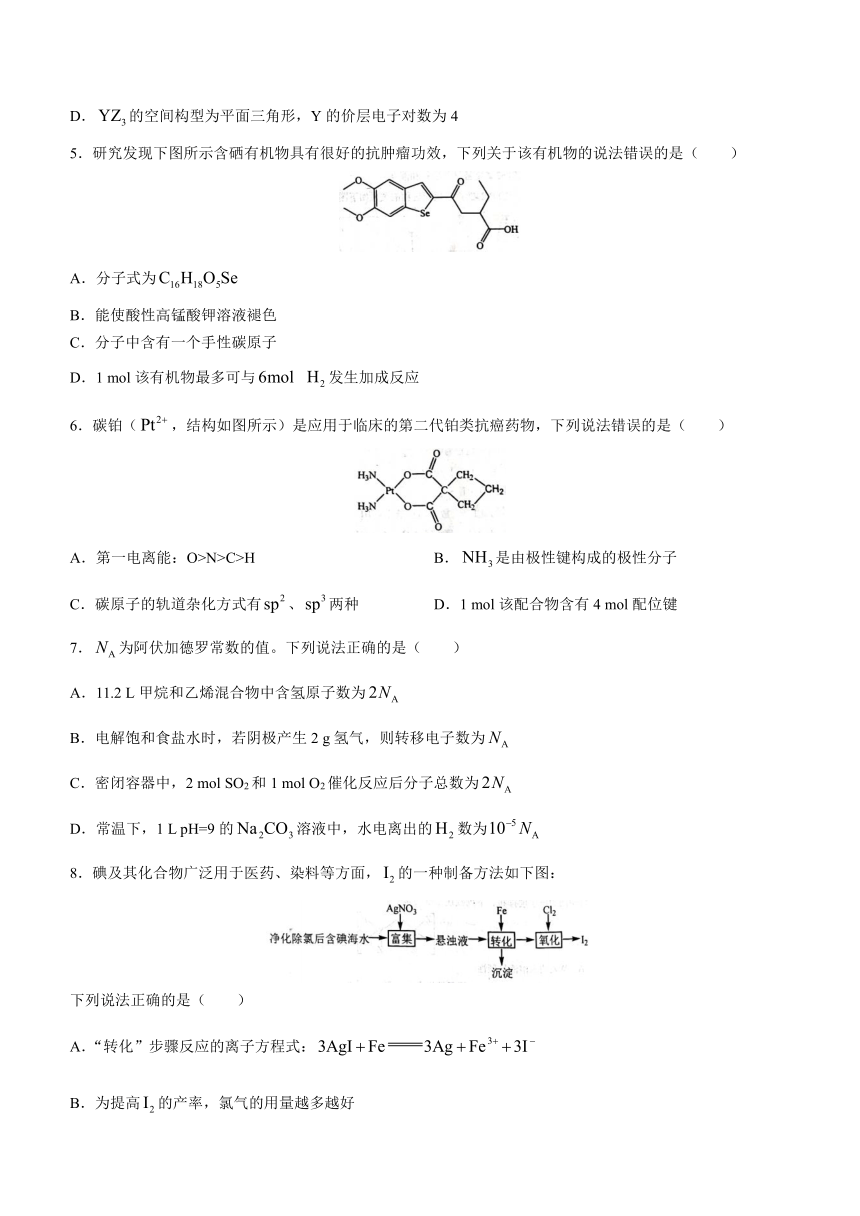
1.化学在人类社会发展中发挥着重要作用,下列说法错误的是( )
A.明矾是常用的净水剂,向海水中加入明矾可以使海水淡化
B.药物合成中,常将胺类药物转化为铵盐,增加药物的稳定性
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.人的手汗中含有多种氨基酸,遇茚三酮溶液显紫色,可用于指纹检验
2.下列化学用语正确的是( )
A.基态Cr原子的价电子排布式: B.二氧化碳的球棍模型:
C.甲酸甲酯的结构简式: D.2,2,4-三甲基-3-戊烯的键线式:
3.配制480 mL 0.1 mol·L-1的溶液,部分实验操作示意图如下:
下列说法正确的是( )
A.需称量5.1 g 固体 B.上述实验操作步骤的正确顺序为③①②④
C.将容量瓶洗涤干净,须干燥后才可使用 D.定容时仰视刻度线,使溶液浓度偏高
4.科学家合成出一种新化合物(如图所示),其中W、X、Y、乙四种元素,X、Y、乙为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,W与Z的简单离子具有相同的电子层排布。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.是共价化合物,X原子轨道杂化类型为杂化
C.原子半径大小顺序为:W>Z>Y>X
D.的空间构型为平面三角形,Y的价层电子对数为4
5.研究发现下图所示含硒有机物具有很好的抗肿瘤功效,下列关于该有机物的说法错误的是( )
A.分子式为
B.能使酸性高锰酸钾溶液褪色
C.分子中含有一个手性碳原子
D.1 mol该有机物最多可与 发生加成反应
6.碳铂(,结构如图所示)是应用于临床的第二代铂类抗癌药物,下列说法错误的是( )
A.第一电离能:O>N>C>H B.是由极性键构成的极性分子
C.碳原子的轨道杂化方式有、两种 D.1 mol该配合物含有4 mol配位键
7.为阿伏加德罗常数的值。下列说法正确的是( )
A.11.2 L甲烷和乙烯混合物中含氢原子数为
B.电解饱和食盐水时,若阴极产生2 g氢气,则转移电子数为
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为
D.常温下,1 L pH=9的溶液中,水电离出的数为
8.碘及其化合物广泛用于医药、染料等方面,的一种制备方法如下图:
下列说法正确的是( )
A.“转化”步骤反应的离子方程式:
B.为提高的产率,氯气的用量越多越好
C.所得沉淀与硝酸反应后的某种生成物可以循环使用
D.流程中过滤时玻璃仪器只需烧杯和漏斗
9.反应物S转化为产物P的能量与反应进程的关系如下图所示:
下列说法正确的是( )
A.S·X→P·X的转化过程为吸热过程
B.平衡时P的产率:Ⅰ=Ⅱ=Ⅲ
C.生成P的速率:Ⅲ>Ⅱ>Ⅰ
D.生成相同物质的量的P,放出的热量Ⅰ>Ⅲ>Ⅱ
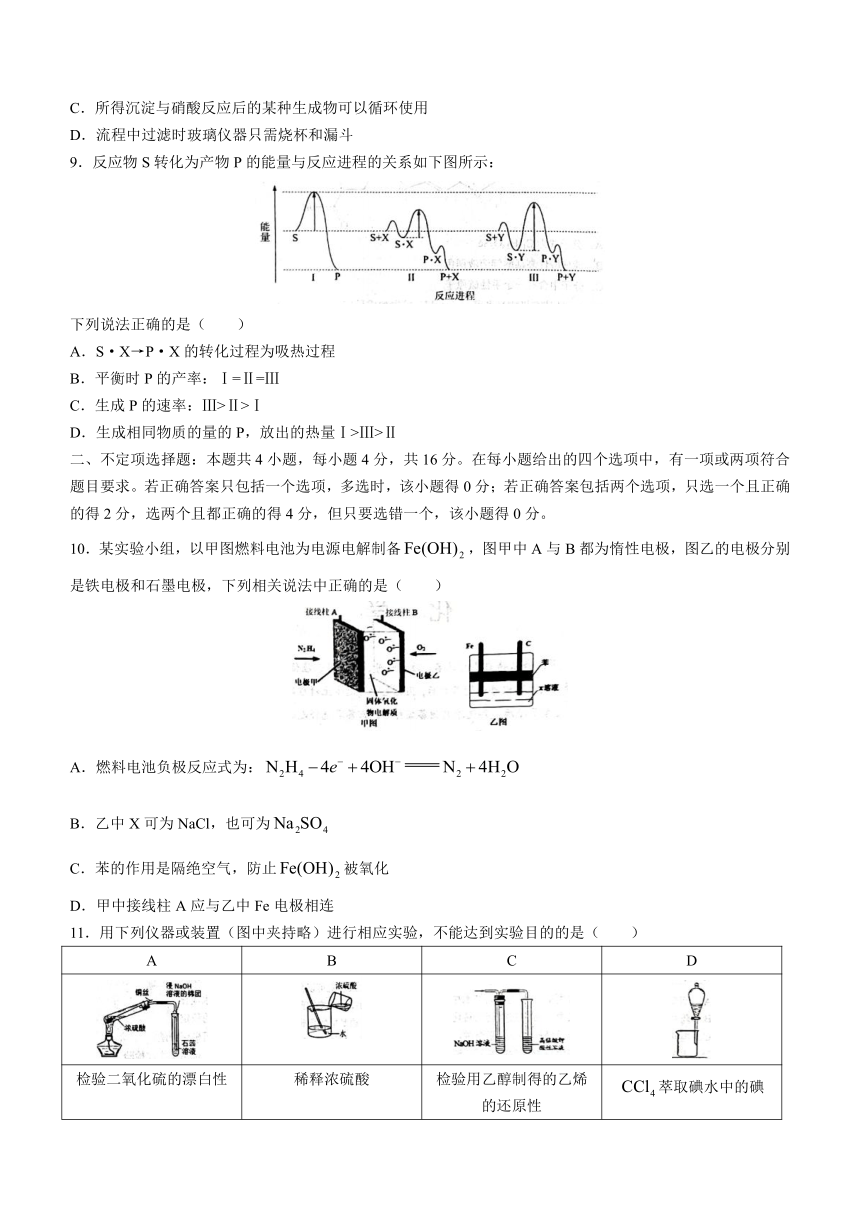
二、不定项选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
10.某实验小组,以甲图燃料电池为电源电解制备,图甲中A与B都为惰性电极,图乙的电极分别是铁电极和石墨电极,下列相关说法中正确的是( )
A.燃料电池负极反应式为:
B.乙中X可为NaCl,也可为
C.苯的作用是隔绝空气,防止被氧化
D.甲中接线柱A应与乙中Fe电极相连
11.用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是( )
A B C D
检验二氧化硫的漂白性 稀释浓硫酸 检验用乙醇制得的乙烯的还原性 萃取碘水中的碘
A.A B.B C.C D.D
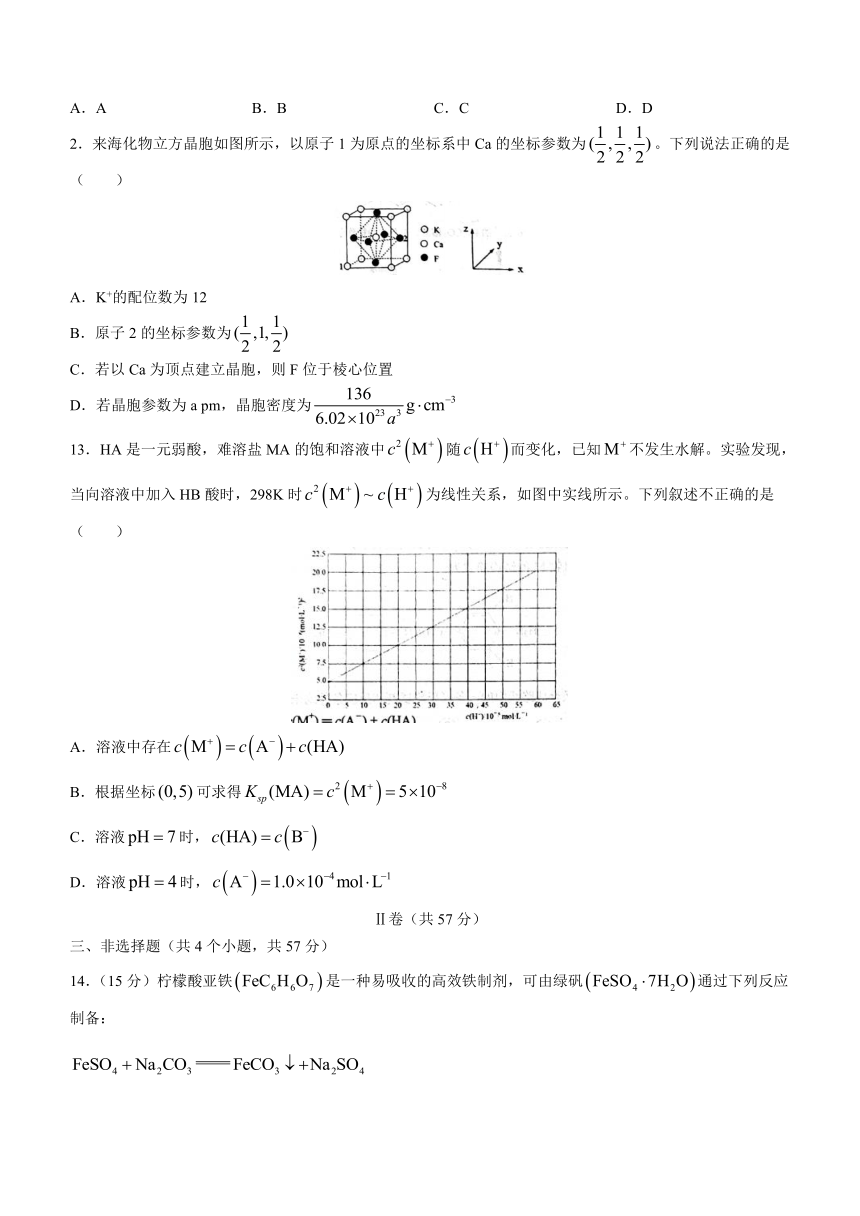
2.来海化物立方晶胞如图所示,以原子1为原点的坐标系中Ca的坐标参数为。下列说法正确的是( )
A.K+的配位数为12
B.原子2的坐标参数为
C.若以Ca为顶点建立晶胞,则F位于棱心位置
D.若晶胞参数为a pm,晶胞密度为
13.HA是一元弱酸,难溶盐MA的饱和溶液中随而变化,已知不发生水解。实验发现,当向溶液中加入HB酸时,298K时为线性关系,如图中实线所示。下列叙述不正确的是( )
A.溶液中存在
B.根据坐标可求得
C.溶液时,
D.溶液时,
Ⅱ卷(共57分)
三、非选择题(共4个小题,共57分)
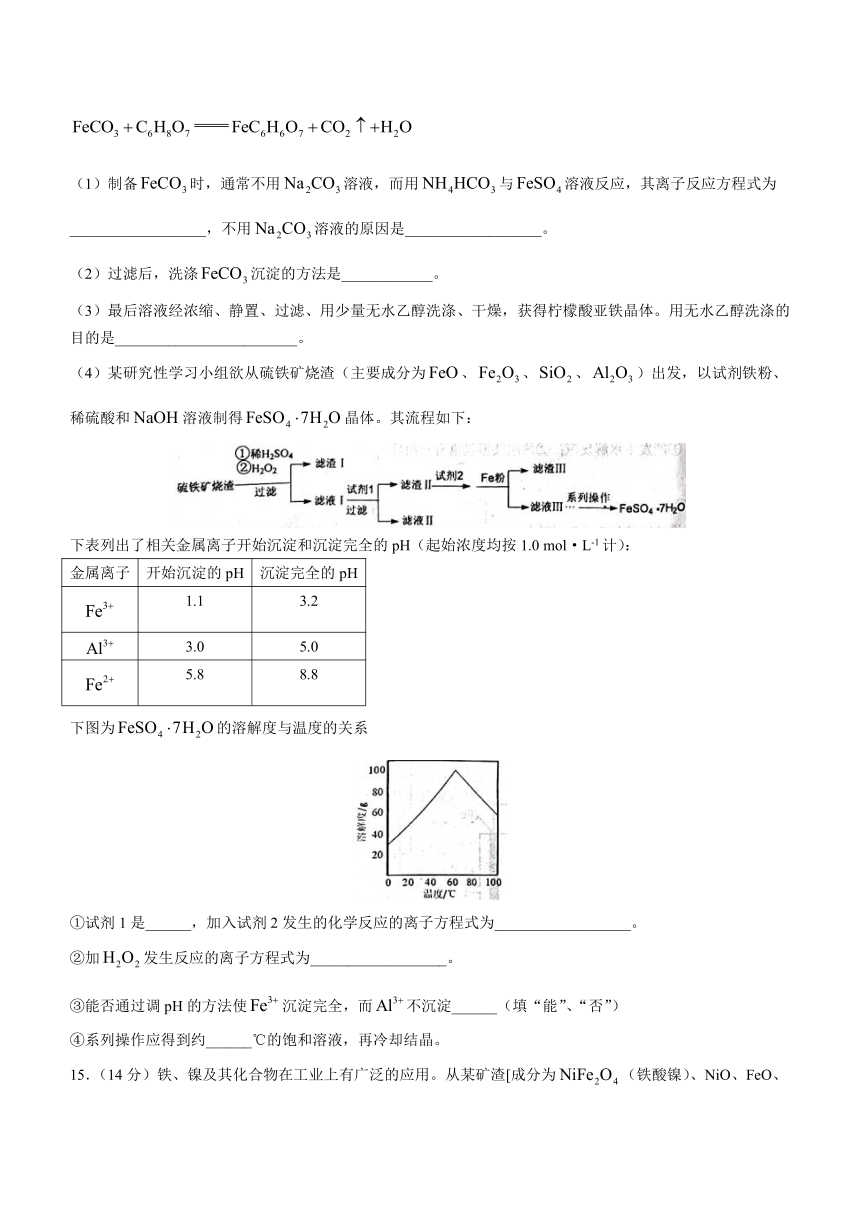
14.(15分)柠檬酸亚铁是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
(1)制备时,通常不用溶液,而用与溶液反应,其离子反应方程式为__________________,不用溶液的原因是__________________。
(2)过滤后,洗涤沉淀的方法是____________。
(3)最后溶液经浓缩、静置、过滤、用少量无水乙醇洗涤、干燥,获得柠檬酸亚铁晶体。用无水乙醇洗涤的目的是________________________。
(4)某研究性学习小组欲从硫铁矿烧渣(主要成分为、、、)出发,以试剂铁粉、稀硫酸和溶液制得晶体。其流程如下:
下表列出了相关金属离子开始沉淀和沉淀完全的pH(起始浓度均按1.0 mol·L-1计):
金属离子 开始沉淀的pH 沉淀完全的pH
1.1 3.2
3.0 5.0
5.8 8.8
下图为的溶解度与温度的关系
①试剂1是______,加入试剂2发生的化学反应的离子方程式为__________________。
②加发生反应的离子方程式为__________________。
③能否通过调pH的方法使沉淀完全,而不沉淀______(填“能”、“否”)
④系列操作应得到约______℃的饱和溶液,再冷却结晶。
15.(14分)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为(铁酸镍)、NiO、FeO、CaO、等]中回收的工艺流程如下:
已知在350℃分解生成和,回答下列问题:
(1)“浸渣”的成分有、、外,还含有______(化学式)。
(2)矿渣中部分有氧焙烧时与反应生成的化学方程式为______。
(3)已知“浸取液”中,向其中加入使溶液中时,除钙率为______.
(4)萃取可对溶液中的金属离子进行窞集与分离:
(水相)(有机相)(有机相)(水相)。萃取祀与溶液的体积比对溶液中、的萃取率影响如图所示,的最佳取值为______。有机相中加入可以再生,反应的化学方程式为______。
(5)以Fe、Ni为电极制取的原理如图所示(a与b是离子交换膜)。通电后,在铁电极附近生成紫红色的。
①电解时阳极的电极反应式为______,离子交换膜b为______(填“阴”或“阳”)离子交换膜。
②在酸性条件下不稳定,会分解生成,写出溶液中加入稀硫酸时反应的化学方程式________________________。
16.(14分)工业脱硫得到的在不同条件下发生不同的反应,从而实现废物的综合利用,变废为宝。硫酸钙在高温下能被CO还原,发生的反应如下:
Ⅰ.平衡常数
Ⅱ.平衡常数
Ⅲ.平衡常数
(1)平衡常数______(用、表示)。
(2)在恒温恒容条件下,反应Ⅱ达到化学平衡的标志有______。
A.气体压强不再变化 B.气体密度不再变化
C.气体的平均摩尔质量不再变化 D.
(3)上述反应平衡常数的对数值与温度的关系如图所示。
①______(填“>”或“<”)0,理由是__________________。
②若只发生反应Ⅰ,点______ (填数值)。
③在345℃时,若只发生反应Ⅲ,图中A点(正)______逆)(填“>”、“<”、“=”)
④若只发生反应Ⅱ,在一密闭刚性容器中控制恒定温度T,开始充入1 mol CO和足量的,此时压强为,当达平衡测得CO的转化率为a,则用分压表达该反应化学平衡常数为______(用含和a的表达式表示)
17.(14分)某有机物M的结构简式为:
下图是M的多条合成路线中的一条(反应试剂和反应条件均未标出)
已知:(1)(R为烃基)
(2)—NH2易被氧化
(3)硝基在Fe粉、HCl作用下会转化成氨基
(4)苯与烯烃能发生加成反应在苯环上引入烃基
完成下列填空:
(1)反应①所需试剂和反应条件是______反应③的反应类型是______。
(2)写出反应⑥的化学方程式____________。
(3)B结构简式为______。
(4)反应⑥中除加入反应试剂C外,还需要加入,其目的是____________。
(5)写出符合下列条件的C的一种同分异构体____________。
①能发生水解反应;②核磁共振氢谱有三组峰
(6)设计以苯和乙烯为原料合成的路线(无机试剂任选)______。
化学参考答案
一、二选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 A C B B D A D C B BC A AC D
三、非选择题
14.(15分)【答案】
(1)Fe2+ + 2HCO3-=FeCO3↓+CO2↑+H2O(2分),
Na2CO3 溶液水解程度较大,碱性较强,防止生成Fe(OH)2(2分)。
(2)向漏斗中的沉淀上加蒸馏水至浸没沉淀,待水自然流下后,重复2~3次(2分)。
(3)减小柠檬酸亚铁晶体因溶解而造成的损失,便于干燥(2分)。
(4) ①NaOH溶液(1分),Fe(OH)3 + 3H+ = Fe3+ + 3H2O(2分)
② H2O2 + 2Fe2+ + 2H+ =2Fe3+ +2H2O (2分)
②否(1分)
③60(1分)
(14分)【答案】
(1)CaSO4 (1分)
(2)4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O (2分)
(3)99% (2分)
(4)0.25 (2分) FeR2 + H2SO4 =FeSO4 + 2HR (2分)
(5)①Fe-6e-+8OH-=FeO42-+4H2O (2分) ②阴 (1分)
4 Na2FeO4 + 10H2SO4 =4Na2SO4 +2 Fe2(SO4)3 + 3O2 ↑ + 10H2O (2分)
(14分)【答案】
(2分)
(2)ABC (2分)
(3)①>(1分),升高温度平衡常增大,平衡正向移动,故△H3>0(2分)。
②1×10-4 (2分)
③<(2分)
④(3分)
(14分)【答案】
(1)浓硝酸,浓硫酸,水浴加热(2分),还原反应(1分)
(2)
(2分)
(3)(2分)
(4)消耗生成的HCl,使平衡正向移动,提高产率(2分)
(5)(CH3)3CONHCH3或(CH3)3CH2CONH2 (2分)(合理均可)
(6)
(3分)
化学
可能用到的相对原子质量:H1 C12 O16 F19 Na23 K39 Ca 40
Ⅰ卷(共43分)
一、单项选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学在人类社会发展中发挥着重要作用,下列说法错误的是( )
A.明矾是常用的净水剂,向海水中加入明矾可以使海水淡化
B.药物合成中,常将胺类药物转化为铵盐,增加药物的稳定性
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.人的手汗中含有多种氨基酸,遇茚三酮溶液显紫色,可用于指纹检验
2.下列化学用语正确的是( )
A.基态Cr原子的价电子排布式: B.二氧化碳的球棍模型:
C.甲酸甲酯的结构简式: D.2,2,4-三甲基-3-戊烯的键线式:
3.配制480 mL 0.1 mol·L-1的溶液,部分实验操作示意图如下:
下列说法正确的是( )
A.需称量5.1 g 固体 B.上述实验操作步骤的正确顺序为③①②④
C.将容量瓶洗涤干净,须干燥后才可使用 D.定容时仰视刻度线,使溶液浓度偏高
4.科学家合成出一种新化合物(如图所示),其中W、X、Y、乙四种元素,X、Y、乙为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,W与Z的简单离子具有相同的电子层排布。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.是共价化合物,X原子轨道杂化类型为杂化
C.原子半径大小顺序为:W>Z>Y>X
D.的空间构型为平面三角形,Y的价层电子对数为4
5.研究发现下图所示含硒有机物具有很好的抗肿瘤功效,下列关于该有机物的说法错误的是( )
A.分子式为
B.能使酸性高锰酸钾溶液褪色
C.分子中含有一个手性碳原子
D.1 mol该有机物最多可与 发生加成反应
6.碳铂(,结构如图所示)是应用于临床的第二代铂类抗癌药物,下列说法错误的是( )
A.第一电离能:O>N>C>H B.是由极性键构成的极性分子
C.碳原子的轨道杂化方式有、两种 D.1 mol该配合物含有4 mol配位键
7.为阿伏加德罗常数的值。下列说法正确的是( )
A.11.2 L甲烷和乙烯混合物中含氢原子数为
B.电解饱和食盐水时,若阴极产生2 g氢气,则转移电子数为
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为
D.常温下,1 L pH=9的溶液中,水电离出的数为
8.碘及其化合物广泛用于医药、染料等方面,的一种制备方法如下图:
下列说法正确的是( )
A.“转化”步骤反应的离子方程式:
B.为提高的产率,氯气的用量越多越好
C.所得沉淀与硝酸反应后的某种生成物可以循环使用
D.流程中过滤时玻璃仪器只需烧杯和漏斗
9.反应物S转化为产物P的能量与反应进程的关系如下图所示:
下列说法正确的是( )
A.S·X→P·X的转化过程为吸热过程
B.平衡时P的产率:Ⅰ=Ⅱ=Ⅲ
C.生成P的速率:Ⅲ>Ⅱ>Ⅰ
D.生成相同物质的量的P,放出的热量Ⅰ>Ⅲ>Ⅱ
二、不定项选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
10.某实验小组,以甲图燃料电池为电源电解制备,图甲中A与B都为惰性电极,图乙的电极分别是铁电极和石墨电极,下列相关说法中正确的是( )
A.燃料电池负极反应式为:
B.乙中X可为NaCl,也可为
C.苯的作用是隔绝空气,防止被氧化
D.甲中接线柱A应与乙中Fe电极相连
11.用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是( )
A B C D
检验二氧化硫的漂白性 稀释浓硫酸 检验用乙醇制得的乙烯的还原性 萃取碘水中的碘
A.A B.B C.C D.D
2.来海化物立方晶胞如图所示,以原子1为原点的坐标系中Ca的坐标参数为。下列说法正确的是( )
A.K+的配位数为12
B.原子2的坐标参数为
C.若以Ca为顶点建立晶胞,则F位于棱心位置
D.若晶胞参数为a pm,晶胞密度为
13.HA是一元弱酸,难溶盐MA的饱和溶液中随而变化,已知不发生水解。实验发现,当向溶液中加入HB酸时,298K时为线性关系,如图中实线所示。下列叙述不正确的是( )
A.溶液中存在
B.根据坐标可求得
C.溶液时,
D.溶液时,
Ⅱ卷(共57分)
三、非选择题(共4个小题,共57分)
14.(15分)柠檬酸亚铁是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
(1)制备时,通常不用溶液,而用与溶液反应,其离子反应方程式为__________________,不用溶液的原因是__________________。
(2)过滤后,洗涤沉淀的方法是____________。
(3)最后溶液经浓缩、静置、过滤、用少量无水乙醇洗涤、干燥,获得柠檬酸亚铁晶体。用无水乙醇洗涤的目的是________________________。
(4)某研究性学习小组欲从硫铁矿烧渣(主要成分为、、、)出发,以试剂铁粉、稀硫酸和溶液制得晶体。其流程如下:
下表列出了相关金属离子开始沉淀和沉淀完全的pH(起始浓度均按1.0 mol·L-1计):
金属离子 开始沉淀的pH 沉淀完全的pH
1.1 3.2
3.0 5.0
5.8 8.8
下图为的溶解度与温度的关系
①试剂1是______,加入试剂2发生的化学反应的离子方程式为__________________。
②加发生反应的离子方程式为__________________。
③能否通过调pH的方法使沉淀完全,而不沉淀______(填“能”、“否”)
④系列操作应得到约______℃的饱和溶液,再冷却结晶。
15.(14分)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为(铁酸镍)、NiO、FeO、CaO、等]中回收的工艺流程如下:
已知在350℃分解生成和,回答下列问题:
(1)“浸渣”的成分有、、外,还含有______(化学式)。
(2)矿渣中部分有氧焙烧时与反应生成的化学方程式为______。
(3)已知“浸取液”中,向其中加入使溶液中时,除钙率为______.
(4)萃取可对溶液中的金属离子进行窞集与分离:
(水相)(有机相)(有机相)(水相)。萃取祀与溶液的体积比对溶液中、的萃取率影响如图所示,的最佳取值为______。有机相中加入可以再生,反应的化学方程式为______。
(5)以Fe、Ni为电极制取的原理如图所示(a与b是离子交换膜)。通电后,在铁电极附近生成紫红色的。
①电解时阳极的电极反应式为______,离子交换膜b为______(填“阴”或“阳”)离子交换膜。
②在酸性条件下不稳定,会分解生成,写出溶液中加入稀硫酸时反应的化学方程式________________________。
16.(14分)工业脱硫得到的在不同条件下发生不同的反应,从而实现废物的综合利用,变废为宝。硫酸钙在高温下能被CO还原,发生的反应如下:
Ⅰ.平衡常数
Ⅱ.平衡常数
Ⅲ.平衡常数
(1)平衡常数______(用、表示)。
(2)在恒温恒容条件下,反应Ⅱ达到化学平衡的标志有______。
A.气体压强不再变化 B.气体密度不再变化
C.气体的平均摩尔质量不再变化 D.
(3)上述反应平衡常数的对数值与温度的关系如图所示。
①______(填“>”或“<”)0,理由是__________________。
②若只发生反应Ⅰ,点______ (填数值)。
③在345℃时,若只发生反应Ⅲ,图中A点(正)______逆)(填“>”、“<”、“=”)
④若只发生反应Ⅱ,在一密闭刚性容器中控制恒定温度T,开始充入1 mol CO和足量的,此时压强为,当达平衡测得CO的转化率为a,则用分压表达该反应化学平衡常数为______(用含和a的表达式表示)
17.(14分)某有机物M的结构简式为:
下图是M的多条合成路线中的一条(反应试剂和反应条件均未标出)
已知:(1)(R为烃基)
(2)—NH2易被氧化
(3)硝基在Fe粉、HCl作用下会转化成氨基
(4)苯与烯烃能发生加成反应在苯环上引入烃基
完成下列填空:
(1)反应①所需试剂和反应条件是______反应③的反应类型是______。
(2)写出反应⑥的化学方程式____________。
(3)B结构简式为______。
(4)反应⑥中除加入反应试剂C外,还需要加入,其目的是____________。
(5)写出符合下列条件的C的一种同分异构体____________。
①能发生水解反应;②核磁共振氢谱有三组峰
(6)设计以苯和乙烯为原料合成的路线(无机试剂任选)______。
化学参考答案
一、二选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 A C B B D A D C B BC A AC D
三、非选择题
14.(15分)【答案】
(1)Fe2+ + 2HCO3-=FeCO3↓+CO2↑+H2O(2分),
Na2CO3 溶液水解程度较大,碱性较强,防止生成Fe(OH)2(2分)。
(2)向漏斗中的沉淀上加蒸馏水至浸没沉淀,待水自然流下后,重复2~3次(2分)。
(3)减小柠檬酸亚铁晶体因溶解而造成的损失,便于干燥(2分)。
(4) ①NaOH溶液(1分),Fe(OH)3 + 3H+ = Fe3+ + 3H2O(2分)
② H2O2 + 2Fe2+ + 2H+ =2Fe3+ +2H2O (2分)
②否(1分)
③60(1分)
(14分)【答案】
(1)CaSO4 (1分)
(2)4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O (2分)
(3)99% (2分)
(4)0.25 (2分) FeR2 + H2SO4 =FeSO4 + 2HR (2分)
(5)①Fe-6e-+8OH-=FeO42-+4H2O (2分) ②阴 (1分)
4 Na2FeO4 + 10H2SO4 =4Na2SO4 +2 Fe2(SO4)3 + 3O2 ↑ + 10H2O (2分)
(14分)【答案】
(2分)
(2)ABC (2分)
(3)①>(1分),升高温度平衡常增大,平衡正向移动,故△H3>0(2分)。
②1×10-4 (2分)
③<(2分)
④(3分)
(14分)【答案】
(1)浓硝酸,浓硫酸,水浴加热(2分),还原反应(1分)
(2)
(2分)
(3)(2分)
(4)消耗生成的HCl,使平衡正向移动,提高产率(2分)
(5)(CH3)3CONHCH3或(CH3)3CH2CONH2 (2分)(合理均可)
(6)
(3分)
同课章节目录
