北京通州区2014-2015学年高二春季会考考前练习化学试题
文档属性
| 名称 | 北京通州区2014-2015学年高二春季会考考前练习化学试题 | 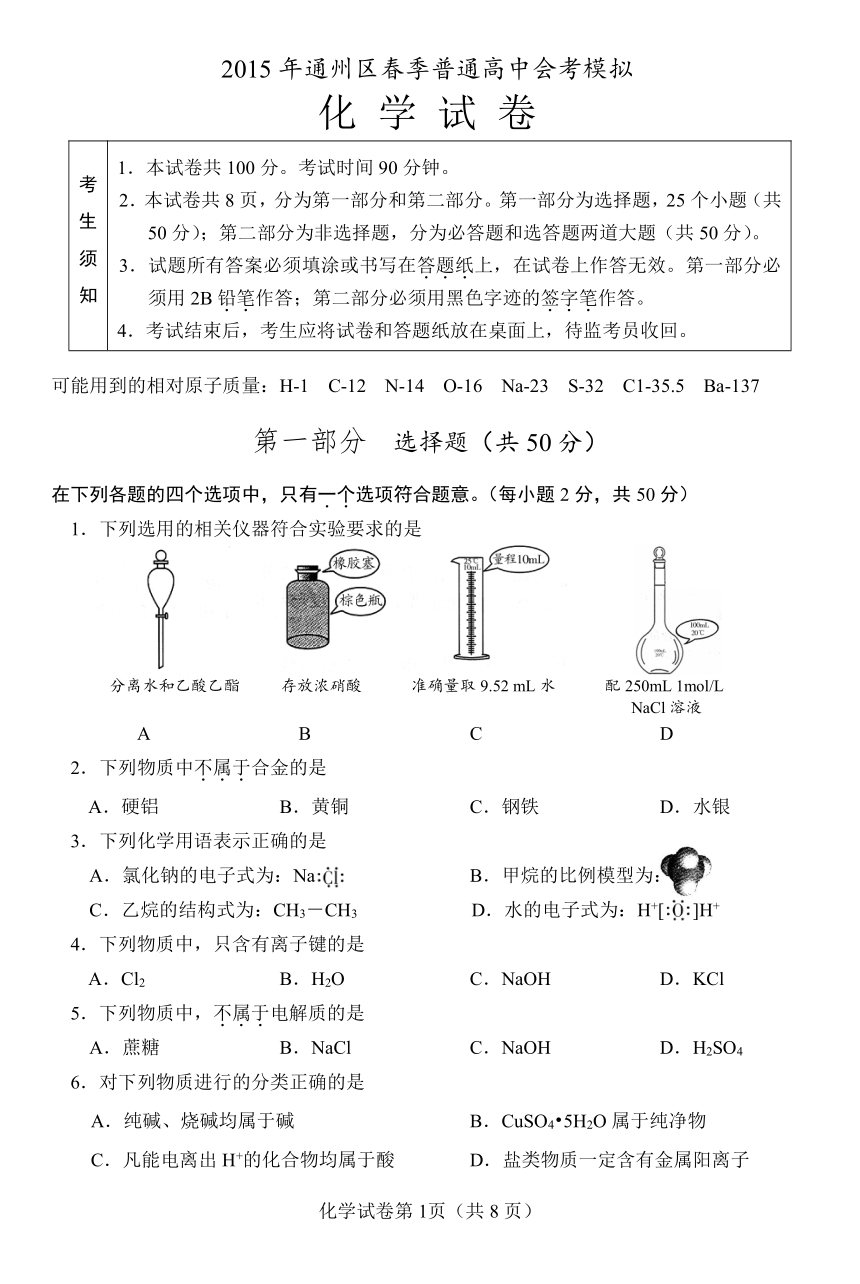 | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-12-31 21:42:09 | ||
图片预览





文档简介
2015年通州区春季普通高中会考模拟
化 学 试 卷
考
生
须
知
1.本试卷共100分。考试时间90分钟。
2.本试卷共8页,分为第一部分和第二部分。第一部分为选择题,25个小题(共50分);第二部分为非选择题,分为必答题和选答题两道大题(共50分)。
3.试题所有答案必须填涂或书写在答题纸上,在试卷上作答无效。第一部分必须用2B铅笔作答;第二部分必须用黑色字迹的签字笔作答。
4.考试结束后,考生应将试卷和答题纸放在桌面上,待监考员收回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 C1-35.5 Ba-137
第一部分 选择题(共50分)
在下列各题的四个选项中,只有一个选项符合题意。(每小题2分,共50分)
1.下列选用的相关仪器符合实验要求的是
A B C D
2.下列物质中不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
3.下列化学用语表示正确的是
A.氯化钠的电子式为:Na B.甲烷的比例模型为:
C.乙烷的结构式为:CH3-CH3 D.水的电子式为:H+[ ]H+
4.下列物质中,只含有离子键的是
A.Cl2 B.H2O C.NaOH D.KCl
5.下列物质中,不属于电解质的是
A.蔗糖 B.NaCl C.NaOH D.H2SO4
6.对下列物质进行的分类正确的是
A.纯碱、烧碱均属于碱 B.CuSO4?5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸 D.盐类物质一定含有金属阳离子
7.下列粒子的结构示意图中,不正确的是
8.下列说法中不正确的是
A.水在人体中作为反应的介质 B.水能调节人体的温度
C.水在人体内是一种很好的溶剂 D.水不能经过食物代谢产生
9.下列说法中不正确的是
A.CO燃烧是放热反应 B.H2SO4与NaOH反应是放热反应
C.CaO与H2O反应是吸热反应 D.CaCO3受热分解是吸热反应
10.下列实验操作中,正确的是
A.在容量瓶中直接溶解氢氧化钠固体
B.向试管中滴加试剂时,将滴管下端紧靠试管内壁
C.用托盘天平称量药品时,左盘放药品,右盘放砝码
D.使用试纸检验溶液的性质时,将试纸浸入溶液中
11.下列有关FeCl3溶液和Fe(OH) 3胶体说法正确的是
A.都能透过滤纸 B.都呈红褐色
C.分散质粒子直径相同 D.都具有丁达尔效应
12.下列气体中不能用浓硫酸干燥的是
A.H2 B.CO2 C.NH3 D.SO2
13.萃取碘水中的碘,可用的萃取剂是(①四氯化碳 ②汽油 ③酒精)
A.只有① B.①和② C.①和③ D.①②③
14.下列有关物质用途的叙述不正确的是
A.二氧化硫可用于食品增白
B.氨可用作制冷剂
C.铁红(Fe2O3)常用作红色油漆和涂料
D.硅是太阳能电池的常用材料
15.下列叙述中正确的是
A.O、Na、S元素的原子半径依次增大
B.KOH、Mg(OH) 2、Ca(OH) 2的碱性依次增强
C.H3PO4、H 2SO4、HClO4的酸性依次增强
D.F2、Cl2、Br2、I2的氧化性依次增强
16.阿伏加德罗常数用NA表示,下列说法正确的是
A.28 g氮气含有的原子数为NA
B.1 mol OH-含有的电子数为10NA
C.标况下22.4 L 水中含有的水分子数为NA
D.0.1 mol的 NaCl中含离子数为0.1NA
17.下列关于化学反应速率的说法错误的是
A.化学反应速率是用于衡量化学反应进行快慢的物理量
B.决定化学反应速率的主要因素是反应物本身的性质
C.增大反应物浓度或升高反应温度都能加快化学反应速率
D.可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
18.下列叙述正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态,该元素一定被还原
D.金属阳离子被还原不一定得到单质
19.下列离子反应方程式书写正确的是
A.用小苏打治疗胃酸过多:HCO3-+ H+ CO2↑+ H2O
B.向稀硫酸溶液中投入铁粉:2Fe + 6H+ 2Fe3+ + 3H2↑
C.氢氧化钡溶液中加入硫酸: H+ + OH- H2O
D.氯化铝溶液中加过量的氢氧化钠溶液: Al3+ + 3OH- Al(OH)3↓
20.在右图所示的原电池中,下列说法不正确的是
A.Cu为正极,Zn为负极
B.电子由锌片通过导线流向铜片
C.正极反应为 Cu2+ + 2e- Cu
D.正极发生还原反应,负极发生氧化反应
21.等质量的钠进行下列实验,其中产生氢气最多的是
A.将钠放入足量的水中
B.将钠放入足量的稀硫酸中
C.将钠用铝箔包好并刺一些小孔,再放入足量的水中
D.将钠放入足量的稀盐酸中
22.以下说法正确的是
A.纤维素属于糖类,且有甜味
B.甲烷、乙烯、苯都可以使溴水发生化学反应而褪色
C.淀粉、油脂、蛋白质在一定条件下都可以水解
D.石油分馏是化学变化、煤干馏是物理变化
23.下列有机反应化学方程式及反应类型均正确的是
A.CH2=CH2 + Br2 CH3-CHBr2 ;加成反应
B.CH4 + Cl2 CH3Cl + HCl ;取代反应
C. + Br2 + HBr ;置换反应
D.CH3CH2OH + CH3 OH CH3CH2-O- ;酯化反应
24.化学与生活、社会密切相关。下列说法不正确的是
①金属材料都是导体,非金属材料都是绝缘体
②棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
③含有食品添加剂的食物对人体健康均有害,不可食用
④水电站把机械能转化成电能,而核电站把化学能转化成电能
A.只①③ B.只①②③ C.只①③④ D.①②③④
25.下列检验方法与结论相符的一组是
序号
检 验 方 法
结 论
A
一种未知溶液滴加AgNO3溶液,有白色沉淀
未知溶液中一定含有Cl-
B
一种未知溶液滴加盐酸,有气泡产生
未知溶液中一定含有
C
一种未知溶液滴加NaOH溶液,加热后产生能使湿润的红色石蕊试纸变蓝的气体
未知溶液中一定含有
D
一种未知溶液滴加BaCl2溶液,有白色沉淀
未知溶液中一定含有
第二部分 非选择题(共50分)
一、必答题(共30分)
1.(4分)现有下列六种物质:① H2O ② H2SO4 ③ Ca(OH)2 ④ 空气 ⑤ Na2CO3
⑥CH3COOH其中属于混合物的是 (填序号,下同),属于氧化物的是 ,属于盐的是 ,属于有机物的是 。
2.(7分)某小组同学设计了一组实验验证元素周期律。
⑴甲在a、b、c三只烧杯里分别加入50 mL水,再各加几滴酚酞,依次加入大小相近的锂、钠、钾块,观察现象。甲的实验目的是 ,反应最剧烈的烧杯是
(填字母);
⑵乙要验证非金属元素的非金属性越强,其对应的最高价含氧酸
的酸性越强。实验装置如右图,验证氮、碳、硅的非金属性强
弱,此实验可直接证明三种酸的强弱。已知A是强酸,常温下
与铜反应,B是块状固体。打开活塞反应后,C中可看到白色
沉淀生成。则A、B、C中选用的物质分别为 、 、 (填化学式)。
3.(5分)将3a L NO2气体依次通过盛有下列物质的容器:饱和NaHCO 3溶液、浓硫酸、固体Na2O2 ,发生的化学反应方程式是:
⑴ ;⑵ ;
⑶ ;
最后用排水法收集残余气体,收集到的气体是 。
4.(6分)为测定某硫酸钠样品(含有碳酸钠杂质)的纯度,某小组同学进行了如下实验:
则:⑴操作③的目的是 ;
⑵原样品中硫酸钠的质量分数为 % ;
⑶操作②的玻璃仪器有 ;
⑷若测定结果偏高,其原因可能是下列情况中的 (填字母)。
a.滤液B中含有Ba2+ b.操作②中盐酸量不足
c.操作④中沉淀没有洗涤干净 d.操作⑤中固体未完全烘干
5.(8分)在金属活动顺序表中,Fe排在H之前,Fe可以与水反应。为了检验其产物,
某小组同学利用下图所列装置进行“铁与水反应”的实验,并检验产物。(夹持装置
已略去)
⑴装置B中发生反应的化学方程式为
,
⑵装置E中现象为
,
说明产物中含有 ;
⑶如何检验B中的固体产物?
;
⑷分析水与Na 、Fe反应异同的原因
。
二、选答题(共20分。请在以下两个模块试题中任选一个模块试题作答,若选答了多个模块的试题,以所答第一模块的试题成绩评分。)
《化学与生活》模块试题
1.(4分)现有下列五种物质:A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.动物油,请按要求填字母。富含维生素C的是 ;可直接进入血液,补充能量的是 ;如果膳食中摄入过多会造成肥胖的是 ;既可作为调味剂,又可除水垢的是 。
2.(8分)已知苯甲酸和苯甲酸钠的防腐效果相同,它们都是主要的食品防腐剂。苯甲酸的结构简式为 ,请回答下列问题:
⑴苯甲酸分子中的官能团名称是 ;预测其化学性质为 ;
(①与氢氧化钠溶液反应 ②发生水解反应 ③与乙醇发生酯化反应)
⑵苯甲酸防腐的原理是可以使细菌的蛋白质 (填“盐析”或“变性”);
⑶苯甲酸属于酸性防腐剂,当pH升高时,其防腐效果将 ;
⑷苯甲酸和苯甲酸钠的防腐效果相同,但在食品包装上的说明中经常见到的却是苯甲酸钠,其原因是 。
3.(8分)为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其编号填入相应的空格内。
实验要求
化学试剂
检验酒精中是否含有水
验证小苏打中是否含有苏打
区别蔗糖与葡萄糖
证明土豆中含有淀粉
可供选择的试剂有:A.新制氢氧化铜悬浊液 B.碘水
C.无水硫酸铜粉末 D.氯化钡溶液
《有机化学基础》模块试题
1.(8分)⑴请根据下列有机物官能团的不同对其进行分类:
属于芳香烃的是 (填序号,下同),属于醇的是 ,属于醛的是 ,属于羧酸的是 ;
⑵上述物质中,⑤的官能团名称是 ,用系统命名法命名,④的名称为
。
2.(4分)卤代烃 (填“能”或“不能”)跟硝酸银溶液反应生成卤化银沉淀。分子式为C3H7Br的卤代烃,其结构简式有两种,分别为 和
,它们与NaOH醇溶液共热生成的有机物的结构简式为 。
3.(8分)已知酪氨酸是生命活动不可缺少的氨基酸之一,它的结构简式是:
(1)酪氨酸能发生的化学反应类型有 ;
A.取代反应 B.加成反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足以下三个条件的,除酪氨酸外还有 种;
( ①苯环上有两个取代基,且遇FeCl3溶液呈紫色 ②分子中不含有甲基 ③属于氨基酸)
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:
。
高二化学会考练习参考答案及评分标准
2014.12
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分数。
第一部分 选择题 (共50分)
选择题(每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
D
A
B
A
D
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
B
A
C
B
D
D
A
C
题号
21
22
23
24
25
答案
C
C
B
D
C
第二部分 非选择题(共50分)
一、必答题(共30分)
1.(4分)④ ;① ;⑤ ;⑥ 。 (各1分)
2.(7分)
⑴验证锂、钠、钾的活泼性(或:同一主族,从上到下元素的金属性逐渐增强);c ;(各2分)
⑵ HNO3 ;CaCO3 ;Na2SiO3(或:K2SiO3)。 (各1分)
3.(5分)
⑴ 3 NO2 + H2O2HNO3 + NO ;
⑵ HNO3 + NaHCO3NaNO3 + H2O + CO2↑ ;
⑶ 2Na2O2 + 2CO2 2Na2CO3 + O2 ; O2 (2分)。 (其余每点1分)
4.(6分)⑴检验溶液中的是否沉淀完全; ⑵ 85.2 ; (各1分)
⑶烧杯、漏斗、玻璃棒; ⑷ b、c、d 。 (各2分)
5.(8分)(每小题2分)
⑴ 3Fe + 4 H2O(g) Fe3O4 + 4 H2 ; ⑵固体由黑色变为红色; Cu ;
⑶ 将固体溶于盐酸,之后滴几滴KSCN溶液,观察溶液颜色变化(变红说明生成Fe3O4,否则生成FeO);
⑷ 铁的金属活动性比钠弱,与水反应条件高,发生置换反应生成H2,但另一产物不是氢氧化物,是氢氧化物分解生成的氧化物。
二、选答题(共20分)
说明:考生可任选其中一个模块的试题作答,若选答了多个模块的试题,以所答第一模块的试题成绩评分。
《化学与生活》模块试题
1.(4分)C ;D ;E ;B 。 (各1分)
2.(8分)⑴羧基(1分); ①、③ ; ⑵变性; ⑶降低(1分);
⑷苯甲酸不易溶于水,但苯甲酸钠属于钠盐,易溶于水。 (其余每空2分)
3.(8分)C ;D ;A ;B 。 (各2分)
《有机化学基础》模块试题
1.(8分)
(1) ⑨ ;① ;⑦ ;⑧ ; (各1分) (2) (酚)羟基 ;乙酸乙酯 。 (各2分)
2.(4分)
不能;CH3CH2CH2Br ;CH3CHBrCH3 ;CH3CH=CH2 。 (各1分)
3.(8分)
(1) A、B、C、D ; (每点1分) (2) 8 ; (2分)
(3) + 2NaOH→ + 2H2O 。 (2分)
[注:符合条件的同分异构体(包括酪氨酸)共有9种:
(邻、间、对3种)、 (邻、间、对3种)、
(邻、间、对3种)。]
化 学 试 卷
考
生
须
知
1.本试卷共100分。考试时间90分钟。
2.本试卷共8页,分为第一部分和第二部分。第一部分为选择题,25个小题(共50分);第二部分为非选择题,分为必答题和选答题两道大题(共50分)。
3.试题所有答案必须填涂或书写在答题纸上,在试卷上作答无效。第一部分必须用2B铅笔作答;第二部分必须用黑色字迹的签字笔作答。
4.考试结束后,考生应将试卷和答题纸放在桌面上,待监考员收回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 C1-35.5 Ba-137
第一部分 选择题(共50分)
在下列各题的四个选项中,只有一个选项符合题意。(每小题2分,共50分)
1.下列选用的相关仪器符合实验要求的是
A B C D
2.下列物质中不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
3.下列化学用语表示正确的是
A.氯化钠的电子式为:Na B.甲烷的比例模型为:
C.乙烷的结构式为:CH3-CH3 D.水的电子式为:H+[ ]H+
4.下列物质中,只含有离子键的是
A.Cl2 B.H2O C.NaOH D.KCl
5.下列物质中,不属于电解质的是
A.蔗糖 B.NaCl C.NaOH D.H2SO4
6.对下列物质进行的分类正确的是
A.纯碱、烧碱均属于碱 B.CuSO4?5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸 D.盐类物质一定含有金属阳离子
7.下列粒子的结构示意图中,不正确的是
8.下列说法中不正确的是
A.水在人体中作为反应的介质 B.水能调节人体的温度
C.水在人体内是一种很好的溶剂 D.水不能经过食物代谢产生
9.下列说法中不正确的是
A.CO燃烧是放热反应 B.H2SO4与NaOH反应是放热反应
C.CaO与H2O反应是吸热反应 D.CaCO3受热分解是吸热反应
10.下列实验操作中,正确的是
A.在容量瓶中直接溶解氢氧化钠固体
B.向试管中滴加试剂时,将滴管下端紧靠试管内壁
C.用托盘天平称量药品时,左盘放药品,右盘放砝码
D.使用试纸检验溶液的性质时,将试纸浸入溶液中
11.下列有关FeCl3溶液和Fe(OH) 3胶体说法正确的是
A.都能透过滤纸 B.都呈红褐色
C.分散质粒子直径相同 D.都具有丁达尔效应
12.下列气体中不能用浓硫酸干燥的是
A.H2 B.CO2 C.NH3 D.SO2
13.萃取碘水中的碘,可用的萃取剂是(①四氯化碳 ②汽油 ③酒精)
A.只有① B.①和② C.①和③ D.①②③
14.下列有关物质用途的叙述不正确的是
A.二氧化硫可用于食品增白
B.氨可用作制冷剂
C.铁红(Fe2O3)常用作红色油漆和涂料
D.硅是太阳能电池的常用材料
15.下列叙述中正确的是
A.O、Na、S元素的原子半径依次增大
B.KOH、Mg(OH) 2、Ca(OH) 2的碱性依次增强
C.H3PO4、H 2SO4、HClO4的酸性依次增强
D.F2、Cl2、Br2、I2的氧化性依次增强
16.阿伏加德罗常数用NA表示,下列说法正确的是
A.28 g氮气含有的原子数为NA
B.1 mol OH-含有的电子数为10NA
C.标况下22.4 L 水中含有的水分子数为NA
D.0.1 mol的 NaCl中含离子数为0.1NA
17.下列关于化学反应速率的说法错误的是
A.化学反应速率是用于衡量化学反应进行快慢的物理量
B.决定化学反应速率的主要因素是反应物本身的性质
C.增大反应物浓度或升高反应温度都能加快化学反应速率
D.可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
18.下列叙述正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态,该元素一定被还原
D.金属阳离子被还原不一定得到单质
19.下列离子反应方程式书写正确的是
A.用小苏打治疗胃酸过多:HCO3-+ H+ CO2↑+ H2O
B.向稀硫酸溶液中投入铁粉:2Fe + 6H+ 2Fe3+ + 3H2↑
C.氢氧化钡溶液中加入硫酸: H+ + OH- H2O
D.氯化铝溶液中加过量的氢氧化钠溶液: Al3+ + 3OH- Al(OH)3↓
20.在右图所示的原电池中,下列说法不正确的是
A.Cu为正极,Zn为负极
B.电子由锌片通过导线流向铜片
C.正极反应为 Cu2+ + 2e- Cu
D.正极发生还原反应,负极发生氧化反应
21.等质量的钠进行下列实验,其中产生氢气最多的是
A.将钠放入足量的水中
B.将钠放入足量的稀硫酸中
C.将钠用铝箔包好并刺一些小孔,再放入足量的水中
D.将钠放入足量的稀盐酸中
22.以下说法正确的是
A.纤维素属于糖类,且有甜味
B.甲烷、乙烯、苯都可以使溴水发生化学反应而褪色
C.淀粉、油脂、蛋白质在一定条件下都可以水解
D.石油分馏是化学变化、煤干馏是物理变化
23.下列有机反应化学方程式及反应类型均正确的是
A.CH2=CH2 + Br2 CH3-CHBr2 ;加成反应
B.CH4 + Cl2 CH3Cl + HCl ;取代反应
C. + Br2 + HBr ;置换反应
D.CH3CH2OH + CH3 OH CH3CH2-O- ;酯化反应
24.化学与生活、社会密切相关。下列说法不正确的是
①金属材料都是导体,非金属材料都是绝缘体
②棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
③含有食品添加剂的食物对人体健康均有害,不可食用
④水电站把机械能转化成电能,而核电站把化学能转化成电能
A.只①③ B.只①②③ C.只①③④ D.①②③④
25.下列检验方法与结论相符的一组是
序号
检 验 方 法
结 论
A
一种未知溶液滴加AgNO3溶液,有白色沉淀
未知溶液中一定含有Cl-
B
一种未知溶液滴加盐酸,有气泡产生
未知溶液中一定含有
C
一种未知溶液滴加NaOH溶液,加热后产生能使湿润的红色石蕊试纸变蓝的气体
未知溶液中一定含有
D
一种未知溶液滴加BaCl2溶液,有白色沉淀
未知溶液中一定含有
第二部分 非选择题(共50分)
一、必答题(共30分)
1.(4分)现有下列六种物质:① H2O ② H2SO4 ③ Ca(OH)2 ④ 空气 ⑤ Na2CO3
⑥CH3COOH其中属于混合物的是 (填序号,下同),属于氧化物的是 ,属于盐的是 ,属于有机物的是 。
2.(7分)某小组同学设计了一组实验验证元素周期律。
⑴甲在a、b、c三只烧杯里分别加入50 mL水,再各加几滴酚酞,依次加入大小相近的锂、钠、钾块,观察现象。甲的实验目的是 ,反应最剧烈的烧杯是
(填字母);
⑵乙要验证非金属元素的非金属性越强,其对应的最高价含氧酸
的酸性越强。实验装置如右图,验证氮、碳、硅的非金属性强
弱,此实验可直接证明三种酸的强弱。已知A是强酸,常温下
与铜反应,B是块状固体。打开活塞反应后,C中可看到白色
沉淀生成。则A、B、C中选用的物质分别为 、 、 (填化学式)。
3.(5分)将3a L NO2气体依次通过盛有下列物质的容器:饱和NaHCO 3溶液、浓硫酸、固体Na2O2 ,发生的化学反应方程式是:
⑴ ;⑵ ;
⑶ ;
最后用排水法收集残余气体,收集到的气体是 。
4.(6分)为测定某硫酸钠样品(含有碳酸钠杂质)的纯度,某小组同学进行了如下实验:
则:⑴操作③的目的是 ;
⑵原样品中硫酸钠的质量分数为 % ;
⑶操作②的玻璃仪器有 ;
⑷若测定结果偏高,其原因可能是下列情况中的 (填字母)。
a.滤液B中含有Ba2+ b.操作②中盐酸量不足
c.操作④中沉淀没有洗涤干净 d.操作⑤中固体未完全烘干
5.(8分)在金属活动顺序表中,Fe排在H之前,Fe可以与水反应。为了检验其产物,
某小组同学利用下图所列装置进行“铁与水反应”的实验,并检验产物。(夹持装置
已略去)
⑴装置B中发生反应的化学方程式为
,
⑵装置E中现象为
,
说明产物中含有 ;
⑶如何检验B中的固体产物?
;
⑷分析水与Na 、Fe反应异同的原因
。
二、选答题(共20分。请在以下两个模块试题中任选一个模块试题作答,若选答了多个模块的试题,以所答第一模块的试题成绩评分。)
《化学与生活》模块试题
1.(4分)现有下列五种物质:A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.动物油,请按要求填字母。富含维生素C的是 ;可直接进入血液,补充能量的是 ;如果膳食中摄入过多会造成肥胖的是 ;既可作为调味剂,又可除水垢的是 。
2.(8分)已知苯甲酸和苯甲酸钠的防腐效果相同,它们都是主要的食品防腐剂。苯甲酸的结构简式为 ,请回答下列问题:
⑴苯甲酸分子中的官能团名称是 ;预测其化学性质为 ;
(①与氢氧化钠溶液反应 ②发生水解反应 ③与乙醇发生酯化反应)
⑵苯甲酸防腐的原理是可以使细菌的蛋白质 (填“盐析”或“变性”);
⑶苯甲酸属于酸性防腐剂,当pH升高时,其防腐效果将 ;
⑷苯甲酸和苯甲酸钠的防腐效果相同,但在食品包装上的说明中经常见到的却是苯甲酸钠,其原因是 。
3.(8分)为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其编号填入相应的空格内。
实验要求
化学试剂
检验酒精中是否含有水
验证小苏打中是否含有苏打
区别蔗糖与葡萄糖
证明土豆中含有淀粉
可供选择的试剂有:A.新制氢氧化铜悬浊液 B.碘水
C.无水硫酸铜粉末 D.氯化钡溶液
《有机化学基础》模块试题
1.(8分)⑴请根据下列有机物官能团的不同对其进行分类:
属于芳香烃的是 (填序号,下同),属于醇的是 ,属于醛的是 ,属于羧酸的是 ;
⑵上述物质中,⑤的官能团名称是 ,用系统命名法命名,④的名称为
。
2.(4分)卤代烃 (填“能”或“不能”)跟硝酸银溶液反应生成卤化银沉淀。分子式为C3H7Br的卤代烃,其结构简式有两种,分别为 和
,它们与NaOH醇溶液共热生成的有机物的结构简式为 。
3.(8分)已知酪氨酸是生命活动不可缺少的氨基酸之一,它的结构简式是:
(1)酪氨酸能发生的化学反应类型有 ;
A.取代反应 B.加成反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足以下三个条件的,除酪氨酸外还有 种;
( ①苯环上有两个取代基,且遇FeCl3溶液呈紫色 ②分子中不含有甲基 ③属于氨基酸)
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:
。
高二化学会考练习参考答案及评分标准
2014.12
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分数。
第一部分 选择题 (共50分)
选择题(每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
D
A
B
A
D
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
B
A
C
B
D
D
A
C
题号
21
22
23
24
25
答案
C
C
B
D
C
第二部分 非选择题(共50分)
一、必答题(共30分)
1.(4分)④ ;① ;⑤ ;⑥ 。 (各1分)
2.(7分)
⑴验证锂、钠、钾的活泼性(或:同一主族,从上到下元素的金属性逐渐增强);c ;(各2分)
⑵ HNO3 ;CaCO3 ;Na2SiO3(或:K2SiO3)。 (各1分)
3.(5分)
⑴ 3 NO2 + H2O2HNO3 + NO ;
⑵ HNO3 + NaHCO3NaNO3 + H2O + CO2↑ ;
⑶ 2Na2O2 + 2CO2 2Na2CO3 + O2 ; O2 (2分)。 (其余每点1分)
4.(6分)⑴检验溶液中的是否沉淀完全; ⑵ 85.2 ; (各1分)
⑶烧杯、漏斗、玻璃棒; ⑷ b、c、d 。 (各2分)
5.(8分)(每小题2分)
⑴ 3Fe + 4 H2O(g) Fe3O4 + 4 H2 ; ⑵固体由黑色变为红色; Cu ;
⑶ 将固体溶于盐酸,之后滴几滴KSCN溶液,观察溶液颜色变化(变红说明生成Fe3O4,否则生成FeO);
⑷ 铁的金属活动性比钠弱,与水反应条件高,发生置换反应生成H2,但另一产物不是氢氧化物,是氢氧化物分解生成的氧化物。
二、选答题(共20分)
说明:考生可任选其中一个模块的试题作答,若选答了多个模块的试题,以所答第一模块的试题成绩评分。
《化学与生活》模块试题
1.(4分)C ;D ;E ;B 。 (各1分)
2.(8分)⑴羧基(1分); ①、③ ; ⑵变性; ⑶降低(1分);
⑷苯甲酸不易溶于水,但苯甲酸钠属于钠盐,易溶于水。 (其余每空2分)
3.(8分)C ;D ;A ;B 。 (各2分)
《有机化学基础》模块试题
1.(8分)
(1) ⑨ ;① ;⑦ ;⑧ ; (各1分) (2) (酚)羟基 ;乙酸乙酯 。 (各2分)
2.(4分)
不能;CH3CH2CH2Br ;CH3CHBrCH3 ;CH3CH=CH2 。 (各1分)
3.(8分)
(1) A、B、C、D ; (每点1分) (2) 8 ; (2分)
(3) + 2NaOH→ + 2H2O 。 (2分)
[注:符合条件的同分异构体(包括酪氨酸)共有9种:
(邻、间、对3种)、 (邻、间、对3种)、
(邻、间、对3种)。]
同课章节目录
