2024届高三新高考化学大一轮专题训练- -化学反应热的计算(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练- -化学反应热的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 603.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 21:47:54 | ||
图片预览



文档简介
2024届高三新高考化学大一轮专题训练--化学反应热的计算
一、单选题
1.(2023秋·高二课时练习)下列关于ΔH的说法正确的是
A.反应过程中,消耗的反应物越多,ΔH越大
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.能量变化如图所示的化学反应为放热反应,ΔH为“-”
2.(2023春·安徽安庆·高一安庆市第二中学校考阶段练习)已知:
化学键 Si-Cl H-H H-Cl Si-Si
键能/kJ·mol 360 436 431 176
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列反应制取:,则该反应的反应热为
A.-116 kJ·mol B.116 kJ·mol C.-236 kJ·mol D.236 kJ·mol
3.(2021秋·广东广州·高二广州市真光中学校考期中)为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机。有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是
A.该构想只涉及了太阳能与电能的转换
B.相同条件下,具有的总能量低于和具有的总能量
C.氢气不易贮存和运输、无开发利用价值
D.氢能源是一次能源,目前已被普遍使用
4.(2022秋·广东茂名·高二信宜市第二中学校考期中)我国科研人员提出了由CO2和CH4转化为高附加值产品 CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.在反应前后催化剂的质量和化学性质不发生改变,因此催化剂不参加反应
5.(2022秋·广东江门·高二校考期中)下列说法正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3 kJ·mol-1,结论:CH4的燃烧热为-801.3 kJ·mol-1
B.已知2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1,ΔS=+494.4 J·mol-1·k-1,结论:该反应在任何温度下都能自发进行
C.稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,结论:将盐酸与氨水的稀溶液混合后,若生成1 mol H2O,则会放出57.3 kJ的能量
D.已知C(石墨,s)=C(金刚石,s) H >0, 结论:相同条件下金刚石比石墨稳定
6.(2023春·广东河源·高二龙川县第一中学校考期中)设为阿佛加德罗常数的数值,下列说法正确的是
A.将个和个置于密闭的容器中充分反应生成,放热38.6 kJ,则热化学方程式为: kJ·mol
B.1 L 0.1 mol/L 溶液中含有的氢原子数大于
C.将25 g 溶于水配成1 L溶液,则溶液中数目为
D.28 g晶体硅中含有键数目为
7.(2022秋·四川资阳·高二四川省资阳中学校考期末)下列热化学方程式书写正确的是(的绝对值均正确)
A.(燃烧热)
B.(中和热)
C.(反应热)
D. (反应热)
8.(2023春·广西·高二校联考阶段练习)下列反应的能量变化规律与图示相符的是
①氯化铵分解
②镁条溶于盐酸
③盐酸与碳酸氢钠反应
④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧
⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①②③ C.①③④ D.②④⑥
9.(2023春·广东广州·高一广州市第七十五中学校考期中)下列说法正确的是
A.凡经加热而发生的化学反应都是吸热反应
B.伴有能量变化的物质变化都是化学变化
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.C(石墨,s)=C(金刚石,s),反应中既没有电子的得失也没有能量的变化
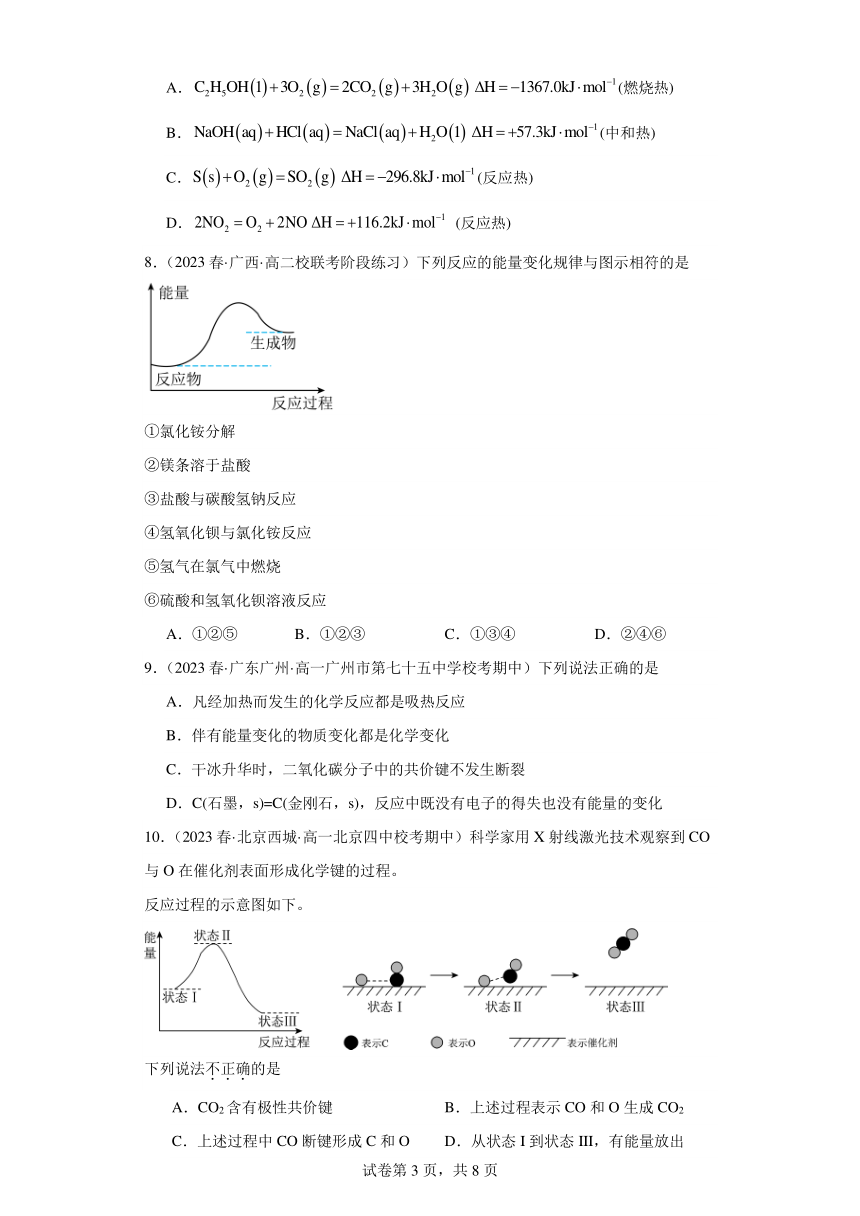
10.(2023春·北京西城·高一北京四中校考期中)科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如下。
下列说法不正确的是
A.CO2含有极性共价键 B.上述过程表示CO和O生成CO2
C.上述过程中CO断键形成C和O D.从状态I到状态III,有能量放出
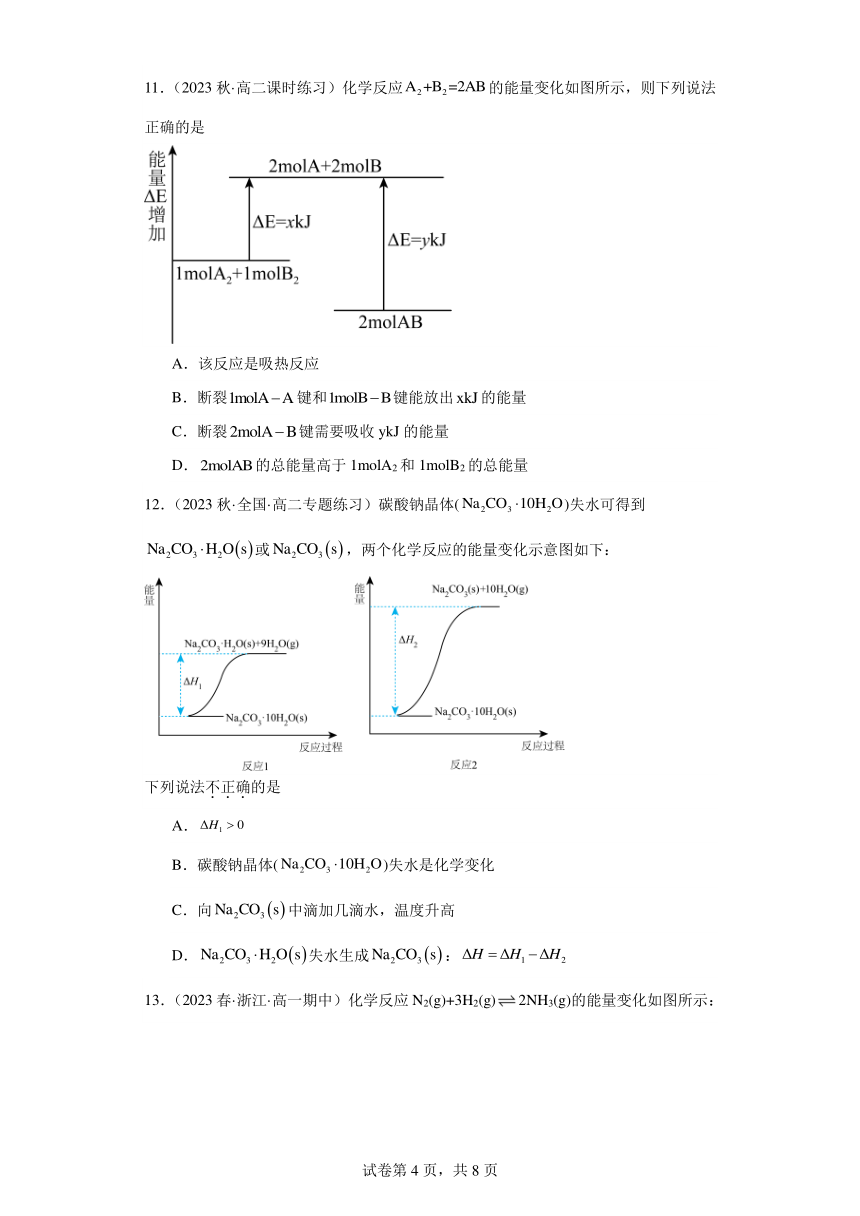
11.(2023秋·高二课时练习)化学反应的能量变化如图所示,则下列说法正确的是
A.该反应是吸热反应
B.断裂键和键能放出的能量
C.断裂键需要吸收ykJ的能量
D.的总能量高于1molA2和1molB2的总能量
12.(2023秋·全国·高二专题练习)碳酸钠晶体()失水可得到或,两个化学反应的能量变化示意图如下:
下列说法不正确的是
A.
B.碳酸钠晶体()失水是化学变化
C.向中滴加几滴水,温度升高
D.失水生成:
13.(2023春·浙江·高一期中)化学反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示:
已知断裂1molN≡N、1molN-H分别需吸收946kJ、391kJ的能量,则下列说法不正确的是
A.该反应为放热反应
B.ΔE2—ΔE1=92kJ mol-1
C.拆开1molH2中化学键需要吸收436kJ的能量
D.生成2molNH3(l)放出的热量小于92kJ
14.(2023秋·河南平顶山·高二统考期末)已知几种化学键的键能如表所示:
化学键
键能 a 436 463 750
根据热化学方程式: ,计算表中的a为
A.484.5 B.969 C.872 D.1938
二、非选择题
15.(2022·全国·高三专题练习)回答下列问题:
(1)已知下列反应:SO2(g)+2OH-(aq)=SO(aq)+H2O(l) ΔH1,ClO-(aq)+SO(aq)= SO(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH= 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式: 。
(3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x= kJ·mol-1(用含有a、b、c、d的代数式表示)。
化学键 P—P P—O O=O P=O
键能/(kJ·mol-1) a b c x
16.(2022秋·湖北荆州·高二沙市中学校考期末)回答下列问题:
(1)用括号内的字母代号填空:中和热测定实验时,使用的酸和碱最好是 (A.恰好完全反应;B.酸稍过量;C.碱稍过量),溶液混合的时候应 (A.一次性快速倒入;B.缓缓滴入),若用环形铜丝代替环形玻璃搅拌棒,会导致测定数据 (A.偏高;B.偏低)。
(2)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促进燃料循环使用的构想,如图所示:
过程I的能量转化形式为 能转化为 能。
(3)有机物M经过太阳光照射可转化成N,转化过程如下:
△H=+88.6 kJ·mol 1。
则M、N相比,较稳定的是 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如下所示:
反应I:2H2SO4(l)2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol 1
反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol 1
写出反应Ⅱ的热化学方程式: 。
17.(2021秋·福建福州·高二校考阶段练习)完成下列问题。
(1)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)键能是断裂1mol共价键所吸收的能量。已知N≡N键能为946kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol,则H—H键的键能是 。
(3)25℃,1.01×105Pa时8g甲烷完全燃烧,当恢复至原状态时,放出445kJ热量,此反应的热化学方程式为: 。
18.(2022秋·安徽·高二校联考阶段练习)请回答以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是 (填序号)。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)①1.68L(标准状况下)仅由C、H两种元素组成的某气体的质量为1.2g,在25℃和101kPa下完全燃烧生成CO2(g)和H2O(l)时,放出66.75kJ的热量。写出表示该气体燃烧热的热化学方程式: 。
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:
C3H8(g)=CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ mol-1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g) △H2=+32.4kJ mol-1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H= 。
(3)根据热化学方程式:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ mol-1,若向处于上述热化学方程式相同温度和体积一定的容器中通入1molN2(g)和3molH2(g),充分反应后,恢复原温度时放出的热量 92.4kJ(填“大于”“小于”或“等于”)。
试卷第2页,共2页
试卷第1页,共1页
参考答案:
1.D
【详解】A.ΔH与化学方程式中的化学计量数有关,与反应物的用量无关,A项错误;
B.ΔH>0时反应吸热,ΔH<0时反应放热,B项错误;
C.反应热有正、负,反应放出的热量越多,ΔH越小,反应吸收的热量越多,ΔH越大,C项错误;
D.由于反应物的总焓大于生成物的总焓,故由反应物转化为生成物时,该反应为放热反应,ΔH为“-”,D项正确;
答案选D。
2.D
【分析】硅晶体中每个硅原子和其他4个硅原子形成4个共价键,均摊法每个硅有2个硅硅单键。
【详解】反应热=反应物键能总和-生成物键能总和=(360+2436-2176-4431)kJ·mol=236 kJ·mol,故选D。
3.B
【详解】A.在太阳能、光分解催化剂下分解为、涉及太阳能转化为化学能,A错误;
B.分解反应是吸热反应,所以反应物总能量小于生成物总能量,B正确;
C.氢气不易贮存和运输,但能消除目前燃料燃烧时产生的环境污染,且缓解能源危机,所以具有很大的开发价值,C错误;
D.氢能源是二次能源,且尚未被普遍使用,D错误;
故选B。
4.D
【详解】A.图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,生成CH3COOH总反应的原子利用率为100%,故A正确;
B.图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一新的共价键,必有C H键发生断裂,故B正确;
C.①→②的焓值降低,过程为放热过程,有C C键形成,故C正确;
D.①中在催化剂的作用下,甲烷中的1个C-H键发生断裂,故D错误;
故选:D。
5.B
【详解】A.燃烧热是生成稳定的产物(液态水)放出的热量,该热化学方程式中是气态水,不能表示反应热,故A错误;
B.已知2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1,ΔS=+494.4 J·mol-1·k-1,ΔG=ΔH-TΔS<0恒成立,结论:该反应在任何温度下都能自发进行,故B正确;
C. 一水合氨是弱电解质,电离吸收热量,所以盐酸和氨水反应生成1mol水时,放出的热量小于57.3kJ,故C错误;
D.已知C(石墨,s)=C(金刚石,s) H >0,该反应是吸热反应,C(金刚石,s)的能量高于C(石墨,s),能量越低越稳定,则相同条件下石墨比金刚石稳定,故D错误;
故选B。
6.B
【详解】A.将1molN2和3mol H2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,因反应为可逆反应,不能进行到底,生成的氨气小于2mol,则密闭的容器中充分反应生成2molNH3(g),放热大于38.6kJ,则热化学反应方程式中的反应热数值错误,选项A错误;
B.醋酸溶液中,醋酸分子、水分子都含有氢原子,1L0.1mol/ LCH3COOH溶液中含有的氢原子数大于0.4NA,选项B正确;
C.25g物质的量为:= 0.1mol,将25g溶于水配成1L溶液,Cu2+水解,则溶液中Cu2+数目小于0.1NA,选项C错误;
D.n(Si)==1mol,硅晶体中每个硅原子与其周围四个硅原子形成四个共价键,但是每个共价键是两个硅原子共用的,所以1molSi含有2mol共价键;28g晶体硅的物质的量是1mol,含有Si-Si键的个数为2NA,选项D错误;
答案选B。
7.C
【详解】A. 水为气态,不表示燃烧反应的热化学方程式,A不正确;
B. 中和反应都是放热反应,ΔH应为“-”,B不正确;
C. 标明了反应物或生成物的状态,反应热也对,C正确;
D. 没有标明物质的状态,D不正确;
故选C。
8.C
【详解】图示反应物能量低于生成物能量,则反应为吸收能量的反应,①③④为吸热反应,②⑤⑥为放热反应,C项符合题意。
故选:C。
9.C
【详解】A.经加热而发生的化学反应不一定是吸热反应,反应是否吸热与反应条件无关,选项A错误;
B.伴有能量变化的物质变化,不一定都是化学变化,如水蒸气变为液态水要放出热量,选项B错误;
C.干冰升华时,只发生了物理变化,改变是分子间的距离,二氧化碳分子中的共价键不发生断裂,选项C正确;
D.C(石墨,s)=C(金刚石,s),反应中没有电子的得失,但是有能量的变化,既不放热也不吸热的化学反应是不存在的,选项D错误;
答案选C。
10.C
【详解】A.CO2的结构式为O=C=O,O=C为极性共价键,则CO2含有极性共价键,A正确;
B.从图中可以看出,在催化剂表面,O与CO反应生成CO2,CO2最终脱离催化剂表面,B正确;
C.从图中可以看出,CO中的C、O原子并未分离,则说明反应过程中CO分子中的共价键并没有全部断裂,没有形成C和O原子,C不正确;
D.从状态I到状态III,反应物的总能量大于生成物的总能量,所以反应有能量放出,D正确;
故选C。
11.C
【详解】A.由图示可知,反应物的总能量高于生成物的总能量,该反应是放热反应,选项A错误;
B.化学键的断裂需要吸收能量,而不是释放能量,选项B错误;
C.化学键的断裂吸收能量,由图可知,断裂2mol A-B键需要吸收y kJ的能量,选项C正确;
D.由图示可知,的总能量低于和的总能量,选项D错误;
答案选C。
12.D
【详解】A.1mol和9molH2O(g)的总能量大于1mol(s)的能量,故,故A正确;
B.碳酸钠晶体()失水生成新物质,是化学变化,故B正确;
C.1mol和9molH2O(g)的总能量大于1mol(s),向中滴加几滴水,放出能量,温度升高,故C正确;
D.
根据盖斯定律②-①得,故D错误;
选D。
13.D
【详解】A.由图可知,合成氨反应为放热反应,故A正确;
B.由图可知,反应的焓变ΔH=—(△E2—△E1)=—92 kJ/mol,则△E2-△E1=92J/mol,故B正确;
C.由焓变的计算可知,H—H键的键能为436kJ/mol,则拆开1mol氢气中化学键需要吸收436kJ的能量,故C正确;
D.反应的焓变△H=—(△E2—△E1)=—92 kJ/mol,则生成2mol氨气放出92 kJ热量,氨气的能量高于液氨,所以生成2mol液氨放出的能量大于92kJ,故D错误;
故选D。
14.B
【详解】反应物总键能-生成物总键能,可求得,B项正确。
15.(1)ΔH1+ΔH2-ΔH3
(2)CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
(3)
【详解】(1)①SO2(g)+2OH-(aq)=SO(aq)+H2O(l) ΔH1,
②ClO-(aq)+SO(aq)= SO(aq)+Cl-(aq) ΔH2,
③CaSO4(s)=Ca2+(aq)+SO(aq) ΔH3,
根据盖斯定律,①+②-③得SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=ΔH1+ΔH2-ΔH3;
(2)①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
根据盖斯定律,由3×②-①×2+③×2得:CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=3×(-192.9 kJ·mol-1)-2×49.0 kJ·mol-1+(-44 kJ·mol-1)×2=-764 kJ·mol-1。
(3)反应热=反应物键能总和-生成物键能总和,P4+5O2=P4010,ΔH=6a+5c-(4x+12b)=-d,可得x= 。
16.(1) B或C A B
(2) 太阳 化学
(3)M
(4)3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254 kJ/mol
【详解】(1)中和热测定实验时,使用的酸和碱最好是酸稍微过量或碱稍微过量,故合理选项是B或C;
酸碱两种溶液混合的时候应一次性快速倒入,故合理选项是A;
铜是金属,容易导热,因此若用环形铜丝代替环形玻璃搅拌棒,导致反应放出的热量损失,会导致测定温度的数据偏低,故合理选项是B;
(2)过程I中H2O在太阳光作用下分解为H2、O2,过程I的能量转化形式为太阳能转化为化学能;
(3)M转化为N时需吸收能量,说明N含有的能量比M高,物质含有的能量越低,物质的稳定性就越强,因此M、N相比,较稳定的是M;
(4)已知反应I:2H2SO4(l)2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol 1,反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol 1
由图可知:反应II为:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),
根据盖斯定律,(I+III)×(-1),整理可得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254 kJ/mol。
17.(1)C(s)+ H2O(g)= CO(g)+ H2(g) △H=+131 kJ·mol-1
(2)436 kJ/mol
(3)CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol
【详解】(1)已知反应①C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;由盖斯定律可知,①-②-③可得反应C(s)+ H2O(g)= CO(g)+ H2(g),则C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(s)+ H2O(g)= CO(g)+ H2(g) △H=-394 kJ·mol-1-(-566kJ·mol-1)- (-484kJ·mol-1)=+131 kJ·mol-1。
(2)设H—H键的键能为x kJ/mol,则946kJ/mol+3x kJ/mol-6391kJ/mol=-92kJ/mol,解得x=436 kJ/mol,则H—H键的键能是436 kJ/mol。
(3)8g甲烷的物质的量为0.5mol,则1mol甲烷完全燃烧放出的热量为445kJ2=890 kJ,则
此反应的热化学方程式为:CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol。
18.(1)B
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ mol-1 +124.2kJ mol-1
(3)小于
【解析】(1)
煤、石油、天然气是化石能源,核能属于新能源,但不可再生,⑤太阳能、⑥生物质能、⑦风能、⑧氢能属于新能源,且可再生;
答案选B;
(2)
①在标准状况下,1.68L气体的物质的量是,质量为1.2g,则其摩尔质量是,其相对分子质量为16,仅由C、H两种元素组成,则其分子式为;根据题意分析,0.75mol在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.75kJ的热量,则1mol在25℃和101kPa下完全燃烧生成(g)和(l)时,放出(kJ)的热量,故表示该气体燃烧热的热化学方程式为。②已知:反应①,则相同条件下,反应反应②,根据盖斯定律,由(①-②)得反应的;
(3)
,意义为1mol氮气与3mol氢气完全反应生成2mol氨气放出的热量为92.4kJ,而该反应为可逆反应,1mol氮气与3mol氢气不能完全反应,所以放出的热量小于92.4kJ。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023秋·高二课时练习)下列关于ΔH的说法正确的是
A.反应过程中,消耗的反应物越多,ΔH越大
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.能量变化如图所示的化学反应为放热反应,ΔH为“-”
2.(2023春·安徽安庆·高一安庆市第二中学校考阶段练习)已知:
化学键 Si-Cl H-H H-Cl Si-Si
键能/kJ·mol 360 436 431 176
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列反应制取:,则该反应的反应热为
A.-116 kJ·mol B.116 kJ·mol C.-236 kJ·mol D.236 kJ·mol
3.(2021秋·广东广州·高二广州市真光中学校考期中)为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机。有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是
A.该构想只涉及了太阳能与电能的转换
B.相同条件下,具有的总能量低于和具有的总能量
C.氢气不易贮存和运输、无开发利用价值
D.氢能源是一次能源,目前已被普遍使用
4.(2022秋·广东茂名·高二信宜市第二中学校考期中)我国科研人员提出了由CO2和CH4转化为高附加值产品 CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.在反应前后催化剂的质量和化学性质不发生改变,因此催化剂不参加反应
5.(2022秋·广东江门·高二校考期中)下列说法正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3 kJ·mol-1,结论:CH4的燃烧热为-801.3 kJ·mol-1
B.已知2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1,ΔS=+494.4 J·mol-1·k-1,结论:该反应在任何温度下都能自发进行
C.稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,结论:将盐酸与氨水的稀溶液混合后,若生成1 mol H2O,则会放出57.3 kJ的能量
D.已知C(石墨,s)=C(金刚石,s) H >0, 结论:相同条件下金刚石比石墨稳定
6.(2023春·广东河源·高二龙川县第一中学校考期中)设为阿佛加德罗常数的数值,下列说法正确的是
A.将个和个置于密闭的容器中充分反应生成,放热38.6 kJ,则热化学方程式为: kJ·mol
B.1 L 0.1 mol/L 溶液中含有的氢原子数大于
C.将25 g 溶于水配成1 L溶液,则溶液中数目为
D.28 g晶体硅中含有键数目为
7.(2022秋·四川资阳·高二四川省资阳中学校考期末)下列热化学方程式书写正确的是(的绝对值均正确)
A.(燃烧热)
B.(中和热)
C.(反应热)
D. (反应热)
8.(2023春·广西·高二校联考阶段练习)下列反应的能量变化规律与图示相符的是
①氯化铵分解
②镁条溶于盐酸
③盐酸与碳酸氢钠反应
④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧
⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①②③ C.①③④ D.②④⑥
9.(2023春·广东广州·高一广州市第七十五中学校考期中)下列说法正确的是
A.凡经加热而发生的化学反应都是吸热反应
B.伴有能量变化的物质变化都是化学变化
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.C(石墨,s)=C(金刚石,s),反应中既没有电子的得失也没有能量的变化
10.(2023春·北京西城·高一北京四中校考期中)科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如下。
下列说法不正确的是
A.CO2含有极性共价键 B.上述过程表示CO和O生成CO2
C.上述过程中CO断键形成C和O D.从状态I到状态III,有能量放出
11.(2023秋·高二课时练习)化学反应的能量变化如图所示,则下列说法正确的是
A.该反应是吸热反应
B.断裂键和键能放出的能量
C.断裂键需要吸收ykJ的能量
D.的总能量高于1molA2和1molB2的总能量
12.(2023秋·全国·高二专题练习)碳酸钠晶体()失水可得到或,两个化学反应的能量变化示意图如下:
下列说法不正确的是
A.
B.碳酸钠晶体()失水是化学变化
C.向中滴加几滴水,温度升高
D.失水生成:
13.(2023春·浙江·高一期中)化学反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示:
已知断裂1molN≡N、1molN-H分别需吸收946kJ、391kJ的能量,则下列说法不正确的是
A.该反应为放热反应
B.ΔE2—ΔE1=92kJ mol-1
C.拆开1molH2中化学键需要吸收436kJ的能量
D.生成2molNH3(l)放出的热量小于92kJ
14.(2023秋·河南平顶山·高二统考期末)已知几种化学键的键能如表所示:
化学键
键能 a 436 463 750
根据热化学方程式: ,计算表中的a为
A.484.5 B.969 C.872 D.1938
二、非选择题
15.(2022·全国·高三专题练习)回答下列问题:
(1)已知下列反应:SO2(g)+2OH-(aq)=SO(aq)+H2O(l) ΔH1,ClO-(aq)+SO(aq)= SO(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH= 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式: 。
(3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x= kJ·mol-1(用含有a、b、c、d的代数式表示)。
化学键 P—P P—O O=O P=O
键能/(kJ·mol-1) a b c x
16.(2022秋·湖北荆州·高二沙市中学校考期末)回答下列问题:
(1)用括号内的字母代号填空:中和热测定实验时,使用的酸和碱最好是 (A.恰好完全反应;B.酸稍过量;C.碱稍过量),溶液混合的时候应 (A.一次性快速倒入;B.缓缓滴入),若用环形铜丝代替环形玻璃搅拌棒,会导致测定数据 (A.偏高;B.偏低)。
(2)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促进燃料循环使用的构想,如图所示:
过程I的能量转化形式为 能转化为 能。
(3)有机物M经过太阳光照射可转化成N,转化过程如下:
△H=+88.6 kJ·mol 1。
则M、N相比,较稳定的是 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如下所示:
反应I:2H2SO4(l)2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol 1
反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol 1
写出反应Ⅱ的热化学方程式: 。
17.(2021秋·福建福州·高二校考阶段练习)完成下列问题。
(1)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)键能是断裂1mol共价键所吸收的能量。已知N≡N键能为946kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol,则H—H键的键能是 。
(3)25℃,1.01×105Pa时8g甲烷完全燃烧,当恢复至原状态时,放出445kJ热量,此反应的热化学方程式为: 。
18.(2022秋·安徽·高二校联考阶段练习)请回答以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是 (填序号)。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)①1.68L(标准状况下)仅由C、H两种元素组成的某气体的质量为1.2g,在25℃和101kPa下完全燃烧生成CO2(g)和H2O(l)时,放出66.75kJ的热量。写出表示该气体燃烧热的热化学方程式: 。
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:
C3H8(g)=CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ mol-1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g) △H2=+32.4kJ mol-1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H= 。
(3)根据热化学方程式:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ mol-1,若向处于上述热化学方程式相同温度和体积一定的容器中通入1molN2(g)和3molH2(g),充分反应后,恢复原温度时放出的热量 92.4kJ(填“大于”“小于”或“等于”)。
试卷第2页,共2页
试卷第1页,共1页
参考答案:
1.D
【详解】A.ΔH与化学方程式中的化学计量数有关,与反应物的用量无关,A项错误;
B.ΔH>0时反应吸热,ΔH<0时反应放热,B项错误;
C.反应热有正、负,反应放出的热量越多,ΔH越小,反应吸收的热量越多,ΔH越大,C项错误;
D.由于反应物的总焓大于生成物的总焓,故由反应物转化为生成物时,该反应为放热反应,ΔH为“-”,D项正确;
答案选D。
2.D
【分析】硅晶体中每个硅原子和其他4个硅原子形成4个共价键,均摊法每个硅有2个硅硅单键。
【详解】反应热=反应物键能总和-生成物键能总和=(360+2436-2176-4431)kJ·mol=236 kJ·mol,故选D。
3.B
【详解】A.在太阳能、光分解催化剂下分解为、涉及太阳能转化为化学能,A错误;
B.分解反应是吸热反应,所以反应物总能量小于生成物总能量,B正确;
C.氢气不易贮存和运输,但能消除目前燃料燃烧时产生的环境污染,且缓解能源危机,所以具有很大的开发价值,C错误;
D.氢能源是二次能源,且尚未被普遍使用,D错误;
故选B。
4.D
【详解】A.图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,生成CH3COOH总反应的原子利用率为100%,故A正确;
B.图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一新的共价键,必有C H键发生断裂,故B正确;
C.①→②的焓值降低,过程为放热过程,有C C键形成,故C正确;
D.①中在催化剂的作用下,甲烷中的1个C-H键发生断裂,故D错误;
故选:D。
5.B
【详解】A.燃烧热是生成稳定的产物(液态水)放出的热量,该热化学方程式中是气态水,不能表示反应热,故A错误;
B.已知2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1,ΔS=+494.4 J·mol-1·k-1,ΔG=ΔH-TΔS<0恒成立,结论:该反应在任何温度下都能自发进行,故B正确;
C. 一水合氨是弱电解质,电离吸收热量,所以盐酸和氨水反应生成1mol水时,放出的热量小于57.3kJ,故C错误;
D.已知C(石墨,s)=C(金刚石,s) H >0,该反应是吸热反应,C(金刚石,s)的能量高于C(石墨,s),能量越低越稳定,则相同条件下石墨比金刚石稳定,故D错误;
故选B。
6.B
【详解】A.将1molN2和3mol H2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,因反应为可逆反应,不能进行到底,生成的氨气小于2mol,则密闭的容器中充分反应生成2molNH3(g),放热大于38.6kJ,则热化学反应方程式中的反应热数值错误,选项A错误;
B.醋酸溶液中,醋酸分子、水分子都含有氢原子,1L0.1mol/ LCH3COOH溶液中含有的氢原子数大于0.4NA,选项B正确;
C.25g物质的量为:= 0.1mol,将25g溶于水配成1L溶液,Cu2+水解,则溶液中Cu2+数目小于0.1NA,选项C错误;
D.n(Si)==1mol,硅晶体中每个硅原子与其周围四个硅原子形成四个共价键,但是每个共价键是两个硅原子共用的,所以1molSi含有2mol共价键;28g晶体硅的物质的量是1mol,含有Si-Si键的个数为2NA,选项D错误;
答案选B。
7.C
【详解】A. 水为气态,不表示燃烧反应的热化学方程式,A不正确;
B. 中和反应都是放热反应,ΔH应为“-”,B不正确;
C. 标明了反应物或生成物的状态,反应热也对,C正确;
D. 没有标明物质的状态,D不正确;
故选C。
8.C
【详解】图示反应物能量低于生成物能量,则反应为吸收能量的反应,①③④为吸热反应,②⑤⑥为放热反应,C项符合题意。
故选:C。
9.C
【详解】A.经加热而发生的化学反应不一定是吸热反应,反应是否吸热与反应条件无关,选项A错误;
B.伴有能量变化的物质变化,不一定都是化学变化,如水蒸气变为液态水要放出热量,选项B错误;
C.干冰升华时,只发生了物理变化,改变是分子间的距离,二氧化碳分子中的共价键不发生断裂,选项C正确;
D.C(石墨,s)=C(金刚石,s),反应中没有电子的得失,但是有能量的变化,既不放热也不吸热的化学反应是不存在的,选项D错误;
答案选C。
10.C
【详解】A.CO2的结构式为O=C=O,O=C为极性共价键,则CO2含有极性共价键,A正确;
B.从图中可以看出,在催化剂表面,O与CO反应生成CO2,CO2最终脱离催化剂表面,B正确;
C.从图中可以看出,CO中的C、O原子并未分离,则说明反应过程中CO分子中的共价键并没有全部断裂,没有形成C和O原子,C不正确;
D.从状态I到状态III,反应物的总能量大于生成物的总能量,所以反应有能量放出,D正确;
故选C。
11.C
【详解】A.由图示可知,反应物的总能量高于生成物的总能量,该反应是放热反应,选项A错误;
B.化学键的断裂需要吸收能量,而不是释放能量,选项B错误;
C.化学键的断裂吸收能量,由图可知,断裂2mol A-B键需要吸收y kJ的能量,选项C正确;
D.由图示可知,的总能量低于和的总能量,选项D错误;
答案选C。
12.D
【详解】A.1mol和9molH2O(g)的总能量大于1mol(s)的能量,故,故A正确;
B.碳酸钠晶体()失水生成新物质,是化学变化,故B正确;
C.1mol和9molH2O(g)的总能量大于1mol(s),向中滴加几滴水,放出能量,温度升高,故C正确;
D.
根据盖斯定律②-①得,故D错误;
选D。
13.D
【详解】A.由图可知,合成氨反应为放热反应,故A正确;
B.由图可知,反应的焓变ΔH=—(△E2—△E1)=—92 kJ/mol,则△E2-△E1=92J/mol,故B正确;
C.由焓变的计算可知,H—H键的键能为436kJ/mol,则拆开1mol氢气中化学键需要吸收436kJ的能量,故C正确;
D.反应的焓变△H=—(△E2—△E1)=—92 kJ/mol,则生成2mol氨气放出92 kJ热量,氨气的能量高于液氨,所以生成2mol液氨放出的能量大于92kJ,故D错误;
故选D。
14.B
【详解】反应物总键能-生成物总键能,可求得,B项正确。
15.(1)ΔH1+ΔH2-ΔH3
(2)CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
(3)
【详解】(1)①SO2(g)+2OH-(aq)=SO(aq)+H2O(l) ΔH1,
②ClO-(aq)+SO(aq)= SO(aq)+Cl-(aq) ΔH2,
③CaSO4(s)=Ca2+(aq)+SO(aq) ΔH3,
根据盖斯定律,①+②-③得SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=ΔH1+ΔH2-ΔH3;
(2)①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
根据盖斯定律,由3×②-①×2+③×2得:CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=3×(-192.9 kJ·mol-1)-2×49.0 kJ·mol-1+(-44 kJ·mol-1)×2=-764 kJ·mol-1。
(3)反应热=反应物键能总和-生成物键能总和,P4+5O2=P4010,ΔH=6a+5c-(4x+12b)=-d,可得x= 。
16.(1) B或C A B
(2) 太阳 化学
(3)M
(4)3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254 kJ/mol
【详解】(1)中和热测定实验时,使用的酸和碱最好是酸稍微过量或碱稍微过量,故合理选项是B或C;
酸碱两种溶液混合的时候应一次性快速倒入,故合理选项是A;
铜是金属,容易导热,因此若用环形铜丝代替环形玻璃搅拌棒,导致反应放出的热量损失,会导致测定温度的数据偏低,故合理选项是B;
(2)过程I中H2O在太阳光作用下分解为H2、O2,过程I的能量转化形式为太阳能转化为化学能;
(3)M转化为N时需吸收能量,说明N含有的能量比M高,物质含有的能量越低,物质的稳定性就越强,因此M、N相比,较稳定的是M;
(4)已知反应I:2H2SO4(l)2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol 1,反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol 1
由图可知:反应II为:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),
根据盖斯定律,(I+III)×(-1),整理可得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254 kJ/mol。
17.(1)C(s)+ H2O(g)= CO(g)+ H2(g) △H=+131 kJ·mol-1
(2)436 kJ/mol
(3)CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol
【详解】(1)已知反应①C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;由盖斯定律可知,①-②-③可得反应C(s)+ H2O(g)= CO(g)+ H2(g),则C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(s)+ H2O(g)= CO(g)+ H2(g) △H=-394 kJ·mol-1-(-566kJ·mol-1)- (-484kJ·mol-1)=+131 kJ·mol-1。
(2)设H—H键的键能为x kJ/mol,则946kJ/mol+3x kJ/mol-6391kJ/mol=-92kJ/mol,解得x=436 kJ/mol,则H—H键的键能是436 kJ/mol。
(3)8g甲烷的物质的量为0.5mol,则1mol甲烷完全燃烧放出的热量为445kJ2=890 kJ,则
此反应的热化学方程式为:CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol。
18.(1)B
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ mol-1 +124.2kJ mol-1
(3)小于
【解析】(1)
煤、石油、天然气是化石能源,核能属于新能源,但不可再生,⑤太阳能、⑥生物质能、⑦风能、⑧氢能属于新能源,且可再生;
答案选B;
(2)
①在标准状况下,1.68L气体的物质的量是,质量为1.2g,则其摩尔质量是,其相对分子质量为16,仅由C、H两种元素组成,则其分子式为;根据题意分析,0.75mol在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.75kJ的热量,则1mol在25℃和101kPa下完全燃烧生成(g)和(l)时,放出(kJ)的热量,故表示该气体燃烧热的热化学方程式为。②已知:反应①,则相同条件下,反应反应②,根据盖斯定律,由(①-②)得反应的;
(3)
,意义为1mol氮气与3mol氢气完全反应生成2mol氨气放出的热量为92.4kJ,而该反应为可逆反应,1mol氮气与3mol氢气不能完全反应,所以放出的热量小于92.4kJ。
答案第1页,共2页
答案第1页,共2页
同课章节目录
