2024届高三新高考化学大一轮专题训练题-- --电离平衡(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练题-- --电离平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 514.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 21:52:31 | ||
图片预览




文档简介
2024届高三新高考化学大一轮专题训练题----电离平衡
一、单选题
1.(2022秋·贵州遵义·高二统考期中)下列物质的分类正确的是
选项 A B C D
强电解质
弱电解质
纯净物 碘酒 冰水混合物 淀粉
A.A B.B C.C D.D
2.(2022秋·广西贵港·高二桂平市浔州高级中学校考期中)一定温度下,向冰醋酸中加水进行稀释,稀释过程中溶液的导电能力随加水量(即加入水的体积)变化如图所示(不考虑稀释过程中的温度变化)。下列说法正确的是
A.醋酸的电离度在原点时为零,b点时最大
B.在溶液处于b点时,加入适量稀硫酸,醋酸的电离度增大
C.稀释过程溶液中c(CH3COO-)的关系:b>a>c
D.稀释过程中醋酸的电离平衡常数逐渐增大
3.(2022秋·广东佛山·高二顺德一中校考期中)下列关于弱电解质的电离平衡中,说法错误的是
A.将0.1 mol·L-1的CH3COOH溶液加水稀释,变大
B.向1L 0.1mol·L-1的CH3COOH溶液滴加NaOH溶液的过程中,n(CH3COOH)与n(CH3COO-)之和始终为0.1 mol
C.向0.1 mol·L-1的氨水中通氨气,NH3 H2O的电离程度增大
D.在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+蓝色+4Cl-[CuCl4]2-黄色+4H2O ΔH>0,向黄绿色的CuCl2溶液中加水,溶液变蓝
4.(2022秋·浙江·高二期中)室温下,下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液相同
B.相同浓度的两溶液消耗相同浓度溶液的体积相同
C.相同的两溶液中,
D.相同体积相同浓度的两溶液,加水稀释相同倍数时,
5.(2022秋·浙江·高二期中)常温下,下列事实不能说明BOH是弱碱的是
A.将的BOH溶液稀释10倍,测得
B.溶液中
C.一定浓度的BCl溶液显酸性
D.一定浓度的BOH溶液可以使酚酞溶液变浅红
6.(2022秋·广东茂名·高二化州市第一中学校考阶段练习)下列各图象中,不正确的是
A.图A中N2(g) + 3H2(g)2NH3(g)△H= - 92.4 kJ/mol
B.图B中向弱酸HA的稀溶液中加水稀释
C.图C中达平衡后,在t0时改变的条件可能是加入催化剂
D.图D中向NH4Al(SO4)2溶液中滴加过量NaOH溶液
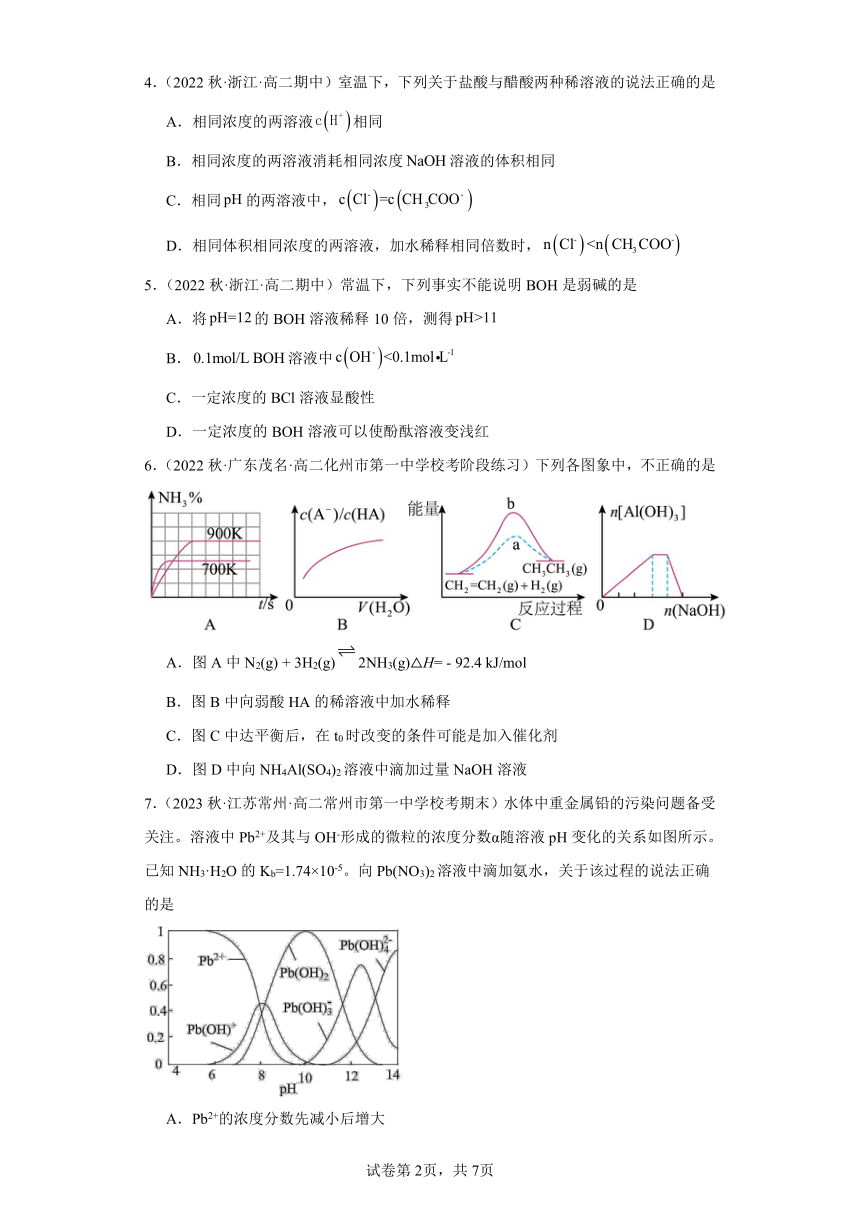
7.(2023秋·江苏常州·高二常州市第一中学校考期末)水体中重金属铅的污染问题备受关注。溶液中Pb2+及其与OH-形成的微粒的浓度分数α随溶液pH变化的关系如图所示。已知NH3·H2O的Kb=1.74×10-5。向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是
A.Pb2+的浓度分数先减小后增大
B.c()与c(Pb2+)的比值减小后增大,pH>10后不变
C.pH=7时,存在的阳离子仅有Pb2+、Pb(OH)+和H+
D.溶液中Pb2+与Pb(OH)2浓度相等时,氨主要以的形式存在
8.(2022秋·湖北恩施·高二校考阶段练习)常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.H2X的电离常数Ka1的数量级为10-2
B.水电离的(H+):N点C.曲线m代表lg溶液
D.当混合溶液呈中性时,c(H+)=c(OH-)
9.(2022秋·黑龙江牡丹江·高二牡丹江一中校考阶段练习)下列说法正确的是
A.非电解质路于水形成的溶液一定呈中性
B.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数保持不变,始终保持增大
C.向氨水中加入少量固体,的电离平衡逆向移动,增大
D.难溶性盐都是弱电解质
10.(2022秋·黑龙江哈尔滨·高二哈尔滨三中校考阶段练习)下列说法正确的有
①不溶于水的盐都是弱电解质
②可溶于水的盐都是强电解质
③熔融的电解质不一定都能导电
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥一元酸溶液中H+浓度一定为
A.1个 B.2个 C.3个 D.4个
二、多选题
11.(2022秋·安徽芜湖·高二安徽师范大学附属中学校考期中)常温下,现有pH=4的盐酸和醋酸溶液,下列说法正确的是
A.两种酸溶液中
B.分别加水稀释10倍后溶液的pH均变为5
C.中和等物质的量的氢氧化钠,消耗酸的体积:盐酸>醋酸
D.等体积的两种酸溶液分别与足量的锌粒反应,产生气体的体积相等
12.(2022秋·湖南长沙·高二长郡中学校考期中)常温下,一元碱MOH的。在某体系中,与不能穿过隔膜,仅未电离的MOH可自由穿过该膜(如图所示)。设溶液中,当达到平衡时,下列叙述正确的是
A.溶液I中
B.溶液II中MOH的电离度为
C.溶液I和II中的不相等
D.溶液I和II中的之比约为
13.(2022秋·山东济宁·高二校考阶段练习)醋酸溶液中存在电离平衡:CH3COOHH++CH3COO-,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25°C时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
14.(2022秋·湖南衡阳·高二衡阳市田家炳实验中学校考阶段练习)已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中增大,可以采取的措施是
A.加少量烧碱固体 B.升高温度 C.加少量冰醋酸 D.加水
三、非选择题
15.(2022·全国·高二专题练习)根据所学知识回答问题
(1)25 ℃时,HF的Ka=6.4×10-4,则此温度下0.1 mol·L-1HF溶液的c(H+)为 mol·L-1。
(2)25 ℃时,a mol·L-1 CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka= 。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++,H++,K2=1.0×10-2(25 ℃)。
①向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为 。
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为 。
(4)已知25 ℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13.现在该温度下将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。
(5)已知25 ℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下反应不能自发进行的是 (填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+
16.(2022·全国·高二专题练习)下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 HCN HClO
电离平衡常数()
(1)当温度升高时,K值 (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是 、 (用化学式表示),
②下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是 (填序号),
A.升高温度 B.加水稀释 C.加少量的固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式 。
(3)已知草酸是一种二元弱酸,其电离常数,,写出草酸的电离方程式 、 。
17.(2021秋·江西宜春·高二校考阶段练习)结合下表回答下列问题(均为常温下的数据):
酸 电离常数(Ka)
CH3COOH 1.8×10-5
HClO 3×10-8
H2CO3 K1=4.4×10-7K2=4.7×10-11
H2C2O4 K1=5.4×10-2K2=5.4×10-5
H2S K1=1.3×10-7K2=7.1×10-15
请回答下列问题:
(1)同浓度的CH3COO-、、、HC2O、ClO-、S2-中结合H+的能力最弱的是 。
(2)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
A.c(H+) B. C. D.c(OH-)
(3)用离子方程式表示NaClO溶液不呈中性原因 。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK NaClO(填“>”、“<”或“=”)。
18.(2022秋·四川广安·高二校考期中)回答下列问题
(1)写出醋酸的电离方程式: ;
(2)向醋酸溶液中加入少量水,电离平衡向 移动(填“左”或“右”) (填“增大”、“减小”或“不变”)。
(3)醋酸溶液和盐酸溶液与足量粉反应,初始速率 b;完全中和这两种酸,消耗的量a b(填“”、“”或“”)。
(4)已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数
以下说法不正确的是_______。填选项
A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】电解质是指在水溶液中或熔融状态下能够导电的化合物,在水溶液中能完全电离的电解质为强电解质,在水溶液中发生部分电离的电解质为弱电解质。
【详解】A.在水溶液中完全电离属于强电解质,且碘酒属于混合物,A错误;
B.为中强酸,属于弱电解质,B错误;
C.改组物质均符合上述物质的分类,C正确;
D.淀粉为高分子化合物,属于混合物,D错误;
故选C。
2.C
【详解】A.冰醋酸中加水稀释,随着水的不断加入,醋酸的浓度不断减小,电离度不断增大,原点时为零,但b点时不是最大,A不正确;
B.在溶液处于b点时,加入适量稀硫酸,增大了溶液中的c(H+),抑制醋酸电离的正向进行,醋酸的电离度减小,B不正确;
C.从图中可以看出,b点时溶液的导电能力最强,a点次之,c点最弱,导电能力与离子浓度成正比,则稀释过程溶液中c(CH3COO-)的关系:b>a>c,C正确;
D.稀释过程中,温度不变,而电离常数只受温度变化的影响,所以醋酸的电离平衡常数不变,D不正确;
故选C。
3.C
【详解】A.CH3COOH的电离平衡常数为Ka=,加水稀释,Ka不变,CH3COO-浓度减小,则=变大,故A正确;
B.向1L 0.1mol·L-1的CH3COOH溶液滴加NaOH溶液的过程中,两者反应生成CH3COONa和水,结合碳元素守恒,n(CH3COOH)与n(CH3COO-)之和始终为0.1 mol,故B正确;
C.弱电解质的浓度越大,电离程度越小,故向0.1 mol·L-1的氨水中通氨气,NH3 H2O浓度增大,电离程度减小,故C错误;
D.根据平衡:[Cu(H2O)4]2+蓝色+4Cl-[CuCl4]2-黄色+4H2O,向黄绿色的CuCl2溶液中加水,平衡逆向移动,溶液变蓝,故D正确;
故选:C。
4.C
【详解】A.盐酸是强酸完全电离,醋酸是弱酸部分电离,相同浓度的两溶液不相同,故A错误;
B.相同浓度的两溶液体积不确定,消耗相同浓度溶液的体积不能确定,故B错误;
C.相同的两溶液中,根据电荷守恒、,相同的两种溶液中存在,故C正确;
D.相同体积相同浓度的两溶液,加水稀释相同倍数时,醋酸可以接着电离但是总量不变,增大减小,不变,但是,故D错误;
故答案为C
5.D
【详解】A.将的BOH溶液稀释10倍,测得,说明稀释促进了BOH的电离,说明BOH部分电离,能证明 BOH是弱电解质,A正确;
B. 常温下,0.1mol/L一元强碱溶液中,0.1mol/LBOH溶液中,说明BOH不完全电离,BOH是弱碱,B正确;
C.一定浓度的BCl溶液显酸性,说明B+离子水解,导致溶液显酸性,说明BOH为弱碱,C正确;
D.碱溶液均可以使酚酞溶液变红,说明 BOH能电离出氢氧根离子,而不能说明 BOH的电离程度,所以不能证明 BOH是弱电解质,D错误;
答案选D。
6.A
【详解】A.温度高,反应速率快,达到平衡的时间就短,A项错误;
B.图B中向弱酸HA的稀溶液中加水稀释,加水促进电离,随着水的体积增大,纵坐标逐渐增大,B项正确;
C.图C中达平衡后,在时改变的条件可能是加入催化剂,催化剂能降低反应的活化能,C项正确;
D.图D中向溶液中滴加过量NaOH溶液,铝离子和氢氧根离子反应先生成氢氧化铝沉淀,氢氧化铝沉淀能继续和氢氧化钠反应,最后沉淀消失,D项正确;
答案选A。
7.D
【详解】A.由图示可知,Pb2+与OH–依次形成Pd(OH)+、Pd(OH)2、Pd(OH)、Pd(OH)四种微粒。随着pH的增大,Pb2+的浓度分数逐渐减小,当pH=10时,Pb2+的浓度分数减小为0,故A错误;
B.NO与Pb2+在同一溶液中,c(NO)与c(Pb2+)的比值等于其物质的量之比,滴加氨水过程中,随着pH的增大,n(Pb2+)逐渐减小,n(NO)不变,n(NO)与n(Pb2+)的比值增大,c(NO)与c(Pb2+)的比值增大,pH>10,c(Pb2+)减小为0时,比值无意义,故B错误;
C.当pH=7时,根据图示可知,溶液中存在的阳离子有Pb2+、Pb(OH)+、H+以及NH,故C错误;
D.当溶液中Pb2+与Pb(OH)2浓度相等时,由图可知,此时溶液pH约等于8,由NH3·H2O电离常数Kb = =1.74 ×10-5,则= = =17.4,故溶液中氨主要以NH形式存在,故D正确。
故答案为D。
8.B
【分析】根据直线m,当pH=0时或=-1.3,对应电离常数为10-1.3;根据直线n,当pH=0时或=-4.3,对应电离常数为10-4.3, ,所以、,曲线m代表lg溶液,曲线n代表溶液。
【详解】A.由分析可知,,Ka1的数量级为10-2,A项正确;
B.直线n表示pH与的关系,,N点=0,则c(H+)=1×10-4.3, HX-电离出氢离子使溶液呈酸性,则M点氢离子浓度更大,氢离子抑制水的电离,故水的电离程度:N点>M点,B项错误;
C.由分析可知,曲线m代表lg溶液,C项正确;
D.溶液呈中性时,H+浓度与OH-相等,D项正确;
答案选B。
9.C
【详解】A.二氧化碳是非电解质,它溶于水后溶液呈酸性,A错误;
B.温度不变加水稀释氢氟酸,电离平衡常数不变,当接近中性时,氢离子浓度接近10-7mol/L,氟离子浓度继续减小,二者比值减小,B错误;
C.氨水中的溶质是一元弱碱一水合氨,加碱氢氧根离子浓度增大,的电离平衡逆向移动,C正确;
D.难溶性盐硫酸钡、氯化银等是强电解质,D错误;
故选C。
10.C
【详解】①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅是易溶于水的弱电解质,故②错误;
③酸为共价化合物,在熔融状态时均以分子形式存在,不能电离,没有自由移动的离子,均不导电,只有溶于水时才能电离出离子而导电,故③正确;
④H+浓度与酸的浓度、分子中能电离出的氢离子的个数以及电离程度有关,与电解质的强弱无关,所以强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,故④正确;
⑤电解质溶液中的自由移动的阴阳离子在外加电场的作用下定向移动而导电,故⑤正确;
⑥一元酸溶液中H+浓度不一定为,如醋酸不完全电离,H+浓度小于,故⑥错误;
正确的是③④⑤,故选C。
11.AC
【详解】A.盐酸和醋酸溶液中存在电离守恒,c(CH3COO-)+c(OH-)=c(H+),c(Cl-)+c(OH-)=c(H+),两者pH相同则两溶液的c(OH-)和c(H+)分别相等,则c(CH3COO-)=c(Cl-),选项A正确;
B.盐酸是强酸,稀释10倍时,pH=4,醋酸是弱酸,存在电离平衡,稀释10倍时,电离平衡向右移动,pH小于4,选项B错误;
C.相同pH的盐酸的浓度比醋酸的浓度小的多,中和等物质的量的氢氧化钠,消耗酸的体积:盐酸>醋酸,选项C正确;
D.相同pH的盐酸的浓度比醋酸的浓度小的多,等体积的两种酸溶液分别与足量的锌粒反应,醋酸产生气体的体积多,选项D错误;
答案选AC。
12.BD
【详解】A.当溶液I的pH=7.0时,c(H+)=c(OH-) ,则溶液中除了氢离子外,还存在至少一种阳离子M+, 溶液I中,故A错误;
B.溶液II中MOH的电离度,故B正确;
C.根据题意,未电离的MOH可以自由穿过膜,说明当达到平衡时,溶液I与溶液I中的MOH的浓度相同,即平衡时cI(MOH)=cII(MOH),C错误;
D.常温下溶液的pH=7.0,溶液中c(OH-)=10-7mol/L,,,,溶液I中,溶液II pH=13,,,溶液I和II中的之比,故D正确;
故答案为BD
13.BD
【详解】A.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,物质电离需吸收热量,升高温度,促进醋酸电离,电离平衡正向移动,导致c(H+)增大,c(CH3COO-)增大,c(CH3COOH)减小,所以醋酸的电离常数Ka= 增大,A正确;
B.0.10 mol·L-1的CH3COOH溶液加水稀释,电离常数Ka不变,但c(H+)减小,溶液中将增大,B错误;
C.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,向溶液中加入少量的CH3COONa固体,c(CH3COO-)增大,电离平衡逆向移动,C正确;
D.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,向该溶液中加入少量冰醋酸,溶液中c(H+)增大,溶液pH减小;温度不变,醋酸的电离平衡常数Ka不变,D错误;
故选:BD。
14.BD
【详解】A.在醋酸溶液中氢氧化钠固体,氢氧根离子和氢离子反应,促进电离,平衡正向移动,醋酸根离子浓度增大,根据电离平衡常数进行分析,变小,故A错误;
B.电离过程吸热,升高温度,平衡正向移动,比值增大,B正确;
C.加入冰醋酸,平衡右移,但电离程度减小,比值减小,C错误;
D.加水稀释,促进电离,氢离子个数增多,醋酸分子个数减小,在同一溶液中,体积相同,所以比值增大,D正确;
故选BD。
15.(1)0.007 7
(2)
(3) H++NH3·H2O=+H2O +=+H2O+CO2↑
(4)因Ka(CH3COOH)<Ka(HSCN),所以相同温度、相同物质的量浓度和体积的两溶液中,HSCN溶液的c(H+)大于CH3COOH溶液的c(H+),故HSCN与NaHCO3反应速率大
(5)be
【详解】(1)Ka==6.4×10-4,故c(H+)=0.007 7 mol·L-1;
(2)25℃时,amol·L-1CH3COOH溶液的pH=b,溶液中剩余的醋酸分子的浓度为(a-10-b)mol/L,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=;
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++, H++SeO,K2=1.0×10-2(25℃),即硒酸的第一步电离是完全的,第二步电离是可逆的;
①向H2SeO4溶液中滴加少量氨水,氨水全部反应生成铵根离子,该反应的离子方程式为H++NH3·H2O=+H2O;
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,即硒酸的酸性强于碳酸,根据强酸制弱酸原理,KHCO3和KHSeO4两溶液混合反应生成和二氧化碳气体,离子方程式为+=+H2O+CO2↑;
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。现在该温度下将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL0.1mol·L-1NaHCO3溶液混合,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是因Ka(CH3COOH)(5)由此几种弱酸的电离平衡常数可知,Ka(HCOOH)>Ka1(H2CO3)>Ka(HCN)> Ka2(H2CO3);
a.Ka(HCOOH)>Ka(HCN),HCOOH+NaCN=HCOONa+HCN,a能自发进行;
b.Ka(HCN)> Ka2(H2CO3),NaHCO3+NaCN=Na2CO3+HCN,b不能自发进行;
c.Ka1(H2CO3)>Ka(HCN)> Ka2(H2CO3),NaCN+H2O+CO2=HCN+NaHCO3,c能自发进行;
d.Ka(HCOOH)>Ka1(H2CO3),2HCOOH+=2HCOO-+H2O+CO2↑,d能自发进行;
e.Ka1(H2CO3)>Ka(HCN)> Ka2(H2CO3),H2O+CO2+2CN-=2HCN+,e不能自发进行;
故选be。
16.(1)增大
(2) HCN HNO2 BE ClO- +CH3COOH = CH3COO- + HClO
(3) H2C2O4+ H+ + H+
【详解】(1)电离平衡常数只与温度有关,电离过程是吸热过程,故当温度升高时,K值增大;
(2)①同种条件下,电离平衡常数Ka越大,电离程度越大,酸性越强。根据表中数据,上述四种酸中,酸性最弱、最强的酸分别是HCN、HNO2;
②醋酸溶液中存在电离平衡,电离时吸热过程,而平衡常数仅跟温度有关。故分析如下:
A.升高温度,电离平衡向着正向移动,电离程度增大,Ka也增大,A不符合题意;
B.温度不变,加水稀释,平衡向着正向移动,电离程度增大,Ka不变,B符合题意;
C.加少量的固体,溶液中c(CH3COO-)增大,平衡逆向移动,电离程度减小,Ka不变,C不符合题意;
D.加少量冰醋酸,醋酸浓度增大,平衡正向移动,但电离程度减小,Ka不变,D不符合题意;
E.加氢氧化钠固体,消耗H+,溶液H+浓度减小,平衡正向移动,电离程度增大,但氢氧化钠固体溶于水放热,Ka先增大,后恢复室温,Ka不变,E符合题意;,
故答案选BE。
③由表格可知,醋酸的酸性比次氯酸大,由反应原理,强酸制弱酸,可知醋酸和次氯酸钠溶液能反应,相应的离子方程式是ClO- +CH3COOH = CH3COO- + HClO;
(3)草酸是二元弱酸,分步电离,电离方程式是H2C2O4+ H+; + H+;
17.(1)HC2O
(2)AC
(3)ClO-+H2OHClO+OH-
(4)>
【详解】(1)电离平衡常数越小、电离出氢离子能力越小、酸越弱,则其阴离子结合质子能力越强。由表知:HC2O电离能力最强,则CH3COO-、、、HC2O、ClO-、S2-中结合H+的能力最弱的是HC2O。
(2)A.稀释促进电离,有所增大,而体积增加得更快、变小,A正确;
B.稀释促进电离,有所增大,n(CH3COOH)变小,则增大,B错误;
C.稀释变小,常温下Kw不变,则变小,C正确;
D.稀释变小,常温下Kw不变,则增大,D错误;
故选AC。
(3)NaClO为强碱弱酸盐,ClO-水解显碱性,故NaClO溶液不呈中性原因为ClO-+H2OHClO+OH-。
(4)的酸性大于HClO,故ClO-的水解程度大于CH3COO-,故pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK>NaClO。
18.(1)CH3COOH CH3COO-+H+
(2) 右 增大
(3) < =
(4)A
【详解】(1)醋酸是弱酸,是部分电离。醋酸的电离方程式为;
(2)向醋酸溶液中加入少量水,根据越稀越电离可知电离平衡向右移动;减小,n(CH3COO-)增大,故增大;
(3)醋酸是弱酸,部分电离,盐酸是强酸,全部电离,所以等浓度的两种酸中,盐酸中的H+浓度大于醋酸,故同浓度的两溶液与足量粉反应,初始速率(4)A. 弱酸电离平衡常数只与温度有关,温度不变,常数不变,A错误;
B. 多元弱酸的酸性主要由第一步电离决定,B正确;
C.表中三种酸根据电离常数的比较可得酸性强弱顺序,电离常数越大,酸性越强,故酸性CH3COOH>H2CO3>HClO>HCO,C正确;
D. 因为HClO酸性弱于碳酸,根据较强酸可制较弱酸,向溶液中通入气体,生成次氯酸和碳酸氢钠,D正确;
故选A。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2022秋·贵州遵义·高二统考期中)下列物质的分类正确的是
选项 A B C D
强电解质
弱电解质
纯净物 碘酒 冰水混合物 淀粉
A.A B.B C.C D.D
2.(2022秋·广西贵港·高二桂平市浔州高级中学校考期中)一定温度下,向冰醋酸中加水进行稀释,稀释过程中溶液的导电能力随加水量(即加入水的体积)变化如图所示(不考虑稀释过程中的温度变化)。下列说法正确的是
A.醋酸的电离度在原点时为零,b点时最大
B.在溶液处于b点时,加入适量稀硫酸,醋酸的电离度增大
C.稀释过程溶液中c(CH3COO-)的关系:b>a>c
D.稀释过程中醋酸的电离平衡常数逐渐增大
3.(2022秋·广东佛山·高二顺德一中校考期中)下列关于弱电解质的电离平衡中,说法错误的是
A.将0.1 mol·L-1的CH3COOH溶液加水稀释,变大
B.向1L 0.1mol·L-1的CH3COOH溶液滴加NaOH溶液的过程中,n(CH3COOH)与n(CH3COO-)之和始终为0.1 mol
C.向0.1 mol·L-1的氨水中通氨气,NH3 H2O的电离程度增大
D.在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+蓝色+4Cl-[CuCl4]2-黄色+4H2O ΔH>0,向黄绿色的CuCl2溶液中加水,溶液变蓝
4.(2022秋·浙江·高二期中)室温下,下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液相同
B.相同浓度的两溶液消耗相同浓度溶液的体积相同
C.相同的两溶液中,
D.相同体积相同浓度的两溶液,加水稀释相同倍数时,
5.(2022秋·浙江·高二期中)常温下,下列事实不能说明BOH是弱碱的是
A.将的BOH溶液稀释10倍,测得
B.溶液中
C.一定浓度的BCl溶液显酸性
D.一定浓度的BOH溶液可以使酚酞溶液变浅红
6.(2022秋·广东茂名·高二化州市第一中学校考阶段练习)下列各图象中,不正确的是
A.图A中N2(g) + 3H2(g)2NH3(g)△H= - 92.4 kJ/mol
B.图B中向弱酸HA的稀溶液中加水稀释
C.图C中达平衡后,在t0时改变的条件可能是加入催化剂
D.图D中向NH4Al(SO4)2溶液中滴加过量NaOH溶液
7.(2023秋·江苏常州·高二常州市第一中学校考期末)水体中重金属铅的污染问题备受关注。溶液中Pb2+及其与OH-形成的微粒的浓度分数α随溶液pH变化的关系如图所示。已知NH3·H2O的Kb=1.74×10-5。向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是
A.Pb2+的浓度分数先减小后增大
B.c()与c(Pb2+)的比值减小后增大,pH>10后不变
C.pH=7时,存在的阳离子仅有Pb2+、Pb(OH)+和H+
D.溶液中Pb2+与Pb(OH)2浓度相等时,氨主要以的形式存在
8.(2022秋·湖北恩施·高二校考阶段练习)常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.H2X的电离常数Ka1的数量级为10-2
B.水电离的(H+):N点
D.当混合溶液呈中性时,c(H+)=c(OH-)
9.(2022秋·黑龙江牡丹江·高二牡丹江一中校考阶段练习)下列说法正确的是
A.非电解质路于水形成的溶液一定呈中性
B.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数保持不变,始终保持增大
C.向氨水中加入少量固体,的电离平衡逆向移动,增大
D.难溶性盐都是弱电解质
10.(2022秋·黑龙江哈尔滨·高二哈尔滨三中校考阶段练习)下列说法正确的有
①不溶于水的盐都是弱电解质
②可溶于水的盐都是强电解质
③熔融的电解质不一定都能导电
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥一元酸溶液中H+浓度一定为
A.1个 B.2个 C.3个 D.4个
二、多选题
11.(2022秋·安徽芜湖·高二安徽师范大学附属中学校考期中)常温下,现有pH=4的盐酸和醋酸溶液,下列说法正确的是
A.两种酸溶液中
B.分别加水稀释10倍后溶液的pH均变为5
C.中和等物质的量的氢氧化钠,消耗酸的体积:盐酸>醋酸
D.等体积的两种酸溶液分别与足量的锌粒反应,产生气体的体积相等
12.(2022秋·湖南长沙·高二长郡中学校考期中)常温下,一元碱MOH的。在某体系中,与不能穿过隔膜,仅未电离的MOH可自由穿过该膜(如图所示)。设溶液中,当达到平衡时,下列叙述正确的是
A.溶液I中
B.溶液II中MOH的电离度为
C.溶液I和II中的不相等
D.溶液I和II中的之比约为
13.(2022秋·山东济宁·高二校考阶段练习)醋酸溶液中存在电离平衡:CH3COOHH++CH3COO-,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25°C时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
14.(2022秋·湖南衡阳·高二衡阳市田家炳实验中学校考阶段练习)已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中增大,可以采取的措施是
A.加少量烧碱固体 B.升高温度 C.加少量冰醋酸 D.加水
三、非选择题
15.(2022·全国·高二专题练习)根据所学知识回答问题
(1)25 ℃时,HF的Ka=6.4×10-4,则此温度下0.1 mol·L-1HF溶液的c(H+)为 mol·L-1。
(2)25 ℃时,a mol·L-1 CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka= 。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++,H++,K2=1.0×10-2(25 ℃)。
①向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为 。
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为 。
(4)已知25 ℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13.现在该温度下将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。
(5)已知25 ℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下反应不能自发进行的是 (填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+
16.(2022·全国·高二专题练习)下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 HCN HClO
电离平衡常数()
(1)当温度升高时,K值 (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是 、 (用化学式表示),
②下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是 (填序号),
A.升高温度 B.加水稀释 C.加少量的固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式 。
(3)已知草酸是一种二元弱酸,其电离常数,,写出草酸的电离方程式 、 。
17.(2021秋·江西宜春·高二校考阶段练习)结合下表回答下列问题(均为常温下的数据):
酸 电离常数(Ka)
CH3COOH 1.8×10-5
HClO 3×10-8
H2CO3 K1=4.4×10-7K2=4.7×10-11
H2C2O4 K1=5.4×10-2K2=5.4×10-5
H2S K1=1.3×10-7K2=7.1×10-15
请回答下列问题:
(1)同浓度的CH3COO-、、、HC2O、ClO-、S2-中结合H+的能力最弱的是 。
(2)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
A.c(H+) B. C. D.c(OH-)
(3)用离子方程式表示NaClO溶液不呈中性原因 。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK NaClO(填“>”、“<”或“=”)。
18.(2022秋·四川广安·高二校考期中)回答下列问题
(1)写出醋酸的电离方程式: ;
(2)向醋酸溶液中加入少量水,电离平衡向 移动(填“左”或“右”) (填“增大”、“减小”或“不变”)。
(3)醋酸溶液和盐酸溶液与足量粉反应,初始速率 b;完全中和这两种酸,消耗的量a b(填“”、“”或“”)。
(4)已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数
以下说法不正确的是_______。填选项
A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】电解质是指在水溶液中或熔融状态下能够导电的化合物,在水溶液中能完全电离的电解质为强电解质,在水溶液中发生部分电离的电解质为弱电解质。
【详解】A.在水溶液中完全电离属于强电解质,且碘酒属于混合物,A错误;
B.为中强酸,属于弱电解质,B错误;
C.改组物质均符合上述物质的分类,C正确;
D.淀粉为高分子化合物,属于混合物,D错误;
故选C。
2.C
【详解】A.冰醋酸中加水稀释,随着水的不断加入,醋酸的浓度不断减小,电离度不断增大,原点时为零,但b点时不是最大,A不正确;
B.在溶液处于b点时,加入适量稀硫酸,增大了溶液中的c(H+),抑制醋酸电离的正向进行,醋酸的电离度减小,B不正确;
C.从图中可以看出,b点时溶液的导电能力最强,a点次之,c点最弱,导电能力与离子浓度成正比,则稀释过程溶液中c(CH3COO-)的关系:b>a>c,C正确;
D.稀释过程中,温度不变,而电离常数只受温度变化的影响,所以醋酸的电离平衡常数不变,D不正确;
故选C。
3.C
【详解】A.CH3COOH的电离平衡常数为Ka=,加水稀释,Ka不变,CH3COO-浓度减小,则=变大,故A正确;
B.向1L 0.1mol·L-1的CH3COOH溶液滴加NaOH溶液的过程中,两者反应生成CH3COONa和水,结合碳元素守恒,n(CH3COOH)与n(CH3COO-)之和始终为0.1 mol,故B正确;
C.弱电解质的浓度越大,电离程度越小,故向0.1 mol·L-1的氨水中通氨气,NH3 H2O浓度增大,电离程度减小,故C错误;
D.根据平衡:[Cu(H2O)4]2+蓝色+4Cl-[CuCl4]2-黄色+4H2O,向黄绿色的CuCl2溶液中加水,平衡逆向移动,溶液变蓝,故D正确;
故选:C。
4.C
【详解】A.盐酸是强酸完全电离,醋酸是弱酸部分电离,相同浓度的两溶液不相同,故A错误;
B.相同浓度的两溶液体积不确定,消耗相同浓度溶液的体积不能确定,故B错误;
C.相同的两溶液中,根据电荷守恒、,相同的两种溶液中存在,故C正确;
D.相同体积相同浓度的两溶液,加水稀释相同倍数时,醋酸可以接着电离但是总量不变,增大减小,不变,但是,故D错误;
故答案为C
5.D
【详解】A.将的BOH溶液稀释10倍,测得,说明稀释促进了BOH的电离,说明BOH部分电离,能证明 BOH是弱电解质,A正确;
B. 常温下,0.1mol/L一元强碱溶液中,0.1mol/LBOH溶液中,说明BOH不完全电离,BOH是弱碱,B正确;
C.一定浓度的BCl溶液显酸性,说明B+离子水解,导致溶液显酸性,说明BOH为弱碱,C正确;
D.碱溶液均可以使酚酞溶液变红,说明 BOH能电离出氢氧根离子,而不能说明 BOH的电离程度,所以不能证明 BOH是弱电解质,D错误;
答案选D。
6.A
【详解】A.温度高,反应速率快,达到平衡的时间就短,A项错误;
B.图B中向弱酸HA的稀溶液中加水稀释,加水促进电离,随着水的体积增大,纵坐标逐渐增大,B项正确;
C.图C中达平衡后,在时改变的条件可能是加入催化剂,催化剂能降低反应的活化能,C项正确;
D.图D中向溶液中滴加过量NaOH溶液,铝离子和氢氧根离子反应先生成氢氧化铝沉淀,氢氧化铝沉淀能继续和氢氧化钠反应,最后沉淀消失,D项正确;
答案选A。
7.D
【详解】A.由图示可知,Pb2+与OH–依次形成Pd(OH)+、Pd(OH)2、Pd(OH)、Pd(OH)四种微粒。随着pH的增大,Pb2+的浓度分数逐渐减小,当pH=10时,Pb2+的浓度分数减小为0,故A错误;
B.NO与Pb2+在同一溶液中,c(NO)与c(Pb2+)的比值等于其物质的量之比,滴加氨水过程中,随着pH的增大,n(Pb2+)逐渐减小,n(NO)不变,n(NO)与n(Pb2+)的比值增大,c(NO)与c(Pb2+)的比值增大,pH>10,c(Pb2+)减小为0时,比值无意义,故B错误;
C.当pH=7时,根据图示可知,溶液中存在的阳离子有Pb2+、Pb(OH)+、H+以及NH,故C错误;
D.当溶液中Pb2+与Pb(OH)2浓度相等时,由图可知,此时溶液pH约等于8,由NH3·H2O电离常数Kb = =1.74 ×10-5,则= = =17.4,故溶液中氨主要以NH形式存在,故D正确。
故答案为D。
8.B
【分析】根据直线m,当pH=0时或=-1.3,对应电离常数为10-1.3;根据直线n,当pH=0时或=-4.3,对应电离常数为10-4.3, ,所以、,曲线m代表lg溶液,曲线n代表溶液。
【详解】A.由分析可知,,Ka1的数量级为10-2,A项正确;
B.直线n表示pH与的关系,,N点=0,则c(H+)=1×10-4.3, HX-电离出氢离子使溶液呈酸性,则M点氢离子浓度更大,氢离子抑制水的电离,故水的电离程度:N点>M点,B项错误;
C.由分析可知,曲线m代表lg溶液,C项正确;
D.溶液呈中性时,H+浓度与OH-相等,D项正确;
答案选B。
9.C
【详解】A.二氧化碳是非电解质,它溶于水后溶液呈酸性,A错误;
B.温度不变加水稀释氢氟酸,电离平衡常数不变,当接近中性时,氢离子浓度接近10-7mol/L,氟离子浓度继续减小,二者比值减小,B错误;
C.氨水中的溶质是一元弱碱一水合氨,加碱氢氧根离子浓度增大,的电离平衡逆向移动,C正确;
D.难溶性盐硫酸钡、氯化银等是强电解质,D错误;
故选C。
10.C
【详解】①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅是易溶于水的弱电解质,故②错误;
③酸为共价化合物,在熔融状态时均以分子形式存在,不能电离,没有自由移动的离子,均不导电,只有溶于水时才能电离出离子而导电,故③正确;
④H+浓度与酸的浓度、分子中能电离出的氢离子的个数以及电离程度有关,与电解质的强弱无关,所以强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,故④正确;
⑤电解质溶液中的自由移动的阴阳离子在外加电场的作用下定向移动而导电,故⑤正确;
⑥一元酸溶液中H+浓度不一定为,如醋酸不完全电离,H+浓度小于,故⑥错误;
正确的是③④⑤,故选C。
11.AC
【详解】A.盐酸和醋酸溶液中存在电离守恒,c(CH3COO-)+c(OH-)=c(H+),c(Cl-)+c(OH-)=c(H+),两者pH相同则两溶液的c(OH-)和c(H+)分别相等,则c(CH3COO-)=c(Cl-),选项A正确;
B.盐酸是强酸,稀释10倍时,pH=4,醋酸是弱酸,存在电离平衡,稀释10倍时,电离平衡向右移动,pH小于4,选项B错误;
C.相同pH的盐酸的浓度比醋酸的浓度小的多,中和等物质的量的氢氧化钠,消耗酸的体积:盐酸>醋酸,选项C正确;
D.相同pH的盐酸的浓度比醋酸的浓度小的多,等体积的两种酸溶液分别与足量的锌粒反应,醋酸产生气体的体积多,选项D错误;
答案选AC。
12.BD
【详解】A.当溶液I的pH=7.0时,c(H+)=c(OH-) ,则溶液中除了氢离子外,还存在至少一种阳离子M+, 溶液I中,故A错误;
B.溶液II中MOH的电离度,故B正确;
C.根据题意,未电离的MOH可以自由穿过膜,说明当达到平衡时,溶液I与溶液I中的MOH的浓度相同,即平衡时cI(MOH)=cII(MOH),C错误;
D.常温下溶液的pH=7.0,溶液中c(OH-)=10-7mol/L,,,,溶液I中,溶液II pH=13,,,溶液I和II中的之比,故D正确;
故答案为BD
13.BD
【详解】A.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,物质电离需吸收热量,升高温度,促进醋酸电离,电离平衡正向移动,导致c(H+)增大,c(CH3COO-)增大,c(CH3COOH)减小,所以醋酸的电离常数Ka= 增大,A正确;
B.0.10 mol·L-1的CH3COOH溶液加水稀释,电离常数Ka不变,但c(H+)减小,溶液中将增大,B错误;
C.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,向溶液中加入少量的CH3COONa固体,c(CH3COO-)增大,电离平衡逆向移动,C正确;
D.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,向该溶液中加入少量冰醋酸,溶液中c(H+)增大,溶液pH减小;温度不变,醋酸的电离平衡常数Ka不变,D错误;
故选:BD。
14.BD
【详解】A.在醋酸溶液中氢氧化钠固体,氢氧根离子和氢离子反应,促进电离,平衡正向移动,醋酸根离子浓度增大,根据电离平衡常数进行分析,变小,故A错误;
B.电离过程吸热,升高温度,平衡正向移动,比值增大,B正确;
C.加入冰醋酸,平衡右移,但电离程度减小,比值减小,C错误;
D.加水稀释,促进电离,氢离子个数增多,醋酸分子个数减小,在同一溶液中,体积相同,所以比值增大,D正确;
故选BD。
15.(1)0.007 7
(2)
(3) H++NH3·H2O=+H2O +=+H2O+CO2↑
(4)因Ka(CH3COOH)<Ka(HSCN),所以相同温度、相同物质的量浓度和体积的两溶液中,HSCN溶液的c(H+)大于CH3COOH溶液的c(H+),故HSCN与NaHCO3反应速率大
(5)be
【详解】(1)Ka==6.4×10-4,故c(H+)=0.007 7 mol·L-1;
(2)25℃时,amol·L-1CH3COOH溶液的pH=b,溶液中剩余的醋酸分子的浓度为(a-10-b)mol/L,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=;
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++, H++SeO,K2=1.0×10-2(25℃),即硒酸的第一步电离是完全的,第二步电离是可逆的;
①向H2SeO4溶液中滴加少量氨水,氨水全部反应生成铵根离子,该反应的离子方程式为H++NH3·H2O=+H2O;
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,即硒酸的酸性强于碳酸,根据强酸制弱酸原理,KHCO3和KHSeO4两溶液混合反应生成和二氧化碳气体,离子方程式为+=+H2O+CO2↑;
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。现在该温度下将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL0.1mol·L-1NaHCO3溶液混合,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是因Ka(CH3COOH)
a.Ka(HCOOH)>Ka(HCN),HCOOH+NaCN=HCOONa+HCN,a能自发进行;
b.Ka(HCN)> Ka2(H2CO3),NaHCO3+NaCN=Na2CO3+HCN,b不能自发进行;
c.Ka1(H2CO3)>Ka(HCN)> Ka2(H2CO3),NaCN+H2O+CO2=HCN+NaHCO3,c能自发进行;
d.Ka(HCOOH)>Ka1(H2CO3),2HCOOH+=2HCOO-+H2O+CO2↑,d能自发进行;
e.Ka1(H2CO3)>Ka(HCN)> Ka2(H2CO3),H2O+CO2+2CN-=2HCN+,e不能自发进行;
故选be。
16.(1)增大
(2) HCN HNO2 BE ClO- +CH3COOH = CH3COO- + HClO
(3) H2C2O4+ H+ + H+
【详解】(1)电离平衡常数只与温度有关,电离过程是吸热过程,故当温度升高时,K值增大;
(2)①同种条件下,电离平衡常数Ka越大,电离程度越大,酸性越强。根据表中数据,上述四种酸中,酸性最弱、最强的酸分别是HCN、HNO2;
②醋酸溶液中存在电离平衡,电离时吸热过程,而平衡常数仅跟温度有关。故分析如下:
A.升高温度,电离平衡向着正向移动,电离程度增大,Ka也增大,A不符合题意;
B.温度不变,加水稀释,平衡向着正向移动,电离程度增大,Ka不变,B符合题意;
C.加少量的固体,溶液中c(CH3COO-)增大,平衡逆向移动,电离程度减小,Ka不变,C不符合题意;
D.加少量冰醋酸,醋酸浓度增大,平衡正向移动,但电离程度减小,Ka不变,D不符合题意;
E.加氢氧化钠固体,消耗H+,溶液H+浓度减小,平衡正向移动,电离程度增大,但氢氧化钠固体溶于水放热,Ka先增大,后恢复室温,Ka不变,E符合题意;,
故答案选BE。
③由表格可知,醋酸的酸性比次氯酸大,由反应原理,强酸制弱酸,可知醋酸和次氯酸钠溶液能反应,相应的离子方程式是ClO- +CH3COOH = CH3COO- + HClO;
(3)草酸是二元弱酸,分步电离,电离方程式是H2C2O4+ H+; + H+;
17.(1)HC2O
(2)AC
(3)ClO-+H2OHClO+OH-
(4)>
【详解】(1)电离平衡常数越小、电离出氢离子能力越小、酸越弱,则其阴离子结合质子能力越强。由表知:HC2O电离能力最强,则CH3COO-、、、HC2O、ClO-、S2-中结合H+的能力最弱的是HC2O。
(2)A.稀释促进电离,有所增大,而体积增加得更快、变小,A正确;
B.稀释促进电离,有所增大,n(CH3COOH)变小,则增大,B错误;
C.稀释变小,常温下Kw不变,则变小,C正确;
D.稀释变小,常温下Kw不变,则增大,D错误;
故选AC。
(3)NaClO为强碱弱酸盐,ClO-水解显碱性,故NaClO溶液不呈中性原因为ClO-+H2OHClO+OH-。
(4)的酸性大于HClO,故ClO-的水解程度大于CH3COO-,故pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK>NaClO。
18.(1)CH3COOH CH3COO-+H+
(2) 右 增大
(3) < =
(4)A
【详解】(1)醋酸是弱酸,是部分电离。醋酸的电离方程式为;
(2)向醋酸溶液中加入少量水,根据越稀越电离可知电离平衡向右移动;减小,n(CH3COO-)增大,故增大;
(3)醋酸是弱酸,部分电离,盐酸是强酸,全部电离,所以等浓度的两种酸中,盐酸中的H+浓度大于醋酸,故同浓度的两溶液与足量粉反应,初始速率
B. 多元弱酸的酸性主要由第一步电离决定,B正确;
C.表中三种酸根据电离常数的比较可得酸性强弱顺序,电离常数越大,酸性越强,故酸性CH3COOH>H2CO3>HClO>HCO,C正确;
D. 因为HClO酸性弱于碳酸,根据较强酸可制较弱酸,向溶液中通入气体,生成次氯酸和碳酸氢钠,D正确;
故选A。
答案第1页,共2页
答案第1页,共2页
同课章节目录
