2024届高三新高考化学大一轮专题训练题-化学平衡(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练题-化学平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 946.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 21:52:50 | ||
图片预览



文档简介
2024届高三新高考化学大一轮专题训练题-化学平衡
一、单选题
1.(2023·浙江·统考高考真题)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
2.(2023春·浙江金华·高一浙江金华第一中学校考期末)下列与化学反应能量变化相关的叙述正确的是
A.对于反应,在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变
B.同温同压下,在光照和点燃条件下的焓变不同
C.甲烷的标准燃烧热为,则甲烷燃烧的热化学方程式可表示为:
D.500℃、30MPa下,将和置于密闭容器中充分反应生成气体,放热,其热化学方程式为:
3.(2023春·广东汕尾·高一统考竞赛)在温度T时,某反应的,,则下列关于该反应的说法正确的是
A.,随温度升高而增大 B.,随温度升高而减小
C.,随温度升高而增大 D.,随温度升高而减小
4.(2023春·广东深圳·高一翠园中学校考期中)在一定温度下,恒容密闭容器中进行反应,下列说法正确的是
A.反应一段时间后只存在于和中
B.向容器中通入少量,反应速率增大
C.达到平衡状态时,与物质的量之比一定为1∶1
D.容器内密度不再变化时,判定反应已经达到平衡状态
5.(2023·湖南郴州·统考三模)下列实验目的、实验操作及实验现象都正确的是
选项 实验目的 实验操作 实验现象
A 验证支持燃烧 将点燃的导管伸入盛满的集气瓶中 安静地燃烧,发出淡蓝色火焰
B 探究晶体颗粒大小与溶液冷却速度的关系 把一小粒明矾晶体悬挂在40℃~50℃的饱和明矾溶液中,快速冷却 形成较大的明矾晶体
C 探究浓度对、相互转化的影响 取少量溶液于试管中,向其中滴加一定量稀硫酸,观察现象;再滴加一定量NaOH溶液,观察现象 滴加稀硫酸后溶液由黄色变为橙色,再滴加NaOH溶液,溶液又变为黄色
D 检验溴乙烷中含溴元素 加热溴乙烷与NaOH的混合液,然后滴加溶液 有淡黄色沉淀生成
A.A B.B C.C D.D
6.(2023春·海南海口·高二海南中学校考阶段练习)某温度下,反应CH2=CH2(g)+H2O(g)CH3CH2OH(g)在密闭容器中达到平衡,下列说法错误的是
A.增大压强,v正>v逆,平衡常数不变
B.加入催化剂,平衡时CH3CH2OH(g)的浓度不变
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率增大
7.(2023秋·江苏扬州·高三江苏省高邮中学校联考期末)二氧化硫是一种重要的化工原料,可以制取硫酸、焦亚硫酸钠等化工产品。其中,催化制取三氧化硫的热化学方程式为: 。在恒温恒压的密闭容器中进行二氧化硫转化成三氧化硫的反应时,下列说法正确的是
A.该反应中,反应物的键能之和大于产物的键能之和
B.升高温度,能加快反应速率,提高二氧化硫的平衡转化率
C.增大压强,可使平衡时的值增大
D.其他条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
8.(2023·北京顺义·牛栏山一中校考三模)CO2催化重整CH4的反应:
(Ⅰ)CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1,
主要副反应:(Ⅱ)H2(g)+CO2(g)CO(g)+H2O(g) ΔH2>0,
(Ⅲ)4H2(g)+CO2(g)CH4(g)+2H2O(g) ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法不正确的是
A.ΔH1=2ΔH2-ΔH3>0
B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
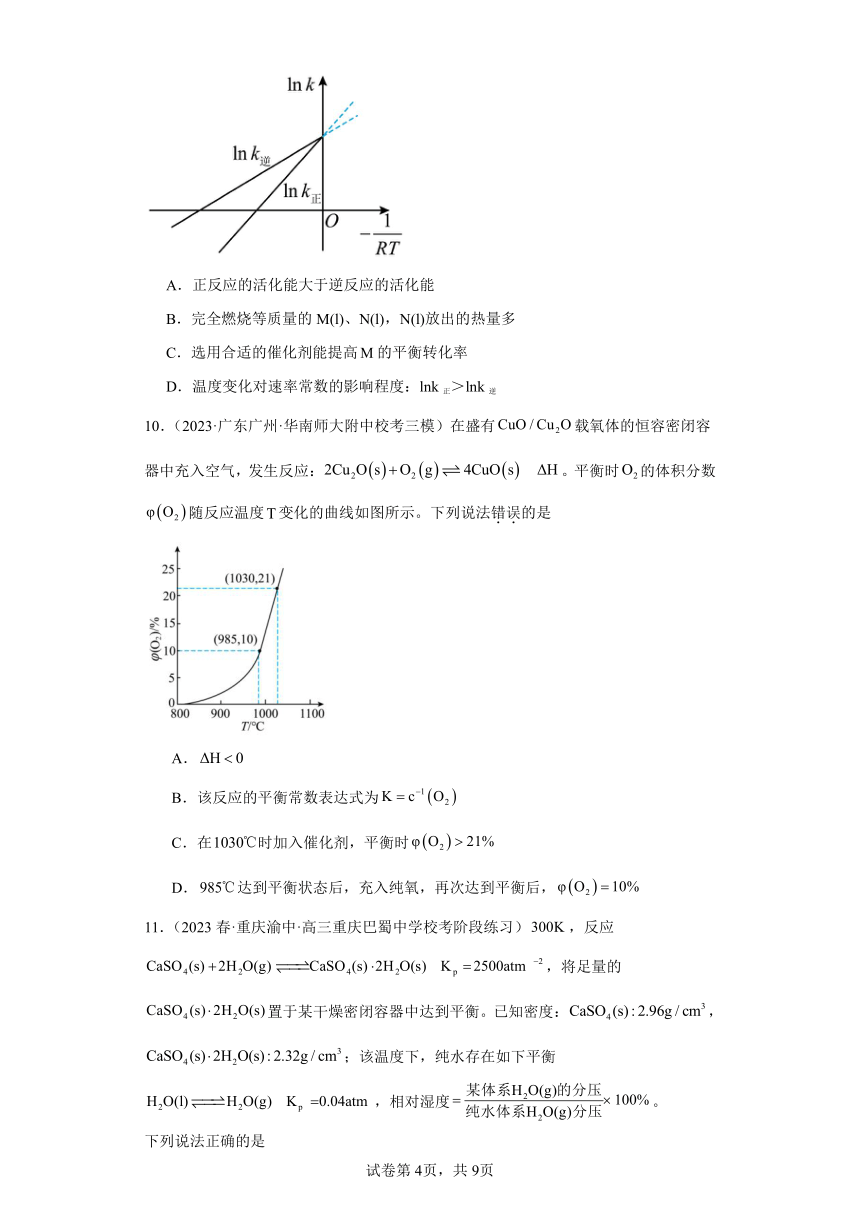
9.(2023春·湖北省直辖县级单位·高三统考阶段练习)阿伦尼乌斯经验公式为lnk=lnA(Ea为活化能,k为速率常数,R和A为常数),已知反应 (l) (l),其lnk正和lnk逆随温度变化的曲线如图所示。下列有关该反应的说法不正确的是
A.正反应的活化能大于逆反应的活化能
B.完全燃烧等质量的M(l)、N(l),N(l)放出的热量多
C.选用合适的催化剂能提高的平衡转化率
D.温度变化对速率常数的影响程度:lnk正>lnk逆
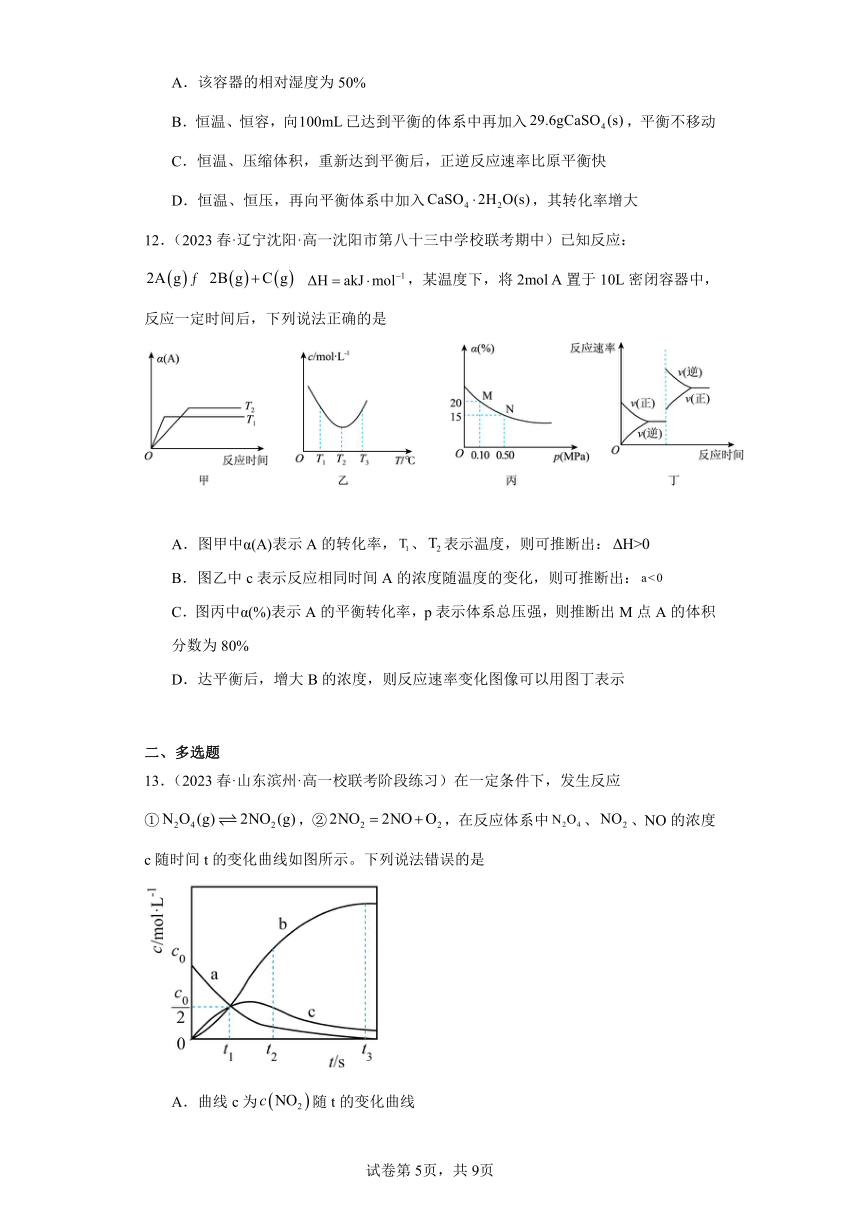
10.(2023·广东广州·华南师大附中校考三模)在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
A.
B.该反应的平衡常数表达式为
C.在时加入催化剂,平衡时
D.达到平衡状态后,充入纯氧,再次达到平衡后,
11.(2023春·重庆渝中·高三重庆巴蜀中学校考阶段练习),反应,将足量的置于某干燥密闭容器中达到平衡。已知密度:,;该温度下,纯水存在如下平衡,相对湿度。
下列说法正确的是
A.该容器的相对湿度为50%
B.恒温、恒容,向已达到平衡的体系中再加入,平衡不移动
C.恒温、压缩体积,重新达到平衡后,正逆反应速率比原平衡快
D.恒温、恒压,再向平衡体系中加入,其转化率增大
12.(2023春·辽宁沈阳·高一沈阳市第八十三中学校联考期中)已知反应: ,某温度下,将2mol A置于10L密闭容器中,反应一定时间后,下列说法正确的是
A.图甲中α(A)表示A的转化率,、表示温度,则可推断出:
B.图乙中c表示反应相同时间A的浓度随温度的变化,则可推断出:
C.图丙中α(%)表示A的平衡转化率,p表示体系总压强,则推断出M点A的体积分数为80%
D.达平衡后,增大B的浓度,则反应速率变化图像可以用图丁表示
二、多选题
13.(2023春·山东滨州·高一校联考阶段练习)在一定条件下,发生反应①,②,在反应体系中、、NO的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A.曲线c为随t的变化曲线
B.时间段内,反应速率
C.时,的消耗速率大于生成速率
D.后,
14.(2023·山东威海·威海市第一中学统考二模)丙烯在有机合成中应用广泛,由甲醇催化制丙烯的热化学方程式为: △H。Arrhenius经验公式为(为活化能,k为正或逆反应速率常数,R和C为与正、逆反应方向无关的常数),反应的实验数据如图所示。下列有关说法错误的是
A.在恒容密闭容器中,气体的压强不变,则该反应达到平衡
B.该反应的
C.温度为T1时,若测得逆反应的Rlnk的数据,则可以确定该反应的H
D.在恒容密闭容器的平衡体系中,增加CH3OH的物质的量,平衡正向移动,CH3OH的体积分数减小
三、非选择题
15.(2023·全国·高三专题练习)经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:
反应Ⅱ:
为分析催化剂对反应的选择性,在密闭容器中充入和,测得有关物质的物质的量随温度变化如图所示:
该催化剂在较低温度时主要选择 (填“反应Ⅰ”或“反应Ⅱ”)。时,反应Ⅰ的平衡常数 (只列算式不计算)。
16.(2022秋·新疆哈密·高二校考期末)工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g) 2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
气体 氮气 氢气 氨
熔点/℃ -210.01 -259.23 -77.74
沸点/℃ -195.79 -252.77 -33.42
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。温度升高,K值 (填“增大”“减小”或“不变”)。
(2)K值越大,表明___________(填序号)。
A.其他条件相同时N2的转化率越高
B.其他条件相同时NH3的产率越高
C.原料中N2的含量越高
D.化学反应速率越快
(3)对于合成氨反应而言,如图有关图像一定正确的是 (填字母)。
17.(2023·全国·高三专题练习)一定条件下,用或作催化剂对燃煤烟气回收。反应为。
(1)其他条件相同、催化剂不同,的转化率随反应温度的变化如图1,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是 。
(2)某科研小组用作催化剂,在时,分别研究了为1∶1、3∶1时转化率的变化情况(图2)。则图2中表示的变化曲线为 (填“a”或“b”)。
18.(2023·全国·高三专题练习)回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.增加浓度,平衡正向移动,但平衡时产物Ⅱ和产物I的比例可能降低,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
2.A
【详解】A.该反应是气体体积不变的反应,改变压强,化学平衡不移动,所以反应放出的热量不变,故A正确;
B.同温同压下,氢气和氯气在光照和点燃条件下都能生成氯化氢,由于反应物和生成物完全相同,光照和点燃条件下的焓变相同,故B错误;
C.甲烷的燃烧热是指1mol甲烷完全燃烧生成二氧化碳和液态水放出的热量,热化学方程式为,故C错误;
D.合成氨反应为可逆反应,可逆反应不可能完全反应,则0.5mol氮气与1.5mol氢气在500°C、30MPa下充分反应放热19.3kJ说明反应的焓变ΔH小于—38.6kJ/mol,故D错误;
故选A。
3.B
【解析】略
4.B
【详解】A.2SO2(g)+18O2(g)2SO3(g)反应可逆,反应一段时间后18O存在于O2、SO2和SO3中,故A错误;
B.向容器中通入少量,逆反应的反应物浓度增大,逆反应速率增大,导致正反应速率也随着增大,故B正确;
C.达到平衡状态时,SO2与SO3物质的量保持不变,SO2与SO3物质的量之比不一定为1∶1,故C错误;
D.反应前后气体总质量不变、容器体积不变,密度是恒量,容器内密度不再变化时,反应不一定达到平衡状态,故D错误;
选B。
5.C
【详解】A.将点燃的导管伸入盛满的集气瓶中,安静地燃烧,发出苍白色火焰,实验现象叙述错误,A错误;
B.快速冷却会形成比较多的细小结晶颗粒,不会出现大颗粒结晶,实验操作错误,B错误;
C.取少量溶液于试管中,向其中滴加一定量稀硫酸,浓度增大,溶液黄色变为橙色,转化为,,再滴加一定量NaOH溶液,浓度降低,溶液又变为黄色,转化为,C正确;
D.加热溴乙烷与NaOH的混合液时,为确保溴乙烷水解完全,NaOH应过量,故反应后混合液中含有未反应的NaOH,需先加稀硝酸中和NaOH至溶液呈酸性,再滴加溶液检验溴离子,实验操作错误,D错误;
故选C。
6.D
【详解】A.该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,则v正>v逆,平衡常数只与温度有关,则平衡常数不变,故A正确;
B.加入催化剂,化学平衡不移动,则平衡时CH3CH2OH(g)的浓度不变,故B正确;
C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,则平衡向正反应方向移动,故C正确;
D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率减小,故D错误;
故选D。
7.D
【详解】A.该反应放热,反应物的键能之和小于产物的键能之和,故A错误;
B.该反应放热,升高温度,平衡逆向移动,二氧化硫的平衡转化率减小,故B错误;
C.平衡常数只与温度有关,增大压强,K=的值不变,故C错误;
D.其他条件不变,催化剂能降低反应活化能,所以加入高效的催化剂能提高单位体积内的活化分子百分数,故D正确;
选D。
8.C
【分析】本题考查的是给定投料比的情况下平衡时各物质的体积分数与温度的图像的分析;1=2-3,正反应吸热,升温平衡向正向移动。
【详解】A.反应(I)可由2倍(II)减去反应(III)得到,故1=2-3,再根据图示随温度的升高,CH4和CO的体积分数减小,说明升温,平衡正移,而升温平衡向吸热方向移,正反应吸热,1>0,A正确
B.其他条件不变,适当增大起始时V(CH4):V(CO2),即增大CH4浓度和减小CO2浓度,根据平衡移动原理,减小反应物浓度或增加生成物浓度,平衡都逆向移动,B正确;
C.300~580°C时,H2O的体积分数不断增大,反应(I)是放热反应,升温平衡逆向移动消耗H2O,反应(II)是吸热反应,升温时正移生成H2O,而由于反应(I)消耗H2O的量小于反应(II)生成水的量, C错误;
D.T°C时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则CO转化的浓度为mol/L,根据三段式:
若不考虑副反应,则反应(I)的平衡常数=,但由于副反应( Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中分子减小的更多,值小于81,故D正确
故选C。
9.C
【详解】A.根据阿伦尼乌斯经验公式lnk=lnA-EaRT(Ea为活化能)可知,题图中曲线的斜率代表活化能大小,lnk正的斜率大,活化能大,A正确;
B.正反应的活化能大于逆反应的活化能,则该反应为吸热反应,生成物N的能量更高,完全燃烧等质量的M(l)、N(l),N(l)放出的热量更多,B正确;
C.催化剂只影响化学反应速率,不影响化学平衡,不能改变平衡转化率,C错误;
D.lnk正的斜率大,正反应的活化能大,温度变化对k正的影响程度大于对k逆的影响程度,D正确;
故选:C。
10.C
【详解】A.平衡时的体积分数随温度升高而增大,则升温平衡左移,,A正确;
B. 该反应方程式为,则按定义,其平衡常数表达式为,B正确;
C. 由图知,在时平衡时,催化剂通常能加快反应但不影响平衡,则加入催化剂时,C不正确;
D. 达到平衡状态后,充入纯氧不影响平衡常数,,则再次达到平衡后,,D正确;
答案选C。
11.A
【详解】A.反应CaSO4(s)+2H2O(g)CaSO4(s) 2H2O(s) Kp==2500,故p(H2O)=0.02atm;纯水存在如下平衡H2O(l) H2O(g) Kp =p(H2O)=0.04atm,该容器的相对湿度为=50%,故A正确;
B.恒温、恒容,向100mL已达到平衡的体系中再加入29.6g CaSO4(s),则占据容器的体积为10mL,相当于压缩体积,则平衡向正向移动,故B错误;
C.恒温、压缩体积,重新达到平衡后,因为平衡常数不变,故平衡时水的分压不变,故正逆反应速率不变,故C错误;
D.恒温、恒压,再向平衡体系中加入CaSO4 2H2O(s),其转化率不变,故D错误;
故选:A。
12.B
【详解】A.图甲中α(A)表示A的转化率,根据先拐先平衡数值大,则,从下到上,温度降低,转化率增大,说明正向移动,则正向放热反应即,故A错误;
B.图乙中c表示反应相同时间A的浓度随温度的变化,温度小于是正在建立平衡的极端,温度大于是平衡移动,升高温度,A的物质的量浓度升高,说明平衡逆向移动,则逆向是吸热反应,正向是放热反应即,故B正确;
C.图丙中α(%)表示A的平衡转化率,p表示体系总压强,则推断出M点A的转化率为20%即消耗0.4mol,剩余80%即剩余1.6mol,生成B的物质的量为0.4mol,C的物质的量为0.2mol,由于该反应是体积增大的反应,气体总物质的量为2.2mol,则A的体积分数小于80%,故C错误;
D.达平衡后,增大B的浓度,逆反应速率瞬间增大,正反应速率瞬间不变,后来两者趋于速率相等,故D错误。
综上所述,答案为B。
13.D
【分析】根据图像分析,NO2先生成后减小,故c表示NO2浓度变化,N2O4的浓度随着反应进行减小,a表示N2O4浓度大小,b为NO浓度大小以此分析;
【详解】A.根据分析可知,c表示NO2浓度变化,A正确;
B.根据图示可知,在t1时刻,N2O4、NO2、NO的浓度相同,则N2O4的减少量为,NO2、NO的增加均为,故时间段内,反应速率,B正确;
C.在t2时刻,NO2的浓度逐渐减小,说明消耗速率大于生成速率,C正确;
D.根据N原子守恒可知,,假设N2O4完全反应则生成NO浓度为2c0,但反应①均为可逆反应,则c(NO)<2c0,D错误;
故答案为:D。
14.BD
【详解】A.由题干反应方程式可知,该反应正反应是一个气体体积增大的方向,即在恒容密闭容器中,反应过程中气体的压强一直在改变,现在气体的压强不变,则该反应达到平衡,A正确;
B.根据图像并结合公式可得:9.2=-3.2Ea+C,4.4=-3.4Ea+C,联立方程,解得Ea=24kJ/mol,B错误;
C.由B项分析可求出Ea(正)和C的值,若温度为T1时,若测得逆反应的Rlnk的数据,则可求出Ea(逆),则可以确定该反应的H= Ea(正)- Ea(逆),C正确;
D.在恒容密闭容器的平衡体系中,增加CH3OH的物质的量,根据等效平衡原理可知,加入CH3OH相当于增大压强,上述平衡逆向移动,故CH3OH的体积分数增大,D错误;
故答案为:BD。
15. 反应I
【详解】温度较低时,的物质的量多,所以该催化剂在较低温度时主要选择反应I。
时,反应I已达平衡状态,且生成的、均是0.2mol,则:
此时各物质的浓度分别为:
,
,
,
,
所以反应Ⅰ的平衡常数。
16.(1) 减小
(2)AB
(3)ac
【详解】(1)平衡常数是反应达到平衡时,生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,N2(g)+3H2(g) 2NH3(g)反应的化学平衡常数表达式K=。正反应放热,温度升高,平衡逆向移动,K值减小。
(2)K值越大,表明反应进行的程度越大,所以其他条件相同时N2的转化率越高;其他条件相同时NH3的产率越高,故选AB。
(3)a.根据“先拐先平”,可知,N2(g)+3H2(g) 2NH3(g)正反应放热,温度升高,平衡逆向移动,氨气的体积分数降低,故a正确;
b.反应达到平衡状态,体系中各物质的浓度不一定相等,故b错误;
c.催化剂能加快反应速率,不能使平衡移动,故c正确;
选ac。
17.(1)作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源
(2)a
【详解】(1)根据图1可知,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源。
(2)在其他条件不变时,增大的浓度,可以提高的平衡转化率。由图2可知转化率:,所以曲线a表示的变化曲线,曲线b表示的变化曲线。
18.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023·浙江·统考高考真题)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
2.(2023春·浙江金华·高一浙江金华第一中学校考期末)下列与化学反应能量变化相关的叙述正确的是
A.对于反应,在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变
B.同温同压下,在光照和点燃条件下的焓变不同
C.甲烷的标准燃烧热为,则甲烷燃烧的热化学方程式可表示为:
D.500℃、30MPa下,将和置于密闭容器中充分反应生成气体,放热,其热化学方程式为:
3.(2023春·广东汕尾·高一统考竞赛)在温度T时,某反应的,,则下列关于该反应的说法正确的是
A.,随温度升高而增大 B.,随温度升高而减小
C.,随温度升高而增大 D.,随温度升高而减小
4.(2023春·广东深圳·高一翠园中学校考期中)在一定温度下,恒容密闭容器中进行反应,下列说法正确的是
A.反应一段时间后只存在于和中
B.向容器中通入少量,反应速率增大
C.达到平衡状态时,与物质的量之比一定为1∶1
D.容器内密度不再变化时,判定反应已经达到平衡状态
5.(2023·湖南郴州·统考三模)下列实验目的、实验操作及实验现象都正确的是
选项 实验目的 实验操作 实验现象
A 验证支持燃烧 将点燃的导管伸入盛满的集气瓶中 安静地燃烧,发出淡蓝色火焰
B 探究晶体颗粒大小与溶液冷却速度的关系 把一小粒明矾晶体悬挂在40℃~50℃的饱和明矾溶液中,快速冷却 形成较大的明矾晶体
C 探究浓度对、相互转化的影响 取少量溶液于试管中,向其中滴加一定量稀硫酸,观察现象;再滴加一定量NaOH溶液,观察现象 滴加稀硫酸后溶液由黄色变为橙色,再滴加NaOH溶液,溶液又变为黄色
D 检验溴乙烷中含溴元素 加热溴乙烷与NaOH的混合液,然后滴加溶液 有淡黄色沉淀生成
A.A B.B C.C D.D
6.(2023春·海南海口·高二海南中学校考阶段练习)某温度下,反应CH2=CH2(g)+H2O(g)CH3CH2OH(g)在密闭容器中达到平衡,下列说法错误的是
A.增大压强,v正>v逆,平衡常数不变
B.加入催化剂,平衡时CH3CH2OH(g)的浓度不变
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率增大
7.(2023秋·江苏扬州·高三江苏省高邮中学校联考期末)二氧化硫是一种重要的化工原料,可以制取硫酸、焦亚硫酸钠等化工产品。其中,催化制取三氧化硫的热化学方程式为: 。在恒温恒压的密闭容器中进行二氧化硫转化成三氧化硫的反应时,下列说法正确的是
A.该反应中,反应物的键能之和大于产物的键能之和
B.升高温度,能加快反应速率,提高二氧化硫的平衡转化率
C.增大压强,可使平衡时的值增大
D.其他条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
8.(2023·北京顺义·牛栏山一中校考三模)CO2催化重整CH4的反应:
(Ⅰ)CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1,
主要副反应:(Ⅱ)H2(g)+CO2(g)CO(g)+H2O(g) ΔH2>0,
(Ⅲ)4H2(g)+CO2(g)CH4(g)+2H2O(g) ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法不正确的是
A.ΔH1=2ΔH2-ΔH3>0
B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
9.(2023春·湖北省直辖县级单位·高三统考阶段练习)阿伦尼乌斯经验公式为lnk=lnA(Ea为活化能,k为速率常数,R和A为常数),已知反应 (l) (l),其lnk正和lnk逆随温度变化的曲线如图所示。下列有关该反应的说法不正确的是
A.正反应的活化能大于逆反应的活化能
B.完全燃烧等质量的M(l)、N(l),N(l)放出的热量多
C.选用合适的催化剂能提高的平衡转化率
D.温度变化对速率常数的影响程度:lnk正>lnk逆
10.(2023·广东广州·华南师大附中校考三模)在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
A.
B.该反应的平衡常数表达式为
C.在时加入催化剂,平衡时
D.达到平衡状态后,充入纯氧,再次达到平衡后,
11.(2023春·重庆渝中·高三重庆巴蜀中学校考阶段练习),反应,将足量的置于某干燥密闭容器中达到平衡。已知密度:,;该温度下,纯水存在如下平衡,相对湿度。
下列说法正确的是
A.该容器的相对湿度为50%
B.恒温、恒容,向已达到平衡的体系中再加入,平衡不移动
C.恒温、压缩体积,重新达到平衡后,正逆反应速率比原平衡快
D.恒温、恒压,再向平衡体系中加入,其转化率增大
12.(2023春·辽宁沈阳·高一沈阳市第八十三中学校联考期中)已知反应: ,某温度下,将2mol A置于10L密闭容器中,反应一定时间后,下列说法正确的是
A.图甲中α(A)表示A的转化率,、表示温度,则可推断出:
B.图乙中c表示反应相同时间A的浓度随温度的变化,则可推断出:
C.图丙中α(%)表示A的平衡转化率,p表示体系总压强,则推断出M点A的体积分数为80%
D.达平衡后,增大B的浓度,则反应速率变化图像可以用图丁表示
二、多选题
13.(2023春·山东滨州·高一校联考阶段练习)在一定条件下,发生反应①,②,在反应体系中、、NO的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A.曲线c为随t的变化曲线
B.时间段内,反应速率
C.时,的消耗速率大于生成速率
D.后,
14.(2023·山东威海·威海市第一中学统考二模)丙烯在有机合成中应用广泛,由甲醇催化制丙烯的热化学方程式为: △H。Arrhenius经验公式为(为活化能,k为正或逆反应速率常数,R和C为与正、逆反应方向无关的常数),反应的实验数据如图所示。下列有关说法错误的是
A.在恒容密闭容器中,气体的压强不变,则该反应达到平衡
B.该反应的
C.温度为T1时,若测得逆反应的Rlnk的数据,则可以确定该反应的H
D.在恒容密闭容器的平衡体系中,增加CH3OH的物质的量,平衡正向移动,CH3OH的体积分数减小
三、非选择题
15.(2023·全国·高三专题练习)经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:
反应Ⅱ:
为分析催化剂对反应的选择性,在密闭容器中充入和,测得有关物质的物质的量随温度变化如图所示:
该催化剂在较低温度时主要选择 (填“反应Ⅰ”或“反应Ⅱ”)。时,反应Ⅰ的平衡常数 (只列算式不计算)。
16.(2022秋·新疆哈密·高二校考期末)工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g) 2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
气体 氮气 氢气 氨
熔点/℃ -210.01 -259.23 -77.74
沸点/℃ -195.79 -252.77 -33.42
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。温度升高,K值 (填“增大”“减小”或“不变”)。
(2)K值越大,表明___________(填序号)。
A.其他条件相同时N2的转化率越高
B.其他条件相同时NH3的产率越高
C.原料中N2的含量越高
D.化学反应速率越快
(3)对于合成氨反应而言,如图有关图像一定正确的是 (填字母)。
17.(2023·全国·高三专题练习)一定条件下,用或作催化剂对燃煤烟气回收。反应为。
(1)其他条件相同、催化剂不同,的转化率随反应温度的变化如图1,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是 。
(2)某科研小组用作催化剂,在时,分别研究了为1∶1、3∶1时转化率的变化情况(图2)。则图2中表示的变化曲线为 (填“a”或“b”)。
18.(2023·全国·高三专题练习)回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.增加浓度,平衡正向移动,但平衡时产物Ⅱ和产物I的比例可能降低,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
2.A
【详解】A.该反应是气体体积不变的反应,改变压强,化学平衡不移动,所以反应放出的热量不变,故A正确;
B.同温同压下,氢气和氯气在光照和点燃条件下都能生成氯化氢,由于反应物和生成物完全相同,光照和点燃条件下的焓变相同,故B错误;
C.甲烷的燃烧热是指1mol甲烷完全燃烧生成二氧化碳和液态水放出的热量,热化学方程式为,故C错误;
D.合成氨反应为可逆反应,可逆反应不可能完全反应,则0.5mol氮气与1.5mol氢气在500°C、30MPa下充分反应放热19.3kJ说明反应的焓变ΔH小于—38.6kJ/mol,故D错误;
故选A。
3.B
【解析】略
4.B
【详解】A.2SO2(g)+18O2(g)2SO3(g)反应可逆,反应一段时间后18O存在于O2、SO2和SO3中,故A错误;
B.向容器中通入少量,逆反应的反应物浓度增大,逆反应速率增大,导致正反应速率也随着增大,故B正确;
C.达到平衡状态时,SO2与SO3物质的量保持不变,SO2与SO3物质的量之比不一定为1∶1,故C错误;
D.反应前后气体总质量不变、容器体积不变,密度是恒量,容器内密度不再变化时,反应不一定达到平衡状态,故D错误;
选B。
5.C
【详解】A.将点燃的导管伸入盛满的集气瓶中,安静地燃烧,发出苍白色火焰,实验现象叙述错误,A错误;
B.快速冷却会形成比较多的细小结晶颗粒,不会出现大颗粒结晶,实验操作错误,B错误;
C.取少量溶液于试管中,向其中滴加一定量稀硫酸,浓度增大,溶液黄色变为橙色,转化为,,再滴加一定量NaOH溶液,浓度降低,溶液又变为黄色,转化为,C正确;
D.加热溴乙烷与NaOH的混合液时,为确保溴乙烷水解完全,NaOH应过量,故反应后混合液中含有未反应的NaOH,需先加稀硝酸中和NaOH至溶液呈酸性,再滴加溶液检验溴离子,实验操作错误,D错误;
故选C。
6.D
【详解】A.该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,则v正>v逆,平衡常数只与温度有关,则平衡常数不变,故A正确;
B.加入催化剂,化学平衡不移动,则平衡时CH3CH2OH(g)的浓度不变,故B正确;
C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,则平衡向正反应方向移动,故C正确;
D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率减小,故D错误;
故选D。
7.D
【详解】A.该反应放热,反应物的键能之和小于产物的键能之和,故A错误;
B.该反应放热,升高温度,平衡逆向移动,二氧化硫的平衡转化率减小,故B错误;
C.平衡常数只与温度有关,增大压强,K=的值不变,故C错误;
D.其他条件不变,催化剂能降低反应活化能,所以加入高效的催化剂能提高单位体积内的活化分子百分数,故D正确;
选D。
8.C
【分析】本题考查的是给定投料比的情况下平衡时各物质的体积分数与温度的图像的分析;1=2-3,正反应吸热,升温平衡向正向移动。
【详解】A.反应(I)可由2倍(II)减去反应(III)得到,故1=2-3,再根据图示随温度的升高,CH4和CO的体积分数减小,说明升温,平衡正移,而升温平衡向吸热方向移,正反应吸热,1>0,A正确
B.其他条件不变,适当增大起始时V(CH4):V(CO2),即增大CH4浓度和减小CO2浓度,根据平衡移动原理,减小反应物浓度或增加生成物浓度,平衡都逆向移动,B正确;
C.300~580°C时,H2O的体积分数不断增大,反应(I)是放热反应,升温平衡逆向移动消耗H2O,反应(II)是吸热反应,升温时正移生成H2O,而由于反应(I)消耗H2O的量小于反应(II)生成水的量, C错误;
D.T°C时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则CO转化的浓度为mol/L,根据三段式:
若不考虑副反应,则反应(I)的平衡常数=,但由于副反应( Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中分子减小的更多,值小于81,故D正确
故选C。
9.C
【详解】A.根据阿伦尼乌斯经验公式lnk=lnA-EaRT(Ea为活化能)可知,题图中曲线的斜率代表活化能大小,lnk正的斜率大,活化能大,A正确;
B.正反应的活化能大于逆反应的活化能,则该反应为吸热反应,生成物N的能量更高,完全燃烧等质量的M(l)、N(l),N(l)放出的热量更多,B正确;
C.催化剂只影响化学反应速率,不影响化学平衡,不能改变平衡转化率,C错误;
D.lnk正的斜率大,正反应的活化能大,温度变化对k正的影响程度大于对k逆的影响程度,D正确;
故选:C。
10.C
【详解】A.平衡时的体积分数随温度升高而增大,则升温平衡左移,,A正确;
B. 该反应方程式为,则按定义,其平衡常数表达式为,B正确;
C. 由图知,在时平衡时,催化剂通常能加快反应但不影响平衡,则加入催化剂时,C不正确;
D. 达到平衡状态后,充入纯氧不影响平衡常数,,则再次达到平衡后,,D正确;
答案选C。
11.A
【详解】A.反应CaSO4(s)+2H2O(g)CaSO4(s) 2H2O(s) Kp==2500,故p(H2O)=0.02atm;纯水存在如下平衡H2O(l) H2O(g) Kp =p(H2O)=0.04atm,该容器的相对湿度为=50%,故A正确;
B.恒温、恒容,向100mL已达到平衡的体系中再加入29.6g CaSO4(s),则占据容器的体积为10mL,相当于压缩体积,则平衡向正向移动,故B错误;
C.恒温、压缩体积,重新达到平衡后,因为平衡常数不变,故平衡时水的分压不变,故正逆反应速率不变,故C错误;
D.恒温、恒压,再向平衡体系中加入CaSO4 2H2O(s),其转化率不变,故D错误;
故选:A。
12.B
【详解】A.图甲中α(A)表示A的转化率,根据先拐先平衡数值大,则,从下到上,温度降低,转化率增大,说明正向移动,则正向放热反应即,故A错误;
B.图乙中c表示反应相同时间A的浓度随温度的变化,温度小于是正在建立平衡的极端,温度大于是平衡移动,升高温度,A的物质的量浓度升高,说明平衡逆向移动,则逆向是吸热反应,正向是放热反应即,故B正确;
C.图丙中α(%)表示A的平衡转化率,p表示体系总压强,则推断出M点A的转化率为20%即消耗0.4mol,剩余80%即剩余1.6mol,生成B的物质的量为0.4mol,C的物质的量为0.2mol,由于该反应是体积增大的反应,气体总物质的量为2.2mol,则A的体积分数小于80%,故C错误;
D.达平衡后,增大B的浓度,逆反应速率瞬间增大,正反应速率瞬间不变,后来两者趋于速率相等,故D错误。
综上所述,答案为B。
13.D
【分析】根据图像分析,NO2先生成后减小,故c表示NO2浓度变化,N2O4的浓度随着反应进行减小,a表示N2O4浓度大小,b为NO浓度大小以此分析;
【详解】A.根据分析可知,c表示NO2浓度变化,A正确;
B.根据图示可知,在t1时刻,N2O4、NO2、NO的浓度相同,则N2O4的减少量为,NO2、NO的增加均为,故时间段内,反应速率,B正确;
C.在t2时刻,NO2的浓度逐渐减小,说明消耗速率大于生成速率,C正确;
D.根据N原子守恒可知,,假设N2O4完全反应则生成NO浓度为2c0,但反应①均为可逆反应,则c(NO)<2c0,D错误;
故答案为:D。
14.BD
【详解】A.由题干反应方程式可知,该反应正反应是一个气体体积增大的方向,即在恒容密闭容器中,反应过程中气体的压强一直在改变,现在气体的压强不变,则该反应达到平衡,A正确;
B.根据图像并结合公式可得:9.2=-3.2Ea+C,4.4=-3.4Ea+C,联立方程,解得Ea=24kJ/mol,B错误;
C.由B项分析可求出Ea(正)和C的值,若温度为T1时,若测得逆反应的Rlnk的数据,则可求出Ea(逆),则可以确定该反应的H= Ea(正)- Ea(逆),C正确;
D.在恒容密闭容器的平衡体系中,增加CH3OH的物质的量,根据等效平衡原理可知,加入CH3OH相当于增大压强,上述平衡逆向移动,故CH3OH的体积分数增大,D错误;
故答案为:BD。
15. 反应I
【详解】温度较低时,的物质的量多,所以该催化剂在较低温度时主要选择反应I。
时,反应I已达平衡状态,且生成的、均是0.2mol,则:
此时各物质的浓度分别为:
,
,
,
,
所以反应Ⅰ的平衡常数。
16.(1) 减小
(2)AB
(3)ac
【详解】(1)平衡常数是反应达到平衡时,生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,N2(g)+3H2(g) 2NH3(g)反应的化学平衡常数表达式K=。正反应放热,温度升高,平衡逆向移动,K值减小。
(2)K值越大,表明反应进行的程度越大,所以其他条件相同时N2的转化率越高;其他条件相同时NH3的产率越高,故选AB。
(3)a.根据“先拐先平”,可知,N2(g)+3H2(g) 2NH3(g)正反应放热,温度升高,平衡逆向移动,氨气的体积分数降低,故a正确;
b.反应达到平衡状态,体系中各物质的浓度不一定相等,故b错误;
c.催化剂能加快反应速率,不能使平衡移动,故c正确;
选ac。
17.(1)作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源
(2)a
【详解】(1)根据图1可知,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源。
(2)在其他条件不变时,增大的浓度,可以提高的平衡转化率。由图2可知转化率:,所以曲线a表示的变化曲线,曲线b表示的变化曲线。
18.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
答案第1页,共2页
答案第1页,共2页
同课章节目录
