2024届高三新高考化学大一轮专题训练题--化学反应热的计算(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练题--化学反应热的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 632.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 21:53:25 | ||
图片预览



文档简介
2024届高三新高考化学大一轮专题训练题--化学反应热的计算
一、单选题
1.(2023秋·高二课时练习)某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)发生中和反应,生成1 mol H2O(l)时放出52.3 kJ的热量,造成这一结果的原因不可能是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度
2.(2023春·浙江宁波·高二统考期末)查表得焓变数据(),下列能正确表示物质燃烧热的热化学方程式是
A.石墨:
B.:
C.:
D.:
3.(2023春·安徽安庆·高一安庆市第二中学校考阶段练习)用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
kJ mol
kJ mol
kJ mol
在溶液中,Cu与反应生成和的反应热等于
A.-417.91 kJ mol B.-319.68 kJ mol
C.+546.69 kJ mol D.-448.46 kJ mol
4.(2022秋·浙江杭州·高二杭州外国语学校校考期中)化学反应原理的研究始终与物质变化、能量变化紧密相连,过程中释放或吸收的能量在生产、生活和科学研究中具有广泛的应用。下列变化属于吸热反应的是
A.碘的升华 B.镁条在CO2中燃烧
C.镁与盐酸反应 D.Ba(OH)2·8H2O 与NH4Cl晶体混合反应
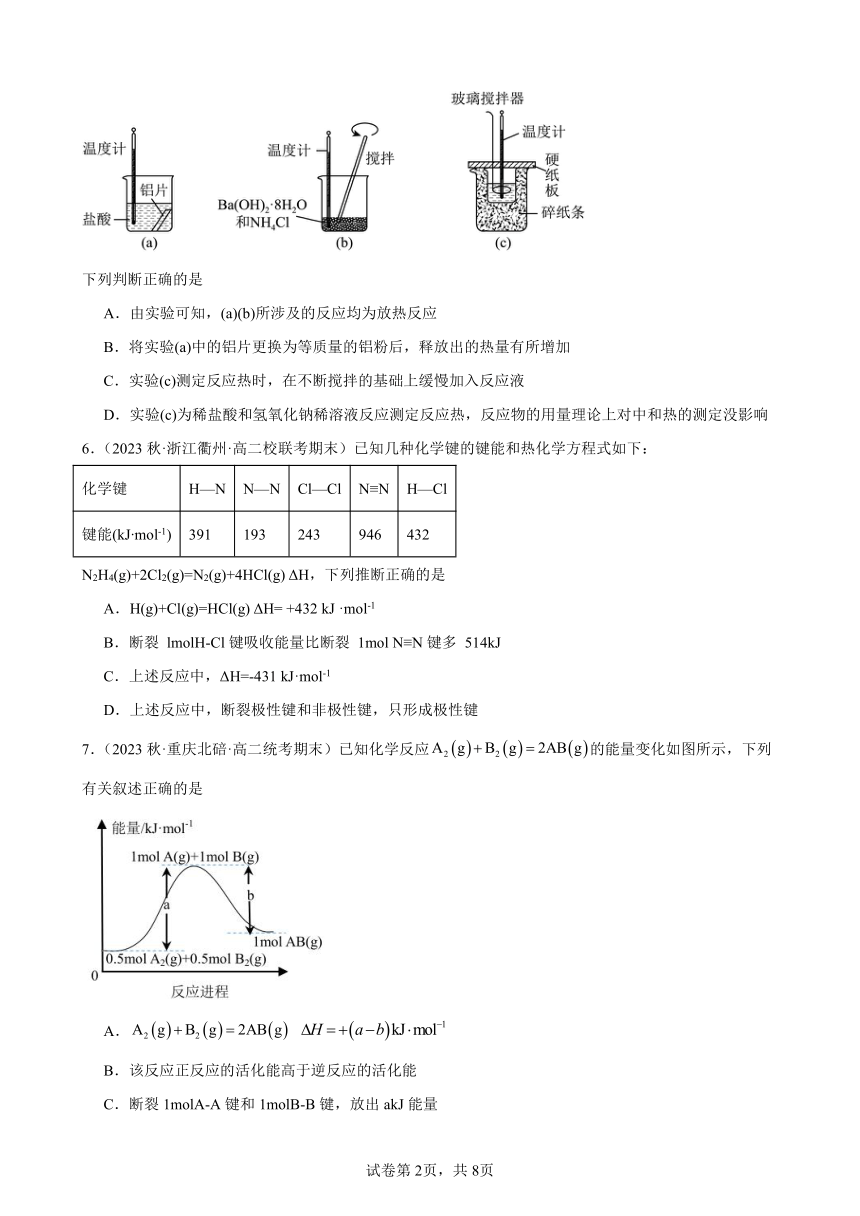
5.(2022·浙江·高二期中)某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是
A.由实验可知,(a)(b)所涉及的反应均为放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后,释放出的热量有所增加
C.实验(c)测定反应热时,在不断搅拌的基础上缓慢加入反应液
D.实验(c)为稀盐酸和氢氧化钠稀溶液反应测定反应热,反应物的用量理论上对中和热的测定没影响
6.(2023秋·浙江衢州·高二校联考期末)已知几种化学键的键能和热化学方程式如下:
化学键 H—N N—N Cl—Cl N≡N H—Cl
键能(kJ mol-1) 391 193 243 946 432
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是
A.H(g)+Cl(g)=HCl(g) ΔH= +432 kJ ·mol-1
B.断裂 lmolH-Cl键吸收能量比断裂 1mol N≡N键多 514kJ
C.上述反应中,ΔH=-431 kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
7.(2023秋·重庆北碚·高二统考期末)已知化学反应的能量变化如图所示,下列有关叙述正确的是
A.
B.该反应正反应的活化能高于逆反应的活化能
C.断裂1molA-A键和1molB-B键,放出akJ能量
D.破坏反应物中化学键所需的能量低于形成反应产物中化学键所释放的能量
8.(2023秋·山东济宁·高二嘉祥县第一中学校考期末)下列关于热化学方程式的叙述正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ mol -1,则H2燃烧热为483.6kJ mol -1
C.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2 则ΔH1 < ΔH2
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ mol-1,若将0.5 mol L -1的稀 H2SO4与1 mol L -1的NaOH的溶液等体积混合,放出的热量等于57.3 kJ
9.(2023秋·天津河西·高二天津市新华中学校考期末)某反应由两步反应A→B→C构成,反应能量曲线如图,下列叙述正确的是
A.两步反应均为吸热反应 B.A→B反应,反应条件一定要加热
C.A与C的能量差为E4 D.三种化合物中C最稳定
10.(2023秋·浙江绍兴·高二统考期末)已知共价键的键能与热化学方程式信息如表:
共价键 H-H H-N
键能/(kJ mol-1) 436 391
热化学方程式 N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ mol-1
则2N(g)=N2(g)的△H为
A.-1130.4kJ mol-1 B.-945.6kJ mol-1 C.+945.6kJ mol-1 D.+1130.4kJ mol-1
11.(2023秋·北京海淀·高二首都师范大学附属中学校考期末)反应的能量变化示意图如图所示。下列说法正确的是
A.1mol和1mol的内能之和为akJ
B.该反应每生成2个AB分子,吸收能量
C.该反应每生成1molAB,放出能量bkJ
D.反应 ,则
12.(2022秋·北京朝阳·高二统考期末)基元反应的反应过程如下图。下列分析不正确的是
A.该基元反应涉及键断裂和键形成
B.该基元反应属于吸热反应
C.使用催化剂,可以改变该反应
D.增大,该反应单位体积内活化分子数增多
13.(2023秋·北京东城·高二统考期末)已知反应:①
②
相关化学键的键能数据如下:
化学键 C-H C-F H-F F-F
键能/(kJ/mol) a b c d
下列说法正确的是
A.①中反应物的总能量小于生成物的总能量
B.
C.
D.
二、多选题
14.(2022秋·浙江杭州·高二杭师大附中校考期中)CO与O在催化剂表面形成化学键时的能量变化如下图所示。下列说法错误的是
A.该反应过程CO中C与O之间化学键发生完全断裂
B.从催化剂上脱离生成 的过程是吸热反应
C.CO和O生成了具有极性共价键的CO2
D.CO与O反应生成CO2的过程ΔH<0
三、非选择题
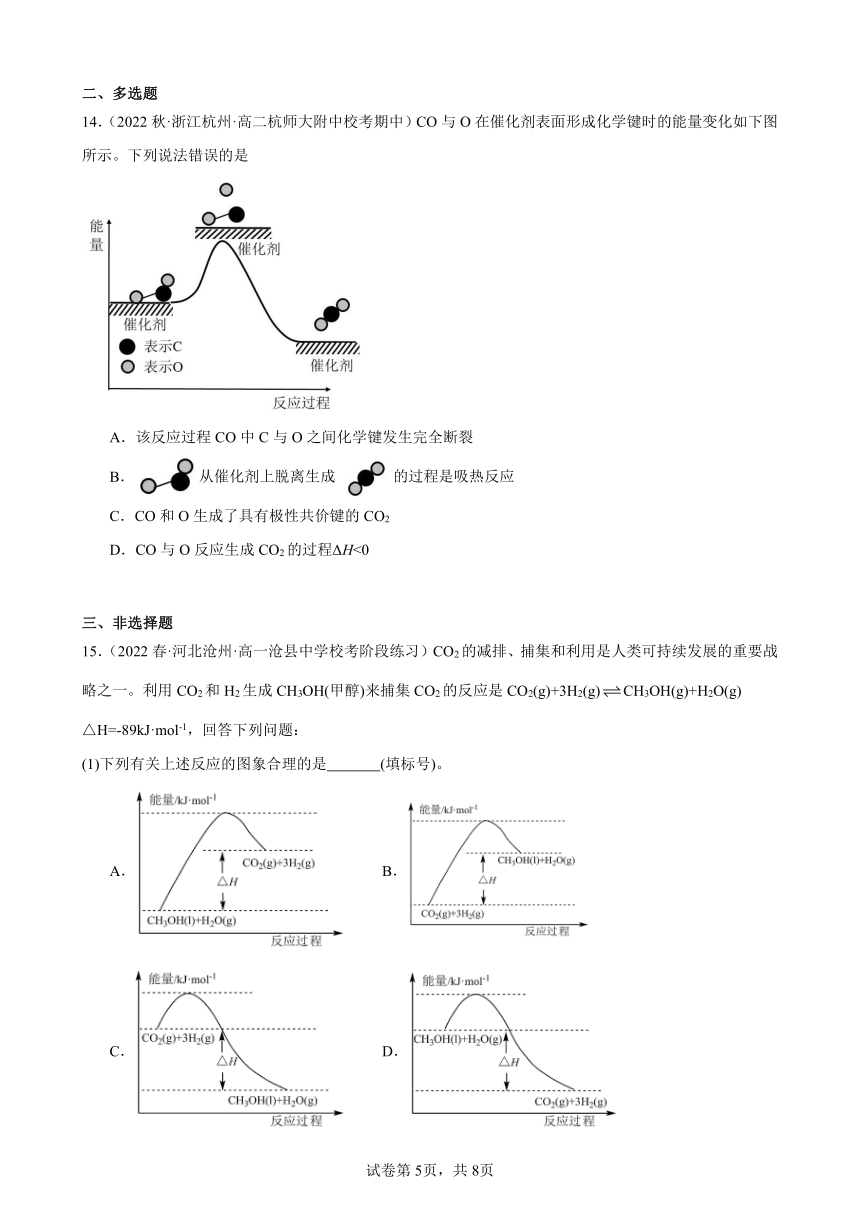
15.(2022春·河北沧州·高一沧县中学校考阶段练习)CO2的减排、捕集和利用是人类可持续发展的重要战略之一。利用CO2和H2生成CH3OH(甲醇)来捕集CO2的反应是CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-89kJ·mol-1,回答下列问题:
(1)下列有关上述反应的图象合理的是 (填标号)。
A. B.
C. D.
(2)①某温度下,向某恒容密闭容器中充入1molCO2(g)和3molH2(g),充分反应后,放出的热量 (填“>”“<”或“=”)89kJ。
②完全燃烧16g甲醇所消耗氧气的物质的量为 ,转移的电子数为 NA。
(3)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ热量,则该反应的热化学方程式为 。
(4)已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是 。
16.(2022春·山西太原·高一山西大附中校考阶段练习)填空
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式: 。
(2)在微生物作用的条件下,经过两步反应被氧化成。这两步的能量变化如图:
写出1mol(aq)全部氧化成(aq)的热化学方程式为
(3)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(1) ΔH=-xkJ·mol-1。蒸发1molH2O(1)需要吸收的能量为44kJ,其他相关数据如表:
物质 NH3(g) O2(g) NO(g) H2O(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ a b z d
则表中z的大小为 (用含x、a、b、d的代数式表示)。
(4)实验室用50mL0.25mol/L硫酸和50mL0.55mol/LNaOH溶液进行中和热的测定实验,测定数据如下:
温度 实验次数 起始温度t1/℃ 终止温度t/℃
H2SO4 NaOH 平均值
1 25.0 25.2 25.1 28.5
2 24.9 25.1 25.0 28.3
3 25.6 25.4 25.5 29.0
设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J/(g·℃),请根据实验数据求出中和热为ΔH= kJ/mol(保留一位小数)
17.(2022·全国·高三专题练习)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g)=(g)+H2(g) ΔH1=100.3kJ·mol 1 ①
H2(g)+I2(g)=2HI(g) ΔH2=﹣11.0kJ·mol 1 ②
对于反应:(g)+I2(g)=(g)+2HI(g) ③ ΔH3= kJ·mol 1。
7近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=83kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
18.(2022春·黑龙江大庆·高一铁人中学校考阶段练习)在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接获得。
(1)实验方法测定反应热
①中和反应反应热的测定:用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液进行中和反应。实验中所需要使用的仪器除量热计、量筒外,还需要的玻璃仪器有 。为了减少实验误差,实验过程中应将NaOH溶液 (填“一次性”或“分多次”)倒入盛有盐酸的量热计内筒中;溶液混合后,准确读取混合溶液的 ,记为终止温度。若量取盐酸溶液时俯视读数,会造成中和热数值 (填“偏大”或“偏小”)
②实验测得在一定温度下,0.2molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33kJ的热量,该反应的热化学方程式为 。
(2)通过化学计算间接获得反应热
①已知断裂1molH—H键、I—I键、H—I键需要吸收的能量分别为436kJ、153kJ、299kJ。则反应H2(g)+I2(g)=2HI(g)的△H= kJ·mol-1。
②已知:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
H2(g)+O2(g)=H2O(g) △H3=-241.8kJ·mol-1。
CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H= kJ·mol-1。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.若实验装置保温、隔热效果差,导致反应过程中有热量损失,测得反应热数值会偏小,故A正确;
B.量取盐酸仰视读数,导致盐酸体积偏大,在碱稍过量时,反应放出热量偏多,测得反应热数值会偏大,故B错误;
C.分多次将NaOH溶液倒入小烧杯中,会导致反应过程中有热量损失,测得反应热数值会偏小,故C正确;
D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度,使测得NaOH溶液初始温度偏高,温度差偏小,计算出的反应热数值会偏小,故D正确;
答案选B。
2.C
【详解】燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,注意产物是液态水,二氧化碳气体等。
A.CO不是碳元素的稳定的氧化物,应该是产生二氧化碳,A错误;
B.气态水不是稳定的氧化产物,应该是液态水,B错误;
C.1mol H2S完全燃烧生成稳定的二氧化硫气体和液态水,符合燃烧热的概念,放出的热量为燃烧热,C正确;
D.燃烧热是指1mol纯净物完全燃烧生成指定物质放出的热量,方程式中为4mol,不是燃烧热,D错误;
故选C。
3.B
【详解】在溶液中,Cu与反应生成和的热化学方程式可以写成:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H,该方程式可以由以下三个方程式进行整理得到
kJ mol①
kJ mol②
kJ mol③
根据盖斯定律得出该方程式,则△H=△H1++△H3=(+64.39)+×(-196.46)+(-285.84)=-319.68KJ/mol。
答案选B。
4.D
【详解】A.碘升华,需要吸热,是物理变化,为吸热过程,不是吸热反应,A错误;
B.燃烧是放热反应,镁条在CO2中燃烧是放热反应,B错误;
C.金属和酸发应是放热反应,镁与盐酸反应是放热反应,C错误;
D.Ba(OH)2·8H2O 与NH4Cl晶体混合反应是吸热反应,D正确;
故答案选D。
5.D
【详解】A.金属铝与酸的反应是放热反应,氢氧化钡晶体与氯化铵的反应是吸热反应,故A错误;
B.铝片更换为等质量的铝粉后,反应速率加快,但Al的物质的量不变,则反应放热不变,故B错误;
C.测定中和热时,在不断搅拌的基础上一次性迅速混合反应液,缓慢混合会使热量散失,误差大,故C错误;
D.中和热为在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量,反应物的用量理论上对中和热的测定没影响,故D正确;
故答案选D。
【点睛】本题考查中和热测定,把握反应中能量变化、中和热测定及注意事项为解答的关键。
6.C
【详解】A.H(g)+Cl(g)=HCl(g)是形成化学键的过程,是放热过程,△H=-432kJ/mol,故A错误;
B.断裂1molCl—Cl键吸收能量为243 kJ,断裂1molN≡N键吸收能量为946 kJ,因此断裂1molCl—Cl键吸收能量比断裂1molN≡N键少703kJ,故B错误;
C.焓变ΔH=反应物的键能之和-生成物的键能之和=4×(391 kJ/mol)+(193 kJ/mol)+2×(243 kJ/mol)-(946 kJ/mol)-4×(432 kJ/mol)=-431kJ/mol,故C正确;
D.上述反应中,断裂了N-H极性键和Cl-Cl、N-N非极性键,形成了H-Cl极性键和N≡N非极性键,故D错误;
故选C。
7.B
【详解】A.由能量变化图可知 ,A错误;
B.该反应正反应的活化能为a,逆反应活化能为b,由能量变化图可知该反应正反应的活化能高于逆反应的活化能,B正确;
C.由能量变化图可知,断裂1molA-A键和1molB-B键,吸收2akJ能量,C错误;
D.由能量变化图可知,破坏反应物中化学键所需的能量为a,形成反应产物中化学键所释放的能量为b,可以看出a>b,D错误;
故答案为:B。
8.C
【详解】A.石墨生成金刚石是吸热反应,说明金刚石的能量高于石墨,则石墨比金刚石稳定,A错误;
B.根据燃烧热的定义,应该是1mol氢气完全燃烧生成液态水时放出的热量为氢气的燃烧热,选项中氢气的物质的量不是1mol,且生成的是气态水,故氢气的燃烧热不是483.6kJ/mol,B错误;
C.S从固态转化为气态需要吸热,则ΔH2>ΔH1,C正确;
D.选项中酸碱等体积混合,但是并未说明酸碱溶液的体积为多少,因此无法计算反应放出的热量,D错误;
故答案选C。
9.D
【分析】A→B过程中反应物总能量小于生成总能量,反应为吸热反应,B→C过程中反应物总能量大于生成总能量,反应为放热反应,据此分析。
【详解】A.B→C过程中反应物总能量大于生成总能量,反应放热,A错误;
B.A→B过程中反应物总能量小于生成总能量,反应吸热反应,吸热反应也不一定需要加热,B错误;
C.根据图示可知,A→C过程放出热量大小为,故A与C的能量差为,C错误;
D.三种化合物中C的能量最低,物质自身能量越低越稳定,D正确;
故本题选D。
10.B
【详解】根据键能与焓变的关系, H = E(反应物的键能总和)- E(生成物的键能总和)可得,E(N-N) +3E(H-H) -6E(N-H)= -92.4kJ·mol-1,所以E(N-N)= 945.6 kJ·mol-1,故2N(g)=N2(g)的△H= -945.6 kJ·mol-1,故选B。
11.D
【分析】反应,生成吸收akJ能量;生成释放bkJ能量;据此分析解题。
【详解】A.akJ是生成吸收的能量,不是1mol和1mol的内能之和,故A错误;
B.根据图像判断,该反应每生成2molAB分子,吸收能量,故B错误;
C.该反应每生成1molAB,吸收能量;故C错误;
D.反应 ,反应,固体B转化为气体B为吸热过程,故D正确;
故答案选D。
12.C
【详解】A.由图示可知,该基元反应涉及H I键断裂和H H键形成,A正确;
B.断键吸收的能量大于成键放出的能量,该反应吸热,B正确;
C.催化剂只改变活化能,影响反应速率,不影响焓变,C错误;
D.增大c(HI),该反应单位体积内活化分子数增多,反应速率加快,D正确;
故选C。
13.D
【详解】A.①是放热反应,则反应物的总能量大于生成物的总能量,A错误;
B.反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,因此,B错误;
C.反应①②中生成物不同,,C错误;
D.依据盖斯定律②-①即得到 ,D正确;
答案选D。
14.AB
【详解】A.由图可知,该反应过程CO中C与O之间化学键没有发生完全断裂,故A错误:
B.由图可知从催化剂上脱离生成的过程,能量降低,是放热反应,故B错误;
C.CO2的结构式为O=C=O,CO2分子中存在碳氧极性共价键,故C正确;
D.CO和O原子反应生成CO2的过程是放热反应,则ΔH<0,故D正确;
本题答案AB。
15.(1)AC
(2) < 0.75mol 3
(3)2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1
(4)N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1
【详解】(1)由CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-89kJ·mol-1可知,CO2(g)和3H2(g)的总能量大于CH3OH(g)和H2O(g)的总能量,则符合该反应的图象是AC,故答案为:AC;
(2)①该反应为可逆反应,不可能彻底进行,因此向某恒容密闭容器中充入1molCO2(g)和3molH2(g),充分反应后,放出的热量小于89kJ,故答案为:<;
②甲醇燃烧的化学方程式为,燃烧2mol甲醇消耗3mol氧气,转移12mol电子,16g甲醇的物质的量为,则消耗氧气的物质的量为,转移电子,数目为3NA,故答案为:0.75mol;3;
(3)CO在O2中充分燃烧的方程式为2CO+O2(g)=2CO2,14gCO的物质的量为0.5mol,0.5molCO在足量的O2中充分燃烧,放出141.3 kJ的热,则2molCO完全燃烧放出565.2kJ热量,则该反应的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1,故答案为:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1;
(4)在反应N2(g)+3H2(g)2NH3(g) 中断裂3molH-H键,1molN≡N键共吸收的能量为,生成2mol NH3,共形成6mol N-H键,放出的能量为,ΔH=反应物键能之和-生成物键能之和=2254kJ-2346kJ=-92kJ,则N2与H2反应生成NH3的热化学方程式是N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1。
16.(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol
(2)(aq)+2O2(g)=(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1
(3)
(4)-56.8
【分析】最后一问是测定中和热,测定中和热是根据酸碱完全反应时放出的热量,通过测定溶液温度升高量测定出反应放出的热量,因此该实验是在简易量热计或量热计中进行,以此解题。
(1)
N2H4和H2O2反应的化学方程式为:,0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热,所以热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol;
(2)
由图可知,第一步热化学反应为①,第二部化学反应为:②,利用盖斯定律①+②可计算1molNH (aq) 全部氧化成NO(aq)的热化学方程式为:(aq)+2O2(g)=(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
(3)
由题给条件可得出,将此式与题干中的热化学方程式相加,可得,结合表中数据得,即可求出,;
(4)
测定中和热是根据酸碱完全反应时放出的热量,通过测定溶液温度升高量测定出反应放出的热量,因此该实验是在简易量热计或量热计中进行;实验1—4过程中溶液变化温度分别为3.4°C、3.3°C、3.5°C,因此溶液变化的平均温度为,50 mL0.55mol/L NaOH溶液和50 mL0.25mol/L H2SO4溶液恰好完全反应生成0.025mol H2O,放出的热量为,则测得中和热。
17.(1)89.3
(2)-116
【解析】(1)
根据盖斯定律可得:反应③=①+②,可得反应③的ΔH3= ΔH1 +ΔH2 =89.3kJ/mol;
(2)
根据盖斯定律知,(反应I+反应II+反应III)×2得4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) H=( H1+ H2+ H3)×2=-116kJ mol-1。
18.(1) 环形玻璃搅拌棒、烧杯 一次性 最高温度 偏小 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165kJ mol-1
(2) 9 392.8
【解析】(1)
①测定中和反应反应热时需用量筒取盐酸和NaOH溶液,需用温度计测定溶液的温度,反应时,为加快反应,则需环形玻璃搅拌棒进行搅拌,并在烧杯中进行反应;为减小热量损失,NaOH溶液应一次性加入;溶液混合后,用温度计测定混合溶液的最高温度,记为终止温度;若量取盐酸溶液时俯视读数,会造成盐酸体积偏小,中和热数值偏小。
②0.2molCH4(g)参加反应吸收33kJ的热量,1molCH4(g)参加反应吸收33kJ=165kJ的热量,该反应的热化学方程式为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165kJ mol-1。
(2)
①焓变△H=反应物键能之和-生成物键能之和=436kJ mol 1+153kJ mol 1 2×299kJ mol 1= 9kJ mol 1。
②已知:反应①CO(g)+2H2(g)=CH3OH(g) △H1=-90.8kJ·mol-1,反应②H2(g)+O2(g)=H2O(g) △H3=-241.8kJ·mol-1,应用盖斯定律,将②×2-①得:CH3OH(g)+O2(g)=CO(g)+2H2O(g),△H= 2ΔH3 ΔH1=2(-241.8kJ·mol-1)-(-90.8kJ·mol-1)= 392.8kJ mol 1。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023秋·高二课时练习)某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)发生中和反应,生成1 mol H2O(l)时放出52.3 kJ的热量,造成这一结果的原因不可能是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度
2.(2023春·浙江宁波·高二统考期末)查表得焓变数据(),下列能正确表示物质燃烧热的热化学方程式是
A.石墨:
B.:
C.:
D.:
3.(2023春·安徽安庆·高一安庆市第二中学校考阶段练习)用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
kJ mol
kJ mol
kJ mol
在溶液中,Cu与反应生成和的反应热等于
A.-417.91 kJ mol B.-319.68 kJ mol
C.+546.69 kJ mol D.-448.46 kJ mol
4.(2022秋·浙江杭州·高二杭州外国语学校校考期中)化学反应原理的研究始终与物质变化、能量变化紧密相连,过程中释放或吸收的能量在生产、生活和科学研究中具有广泛的应用。下列变化属于吸热反应的是
A.碘的升华 B.镁条在CO2中燃烧
C.镁与盐酸反应 D.Ba(OH)2·8H2O 与NH4Cl晶体混合反应
5.(2022·浙江·高二期中)某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是
A.由实验可知,(a)(b)所涉及的反应均为放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后,释放出的热量有所增加
C.实验(c)测定反应热时,在不断搅拌的基础上缓慢加入反应液
D.实验(c)为稀盐酸和氢氧化钠稀溶液反应测定反应热,反应物的用量理论上对中和热的测定没影响
6.(2023秋·浙江衢州·高二校联考期末)已知几种化学键的键能和热化学方程式如下:
化学键 H—N N—N Cl—Cl N≡N H—Cl
键能(kJ mol-1) 391 193 243 946 432
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是
A.H(g)+Cl(g)=HCl(g) ΔH= +432 kJ ·mol-1
B.断裂 lmolH-Cl键吸收能量比断裂 1mol N≡N键多 514kJ
C.上述反应中,ΔH=-431 kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
7.(2023秋·重庆北碚·高二统考期末)已知化学反应的能量变化如图所示,下列有关叙述正确的是
A.
B.该反应正反应的活化能高于逆反应的活化能
C.断裂1molA-A键和1molB-B键,放出akJ能量
D.破坏反应物中化学键所需的能量低于形成反应产物中化学键所释放的能量
8.(2023秋·山东济宁·高二嘉祥县第一中学校考期末)下列关于热化学方程式的叙述正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ mol -1,则H2燃烧热为483.6kJ mol -1
C.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2 则ΔH1 < ΔH2
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ mol-1,若将0.5 mol L -1的稀 H2SO4与1 mol L -1的NaOH的溶液等体积混合,放出的热量等于57.3 kJ
9.(2023秋·天津河西·高二天津市新华中学校考期末)某反应由两步反应A→B→C构成,反应能量曲线如图,下列叙述正确的是
A.两步反应均为吸热反应 B.A→B反应,反应条件一定要加热
C.A与C的能量差为E4 D.三种化合物中C最稳定
10.(2023秋·浙江绍兴·高二统考期末)已知共价键的键能与热化学方程式信息如表:
共价键 H-H H-N
键能/(kJ mol-1) 436 391
热化学方程式 N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ mol-1
则2N(g)=N2(g)的△H为
A.-1130.4kJ mol-1 B.-945.6kJ mol-1 C.+945.6kJ mol-1 D.+1130.4kJ mol-1
11.(2023秋·北京海淀·高二首都师范大学附属中学校考期末)反应的能量变化示意图如图所示。下列说法正确的是
A.1mol和1mol的内能之和为akJ
B.该反应每生成2个AB分子,吸收能量
C.该反应每生成1molAB,放出能量bkJ
D.反应 ,则
12.(2022秋·北京朝阳·高二统考期末)基元反应的反应过程如下图。下列分析不正确的是
A.该基元反应涉及键断裂和键形成
B.该基元反应属于吸热反应
C.使用催化剂,可以改变该反应
D.增大,该反应单位体积内活化分子数增多
13.(2023秋·北京东城·高二统考期末)已知反应:①
②
相关化学键的键能数据如下:
化学键 C-H C-F H-F F-F
键能/(kJ/mol) a b c d
下列说法正确的是
A.①中反应物的总能量小于生成物的总能量
B.
C.
D.
二、多选题
14.(2022秋·浙江杭州·高二杭师大附中校考期中)CO与O在催化剂表面形成化学键时的能量变化如下图所示。下列说法错误的是
A.该反应过程CO中C与O之间化学键发生完全断裂
B.从催化剂上脱离生成 的过程是吸热反应
C.CO和O生成了具有极性共价键的CO2
D.CO与O反应生成CO2的过程ΔH<0
三、非选择题
15.(2022春·河北沧州·高一沧县中学校考阶段练习)CO2的减排、捕集和利用是人类可持续发展的重要战略之一。利用CO2和H2生成CH3OH(甲醇)来捕集CO2的反应是CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-89kJ·mol-1,回答下列问题:
(1)下列有关上述反应的图象合理的是 (填标号)。
A. B.
C. D.
(2)①某温度下,向某恒容密闭容器中充入1molCO2(g)和3molH2(g),充分反应后,放出的热量 (填“>”“<”或“=”)89kJ。
②完全燃烧16g甲醇所消耗氧气的物质的量为 ,转移的电子数为 NA。
(3)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ热量,则该反应的热化学方程式为 。
(4)已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是 。
16.(2022春·山西太原·高一山西大附中校考阶段练习)填空
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式: 。
(2)在微生物作用的条件下,经过两步反应被氧化成。这两步的能量变化如图:
写出1mol(aq)全部氧化成(aq)的热化学方程式为
(3)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(1) ΔH=-xkJ·mol-1。蒸发1molH2O(1)需要吸收的能量为44kJ,其他相关数据如表:
物质 NH3(g) O2(g) NO(g) H2O(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ a b z d
则表中z的大小为 (用含x、a、b、d的代数式表示)。
(4)实验室用50mL0.25mol/L硫酸和50mL0.55mol/LNaOH溶液进行中和热的测定实验,测定数据如下:
温度 实验次数 起始温度t1/℃ 终止温度t/℃
H2SO4 NaOH 平均值
1 25.0 25.2 25.1 28.5
2 24.9 25.1 25.0 28.3
3 25.6 25.4 25.5 29.0
设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J/(g·℃),请根据实验数据求出中和热为ΔH= kJ/mol(保留一位小数)
17.(2022·全国·高三专题练习)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g)=(g)+H2(g) ΔH1=100.3kJ·mol 1 ①
H2(g)+I2(g)=2HI(g) ΔH2=﹣11.0kJ·mol 1 ②
对于反应:(g)+I2(g)=(g)+2HI(g) ③ ΔH3= kJ·mol 1。
7近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=83kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
18.(2022春·黑龙江大庆·高一铁人中学校考阶段练习)在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接获得。
(1)实验方法测定反应热
①中和反应反应热的测定:用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液进行中和反应。实验中所需要使用的仪器除量热计、量筒外,还需要的玻璃仪器有 。为了减少实验误差,实验过程中应将NaOH溶液 (填“一次性”或“分多次”)倒入盛有盐酸的量热计内筒中;溶液混合后,准确读取混合溶液的 ,记为终止温度。若量取盐酸溶液时俯视读数,会造成中和热数值 (填“偏大”或“偏小”)
②实验测得在一定温度下,0.2molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33kJ的热量,该反应的热化学方程式为 。
(2)通过化学计算间接获得反应热
①已知断裂1molH—H键、I—I键、H—I键需要吸收的能量分别为436kJ、153kJ、299kJ。则反应H2(g)+I2(g)=2HI(g)的△H= kJ·mol-1。
②已知:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
H2(g)+O2(g)=H2O(g) △H3=-241.8kJ·mol-1。
CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H= kJ·mol-1。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.若实验装置保温、隔热效果差,导致反应过程中有热量损失,测得反应热数值会偏小,故A正确;
B.量取盐酸仰视读数,导致盐酸体积偏大,在碱稍过量时,反应放出热量偏多,测得反应热数值会偏大,故B错误;
C.分多次将NaOH溶液倒入小烧杯中,会导致反应过程中有热量损失,测得反应热数值会偏小,故C正确;
D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度,使测得NaOH溶液初始温度偏高,温度差偏小,计算出的反应热数值会偏小,故D正确;
答案选B。
2.C
【详解】燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,注意产物是液态水,二氧化碳气体等。
A.CO不是碳元素的稳定的氧化物,应该是产生二氧化碳,A错误;
B.气态水不是稳定的氧化产物,应该是液态水,B错误;
C.1mol H2S完全燃烧生成稳定的二氧化硫气体和液态水,符合燃烧热的概念,放出的热量为燃烧热,C正确;
D.燃烧热是指1mol纯净物完全燃烧生成指定物质放出的热量,方程式中为4mol,不是燃烧热,D错误;
故选C。
3.B
【详解】在溶液中,Cu与反应生成和的热化学方程式可以写成:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H,该方程式可以由以下三个方程式进行整理得到
kJ mol①
kJ mol②
kJ mol③
根据盖斯定律得出该方程式,则△H=△H1++△H3=(+64.39)+×(-196.46)+(-285.84)=-319.68KJ/mol。
答案选B。
4.D
【详解】A.碘升华,需要吸热,是物理变化,为吸热过程,不是吸热反应,A错误;
B.燃烧是放热反应,镁条在CO2中燃烧是放热反应,B错误;
C.金属和酸发应是放热反应,镁与盐酸反应是放热反应,C错误;
D.Ba(OH)2·8H2O 与NH4Cl晶体混合反应是吸热反应,D正确;
故答案选D。
5.D
【详解】A.金属铝与酸的反应是放热反应,氢氧化钡晶体与氯化铵的反应是吸热反应,故A错误;
B.铝片更换为等质量的铝粉后,反应速率加快,但Al的物质的量不变,则反应放热不变,故B错误;
C.测定中和热时,在不断搅拌的基础上一次性迅速混合反应液,缓慢混合会使热量散失,误差大,故C错误;
D.中和热为在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量,反应物的用量理论上对中和热的测定没影响,故D正确;
故答案选D。
【点睛】本题考查中和热测定,把握反应中能量变化、中和热测定及注意事项为解答的关键。
6.C
【详解】A.H(g)+Cl(g)=HCl(g)是形成化学键的过程,是放热过程,△H=-432kJ/mol,故A错误;
B.断裂1molCl—Cl键吸收能量为243 kJ,断裂1molN≡N键吸收能量为946 kJ,因此断裂1molCl—Cl键吸收能量比断裂1molN≡N键少703kJ,故B错误;
C.焓变ΔH=反应物的键能之和-生成物的键能之和=4×(391 kJ/mol)+(193 kJ/mol)+2×(243 kJ/mol)-(946 kJ/mol)-4×(432 kJ/mol)=-431kJ/mol,故C正确;
D.上述反应中,断裂了N-H极性键和Cl-Cl、N-N非极性键,形成了H-Cl极性键和N≡N非极性键,故D错误;
故选C。
7.B
【详解】A.由能量变化图可知 ,A错误;
B.该反应正反应的活化能为a,逆反应活化能为b,由能量变化图可知该反应正反应的活化能高于逆反应的活化能,B正确;
C.由能量变化图可知,断裂1molA-A键和1molB-B键,吸收2akJ能量,C错误;
D.由能量变化图可知,破坏反应物中化学键所需的能量为a,形成反应产物中化学键所释放的能量为b,可以看出a>b,D错误;
故答案为:B。
8.C
【详解】A.石墨生成金刚石是吸热反应,说明金刚石的能量高于石墨,则石墨比金刚石稳定,A错误;
B.根据燃烧热的定义,应该是1mol氢气完全燃烧生成液态水时放出的热量为氢气的燃烧热,选项中氢气的物质的量不是1mol,且生成的是气态水,故氢气的燃烧热不是483.6kJ/mol,B错误;
C.S从固态转化为气态需要吸热,则ΔH2>ΔH1,C正确;
D.选项中酸碱等体积混合,但是并未说明酸碱溶液的体积为多少,因此无法计算反应放出的热量,D错误;
故答案选C。
9.D
【分析】A→B过程中反应物总能量小于生成总能量,反应为吸热反应,B→C过程中反应物总能量大于生成总能量,反应为放热反应,据此分析。
【详解】A.B→C过程中反应物总能量大于生成总能量,反应放热,A错误;
B.A→B过程中反应物总能量小于生成总能量,反应吸热反应,吸热反应也不一定需要加热,B错误;
C.根据图示可知,A→C过程放出热量大小为,故A与C的能量差为,C错误;
D.三种化合物中C的能量最低,物质自身能量越低越稳定,D正确;
故本题选D。
10.B
【详解】根据键能与焓变的关系, H = E(反应物的键能总和)- E(生成物的键能总和)可得,E(N-N) +3E(H-H) -6E(N-H)= -92.4kJ·mol-1,所以E(N-N)= 945.6 kJ·mol-1,故2N(g)=N2(g)的△H= -945.6 kJ·mol-1,故选B。
11.D
【分析】反应,生成吸收akJ能量;生成释放bkJ能量;据此分析解题。
【详解】A.akJ是生成吸收的能量,不是1mol和1mol的内能之和,故A错误;
B.根据图像判断,该反应每生成2molAB分子,吸收能量,故B错误;
C.该反应每生成1molAB,吸收能量;故C错误;
D.反应 ,反应,固体B转化为气体B为吸热过程,故D正确;
故答案选D。
12.C
【详解】A.由图示可知,该基元反应涉及H I键断裂和H H键形成,A正确;
B.断键吸收的能量大于成键放出的能量,该反应吸热,B正确;
C.催化剂只改变活化能,影响反应速率,不影响焓变,C错误;
D.增大c(HI),该反应单位体积内活化分子数增多,反应速率加快,D正确;
故选C。
13.D
【详解】A.①是放热反应,则反应物的总能量大于生成物的总能量,A错误;
B.反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,因此,B错误;
C.反应①②中生成物不同,,C错误;
D.依据盖斯定律②-①即得到 ,D正确;
答案选D。
14.AB
【详解】A.由图可知,该反应过程CO中C与O之间化学键没有发生完全断裂,故A错误:
B.由图可知从催化剂上脱离生成的过程,能量降低,是放热反应,故B错误;
C.CO2的结构式为O=C=O,CO2分子中存在碳氧极性共价键,故C正确;
D.CO和O原子反应生成CO2的过程是放热反应,则ΔH<0,故D正确;
本题答案AB。
15.(1)AC
(2) < 0.75mol 3
(3)2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1
(4)N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1
【详解】(1)由CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-89kJ·mol-1可知,CO2(g)和3H2(g)的总能量大于CH3OH(g)和H2O(g)的总能量,则符合该反应的图象是AC,故答案为:AC;
(2)①该反应为可逆反应,不可能彻底进行,因此向某恒容密闭容器中充入1molCO2(g)和3molH2(g),充分反应后,放出的热量小于89kJ,故答案为:<;
②甲醇燃烧的化学方程式为,燃烧2mol甲醇消耗3mol氧气,转移12mol电子,16g甲醇的物质的量为,则消耗氧气的物质的量为,转移电子,数目为3NA,故答案为:0.75mol;3;
(3)CO在O2中充分燃烧的方程式为2CO+O2(g)=2CO2,14gCO的物质的量为0.5mol,0.5molCO在足量的O2中充分燃烧,放出141.3 kJ的热,则2molCO完全燃烧放出565.2kJ热量,则该反应的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1,故答案为:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2kJ·mol-1;
(4)在反应N2(g)+3H2(g)2NH3(g) 中断裂3molH-H键,1molN≡N键共吸收的能量为,生成2mol NH3,共形成6mol N-H键,放出的能量为,ΔH=反应物键能之和-生成物键能之和=2254kJ-2346kJ=-92kJ,则N2与H2反应生成NH3的热化学方程式是N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1。
16.(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol
(2)(aq)+2O2(g)=(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1
(3)
(4)-56.8
【分析】最后一问是测定中和热,测定中和热是根据酸碱完全反应时放出的热量,通过测定溶液温度升高量测定出反应放出的热量,因此该实验是在简易量热计或量热计中进行,以此解题。
(1)
N2H4和H2O2反应的化学方程式为:,0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热,所以热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol;
(2)
由图可知,第一步热化学反应为①,第二部化学反应为:②,利用盖斯定律①+②可计算1molNH (aq) 全部氧化成NO(aq)的热化学方程式为:(aq)+2O2(g)=(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
(3)
由题给条件可得出,将此式与题干中的热化学方程式相加,可得,结合表中数据得,即可求出,;
(4)
测定中和热是根据酸碱完全反应时放出的热量,通过测定溶液温度升高量测定出反应放出的热量,因此该实验是在简易量热计或量热计中进行;实验1—4过程中溶液变化温度分别为3.4°C、3.3°C、3.5°C,因此溶液变化的平均温度为,50 mL0.55mol/L NaOH溶液和50 mL0.25mol/L H2SO4溶液恰好完全反应生成0.025mol H2O,放出的热量为,则测得中和热。
17.(1)89.3
(2)-116
【解析】(1)
根据盖斯定律可得:反应③=①+②,可得反应③的ΔH3= ΔH1 +ΔH2 =89.3kJ/mol;
(2)
根据盖斯定律知,(反应I+反应II+反应III)×2得4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) H=( H1+ H2+ H3)×2=-116kJ mol-1。
18.(1) 环形玻璃搅拌棒、烧杯 一次性 最高温度 偏小 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165kJ mol-1
(2) 9 392.8
【解析】(1)
①测定中和反应反应热时需用量筒取盐酸和NaOH溶液,需用温度计测定溶液的温度,反应时,为加快反应,则需环形玻璃搅拌棒进行搅拌,并在烧杯中进行反应;为减小热量损失,NaOH溶液应一次性加入;溶液混合后,用温度计测定混合溶液的最高温度,记为终止温度;若量取盐酸溶液时俯视读数,会造成盐酸体积偏小,中和热数值偏小。
②0.2molCH4(g)参加反应吸收33kJ的热量,1molCH4(g)参加反应吸收33kJ=165kJ的热量,该反应的热化学方程式为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165kJ mol-1。
(2)
①焓变△H=反应物键能之和-生成物键能之和=436kJ mol 1+153kJ mol 1 2×299kJ mol 1= 9kJ mol 1。
②已知:反应①CO(g)+2H2(g)=CH3OH(g) △H1=-90.8kJ·mol-1,反应②H2(g)+O2(g)=H2O(g) △H3=-241.8kJ·mol-1,应用盖斯定律,将②×2-①得:CH3OH(g)+O2(g)=CO(g)+2H2O(g),△H= 2ΔH3 ΔH1=2(-241.8kJ·mol-1)-(-90.8kJ·mol-1)= 392.8kJ mol 1。
答案第1页,共2页
答案第1页,共2页
同课章节目录
