2024届高三新高考化学大一轮专题复习题----盐类的水解(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题复习题----盐类的水解(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 994.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 18:24:20 | ||
图片预览


文档简介
2024届高三新高考化学大一轮专题复习题----盐类的水解
一、单选题
1.(2023·上海·高三专题练习)向100mL1mol·L-1NH4Al(SO4)2溶液中逐滴加入1mol·L-1Ba(OH)2溶液。沉淀总物质的量n随加入Ba(OH)2溶液体积V的变化如图。下列说法错误的是
A.沉淀质量:b点>a点>c点
B.a点到c点过程中,b点溶液中水的电离程度最小
C.a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-]
D.b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O
2.(2023·全国·模拟预测)明矾[KAl(SO4)2·12H2O]是重要化工原料,下列与明矾相关的实验设计中,所得结论不正确的是
实验方案 现象 结论
A 分别用明矾溶液、蒸馏水喷淋两张白纸,久置 明矾喷淋过的白纸老化明显 Al3+水解产生的H+可促进纸张中的纤维素的水解
B 用铂丝蘸取明矾溶液置于无色火焰上灼烧 灼烧时火焰呈紫色 明矾中含有K+
C 明矾溶液中加入过量NaF后再加浓氨水 无白色沉淀生成 Al3+会与F-反应,且反应后溶液中的Al3+浓度很低
D 取一烧杯比室温高3~5℃的明矾饱和溶液,把明矾小晶体悬挂在烧杯中央,静置 明矾小晶体变成了外形规则的大晶体 析出的明矾覆盖到小晶体表面,晶体变大;如升高饱和溶液温度,可获得更大的规则晶体
A.A B.B C.C D.D
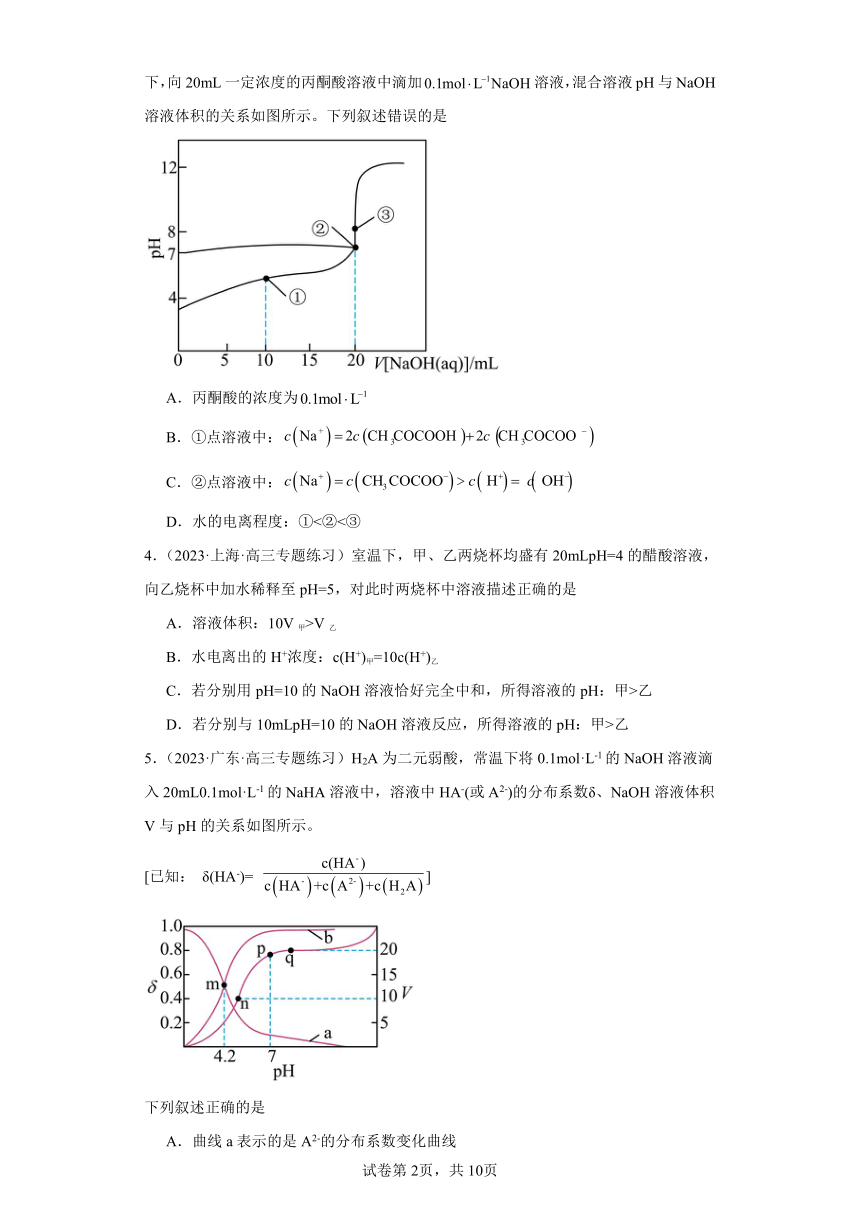
3.(2023春·广东·高三统考阶段练习)已知:丙酮酸(CH3COCOOH)是一种弱酸。室温下,向20mL一定浓度的丙酮酸溶液中滴加溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列叙述错误的是
A.丙酮酸的浓度为
B.①点溶液中:
C.②点溶液中:
D.水的电离程度:①<②<③
4.(2023·上海·高三专题练习)室温下,甲、乙两烧杯均盛有20mLpH=4的醋酸溶液,向乙烧杯中加水稀释至pH=5,对此时两烧杯中溶液描述正确的是
A.溶液体积:10V甲>V乙
B.水电离出的H+浓度:c(H+)甲=10c(H+)乙
C.若分别用pH=10的NaOH溶液恰好完全中和,所得溶液的pH:甲>乙
D.若分别与10mLpH=10的NaOH溶液反应,所得溶液的pH:甲>乙
5.(2023·广东·高三专题练习)H2A为二元弱酸,常温下将0.1mol·L-1的NaOH溶液滴入20mL0.1mol·L-1的NaHA溶液中,溶液中HA-(或A2-)的分布系数δ、NaOH溶液体积V与pH的关系如图所示。
[已知: δ(HA-)= ]
下列叙述正确的是
A.曲线a表示的是A2-的分布系数变化曲线
B.H2A的第二步电离平衡常数的数量级为10-6
C.n点对应的溶液中,2c(H+)+c(HA -)- 2c(OH- )=c(A2-)-3c(H2A)
D.在n、p、q三点中,水的电离程度大小关系为: n>p>q
6.(2023春·广东惠州·高三校考期中)某化学研究学习小组对高三所学部分内容作了归纳总结(均指常温下),现摘录6条,其中错误的有
①物质的量的浓度相同的2种盐,若pH:NaX>NaY,则HX>HY
②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,则三者关系为:Ka·Kh = KW
③pH=7的NH3·H2O与NH4Cl的混合溶液中:c(Cl-) = c()
④0.1 mol·L-1的硫酸铵溶液中:c()>c()>c(H+)
⑤冰晶胞中水分子的空间排列方式与干冰晶胞类似
⑥1mol [Cu(NH3)4]2+中含有σ键的数目为12NA
A.①⑤⑥ B.①③⑤ C.②④⑥ D.③④⑥
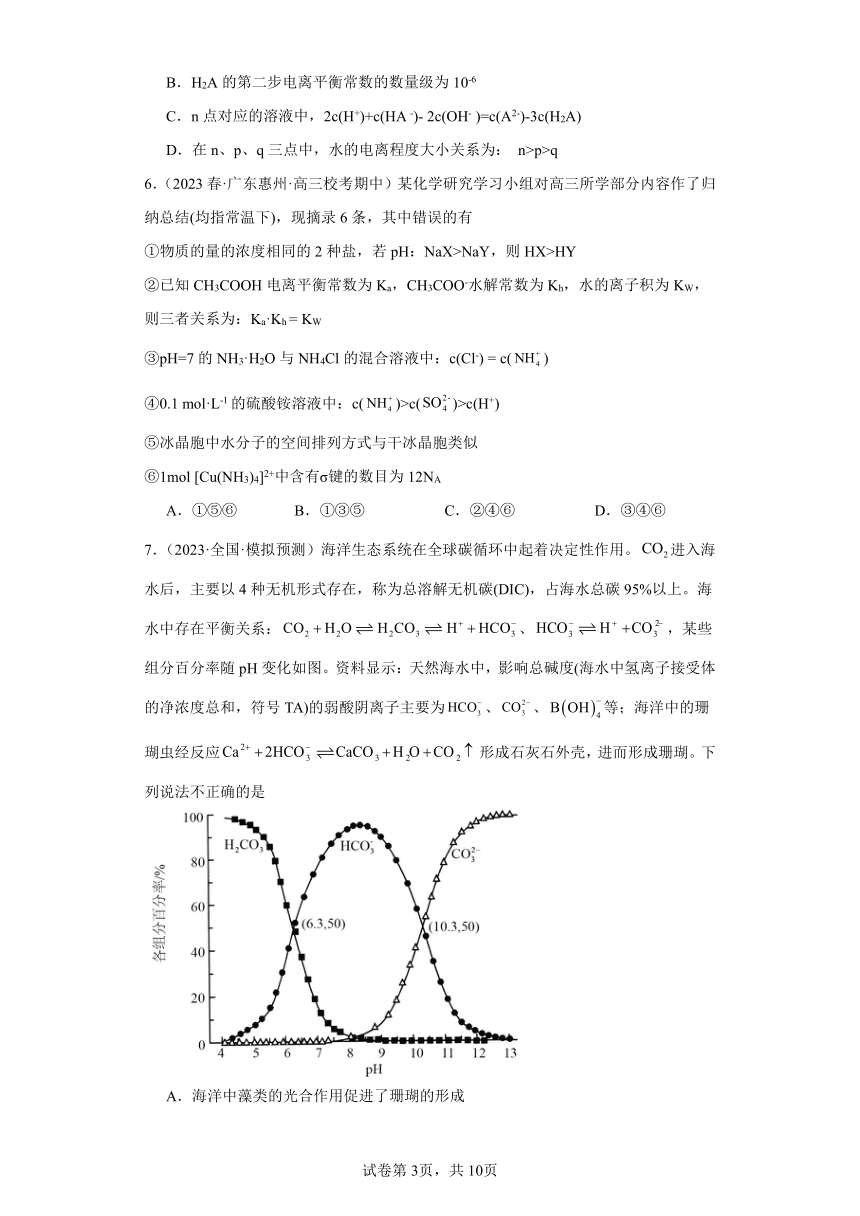
7.(2023·全国·模拟预测)海洋生态系统在全球碳循环中起着决定性作用。进入海水后,主要以4种无机形式存在,称为总溶解无机碳(DIC),占海水总碳95%以上。海水中存在平衡关系:、,某些组分百分率随pH变化如图。资料显示:天然海水中,影响总碱度(海水中氢离子接受体的净浓度总和,符号TA)的弱酸阴离子主要为、、等;海洋中的珊瑚虫经反应形成石灰石外壳,进而形成珊瑚。下列说法不正确的是
A.海洋中藻类的光合作用促进了珊瑚的形成
B.海水中:
C.
D.天然海水的pH一般在7.8~8.3左右,DIC的主要存在形式为
8.(2023·全国·模拟预测)类比法是化学学习中的一种常用方法,下列关于物质性质的推论正确的是
选项 性质 推论
A 水解生成、 水解生成、
B 中Fe为+2、+3价 中Pb为+2、+3价
C 与水反应产生乙炔 与水反应产生丙炔
D 和的空间结构模型相同 和的空间结构模型相同
A.A B.B C.C D.D
9.(2023·新疆乌鲁木齐·统考二模)在1L 0.10mol·L-1NH4HCO3溶液中,加入一定量NaOH固体并恢复到常温(体积变化忽略不计)。溶液中各主要微粒浓度变化如图所示[已知Kb(NH3·H2O)=1.75×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3)=4.7×10-11]。下列说法正确的是
A.NH4HCO3溶液呈酸性
B.a点pH约为5,b点pH约为12
C.0.1mol·L-1NH4HCO3溶液: c()+c(NH3H2O)+c()+c()=0.2 mol·L-1
D.当n(NaOH) =0.10 mol时,c(Na+)>c()>c( )>c(OH-)>c(H+)
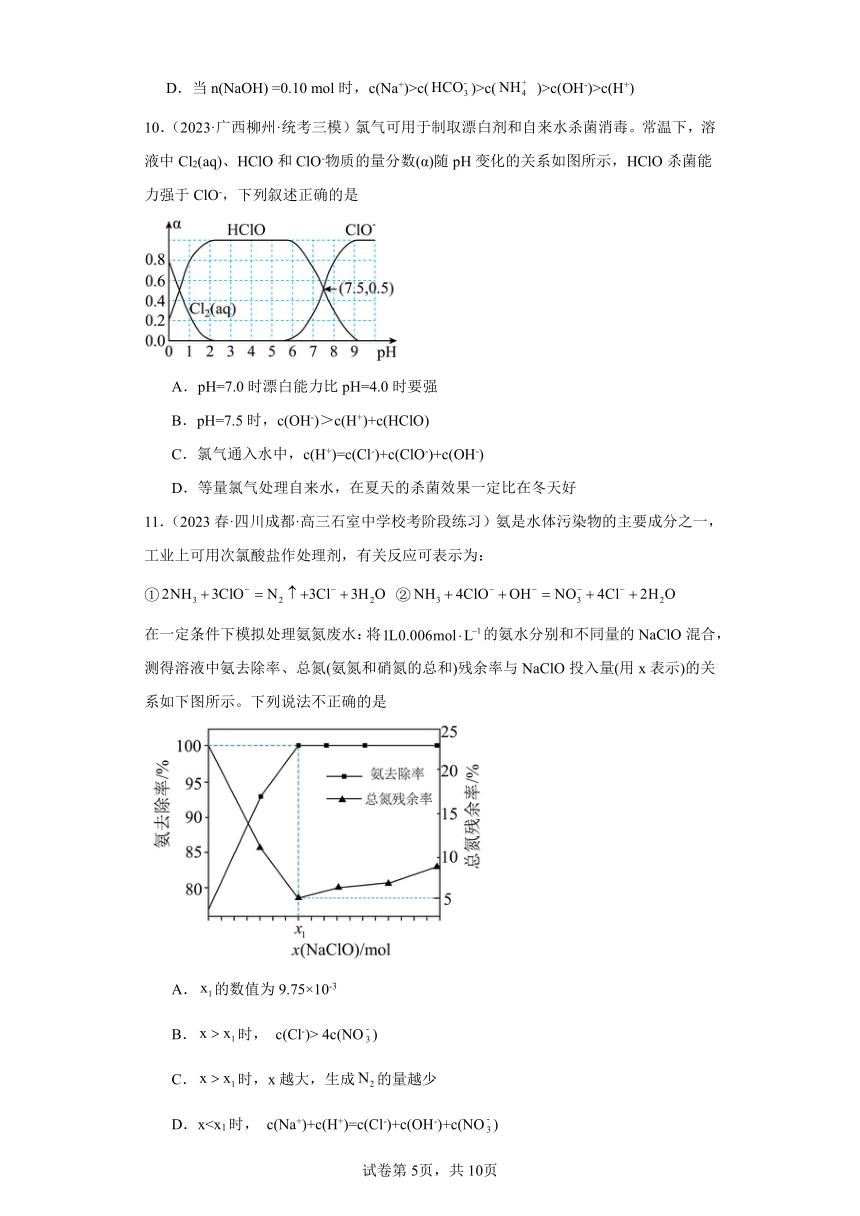
10.(2023·广西柳州·统考三模)氯气可用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示,HClO杀菌能力强于ClO-,下列叙述正确的是
A.pH=7.0时漂白能力比pH=4.0时要强
B.pH=7.5时,c(OH-)>c(H+)+c(HClO)
C.氯气通入水中,c(H+)=c(Cl-)+c(ClO-)+c(OH-)
D.等量氯气处理自来水,在夏天的杀菌效果一定比在冬天好
11.(2023春·四川成都·高三石室中学校考阶段练习)氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:① ②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的NaClO混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与NaClO投入量(用x表示)的关系如下图所示。下列说法不正确的是
A.的数值为9.75×10-3
B.时, c(Cl-)> 4c(NO)
C.时,x越大,生成的量越少
D.x12.(2023春·四川遂宁·高三射洪中学校考期中)在下列溶液中,一定能大量共存的离子组是
A.=10-5mol L-1的溶液中:Ba2+、ClO-、Cl-、NO
B.由水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO、K+、SO
C.能使甲基橙试液变红的溶液:Fe2+、Na+、Cl-、NO
D.无色透明溶液中:Al3+、Na+、AlO、Cl-
13.(2023·广东汕头·金山中学校考一模)将Cl2缓慢通入1L0.1mol·L-1Na2CO3溶液中,反应过程中无CO2逸出,用数字传感器测得溶液中pH与c(HClO)的变化如图所示。已知Ka1(H2CO3)=10-6.3,Ka2(H2CO3)=10-10.3。下列说法错误的是
A.曲线①表示溶液中pH的变化
B.整个过程中,水的电离程度逐渐减小
C.a点溶液中:c(H+)=2c()+c()+c(OH-)
D.pH=10.3时:c(Na+)>3c()+2c(ClO-)+c(HClO)
14.(2023春·云南玉溪·高三云南省玉溪第一中学校考阶段练习)下列说法错误的是
A.除去MgCl2酸性溶液中的Fe3+,可加入MgO调节pH使Fe3+转化为Fe(OH)3沉淀
B.将Al(NO3)3溶液蒸干灼烧,可得到Al(NO3)3
C.实验室盛放Na2CO3、Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
D.硫酸铜溶液可对游泳池水进行消毒,其原理是能使蛋白质变性
15.(2023秋·浙江杭州·高三期末)25℃时,将HCl气体缓慢通入0.1 mol/L的氨水中,溶液的pH、 体系中微粒浓度的对数值(lgc) 与反应物的物质的量之比[t=]的关系如图所示。若忽略溶液体积变化,下列有关说法不正确的是
A.25℃时, 的水解平衡常数为10-9.25
B.P2所示溶液: c ()>100c (NH3·H2O)
C.t=0.5时,c ()+c (H+)D.溶液中水的电离程度: P3>P2>P1
16.(2023秋·浙江杭州·高三期末)类比法是一种学习化学的重要方法。 下列“类比”合理的是
A.MgCl2溶液在空气中蒸干得到MgO固体,则SrCl2溶液在空气中蒸干得到SrO固体
B.Fe3O4与盐酸反应生成Fe2+和Fe3+, 则Fe3S4也可与盐酸反应生成Fe2+和Fe3+
C.CuS与O2在高温下反应生成CuO,则HgS与O2在高温下反应生成HgO
D.CO2是直线型分子, 则COS也是直线型分子
17.(2023·湖北黄冈·黄冈中学校考二模)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用cmol/L盐酸标准溶液测定VmL某纯碱样品溶液中NaHCO3的含量(其它杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是
A.水的电离程度:c>b>a
B.a点溶液中存在关系:c(Na+)+c(H+)=c(OH-)+c(CO)+c(HCO)+c(Cl-)
C.VmL该纯碱样品溶液中含有NaHCO3的质量为0.084cg
D.c点指示的是第二滴定终点,b到c过程中存在c(Na+)<c(Cl-)
二、非选择题
18.(2022秋·湖北武汉·高三校联考阶段练习)常温下,浓度均为0.1 mol/L的6种溶液的pH如表:
序号 a b c d e f
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN NaAlO2
pH 8. 8 9. 7 11. 6 10. 3 11. 1 11. 3
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用化学方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析,与0.1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH=8.8的NaOH溶液 B.pH=5.2的NH4Cl溶液 C.pH=5.2的盐酸 D.0.1 mol/L的NaCN溶液 E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO) +c(HCO) +c(H2CO3)
B.2c(Na+)=3c(CO) +3c(HCO) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO) +c(HCO) +c(OH-)
E. c(Na+)>c(HCO)> c(CO) > c(OH-)> c(H+)
F. c(Na+)> c(CO) > c(HCO) > c(H+)> c(OH-)
(5)0.1 mol/LHCl与0.1 mol/L Na2CO3溶液等体积混合后溶液中各离子浓度大小关系为 。
(6)向NaCN溶液中通入少量CO2气体发生反应的离子方程式为 。
19.(2022秋·高三课时练习)物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请根据所学知识回答下列问题:
(1)Al2(SO4)3溶液不显中性,原因是 (用离子方程式表示);若把Al2(SO4)3溶液蒸干,最后主要得到的固体产物是 ;泡沫灭火器的主要成分为Al2(SO4)3溶液和NaHCO3溶液,用离子方程式表示其灭火的原理 。
(2)将1L 0.2 mol/LHA溶液与1L 0.1 mol/LNaOH溶液混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-) c(HA)(填“>”“<”或“=”)。
②混合溶液中,c(HA)+c(A-)= mol/L
(3)已知25℃是部分弱电解质的电离平衡常数如表所示:
化学式 NH3·H2O CH3COOH HClO H2CO3
电离平衡常数 Kb=2.0×10-5 Ka=1.8×10-6 Ka=3.0×10-8 Ka1=4.0×10-7 Ka2=5.0×l0-11
①则pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+): (用序号表示由大到小的顺序)。
②判断0.1mol/L的(NH4)2CO3溶液使pH试纸 (填“变蓝”“不变色”或“变红”),该溶液中c(CO)、c(HCO)、c(NH)的浓度大小关系是 。
③0.50mol/L的Na2CO3溶液的pH约等于 。(不考虑CO第二步水解和H2O的电离)
20.(2022秋·新疆乌鲁木齐·高三乌市八中校考阶段练习)水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1)时,向水的电离平衡体系中加入少量醋酸钠固体,得到为的溶液,其水解反应离子方程式为 ,由水电离出的=
(2)时,已知,在与的混合溶液中,若测得,则溶液中= (填精确值),= 。
(3)向溶液中滴加溶液至中性后,各离子浓度由大到小的顺序为 。
(4)某温度时水的离子积常数,若将此温度下的溶液与的稀硫酸混合,所得混合液,则 。
(5)时,向的NH3·H2O溶液滴加amL0.1的溶液时,混合溶液的恰好为7。则NH3·H2O的电离平衡常数 (用含有的式子表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】100mL1mol/LNH4Al(SO4)2溶液中逐滴加入1mol/LBa(OH)2溶液,a点时铝离子与氢氧根离子完全反应生成氢氧化铝沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,此时硫酸根离子剩余0.05mol,继续滴加50mLBa(OH)2,剩余的硫酸根离子全部与钡离子反应生成硫酸钡沉淀,0.1mol铵根离子与0.1mol氢氧根离子反应生成0.1mol一水合氨,继续加入50mLBa(OH)2,此时氢氧化铝开始溶解,c点时氢氧化铝完全溶解转化为偏铝酸根离子。
【详解】A.根据分析可知,b点沉淀质量最大,a点为0.1mol氢氧化铝和0.15mol硫酸钡,c点为0.2mol硫酸钡,a点沉淀质量小于c点,A错误;
B.a点溶液中溶质为硫酸铵,a到b的过程中硫酸铵与氢氧化钡反应,b点溶质为NH3·H2O,b到c点氢氧化铝与Ba(OH)2反应生成偏铝酸根离子,偏铝酸根离子和铵根离子均能促进水的电离,一水合氨抑制水的电离,故b点水的电离程度最小,B正确;
C.a点溶液溶质为硫酸铵,铵根离子水解使溶液呈酸性,则a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-],C正确;
D.b点到c点,氢氧化铝与Ba(OH)2反应生成偏铝酸根离子,离子方程式为Al(OH)3+OH-=AlO+2H2O,D正确;
故答案选A。
2.D
【详解】A.明矾中的铝离子可以水解,产生氢离子,纤维素属于糖类,在酸性条件下可以水解,A正确;
B.透过蓝色钴玻璃观察到焰色反应为紫色,则说明溶液中含有钾元素,B正确;
C.在盛有 AlCl3溶液的试管中加入 NaF 溶液生成Na3[AlF6],[AlF6]3-很难电离出铝离子,则再加入氨水,无白色沉淀生成,故其原因可能是 Al3+与 F-结合生成了新的物质,C正确;
D.该过程之所以可以得到更大的晶体,是因为在饱和溶液逐渐降温的过程中新析出的晶体在原来小晶体上结晶导致,反之如果升高饱和溶液的温度的话,则不利于晶体的析出,D错误;
故选D。
3.B
【详解】A.由图可知,加入20mLNaOH溶液时酸碱恰好完全反应,故丙酮酸溶液浓度等于氢氧化钠溶液浓度,A项正确;
B.①点加入氢氧化钠的物质的量是丙酮酸的一半,根据物料守恒,,B项错误;
C.②点溶液为CH3COCOOH 和CH3COCOONa的混合溶液,此时溶液显中性,,由电荷守恒,则,则溶液中存在,C项正确;
D.向20mL一定浓度的丙酮酸溶液中滴加溶液,滴定过程中CH3COCOOH浓度减小,水的电离程度增大,③点时酸碱恰好完全反应,水的电离程度最大,则水的电离程度:①<②<③,D项正确;
故选B。
4.C
【详解】A.醋酸是弱酸,加水稀释,醋酸电离平衡正向移动,pH=4的醋酸溶液加水稀释10倍,稀释后溶液pH<5,若使pH=5,需继续加水稀释,所以溶液体积:10V甲B.甲烧杯中醋酸溶液的pH=4,水电离出的H+浓度为10-10;乙烧杯中醋酸溶液的pH=5,水电离出的H+浓度为10-9;所以水电离出的H+浓度:10c(H+)甲=c(H+)乙,故B错误;
C.若分别用pH=10的NaOH溶液恰好完全中和,消耗氢氧化钠溶液的体积相等,所得溶液的体积甲<乙,醋酸钠的浓度甲>乙,所以pH:甲>乙,故C正确;
D.若分别与10mLpH=10的NaOH溶液反应,剩余醋酸的物质的量相等,所得溶液的体积甲<乙,剩余醋酸的浓度甲>乙,所得溶液的pH:甲<乙,故D错误;
选C。
5.C
【详解】A.用NaOH溶液滴定NaHA发生反应NaOH+NaHA=Na2A+H2O,HA-不断减少,A2-不断增多,故曲线b表示的是A2-的分布系数变化曲线,A错误;
B.m点时HA-和 A2-的分布系数相同,pH=4.2,则H2A的第二步电离平衡常数,其数量级为10-5,B错误;
C.n点时滴入了10mLNaOH溶液,溶液中NaHA和Na2A的浓度比为1:1,根据电荷守恒和物料守恒可得,,,消去c(Na+)可得2c(H+)+c(HA -)- 2c(OH- )=c(A2-)-3c(H2A),C正确;
D.A2-的水解程度大于HA-,在NaOH与NaHA恰好完全反应之前溶液中A2-越多,水的电离程度越大,则在n、p、q三点中,水的电离程度大小关系为: n故选C。
6.A
【详解】①物质的量的浓度相同的2种盐,若pH:NaX>NaY,说明X-水解时生成更多氢氧根,则HX②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,CH3COOH为一元弱酸,根据定义有三者关系为:Ka·Kh = KW;故②正确;
③pH=7的NH3·H2O与NH4Cl的混合溶液中时,c(OH-)=c(H+),根据电荷守恒有c(Cl-) = c();故③正确;
④硫酸铵分子式为(NH4)2SO4,所以0.1 mol·L-1的硫酸铵溶液中,部分水解,离子浓度大小为c()>c()>c(H+);故④正确;
⑤冰晶胞中水分子的空间排列方式与金刚石晶胞类似,故⑤错误;
⑥1mol [Cu(NH3)4]2+中除了N-H键,还有NH3和Cu的配位键,所以含有σ键的数目为16NA;故⑥错误;
故答案选A。
7.C
【详解】A.根据反应可知,藻类光合作用吸收了,使平衡正向移动,促进珊瑚虫形成石灰石外壳,进而形成珊瑚,A正确;
B.碳酸的第一步电离方程式为,所以电离平衡常数表达式为,根据题图中点,可计算出,根据碳酸表达式和可得,即,B正确;
C.1个发生两步水解时可以结合2个水中的,计算总碱度时系数应为2,,C错误;
D.由题图可知,pH在7.8~8.3时DIC的主要存在形式为,D正确;
故选C。
8.A
【详解】A.水解过程中,元素的化合价不发生变化,生成、,则水解过程中,元素的化合价也不发生变化,应生成、,A正确;
B.Pb为第ⅣA族元素,常见化合价为+2、+4价,B错误;
C.金属碳化物与水的反应为复分解反应,中C元素为-4价,所以与水反应生成甲烷,C错误;
D.中心原子的价层电子对数为,空间结构为V形,中心原子的价层电子对数为,空间结构为V形,和的空间结构模型相同,中心原子的价层电子对数为,空间结构为平面三角形,空间结构为三角锥形,和的空间结构模型不相同,D错误;
故答案为:A。
9.D
【详解】A.NH4HCO3是弱酸弱碱盐,其溶液的酸碱性要看生成的弱酸、弱碱的电离常数,因为Kb(NH3·H2O)=1.75×10-5> Ka1(H2CO3) =4.4×10-7,所以NH4HCO3溶液中水解能力小于HCO水解能力,所以溶液呈碱性,A错误;
B.pH=-lgc(H+),由题图可知,a点的、NH3·H2O浓度相等,由Kb(NH3·H2O)=1.75×10-5==c(OH-),则a点pH=-lg()9,同理可得b点的、浓度相等,由Ka2(H2CO3)=4.7×10-11==c(H+),则b点pH=-lg(4.7×10-11)10,B错误;
C.根据物料守恒,c()+c(NH3H2O)=0.1mol·L-1,c()+c()+c()=0.1 mol·L-1,则c()+c(NH3H2O)+ c()+c()+c()=0.2mol·L-1,C错误;
D.由题图可知,当n(NaOH) = 0.10 mol时,c(Na+)>c()>c(),c()= c(),因为Kb(NH3·H2O)=1.75×10-5> Ka2(H2CO3)=4.7×10-11,所以溶液呈碱性,故c(OH-)>c(H+),D正确;
故选D。
10.C
【详解】A.起漂白作用的是HClO,由图像可知,pH=7.0时,c(HClO)比pH=4.0小,因此pH=7.0时漂白能力要比pH=4.0时要弱,选项A错误;
B.pH=7.5时,c(HClO)= c(ClO-),根据电荷守 恒有c(OH-)=c(H+)+ c(ClO-),故c(OH-)=c(H+)+c(HClO),选项B错误;
C.氯气通入水中,存在电荷守恒:c(H+)=c(Cl-)+c(ClO-)+c(OH-),选项C正确;
D.夏天相比冬天温度高,并且HClO易分解;温度越高,HClO分解越快。所以,在夏天的杀菌消毒效果要比在冬天差,选项D错误;
答案选C。
11.D
【详解】A.x1时,氨的去除率为100%、总氮残留率为5,,95%的氨气参与反应①、有5%的氨气参与反应②,反应①消耗,参与反应②消耗,,A正确;
B.x>x1时,反应①也生成氯离子,所以,B正确;
C.x>x1时,x越大,氨总去除率不变,氮残余率增大,说明生成的硝酸根离子越多,生成N2的量越少,C正确;
D.x故选D。
12.A
【详解】A.=10-5mol L-1的溶液为碱性溶液,四种离子在碱性溶液中不发生任何反应,能大量共存,故A正确;
B.由水电离出的c(H+)=10-14mol/L的溶液可能为酸溶液,也可能为碱溶液,碳酸氢根离子既能与酸溶液中的氢离子反应,也能与碱溶液中的氢氧根离子反应,一定不能大量共存,故B错误;
C.能使甲基橙变红的溶液为酸性溶液,酸性条件下,溶液中硝酸根离子与亚铁离子发生氧化还原反应,不能大量共存,故C错误;
D.溶液中铝离子和偏铝酸根离子发生双水解反应,不能大量共存,故D错误;
故选A。
13.C
【分析】由于0.1mol·L-1Na2CO3溶液可发生水解,溶液显碱性,通入Cl2后,生成NaHCO3、NaClO、NaCl,水解程度减小,溶液碱性减弱,且随着Cl2的通入,溶液中HCl和HClO增多,酸性增强,据此解答。
【详解】A.由分析可知,随着Cl2的通入,溶液酸性增强,pH逐渐减小,则曲线①表示溶液中pH的变化,故A正确;
B.随着Cl2的通入,溶液中溶质的变化为Na2CO3 NaHCO3、NaClO、NaCl NaCl、HCl、HClO、H2CO3,水的电离程度逐渐减小,故B正确;
C.通入Cl2后,溶液中存在电荷守恒:c(Na+)+c(H+)=2c()+c()+c(ClO-)+c(Cl-)+c(OH-),由图中a点时通入的Cl2为0.10mol,根据物料守恒有:c(Na+)=c(ClO-)+c(Cl-)+c(HCO),联立两式可得:c(H+)+ c(HCO)=2c()+c()+c(OH-),故C错误;
D.pH=10.3时:结合=10-10.3,可知c()=c(),溶液中存在电荷守恒:c(Na+)+c(H+)=2c()+c()+c(ClO-)+c(Cl-)+c(OH-),Cl2在水溶液中发生歧化反应生成HClO、ClO-、Cl-,存在c(Cl-)=c(HClO)+c(ClO-),可得c(H+)- c(OH-)=2c()+c()+c(ClO-)+c(Cl-)- c(Na+)=3c()+2c(ClO-)+c(HClO)- c(Na+)<0,即有c(Na+)>3c()+2c(ClO-)+c(HClO),故D正确;
答案选C。
14.B
【详解】A.除去MgCl2酸性溶液中的Fe3+,铁离子水解生成氢氧化铁和氢离子,加入MgO调节pH消耗氢离子,使水解平衡不断正向移动而使Fe3+转化为Fe(OH)3沉淀,故A正确;
B.Al(NO3)3水解生成氢氧化铝和硝酸,硝酸具有挥发性,因此将Al(NO3)3溶液蒸干灼烧,可得到Al2O3,故B错误;
C.Na2CO3溶液水解显碱性,会与玻璃中二氧化硅反应生成硅酸钠,硅酸钠是一种矿物胶,会黏住玻璃塞,因此实验室盛放Na2CO3、Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,故C正确;
D.能使蛋白质变性,因此可以用硫酸铜溶液对游泳池水进行消毒,故D正确。
综上所述,答案为B。
15.C
【分析】由图可知,P1时溶液为氯化铵和一水合氨的混合溶液,溶液中铵根离子和一水合氨的浓度相同、pH为9.25,则氨水的电离常数Kb==c (OH—)= 10—4.75,P2时溶液为氯化铵和一水合氨的混合溶液,溶液中氢离子和氢氧根离子相等,溶液呈中性,P3时氨水和氯化氢气体完全反应生成氯化铵,溶液呈酸性。
【详解】A.由分析可知,氨水的电离常数Kb=10—4.75,则铵根离子的水解常数Kh===10-9.25,故A正确;
B.由图可知,P2时溶液中氢离子和氢氧根离子相等,溶液pH=7,溶液中==102.25,则溶液中c ()>100c (NH3·H2O),故B正确;
C.由图可知,t =0.5时溶质为等浓度的氯化铵和一水合氨的混合物,溶液呈碱性说明一水合氨的电离程度大于铵根离子水解程度,则溶液中氯离子浓度大于一水合氨的浓度,由电荷守恒c ()+c (H+)=c (Cl—)+c (OH-)可知,溶液中的离子浓度大小顺序为c ()+c (H+)>c (NH3·H2O)+c (OH—),故C错误;
D.氨水在溶液中电离出的氢氧根离子抑制水的电离,铵根离子在溶液中水解促进水的电离,由分析可知,P1、P2、P3时溶液中铵根离子浓度依次增大,水的电离程度依次增大,故D正确;
故选C。
16.D
【详解】A.MgCl2水解生成氢氧化镁和盐酸,因此MgCl2溶液在空气中蒸干得到MgO固体,Sr(OH)2是强碱,SrCl2不发生水解,因此SrCl2溶液在空气中蒸干得到SrCl2固体,故A错误;
B.Fe3O4与盐酸反应生成Fe2+和Fe3+, 由于硫离子具有还原性,因此Fe3S4也可与盐酸反应生成Fe2+和硫化氢,故B错误;
C.HgS与O2在高温下反应生成Hg和SO2,故C错误;
D.CO2是直线型分子, COS与CO2是等电子体,则COS也是直线型分子,故D正确。
综上所述,答案为D。
17.C
【分析】a点为第一个终点发生反应为:Na2CO3+HCl=NaCl+NaHCO3,c点为第二个终点:NaHCO3+HCl=NaCl+CO2↑+H2O。
【详解】A.a点的成分为NaCl和NaHCO3。相比a点,b点加入更多盐酸, NaHCO减少,b点成分为NaCl和NaHCO3。c点成分为NaCl。NaHCO3弱酸盐促进水的电离,水的电离程度:a>b>c,A项错误;
B.a点的成分为NaCl、NaHCO3,存在电荷守恒为c(Na+)+c(H+)=c(OH-)+2c(CO)+c(HCO)+c(Cl-),B项错误;
C.Na2CO3转变为NaHCO3消耗盐酸2.9mL,而总共消耗盐酸6.8mL,所以纯碱中NaHCO3消耗盐酸为6.8-2.9×2=1mL。所以n(NaHCO3)=n(HCl)=10-3cmol,得m(NaHCO3)= n(NaHCO3)M(NaHCO3)=84×10-3cg=0.084cg,C项正确;
D.b点的成分为NaCl、NaHCO3,而c点成分为NaCl,所以b到c的过程中c(Na+)>c(Cl-),D项错误;
故选C。
18.(1)CH3COO-
(2) NaAlO2+2H2O Al(OH)3+NaOH NaAlO2
(3)BE
(4)BDE
(5)c(Na+)>c(Cl-)>c(HCO)>c(OH-)>c(H+)>c(CO)
(6)CN-+CO2+H2O=HCN+HCO
【解析】(1)
越容易水解的盐,代表水解生成的酸的酸性越弱,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO,反之,上述溶液中的阴离子结合H+能力最弱的为CH3COO-。
(2)
NaAlO2是强碱弱酸盐,偏铝酸根离子水解使溶液呈碱性,化学方程式为:NaAlO2+2H2O Al(OH)3+NaOH。将NaAlO2溶液加热,促进水解,氢氧化铝、氢氧化钠浓度增大,反应生成偏铝酸钠,故蒸干最后得到的固体产物是NaAlO2;
(3)
由表中数据可知,在常温下,0.1mol/L的CH3COONa溶液的pH=8.8,促进水的电离,c(H+)=10-8.8mol/L,由水电离产生的氢氧根离子浓度为10-5.2mol/L,而由水电离产生的氢离子浓度与由水电离产生氢氧根离子浓度相等,则由水电离产生的氢离子浓度也为10-5.2mol/L:
A.pH=8.8的NaOH溶液,抑制水的电离,A错误;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-5.2mol/L,B正确;
C.pH=5.2的盐酸,抑制水的电离,C错误;
D.0.1mol/L的NaCN溶液pH=11.1,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-2.9mol/L,D错误;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-5.2mol/L,E正确;
答案选BE。
(4)
将浓度均为0.1mol/L的NaHCO3、Na2CO3等体积混合,钠离子的物质的量与碳原子的物质的量之比为3:2,则物料守恒:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),溶液呈电中性,有电荷守恒:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),则:
A.依据物料守恒有:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),A错误;
B.依据物料守恒有:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),B正确;
C.物料守恒:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),电荷守恒:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),两式联立有质子守恒:c(CO)+2c(OH-)=2c(H+)+c(HCO)+3c(H2CO3),C错误;
D.依据电荷守恒有:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),D正确;
E.混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,故混合溶液中离子浓度c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+),E正确;
F.混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,故混合溶液中离子浓度c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+),F错误;
答案选BDE。
(5)
0.1mol/LHCl与0.1mol/LNa2CO3溶液等体积混合后所得为0.05mol/LNaCl与0.05mol/LNaHCO3混合溶液;溶液呈碱性,因碳酸氢根离子水解程度大于电离程度,故各离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO)>c(OH-)>c(H+)>c(CO)。
(6)
等浓度的上述盐溶液,水解程度越大,溶液pH越大,对应酸的酸的酸性越弱,则有酸性:H2CO3>HCN>HCO,则向NaCN溶液中通入少量CO2气体发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO。
19.(1) Al3++3H2O Al(OH)3+3H+ Al2(SO4)3 Al3++3HCO=Al(OH)3↓+CO2↑
(2) < 0.1
(3) ①>②>③ 变蓝 c(NH)>c(CO)>c(HCO) 12
【详解】(1)Al2(SO4)3为强酸弱碱盐,铝离子发生水解反应生成氢氧化铝和硫酸而溶液呈酸性,水解方程式为Al3++3H2O Al(OH)3+3H+,硫酸是难挥发性物质,整个Al2(SO4)3溶液得到Al2(SO4)3固体,泡沫灭火器中Al2(SO4)3溶液和NaHCO3溶液发生双水解反应得到氢氧化铝沉淀和二氧化碳,离子方程式为:Al3++3HCO=Al(OH)3↓+CO2↑,故答案为:Al3++3H2O Al(OH)3+3H+;Al2(SO4)3;Al3++3HCO=Al(OH)3↓+CO2↑;
(2)①将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,则溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,混合溶液中c(Na+)>c(A-),则A-离子的水解程度大于HA的电离程度,溶液显碱性,则c(A-)<c(HA),故答案为:<;
②溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,根据物料守恒得:c(HA)+c(A-)=0.1mol/L,故答案为:0.1;
(3)①弱酸的酸性越弱,其盐水解程度越大,溶液碱性越强,则pH相同时物质的量浓度较小,由平衡常数越大其酸性越强,则酸性:CH3COOH > H2CO3> HClO,则物质的量浓度:c(CH3COONa) > c(NaHCO3)> c(NaClO),c(Na+):①>②>③;
②根据电离平衡常数可知,电离程度大小为:NH3 H2O>H2CO3>HCO,电离程度越大,离子的水解程度越小,则水解程度大小顺序为:CO>HCO>NH。0.1mol L-1的(NH4)2CO3溶液中,CO、NH都水解,水解程度大小为CO>NH,溶液呈碱性,使pH试纸变蓝;水解程度越大,离子浓度越小,且水解程度较小,则离子浓度大小为:c(NH)>c(CO)>c(HCO),故答案为:变蓝;c(NH)>c(CO)>c(HCO);
③CO的水解程度较小,忽略CO第二步水解和H2O的电离,则该溶液中c(OH-)≈c(HCO),c(CO)≈0.50mol/L,CO的第一步水解平衡常数Kh1== 2×l0-4 =,所以该溶液中c(OH-)≈mol/L=0.01mol/L,则溶液中c(H+)=mol/L=10-12mol/L,溶液的pH=12,故答案为:12。
20.(1) 1×10-3
(2) 9.9×10-7 18
(3)
(4)
(5)
【详解】(1)醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解生成醋酸和氢氧根离子,溶液呈碱性,水解的离子方程式为,pH为11的溶液中水电离出的氢氧化离子浓度为1×10-3mol/L,故答案为:;1×10-3;
(2)溶液pH为6的醋酸和醋酸钠混合溶液中存在电荷守恒关系c(Na+)+ c(H+)=c(CH3COO—)+ c(OH—),c(CH3COO—)—c(Na+)= c(H+)—c(OH—)=10—6mol/L—10—8mol/L=9.9×10—7mol/L;溶液中===18,故答案为:9.9×10—7;18;
(3)向硫酸氢铵溶液中滴加氢氧化钠溶液时,溶液中的氢离子优先与氢氧根离子反应,以物质的量比1∶1恰好反应时得到硫酸钠和硫酸铵的混合溶液,铵根离子水解使溶液呈酸性,所以硫酸氢铵溶液与加入的氢氧化钠溶液反应得到的中性溶液为硫酸钠、硫酸铵、一水合氨的混合溶液,溶液中离子浓度由大到小的顺序为,故答案为:;
(4)由反应后溶液pH为2可得:=10—2mol/L,解得a∶b=19∶2,故答案为:19∶2;
(5)氨水与稀硫酸反应得到的中性溶液为硫酸铵和一水合氨的混合溶液,溶液中氢氧根离子的浓度为10—7 mol/L、铵根离子浓度为×2= mol/L、一水合氨的浓度为= mol/L,则电离常数Kb==,故答案为:。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023·上海·高三专题练习)向100mL1mol·L-1NH4Al(SO4)2溶液中逐滴加入1mol·L-1Ba(OH)2溶液。沉淀总物质的量n随加入Ba(OH)2溶液体积V的变化如图。下列说法错误的是
A.沉淀质量:b点>a点>c点
B.a点到c点过程中,b点溶液中水的电离程度最小
C.a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-]
D.b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O
2.(2023·全国·模拟预测)明矾[KAl(SO4)2·12H2O]是重要化工原料,下列与明矾相关的实验设计中,所得结论不正确的是
实验方案 现象 结论
A 分别用明矾溶液、蒸馏水喷淋两张白纸,久置 明矾喷淋过的白纸老化明显 Al3+水解产生的H+可促进纸张中的纤维素的水解
B 用铂丝蘸取明矾溶液置于无色火焰上灼烧 灼烧时火焰呈紫色 明矾中含有K+
C 明矾溶液中加入过量NaF后再加浓氨水 无白色沉淀生成 Al3+会与F-反应,且反应后溶液中的Al3+浓度很低
D 取一烧杯比室温高3~5℃的明矾饱和溶液,把明矾小晶体悬挂在烧杯中央,静置 明矾小晶体变成了外形规则的大晶体 析出的明矾覆盖到小晶体表面,晶体变大;如升高饱和溶液温度,可获得更大的规则晶体
A.A B.B C.C D.D
3.(2023春·广东·高三统考阶段练习)已知:丙酮酸(CH3COCOOH)是一种弱酸。室温下,向20mL一定浓度的丙酮酸溶液中滴加溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列叙述错误的是
A.丙酮酸的浓度为
B.①点溶液中:
C.②点溶液中:
D.水的电离程度:①<②<③
4.(2023·上海·高三专题练习)室温下,甲、乙两烧杯均盛有20mLpH=4的醋酸溶液,向乙烧杯中加水稀释至pH=5,对此时两烧杯中溶液描述正确的是
A.溶液体积:10V甲>V乙
B.水电离出的H+浓度:c(H+)甲=10c(H+)乙
C.若分别用pH=10的NaOH溶液恰好完全中和,所得溶液的pH:甲>乙
D.若分别与10mLpH=10的NaOH溶液反应,所得溶液的pH:甲>乙
5.(2023·广东·高三专题练习)H2A为二元弱酸,常温下将0.1mol·L-1的NaOH溶液滴入20mL0.1mol·L-1的NaHA溶液中,溶液中HA-(或A2-)的分布系数δ、NaOH溶液体积V与pH的关系如图所示。
[已知: δ(HA-)= ]
下列叙述正确的是
A.曲线a表示的是A2-的分布系数变化曲线
B.H2A的第二步电离平衡常数的数量级为10-6
C.n点对应的溶液中,2c(H+)+c(HA -)- 2c(OH- )=c(A2-)-3c(H2A)
D.在n、p、q三点中,水的电离程度大小关系为: n>p>q
6.(2023春·广东惠州·高三校考期中)某化学研究学习小组对高三所学部分内容作了归纳总结(均指常温下),现摘录6条,其中错误的有
①物质的量的浓度相同的2种盐,若pH:NaX>NaY,则HX>HY
②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,则三者关系为:Ka·Kh = KW
③pH=7的NH3·H2O与NH4Cl的混合溶液中:c(Cl-) = c()
④0.1 mol·L-1的硫酸铵溶液中:c()>c()>c(H+)
⑤冰晶胞中水分子的空间排列方式与干冰晶胞类似
⑥1mol [Cu(NH3)4]2+中含有σ键的数目为12NA
A.①⑤⑥ B.①③⑤ C.②④⑥ D.③④⑥
7.(2023·全国·模拟预测)海洋生态系统在全球碳循环中起着决定性作用。进入海水后,主要以4种无机形式存在,称为总溶解无机碳(DIC),占海水总碳95%以上。海水中存在平衡关系:、,某些组分百分率随pH变化如图。资料显示:天然海水中,影响总碱度(海水中氢离子接受体的净浓度总和,符号TA)的弱酸阴离子主要为、、等;海洋中的珊瑚虫经反应形成石灰石外壳,进而形成珊瑚。下列说法不正确的是
A.海洋中藻类的光合作用促进了珊瑚的形成
B.海水中:
C.
D.天然海水的pH一般在7.8~8.3左右,DIC的主要存在形式为
8.(2023·全国·模拟预测)类比法是化学学习中的一种常用方法,下列关于物质性质的推论正确的是
选项 性质 推论
A 水解生成、 水解生成、
B 中Fe为+2、+3价 中Pb为+2、+3价
C 与水反应产生乙炔 与水反应产生丙炔
D 和的空间结构模型相同 和的空间结构模型相同
A.A B.B C.C D.D
9.(2023·新疆乌鲁木齐·统考二模)在1L 0.10mol·L-1NH4HCO3溶液中,加入一定量NaOH固体并恢复到常温(体积变化忽略不计)。溶液中各主要微粒浓度变化如图所示[已知Kb(NH3·H2O)=1.75×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3)=4.7×10-11]。下列说法正确的是
A.NH4HCO3溶液呈酸性
B.a点pH约为5,b点pH约为12
C.0.1mol·L-1NH4HCO3溶液: c()+c(NH3H2O)+c()+c()=0.2 mol·L-1
D.当n(NaOH) =0.10 mol时,c(Na+)>c()>c( )>c(OH-)>c(H+)
10.(2023·广西柳州·统考三模)氯气可用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示,HClO杀菌能力强于ClO-,下列叙述正确的是
A.pH=7.0时漂白能力比pH=4.0时要强
B.pH=7.5时,c(OH-)>c(H+)+c(HClO)
C.氯气通入水中,c(H+)=c(Cl-)+c(ClO-)+c(OH-)
D.等量氯气处理自来水,在夏天的杀菌效果一定比在冬天好
11.(2023春·四川成都·高三石室中学校考阶段练习)氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:① ②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的NaClO混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与NaClO投入量(用x表示)的关系如下图所示。下列说法不正确的是
A.的数值为9.75×10-3
B.时, c(Cl-)> 4c(NO)
C.时,x越大,生成的量越少
D.x
A.=10-5mol L-1的溶液中:Ba2+、ClO-、Cl-、NO
B.由水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO、K+、SO
C.能使甲基橙试液变红的溶液:Fe2+、Na+、Cl-、NO
D.无色透明溶液中:Al3+、Na+、AlO、Cl-
13.(2023·广东汕头·金山中学校考一模)将Cl2缓慢通入1L0.1mol·L-1Na2CO3溶液中,反应过程中无CO2逸出,用数字传感器测得溶液中pH与c(HClO)的变化如图所示。已知Ka1(H2CO3)=10-6.3,Ka2(H2CO3)=10-10.3。下列说法错误的是
A.曲线①表示溶液中pH的变化
B.整个过程中,水的电离程度逐渐减小
C.a点溶液中:c(H+)=2c()+c()+c(OH-)
D.pH=10.3时:c(Na+)>3c()+2c(ClO-)+c(HClO)
14.(2023春·云南玉溪·高三云南省玉溪第一中学校考阶段练习)下列说法错误的是
A.除去MgCl2酸性溶液中的Fe3+,可加入MgO调节pH使Fe3+转化为Fe(OH)3沉淀
B.将Al(NO3)3溶液蒸干灼烧,可得到Al(NO3)3
C.实验室盛放Na2CO3、Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
D.硫酸铜溶液可对游泳池水进行消毒,其原理是能使蛋白质变性
15.(2023秋·浙江杭州·高三期末)25℃时,将HCl气体缓慢通入0.1 mol/L的氨水中,溶液的pH、 体系中微粒浓度的对数值(lgc) 与反应物的物质的量之比[t=]的关系如图所示。若忽略溶液体积变化,下列有关说法不正确的是
A.25℃时, 的水解平衡常数为10-9.25
B.P2所示溶液: c ()>100c (NH3·H2O)
C.t=0.5时,c ()+c (H+)
16.(2023秋·浙江杭州·高三期末)类比法是一种学习化学的重要方法。 下列“类比”合理的是
A.MgCl2溶液在空气中蒸干得到MgO固体,则SrCl2溶液在空气中蒸干得到SrO固体
B.Fe3O4与盐酸反应生成Fe2+和Fe3+, 则Fe3S4也可与盐酸反应生成Fe2+和Fe3+
C.CuS与O2在高温下反应生成CuO,则HgS与O2在高温下反应生成HgO
D.CO2是直线型分子, 则COS也是直线型分子
17.(2023·湖北黄冈·黄冈中学校考二模)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用cmol/L盐酸标准溶液测定VmL某纯碱样品溶液中NaHCO3的含量(其它杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是
A.水的电离程度:c>b>a
B.a点溶液中存在关系:c(Na+)+c(H+)=c(OH-)+c(CO)+c(HCO)+c(Cl-)
C.VmL该纯碱样品溶液中含有NaHCO3的质量为0.084cg
D.c点指示的是第二滴定终点,b到c过程中存在c(Na+)<c(Cl-)
二、非选择题
18.(2022秋·湖北武汉·高三校联考阶段练习)常温下,浓度均为0.1 mol/L的6种溶液的pH如表:
序号 a b c d e f
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN NaAlO2
pH 8. 8 9. 7 11. 6 10. 3 11. 1 11. 3
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用化学方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析,与0.1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH=8.8的NaOH溶液 B.pH=5.2的NH4Cl溶液 C.pH=5.2的盐酸 D.0.1 mol/L的NaCN溶液 E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO) +c(HCO) +c(H2CO3)
B.2c(Na+)=3c(CO) +3c(HCO) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO) +c(HCO) +c(OH-)
E. c(Na+)>c(HCO)> c(CO) > c(OH-)> c(H+)
F. c(Na+)> c(CO) > c(HCO) > c(H+)> c(OH-)
(5)0.1 mol/LHCl与0.1 mol/L Na2CO3溶液等体积混合后溶液中各离子浓度大小关系为 。
(6)向NaCN溶液中通入少量CO2气体发生反应的离子方程式为 。
19.(2022秋·高三课时练习)物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请根据所学知识回答下列问题:
(1)Al2(SO4)3溶液不显中性,原因是 (用离子方程式表示);若把Al2(SO4)3溶液蒸干,最后主要得到的固体产物是 ;泡沫灭火器的主要成分为Al2(SO4)3溶液和NaHCO3溶液,用离子方程式表示其灭火的原理 。
(2)将1L 0.2 mol/LHA溶液与1L 0.1 mol/LNaOH溶液混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-) c(HA)(填“>”“<”或“=”)。
②混合溶液中,c(HA)+c(A-)= mol/L
(3)已知25℃是部分弱电解质的电离平衡常数如表所示:
化学式 NH3·H2O CH3COOH HClO H2CO3
电离平衡常数 Kb=2.0×10-5 Ka=1.8×10-6 Ka=3.0×10-8 Ka1=4.0×10-7 Ka2=5.0×l0-11
①则pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+): (用序号表示由大到小的顺序)。
②判断0.1mol/L的(NH4)2CO3溶液使pH试纸 (填“变蓝”“不变色”或“变红”),该溶液中c(CO)、c(HCO)、c(NH)的浓度大小关系是 。
③0.50mol/L的Na2CO3溶液的pH约等于 。(不考虑CO第二步水解和H2O的电离)
20.(2022秋·新疆乌鲁木齐·高三乌市八中校考阶段练习)水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1)时,向水的电离平衡体系中加入少量醋酸钠固体,得到为的溶液,其水解反应离子方程式为 ,由水电离出的=
(2)时,已知,在与的混合溶液中,若测得,则溶液中= (填精确值),= 。
(3)向溶液中滴加溶液至中性后,各离子浓度由大到小的顺序为 。
(4)某温度时水的离子积常数,若将此温度下的溶液与的稀硫酸混合,所得混合液,则 。
(5)时,向的NH3·H2O溶液滴加amL0.1的溶液时,混合溶液的恰好为7。则NH3·H2O的电离平衡常数 (用含有的式子表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】100mL1mol/LNH4Al(SO4)2溶液中逐滴加入1mol/LBa(OH)2溶液,a点时铝离子与氢氧根离子完全反应生成氢氧化铝沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,此时硫酸根离子剩余0.05mol,继续滴加50mLBa(OH)2,剩余的硫酸根离子全部与钡离子反应生成硫酸钡沉淀,0.1mol铵根离子与0.1mol氢氧根离子反应生成0.1mol一水合氨,继续加入50mLBa(OH)2,此时氢氧化铝开始溶解,c点时氢氧化铝完全溶解转化为偏铝酸根离子。
【详解】A.根据分析可知,b点沉淀质量最大,a点为0.1mol氢氧化铝和0.15mol硫酸钡,c点为0.2mol硫酸钡,a点沉淀质量小于c点,A错误;
B.a点溶液中溶质为硫酸铵,a到b的过程中硫酸铵与氢氧化钡反应,b点溶质为NH3·H2O,b到c点氢氧化铝与Ba(OH)2反应生成偏铝酸根离子,偏铝酸根离子和铵根离子均能促进水的电离,一水合氨抑制水的电离,故b点水的电离程度最小,B正确;
C.a点溶液溶质为硫酸铵,铵根离子水解使溶液呈酸性,则a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-],C正确;
D.b点到c点,氢氧化铝与Ba(OH)2反应生成偏铝酸根离子,离子方程式为Al(OH)3+OH-=AlO+2H2O,D正确;
故答案选A。
2.D
【详解】A.明矾中的铝离子可以水解,产生氢离子,纤维素属于糖类,在酸性条件下可以水解,A正确;
B.透过蓝色钴玻璃观察到焰色反应为紫色,则说明溶液中含有钾元素,B正确;
C.在盛有 AlCl3溶液的试管中加入 NaF 溶液生成Na3[AlF6],[AlF6]3-很难电离出铝离子,则再加入氨水,无白色沉淀生成,故其原因可能是 Al3+与 F-结合生成了新的物质,C正确;
D.该过程之所以可以得到更大的晶体,是因为在饱和溶液逐渐降温的过程中新析出的晶体在原来小晶体上结晶导致,反之如果升高饱和溶液的温度的话,则不利于晶体的析出,D错误;
故选D。
3.B
【详解】A.由图可知,加入20mLNaOH溶液时酸碱恰好完全反应,故丙酮酸溶液浓度等于氢氧化钠溶液浓度,A项正确;
B.①点加入氢氧化钠的物质的量是丙酮酸的一半,根据物料守恒,,B项错误;
C.②点溶液为CH3COCOOH 和CH3COCOONa的混合溶液,此时溶液显中性,,由电荷守恒,则,则溶液中存在,C项正确;
D.向20mL一定浓度的丙酮酸溶液中滴加溶液,滴定过程中CH3COCOOH浓度减小,水的电离程度增大,③点时酸碱恰好完全反应,水的电离程度最大,则水的电离程度:①<②<③,D项正确;
故选B。
4.C
【详解】A.醋酸是弱酸,加水稀释,醋酸电离平衡正向移动,pH=4的醋酸溶液加水稀释10倍,稀释后溶液pH<5,若使pH=5,需继续加水稀释,所以溶液体积:10V甲
C.若分别用pH=10的NaOH溶液恰好完全中和,消耗氢氧化钠溶液的体积相等,所得溶液的体积甲<乙,醋酸钠的浓度甲>乙,所以pH:甲>乙,故C正确;
D.若分别与10mLpH=10的NaOH溶液反应,剩余醋酸的物质的量相等,所得溶液的体积甲<乙,剩余醋酸的浓度甲>乙,所得溶液的pH:甲<乙,故D错误;
选C。
5.C
【详解】A.用NaOH溶液滴定NaHA发生反应NaOH+NaHA=Na2A+H2O,HA-不断减少,A2-不断增多,故曲线b表示的是A2-的分布系数变化曲线,A错误;
B.m点时HA-和 A2-的分布系数相同,pH=4.2,则H2A的第二步电离平衡常数,其数量级为10-5,B错误;
C.n点时滴入了10mLNaOH溶液,溶液中NaHA和Na2A的浓度比为1:1,根据电荷守恒和物料守恒可得,,,消去c(Na+)可得2c(H+)+c(HA -)- 2c(OH- )=c(A2-)-3c(H2A),C正确;
D.A2-的水解程度大于HA-,在NaOH与NaHA恰好完全反应之前溶液中A2-越多,水的电离程度越大,则在n、p、q三点中,水的电离程度大小关系为: n
6.A
【详解】①物质的量的浓度相同的2种盐,若pH:NaX>NaY,说明X-水解时生成更多氢氧根,则HX
③pH=7的NH3·H2O与NH4Cl的混合溶液中时,c(OH-)=c(H+),根据电荷守恒有c(Cl-) = c();故③正确;
④硫酸铵分子式为(NH4)2SO4,所以0.1 mol·L-1的硫酸铵溶液中,部分水解,离子浓度大小为c()>c()>c(H+);故④正确;
⑤冰晶胞中水分子的空间排列方式与金刚石晶胞类似,故⑤错误;
⑥1mol [Cu(NH3)4]2+中除了N-H键,还有NH3和Cu的配位键,所以含有σ键的数目为16NA;故⑥错误;
故答案选A。
7.C
【详解】A.根据反应可知,藻类光合作用吸收了,使平衡正向移动,促进珊瑚虫形成石灰石外壳,进而形成珊瑚,A正确;
B.碳酸的第一步电离方程式为,所以电离平衡常数表达式为,根据题图中点,可计算出,根据碳酸表达式和可得,即,B正确;
C.1个发生两步水解时可以结合2个水中的,计算总碱度时系数应为2,,C错误;
D.由题图可知,pH在7.8~8.3时DIC的主要存在形式为,D正确;
故选C。
8.A
【详解】A.水解过程中,元素的化合价不发生变化,生成、,则水解过程中,元素的化合价也不发生变化,应生成、,A正确;
B.Pb为第ⅣA族元素,常见化合价为+2、+4价,B错误;
C.金属碳化物与水的反应为复分解反应,中C元素为-4价,所以与水反应生成甲烷,C错误;
D.中心原子的价层电子对数为,空间结构为V形,中心原子的价层电子对数为,空间结构为V形,和的空间结构模型相同,中心原子的价层电子对数为,空间结构为平面三角形,空间结构为三角锥形,和的空间结构模型不相同,D错误;
故答案为:A。
9.D
【详解】A.NH4HCO3是弱酸弱碱盐,其溶液的酸碱性要看生成的弱酸、弱碱的电离常数,因为Kb(NH3·H2O)=1.75×10-5> Ka1(H2CO3) =4.4×10-7,所以NH4HCO3溶液中水解能力小于HCO水解能力,所以溶液呈碱性,A错误;
B.pH=-lgc(H+),由题图可知,a点的、NH3·H2O浓度相等,由Kb(NH3·H2O)=1.75×10-5==c(OH-),则a点pH=-lg()9,同理可得b点的、浓度相等,由Ka2(H2CO3)=4.7×10-11==c(H+),则b点pH=-lg(4.7×10-11)10,B错误;
C.根据物料守恒,c()+c(NH3H2O)=0.1mol·L-1,c()+c()+c()=0.1 mol·L-1,则c()+c(NH3H2O)+ c()+c()+c()=0.2mol·L-1,C错误;
D.由题图可知,当n(NaOH) = 0.10 mol时,c(Na+)>c()>c(),c()= c(),因为Kb(NH3·H2O)=1.75×10-5> Ka2(H2CO3)=4.7×10-11,所以溶液呈碱性,故c(OH-)>c(H+),D正确;
故选D。
10.C
【详解】A.起漂白作用的是HClO,由图像可知,pH=7.0时,c(HClO)比pH=4.0小,因此pH=7.0时漂白能力要比pH=4.0时要弱,选项A错误;
B.pH=7.5时,c(HClO)= c(ClO-),根据电荷守 恒有c(OH-)=c(H+)+ c(ClO-),故c(OH-)=c(H+)+c(HClO),选项B错误;
C.氯气通入水中,存在电荷守恒:c(H+)=c(Cl-)+c(ClO-)+c(OH-),选项C正确;
D.夏天相比冬天温度高,并且HClO易分解;温度越高,HClO分解越快。所以,在夏天的杀菌消毒效果要比在冬天差,选项D错误;
答案选C。
11.D
【详解】A.x1时,氨的去除率为100%、总氮残留率为5,,95%的氨气参与反应①、有5%的氨气参与反应②,反应①消耗,参与反应②消耗,,A正确;
B.x>x1时,反应①也生成氯离子,所以,B正确;
C.x>x1时,x越大,氨总去除率不变,氮残余率增大,说明生成的硝酸根离子越多,生成N2的量越少,C正确;
D.x
12.A
【详解】A.=10-5mol L-1的溶液为碱性溶液,四种离子在碱性溶液中不发生任何反应,能大量共存,故A正确;
B.由水电离出的c(H+)=10-14mol/L的溶液可能为酸溶液,也可能为碱溶液,碳酸氢根离子既能与酸溶液中的氢离子反应,也能与碱溶液中的氢氧根离子反应,一定不能大量共存,故B错误;
C.能使甲基橙变红的溶液为酸性溶液,酸性条件下,溶液中硝酸根离子与亚铁离子发生氧化还原反应,不能大量共存,故C错误;
D.溶液中铝离子和偏铝酸根离子发生双水解反应,不能大量共存,故D错误;
故选A。
13.C
【分析】由于0.1mol·L-1Na2CO3溶液可发生水解,溶液显碱性,通入Cl2后,生成NaHCO3、NaClO、NaCl,水解程度减小,溶液碱性减弱,且随着Cl2的通入,溶液中HCl和HClO增多,酸性增强,据此解答。
【详解】A.由分析可知,随着Cl2的通入,溶液酸性增强,pH逐渐减小,则曲线①表示溶液中pH的变化,故A正确;
B.随着Cl2的通入,溶液中溶质的变化为Na2CO3 NaHCO3、NaClO、NaCl NaCl、HCl、HClO、H2CO3,水的电离程度逐渐减小,故B正确;
C.通入Cl2后,溶液中存在电荷守恒:c(Na+)+c(H+)=2c()+c()+c(ClO-)+c(Cl-)+c(OH-),由图中a点时通入的Cl2为0.10mol,根据物料守恒有:c(Na+)=c(ClO-)+c(Cl-)+c(HCO),联立两式可得:c(H+)+ c(HCO)=2c()+c()+c(OH-),故C错误;
D.pH=10.3时:结合=10-10.3,可知c()=c(),溶液中存在电荷守恒:c(Na+)+c(H+)=2c()+c()+c(ClO-)+c(Cl-)+c(OH-),Cl2在水溶液中发生歧化反应生成HClO、ClO-、Cl-,存在c(Cl-)=c(HClO)+c(ClO-),可得c(H+)- c(OH-)=2c()+c()+c(ClO-)+c(Cl-)- c(Na+)=3c()+2c(ClO-)+c(HClO)- c(Na+)<0,即有c(Na+)>3c()+2c(ClO-)+c(HClO),故D正确;
答案选C。
14.B
【详解】A.除去MgCl2酸性溶液中的Fe3+,铁离子水解生成氢氧化铁和氢离子,加入MgO调节pH消耗氢离子,使水解平衡不断正向移动而使Fe3+转化为Fe(OH)3沉淀,故A正确;
B.Al(NO3)3水解生成氢氧化铝和硝酸,硝酸具有挥发性,因此将Al(NO3)3溶液蒸干灼烧,可得到Al2O3,故B错误;
C.Na2CO3溶液水解显碱性,会与玻璃中二氧化硅反应生成硅酸钠,硅酸钠是一种矿物胶,会黏住玻璃塞,因此实验室盛放Na2CO3、Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,故C正确;
D.能使蛋白质变性,因此可以用硫酸铜溶液对游泳池水进行消毒,故D正确。
综上所述,答案为B。
15.C
【分析】由图可知,P1时溶液为氯化铵和一水合氨的混合溶液,溶液中铵根离子和一水合氨的浓度相同、pH为9.25,则氨水的电离常数Kb==c (OH—)= 10—4.75,P2时溶液为氯化铵和一水合氨的混合溶液,溶液中氢离子和氢氧根离子相等,溶液呈中性,P3时氨水和氯化氢气体完全反应生成氯化铵,溶液呈酸性。
【详解】A.由分析可知,氨水的电离常数Kb=10—4.75,则铵根离子的水解常数Kh===10-9.25,故A正确;
B.由图可知,P2时溶液中氢离子和氢氧根离子相等,溶液pH=7,溶液中==102.25,则溶液中c ()>100c (NH3·H2O),故B正确;
C.由图可知,t =0.5时溶质为等浓度的氯化铵和一水合氨的混合物,溶液呈碱性说明一水合氨的电离程度大于铵根离子水解程度,则溶液中氯离子浓度大于一水合氨的浓度,由电荷守恒c ()+c (H+)=c (Cl—)+c (OH-)可知,溶液中的离子浓度大小顺序为c ()+c (H+)>c (NH3·H2O)+c (OH—),故C错误;
D.氨水在溶液中电离出的氢氧根离子抑制水的电离,铵根离子在溶液中水解促进水的电离,由分析可知,P1、P2、P3时溶液中铵根离子浓度依次增大,水的电离程度依次增大,故D正确;
故选C。
16.D
【详解】A.MgCl2水解生成氢氧化镁和盐酸,因此MgCl2溶液在空气中蒸干得到MgO固体,Sr(OH)2是强碱,SrCl2不发生水解,因此SrCl2溶液在空气中蒸干得到SrCl2固体,故A错误;
B.Fe3O4与盐酸反应生成Fe2+和Fe3+, 由于硫离子具有还原性,因此Fe3S4也可与盐酸反应生成Fe2+和硫化氢,故B错误;
C.HgS与O2在高温下反应生成Hg和SO2,故C错误;
D.CO2是直线型分子, COS与CO2是等电子体,则COS也是直线型分子,故D正确。
综上所述,答案为D。
17.C
【分析】a点为第一个终点发生反应为:Na2CO3+HCl=NaCl+NaHCO3,c点为第二个终点:NaHCO3+HCl=NaCl+CO2↑+H2O。
【详解】A.a点的成分为NaCl和NaHCO3。相比a点,b点加入更多盐酸, NaHCO减少,b点成分为NaCl和NaHCO3。c点成分为NaCl。NaHCO3弱酸盐促进水的电离,水的电离程度:a>b>c,A项错误;
B.a点的成分为NaCl、NaHCO3,存在电荷守恒为c(Na+)+c(H+)=c(OH-)+2c(CO)+c(HCO)+c(Cl-),B项错误;
C.Na2CO3转变为NaHCO3消耗盐酸2.9mL,而总共消耗盐酸6.8mL,所以纯碱中NaHCO3消耗盐酸为6.8-2.9×2=1mL。所以n(NaHCO3)=n(HCl)=10-3cmol,得m(NaHCO3)= n(NaHCO3)M(NaHCO3)=84×10-3cg=0.084cg,C项正确;
D.b点的成分为NaCl、NaHCO3,而c点成分为NaCl,所以b到c的过程中c(Na+)>c(Cl-),D项错误;
故选C。
18.(1)CH3COO-
(2) NaAlO2+2H2O Al(OH)3+NaOH NaAlO2
(3)BE
(4)BDE
(5)c(Na+)>c(Cl-)>c(HCO)>c(OH-)>c(H+)>c(CO)
(6)CN-+CO2+H2O=HCN+HCO
【解析】(1)
越容易水解的盐,代表水解生成的酸的酸性越弱,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO,反之,上述溶液中的阴离子结合H+能力最弱的为CH3COO-。
(2)
NaAlO2是强碱弱酸盐,偏铝酸根离子水解使溶液呈碱性,化学方程式为:NaAlO2+2H2O Al(OH)3+NaOH。将NaAlO2溶液加热,促进水解,氢氧化铝、氢氧化钠浓度增大,反应生成偏铝酸钠,故蒸干最后得到的固体产物是NaAlO2;
(3)
由表中数据可知,在常温下,0.1mol/L的CH3COONa溶液的pH=8.8,促进水的电离,c(H+)=10-8.8mol/L,由水电离产生的氢氧根离子浓度为10-5.2mol/L,而由水电离产生的氢离子浓度与由水电离产生氢氧根离子浓度相等,则由水电离产生的氢离子浓度也为10-5.2mol/L:
A.pH=8.8的NaOH溶液,抑制水的电离,A错误;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-5.2mol/L,B正确;
C.pH=5.2的盐酸,抑制水的电离,C错误;
D.0.1mol/L的NaCN溶液pH=11.1,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-2.9mol/L,D错误;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离产生的氢离子或氢氧根离子浓度为10-5.2mol/L,E正确;
答案选BE。
(4)
将浓度均为0.1mol/L的NaHCO3、Na2CO3等体积混合,钠离子的物质的量与碳原子的物质的量之比为3:2,则物料守恒:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),溶液呈电中性,有电荷守恒:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),则:
A.依据物料守恒有:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),A错误;
B.依据物料守恒有:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),B正确;
C.物料守恒:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),电荷守恒:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),两式联立有质子守恒:c(CO)+2c(OH-)=2c(H+)+c(HCO)+3c(H2CO3),C错误;
D.依据电荷守恒有:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),D正确;
E.混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,故混合溶液中离子浓度c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+),E正确;
F.混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,故混合溶液中离子浓度c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+),F错误;
答案选BDE。
(5)
0.1mol/LHCl与0.1mol/LNa2CO3溶液等体积混合后所得为0.05mol/LNaCl与0.05mol/LNaHCO3混合溶液;溶液呈碱性,因碳酸氢根离子水解程度大于电离程度,故各离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO)>c(OH-)>c(H+)>c(CO)。
(6)
等浓度的上述盐溶液,水解程度越大,溶液pH越大,对应酸的酸的酸性越弱,则有酸性:H2CO3>HCN>HCO,则向NaCN溶液中通入少量CO2气体发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO。
19.(1) Al3++3H2O Al(OH)3+3H+ Al2(SO4)3 Al3++3HCO=Al(OH)3↓+CO2↑
(2) < 0.1
(3) ①>②>③ 变蓝 c(NH)>c(CO)>c(HCO) 12
【详解】(1)Al2(SO4)3为强酸弱碱盐,铝离子发生水解反应生成氢氧化铝和硫酸而溶液呈酸性,水解方程式为Al3++3H2O Al(OH)3+3H+,硫酸是难挥发性物质,整个Al2(SO4)3溶液得到Al2(SO4)3固体,泡沫灭火器中Al2(SO4)3溶液和NaHCO3溶液发生双水解反应得到氢氧化铝沉淀和二氧化碳,离子方程式为:Al3++3HCO=Al(OH)3↓+CO2↑,故答案为:Al3++3H2O Al(OH)3+3H+;Al2(SO4)3;Al3++3HCO=Al(OH)3↓+CO2↑;
(2)①将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,则溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,混合溶液中c(Na+)>c(A-),则A-离子的水解程度大于HA的电离程度,溶液显碱性,则c(A-)<c(HA),故答案为:<;
②溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,根据物料守恒得:c(HA)+c(A-)=0.1mol/L,故答案为:0.1;
(3)①弱酸的酸性越弱,其盐水解程度越大,溶液碱性越强,则pH相同时物质的量浓度较小,由平衡常数越大其酸性越强,则酸性:CH3COOH > H2CO3> HClO,则物质的量浓度:c(CH3COONa) > c(NaHCO3)> c(NaClO),c(Na+):①>②>③;
②根据电离平衡常数可知,电离程度大小为:NH3 H2O>H2CO3>HCO,电离程度越大,离子的水解程度越小,则水解程度大小顺序为:CO>HCO>NH。0.1mol L-1的(NH4)2CO3溶液中,CO、NH都水解,水解程度大小为CO>NH,溶液呈碱性,使pH试纸变蓝;水解程度越大,离子浓度越小,且水解程度较小,则离子浓度大小为:c(NH)>c(CO)>c(HCO),故答案为:变蓝;c(NH)>c(CO)>c(HCO);
③CO的水解程度较小,忽略CO第二步水解和H2O的电离,则该溶液中c(OH-)≈c(HCO),c(CO)≈0.50mol/L,CO的第一步水解平衡常数Kh1== 2×l0-4 =,所以该溶液中c(OH-)≈mol/L=0.01mol/L,则溶液中c(H+)=mol/L=10-12mol/L,溶液的pH=12,故答案为:12。
20.(1) 1×10-3
(2) 9.9×10-7 18
(3)
(4)
(5)
【详解】(1)醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解生成醋酸和氢氧根离子,溶液呈碱性,水解的离子方程式为,pH为11的溶液中水电离出的氢氧化离子浓度为1×10-3mol/L,故答案为:;1×10-3;
(2)溶液pH为6的醋酸和醋酸钠混合溶液中存在电荷守恒关系c(Na+)+ c(H+)=c(CH3COO—)+ c(OH—),c(CH3COO—)—c(Na+)= c(H+)—c(OH—)=10—6mol/L—10—8mol/L=9.9×10—7mol/L;溶液中===18,故答案为:9.9×10—7;18;
(3)向硫酸氢铵溶液中滴加氢氧化钠溶液时,溶液中的氢离子优先与氢氧根离子反应,以物质的量比1∶1恰好反应时得到硫酸钠和硫酸铵的混合溶液,铵根离子水解使溶液呈酸性,所以硫酸氢铵溶液与加入的氢氧化钠溶液反应得到的中性溶液为硫酸钠、硫酸铵、一水合氨的混合溶液,溶液中离子浓度由大到小的顺序为,故答案为:;
(4)由反应后溶液pH为2可得:=10—2mol/L,解得a∶b=19∶2,故答案为:19∶2;
(5)氨水与稀硫酸反应得到的中性溶液为硫酸铵和一水合氨的混合溶液,溶液中氢氧根离子的浓度为10—7 mol/L、铵根离子浓度为×2= mol/L、一水合氨的浓度为= mol/L,则电离常数Kb==,故答案为:。
答案第1页,共2页
答案第1页,共2页
同课章节目录
