2024届高三新高考化学大一轮复习题-化学反应原理综合题(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮复习题-化学反应原理综合题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 18:51:48 | ||
图片预览



文档简介
2024届高三新高考化学大一轮复习题-化学反应原理综合题
1.(2022·河北·模拟预测)我国科学家首次实现甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ:
反应Ⅱ:
(1)已知:①
②
③
上述反应Ⅰ的 。
(2)在密闭容器中投入2mol和1mol发生反应Ⅰ、Ⅱ,保持起始投料量不变,在不同温度、压强下做平行实验,测得的平衡体积分数与温度、压强的关系如图所示。
①a、b、c由大到小排序为 。
②由图可知,当时,以反应 (填“Ⅰ”或“Ⅱ”)为主,理由是 。
③℃时,三条曲线几乎相交的原因可能是 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)、的体积比为2:1以及(b)、、[的作用是活化催化剂]的体积比为2:1:8充入并发生反应Ⅰ、Ⅱ,相同的时间内(都加入相同催化剂),测得产物的选择性[如甲醇的选择性]如表所示。
投料方式 a b
的选择性/% 90 15
的选择性/% 10 85
①b投料方式能显著提高甲醇选择性的原因是 。
②向上述刚性密闭容器中按照体积比2:1:8充入、和,在450K下反应达到平衡时,的转化率为50%,的选择性为90%,则反应Ⅱ的压强平衡常数 。(计算结果保留2位小数)
(4)我国科学家研发出新型催化剂,利用电催化法实现将甲烷转化成甲醇,装置如图所示。
交换膜M是 (填“阳离子”或“阴离子”)交换膜。阳极的电极反应式为 。
2.(2022·全国·模拟预测)丙烯是重要的化工原料,目前生产丙烯主要有丙烷脱氢、丙烷与二氧化碳耦合、电解等技术。
方法一:丙烷直接脱氢法制丙烯
已知:CH3CH2CH3(g)+5O2(g)=3CO2(g)+4H2O(1) △H=akJ·mol-1
2CH3CH=CH2(g)+9O2(g)=6CO2(g)+6H2O(1) △H=bkJ·mol-1
2H2(g)+O2(g)=H2O(1) △H=ckJ·mol-1
(1)写出丙烷脱氢生成丙烯和氢气的热化学方程式: 。
(2)600℃、0.4MPa下,向装有催化剂的恒压密闭容器中,以=1投料,发生丙烷脱氢生成丙烯的反应,丙烷的转化率(α)随时间(t)变化的曲线如图所示:
则该体系达到平衡状态的标志为 (填选项字母)。
A.单位时间内消耗C3H8(g)的物质的量等于生成H2(g)的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D.H2O(g)的分压不再改变
(3)平衡时水的分压约为 ,增大的值可提高丙烷的转化率,解释其原因: 。
方法二:丙烷与二氧化碳耦合法制丙烯
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
①C3H8(g)C3H6(g)+H2(g)
②C3H8(g)C2H4(g)+CH4(g)
③3CO2(g)+9H2(g) C3H6(g)+6H2O(g)
④CO2(g)+H2(g)CO(g)+H2O(g)
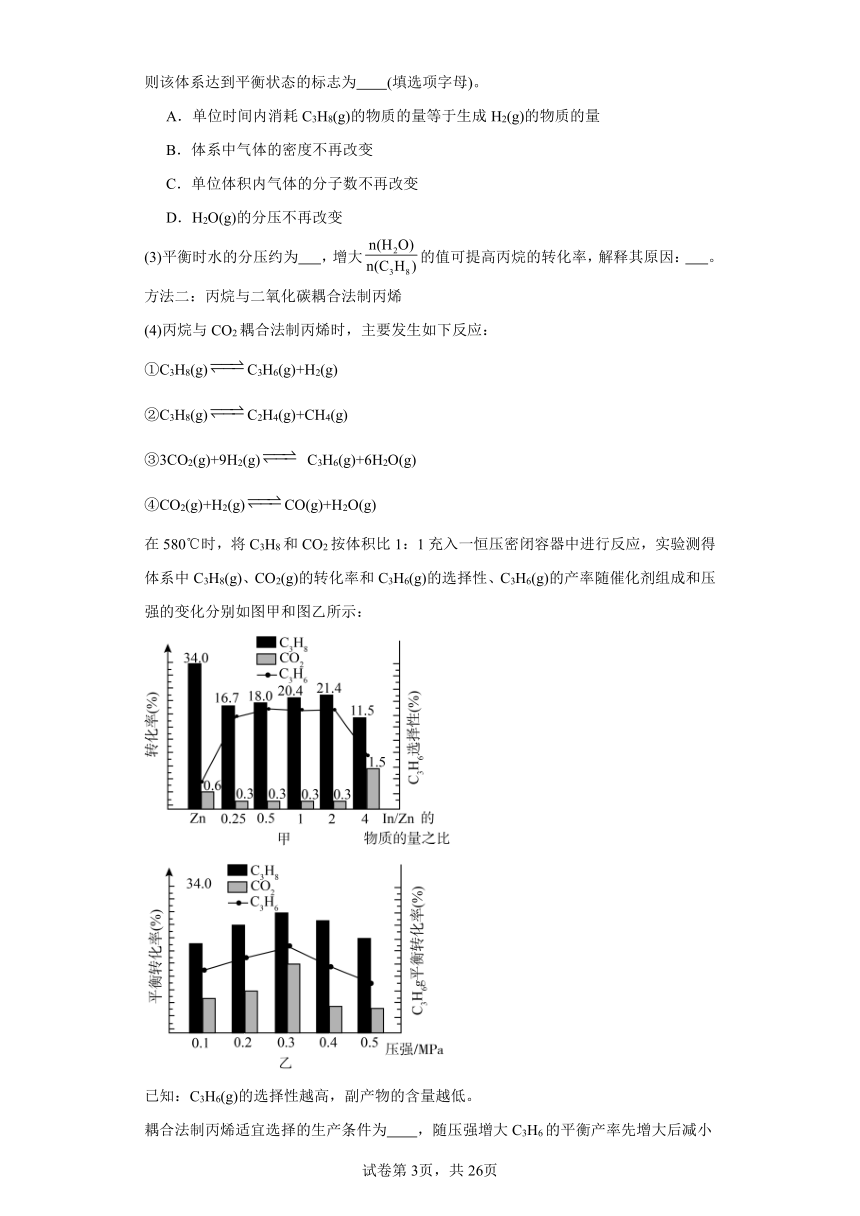
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图甲和图乙所示:
已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为 ,随压强增大C3H6的平衡产率先增大后减小的原因为 。
方法三:电解法制丙烯
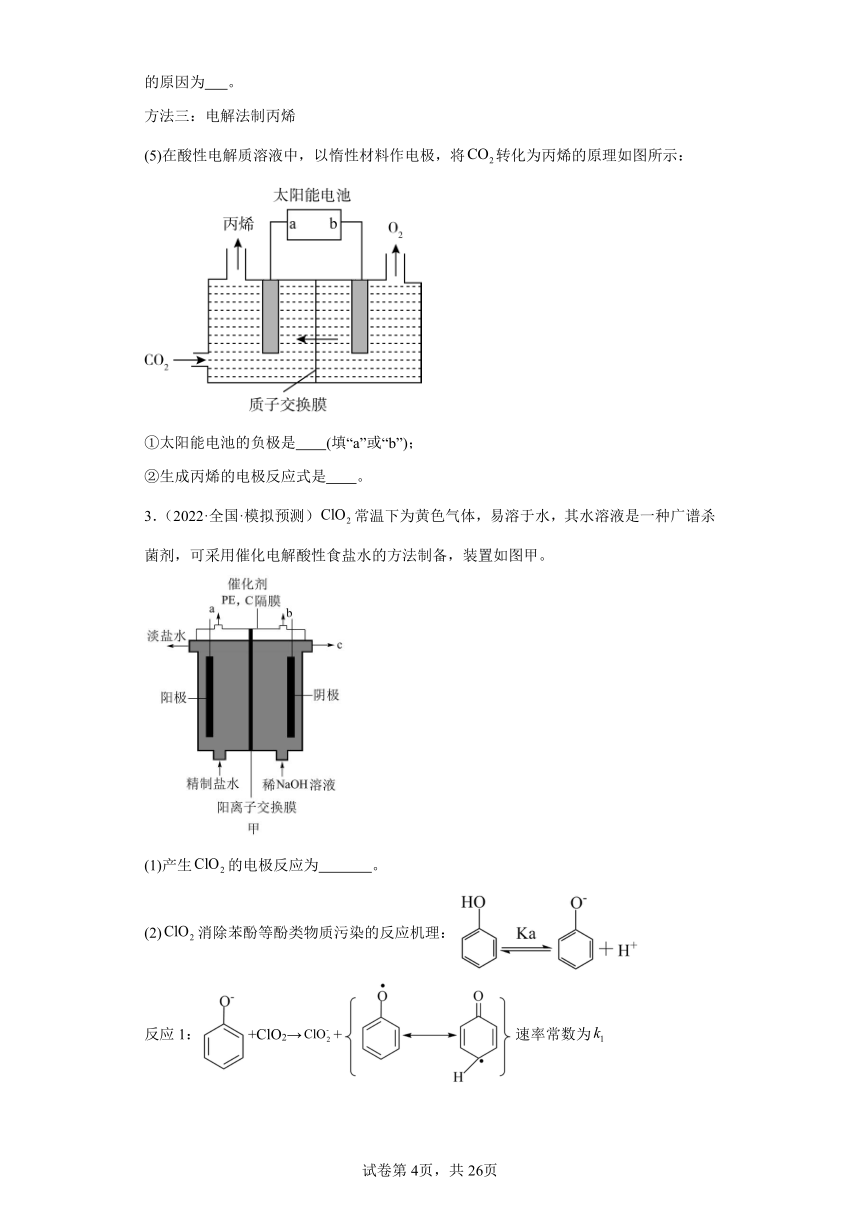
(5)在酸性电解质溶液中,以惰性材料作电极,将转化为丙烯的原理如图所示:
①太阳能电池的负极是 (填“a”或“b”);
②生成丙烯的电极反应式是 。
3.(2022·全国·模拟预测)常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
(1)产生的电极反应为 。
(2)消除苯酚等酚类物质污染的反应机理:
反应1:+ClO2→+速率常数为
反应2:+ClO2→速率常数为
已知反应速率常数:,则决定与苯酚反应速率的步骤为反应 (填“1”或“2”)。
(3)在电解食盐水时控制一定条件,会得到氯酸钠()和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯的方法为 。
(4)商业上常用“有效氯”来说明含氯消毒剂的消毒能力,“有效氯”是指一定质量的消毒剂与多少质量的氯气氧化能力相当,其数值可用此时氯气的质量与消毒剂质量的百分比来表示,则的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO g(精确到小数点后两位)。
(5)25℃时配制0.1mol/L的氯水100mL(假设完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是 ,d点溶液中的物料守恒为 ,滴定终点时消耗NaOH标准溶液100mL,此时pH=10.84,则该温度下的水解平衡常数约为 (已知)。
4.(2022·河北·模拟预测)“绿水青山就是金山银山”。研究含硫化合物的性质在工业生产和环境保护中有重要意义。回答下列问题:
(1)是重要的工业原料,工业上可通过氯酸钠溶液直接吸收制备,该反应的离子方程式可表示为 。
(2)燃气中的可先通过浓NaOH溶液吸收,再将从溶液中提取出来,实现的回收与利用。
已知:①
②
则常温下NaOH溶液与反应生成溶液的热化学方程式为 。
(3)0.4 mol 与0.1 mol 在 610 K时发生反应: ,反应制得的基硫(COS)可用于合成除草剂。
①下列选项中能作为判断密闭容器中反应达到化学平衡状态的标志的是 (填字母)。
A. B.混合气体密度不再变化
C.与的物质的量之比保持不变 D.混合气体平均摩尔质量不再变化
②实验测得上述反应的速率方程为:,,、分别为正、逆反应速率常数,则该反应的平衡常数K与、之间的关系是 。
(4)工业尾气中的可通过如下反应处理并回收硫: 。
①T ℃时,若在2 L的密闭容器中充入4 mol 和4 mol 发生上述反应,50 min后反应达平衡,此时容器内压强为开始时的1.25倍,则用表示反应的速率 ;反应平衡常数 。
②分别选取、NiO作催化剂,反应相同时间内的转化率随反应温度的变化如图所示,选择作催化剂,最适宜温度大约为 ;a点后的转化率降低的原因可能是 。
5.(2022·全国·模拟预测)在现有的制氢技术中,广泛使用的是甲烷水蒸气重整制氢技术,该技术已广泛用于工业生产,并已获得其成熟工艺流程和催化剂制备工艺。其中包含的主要反应有
①
②
回答下列问题:
(1)原料气反应前要进行脱硫处理才能进入催化剂主转化炉,这样做的目的是 。
(2)增加入口气体流速对于提高转化率 (填“有利”或“不利”),实际生产中,往往选取2 3MPa这种相对较高的压强,试分析原因: 。
(3)不同温度下反应达到平衡时各物质的物质的量分数如图所示:
①CO气体物质的量分数随温度升高而增加的原因是 ;
②℃时,容器中 。
(4)900℃下,向恒压密闭容器中充入1mol和1mol,容器的总压强为1MPa,反应达到平衡时,的平衡分压为0.1MPa,的物质的量分数为0.6,则的转化率为 ,计算900℃时反应②的平衡常数 (已知气体分压=总压×气体的物质的量分数)。
6.(2023·湖南娄底·高三双峰县第一中学校考阶段练习)甲醇是重要的化工原料,也是重要的能源物质,可发展替代传统化石燃料。开发加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:
(1)加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
①
②
③
则反应③的 。
(2)加氢生成甲醇适宜在 (填“低温”“高温”“高压”“低压”,可多选)条件下进行,在实际生产过程中,通常会在原料气里掺一些CO,请从平衡移动角度分析原因: 。
(3)在一恒温、容积可变的密闭容器中,充入1mol 与3mol 发生反应: ,在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时的物质的量分数为 ,该反应的压强平衡常数为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)也可以通过电化学方法转化为,装置如图2所示。阴极的电极反应式为 ,若外接电源为铅蓄电池,铅蓄电池正极质量增加32g时,则标准状况下阳极生成 L 。
7.(2022·河北·模拟预测)氮氧化物的处理对建设生态文明具有重要意义,如何消除氮氧化物的污染成为当前研究的主要课题之一、回答下列问题:
(1)已知:①碳的燃烧热为;② 。结合图1,写出一氧化氮分解生成两种无污染气体的热化学方程式 。
(2)还原法。研究发现反应过程如图2,此反应过程中的催化剂为 ,写出脱氮过程的总反应的化学方程式 。
(3)还原法。已知催化剂Rh表面催化还原NO的反应机理如表,其他条件一定时,决定催化还原NO的反应速率的基元反应为 (填序号)。
序号 基元反应 活化能
① 12.6
② 0.0
③ 97.5
④ 83.7
⑤ 33.5
⑥ 45.0
⑦ 120.9
⑧ 37.7
⑨ 77.8
⑩ 108.9
(4)还原法。利用甲烷可实现氮氧化物的消除,反应原理为 。一定温度下,在2.0L刚性密闭容器中通入1mol 和2mol ,测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
反应时间t/min 0 2 4 6 8 10
总压强p/(100kPa) 4.80 5.44 5.76 5.92 6.00 6.00
达到平衡时,的转化率为 。若起始时加入2mol 和2mol ,则该温度下的压强平衡常数 (以分压表示,分压=总压×物质的量分数)。
(5)CO还原法。汽车尾气(CO、NO)可转化为无毒、无害物质。在密闭容器中充入10mol CO和8mol NO发生反应(),如图3为平衡时NO的体积分数与温度、压强的关系。若在D点对反应容器降温的同时缩小体积,使体系压强增大,重新达到的平衡状态可能是图3中A~G点中的 点。
(6)电解氧化吸收法。将废气中的转变为硝态氮。电解 NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图4。电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO的主要反应的离子方程式为 。
8.(2022·全国·模拟预测)碳中和问题已成为国际研究热点,回收利用已成为科学家研究的热点课题。
I.如图为与转化为和的反应的能量变化过程:
(1)反应①的热化学方程式为 ;可以推测反应①速率 (填“>”“=”或“<”)反应②速率。
II.如图为金属钌作催化剂,将转化为的过程:
(2)将6mol和8mol充入一体积为2L的密闭容器中(温度保持不变),测得压强为70MPa;测得的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。
①该反应在内的平均反应速率为 ;
②下列说法不正确的是 (填字母);
A.催化过程中
B.若缩小体积,正反应速率加快,逆反应速率降低,平衡正向移动
C.金属钌可大大提高该反应中反应物的转化率
D.当不再变化时,反应达平衡状态
E.平衡后再次充入,平衡正向移动,的转化率升高
③该反应的平衡常数表达式为 (以分压表示,分压=总压×物质的量分数);可计算该条件下的为 ;
④图中虚线A、B为改变某一条件情况,与实线相比,虚线A改变的条件可能是 ,虚线B改变的条件可能是 ;虚线A对应条件下平衡常数为,虚线B对应条件下平衡常数为,则、的大小关系是 。
9.(2022·河北·模拟预测)2021年11月,《自然》杂志报道:科学家设计了一种用阳光和空气生产燃料的实验系统,其分三步:第一步,利用直接空气捕获装置收集空气中的和;第二步,在太阳能作用下运用氧化还原装置将和转化成合成气(CO、);第三步,利用合成气合成烃和甲醇。回答下列问题:
Ⅰ.模拟制备合成气,装置如图1所示。
(1)光伏电池中b极是 (填“正极”或“负极”)。交换膜类型是 (填“阳离子”或“阴离子”)交换膜。
(2)如果制备的合成气中CO、的体积比为1:2(同温同压),则产生合成气的电极的总反应式为 。
Ⅱ.利用合成气合成甲醇、甲烷等。已知:
反应①
反应②
(3)在热力学标态下由指定单质(大多是稳定单质)生成1mol物质的反应焓变,称为该物质的标准摩尔生成焓()。相关物质的标准摩尔生成焓数据如表所示。
物质 CO(g)
() 0 -75 -110.5 -200.7 -241.8
上述反应中, 。
(4)在某催化剂作用下,反应的速率方程为(k为速率常数,与温度、催化剂有关,与浓度无关)。在某温度、该催化剂作用下,仅发生反应②,测得反应速率与CO、的浓度关系如表所示。
实验 反应速率
Ⅰ 0.1 0.1 v
Ⅱ 0.2 0.1 2v
Ⅲ 0.2 0.2 8v
Ⅳ 0.4 x 36v
下列推断正确的是_______(填字母)。
A., B.
C.其他条件不变,升高温度,k增大 D.其他条件不变,加入催化剂,k减小
(5)在一定温度下,向某恒容密闭容器中充入CO和,仅发生反应①,测得平衡体系中的体积分数与投料比[]的关系如图2所示。
在a、b、c三点中,CO的转化率最大的是 点,判断依据是 。
(6)在1L刚性密闭容器中充入1molCO和2mol,在某催化剂作用下发生反应①和反应②,测得产物甲醇、甲烷的体积分数与温度的关系如图3所示。
当温度高于300℃时,该催化剂选择性较大的产物是 (填化学式)。已知T℃时,达到平衡时的选择性为80%,,则该温度下反应①的平衡常数 (结果取整数)。
10.(2022·全国·模拟预测)我国科学家首次实现利用甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ:
反应Ⅱ:
(1)已知:①
②
③
上述反应Ⅰ中的 。
(2)在密闭容器中投入2mol和1mol,起始投料量不变,在不同温度、压强下做平行实验,测得的平衡体积分数与温度、压强的关系如图所示:
①由图可知,当时,以反应 (填“Ⅰ”或“Ⅱ”)为主,理由是 ;
②时,三条曲线几乎相连的原因可能是 ;
③a、b、c由大到小排序为 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)、的体积比为2:1以及(b)、、(的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=]如表所示:
投料方式 a b
的选择性/% 90 15
的选择性/% 10 85
①投料b能显著提高甲醇选择性的原因是 。
②向上述刚性密闭容器中按照体积比2:1:8充入、和,在450K下达到平衡状态时,的转化率为50%,的选择性为90%,则副反应的压强平衡常数 (计算结果保留1位小数)。
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:
交换膜M的名称是 ;阳极的电极反应式为 。
11.(2023·浙江宁波·镇海中学校考模拟预测)利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢茶(1-MD)的副反应,涉及反应如图:
(1)已知一定条件下反应、,的焓变分别为,、,则反应的焓变 (用含、、的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
①下列说法不正确的是
A.上述四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成MTLs
D.由图甲可知,500K前,曲线a对应的反应速率最大
②若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,则表示反应R2的平衡常数随温度变化的曲线为 。
(3)某温度下,将一定量的1-MN投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
①请解释1-MTL的物质的量随时间呈现先上升后下降的原因 ;
②若,请在图丙绘制反应R1、R3的“能量~反应过程”示意图 。
12.(2023·四川成都·统考三模)在光照或加热条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g)CH3Cl(g)+HCl(g)ΔH.该反应涉及两个基元步骤①②,其相对能量—反应进程图如下所示:
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ·mol-1。则步骤①的焓变ΔH1= kJ/mol;一氯取代反应总焓变ΔH= (用ΔH1、ΔH2表示)。
(2)不考虑其他副反应,下列可增大甲烷的平衡转化率的措施有 (填字母序号)。
a.恒容充入甲烷 b.设法使CH3Cl液化
c.适当降低温度 d.用更强的光照射反应混合物。
(3)450℃时,tmin内甲烷与Cl2发生取代反应,共消耗amol甲烷得到各种产物如下:
产物 CH3Cl CH2Cl2 CHCl3 CCl4 CH3CH3
反应选择性= 87% 7% 4% 1% 1%
则生成乙烷的平均速率v(CH3CH3)= mol·min-1。
(4)温度为T1时,步骤①的v正=1.7×108c(Cl·)·c(CH4),v逆=6.8×1010c(CH3·)·c(HCl),T1时步骤①的平衡常数K= ;T2时,步骤①达平衡时存在物质的量关系:n(Cl·)=450n(·CH3),分压关系:2p(HCl)=3p(CH4),由此判断温度T1 T2(填“>”或“<”),判断理由是 。
13.(2023·四川内江·统考三模)铁、镍、铜在医药、催化及材料等领域中都有广泛的应用。回答下列问题:
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为 (填轨道表示式)。
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为 。
②不存在的化学键有 (填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
①甘氨酸铜中氮原子的杂化类型为 。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是 。
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1,),Y的坐标为(,,),设NA为阿伏加德罗常数的值。坐标为(,1,)的是 原子,Se原子X与Se原子Y之间的距离为 nm,该晶体的密度为 g·cm-3。
14.(2023·河北衡水·河北衡水中学校考模拟预测)中国科学院宣布在入工合成淀粉方面取得突破性进展,在国际上首次实现二氧化碳到淀粉的全合成,该技术未来有望促进碳中和的生物经济发展。
(1)入工合成转化为淀粉只需要11步,其中前两步涉及的反应如图1所示。
①该流程中所涉及含碳化合物中碳原子的杂化方式有 。
②反应: 。
(2)反应Ⅰ进行时,同时发生反应:。在恒容密闭容器中充入和,一定温度下,达到平衡时,物质的量分数为 %(计算结果保留1位小数)。
(3)乙烯是合成工业的重要原料,一定条件下可发生反应:。
①分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得体积分数与温度的关系如图2所示。
在催化剂甲作用下,图2中点的速率 (填“>”“<”或“=”),根据图中所给信息,应选择的反应条件为 。
(2)一定温度下,该反应正逆反应速率与的浓度关系:,(是速率常数),且或的关系如图3所示,向恒容密闭容器中充入一定量,反应进行分钟后达平衡,测得,该温度下,平衡常数 (用含的计算式表示,下同),用表示的平均反应速率为 mol·L-1·min-1。
15.(2023·云南昆明·统考二模)CO2的有效转化有助于我国实现2060年“碳中和”目标。将CO2和H2在催化剂作用下,可实现二氧化碳甲烷化。已知:
键能 C=O H-H C-H H-O
kJ·mol-1 803 436 414 464
(1)写出CO2甲烷化生成气态水的热化学方程式 。
(2)二氧化碳甲烷化反应体系中,存在副反应:CO2(g)+ H2(g)= CO(g)+H2O(g) ΔH>0。向1L恒容密闭容器中通入1 mol CO2和5 mol H2,测得相同反应时间内,不同催化剂作用下温度对CO2转化率和CH4选择性的影响如图所示。
CH4选择性=
①写出一种既能提高三氧化碳甲烷化的反应速率又能提高甲烷产率的措施 。
②反应温度在260°C ~320°C之间时,应选择 为催化剂,该温度范围内,升高温度CH4的产率 (填“增大”“减小”或“不变”)。
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升的原因是 。
④若A点表示320°C时的平衡状态,则容器中CH4的浓度为 mol·L-1,二氧化碳甲烷化反应的平衡常数K= (mol·L-1)-2(用含a、b的表达式表示)。
(3)CeO2理想晶胞如图所示。若晶胞边长为a nm, NA为阿佛伽德罗常数的值。CeO2理想晶胞中Ce4+的配位数为 ,CeO2晶体的密度为 g·cm-3。
16.(2023·天津河西·天津市新华中学校考二模)氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
I.完成下列问题。
(1)在一定条件下氨的平衡含量如表。
温度/℃ 压强/ 氨的平衡含量
200 10 81.5%
550 10 8.25%
①该反应为 (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、,而非200℃、,主要的原因是 。
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中的物质的量分数的变化情况。
曲线a对应的温度是 。
②M、N、Q点平衡常数K的大小关系是 。
II.转化为是工业制取硝酸的重要一步,已知:、298K时:
(3)请写出转化为的热化学方程式 。
(4)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是 。
A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.与反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(5)某兴趣小组对反应进行了实验探究。在一定温度和催化剂的条件下,将通入3L的密闭容器中进行反应(此时容器内总压为),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,时反应达到平衡,用的浓度变化表示时间内的反应速率 (用含的代数式表示);
②时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后分压变化趋势的曲线是 (用图中a、b、c、d表示)。
17.(2023·吉林长春·统考模拟预测)氮和碳及其化合物在工农业生产、环境等方面有重要应用和影响。
回答下列问题:
(1)燃料在汽车发动机中燃烧时会产生污染环境的,加装三元催化转化器可使汽车尾气中的转化为无毒物质。
已知:I.
II.
III.
①反应III对应的 ,该反应能自发进行的条件是在 (填“低温”、“高温”或“任意温度”)下。
②向某绝热恒容密闭容器内充入一定量的和,发生反应III。下列能说明该反应达到平衡状态的是 (填标号)。
A.容器内气体的密度不再改变B.容器内气体的温度不再改变
C.D.容器内气体的平均摩尔质量不再改变
③向容积均为的三个恒容密闭容器中分别通入和,发生上述反应III,a、b、c三组实验的反应温度分别记为。恒温恒容条件下反应各体系压强的变化如图所示.则平衡常数由大到小的顺序是 ;实验b中,内,分压的平均变化率为 ,该反应的分压平衡常数 (以分压表示,分压=总压×物质的量分数)。
(2)汽车三元催化剂中含有铂()、钯()、铑()等贵金属元素。其中形成的晶体,其晶胞结构如图所示。设为阿伏加德罗常数的值,该晶体的密度为。
①该晶体的配位数为 。
②距离最近的两个原子的核间距为 (列出计算式)。
18.(2023·天津和平·统考三模)研究含有一个碳原子物质的化学称为“一碳”化学。
(1)已知:HCHO(g)+H2(g)=CH3OH(g) ΔH1= - 84kJ·mol-1
CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2= - 49.5 kJ·mol-1
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) ΔH3= kJ·mol-1
(2)工业上合成甲醇的反应: CO(g)+ 2H2(g)CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
①压强P1 P2(填“大于”或“小于”)。
②a点条件下,H2的平衡转化率为 ,该温度下达到平衡后,在容积不变的条件下再充入mol CO和mol CH3OH,平衡 (填“正向” “逆向”或“不”)移动,新平衡时的逆反应速率 (填“大于” “等于”或“小于”)原平衡。
(3)由甲醇制烯烃:主反应(2CH3OHC2H4+2H2O、3CH3OHC3H6+3H2O)、 副反应:2CH3OHCH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是 (填“Cat.1”、或“Cat.2”)。使用Cat。2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是 (结合碰撞理论解释)。
(4)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨相似。则甲胺在水中的电离方程式为 ,常温下,反应CH3NH2·H2O(aq)+H+(aq)CH3NH(aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb= (填数值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)
(2) Ⅰ 时,相同温度下,减小压强,反应Ⅰ中体积分数增大,而反应Ⅱ中体积分数不受压强影响 随着温度升高,压强对平衡的影响减弱;以反应Ⅱ为主,压强对反应Ⅱ的平衡不影响
(3) 是催化剂的活化剂,增大生成甲醇的速率,增大反应Ⅱ的逆反应速率 54.89
(4) 阴离子
【详解】(1)①
②
③
根据盖斯定律,① ②③得反应,则 。
(2)①相同温度下,减小压强,平衡Ⅰ向逆反应方向移动,体积分数增大,故。
②根据图示,时压强对反应的影响大,根据反应Ⅰ、Ⅱ反应前后气体分子数变化特点,压强对反应Ⅰ平衡移动有影响,进而推断出时以反应Ⅰ为主。
③随着温度升高,压强对平衡的影响减弱;压强对反应Ⅱ的平衡没有影响,℃时以反应Ⅱ为主,所以℃时三条曲线几乎相交;
(3)①是催化剂的活化剂,增大生成甲醇的速率,增大反应Ⅱ的逆反应速率,所以b投料方式能显著提高甲醇选择性;
②设起始充入、、的物质的量分别为2mol、1mol、8mol,
,,解得:,。
该反应是反应前后气体分子数不变的反应,可以用物质的量替代分压计算压强平衡常数。。
(4)根据物质转化中元素化合价变化知,甲烷转化为甲醇,碳元素的化合价升高,则a极为阳极,b极为阴极,阴极反应式为,阳极反应式为,阴极产生的需通过交换膜M迁移至阳极参与反应,所以交换膜M为阴离子交换膜。
2.(1)CH3CH2CH3(g)CH3CH=CH2(g)+H2(g) △H=kJ·mol-1
(2)BD
(3) 0.163MPa 该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动
(4) In/Zn的物质的量之比为2,压强为0.3Mpa 压强低于0.3MPa时,压强增大反应③平衡正向移动,丙烯产率增大;压强高于0.3MPa时,压强增大反应①平衡逆向移动丙烯产率减小
(5) a 3CO2+18H++18e-=C3H6+6H2O
【详解】(1)①
②
③
根据盖斯定律,(2×①﹣②﹣③)可得:;
(2)A.单位时间内消耗丙烷的物质的量始终等于生成氢气的物质的量,不能说明正逆反应速率是否相等,不能作为达到平衡状态的标志,故不选A;
B.随着反应的进行,容器的体积逐渐变大,气体质量不变,则密度逐渐减小,密度不变说明反应达到平衡状态,故选B正确;
C.恒温恒压,单位体积内气体的分子数是恒量,单位体积内气体分子数不变,不能说明反应是否达到平衡状态,故不选C;
D.丙烷、丙烯和氢气的总物质的量是变量,水蒸气的物质的量不变,的分压是变量, 的分压不再改变说明反应一定达到平衡状态,故选D;
选BD;
(3)设起始投入的丙烷和水的物质的量均为1mol,丙烷的平衡转化率为0.45,
平衡时水的分压约为0.163 MPa;该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动,所以增大的值可提高丙烷的转化率;
(4)由图象可知,在In/Zn的物质的量之比为2,压强为0.3MPa时,C3H6(g)的选择性、C3H6(g)的产率最大,所以适合的条件是In/Zn的物质的量之比为2,压强为0.3Mpa;压强低于0.3MPa时,压强增大反应③平衡正向移动,丙烯产率增大;压强高于0.3MPa时,压强增大反应①平衡逆向移动丙烯产率减小;
(5)①右侧放出氧气,发生氧化反应,则b为正极,a为负极;
②电解时,二氧化碳在阴极区得到电子,生成丙烯,电极反应式为。
3.(1)
(2)1
(3)蒸发浓缩,降温结晶并过滤
(4)3.73g
(5) e点
【详解】(1)根据题意和生成原理,电极反应为;
(2)反应速率常数越大,速率越快,而慢反应决定反应速率,所以反应1决定与苯酚的反应速率;
(3)氯酸钠溶解度随温度变化较大,氯化钠溶解度随温度变化不大,所以从含有NaCl杂质的溶液中提纯,采用操作为蒸发浓缩,降温结晶并过滤;
(4)71g氯气作氧化剂转移2mol电子,67.5g二氧化氯作氧化剂转移5mol电子,即27g二氧化氯作氧化剂转移2mol电子,所以二氧化氯的“有效氯”数值为,3.55g氯气为0.05mol,作氧化剂转移0.1mol电子,1mol次氯酸钠(74.5g)作氧化剂转移2mol电子,若要转移0.1mol电子,需要0.05mol次氯酸钠,质量约为3.73g;
(5)c点含有酸,抑制水的电离d点pH=7,水的电离不受影响,e点为滴定终点,水解呈碱性,促进水的电离;d点pH=7,,所以;根据,pH=10.84,pOH=14-pH=3.16,,,所以。
4.(1)
(2)
(3) AC
(4) (或0.33) 340 ℃ 反应未达到平衡,380 ℃后,温度升高NiO催化活性降低
【详解】(1)氯酸钠具有氧化性,吸收生成和硫酸钠,根据得失电子守恒配平得,。
(2)根据盖斯定律,由得 。
(3)①A.根据化学反应速率之比等于化学计量数之比可以得到,若,则,可以说明反应达到平衡,A正确;
B.该反应气体总质量不变,容器的体积也不变,所以容器内混合气体密度是定值,不能够判断该反应是否达到平衡,B错误;
C.与的物质的量之比为,与的物质的量之比保持不变说明不变,即各组分含量不再改变,可以说明反应达到平衡,C正确;
D.该反应前后气体总物质的量不变,气体总质量也不变,所以混合气体平均摩尔质量是定值,不能够判断该反应是否达到平衡,D错误。
故选AC。
②,,达到平衡时,则,变形后即可得到。
(4)①设达平衡时,转化的浓度为,列三段式如下:
相同条件下,压强比等于物质的量比,则, mol/L,,平衡常数;
②由题图可以得出340 ℃之后,升高温度转化率提升不大,从成本角度考虑340 ℃为最适宜温度;a点后的转化率减小的原因可能是NiO的催化能力与温度有关,380℃之后,温度升高NiO催化活性降低。
5.(1)减少二氧化硫的排放,防止污染空气
(2) 不利 加快反应速率
(3) 由图象可知,,,温度升高,反应①正向移动,反应②逆向移动
(4) 50% (或13.5)
【详解】(1)气体进入催化剂主转化炉前进行脱硫处理的目的是减少二氧化硫的排放,防止污染空气;
(2)增加流速,会使气体反应不够充分,因此不利于提高转化率;增大压强,会加快反应速率;
(3)①由图象可知,的物质的量分数随温度升高而减小说明,与物质的量分数的差值先增大后减小,说明与是不同方向的,,升高温度,反应向吸热方向移动,随着温度升高,反应①正向移动,反应②逆向移动,都是向生成CO的方向移动,故CO气体物质的量分数增加;
②由图可知,开始时两种反应物1:1混合,设,第一步反应变化量为x,第二步反应变化量为y;反应同时发生,但为了计算方便可假想为有先后,计算过程如下:
水蒸气重整:
水煤气变换:
时,的物质的量和CO的物质的量相等,则由,解得,所以平衡时的物质的量为,的物质的量为,则容器中;
(4)水蒸气重整:
水煤气变换:
平衡时、、CO、、的物质的量分别为,,,,,容器的总压强为,反应达到平衡时,的物质的量分数为60%,的平衡分压,则有,可以得到,,可以得到,联立方程组,解得,则的转化率为,所以反应②的平衡常数。
6.(1)
(2) 低温、高压 加入一定量CO,使反应逆向进行,提高生成的选择性
(3) 16.7%
(4) 5.6
【详解】(1)加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
①
②
③
根据盖斯定律,可知反应③=反应① 反应②,,则反应③的。
(2)加氢生成甲醇的反应是一个反应后气体分子数减少的放热反应,因此,从热力学角度上分析,加氢生成甲醇的反应适宜在低温、高压的条件下进行;在实际生产过程中,通常会在原料气里掺一些CO,从平衡移动角度分析原因:加入一定量CO,使反应逆向进行,提高生成的选择性。
(3)根据图中M点的平衡转化率为50%,得:
所以平衡时的物质的量分数为. 。
(4)根据电荷守恒和质量守恒,阴极的电极反应式为,阳极有关系,若外接电源为铅蓄电池,铅蓄电池正极反应式为,正极质量增加64g转移2mol ,若铅蓄电池正极质量增加32g,则铅蓄电池中转移电子为1mol,生成的物质的量为0.25mol,则标准状况下阳极生成5.6L 。
7.(1)
(2)
(3)⑦
(4) 75% 3240kPa
(5)G
(6)
【详解】(1)由题意知 ,结合图1可知 ,根据盖斯定律得 。
(2)由图2可知反应物为2mol 、2mol NO、0.5mol ,产物为2mol 、3mol ,为催化剂,脱氮过程的总反应的化学方程式为。
(3)由表格可知,反应⑦活化能最大,反应速率最慢,因此其他条件一定时,决定催化还原NO的反应速率的基元反应为⑦。
(4)一定温度下,固定体积的容器中,压强比等于气体物质的量比,即,故平衡时气体总物质的量为3.75mol。设平衡时,转化的物质的量为xmol,列三段式:
可得,解得,的转化率为 【提示:只与温度有关,与反应物的起始量无关】。
(5)该反应是放热反应,相同压强时降低温度,平衡向正反应方向移动,一氧化氮体积分数减小,相同温度时增大压强,一氧化氮体积分数减小,则该反应是气体分子数减小的反应,若在D点对反应容器降温的同时缩小体积,使体系压强增大,重新达到的平衡状态可能是G点。
(6)电流强度为4A时,主要是氧化NO生成硝酸盐,故离子方程式为。
8.(1) <
(2) BCE 升高温度 缩小体积 <
【详解】(1)根据图象可知反应①的热化学方程式为: 或 ;活化能越高,反应速率越小,反应①的活化能比反应②的活化能大,因此可以推测反应①的速率比反应②小;
(2)根据题目信息,可列出三段式:
①根据三段式中信息可知,0~8min内的平均反应速率为;
②A.根据图示和盖斯定律可知,,A正确;
B.缩小体积,各物质浓度增大,正逆反应速率都增大,B错误;
C.催化剂可以改变反应速率,但不能引起平衡移动,故不能提高转化率,C错误;
D.不再变化时,说明各物质浓度不变,反应达平衡状态,D正确;
E.平衡后充入,平衡正向移动,氢气转化率增大,但转化率降低,E错误;
答案选BCE;
③根据方程式可以判断的表达式为;开始时,密闭容器中为和的混合气体,压强为,平衡后密闭容器中存在、、、,根据等量转换可得平衡时的总压为;因此的计算式可列为;
④虚线A相对于原始条件下,反应速率加快,平衡逆向移动,故为升高温度,虚线B相对于原始条件下,反应速率加快,平衡正向移动,故为缩小体积;该反应为放热反应,升高温度平衡逆向移动,值降低,故。
【点睛】本题考查热化学方程式书写、化学反应中的能量变化、平衡移动和平衡常数的计算。
9.(1) 正极 阳离子
(2)
(3)+116.1
(4)BC
(5) c 其他条件不变,增大浓度,CO的平衡转化率增大
(6) 1
【详解】(1)根据装置图,右边电极上得到氧气,氧元素的化合价升高,根据电解工作原理,右边电极为阳极,即b电极为正极,阳极电极反应式为2H2O-4e-=O2↑+4H+,阴极电极反应式为CO2+2e-+2H+=CO+H2O、2H2O+2e-=H2↑+2OH-,阳极产生H+移向阴极,交换膜为阳离子交换膜;故答案为正极;阳离子;
(2)阴极电极反应式为CO2+2e-+2H+=CO+H2O、2H2O+2e-=H2↑+2OH-,生成CO和H2体积比为1∶2,则总反应式为;故答案为;
(3)已知标准摩尔生成焓是由指定单质生成1mol该物质的焓变,所以一个反应的焓变可由生成物的标准摩尔生成焓减去反应物的标准摩尔生成焓得到。,,所以,;故答案为+116.1;
(4)A.代入实验Ⅰ、Ⅱ数据可得n=1,代入实验Ⅱ、Ⅲ数据可得m=2,故A错误;
B.根据实验Ⅰ、Ⅳ数据可得x=0.3,故B正确;
C.其他条件不变,升高温度,反应速率增大,浓度不变,由速率方程知,速率常数增大,故C正确;
D.加入催化剂,速率常数增大,故D错误;
答案为BC;
(5)纵坐标代表甲醇的体积分数,不是反应物转化率。横坐标从左至右,氢气与一氧化碳的投料比增大,可以看作是CO物质的量不变,增大氢气物质的量,增大氢气物质的量,平衡向正反应方向进行,CO的平衡转化率增大,因此CO转化率最大的是c;故答案为c;其他条件不变,增大浓度,CO的平衡转化率增大;
(6)根据图象可知,当温度高于300℃,甲醇体积分数增大,说明该催化剂对甲醇选择性较大;令生成甲醇的物质的量为xmol,生成甲烷的物质的量为ymol,反应①中消耗CO的物质的量为xmol,消耗氢气物质的量为2xmol,反应②中消耗CO的物质的量为ymol,消耗氢气物质的量为3ymol,甲醇的选择性为80%,则,达到平衡时CO物质的量浓度为0.5mol/L,则有,解得x=0.4,y=0.1,平衡时,,,,;故答案为;1。
10.(1)-26
(2) Ⅰ 当时,相同温度下,减小压强,反应Ⅰ中体积分数增大,而反应Ⅱ的平衡不受压强影响 随着温度升高,压强对平衡的影响减弱;以反应Ⅱ为主,压强不影响反应Ⅱ的平衡
(3) 水是催化剂的活化剂,可增大生成甲醇的速率增大Ⅱ反应的逆反应速率(或减小Ⅱ反应的正反应速率),提高甲醇的选择性 54.9
(4) 阴离子交换膜
【详解】(1)根据盖斯定律,得反应Ⅰ的。
(2)①反应Ⅰ为气体分子数减小的反应、Ⅱ为气体分子数不变的反应,相同温度下,减小压强,反应Ⅰ的平衡向逆反应方向移动体积分数增大,反应Ⅱ的平衡不受压强影响,结合图象可知,压强关系为;
当温度较低时,压强对平衡的影响大于温度对平衡的影响,加压时反应Ⅰ的平衡正向移动,体积分数减小,故时,在相同温度下,以反应Ⅰ为主;
②时压强对平衡影响小于温度,此时以反应Ⅱ为主,压强不影响反应Ⅱ的平衡,所以时,三条曲线几乎相连;
③由①分析可知,。
(3)①投料b能显著提高甲醇选择性的原因是水是催化剂的活化剂,可增大生成甲醇的速率增大Ⅱ反应的逆反应速率(或减小Ⅱ反应的正反应速率),提高甲醇的选择性;
②设反应Ⅰ转化的的物质的量为x,反应Ⅱ转化的的物质的量为y,若先发生反应Ⅰ,再发生反应Ⅱ可列出三段式:
在450K下达到平衡状态时,的转化率为50%,则
的选择性为90%,则
解得x=0.9mol、y=0.1mol
该反应是反应前后气体分子数相同的反应,可以用物质的量替代平衡分压来计算平衡常数,则。
(4)根据物质转化中的元素化合价变化可知,甲烷转化为甲醇的过程中,碳的化合价升高,发生氧化反应,故a为阳极,在阳极上生成甲醇;则b为阴极,在阴极上析出氢气,阴极反应式为,阳极反应式为;为了使电解池持续稳定工作,阳极需要补充,故交换膜M为阴离子交换膜,右侧生成的氢氧根离子通过阴离子交换膜进入左侧。
11.(1)
(2) CD b
(3) 反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减少,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降
【详解】(1)由盖斯定律可知,,已知一定条件下反应、,的焓变分别为,、,的焓变,则,故反应的焓变。
(2)①A.由图知,温度升高,上述四个反应的平衡常数都变小,则升温平衡左移,故四个反应均为放热反应,A正确;
B.能量越低越稳定,结合A选项可知,1-MD的能量最低,则反应体系中1-MD最稳定,B正确;
C.生成四氢萘类物质(MTLs,包括1-MTL和5-MTL)、生成十氢茶(1-MD)的反应均为气体分子总数减小的放热反应,则压强越大,温度越低越有利于生成十氢茶(1-MD),C不正确;
D.由图甲可知,500K前,曲线a对应的平衡常数最大,但平衡常数大时反应速率不一定也大,则不能判断曲线a对应的反应速率是否最大,D不正确;
选CD。
②由(1)可知,则,若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,,则表示反应R2的平衡常数随温度变化的曲线为b。
(3)①1-MTL的物质的量随时间呈现先上升后下降的原因为:反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减少,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降;
②若,则的总能量大于的总能量,由图乙可知,的物质的量大于的物质的量,则的生成速率大于的生成速率,生成的活化能小于生成的活化能,故图丙绘制反应R1、R3的“能量~反应过程”示意图为: 。
12.(1) +9.65 ΔH1-ΔH2
(2)bc
(3)a/200t
(4) 1/400 < T1时K1=,T2时K2=,步骤①的△H1>0,升高温度,K增大,故T2>>T1
【详解】(1)步骤①CH4(g)+(g)+Cl2(g)+HCl(g)+Cl2(g),断开H3C-H,生成H-Cl,即吸收4.56eV,放出4.46eV,+4.56-4.46=+0.1ev,即ΔH1=0.1×96.5=9.65kJ·mol-1;步骤②+HCl(g)+Cl2(g)CH3Cl(g)+(g)+HCl(g),由消去中间产物,可得总反应,由图可知,反应物与生成物的相对能量之差为H1-H2,所以H=H1-H2。
(2)a.恒容充入甲烷,甲烷转化率减小,错误;b.设法使CH3Cl液化,平衡正向移动,甲烷转化率增大,正确;c.适当降低温度,平衡正向移动,甲烷转化率增大,正确;d.用更强的光照射反应混合物,可能使甲烷生成副产物,错误;故选bc。
(3)生成乙烷消耗n(CH4)=0.01amol,生成乙烷的物质的量=0.005amol,可得v=a/200tmol·min-1。
(4)当v正=v逆时,1.7×108c(Cl·)·c(CH4)=6.8×1010c(CH3·)·c(HCl),K==1/400。步骤①达平衡时存在物质的量关系:n(Cl·)=450n(·CH3),分压关系:2p(HCl)=3p(CH4),代入K=,步骤①的△H1>0,升高温度,K增大,故T2>>T1。
13.(1)
(2) N>O>C b
(3) sp3 依据“相似相溶原理”,顺式甘氨酸铜为极性分子,反式甘氨酸铜为非极性分子,水为极性溶剂
(4) Fe
【详解】(1)在元素周期表中,三种元素位于同一周期又位于同一族则一定是第Ⅷ族元素,和铁、镍既处于同一周期又位于同一族的元素为钴,27号元素,该元素的基态原子的价电子排布图为 ,
故答案为: ;
(2)第一电离能从左往右第一电离能在增大,其中N元素大于相邻元素,因此第二周期元素第一电离能从大到小的顺序为N>O>C,硝普钠(Na2[Fe(CN)5(NO)·2H2O])是配合物,外界Na+和内界之间存在离子键,NO、CN﹣与Fe3+之间存在配位键,C和N、N和O、H和O之间存在极性共价键,故不存在的化学键为金属键,应选b,故答案为:N>O>C;b;
(3)甘氨酸铜中氮原子均连接的是三个单键,因此杂化类型为sp3,反式甘氨酸铜难溶于水的原因可能是,反式甘氨酸铜为非极性分子,顺式甘氨酸铜为极性分子,根据相似相溶原理,可知反式甘氨酸铜难溶于水,故答案为:sp3;依据“相似相溶原理”,顺式甘氨酸铜为极性分子,反式甘氨酸铜为非极性分子,水为极性溶剂;
(4)由晶胞结构可知坐标为(,1,)的原子是Z原子,即Fe原子;Se原子X与Se原子Y,沿x轴方向的距离为,沿y轴方向的距离为,沿z轴方向的距离为,两点间的距离为;Li原子有8个位于顶点,1个位于体心,个数为:,Fe有8个位于面上,个数为,Se原子8个位于棱上,2个位于体内,个数为:,晶胞的质量为:,晶胞体积为:a2b×10﹣21 cm3,密度,故答案为:Fe;;。
14.(1)
(2)11.1
(3) > 催化剂乙、反应温度 或
【详解】(1)①该流程中所涉及含碳化合物中CO2中碳原子的杂化方式为sp杂化,CH3OH中C原子的杂化方式为sp3杂化,HCHO中C原子的杂化方式为sp2杂化;
②反应I:,反应Ⅱ:,反应Ⅲ:,反应Ⅳ:,由盖斯定律,反应I+Ⅱ+×Ⅲ+×Ⅳ可得反应: ++×+×;
(2)设平衡时物质的量为x,C2H4的为y,列三段式:、,容器体积为1L,达到平衡时,,则4-x-2y=x+4y①,,则6-3x-6y=1.2②,联立①②式解得x=0.8mol、y=0.4mol,则物质的量分数为;
(3)①催化剂不能使平衡发生移动,由图可知M点乙烯的转化率低于同温度下催化剂为乙时乙烯的转化率,说明M点时反应还没有达到平衡状态,还在正向进行,故>;
根据图1所给信息,催化剂为乙的时候乙烯的转化率高,故应选择的反应条件为催化剂乙、反应温度200℃;故答案为:>;催化剂乙、反应温度200℃;
②由化学方程式可知,正速率与乙烯的浓度有关,逆速率与丙烯的浓度有关,故v正的斜率更大一些,由速率公式可得:lgv正=lgk正+3lg c(C2H4),lgv逆=lgk逆+2lgc(C3H6),由图可知当lg c(C2H4)和lgc(C3H6)均为0时,lgv正=a,lgv逆=b,则lgv正=lgk正=a,k正=10a,lgv逆=lgk逆=b,k逆=10b,则T℃时,该反应达到平衡时,v正=v逆,即k正c3(C2H4)=k逆c2(C3H6),则平衡常数K=;
设向容器中充入xmol/L C2H4,平衡后测得,则有三段式:
K=,解得:,则用表示的平均反应速率为v(C3H6)=
故答案为:;。
15.(1)CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol
(2) 加压或选择合适的催化剂 CeO2 增大 高于320°C后,Ni的催化活性显著增强,反应速率加快 ab
(3) 8
【详解】(1)依题意,CO2甲烷化生成气态水的化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(g),则ΔH=(803×2+436×4-414×4-464×4) kJ/mol=-162 kJ/mol,所以CO2甲烷化生成气态水的热化学方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol。
(2)①CO2甲烷化反应为CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol,加压、选择合适的催化剂既能提高三氧化碳甲烷化的反应速率又能提高甲烷产率,升温能加快反应速率,但会降低甲烷的产率,所以采取的措施:加压或选择合适的催化剂。
②从图中可以看出,反应温度在260°C ~320°C之间时,CeO2作催化剂时,CO2的转化率和甲烷选择性远高于Ni作催化剂,所以应选择CeO2为催化剂;图中信息显示,该温度范围内,升高温度CH4的产率增大。
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升,则表明此温度有利于Ni的催化作用,所以原因是:高于320°C后,Ni的催化活性显著增强,反应速率加快。
④若A点表示320°C时的平衡状态,则可建立如下两个三段式:
则容器中CH4的浓度为=ab mol·L-1,二氧化碳甲烷化反应的平衡常数K==(mol·L-1)-2。
(3)在CeO2理想晶胞中,含Ce4+个数为=4,含O2-个数为8。若晶胞边长为a nm,NA为阿佛伽德罗常数的值。从图中可以看出,CeO2理想晶胞中,与面心的Ce4+最近且相等的O2-有4个,则在另一晶胞中,与Ce4+等距离的O2-还有4个,则Ce4+的配位数为8,CeO2晶体的密度为=g·cm-3。
【点睛】计算晶胞中所含微粒数目时,可采用均摊法。
16.(1) 放热 550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率
(2) 200℃ KQ=KM>KN
(3)4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol,
(4)AB
(5) b
【详解】(1)①由表格数据可知,压强一定时,升高温度,氨的平衡含量减小,说明升高温度平衡向逆反应方向移动,该反应为放热反应,故答案为:放热;
②550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率,所以哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,故答案为:550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率;
(2)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,氨气的百分含量降低,所以曲线a对应的温度是200℃,故答案为:200℃;
②合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,由图可知温度的大小关系为Q=M<N,则平衡常数的大小关系为KQ=KM>KN,故答案为:KQ=KM>KN;
(3)将已知反应依次编号为①②,由盖斯定律可知,①—②×2可得反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),则反应ΔH=(—1268kJ/mol) +(—180.5kJ/mol)×2=-907 kJ/mol,反应的热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol,故答案为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol;
(4)A.催化剂a表面有氮氮三键键的断裂和氮氢键的形成,则a表面发生了非极性共价键的断裂和极性共价键的形成,故正确;
B.氮气与氢气反应为游离态的氮元素转化为化合态氮元素的过程,属于氮的固定过程,故正确;
C.在催化剂b表面形成氮氧键时氮元素化合价升高被氧化,反应中有电子转移,故错误;
故选AB;
(5)①由图可知,起始氨气物质的量为0.1 mol 时气体压强为200 kPa,t1时间反应达到平衡时氨气的平衡分压为120 kPa,由物质的量之比等于压强之比可知,平衡时氨气的物质的量为0.1mol×=0.06mol,则0~t1时间内氢气的反应速率为 = mol/(L·min),故答案为:;
②t2时将容器体积迅速缩小至原来的一半并保持不变,容器中气体压强增大,氮气分压瞬间增大,该反应是气体体积增大的反应,平衡向逆反应方向移动,氮气分压减小,则将容器体积迅速缩小至原来的一半并保持不变时,氮气的分压先增大后又减小,所以能正确表示压缩后氮气分压变化趋势的曲线是b,故选b。
17.(1) -749 低温 BD Ka=Kb>Kc 2
(2) 12
【详解】(1)①由盖斯定律可知,2×II- I即可得到==-749,该反应是气体体积减小的反应,,当时,反应能自发进行,则该反应在低温下能够自发进行;
②A.该反应过程中气体总质量和总体积都不变,气体密度是定值,当容器内气体的密度不再改变时,不能说明反应达到平衡,故A不选;
B.该反应是放热反应,在绝热恒容密闭容器进行,温度一直上升,当容器内气体的温度不再改变时,能说明反应达到平衡,故B选;
C.时,不能说明正逆反应速率相等,不能说明反应达到平衡,故C不选;
D.该反应过程中气体总质量不变,总物质的量减小,则容器内气体的平均摩尔质量增大,当容器内气体的平均摩尔质量不变时,说明反应达到平衡,故D选;
故选BD;
③恒温恒容条件发生发应Ⅲ,气体的压强之比等于气体的物质的量之比,随着反应的进行,各容器内压强:pa=pbc,则平衡常数:Ka=Kb>Kc;实验b中,反应IⅢ 中,0-20min内,体系压强从160 kPa减少到140kPa,减小的压强为生成氮气的分压,即△p(N2)=20kPa,所以转化的CO的分压△p(CO)=2△p(N2)=40kPa,起始总压为160kPa,CO和NO的物质的量之比为1:1,即CO的起始分压为80kPa,所以CO分压的平均变化率为=2,列出三段式如下:
。
(2)①由晶胞结构可知,形成的晶体是面心立方堆积,该晶体的配位数为12;
②原子的个数为8=4,该晶胞的质量为g,体积V=,晶胞的边长a=,两个原子的核间距为晶胞体对角线长的,为=
18.(1)+34.5
(2) 小于 66.7% 正向 大于
(3) Cat.1 该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat。2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低。)
(4) CH3NH2·H2OCH3NH(aq)+OH- 2.5×10-10
【详解】(1)已知反应:HCHO(g)+H2(g)=CH3OH(g)ΔH1=-84kJ mol-1① CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=-49.5kJ mol-1②由盖斯定律②-①得CO2(g)+2H2(g)=HCHO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-49.5kJ mol-1)-(-84kJ mol-1)=+34.5kJ mol-1,故答案为:+34.5;
(2)①由图可知在相同温度时,压强P1下平衡时H2的体积分数大,平衡逆向移动,根据勒夏特列原理减小压强化学平衡向计量数之和小的方向移动,故P1小于P2,故答案为:小于;
②,由图可知×100%=40% 解得x≈0.667,H2的平衡转化率=×100%=66.7%,令容器的体积为VL,该温度下K=≈4.5V2,该温度下达到平衡后,在容积不变的条件下再充入molCO和molCH3OH,此时Qc=≈3.4V2,即Qc小于K,故在容积不变的条件下再充入molCO和molCH3OH时,反应正向进行,在容积不变的条件下再充入molCO和molCH3OH时,物质的量浓度增大,化学反应速率增大,故新平衡时的逆反应速率大于原平衡故答案为:66.7%;正向;大于;
(3)由图可知催化剂Cat.1对应的乙烯和丙烯的选择性更高,故结果较好的是Cat.1,该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat.2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低。),故答案为:Cat.1;该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat.2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低);
(4)甲胺与氨相似,则甲胺在水中的电离方程式为:CH3NH2 H2O(aq)+OH-,反应CH3NH2 H2O(aq)+OH-的平衡常数表达式K=,CH3NH2 H2O(aq)+OH-的电离平衡常数Kb=
==Kw=Kw K=1.0×10-14×2.5×104=2.5×10-10,故答案为:CH3NH2 H2O(aq)+OH-; 2.5×10-10。
答案第1页,共2页
答案第1页,共2页
1.(2022·河北·模拟预测)我国科学家首次实现甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ:
反应Ⅱ:
(1)已知:①
②
③
上述反应Ⅰ的 。
(2)在密闭容器中投入2mol和1mol发生反应Ⅰ、Ⅱ,保持起始投料量不变,在不同温度、压强下做平行实验,测得的平衡体积分数与温度、压强的关系如图所示。
①a、b、c由大到小排序为 。
②由图可知,当时,以反应 (填“Ⅰ”或“Ⅱ”)为主,理由是 。
③℃时,三条曲线几乎相交的原因可能是 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)、的体积比为2:1以及(b)、、[的作用是活化催化剂]的体积比为2:1:8充入并发生反应Ⅰ、Ⅱ,相同的时间内(都加入相同催化剂),测得产物的选择性[如甲醇的选择性]如表所示。
投料方式 a b
的选择性/% 90 15
的选择性/% 10 85
①b投料方式能显著提高甲醇选择性的原因是 。
②向上述刚性密闭容器中按照体积比2:1:8充入、和,在450K下反应达到平衡时,的转化率为50%,的选择性为90%,则反应Ⅱ的压强平衡常数 。(计算结果保留2位小数)
(4)我国科学家研发出新型催化剂,利用电催化法实现将甲烷转化成甲醇,装置如图所示。
交换膜M是 (填“阳离子”或“阴离子”)交换膜。阳极的电极反应式为 。
2.(2022·全国·模拟预测)丙烯是重要的化工原料,目前生产丙烯主要有丙烷脱氢、丙烷与二氧化碳耦合、电解等技术。
方法一:丙烷直接脱氢法制丙烯
已知:CH3CH2CH3(g)+5O2(g)=3CO2(g)+4H2O(1) △H=akJ·mol-1
2CH3CH=CH2(g)+9O2(g)=6CO2(g)+6H2O(1) △H=bkJ·mol-1
2H2(g)+O2(g)=H2O(1) △H=ckJ·mol-1
(1)写出丙烷脱氢生成丙烯和氢气的热化学方程式: 。
(2)600℃、0.4MPa下,向装有催化剂的恒压密闭容器中,以=1投料,发生丙烷脱氢生成丙烯的反应,丙烷的转化率(α)随时间(t)变化的曲线如图所示:
则该体系达到平衡状态的标志为 (填选项字母)。
A.单位时间内消耗C3H8(g)的物质的量等于生成H2(g)的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D.H2O(g)的分压不再改变
(3)平衡时水的分压约为 ,增大的值可提高丙烷的转化率,解释其原因: 。
方法二:丙烷与二氧化碳耦合法制丙烯
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
①C3H8(g)C3H6(g)+H2(g)
②C3H8(g)C2H4(g)+CH4(g)
③3CO2(g)+9H2(g) C3H6(g)+6H2O(g)
④CO2(g)+H2(g)CO(g)+H2O(g)
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图甲和图乙所示:
已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为 ,随压强增大C3H6的平衡产率先增大后减小的原因为 。
方法三:电解法制丙烯
(5)在酸性电解质溶液中,以惰性材料作电极,将转化为丙烯的原理如图所示:
①太阳能电池的负极是 (填“a”或“b”);
②生成丙烯的电极反应式是 。
3.(2022·全国·模拟预测)常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂,可采用催化电解酸性食盐水的方法制备,装置如图甲。
(1)产生的电极反应为 。
(2)消除苯酚等酚类物质污染的反应机理:
反应1:+ClO2→+速率常数为
反应2:+ClO2→速率常数为
已知反应速率常数:,则决定与苯酚反应速率的步骤为反应 (填“1”或“2”)。
(3)在电解食盐水时控制一定条件,会得到氯酸钠()和氯化钠的混合液,已知二者溶解度曲线如图乙所示,则从二者混合液中提纯的方法为 。
(4)商业上常用“有效氯”来说明含氯消毒剂的消毒能力,“有效氯”是指一定质量的消毒剂与多少质量的氯气氧化能力相当,其数值可用此时氯气的质量与消毒剂质量的百分比来表示,则的“有效氯”数值约为,某100g“84”消毒液与3.55g氯气氧化能力相当,则该消毒液中含NaClO g(精确到小数点后两位)。
(5)25℃时配制0.1mol/L的氯水100mL(假设完全溶解),用0.2mol/L的NaOH标准溶液进行滴定,滴定过程中溶液pH变化如图丙,则c、d、e三点所表示的溶液中水的电离程度最大的是 ,d点溶液中的物料守恒为 ,滴定终点时消耗NaOH标准溶液100mL,此时pH=10.84,则该温度下的水解平衡常数约为 (已知)。
4.(2022·河北·模拟预测)“绿水青山就是金山银山”。研究含硫化合物的性质在工业生产和环境保护中有重要意义。回答下列问题:
(1)是重要的工业原料,工业上可通过氯酸钠溶液直接吸收制备,该反应的离子方程式可表示为 。
(2)燃气中的可先通过浓NaOH溶液吸收,再将从溶液中提取出来,实现的回收与利用。
已知:①
②
则常温下NaOH溶液与反应生成溶液的热化学方程式为 。
(3)0.4 mol 与0.1 mol 在 610 K时发生反应: ,反应制得的基硫(COS)可用于合成除草剂。
①下列选项中能作为判断密闭容器中反应达到化学平衡状态的标志的是 (填字母)。
A. B.混合气体密度不再变化
C.与的物质的量之比保持不变 D.混合气体平均摩尔质量不再变化
②实验测得上述反应的速率方程为:,,、分别为正、逆反应速率常数,则该反应的平衡常数K与、之间的关系是 。
(4)工业尾气中的可通过如下反应处理并回收硫: 。
①T ℃时,若在2 L的密闭容器中充入4 mol 和4 mol 发生上述反应,50 min后反应达平衡,此时容器内压强为开始时的1.25倍,则用表示反应的速率 ;反应平衡常数 。
②分别选取、NiO作催化剂,反应相同时间内的转化率随反应温度的变化如图所示,选择作催化剂,最适宜温度大约为 ;a点后的转化率降低的原因可能是 。
5.(2022·全国·模拟预测)在现有的制氢技术中,广泛使用的是甲烷水蒸气重整制氢技术,该技术已广泛用于工业生产,并已获得其成熟工艺流程和催化剂制备工艺。其中包含的主要反应有
①
②
回答下列问题:
(1)原料气反应前要进行脱硫处理才能进入催化剂主转化炉,这样做的目的是 。
(2)增加入口气体流速对于提高转化率 (填“有利”或“不利”),实际生产中,往往选取2 3MPa这种相对较高的压强,试分析原因: 。
(3)不同温度下反应达到平衡时各物质的物质的量分数如图所示:
①CO气体物质的量分数随温度升高而增加的原因是 ;
②℃时,容器中 。
(4)900℃下,向恒压密闭容器中充入1mol和1mol,容器的总压强为1MPa,反应达到平衡时,的平衡分压为0.1MPa,的物质的量分数为0.6,则的转化率为 ,计算900℃时反应②的平衡常数 (已知气体分压=总压×气体的物质的量分数)。
6.(2023·湖南娄底·高三双峰县第一中学校考阶段练习)甲醇是重要的化工原料,也是重要的能源物质,可发展替代传统化石燃料。开发加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:
(1)加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
①
②
③
则反应③的 。
(2)加氢生成甲醇适宜在 (填“低温”“高温”“高压”“低压”,可多选)条件下进行,在实际生产过程中,通常会在原料气里掺一些CO,请从平衡移动角度分析原因: 。
(3)在一恒温、容积可变的密闭容器中,充入1mol 与3mol 发生反应: ,在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时的物质的量分数为 ,该反应的压强平衡常数为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)也可以通过电化学方法转化为,装置如图2所示。阴极的电极反应式为 ,若外接电源为铅蓄电池,铅蓄电池正极质量增加32g时,则标准状况下阳极生成 L 。
7.(2022·河北·模拟预测)氮氧化物的处理对建设生态文明具有重要意义,如何消除氮氧化物的污染成为当前研究的主要课题之一、回答下列问题:
(1)已知:①碳的燃烧热为;② 。结合图1,写出一氧化氮分解生成两种无污染气体的热化学方程式 。
(2)还原法。研究发现反应过程如图2,此反应过程中的催化剂为 ,写出脱氮过程的总反应的化学方程式 。
(3)还原法。已知催化剂Rh表面催化还原NO的反应机理如表,其他条件一定时,决定催化还原NO的反应速率的基元反应为 (填序号)。
序号 基元反应 活化能
① 12.6
② 0.0
③ 97.5
④ 83.7
⑤ 33.5
⑥ 45.0
⑦ 120.9
⑧ 37.7
⑨ 77.8
⑩ 108.9
(4)还原法。利用甲烷可实现氮氧化物的消除,反应原理为 。一定温度下,在2.0L刚性密闭容器中通入1mol 和2mol ,测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
反应时间t/min 0 2 4 6 8 10
总压强p/(100kPa) 4.80 5.44 5.76 5.92 6.00 6.00
达到平衡时,的转化率为 。若起始时加入2mol 和2mol ,则该温度下的压强平衡常数 (以分压表示,分压=总压×物质的量分数)。
(5)CO还原法。汽车尾气(CO、NO)可转化为无毒、无害物质。在密闭容器中充入10mol CO和8mol NO发生反应(),如图3为平衡时NO的体积分数与温度、压强的关系。若在D点对反应容器降温的同时缩小体积,使体系压强增大,重新达到的平衡状态可能是图3中A~G点中的 点。
(6)电解氧化吸收法。将废气中的转变为硝态氮。电解 NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图4。电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO的主要反应的离子方程式为 。
8.(2022·全国·模拟预测)碳中和问题已成为国际研究热点,回收利用已成为科学家研究的热点课题。
I.如图为与转化为和的反应的能量变化过程:
(1)反应①的热化学方程式为 ;可以推测反应①速率 (填“>”“=”或“<”)反应②速率。
II.如图为金属钌作催化剂,将转化为的过程:
(2)将6mol和8mol充入一体积为2L的密闭容器中(温度保持不变),测得压强为70MPa;测得的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。
①该反应在内的平均反应速率为 ;
②下列说法不正确的是 (填字母);
A.催化过程中
B.若缩小体积,正反应速率加快,逆反应速率降低,平衡正向移动
C.金属钌可大大提高该反应中反应物的转化率
D.当不再变化时,反应达平衡状态
E.平衡后再次充入,平衡正向移动,的转化率升高
③该反应的平衡常数表达式为 (以分压表示,分压=总压×物质的量分数);可计算该条件下的为 ;
④图中虚线A、B为改变某一条件情况,与实线相比,虚线A改变的条件可能是 ,虚线B改变的条件可能是 ;虚线A对应条件下平衡常数为,虚线B对应条件下平衡常数为,则、的大小关系是 。
9.(2022·河北·模拟预测)2021年11月,《自然》杂志报道:科学家设计了一种用阳光和空气生产燃料的实验系统,其分三步:第一步,利用直接空气捕获装置收集空气中的和;第二步,在太阳能作用下运用氧化还原装置将和转化成合成气(CO、);第三步,利用合成气合成烃和甲醇。回答下列问题:
Ⅰ.模拟制备合成气,装置如图1所示。
(1)光伏电池中b极是 (填“正极”或“负极”)。交换膜类型是 (填“阳离子”或“阴离子”)交换膜。
(2)如果制备的合成气中CO、的体积比为1:2(同温同压),则产生合成气的电极的总反应式为 。
Ⅱ.利用合成气合成甲醇、甲烷等。已知:
反应①
反应②
(3)在热力学标态下由指定单质(大多是稳定单质)生成1mol物质的反应焓变,称为该物质的标准摩尔生成焓()。相关物质的标准摩尔生成焓数据如表所示。
物质 CO(g)
() 0 -75 -110.5 -200.7 -241.8
上述反应中, 。
(4)在某催化剂作用下,反应的速率方程为(k为速率常数,与温度、催化剂有关,与浓度无关)。在某温度、该催化剂作用下,仅发生反应②,测得反应速率与CO、的浓度关系如表所示。
实验 反应速率
Ⅰ 0.1 0.1 v
Ⅱ 0.2 0.1 2v
Ⅲ 0.2 0.2 8v
Ⅳ 0.4 x 36v
下列推断正确的是_______(填字母)。
A., B.
C.其他条件不变,升高温度,k增大 D.其他条件不变,加入催化剂,k减小
(5)在一定温度下,向某恒容密闭容器中充入CO和,仅发生反应①,测得平衡体系中的体积分数与投料比[]的关系如图2所示。
在a、b、c三点中,CO的转化率最大的是 点,判断依据是 。
(6)在1L刚性密闭容器中充入1molCO和2mol,在某催化剂作用下发生反应①和反应②,测得产物甲醇、甲烷的体积分数与温度的关系如图3所示。
当温度高于300℃时,该催化剂选择性较大的产物是 (填化学式)。已知T℃时,达到平衡时的选择性为80%,,则该温度下反应①的平衡常数 (结果取整数)。
10.(2022·全国·模拟预测)我国科学家首次实现利用甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ:
反应Ⅱ:
(1)已知:①
②
③
上述反应Ⅰ中的 。
(2)在密闭容器中投入2mol和1mol,起始投料量不变,在不同温度、压强下做平行实验,测得的平衡体积分数与温度、压强的关系如图所示:
①由图可知,当时,以反应 (填“Ⅰ”或“Ⅱ”)为主,理由是 ;
②时,三条曲线几乎相连的原因可能是 ;
③a、b、c由大到小排序为 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)、的体积比为2:1以及(b)、、(的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=]如表所示:
投料方式 a b
的选择性/% 90 15
的选择性/% 10 85
①投料b能显著提高甲醇选择性的原因是 。
②向上述刚性密闭容器中按照体积比2:1:8充入、和,在450K下达到平衡状态时,的转化率为50%,的选择性为90%,则副反应的压强平衡常数 (计算结果保留1位小数)。
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:
交换膜M的名称是 ;阳极的电极反应式为 。
11.(2023·浙江宁波·镇海中学校考模拟预测)利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢茶(1-MD)的副反应,涉及反应如图:
(1)已知一定条件下反应、,的焓变分别为,、,则反应的焓变 (用含、、的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
①下列说法不正确的是
A.上述四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成MTLs
D.由图甲可知,500K前,曲线a对应的反应速率最大
②若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,则表示反应R2的平衡常数随温度变化的曲线为 。
(3)某温度下,将一定量的1-MN投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
①请解释1-MTL的物质的量随时间呈现先上升后下降的原因 ;
②若,请在图丙绘制反应R1、R3的“能量~反应过程”示意图 。
12.(2023·四川成都·统考三模)在光照或加热条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g)CH3Cl(g)+HCl(g)ΔH.该反应涉及两个基元步骤①②,其相对能量—反应进程图如下所示:
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ·mol-1。则步骤①的焓变ΔH1= kJ/mol;一氯取代反应总焓变ΔH= (用ΔH1、ΔH2表示)。
(2)不考虑其他副反应,下列可增大甲烷的平衡转化率的措施有 (填字母序号)。
a.恒容充入甲烷 b.设法使CH3Cl液化
c.适当降低温度 d.用更强的光照射反应混合物。
(3)450℃时,tmin内甲烷与Cl2发生取代反应,共消耗amol甲烷得到各种产物如下:
产物 CH3Cl CH2Cl2 CHCl3 CCl4 CH3CH3
反应选择性= 87% 7% 4% 1% 1%
则生成乙烷的平均速率v(CH3CH3)= mol·min-1。
(4)温度为T1时,步骤①的v正=1.7×108c(Cl·)·c(CH4),v逆=6.8×1010c(CH3·)·c(HCl),T1时步骤①的平衡常数K= ;T2时,步骤①达平衡时存在物质的量关系:n(Cl·)=450n(·CH3),分压关系:2p(HCl)=3p(CH4),由此判断温度T1 T2(填“>”或“<”),判断理由是 。
13.(2023·四川内江·统考三模)铁、镍、铜在医药、催化及材料等领域中都有广泛的应用。回答下列问题:
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为 (填轨道表示式)。
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为 。
②不存在的化学键有 (填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
①甘氨酸铜中氮原子的杂化类型为 。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是 。
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1,),Y的坐标为(,,),设NA为阿伏加德罗常数的值。坐标为(,1,)的是 原子,Se原子X与Se原子Y之间的距离为 nm,该晶体的密度为 g·cm-3。
14.(2023·河北衡水·河北衡水中学校考模拟预测)中国科学院宣布在入工合成淀粉方面取得突破性进展,在国际上首次实现二氧化碳到淀粉的全合成,该技术未来有望促进碳中和的生物经济发展。
(1)入工合成转化为淀粉只需要11步,其中前两步涉及的反应如图1所示。
①该流程中所涉及含碳化合物中碳原子的杂化方式有 。
②反应: 。
(2)反应Ⅰ进行时,同时发生反应:。在恒容密闭容器中充入和,一定温度下,达到平衡时,物质的量分数为 %(计算结果保留1位小数)。
(3)乙烯是合成工业的重要原料,一定条件下可发生反应:。
①分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得体积分数与温度的关系如图2所示。
在催化剂甲作用下,图2中点的速率 (填“>”“<”或“=”),根据图中所给信息,应选择的反应条件为 。
(2)一定温度下,该反应正逆反应速率与的浓度关系:,(是速率常数),且或的关系如图3所示,向恒容密闭容器中充入一定量,反应进行分钟后达平衡,测得,该温度下,平衡常数 (用含的计算式表示,下同),用表示的平均反应速率为 mol·L-1·min-1。
15.(2023·云南昆明·统考二模)CO2的有效转化有助于我国实现2060年“碳中和”目标。将CO2和H2在催化剂作用下,可实现二氧化碳甲烷化。已知:
键能 C=O H-H C-H H-O
kJ·mol-1 803 436 414 464
(1)写出CO2甲烷化生成气态水的热化学方程式 。
(2)二氧化碳甲烷化反应体系中,存在副反应:CO2(g)+ H2(g)= CO(g)+H2O(g) ΔH>0。向1L恒容密闭容器中通入1 mol CO2和5 mol H2,测得相同反应时间内,不同催化剂作用下温度对CO2转化率和CH4选择性的影响如图所示。
CH4选择性=
①写出一种既能提高三氧化碳甲烷化的反应速率又能提高甲烷产率的措施 。
②反应温度在260°C ~320°C之间时,应选择 为催化剂,该温度范围内,升高温度CH4的产率 (填“增大”“减小”或“不变”)。
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升的原因是 。
④若A点表示320°C时的平衡状态,则容器中CH4的浓度为 mol·L-1,二氧化碳甲烷化反应的平衡常数K= (mol·L-1)-2(用含a、b的表达式表示)。
(3)CeO2理想晶胞如图所示。若晶胞边长为a nm, NA为阿佛伽德罗常数的值。CeO2理想晶胞中Ce4+的配位数为 ,CeO2晶体的密度为 g·cm-3。
16.(2023·天津河西·天津市新华中学校考二模)氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
I.完成下列问题。
(1)在一定条件下氨的平衡含量如表。
温度/℃ 压强/ 氨的平衡含量
200 10 81.5%
550 10 8.25%
①该反应为 (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、,而非200℃、,主要的原因是 。
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中的物质的量分数的变化情况。
曲线a对应的温度是 。
②M、N、Q点平衡常数K的大小关系是 。
II.转化为是工业制取硝酸的重要一步,已知:、298K时:
(3)请写出转化为的热化学方程式 。
(4)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是 。
A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.与反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(5)某兴趣小组对反应进行了实验探究。在一定温度和催化剂的条件下,将通入3L的密闭容器中进行反应(此时容器内总压为),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,时反应达到平衡,用的浓度变化表示时间内的反应速率 (用含的代数式表示);
②时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后分压变化趋势的曲线是 (用图中a、b、c、d表示)。
17.(2023·吉林长春·统考模拟预测)氮和碳及其化合物在工农业生产、环境等方面有重要应用和影响。
回答下列问题:
(1)燃料在汽车发动机中燃烧时会产生污染环境的,加装三元催化转化器可使汽车尾气中的转化为无毒物质。
已知:I.
II.
III.
①反应III对应的 ,该反应能自发进行的条件是在 (填“低温”、“高温”或“任意温度”)下。
②向某绝热恒容密闭容器内充入一定量的和,发生反应III。下列能说明该反应达到平衡状态的是 (填标号)。
A.容器内气体的密度不再改变B.容器内气体的温度不再改变
C.D.容器内气体的平均摩尔质量不再改变
③向容积均为的三个恒容密闭容器中分别通入和,发生上述反应III,a、b、c三组实验的反应温度分别记为。恒温恒容条件下反应各体系压强的变化如图所示.则平衡常数由大到小的顺序是 ;实验b中,内,分压的平均变化率为 ,该反应的分压平衡常数 (以分压表示,分压=总压×物质的量分数)。
(2)汽车三元催化剂中含有铂()、钯()、铑()等贵金属元素。其中形成的晶体,其晶胞结构如图所示。设为阿伏加德罗常数的值,该晶体的密度为。
①该晶体的配位数为 。
②距离最近的两个原子的核间距为 (列出计算式)。
18.(2023·天津和平·统考三模)研究含有一个碳原子物质的化学称为“一碳”化学。
(1)已知:HCHO(g)+H2(g)=CH3OH(g) ΔH1= - 84kJ·mol-1
CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2= - 49.5 kJ·mol-1
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) ΔH3= kJ·mol-1
(2)工业上合成甲醇的反应: CO(g)+ 2H2(g)CH3OH(g) ΔH4,在一个密闭容器中,充入lmolCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图1所示。
①压强P1 P2(填“大于”或“小于”)。
②a点条件下,H2的平衡转化率为 ,该温度下达到平衡后,在容积不变的条件下再充入mol CO和mol CH3OH,平衡 (填“正向” “逆向”或“不”)移动,新平衡时的逆反应速率 (填“大于” “等于”或“小于”)原平衡。
(3)由甲醇制烯烃:主反应(2CH3OHC2H4+2H2O、3CH3OHC3H6+3H2O)、 副反应:2CH3OHCH3OCH3+H2O。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到有关实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比) 如图2所示。结果较好的是 (填“Cat.1”、或“Cat.2”)。使用Cat。2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是 (结合碰撞理论解释)。
(4)工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨相似。则甲胺在水中的电离方程式为 ,常温下,反应CH3NH2·H2O(aq)+H+(aq)CH3NH(aq)+ H2O(1)的平衡常数K=2.5×104,该温度下,甲胺的电离常数Kb= (填数值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)
(2) Ⅰ 时,相同温度下,减小压强,反应Ⅰ中体积分数增大,而反应Ⅱ中体积分数不受压强影响 随着温度升高,压强对平衡的影响减弱;以反应Ⅱ为主,压强对反应Ⅱ的平衡不影响
(3) 是催化剂的活化剂,增大生成甲醇的速率,增大反应Ⅱ的逆反应速率 54.89
(4) 阴离子
【详解】(1)①
②
③
根据盖斯定律,① ②③得反应,则 。
(2)①相同温度下,减小压强,平衡Ⅰ向逆反应方向移动,体积分数增大,故。
②根据图示,时压强对反应的影响大,根据反应Ⅰ、Ⅱ反应前后气体分子数变化特点,压强对反应Ⅰ平衡移动有影响,进而推断出时以反应Ⅰ为主。
③随着温度升高,压强对平衡的影响减弱;压强对反应Ⅱ的平衡没有影响,℃时以反应Ⅱ为主,所以℃时三条曲线几乎相交;
(3)①是催化剂的活化剂,增大生成甲醇的速率,增大反应Ⅱ的逆反应速率,所以b投料方式能显著提高甲醇选择性;
②设起始充入、、的物质的量分别为2mol、1mol、8mol,
,,解得:,。
该反应是反应前后气体分子数不变的反应,可以用物质的量替代分压计算压强平衡常数。。
(4)根据物质转化中元素化合价变化知,甲烷转化为甲醇,碳元素的化合价升高,则a极为阳极,b极为阴极,阴极反应式为,阳极反应式为,阴极产生的需通过交换膜M迁移至阳极参与反应,所以交换膜M为阴离子交换膜。
2.(1)CH3CH2CH3(g)CH3CH=CH2(g)+H2(g) △H=kJ·mol-1
(2)BD
(3) 0.163MPa 该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动
(4) In/Zn的物质的量之比为2,压强为0.3Mpa 压强低于0.3MPa时,压强增大反应③平衡正向移动,丙烯产率增大;压强高于0.3MPa时,压强增大反应①平衡逆向移动丙烯产率减小
(5) a 3CO2+18H++18e-=C3H6+6H2O
【详解】(1)①
②
③
根据盖斯定律,(2×①﹣②﹣③)可得:;
(2)A.单位时间内消耗丙烷的物质的量始终等于生成氢气的物质的量,不能说明正逆反应速率是否相等,不能作为达到平衡状态的标志,故不选A;
B.随着反应的进行,容器的体积逐渐变大,气体质量不变,则密度逐渐减小,密度不变说明反应达到平衡状态,故选B正确;
C.恒温恒压,单位体积内气体的分子数是恒量,单位体积内气体分子数不变,不能说明反应是否达到平衡状态,故不选C;
D.丙烷、丙烯和氢气的总物质的量是变量,水蒸气的物质的量不变,的分压是变量, 的分压不再改变说明反应一定达到平衡状态,故选D;
选BD;
(3)设起始投入的丙烷和水的物质的量均为1mol,丙烷的平衡转化率为0.45,
平衡时水的分压约为0.163 MPa;该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动,所以增大的值可提高丙烷的转化率;
(4)由图象可知,在In/Zn的物质的量之比为2,压强为0.3MPa时,C3H6(g)的选择性、C3H6(g)的产率最大,所以适合的条件是In/Zn的物质的量之比为2,压强为0.3Mpa;压强低于0.3MPa时,压强增大反应③平衡正向移动,丙烯产率增大;压强高于0.3MPa时,压强增大反应①平衡逆向移动丙烯产率减小;
(5)①右侧放出氧气,发生氧化反应,则b为正极,a为负极;
②电解时,二氧化碳在阴极区得到电子,生成丙烯,电极反应式为。
3.(1)
(2)1
(3)蒸发浓缩,降温结晶并过滤
(4)3.73g
(5) e点
【详解】(1)根据题意和生成原理,电极反应为;
(2)反应速率常数越大,速率越快,而慢反应决定反应速率,所以反应1决定与苯酚的反应速率;
(3)氯酸钠溶解度随温度变化较大,氯化钠溶解度随温度变化不大,所以从含有NaCl杂质的溶液中提纯,采用操作为蒸发浓缩,降温结晶并过滤;
(4)71g氯气作氧化剂转移2mol电子,67.5g二氧化氯作氧化剂转移5mol电子,即27g二氧化氯作氧化剂转移2mol电子,所以二氧化氯的“有效氯”数值为,3.55g氯气为0.05mol,作氧化剂转移0.1mol电子,1mol次氯酸钠(74.5g)作氧化剂转移2mol电子,若要转移0.1mol电子,需要0.05mol次氯酸钠,质量约为3.73g;
(5)c点含有酸,抑制水的电离d点pH=7,水的电离不受影响,e点为滴定终点,水解呈碱性,促进水的电离;d点pH=7,,所以;根据,pH=10.84,pOH=14-pH=3.16,,,所以。
4.(1)
(2)
(3) AC
(4) (或0.33) 340 ℃ 反应未达到平衡,380 ℃后,温度升高NiO催化活性降低
【详解】(1)氯酸钠具有氧化性,吸收生成和硫酸钠,根据得失电子守恒配平得,。
(2)根据盖斯定律,由得 。
(3)①A.根据化学反应速率之比等于化学计量数之比可以得到,若,则,可以说明反应达到平衡,A正确;
B.该反应气体总质量不变,容器的体积也不变,所以容器内混合气体密度是定值,不能够判断该反应是否达到平衡,B错误;
C.与的物质的量之比为,与的物质的量之比保持不变说明不变,即各组分含量不再改变,可以说明反应达到平衡,C正确;
D.该反应前后气体总物质的量不变,气体总质量也不变,所以混合气体平均摩尔质量是定值,不能够判断该反应是否达到平衡,D错误。
故选AC。
②,,达到平衡时,则,变形后即可得到。
(4)①设达平衡时,转化的浓度为,列三段式如下:
相同条件下,压强比等于物质的量比,则, mol/L,,平衡常数;
②由题图可以得出340 ℃之后,升高温度转化率提升不大,从成本角度考虑340 ℃为最适宜温度;a点后的转化率减小的原因可能是NiO的催化能力与温度有关,380℃之后,温度升高NiO催化活性降低。
5.(1)减少二氧化硫的排放,防止污染空气
(2) 不利 加快反应速率
(3) 由图象可知,,,温度升高,反应①正向移动,反应②逆向移动
(4) 50% (或13.5)
【详解】(1)气体进入催化剂主转化炉前进行脱硫处理的目的是减少二氧化硫的排放,防止污染空气;
(2)增加流速,会使气体反应不够充分,因此不利于提高转化率;增大压强,会加快反应速率;
(3)①由图象可知,的物质的量分数随温度升高而减小说明,与物质的量分数的差值先增大后减小,说明与是不同方向的,,升高温度,反应向吸热方向移动,随着温度升高,反应①正向移动,反应②逆向移动,都是向生成CO的方向移动,故CO气体物质的量分数增加;
②由图可知,开始时两种反应物1:1混合,设,第一步反应变化量为x,第二步反应变化量为y;反应同时发生,但为了计算方便可假想为有先后,计算过程如下:
水蒸气重整:
水煤气变换:
时,的物质的量和CO的物质的量相等,则由,解得,所以平衡时的物质的量为,的物质的量为,则容器中;
(4)水蒸气重整:
水煤气变换:
平衡时、、CO、、的物质的量分别为,,,,,容器的总压强为,反应达到平衡时,的物质的量分数为60%,的平衡分压,则有,可以得到,,可以得到,联立方程组,解得,则的转化率为,所以反应②的平衡常数。
6.(1)
(2) 低温、高压 加入一定量CO,使反应逆向进行,提高生成的选择性
(3) 16.7%
(4) 5.6
【详解】(1)加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
①
②
③
根据盖斯定律,可知反应③=反应① 反应②,,则反应③的。
(2)加氢生成甲醇的反应是一个反应后气体分子数减少的放热反应,因此,从热力学角度上分析,加氢生成甲醇的反应适宜在低温、高压的条件下进行;在实际生产过程中,通常会在原料气里掺一些CO,从平衡移动角度分析原因:加入一定量CO,使反应逆向进行,提高生成的选择性。
(3)根据图中M点的平衡转化率为50%,得:
所以平衡时的物质的量分数为. 。
(4)根据电荷守恒和质量守恒,阴极的电极反应式为,阳极有关系,若外接电源为铅蓄电池,铅蓄电池正极反应式为,正极质量增加64g转移2mol ,若铅蓄电池正极质量增加32g,则铅蓄电池中转移电子为1mol,生成的物质的量为0.25mol,则标准状况下阳极生成5.6L 。
7.(1)
(2)
(3)⑦
(4) 75% 3240kPa
(5)G
(6)
【详解】(1)由题意知 ,结合图1可知 ,根据盖斯定律得 。
(2)由图2可知反应物为2mol 、2mol NO、0.5mol ,产物为2mol 、3mol ,为催化剂,脱氮过程的总反应的化学方程式为。
(3)由表格可知,反应⑦活化能最大,反应速率最慢,因此其他条件一定时,决定催化还原NO的反应速率的基元反应为⑦。
(4)一定温度下,固定体积的容器中,压强比等于气体物质的量比,即,故平衡时气体总物质的量为3.75mol。设平衡时,转化的物质的量为xmol,列三段式:
可得,解得,的转化率为 【提示:只与温度有关,与反应物的起始量无关】。
(5)该反应是放热反应,相同压强时降低温度,平衡向正反应方向移动,一氧化氮体积分数减小,相同温度时增大压强,一氧化氮体积分数减小,则该反应是气体分子数减小的反应,若在D点对反应容器降温的同时缩小体积,使体系压强增大,重新达到的平衡状态可能是G点。
(6)电流强度为4A时,主要是氧化NO生成硝酸盐,故离子方程式为。
8.(1) <
(2) BCE 升高温度 缩小体积 <
【详解】(1)根据图象可知反应①的热化学方程式为: 或 ;活化能越高,反应速率越小,反应①的活化能比反应②的活化能大,因此可以推测反应①的速率比反应②小;
(2)根据题目信息,可列出三段式:
①根据三段式中信息可知,0~8min内的平均反应速率为;
②A.根据图示和盖斯定律可知,,A正确;
B.缩小体积,各物质浓度增大,正逆反应速率都增大,B错误;
C.催化剂可以改变反应速率,但不能引起平衡移动,故不能提高转化率,C错误;
D.不再变化时,说明各物质浓度不变,反应达平衡状态,D正确;
E.平衡后充入,平衡正向移动,氢气转化率增大,但转化率降低,E错误;
答案选BCE;
③根据方程式可以判断的表达式为;开始时,密闭容器中为和的混合气体,压强为,平衡后密闭容器中存在、、、,根据等量转换可得平衡时的总压为;因此的计算式可列为;
④虚线A相对于原始条件下,反应速率加快,平衡逆向移动,故为升高温度,虚线B相对于原始条件下,反应速率加快,平衡正向移动,故为缩小体积;该反应为放热反应,升高温度平衡逆向移动,值降低,故。
【点睛】本题考查热化学方程式书写、化学反应中的能量变化、平衡移动和平衡常数的计算。
9.(1) 正极 阳离子
(2)
(3)+116.1
(4)BC
(5) c 其他条件不变,增大浓度,CO的平衡转化率增大
(6) 1
【详解】(1)根据装置图,右边电极上得到氧气,氧元素的化合价升高,根据电解工作原理,右边电极为阳极,即b电极为正极,阳极电极反应式为2H2O-4e-=O2↑+4H+,阴极电极反应式为CO2+2e-+2H+=CO+H2O、2H2O+2e-=H2↑+2OH-,阳极产生H+移向阴极,交换膜为阳离子交换膜;故答案为正极;阳离子;
(2)阴极电极反应式为CO2+2e-+2H+=CO+H2O、2H2O+2e-=H2↑+2OH-,生成CO和H2体积比为1∶2,则总反应式为;故答案为;
(3)已知标准摩尔生成焓是由指定单质生成1mol该物质的焓变,所以一个反应的焓变可由生成物的标准摩尔生成焓减去反应物的标准摩尔生成焓得到。,,所以,;故答案为+116.1;
(4)A.代入实验Ⅰ、Ⅱ数据可得n=1,代入实验Ⅱ、Ⅲ数据可得m=2,故A错误;
B.根据实验Ⅰ、Ⅳ数据可得x=0.3,故B正确;
C.其他条件不变,升高温度,反应速率增大,浓度不变,由速率方程知,速率常数增大,故C正确;
D.加入催化剂,速率常数增大,故D错误;
答案为BC;
(5)纵坐标代表甲醇的体积分数,不是反应物转化率。横坐标从左至右,氢气与一氧化碳的投料比增大,可以看作是CO物质的量不变,增大氢气物质的量,增大氢气物质的量,平衡向正反应方向进行,CO的平衡转化率增大,因此CO转化率最大的是c;故答案为c;其他条件不变,增大浓度,CO的平衡转化率增大;
(6)根据图象可知,当温度高于300℃,甲醇体积分数增大,说明该催化剂对甲醇选择性较大;令生成甲醇的物质的量为xmol,生成甲烷的物质的量为ymol,反应①中消耗CO的物质的量为xmol,消耗氢气物质的量为2xmol,反应②中消耗CO的物质的量为ymol,消耗氢气物质的量为3ymol,甲醇的选择性为80%,则,达到平衡时CO物质的量浓度为0.5mol/L,则有,解得x=0.4,y=0.1,平衡时,,,,;故答案为;1。
10.(1)-26
(2) Ⅰ 当时,相同温度下,减小压强,反应Ⅰ中体积分数增大,而反应Ⅱ的平衡不受压强影响 随着温度升高,压强对平衡的影响减弱;以反应Ⅱ为主,压强不影响反应Ⅱ的平衡
(3) 水是催化剂的活化剂,可增大生成甲醇的速率增大Ⅱ反应的逆反应速率(或减小Ⅱ反应的正反应速率),提高甲醇的选择性 54.9
(4) 阴离子交换膜
【详解】(1)根据盖斯定律,得反应Ⅰ的。
(2)①反应Ⅰ为气体分子数减小的反应、Ⅱ为气体分子数不变的反应,相同温度下,减小压强,反应Ⅰ的平衡向逆反应方向移动体积分数增大,反应Ⅱ的平衡不受压强影响,结合图象可知,压强关系为;
当温度较低时,压强对平衡的影响大于温度对平衡的影响,加压时反应Ⅰ的平衡正向移动,体积分数减小,故时,在相同温度下,以反应Ⅰ为主;
②时压强对平衡影响小于温度,此时以反应Ⅱ为主,压强不影响反应Ⅱ的平衡,所以时,三条曲线几乎相连;
③由①分析可知,。
(3)①投料b能显著提高甲醇选择性的原因是水是催化剂的活化剂,可增大生成甲醇的速率增大Ⅱ反应的逆反应速率(或减小Ⅱ反应的正反应速率),提高甲醇的选择性;
②设反应Ⅰ转化的的物质的量为x,反应Ⅱ转化的的物质的量为y,若先发生反应Ⅰ,再发生反应Ⅱ可列出三段式:
在450K下达到平衡状态时,的转化率为50%,则
的选择性为90%,则
解得x=0.9mol、y=0.1mol
该反应是反应前后气体分子数相同的反应,可以用物质的量替代平衡分压来计算平衡常数,则。
(4)根据物质转化中的元素化合价变化可知,甲烷转化为甲醇的过程中,碳的化合价升高,发生氧化反应,故a为阳极,在阳极上生成甲醇;则b为阴极,在阴极上析出氢气,阴极反应式为,阳极反应式为;为了使电解池持续稳定工作,阳极需要补充,故交换膜M为阴离子交换膜,右侧生成的氢氧根离子通过阴离子交换膜进入左侧。
11.(1)
(2) CD b
(3) 反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减少,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降
【详解】(1)由盖斯定律可知,,已知一定条件下反应、,的焓变分别为,、,的焓变,则,故反应的焓变。
(2)①A.由图知,温度升高,上述四个反应的平衡常数都变小,则升温平衡左移,故四个反应均为放热反应,A正确;
B.能量越低越稳定,结合A选项可知,1-MD的能量最低,则反应体系中1-MD最稳定,B正确;
C.生成四氢萘类物质(MTLs,包括1-MTL和5-MTL)、生成十氢茶(1-MD)的反应均为气体分子总数减小的放热反应,则压强越大,温度越低越有利于生成十氢茶(1-MD),C不正确;
D.由图甲可知,500K前,曲线a对应的平衡常数最大,但平衡常数大时反应速率不一定也大,则不能判断曲线a对应的反应速率是否最大,D不正确;
选CD。
②由(1)可知,则,若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,,则表示反应R2的平衡常数随温度变化的曲线为b。
(3)①1-MTL的物质的量随时间呈现先上升后下降的原因为:反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减少,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降;
②若,则的总能量大于的总能量,由图乙可知,的物质的量大于的物质的量,则的生成速率大于的生成速率,生成的活化能小于生成的活化能,故图丙绘制反应R1、R3的“能量~反应过程”示意图为: 。
12.(1) +9.65 ΔH1-ΔH2
(2)bc
(3)a/200t
(4) 1/400 < T1时K1=,T2时K2=,步骤①的△H1>0,升高温度,K增大,故T2>>T1
【详解】(1)步骤①CH4(g)+(g)+Cl2(g)+HCl(g)+Cl2(g),断开H3C-H,生成H-Cl,即吸收4.56eV,放出4.46eV,+4.56-4.46=+0.1ev,即ΔH1=0.1×96.5=9.65kJ·mol-1;步骤②+HCl(g)+Cl2(g)CH3Cl(g)+(g)+HCl(g),由消去中间产物,可得总反应,由图可知,反应物与生成物的相对能量之差为H1-H2,所以H=H1-H2。
(2)a.恒容充入甲烷,甲烷转化率减小,错误;b.设法使CH3Cl液化,平衡正向移动,甲烷转化率增大,正确;c.适当降低温度,平衡正向移动,甲烷转化率增大,正确;d.用更强的光照射反应混合物,可能使甲烷生成副产物,错误;故选bc。
(3)生成乙烷消耗n(CH4)=0.01amol,生成乙烷的物质的量=0.005amol,可得v=a/200tmol·min-1。
(4)当v正=v逆时,1.7×108c(Cl·)·c(CH4)=6.8×1010c(CH3·)·c(HCl),K==1/400。步骤①达平衡时存在物质的量关系:n(Cl·)=450n(·CH3),分压关系:2p(HCl)=3p(CH4),代入K=,步骤①的△H1>0,升高温度,K增大,故T2>>T1。
13.(1)
(2) N>O>C b
(3) sp3 依据“相似相溶原理”,顺式甘氨酸铜为极性分子,反式甘氨酸铜为非极性分子,水为极性溶剂
(4) Fe
【详解】(1)在元素周期表中,三种元素位于同一周期又位于同一族则一定是第Ⅷ族元素,和铁、镍既处于同一周期又位于同一族的元素为钴,27号元素,该元素的基态原子的价电子排布图为 ,
故答案为: ;
(2)第一电离能从左往右第一电离能在增大,其中N元素大于相邻元素,因此第二周期元素第一电离能从大到小的顺序为N>O>C,硝普钠(Na2[Fe(CN)5(NO)·2H2O])是配合物,外界Na+和内界之间存在离子键,NO、CN﹣与Fe3+之间存在配位键,C和N、N和O、H和O之间存在极性共价键,故不存在的化学键为金属键,应选b,故答案为:N>O>C;b;
(3)甘氨酸铜中氮原子均连接的是三个单键,因此杂化类型为sp3,反式甘氨酸铜难溶于水的原因可能是,反式甘氨酸铜为非极性分子,顺式甘氨酸铜为极性分子,根据相似相溶原理,可知反式甘氨酸铜难溶于水,故答案为:sp3;依据“相似相溶原理”,顺式甘氨酸铜为极性分子,反式甘氨酸铜为非极性分子,水为极性溶剂;
(4)由晶胞结构可知坐标为(,1,)的原子是Z原子,即Fe原子;Se原子X与Se原子Y,沿x轴方向的距离为,沿y轴方向的距离为,沿z轴方向的距离为,两点间的距离为;Li原子有8个位于顶点,1个位于体心,个数为:,Fe有8个位于面上,个数为,Se原子8个位于棱上,2个位于体内,个数为:,晶胞的质量为:,晶胞体积为:a2b×10﹣21 cm3,密度,故答案为:Fe;;。
14.(1)
(2)11.1
(3) > 催化剂乙、反应温度 或
【详解】(1)①该流程中所涉及含碳化合物中CO2中碳原子的杂化方式为sp杂化,CH3OH中C原子的杂化方式为sp3杂化,HCHO中C原子的杂化方式为sp2杂化;
②反应I:,反应Ⅱ:,反应Ⅲ:,反应Ⅳ:,由盖斯定律,反应I+Ⅱ+×Ⅲ+×Ⅳ可得反应: ++×+×;
(2)设平衡时物质的量为x,C2H4的为y,列三段式:、,容器体积为1L,达到平衡时,,则4-x-2y=x+4y①,,则6-3x-6y=1.2②,联立①②式解得x=0.8mol、y=0.4mol,则物质的量分数为;
(3)①催化剂不能使平衡发生移动,由图可知M点乙烯的转化率低于同温度下催化剂为乙时乙烯的转化率,说明M点时反应还没有达到平衡状态,还在正向进行,故>;
根据图1所给信息,催化剂为乙的时候乙烯的转化率高,故应选择的反应条件为催化剂乙、反应温度200℃;故答案为:>;催化剂乙、反应温度200℃;
②由化学方程式可知,正速率与乙烯的浓度有关,逆速率与丙烯的浓度有关,故v正的斜率更大一些,由速率公式可得:lgv正=lgk正+3lg c(C2H4),lgv逆=lgk逆+2lgc(C3H6),由图可知当lg c(C2H4)和lgc(C3H6)均为0时,lgv正=a,lgv逆=b,则lgv正=lgk正=a,k正=10a,lgv逆=lgk逆=b,k逆=10b,则T℃时,该反应达到平衡时,v正=v逆,即k正c3(C2H4)=k逆c2(C3H6),则平衡常数K=;
设向容器中充入xmol/L C2H4,平衡后测得,则有三段式:
K=,解得:,则用表示的平均反应速率为v(C3H6)=
故答案为:;。
15.(1)CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol
(2) 加压或选择合适的催化剂 CeO2 增大 高于320°C后,Ni的催化活性显著增强,反应速率加快 ab
(3) 8
【详解】(1)依题意,CO2甲烷化生成气态水的化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(g),则ΔH=(803×2+436×4-414×4-464×4) kJ/mol=-162 kJ/mol,所以CO2甲烷化生成气态水的热化学方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol。
(2)①CO2甲烷化反应为CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-162 kJ/mol,加压、选择合适的催化剂既能提高三氧化碳甲烷化的反应速率又能提高甲烷产率,升温能加快反应速率,但会降低甲烷的产率,所以采取的措施:加压或选择合适的催化剂。
②从图中可以看出,反应温度在260°C ~320°C之间时,CeO2作催化剂时,CO2的转化率和甲烷选择性远高于Ni作催化剂,所以应选择CeO2为催化剂;图中信息显示,该温度范围内,升高温度CH4的产率增大。
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升,则表明此温度有利于Ni的催化作用,所以原因是:高于320°C后,Ni的催化活性显著增强,反应速率加快。
④若A点表示320°C时的平衡状态,则可建立如下两个三段式:
则容器中CH4的浓度为=ab mol·L-1,二氧化碳甲烷化反应的平衡常数K==(mol·L-1)-2。
(3)在CeO2理想晶胞中,含Ce4+个数为=4,含O2-个数为8。若晶胞边长为a nm,NA为阿佛伽德罗常数的值。从图中可以看出,CeO2理想晶胞中,与面心的Ce4+最近且相等的O2-有4个,则在另一晶胞中,与Ce4+等距离的O2-还有4个,则Ce4+的配位数为8,CeO2晶体的密度为=g·cm-3。
【点睛】计算晶胞中所含微粒数目时,可采用均摊法。
16.(1) 放热 550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率
(2) 200℃ KQ=KM>KN
(3)4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol,
(4)AB
(5) b
【详解】(1)①由表格数据可知,压强一定时,升高温度,氨的平衡含量减小,说明升高温度平衡向逆反应方向移动,该反应为放热反应,故答案为:放热;
②550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率,所以哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,故答案为:550℃、10Mpa的条件下,催化剂活性最好,可以提高合成氨的反应速率;
(2)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,氨气的百分含量降低,所以曲线a对应的温度是200℃,故答案为:200℃;
②合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,由图可知温度的大小关系为Q=M<N,则平衡常数的大小关系为KQ=KM>KN,故答案为:KQ=KM>KN;
(3)将已知反应依次编号为①②,由盖斯定律可知,①—②×2可得反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),则反应ΔH=(—1268kJ/mol) +(—180.5kJ/mol)×2=-907 kJ/mol,反应的热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol,故答案为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH= 907kJ/mol;
(4)A.催化剂a表面有氮氮三键键的断裂和氮氢键的形成,则a表面发生了非极性共价键的断裂和极性共价键的形成,故正确;
B.氮气与氢气反应为游离态的氮元素转化为化合态氮元素的过程,属于氮的固定过程,故正确;
C.在催化剂b表面形成氮氧键时氮元素化合价升高被氧化,反应中有电子转移,故错误;
故选AB;
(5)①由图可知,起始氨气物质的量为0.1 mol 时气体压强为200 kPa,t1时间反应达到平衡时氨气的平衡分压为120 kPa,由物质的量之比等于压强之比可知,平衡时氨气的物质的量为0.1mol×=0.06mol,则0~t1时间内氢气的反应速率为 = mol/(L·min),故答案为:;
②t2时将容器体积迅速缩小至原来的一半并保持不变,容器中气体压强增大,氮气分压瞬间增大,该反应是气体体积增大的反应,平衡向逆反应方向移动,氮气分压减小,则将容器体积迅速缩小至原来的一半并保持不变时,氮气的分压先增大后又减小,所以能正确表示压缩后氮气分压变化趋势的曲线是b,故选b。
17.(1) -749 低温 BD Ka=Kb>Kc 2
(2) 12
【详解】(1)①由盖斯定律可知,2×II- I即可得到==-749,该反应是气体体积减小的反应,,当时,反应能自发进行,则该反应在低温下能够自发进行;
②A.该反应过程中气体总质量和总体积都不变,气体密度是定值,当容器内气体的密度不再改变时,不能说明反应达到平衡,故A不选;
B.该反应是放热反应,在绝热恒容密闭容器进行,温度一直上升,当容器内气体的温度不再改变时,能说明反应达到平衡,故B选;
C.时,不能说明正逆反应速率相等,不能说明反应达到平衡,故C不选;
D.该反应过程中气体总质量不变,总物质的量减小,则容器内气体的平均摩尔质量增大,当容器内气体的平均摩尔质量不变时,说明反应达到平衡,故D选;
故选BD;
③恒温恒容条件发生发应Ⅲ,气体的压强之比等于气体的物质的量之比,随着反应的进行,各容器内压强:pa=pb
。
(2)①由晶胞结构可知,形成的晶体是面心立方堆积,该晶体的配位数为12;
②原子的个数为8=4,该晶胞的质量为g,体积V=,晶胞的边长a=,两个原子的核间距为晶胞体对角线长的,为=
18.(1)+34.5
(2) 小于 66.7% 正向 大于
(3) Cat.1 该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat。2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低。)
(4) CH3NH2·H2OCH3NH(aq)+OH- 2.5×10-10
【详解】(1)已知反应:HCHO(g)+H2(g)=CH3OH(g)ΔH1=-84kJ mol-1① CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=-49.5kJ mol-1②由盖斯定律②-①得CO2(g)+2H2(g)=HCHO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-49.5kJ mol-1)-(-84kJ mol-1)=+34.5kJ mol-1,故答案为:+34.5;
(2)①由图可知在相同温度时,压强P1下平衡时H2的体积分数大,平衡逆向移动,根据勒夏特列原理减小压强化学平衡向计量数之和小的方向移动,故P1小于P2,故答案为:小于;
②,由图可知×100%=40% 解得x≈0.667,H2的平衡转化率=×100%=66.7%,令容器的体积为VL,该温度下K=≈4.5V2,该温度下达到平衡后,在容积不变的条件下再充入molCO和molCH3OH,此时Qc=≈3.4V2,即Qc小于K,故在容积不变的条件下再充入molCO和molCH3OH时,反应正向进行,在容积不变的条件下再充入molCO和molCH3OH时,物质的量浓度增大,化学反应速率增大,故新平衡时的逆反应速率大于原平衡故答案为:66.7%;正向;大于;
(3)由图可知催化剂Cat.1对应的乙烯和丙烯的选择性更高,故结果较好的是Cat.1,该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat.2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低。),故答案为:Cat.1;该条件下2h后催化剂失活,导致甲醇转化率、乙烯和丙烯的选择性均明显下降;(或该条件下2h后Cat.2显著降低副反应的活化能,相同时间内快速生成副产物二甲醚,乙烯和丙烯的选择性下降,甲醇转化率也会有一定程度的降低);
(4)甲胺与氨相似,则甲胺在水中的电离方程式为:CH3NH2 H2O(aq)+OH-,反应CH3NH2 H2O(aq)+OH-的平衡常数表达式K=,CH3NH2 H2O(aq)+OH-的电离平衡常数Kb=
==Kw=Kw K=1.0×10-14×2.5×104=2.5×10-10,故答案为:CH3NH2 H2O(aq)+OH-; 2.5×10-10。
答案第1页,共2页
答案第1页,共2页
同课章节目录
