2023届高三化学一轮专题训练- -化学反应速率(含解析)
文档属性
| 名称 | 2023届高三化学一轮专题训练- -化学反应速率(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-25 10:01:34 | ||
图片预览

文档简介
2023届高三化学一轮专题训练--化学反应速率
一、单选题
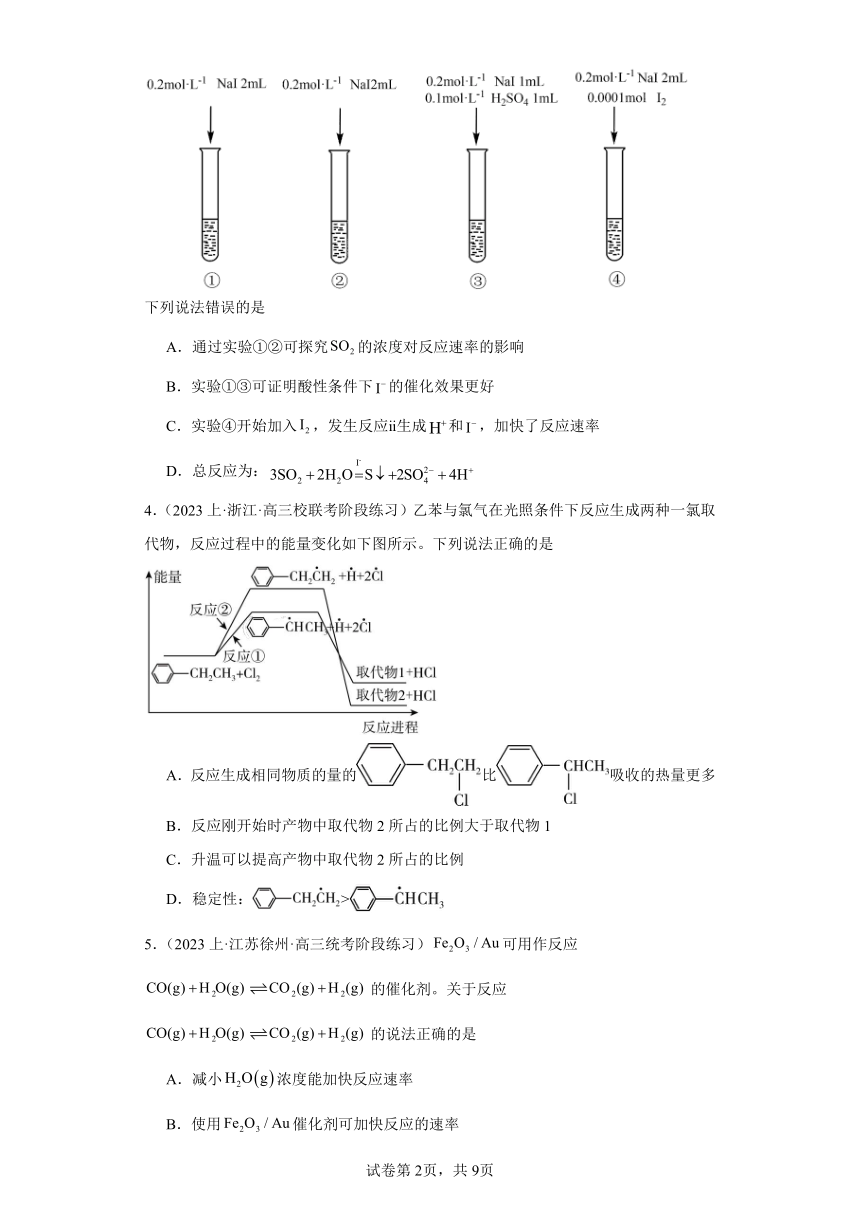
1.(2023上·广东深圳·高三深圳第三高中校考期中)某反应过程的能量变化如图所示,下列说法正确的是
A.该反应的ΔH<0
B.该反应需要加热才能发生
C.反应过程Ⅰ的活化能大于 E1
D.反应过程Ⅱ中步骤b为决速步骤
2.(2023上·天津红桥·高三统考期中)已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
A.反应①为放热反应
B.反应②是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.H2(g)+2ICl(g)=I2(g)+2HCl(g) ΔH=-218kJ·mol-1
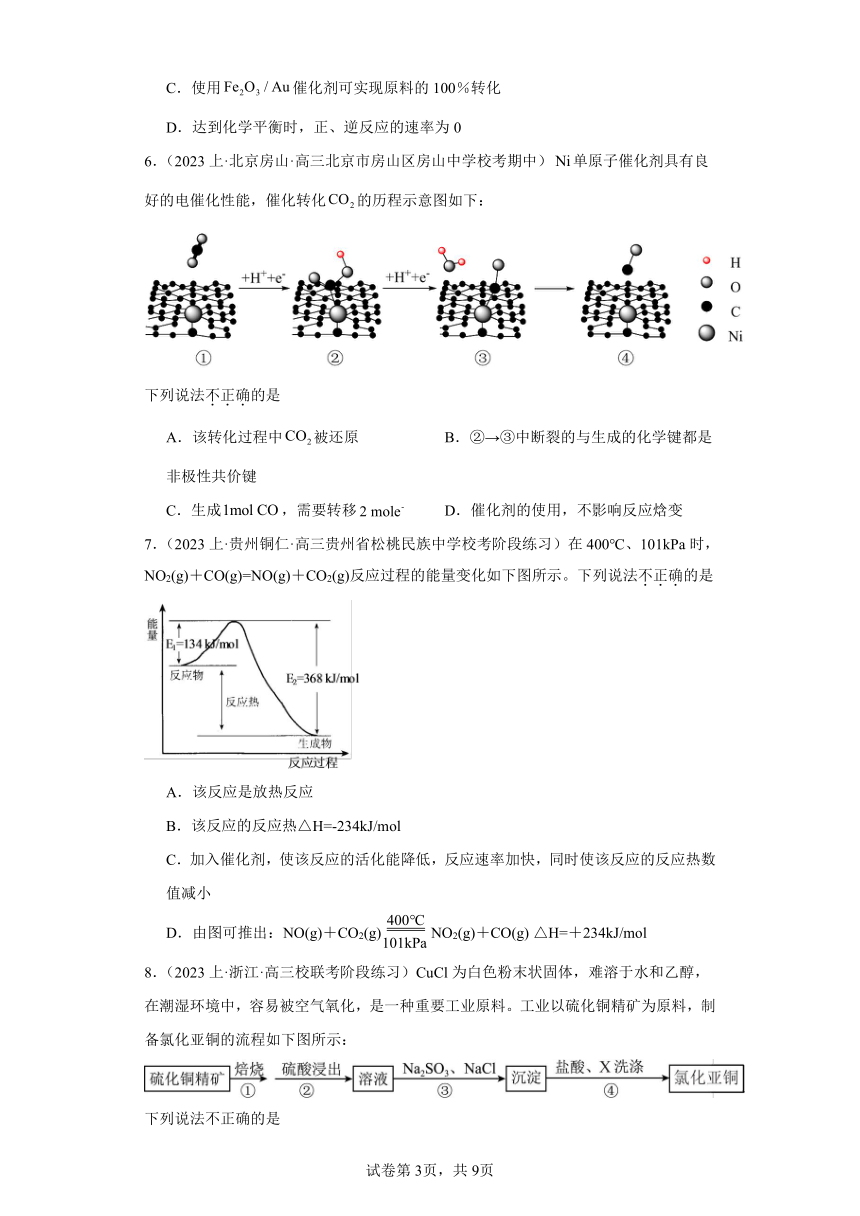
3.(2023上·山东德州·高三统考期中)一定条件下,可催化在水中发生反应,过程分为两步
i.
ⅱ.
某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是的稀溶液;②③④中是的饱和溶液
(2)四组实验中溶液出现混浊所用时间:①>②>③>④
下列说法错误的是
A.通过实验①②可探究的浓度对反应速率的影响
B.实验①③可证明酸性条件下的催化效果更好
C.实验④开始加入,发生反应ⅱ生成和,加快了反应速率
D.总反应为:
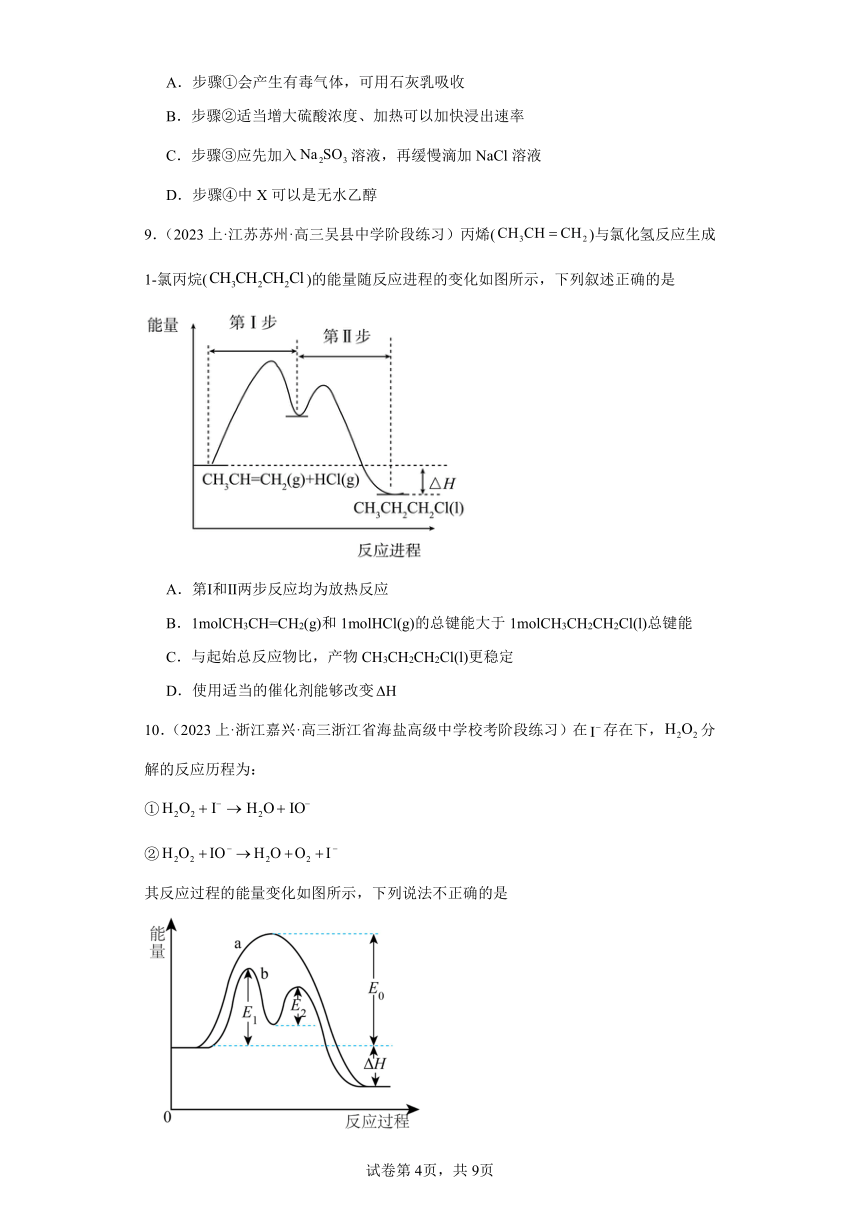
4.(2023上·浙江·高三校联考阶段练习)乙苯与氯气在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如下图所示。下列说法正确的是
A.反应生成相同物质的量的比吸收的热量更多
B.反应刚开始时产物中取代物2所占的比例大于取代物1
C.升温可以提高产物中取代物2所占的比例
D.稳定性:>
5.(2023上·江苏徐州·高三统考阶段练习)可用作反应的催化剂。关于反应的说法正确的是
A.减小浓度能加快反应速率
B.使用催化剂可加快反应的速率
C.使用催化剂可实现原料的100%转化
D.达到化学平衡时,正、逆反应的速率为0
6.(2023上·北京房山·高三北京市房山区房山中学校考期中)单原子催化剂具有良好的电催化性能,催化转化的历程示意图如下:
下列说法不正确的是
A.该转化过程中被还原 B.②→③中断裂的与生成的化学键都是非极性共价键
C.生成,需要转移 D.催化剂的使用,不影响反应焓变
7.(2023上·贵州铜仁·高三贵州省松桃民族中学校考阶段练习)在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确的是
A.该反应是放热反应
B.该反应的反应热△H=-234kJ/mol
C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小
D.由图可推出:NO(g)+CO2(g)NO2(g)+CO(g) △H=+234kJ/mol
8.(2023上·浙江·高三校联考阶段练习)CuCl为白色粉末状固体,难溶于水和乙醇,在潮湿环境中,容易被空气氧化,是一种重要工业原料。工业以硫化铜精矿为原料,制备氯化亚铜的流程如下图所示:
下列说法不正确的是
A.步骤①会产生有毒气体,可用石灰乳吸收
B.步骤②适当增大硫酸浓度、加热可以加快浸出速率
C.步骤③应先加入溶液,再缓慢滴加NaCl溶液
D.步骤④中X可以是无水乙醇
9.(2023上·江苏苏州·高三吴县中学阶段练习)丙烯()与氯化氢反应生成1-氯丙烷()的能量随反应进程的变化如图所示,下列叙述正确的是
A.第Ⅰ和Ⅱ两步反应均为放热反应
B.1molCH3CH=CH2(g)和1molHCl(g)的总键能大于1molCH3CH2CH2Cl(l)总键能
C.与起始总反应物比,产物CH3CH2CH2Cl(l)更稳定
D.使用适当的催化剂能够改变
10.(2023上·浙江嘉兴·高三浙江省海盐高级中学校考阶段练习)在存在下,分解的反应历程为:
①
②
其反应过程的能量变化如图所示,下列说法不正确的是
A.存在改变了双氧水分解的反应历程
B.反应①是吸热反应
C.存在改变了双氧水制氧气的焓变
D.决定总反应速率的是第1步基元反应
11.(2023上·广东广州·高三执信中学校考阶段练习)在含、和的溶液中,发生反应:,其分解机理及反应进程中的能量变化如下:
步骤①:
步骤②:
下列有关该反应的说法正确的是
A.加入可以使反应物分子中活化分子百分数增大
B.该反应的催化剂是
C.步骤②是整个反应的决速步骤
D.若不加,则正反应的活化能比逆反应的大
12.(2023上·辽宁沈阳·高三东北育才学校校考阶段练习)下列各实验装置、目的或结论全都正确的是
实验装置
甲 乙 丙 丁
A.甲用于测定中和反应的反应热
B.乙可验证镁片与稀盐酸反应放热
C.由丙可推断出:反应为吸热反应
D.丁可验证对的分解反应有催化作用
13.(2023上·广东广州·高三广东华侨中学校考阶段练习)和CO是环境污染性气体,可在表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法正确的是
A.总反应的
B.为了实现转化,需不断向反应器中补充和
C.该总反应正反应的活化能小于逆反应的活化能
D.和都是反应的催化剂
14.(2023上·全国·高三期中)一定条件下,可逆反应2AB+3C,在四种状态中处于平衡状态的是
正反应速率 逆反应速率
A vA=2mol/(L min) vB=2mol/(L min)
B vA=2mol/(L min) vC=2mol/(L min)
C vA=1mol/(L min) vB=2mol/(L min)
D vA=1mol/(L min) vC=1.5mol/(L min)
A.A B.B C.C D.D
二、非选择题
15.(2020下·贵州黔西·高三校考期末)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,该反应过程和机理较复杂,一般认为分为以下几步:
①+→+(慢)
②+→IO-+(快)
③5I-+6H++→3I2+3H2O(快)
④I2++H2O→2I-++2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在 离子消耗完时,才会使淀粉变蓝的现象产生。
16.(2021下·高三课时练习)为了研究碳酸钙与稀盐酸的反应速率,一位同学通过测定反应中生成的气体体积随时间变化的情况,绘制出了如图所示的曲线。请分析讨论以下问题:
(1)在0~、~、~各相同的时间段里,反应速率最慢的是 时间段,收集到气体最多的是 时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放出热量的反应) 。
(3)在后,为什么收集到的气体的体积不再增加 ?
17.(2021·高三课时练习)在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
项目 反应物 催化剂 温度
① 10mL10%H2O2溶液 无 25℃
② 10mL20%H2O2溶液 无 25℃
③ 10mL20%H2O2溶液 无 40℃
④ 10mL20%H2O2溶液 1~2滴0.1mol L-1FeCl3溶液 40℃
通过实验得到氧气的体积与时间的关系如图甲所示,回答下列问题:
(1)代表实验①的曲线是 。
(2)对比实验③和④的目的是 。
(3)通过上面对比实验,所得的实验结论是 。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应N2(g)+3H2(g)2NH3(g),测得其中N2的物质的量随时间变化如图乙所示。回答下列问题:
(4)从开始反应到t2时刻,氨的平均反应速率为 。
18.(2021上·山西阳泉·高三统考期末)为探究化学反应速率的影响因素,学生设计了锌与过量的c mol/L 100mL盐酸起反应的实验,得到了下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
① 2.0 薄片 15 200
② 2.0 薄片 25 100
③ 2.0 薄片 30 t1
④ 2.0 薄片 35 50
⑤ 2.0 颗粒 25 t2
⑥ 2.0 粉末 25 t3
(1)上述实验中①②③④是探究 对化学反应速率的影响; (填序号)是探究固体表面积对化学反应速率的影响。
(2)下列说法正确的是 。
a.t1=75s b. 100﹥t2﹥t3
c.单位时间内耗锌的质量⑤﹥⑥﹥②
d.以上都不正确
(3)②中气泡生成的速率与时间的关系大致如图。推测从0到t速率不减反增的原因可能是 。
(4)某同学为了探究化学腐蚀与电化学腐蚀的速率,设计实验与②进行对照。操作如下: 25℃时,另取一个烧杯,放入与实验②完全相同的锌片,先加入2mL某浓度的 溶液,再加入与②相同的盐酸。可以观察到 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由图像可知,此反应为吸热反应ΔH>0, A错误;
B.吸热反应不一定要加热才能进行,B错误;
C.由题干图像信息可知,反应过程Ⅰ的活化能大于E1,C正确;
D.途径Ⅱ中分二步进行,活化能大的反应速率慢,起决定性作用即步骤a为决速步骤,D错误;
故答案为:C。
2.C
【详解】A.根据图像可知,反应①中反应物总能量大于生成物,则反应①为放热反应,A项正确;
B.②中只有I元素的化合价变化,则②是同种元素间发生的氧化还原反应,B项正确;
C.由图可知,反应①中正反应的活化能大,反应②中正反应的活化能小,反应①比反应②的速率慢,C项错误;
D.由图可知,反应的反应物总能量和生成物总能量差值等于218kJ,则该反应的焓变,D项正确;
故选C。
3.B
【详解】A.实验①②中温度和NaI溶液的浓度相同,的浓度不同,可以通过实验①②可探究的浓度对反应速率的影响,故A正确;
B.实验①③中的浓度和H+的浓度都不同,实验①③不能证明酸性条件下的催化效果更好,故B错误;
C.实验④开始加入,发生反应ⅱ生成和,加快了反应速率,故C正确;
D.反应i+2×反应ⅱ可得总反应为:,故D正确;
故选B。
4.C
【详解】A.乙苯与氯气在光照条件下的反应为放热反应,A错误;
B.反应①的活化能更低,所以产物中取代物1所占的比例大于取代物2,B错误;
C.反应②的活化能大,所以升温可以提高产物中取代物2所占的比例,C正确;
D.的能量高,所以其稳定性差,D错误;
故选C。
5.B
【详解】A.减小浓度,反应物浓度减小,反应速率减慢,A错误;
B.催化剂可加快反应速率,故使用催化剂可加快反应的速率,B正确;
C.可逆反应不能实现原料的完全转化,催化剂可加快反应速率,但是不能提高原料的转化率,实现原料的100%转化,C错误;
D.达到化学平衡时,正、逆反应的速率相等,但不为0,D错误;
故选B。
6.B
【详解】A. 酸性条件下,CO2催化转化的产物是CO和H2O,C元素化合价降低,CO2被还原,故A正确;
B. 断裂了C-O键生成了H-O键,断裂的与生成的化学键都是极性共价键,故B错误;
C. 生成,碳元素化合价从+4降低为+2,则需要2mol电子,故C正确;
D. 催化剂只能改变反应速率,不能改变反应的焓变,故D正确;
故选B。
7.C
【详解】A.根据图像可知反应物的总能量高于生成物的总能量,所以是放热反应,A正确;
B.该反应的反应热,B正确;
C.催化剂能降低反应的活化能,但不能改变反应热,C错误;
D.由图可推出:NO(g)+CO2(g)NO2(g)+CO(g) △H=+234kJ/mol,D正确;
答案选C。
8.C
【分析】第①步为硫化铜氧化焙烧,第②步为硫酸浸出,得到硫酸铜溶液,第3步硫酸铜、亚硫酸钠和氯化钠反应生成氯化亚铜沉淀,第④步用盐酸、乙醇洗涤后得到氯化亚铜固体。
【详解】A.步骤①会产生二氧化硫有毒气体,可用石灰乳吸收,A正确;
B.硫酸浓度增大,反应速率加快,能加快浸出速率,适当加热也能加快浸出速率,B正确;
C.步骤③中Cu2+被Na2SO3还原生成Cu+,为防止Cu+再次被空气氧化,不能缓慢滴加NaCl溶液,C错误;
D.无水乙醇可洗去水,加快干燥速度,防止CuCl在潮湿环境中被空气氧化,D正确;
故选C。
9.C
【详解】A.第Ⅰ步反应反应物的总能量小于生成物的总能量,为吸热反应,第Ⅱ步反应反应物的总能量大于生成物的总能量,为放热反应,A错误;
B.由图可知,该反应放热,焓变为负,焓变等于断裂化学键吸收的能量减去成键释放的能量,则1molCH3CH=CH2(g)和1molHCl(g)的总键能小于1molCH3CH2CH2Cl(l)总键能,B错误;
C.已知物质具有的总能量越低,物质越稳定,由题干反应历程图可知,1molCH3CH=CH2(g)和1molHCl(g)的总能量大于1molCH3CH2CH2Cl(l),故与起始总反应物比,产物CH3CH2CH2Cl(l)更稳定,C正确;
D.催化剂不改变反应的始终态,则催化剂能够改变反应途径、降低反应的活化能,而反应的焓变不变,D错误;
故答案为:C。
10.C
【详解】A.由图可知,碘离子是反应的催化剂,改变了双氧水分解的反应历程,降低了反应的活化能,故A正确;
B.由图可知,反应①是反应物总能量小于生成物总能量的吸热反应,故B正确;
C.由图可知,碘离子是反应的催化剂,改变了双氧水分解的反应历程,降低了反应的活化能,但双氧水制氧气的焓变不变,故C错误;
D.由图可知,第1步基元反应的活化能大于第2步基元反应,反应的活化能越大,反应速率越慢,总反应速率取决于慢反应,所以决定总反应速率的是第1步基元反应,故D正确;
故选C。
11.A
【详解】A.Fe3+是该反应的催化剂,催化剂能降低反应的活化能,提高活化分子百分数,故A正确;
B.由反应机理可以看出,Fe3+是该反应的催化剂,Fe2+是该反应的中间产物,故B错误;
C.步骤①的活化能大于步骤②,所以步骤①为慢反应,为决速步反应,故C错误;
D.此反应整体为放热反应,正反应的活化能小于逆反应的活化能,加入催化剂不改变反应热,故D错误。
答案选A。
12.B
【详解】A.图中缺少玻璃搅拌器,不能搅拌,则不能准确测定中和热,故A错误;
B.Mg与盐酸反应放热,使饱和石灰水的温度升高,石灰水变浑浊,可验证镁片与稀盐酸反应放热,故B正确;
C.热水中颜色深,可知升高温度平衡向生成二氧化氮的方向移动,则反应2NO2(g) N2O4(g)为放热反应,故C错误;
D.右侧试管的温度高,且加催化剂,两个变量,不能验证FeCl3对H2O2的分解反应有催化作用,故D错误;
故选:B。
13.C
【详解】A.①;②;根据盖斯定律:①+②得,故A错误;
B.反应过程中和参与反应后又生成,不需向反应器中再补充和,故B错误;
C.该反应正反应的活化能为,逆反应的活化能为,正反应的活化能小于逆反应活化能,故C正确;
D.是该反应的催化剂,是该反应的中间体,故D错误;
答案选C。
14.D
【详解】A.A物质的正反应速率υA=2mol/( L·min),逆反应速率υB=2mol/( L·min),则逆反应速率υA=4mol/( L·min),A的正逆反应速率不相等,所以该反应未达到平衡状态,选项A错误;
B.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L·min),C的逆反应速率为2mol/( L·min),A的逆反应速率为mol/(L·min),所以A的正逆反应速率不等,选项B错误;
C.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1mol/( L·min),B的逆反应速率为2mol/( L·min),A的逆反应速率为4mol/(L·min),所以A的正逆反应速率不等,选项C错误;
D.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1mol/(L·min),C的逆反应速率为1.5mol/(L·min),A的逆反应速率为1mol/( L·min),所以A的正逆反应速率相等,选项D正确;
答案选D。
15. ①
【详解】(1)一个化学反应的总的反应速率是由慢反应速率决定的,根据上述条件推测,此反应的总的反应速率由①步反应决定;
(2)由反应机理可知,该反应①是和反应,且为慢反应,而反应④是I2和反应,为快反应,由此说明I2和反应比和反应更快,故若预先加入淀粉溶液,由反应过程看必在离子消耗完时,才会使淀粉变蓝的现象产生。
16. ~ ~ O~时间段:反应物浓度高,但温度较低,所以速率较慢;~时间段:由于反应放热,温度升高,反应速率变快; ~时间段:随反应物浓度的下降,速率又变慢 以后反应物中至少有一种消耗完全。
【分析】(1)首先明确横、纵坐标的含义,特别是纵坐标并不是速率,因此从曲线的斜率大小来判断反应的快慢。
(2)一个反应的反应速率的大小受制于若干条件,综合分析每个阶段的主要影响因素。
(3)当反应停止时,收集到的气体体积不再发生变化。
【详解】(1)首先明确横、纵坐标的含义,特别是纵坐标并不是速率,因此从曲线的斜率大小来判断反应的快慢,之前,~时间段的斜率最小,反应最慢。~纵会标升幅最大,故收集到的气体就多;
(2) O~时间段:反应物浓度高,但温度较低,所以速率较慢;~时间段:由于反应放热,温度升高,反应速率变快; ~时间段:随反应物浓度的下降,速率又变慢;
(3)当反应停止时,收集到的气体体积不再发生变化。
17. Ⅳ 研究催化剂对反应速率的影响 其他条件不变,增大反应物浓度、升高温度、加入催化剂,化学反应速率均加快 mol L-1 min-1
【分析】Ⅰ.根据影响反应速率的因素分析;
Ⅱ.根据 计算反应速率,不同物质表示的反应速率比等于系数比。
【详解】Ⅰ.(1)温度越高,反应速率越快;使用催化剂,反应速率加快;反应物浓度越大,反应速率越快。实验①中双氧水浓度最小,没有使用催化剂,温度最低,则在实验①~④中反应速率最小,图中曲线斜率越大,反应速率越快,则代表实验①的为曲线Ⅳ。
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是研究催化剂对反应速率的影响。
(3)根据实验①②可知,增加反应物浓度,反应速率加快;根据实验②③可知,升高反应温度,反应速率加快;根据实验③④可知,使用催化剂,反应速率加快,所以通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度、升高温度、加入催化剂,化学反应速率均加快。
Ⅱ.(4)根据图乙可知,时刻氮气的物质的量为0.50,氮气的浓度变化量为,从开始反应到时刻,氮气的平均反应速率,根据合成氨的反应可知,氨的平均反应速率为。
【点睛】本题考查影响反应速率的因素、反应速率计算,明确反应速率的定义是解题关键,掌握影响反应速率的因素,利用“控制变量法”研究影响反应速率的因素。
18. 温度 ②⑤⑥ d 反应放热使温度升高,加快了化学反应速率 硫酸铜(或CuSO4) 放出气泡的速率明显比②快
【分析】影响化学反应速率的因素有很多,如温度、浓度、压强、催化剂、固体表面积等,探究一个因素对反应速率的影响时用控制变量法保证其他因素相同;(2)中计算反应时间t1时,利用表中数据推出升高温度,反应速率随温度变化的公式进行作答;(3)中反应速率可能同时受多个因素的影响,抓住某时间段内反应速率的主要影响因素进行分析。
【详解】(1)实验中①②③④中锌的质量、形状相同而温度不同,目的是探究温度对反应速率的影响,利用控制变量法探究固体表面积对化学反应速率的影响时需要保证其他因素一致,分析表中第②组、第⑤组、第⑥组其他条件形态,锌的形状不同,表面积不同,故答案为:温度、②⑤⑥;
(2)根据表中①②④三组分析,温度每升高10℃,锌溶解的时间变为原来的一半,即反应速率是原来的两倍,则其他条件不变时,升高温度对反应速率的影响可用公式:×v0表示,则温度从25℃升高到30℃,反应速率×v0= v0,即30℃时反应速率是25℃的倍,则锌溶解完的时间是原来的,则t1=×100=70.7s,a错误;第②组、第⑤组锌、第⑥组其他条件相同,锌的形状不同,反应速率与固体表面积有关,表面积越大,反应速率越快,表面积:粉末>薄片>颗粒,则反应速率⑥>②>⑤,故反应时间:t3<100< t2,b错误;因为反应速率:⑥>②>⑤,故单位时间内消耗锌的质量:⑥>②>⑤,c错误,故答案选:d;
(3)随着反应的进行,盐酸浓度逐渐降低,反应速率逐渐减小,但该反应是放热反应,随着反应的进行温度升高,反应速率加快,则0~t时间内,反应速率主要由温度影响,t过后反应速率主要由盐酸浓度影响,故答案为:反应放热使温度升高,加快了化学反应速率;
(4)根据实验目的是探究化学腐蚀与电化学腐蚀速率的实验,以第②组实验为对照,滴加硫酸铜溶液,锌与硫酸铜发生反应:Zn + Cu2+ = Cu + Zn 2+,生成的Cu单质覆盖在锌片上,形成Cu-Zn原电池,加快产生H2的速率,故答案为:硫酸铜(或CuSO4)、放出气泡的速率明显比②快。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023上·广东深圳·高三深圳第三高中校考期中)某反应过程的能量变化如图所示,下列说法正确的是
A.该反应的ΔH<0
B.该反应需要加热才能发生
C.反应过程Ⅰ的活化能大于 E1
D.反应过程Ⅱ中步骤b为决速步骤
2.(2023上·天津红桥·高三统考期中)已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
A.反应①为放热反应
B.反应②是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.H2(g)+2ICl(g)=I2(g)+2HCl(g) ΔH=-218kJ·mol-1
3.(2023上·山东德州·高三统考期中)一定条件下,可催化在水中发生反应,过程分为两步
i.
ⅱ.
某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是的稀溶液;②③④中是的饱和溶液
(2)四组实验中溶液出现混浊所用时间:①>②>③>④
下列说法错误的是
A.通过实验①②可探究的浓度对反应速率的影响
B.实验①③可证明酸性条件下的催化效果更好
C.实验④开始加入,发生反应ⅱ生成和,加快了反应速率
D.总反应为:
4.(2023上·浙江·高三校联考阶段练习)乙苯与氯气在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如下图所示。下列说法正确的是
A.反应生成相同物质的量的比吸收的热量更多
B.反应刚开始时产物中取代物2所占的比例大于取代物1
C.升温可以提高产物中取代物2所占的比例
D.稳定性:>
5.(2023上·江苏徐州·高三统考阶段练习)可用作反应的催化剂。关于反应的说法正确的是
A.减小浓度能加快反应速率
B.使用催化剂可加快反应的速率
C.使用催化剂可实现原料的100%转化
D.达到化学平衡时,正、逆反应的速率为0
6.(2023上·北京房山·高三北京市房山区房山中学校考期中)单原子催化剂具有良好的电催化性能,催化转化的历程示意图如下:
下列说法不正确的是
A.该转化过程中被还原 B.②→③中断裂的与生成的化学键都是非极性共价键
C.生成,需要转移 D.催化剂的使用,不影响反应焓变
7.(2023上·贵州铜仁·高三贵州省松桃民族中学校考阶段练习)在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确的是
A.该反应是放热反应
B.该反应的反应热△H=-234kJ/mol
C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小
D.由图可推出:NO(g)+CO2(g)NO2(g)+CO(g) △H=+234kJ/mol
8.(2023上·浙江·高三校联考阶段练习)CuCl为白色粉末状固体,难溶于水和乙醇,在潮湿环境中,容易被空气氧化,是一种重要工业原料。工业以硫化铜精矿为原料,制备氯化亚铜的流程如下图所示:
下列说法不正确的是
A.步骤①会产生有毒气体,可用石灰乳吸收
B.步骤②适当增大硫酸浓度、加热可以加快浸出速率
C.步骤③应先加入溶液,再缓慢滴加NaCl溶液
D.步骤④中X可以是无水乙醇
9.(2023上·江苏苏州·高三吴县中学阶段练习)丙烯()与氯化氢反应生成1-氯丙烷()的能量随反应进程的变化如图所示,下列叙述正确的是
A.第Ⅰ和Ⅱ两步反应均为放热反应
B.1molCH3CH=CH2(g)和1molHCl(g)的总键能大于1molCH3CH2CH2Cl(l)总键能
C.与起始总反应物比,产物CH3CH2CH2Cl(l)更稳定
D.使用适当的催化剂能够改变
10.(2023上·浙江嘉兴·高三浙江省海盐高级中学校考阶段练习)在存在下,分解的反应历程为:
①
②
其反应过程的能量变化如图所示,下列说法不正确的是
A.存在改变了双氧水分解的反应历程
B.反应①是吸热反应
C.存在改变了双氧水制氧气的焓变
D.决定总反应速率的是第1步基元反应
11.(2023上·广东广州·高三执信中学校考阶段练习)在含、和的溶液中,发生反应:,其分解机理及反应进程中的能量变化如下:
步骤①:
步骤②:
下列有关该反应的说法正确的是
A.加入可以使反应物分子中活化分子百分数增大
B.该反应的催化剂是
C.步骤②是整个反应的决速步骤
D.若不加,则正反应的活化能比逆反应的大
12.(2023上·辽宁沈阳·高三东北育才学校校考阶段练习)下列各实验装置、目的或结论全都正确的是
实验装置
甲 乙 丙 丁
A.甲用于测定中和反应的反应热
B.乙可验证镁片与稀盐酸反应放热
C.由丙可推断出:反应为吸热反应
D.丁可验证对的分解反应有催化作用
13.(2023上·广东广州·高三广东华侨中学校考阶段练习)和CO是环境污染性气体,可在表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法正确的是
A.总反应的
B.为了实现转化,需不断向反应器中补充和
C.该总反应正反应的活化能小于逆反应的活化能
D.和都是反应的催化剂
14.(2023上·全国·高三期中)一定条件下,可逆反应2AB+3C,在四种状态中处于平衡状态的是
正反应速率 逆反应速率
A vA=2mol/(L min) vB=2mol/(L min)
B vA=2mol/(L min) vC=2mol/(L min)
C vA=1mol/(L min) vB=2mol/(L min)
D vA=1mol/(L min) vC=1.5mol/(L min)
A.A B.B C.C D.D
二、非选择题
15.(2020下·贵州黔西·高三校考期末)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,该反应过程和机理较复杂,一般认为分为以下几步:
①+→+(慢)
②+→IO-+(快)
③5I-+6H++→3I2+3H2O(快)
④I2++H2O→2I-++2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在 离子消耗完时,才会使淀粉变蓝的现象产生。
16.(2021下·高三课时练习)为了研究碳酸钙与稀盐酸的反应速率,一位同学通过测定反应中生成的气体体积随时间变化的情况,绘制出了如图所示的曲线。请分析讨论以下问题:
(1)在0~、~、~各相同的时间段里,反应速率最慢的是 时间段,收集到气体最多的是 时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放出热量的反应) 。
(3)在后,为什么收集到的气体的体积不再增加 ?
17.(2021·高三课时练习)在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
项目 反应物 催化剂 温度
① 10mL10%H2O2溶液 无 25℃
② 10mL20%H2O2溶液 无 25℃
③ 10mL20%H2O2溶液 无 40℃
④ 10mL20%H2O2溶液 1~2滴0.1mol L-1FeCl3溶液 40℃
通过实验得到氧气的体积与时间的关系如图甲所示,回答下列问题:
(1)代表实验①的曲线是 。
(2)对比实验③和④的目的是 。
(3)通过上面对比实验,所得的实验结论是 。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应N2(g)+3H2(g)2NH3(g),测得其中N2的物质的量随时间变化如图乙所示。回答下列问题:
(4)从开始反应到t2时刻,氨的平均反应速率为 。
18.(2021上·山西阳泉·高三统考期末)为探究化学反应速率的影响因素,学生设计了锌与过量的c mol/L 100mL盐酸起反应的实验,得到了下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
① 2.0 薄片 15 200
② 2.0 薄片 25 100
③ 2.0 薄片 30 t1
④ 2.0 薄片 35 50
⑤ 2.0 颗粒 25 t2
⑥ 2.0 粉末 25 t3
(1)上述实验中①②③④是探究 对化学反应速率的影响; (填序号)是探究固体表面积对化学反应速率的影响。
(2)下列说法正确的是 。
a.t1=75s b. 100﹥t2﹥t3
c.单位时间内耗锌的质量⑤﹥⑥﹥②
d.以上都不正确
(3)②中气泡生成的速率与时间的关系大致如图。推测从0到t速率不减反增的原因可能是 。
(4)某同学为了探究化学腐蚀与电化学腐蚀的速率,设计实验与②进行对照。操作如下: 25℃时,另取一个烧杯,放入与实验②完全相同的锌片,先加入2mL某浓度的 溶液,再加入与②相同的盐酸。可以观察到 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由图像可知,此反应为吸热反应ΔH>0, A错误;
B.吸热反应不一定要加热才能进行,B错误;
C.由题干图像信息可知,反应过程Ⅰ的活化能大于E1,C正确;
D.途径Ⅱ中分二步进行,活化能大的反应速率慢,起决定性作用即步骤a为决速步骤,D错误;
故答案为:C。
2.C
【详解】A.根据图像可知,反应①中反应物总能量大于生成物,则反应①为放热反应,A项正确;
B.②中只有I元素的化合价变化,则②是同种元素间发生的氧化还原反应,B项正确;
C.由图可知,反应①中正反应的活化能大,反应②中正反应的活化能小,反应①比反应②的速率慢,C项错误;
D.由图可知,反应的反应物总能量和生成物总能量差值等于218kJ,则该反应的焓变,D项正确;
故选C。
3.B
【详解】A.实验①②中温度和NaI溶液的浓度相同,的浓度不同,可以通过实验①②可探究的浓度对反应速率的影响,故A正确;
B.实验①③中的浓度和H+的浓度都不同,实验①③不能证明酸性条件下的催化效果更好,故B错误;
C.实验④开始加入,发生反应ⅱ生成和,加快了反应速率,故C正确;
D.反应i+2×反应ⅱ可得总反应为:,故D正确;
故选B。
4.C
【详解】A.乙苯与氯气在光照条件下的反应为放热反应,A错误;
B.反应①的活化能更低,所以产物中取代物1所占的比例大于取代物2,B错误;
C.反应②的活化能大,所以升温可以提高产物中取代物2所占的比例,C正确;
D.的能量高,所以其稳定性差,D错误;
故选C。
5.B
【详解】A.减小浓度,反应物浓度减小,反应速率减慢,A错误;
B.催化剂可加快反应速率,故使用催化剂可加快反应的速率,B正确;
C.可逆反应不能实现原料的完全转化,催化剂可加快反应速率,但是不能提高原料的转化率,实现原料的100%转化,C错误;
D.达到化学平衡时,正、逆反应的速率相等,但不为0,D错误;
故选B。
6.B
【详解】A. 酸性条件下,CO2催化转化的产物是CO和H2O,C元素化合价降低,CO2被还原,故A正确;
B. 断裂了C-O键生成了H-O键,断裂的与生成的化学键都是极性共价键,故B错误;
C. 生成,碳元素化合价从+4降低为+2,则需要2mol电子,故C正确;
D. 催化剂只能改变反应速率,不能改变反应的焓变,故D正确;
故选B。
7.C
【详解】A.根据图像可知反应物的总能量高于生成物的总能量,所以是放热反应,A正确;
B.该反应的反应热,B正确;
C.催化剂能降低反应的活化能,但不能改变反应热,C错误;
D.由图可推出:NO(g)+CO2(g)NO2(g)+CO(g) △H=+234kJ/mol,D正确;
答案选C。
8.C
【分析】第①步为硫化铜氧化焙烧,第②步为硫酸浸出,得到硫酸铜溶液,第3步硫酸铜、亚硫酸钠和氯化钠反应生成氯化亚铜沉淀,第④步用盐酸、乙醇洗涤后得到氯化亚铜固体。
【详解】A.步骤①会产生二氧化硫有毒气体,可用石灰乳吸收,A正确;
B.硫酸浓度增大,反应速率加快,能加快浸出速率,适当加热也能加快浸出速率,B正确;
C.步骤③中Cu2+被Na2SO3还原生成Cu+,为防止Cu+再次被空气氧化,不能缓慢滴加NaCl溶液,C错误;
D.无水乙醇可洗去水,加快干燥速度,防止CuCl在潮湿环境中被空气氧化,D正确;
故选C。
9.C
【详解】A.第Ⅰ步反应反应物的总能量小于生成物的总能量,为吸热反应,第Ⅱ步反应反应物的总能量大于生成物的总能量,为放热反应,A错误;
B.由图可知,该反应放热,焓变为负,焓变等于断裂化学键吸收的能量减去成键释放的能量,则1molCH3CH=CH2(g)和1molHCl(g)的总键能小于1molCH3CH2CH2Cl(l)总键能,B错误;
C.已知物质具有的总能量越低,物质越稳定,由题干反应历程图可知,1molCH3CH=CH2(g)和1molHCl(g)的总能量大于1molCH3CH2CH2Cl(l),故与起始总反应物比,产物CH3CH2CH2Cl(l)更稳定,C正确;
D.催化剂不改变反应的始终态,则催化剂能够改变反应途径、降低反应的活化能,而反应的焓变不变,D错误;
故答案为:C。
10.C
【详解】A.由图可知,碘离子是反应的催化剂,改变了双氧水分解的反应历程,降低了反应的活化能,故A正确;
B.由图可知,反应①是反应物总能量小于生成物总能量的吸热反应,故B正确;
C.由图可知,碘离子是反应的催化剂,改变了双氧水分解的反应历程,降低了反应的活化能,但双氧水制氧气的焓变不变,故C错误;
D.由图可知,第1步基元反应的活化能大于第2步基元反应,反应的活化能越大,反应速率越慢,总反应速率取决于慢反应,所以决定总反应速率的是第1步基元反应,故D正确;
故选C。
11.A
【详解】A.Fe3+是该反应的催化剂,催化剂能降低反应的活化能,提高活化分子百分数,故A正确;
B.由反应机理可以看出,Fe3+是该反应的催化剂,Fe2+是该反应的中间产物,故B错误;
C.步骤①的活化能大于步骤②,所以步骤①为慢反应,为决速步反应,故C错误;
D.此反应整体为放热反应,正反应的活化能小于逆反应的活化能,加入催化剂不改变反应热,故D错误。
答案选A。
12.B
【详解】A.图中缺少玻璃搅拌器,不能搅拌,则不能准确测定中和热,故A错误;
B.Mg与盐酸反应放热,使饱和石灰水的温度升高,石灰水变浑浊,可验证镁片与稀盐酸反应放热,故B正确;
C.热水中颜色深,可知升高温度平衡向生成二氧化氮的方向移动,则反应2NO2(g) N2O4(g)为放热反应,故C错误;
D.右侧试管的温度高,且加催化剂,两个变量,不能验证FeCl3对H2O2的分解反应有催化作用,故D错误;
故选:B。
13.C
【详解】A.①;②;根据盖斯定律:①+②得,故A错误;
B.反应过程中和参与反应后又生成,不需向反应器中再补充和,故B错误;
C.该反应正反应的活化能为,逆反应的活化能为,正反应的活化能小于逆反应活化能,故C正确;
D.是该反应的催化剂,是该反应的中间体,故D错误;
答案选C。
14.D
【详解】A.A物质的正反应速率υA=2mol/( L·min),逆反应速率υB=2mol/( L·min),则逆反应速率υA=4mol/( L·min),A的正逆反应速率不相等,所以该反应未达到平衡状态,选项A错误;
B.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L·min),C的逆反应速率为2mol/( L·min),A的逆反应速率为mol/(L·min),所以A的正逆反应速率不等,选项B错误;
C.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1mol/( L·min),B的逆反应速率为2mol/( L·min),A的逆反应速率为4mol/(L·min),所以A的正逆反应速率不等,选项C错误;
D.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1mol/(L·min),C的逆反应速率为1.5mol/(L·min),A的逆反应速率为1mol/( L·min),所以A的正逆反应速率相等,选项D正确;
答案选D。
15. ①
【详解】(1)一个化学反应的总的反应速率是由慢反应速率决定的,根据上述条件推测,此反应的总的反应速率由①步反应决定;
(2)由反应机理可知,该反应①是和反应,且为慢反应,而反应④是I2和反应,为快反应,由此说明I2和反应比和反应更快,故若预先加入淀粉溶液,由反应过程看必在离子消耗完时,才会使淀粉变蓝的现象产生。
16. ~ ~ O~时间段:反应物浓度高,但温度较低,所以速率较慢;~时间段:由于反应放热,温度升高,反应速率变快; ~时间段:随反应物浓度的下降,速率又变慢 以后反应物中至少有一种消耗完全。
【分析】(1)首先明确横、纵坐标的含义,特别是纵坐标并不是速率,因此从曲线的斜率大小来判断反应的快慢。
(2)一个反应的反应速率的大小受制于若干条件,综合分析每个阶段的主要影响因素。
(3)当反应停止时,收集到的气体体积不再发生变化。
【详解】(1)首先明确横、纵坐标的含义,特别是纵坐标并不是速率,因此从曲线的斜率大小来判断反应的快慢,之前,~时间段的斜率最小,反应最慢。~纵会标升幅最大,故收集到的气体就多;
(2) O~时间段:反应物浓度高,但温度较低,所以速率较慢;~时间段:由于反应放热,温度升高,反应速率变快; ~时间段:随反应物浓度的下降,速率又变慢;
(3)当反应停止时,收集到的气体体积不再发生变化。
17. Ⅳ 研究催化剂对反应速率的影响 其他条件不变,增大反应物浓度、升高温度、加入催化剂,化学反应速率均加快 mol L-1 min-1
【分析】Ⅰ.根据影响反应速率的因素分析;
Ⅱ.根据 计算反应速率,不同物质表示的反应速率比等于系数比。
【详解】Ⅰ.(1)温度越高,反应速率越快;使用催化剂,反应速率加快;反应物浓度越大,反应速率越快。实验①中双氧水浓度最小,没有使用催化剂,温度最低,则在实验①~④中反应速率最小,图中曲线斜率越大,反应速率越快,则代表实验①的为曲线Ⅳ。
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是研究催化剂对反应速率的影响。
(3)根据实验①②可知,增加反应物浓度,反应速率加快;根据实验②③可知,升高反应温度,反应速率加快;根据实验③④可知,使用催化剂,反应速率加快,所以通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度、升高温度、加入催化剂,化学反应速率均加快。
Ⅱ.(4)根据图乙可知,时刻氮气的物质的量为0.50,氮气的浓度变化量为,从开始反应到时刻,氮气的平均反应速率,根据合成氨的反应可知,氨的平均反应速率为。
【点睛】本题考查影响反应速率的因素、反应速率计算,明确反应速率的定义是解题关键,掌握影响反应速率的因素,利用“控制变量法”研究影响反应速率的因素。
18. 温度 ②⑤⑥ d 反应放热使温度升高,加快了化学反应速率 硫酸铜(或CuSO4) 放出气泡的速率明显比②快
【分析】影响化学反应速率的因素有很多,如温度、浓度、压强、催化剂、固体表面积等,探究一个因素对反应速率的影响时用控制变量法保证其他因素相同;(2)中计算反应时间t1时,利用表中数据推出升高温度,反应速率随温度变化的公式进行作答;(3)中反应速率可能同时受多个因素的影响,抓住某时间段内反应速率的主要影响因素进行分析。
【详解】(1)实验中①②③④中锌的质量、形状相同而温度不同,目的是探究温度对反应速率的影响,利用控制变量法探究固体表面积对化学反应速率的影响时需要保证其他因素一致,分析表中第②组、第⑤组、第⑥组其他条件形态,锌的形状不同,表面积不同,故答案为:温度、②⑤⑥;
(2)根据表中①②④三组分析,温度每升高10℃,锌溶解的时间变为原来的一半,即反应速率是原来的两倍,则其他条件不变时,升高温度对反应速率的影响可用公式:×v0表示,则温度从25℃升高到30℃,反应速率×v0= v0,即30℃时反应速率是25℃的倍,则锌溶解完的时间是原来的,则t1=×100=70.7s,a错误;第②组、第⑤组锌、第⑥组其他条件相同,锌的形状不同,反应速率与固体表面积有关,表面积越大,反应速率越快,表面积:粉末>薄片>颗粒,则反应速率⑥>②>⑤,故反应时间:t3<100< t2,b错误;因为反应速率:⑥>②>⑤,故单位时间内消耗锌的质量:⑥>②>⑤,c错误,故答案选:d;
(3)随着反应的进行,盐酸浓度逐渐降低,反应速率逐渐减小,但该反应是放热反应,随着反应的进行温度升高,反应速率加快,则0~t时间内,反应速率主要由温度影响,t过后反应速率主要由盐酸浓度影响,故答案为:反应放热使温度升高,加快了化学反应速率;
(4)根据实验目的是探究化学腐蚀与电化学腐蚀速率的实验,以第②组实验为对照,滴加硫酸铜溶液,锌与硫酸铜发生反应:Zn + Cu2+ = Cu + Zn 2+,生成的Cu单质覆盖在锌片上,形成Cu-Zn原电池,加快产生H2的速率,故答案为:硫酸铜(或CuSO4)、放出气泡的速率明显比②快。
答案第1页,共2页
答案第1页,共2页
同课章节目录
