2024届高三新高考化学大一轮专题复习--化学反应原理综合题(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题复习--化学反应原理综合题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 12:43:57 | ||
图片预览



文档简介
2024届高三新高考化学大一轮专题复习--化学反应原理综合题
1.(2022·四川南充·统考二模)实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。
甲醇的制备原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为 。
(2)甲醇的制备反应一般认为通过如下两步来实现:
①CO2(g)+H2(g) CO(g)+H2O(g)kJ/mol
②CO(g)+2H2(g) CH3OH(g)kJ/mol
根据盖斯定律,该反应的 kJ·mol-1,反应能在 (填“高温”或“低温”)自发进行。
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)= 。
②该温度下的平衡常数K= (mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图象正确的是 。
(4)我国科学家制备了一种ZO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(S)随温度的变化曲线如图。
①生成CH3OH的最佳温度约为 。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因: 。
(5)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g) HCOOH(g)<0。在一容积固定的密闭容器中进行反应,实验测得:,、为速率常数。温度为T1℃时,该反应K=2,温度为T2℃时,,则T2℃时平衡压强 (填“>”“<”或“=”)T1℃时平衡压强,理由是 。
2.(2023·浙江·统考高考真题)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
该反应分两步完成:
请回答:
(1) 。
(2)恒定总压和水碳比[]投料,在不同条件下达到平衡时和的分压(某成分分压=总压×该成分的物质的量分数)如下表:
条件1 0.40 0.40 0
条件2 0.42 0.36 0.02
①在条件1下,水煤气变换反应的平衡常数 。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式 。
(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入
B.恒定水碳比,增加体系总压可提高的平衡产率
C.通入过量的水蒸气可防止被进一步还原为
D.通过充入惰性气体增加体系总压,可提高反应速率
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。
①在催化剂活性温度范围内,图2中b-c段对应降温操作的过程,实现该过程的一种操作方法是 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出平衡转化率随温度变化的曲线 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是 。
3.(2023·北京·统考高考真题)尿素合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银与在一定条件下反应制得,实现了由无机物到有机物的合成。该反应的化学方程式是 。
(2)二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.和生成;
ⅱ.分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是 (填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.
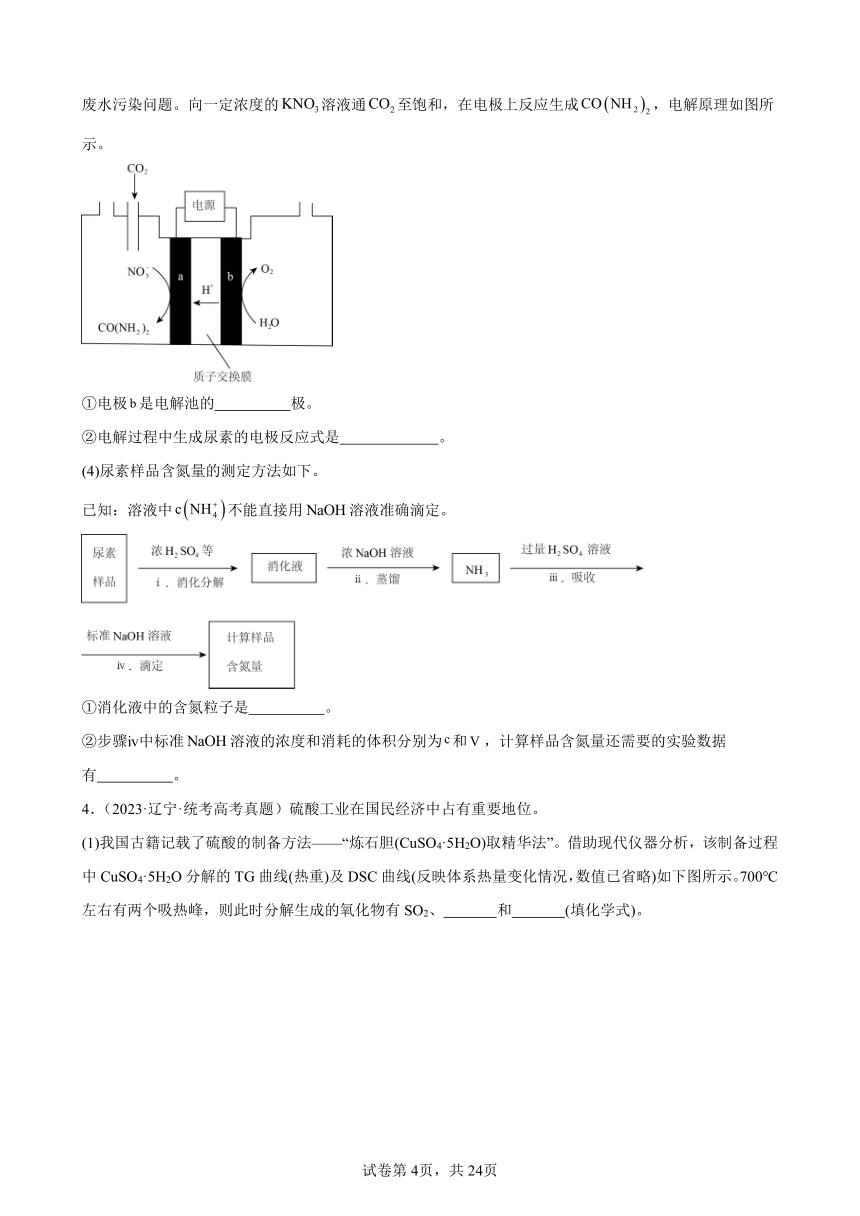
(3)近年研究发现,电催化和含氮物质(等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成,电解原理如图所示。
①电极是电解池的 极。
②电解过程中生成尿素的电极反应式是 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中不能直接用溶液准确滴定。
①消化液中的含氮粒子是 。
②步骤ⅳ中标准溶液的浓度和消耗的体积分别为和,计算样品含氮量还需要的实验数据有 。
4.(2023·辽宁·统考高考真题)硫酸工业在国民经济中占有重要地位。
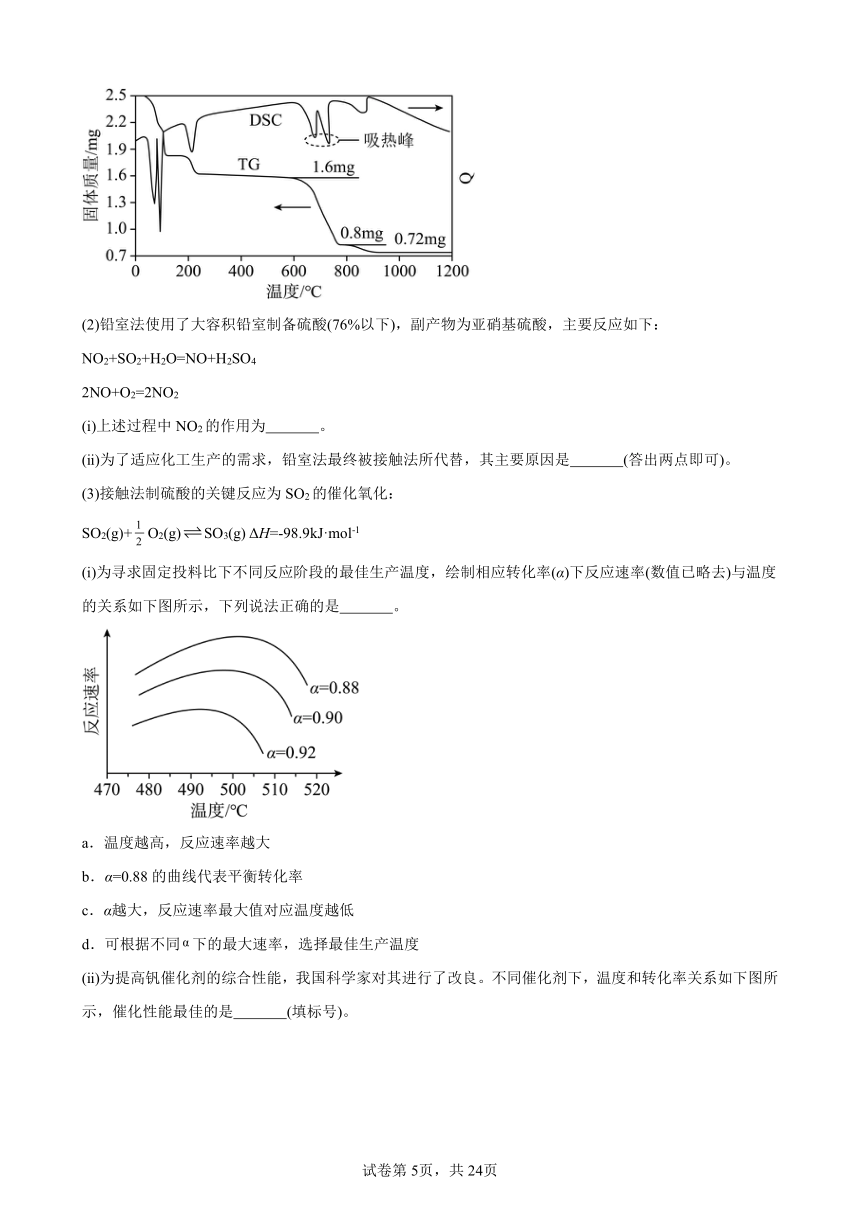
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、 和 (填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为 。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是 (答出两点即可)。
(3)接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是 。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp= (用平衡分压代替平衡浓度计算)。
5.(2023·山东济南·统考三模)二氧化碳捕集利用与封存、甲烷重整是实现“双碳”目标的重要途径。回答下列问题:
Ⅰ.化学家通过理论计算与研究,提出含氧空位的氧化铜对加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。加氢选择合成甲醇的主要反应如下:
①
②
③
298K时,测得键能数据如下表所示。
化学键 C=O() C-O C-H O-H H-H
键能 803 326 414 464 436
(1)有利于反应①自发进行的条件是 (填“高温”或“低温”); ,有利于提高甲醇产率的措施有 (至少回答2条)。
(2)将与按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。
A.容器体积不再发生改变
B.
C.混合气体的平均相对分子质量不再改变
D.某时刻测得与的物质的量之比为3:1
Ⅱ.甲烷重整工艺主要包括甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的主要反应为④ 。若将与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为,在条件下与p的关系、在条件下与t的关系如图a所示。当CO的平衡转化率为时,反应条件可能是 ;210℃条件下,反应④的压强平衡常数 (保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。
(4)与重整制氢主要反应为⑤,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式(为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为 。
6.(2023·江西宜春·江西省宜丰中学校考模拟预测)将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
(1)已知:①2H2(g)+O2(g)2H2O(g) ΔH= 484 kJ mol 1
②2CH3OH(g)+ 3O2(g) 2CO2(g)+4H2O(g) ΔH = 1353 kJ mol 1
则CO2(g)+ 3H2(g) CH3OH(g)+H2O(g) ΔH = kJ mol 1.
(2)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ mol 1.在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[(CH3OH)%= ×100%]随着温度变化关系如下图所示。
①分析温度高于236°C时图中曲线下降的原因 。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244°C时反应生成CH3OH的物质的量为 mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp= 。 (列出计算式即可)
7.(2023·陕西咸阳·统考三模)用CO还原N2O,实现无害化处理是环境治理的一个重要方法:N2O(g)+CO(g)N2(g)+CO2(g)ΔH。回答下列问题:
(1)已知:i.2CO(g)+O2(g)2CO2(g)ΔH1
ii.2N2O(g)2N2(g)+O2(g)ΔH2
ΔH= (用含ΔH1、ΔH2的式子表示)。
(2)N2O和CO在Fe+作用下的反应分两步进行:
反应I:Fe++N2O→FeO++N2
反应Ⅱ:FeO++CO→Fe++CO2
反应过程的能量变化如图所示:
①决定总反应速率的是 (填“反应I”或“反应Ⅱ”)。
②对于反应N2O(g)+CO(g)N2(g)+CO2(g),下列说法正确的是 (填字母)。
A.Fe+是催化剂,能降低反应的焓变
B.升高温度,N2O的平衡转化率减小
C.降低反应温度,反应平衡常数不变
D.上述反应过程中断裂离子键和极性键
(3)N2O(g)+CO(g)N2(g)+CO2(g)的速率方程为v正=k正c(CO) c(N2O),v逆=k逆c(O2) c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
①反应速率Δv等于正、逆反应速率之差。平衡时,Δv(500K) Δv(550K)(填“>”或“=”)。
②该反应的平衡常数为K,在图中画出pK(pK=-lgK)随温度的倒数()的变化曲线 。
(4)在473K时,向恒容密闭容器中充入amolCO和amolN2O,发生上述反应,平衡时N2O的体积分数为25%,该温度下的平衡常数的数值为 。
(5)已知500℃时,CaC2O4(s)CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g)N2(g)+CO2(g)的平衡常数Kp= (用含e、b、c的式子表示)。
8.(2023·浙江·校联考模拟预测)工业上,以为原料,通过不同反应生产更高价值的。
I.直接分解生产:
反应①:
反应②:
请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol (g)(仅考虑发生上述反应)。某时刻转化率为20%,选择性为40%,则该时刻反应①的浓度商 。
(2)下列说法正确的是_______。
A.反应①能自发进行的条件是低温
B.温度升高,反应②的平衡常数增大
C.压强增大,活化分子百分数增多,导致反应①速率加快
D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态
(3)研究表明,在固体催化剂N存在下,反应①分三步进行,生成步骤的活化能远大于生成步骤的活化能,且开始一段时间内与的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图 。
II.辅助生产:
反应③:
恒温恒压下,和按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
(4)关于反应过程,下列说法正确的是_______。
A.M可循环利用, 不可循环利用
B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂
C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快
D.其他条件不变,更换不同催化剂,同样生产1mol (g)所需能量不一定相同
(5)对该反应器催化剂表面上CO的生成速率和的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和的消耗速率不相等的可能原因 。
9.(2023·广西·统考三模)以CO2为原料合成CH3OH和CH3OCH3是实现碳中和的重要途径之一、一定条件下,有关反应如下:
反应I.CO2(g) +3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.0 kJ ·mol-1
反应Ⅱ.2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-25.0 kJ ·mol-1
反应Ⅲ.CO2(g)+ H2(g)CO(g)+H2O(g) ΔH3=+41.2kJ ·mol-1
回答下列问题:
(1)反应2CO2 (g) + 6H2 (g)CH3OCH3 (g)+3H2O(g)的△H= 。
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的反应历程如图所示。
图中反应②的化学方程式为 。在反应气中适当加入少量的水能够增大甲醇的产率,原因是 。
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、二甲醚的物质的量分数的影响如图所示。
温度600K以下,甲醇的物质的量分数变化的可能原因是 。一定温度下,增大压强,二甲醚的物质的量分数 (填“增大”“减小”或“不变”)。
(4)在5MPa下,CO2和H2按物质的量之比为1:3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。
①图中n代表的物质是 。
②150~400°C范围内,随着温度升高,H2O的平衡产量的变化趋势是 。
③270 °C时,CH3OH的分压为 MPa(保留2位小数);反应Ⅲ的平衡常数K= (Kp为以分压表示的平衡常数,分压=总压 ×物质的量分数。保留3位小数)。
10.(2023·重庆沙坪坝·重庆南开中学校考模拟预测)天然气是一种重要的化工原料,现代工业中常用天然气生产氢气、一氧化碳、甲醇等高附加值化学品,或是将其用于燃料电池。
(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.
Ⅱ.
Ⅲ.
①反应Ⅱ在 (填“高温”、“低温”或“任何温度”)下为自发反应,反应Ⅲ的反应热 。
②已知反应I的正、逆反应活化能分别为,反应Ⅱ的正、逆反应活化能分别为,则 (填“>”、“<”或“=”)。
③在一定条件下,向恒容密闭容器中通入1mol和2mol,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是 (填序号)。
A.
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D.与的物质的量之比不再改变
④一定条件下,向体积为VL的恒容密闭容器中通入1mol和1mol,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中和的物质的量均为0.2mol,此时CO的浓度为 ,反应Ⅲ的平衡常数为 。
(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入,时刻,已消耗的体积为67.2L(标准状况下),继续通入,此时负极的电极反应式为 ;若向时刻的溶液中加入 molKOH并将溶液混匀,可使溶液中只含有一种溶质。
11.(2023·北京海淀·101中学校考三模)用纳米Fe/Ni复合材料能去除污染水体的,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO分两步,将步骤ii补充完整: 。
i. +Fe+2H+=+Fe2++H2O
ii.______+______+H+=Fe2++______+______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因 。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图所示。(注:为初始时NO的浓度。)
①为达到最高去除率,应调水体的初始pH= 。
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是 。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是 。
(5)利用电解无害化处理水体中的NO,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为 。
②生成N2的离子方程式为 。
12.(2023·新疆·统考三模)深入研究含碳、氮元素的物质转化有着重要的实际意义,合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g) ΔH=-87.0kJ ·mol-1。
(1)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2mol的NH3和0.1mol的CO2,若达平衡时等温等容容器中CO(NH2)2的质量分数为a%,绝热等容容器中CO(NH2)2的质量分数为b%,则a b(填“大于”“小于”或“等于”)。
(2)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。电解装置如图所示,熔融NaOH-KOH为电解液,Fe2O3在发生电极反应时生成中间体Fe。惰性电极I的电极反应为 , 生成氨气的反应:2Fe+N2 +3H2O(g)=Fe2O3+2NH3。
(3)如图是上述反应合成尿素的机理及能量变化(单位:kJ·mol-1) ,TS表示过渡态。
该反应历程中,起决速步骤的方程式是 。若 ΔE1=66.5 kJ·mol-1,则 ΔE2= kJ·mol-1。
(4)在T1℃和T2℃时(T1
(5)已知:Arrhenius经验公式为Rlnk=-+C(Ea为活化能,k为速率常数,R和C为常数)。实验探究Catl、Cat2两种催化剂的催化效能,获得如图曲线。则催化效能较高的催化剂是 (填“Catl”或“Cat2”),判断依据是 。
13.(2023·福建三明·统考模拟预测)与在固载金属催化剂(M)上可发生以下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:……
可能的机理如图所示:
(1)写出反应ⅲ的化学方程式: 。
(2)已知298K时下列几种物质的标准生成焓。
[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]
物质 (g) (g) HCHO(g) (g)
标准生成焓/ -393.5 -242 -115.9 0
则反应ⅱ的 。
(3)向一装有催化剂的反应容器中通入和,维持体系压强为p MPa,只发生反应ⅰ和ⅱ,测得不同投料比下的平衡转化率随温度变化的曲线如图甲所示;时,HCHO和HCOOH的选择性随温度的变化曲线如图乙所示。
已知:物质B的选择性
①图甲中x (填“>”、“<”或“=”)3,理由是 。
②下列说法正确的是 (填标号)。
A.当容器中气体密度不再变化时,体系处于平衡状态
B.体系达平衡时,若分离出部分,反应ⅱ的平衡常数值将增大
C.若充入稀有气体,体系重新达平衡时HCHO的物质的量会减少
D.升高温度,反应ⅰ的增大,减小
③P点对应的体系中消耗了2.7mol ,则体系中充入的 mol,此时反应ⅰ的平衡常数 。(列出计算式即可)为以分+压表示的平衡常数,分压=总压×物质的量分数)。
14.(2023·福建宁德·统考模拟预测)乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下,,,则 。
(2)在恒压密闭容器中充入合成气,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
温度T/K 298.15 300 354.7 400
压强P/kPa 5.73 6.38 49.27 260.99
反应Ⅰ平衡常数K 1
则 (填“>”或“<”)0,随着温度升高所需压强增大的原因是 。
(3)在2L刚性容器中充入合成气,总压,温度473K,催化剂(含)下进行反应。
①测得和的时空收率分别为和(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用表示的反应速率为 。
②平衡时,若和体积分数相等,的分压为,则的选择性为 ,反应Ⅰ的平衡常数 (用含x的式子表示)。(已知:的选择性;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
图1(TS表示过渡态,*表示吸附在催化剂表面)
图2
结合图1,图2,从速率角度解释CO分压增大选择性升高的原因 。
15.(2023·四川南充·统考三模)自“十四五规划”提出氮氧化物减排目标,烟气脱硝成为新型科研热点。其反应原理为:
反应I:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH<0
反应Ⅱ:6NO(g)+4NH3(g)5N2(g)+6H2O(g)
(1)相关化学键的键能如表所示,则反应Ⅱ的正反应与逆反应活化能之差为 。
化学键 N≡O(NO气体) N-H N≡N H-O
键能/(kJ mol-1) 630 391 946 465
(2)在密闭体系中进行上述实验,一定条件下,测得不同温度下的相同时间内各组分含量如图1所示(部分反应物未画出)。
①温度小于500℃,随着温度的升高,N2的含量上升的原因是 。
②分析图像可知该容器内还发生了其它副反应,理由是 。
(3)烟气脱硝过程通常使用Vx/Ti作催化剂,实验室向1L密闭容器中充入4molNO、4molNH3和1molO2,发生反应I和反应Ⅱ,采用催化剂V0.5/Ti和V7/Ti测得不同温度下,NO转化率如图2所示。
①工业生产中最佳适宜条件为 ;在最佳适宜条件下进行反应,达平衡后,既能增大NO的平衡转化率又能加快反应速率的措施是 (填字母标号)。
A.升高温度 B.移去N2 C.充入氩气 D.充入2molNH3
②若恒温时,向体系再通入1molO2,则Kp(Ⅰ)/Kp(Ⅱ)的值将 (填“增大”“减小”或“不变”)。
③图中A点时(若A点为平衡状态),初始压强为90kPa,平衡时N2的物质的量为3.7mol,平衡时容器中NO的分压为 ,则反应Ⅱ的标准平衡常数K= 。(列计算式)已知K=,其中pθ为标准压强(100kPa),p(N2)、p(H2O)、p(NO)、p(NH3)为各组分的平衡分压}
16.(2023·广东·广州市第二中学校联考三模)人体内的血红蛋白(Hb)与肌红蛋白(Mb)均可结合,血红蛋白(Hb)与结合的过程存在如下反应:
①
②
③
回答下列问题:
(1) 0(填“>”“<”), (用、表示)
(2)科研人员仅对于反应①进行模拟研究发现,37℃,pH=7.4时氧气分压与达到平衡时与的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为 (在下图中绘出)。
(3)已知:气液平衡体系中,例如平衡常数表达式为:。则37℃,pH=7.4时,反应①的平衡常数为
(4)高压氧舱常用于CO中毒治疗。若控制氧分压为80kPa,则37℃,pH=7.4时,达到平衡时与氧气的结合度α(转化率)为 %(保留一位小数)。
(5)血液中还同时存在反应④:,则氧分压 (填“高”或“低”)有利于排出体外。
(6)血液向肌肉细胞输送氧气时还存在反应⑤:,由向肌肉细胞快速提供氧气。正常人Mb含量为,Hb含量为。下列说法正确的是___________。
A.Hb结合氧气的能力强于Mb
B.高氧分压下,血液中浓度增加
C.高海拔居民体内Mb的含量偏高
D.肌肉细胞中Mb浓度不变时,氧气运输达平衡
17.(2023·广东深圳·翠园中学校考模拟预测)我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将转化为高附加值化学品成为科学家研究的重要课题。异丁烯作为汽油添加剂的主要成分,可利用异丁烷与反应来制备。
反应I:
反应II:
已知:
回答下列问题:
(1)已知:异丁烷,异丁烯,CO的燃烧热热化学方程式的焓变分别为,,,则 (用题目给的反应焓变来表示)
(2)向恒容密闭容器中加入和,利用反应Ⅰ制备异丁烯。已知。已知正反应速率表示为,逆反应速率表示为,其中、为速率常数。
①图中能够代表的曲线为 (填“”“”“”或“”)。
②温度为时,该反应化学平衡常数 ,平衡时转化率 50%(填“>”、“=”、“<”)。
(3)重整技术是实现“碳中和”的一种理想的利用技术,反应为:。在时,将和按物质的量之为充入密闭容器中,分别在无催化剂及催化下反应相同时间,测得的转化率与温度的关系如图所示:
①a点转化率相等的原因是 。
②在、900℃、催化条件下,将、、按物质的量之比为充入密闭容器,的平衡转化率为,此时平衡常数 (以分压表示,分压=总压×物质的量分数;写出含、n、p的计算表达式)。
(4)相比于反应II直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应相比于异丁烷直按脱氢制备丁烯。从产率角度分析该方法的优点是 。
(5)利用电化学可以将有效转化为,装置如图所示。
装置工作时,阴极除有生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是 ,标准状况下,当阳极生成的体积为时,测得阴极区内的,则电解效率为 。(忽略电解前后液体积的变化)
已知:电解效率=×100%。
18.(2023·湖北荆门·荆门市龙泉中学校联考二模)工业烟气中常含有NOx(NO、NO2)。用NaClO溶液将NOx氧化为,实现烟气中NOx的脱除。
(1)NOx在大气中会形成酸雨。形成酸雨的过程中,NO表现 性。
(2)向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
已知:NOx脱除率=×100%
①不用盐酸调节NaClO溶液初始pH的原因是 。
②将pH=3.5时NaClO溶液脱除NO的离子方程式(可逆)为 。
③pH<5.5时,分析NOx脱除率随溶液初始pH升高而增大的可能原因: 。
(3)用CrO3分别将脱除前后的NOx全部转化为NO2,并用库仑仪测定NO2的量,可计算NOx脱除率。库仑仪工作的原理和装置如下:
检测前,电解质溶液中的保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
①NO2在电解池中被I-还原为NO的离子方程式为 。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。NOx脱除率是 。
③测量结束后,电解池中还检测到少量和,这将导致NO2测定结果 (填“偏高”或“偏低”),需进行校正。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)NH3·H2O+ CO2=NH+HCO
(2) —49 低温
(3) 0.225mol(L·min) 5.3 AC
(4) 320℃ 温度升高,反应速率加快,CO2转化率增大,但CH3OH的选择性降低,副反应也增多,CH3OH的含量降低
(5) > 该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的体积分数增大,压强增大
【详解】(1)由题意可知,浓氨水与二氧化碳反应生成碳酸氢铵,反应的离子方程式为NH3·H2O+ CO2=NH+HCO,故答案为:NH3·H2O+ CO2=NH+HCO;
(2)由盖斯定律可知,反应①+②得到二氧化碳转化为甲醇的反应,反应△H=△H1+△H2=(+41kJ/mol)+(—90kJ/mol)=—49 kJ/mol,该反应为熵减的放热反应,低温条件下,反应△H—T△S<0,反应能自发进行,故答案为:—49;低温;
(3)10min时测得二氧化碳和甲醇的体积分数之比变为1:3且比值不再随时间变化可知反应达到平衡,设平衡时生成甲醇的浓度为amol/L,由题意可建立如下三段式:
由二氧化碳和甲醇的体积分数之比变为1:3可得:3(1—a)=a,解得a=0.75;
①由三段式数据可知,反应开始到平衡时氢气的反应速率为=0.225mol(L·min),故答案为:0.225mol(L·min);
②由三段式数据可知,该温度下的平衡常数K=≈5.3,故答案为:5.3;
③该反应为放热反应,升高温度,化学反应速率增大,反应达到平衡后,平衡向逆反应方向移动,化学平衡常数减小、甲醇的浓度增大、氢气的体积分数增大,故选AC;
(4)①由图可知,温度为320℃时,甲醇的选择性较高、二氧化碳转化率较高,则生成甲醇的最佳温度约为320℃,故答案为:320℃;
②温度升高,二氧化碳转化率升高,但产物甲醇含量降低说明温度升高,反应速率加快,二氧化碳转化率增大、甲醇的选择性降低,甲醇的选择性降低导致副反应也增多,甲醇的含量降低,故答案为:温度升高,反应速率加快,CO2转化率增大,但CH3OH的选择性降低,副反应也增多,CH3OH的含量降低;
(5)该反应为气体体积减小放热反应,升高温度,平衡向逆反应方向移动,由温度为T2℃时,可得平衡常数K==1.9,平衡常数小于温度为T1℃时说明T1小于T2,T1℃时气体的体积分数小于T2℃时,压强小于T2℃时,故答案为:>;该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的体积分数增大,压强增大。
2.(1)6
(2) 2 CO+3H2 CH4+H2O
(3)AC
(4) AC
(5)温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小
【详解】(1)设方程式①
②
③
根据盖斯定律可知,③=①-②,则;
(2)①条件1下没有甲烷生成,只发生了水煤气变换反应,该反应是一个气体分子数不变的反应。设在条件1下平衡时容器的总体积为V,水蒸气和一氧化碳的投料分别为12mol和5mol,参加反应的一氧化碳为xmol,根据已知信息可得以下三段式:
,解得x=4;
则平衡常数;
②根据表格中的数据可知,有甲烷生成,且该副反应没有二氧化碳参与,且氢气的产率降低,则该方程式为:CO+3H2 CH4+H2O;
(3)A.一氧化碳和氢气都可以和氧气反应,则通入反应器的原料气中应避免混入,A正确;
B.该反应前后气体计量系数相同,则增加体系总压平衡不移动,不能提高平衡产率,B错误;
C.通入过量的水蒸气可以促进四氧化三铁被氧化为氧化铁,水蒸气不能将铁的氧化物还原为单质铁,但过量的水蒸气可以降低体系中CO和H2的浓度,从而防止铁的氧化物被还原为单质铁,C正确;
D.若保持容器的体积不变,通过充入惰性气体增加体系总压,反应物浓度不变,反应速率不变,D错误;
故选AC;
(4)①A.按原水碳比通入冷的原料气,可以降低温度,同时化学反应速率稍减小,导致CO的转化率稍减小,与图中变化相符,A正确;
B.喷入冷水(蒸气),可以降低温度,但是同时水蒸气的浓度增大,会导致CO的转化率增大,与图中变化不符,B错误;
C.通过热交换器换热,可以降低温度,且不改变投料比,同时化学反应速率稍减小,导致CO的转化率稍减小,与图中变化相符,C正确;
故选AC;
②增大水蒸气的浓度,平衡正向移动,则一氧化碳的的平衡转化率增大,会高于原平衡线,故图像为: ;
(5)反应物分子在催化剂表面的吸附是一个放热的快速过程,温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小。
3.(1)
(2)ab
(3) 阳
(4) 样品的质量、步骤Ⅲ所加入溶液的体积和浓度
【详解】(1)根据原子守恒分析,二者反应生成尿素和氯化银,化学方程式是。答案为;
(2)a.反应ⅰ的活化能是,反应ⅱ活化能是,,a项正确;
b.从图中反应物和生成物能量的相对大小可看出反应ⅰ放热,反应ⅱ吸热,b项正确;
c.总反应的:,c项错误;
故选ab。
(3)①电极b上发生失电子生成的氧化反应,是电解池的阳极。②a极硝酸根离子得电子转化为尿素,再结合酸性环境可分析出电极反应式为。答案为阳极;;
(4)①尿素消化分解生成和,由于反应中存在浓,则消化液中含氮粒子为。②除了已知数据外,还需要的是样品的质量、步骤ⅲ所加入溶液的体积和浓度。答案为;样品的质量、步骤Ⅲ所加入H2SO4溶液的体积和浓度。
4.(1) CuO SO3
(2) 催化剂 反应中有污染空气的NO和NO2放出影响空气环境、NO2可以溶解在硫酸中给产物硫酸带来杂质、产率不高(答案合理即可)
(3) cd d
【详解】(1)根据图示的热重曲线所示,在700℃左右会出现两个吸热峰,说明此时CuSO4发生热分解反应,从TG图像可以看出,质量减少量为原CuSO4质量的一半,说明有固体CuO剩余,还有其他气体产出,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO43CuO+2SO2↑+SO3↑+O2↑,结合反应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO2、SO3、O2,故答案为CuO、SO3。
(2)(i)根据所给的反应方程式,NO2在反应过程中线消耗再生成,说明NO2在反应中起催化剂的作用;
(ii)近年来,铅室法被接触法代替因为在反应中有污染空气的NO和NO2放出影响空气环境、同时作为催化剂的NO2可以溶解在硫酸中给产物硫酸带来杂质影响产品质量、产率不高(答案合理即可)。
(3)(i)a.根据不同转化率下的反应速率曲线可以看出,随着温度的升高反应速率先加快后减慢,a错误;
b.从图中所给出的速率曲线可以看出,相同温度下,转化率越低反应速率越快,但在转化率小于88%的时的反应速率图像并没有给出,无法判断α=0.88的条件下是平衡转化率,b错误;
c.从图像可以看出随着转化率的增大,最大反应速率不断减小,最大反应速率出现的温度也逐渐降低,c正确;
d.从图像可以看出随着转化率的增大,最大反应速率出现的温度也逐渐降低,这时可以根据不同转化率选择合适的反应温度以减少能源的消耗,d正确;
故答案选cd;
(ii)为了提高催化剂的综合性能,科学家对催化剂进行了改良,从图中可以看出标号为d的催化剂V-K-Cs-Ce对SO2的转化率最好,产率最佳,故答案选d;
(iii)利用分压代替浓度计算平衡常数,反应的平衡常数Kp===;设SO2初始量为m mol,则平衡时n(SO2)=m-m·αe=m(1-αe),n(SO3)=m·αe,Kp==,故答案为。
5.(1) 低温 -88 降温、加压、及时分离出产物
(2)D
(3) 250℃、9×105Pa或210℃、5×105Pa 1.08×1012 使原料气部分发生氧化反应,为甲烷进一步转化提供热量
(4)30
【详解】(1)反应的焓变等于反应物键能和减去生成物键能和,则反应的焓变为,反应①为放热的熵减反应,故低温利于反应的自发进行;
已知:① ,② ,根据盖斯定律可知,反应①-②得:③,故;
生成甲醇的反应为气体分子数减小的放热反应,故降温、加压、及时分离出产物均有利于平衡正向移动,利于提高甲醇产率;
(2)A.反应为气体分子数改变的反应,容器体积不再发生改变,说明达到平衡状态,A不符合题意;
B.,说明此时正逆反应速率相等,则达到平衡状态,B不符合题意;
C.混合气体的平均摩尔质量为M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,C不符合题意;
D.投料比为反应的二氧化碳、氢气的系数比,故二氧化碳、氢气的物质的量之比为定值,某时刻测得与的物质的量之比为3:1,不能说明反应达到平衡,D符合题意;
故选D;
(3)已知:,则温度相同,增大压强,平衡逆向移动,甲烷含量增大,故向上的曲线为条件下与p的关系;压强相同,升高温度,平衡正向进行,甲烷含量减小,故向下的曲线为条件下与t的关系;
假设与CO 投料分别为3mol、1mol,CO的平衡转化率为时,反应CO为1mol
则反应后总的物质的量为,,故反应条件可能是250℃、9×105Pa或210℃、5×105Pa;
210℃条件下,反应后总的物质的量为,甲烷、水、氢气、一氧化碳的物质的量分别为、、2mol、,分压分别为、、、,反应④的压强平衡常数;
通入空气或氧气的目的是使原料气部分发生氧化反应,为甲烷进一步转化提供热量;
(4)已知,则,也就是图像的斜率为活化能,故反应⑤逆反应的活化能为。
6.(1) 49.5
(2) 主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使 CO2转化率、甲醇选择性均下降 0.061
【详解】(1)根据盖斯定律,将反应①的焓变值的1.5倍减去反应②的焓变值的一半得到CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g), ΔH =[( 484 kJ mol 1)×1.5] [( 1353 kJ mol 1)÷2]= 49.5kJ mol 1,故答案为 49.5;
(2)分析温度高于236°C时图中曲线下降的原因根据方程式分析主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使 CO2转化率、甲醇选择性均下降;
按1 mol CO2(g)、3 mol H2(g)投料反应,244°C时二氧化碳转化率是10.5%,甲醇选择性为58.3%,因此此温度下反应生成CH3OH的物质的量为1mol×10.5%×58.3%≈0.061mol,故答案为0.061;
在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,,,则平衡时二氧化碳物质的量为0.8mol,氢气物质的量为2.6mol,甲醇物质的量为0.1mol,水蒸气物质的量为0.2mol,一氧化碳物质的量为0.1mol,总气体物质的量为3.8mol,则该温度下主反应的平衡常数;
7.(1)
(2) 反应I BD
(3) =
(4)1
(5)
【详解】(1)已知:i.2CO(g)+O2(g)2CO2(g)ΔH1,ii.2N2O(g)2N2(g)+O2(g)ΔH2,根据盖斯定律,反应N2O(g)+CO(g)N2(g)+CO2(g)为反应(i+ii),则H=。
(2)①决定总反应速率是由慢反应决定,活化能越大,化学反应速率越慢,根据图像可知,第一步反应活化能大,因此决定总反应速率是由第一步决定;故答案为反应I;
②A.根据题意,Fe+是N2O和CO反应的催化剂,催化剂改变历程,但对ΔH无影响,故A错误;
B.反应I为放热反应,升高温度,平衡逆向进行,CO2的体积分数减小,故B正确;
C.降低温度平衡正向移动,平衡常数增大,故C错误;
D.CO分子中C和O共用叁键,CO2的结构式为O=C=O,因此反应中有极性键的断裂,也有离子键的断裂,故D正确;
答案为BD;
(3)①达到平衡时,正反应速率=逆反应速率净反应速率为0,即Δv(500K)=Δv(550K),故答案为=;
②反应为放热反应,升高温度,K减小,pK=-lgK,pK增大,pK与温度的倒数的图像是 ;故答案为;
(4)①开始N2O的投入量是amol,CO是amol,N2O的转化量是2x,则有,平衡后O的体积分数为25%,则有,解得x=0.5a,则该温度下平衡常数,故答案为:1;
(5)已知CaC2O4(s)CaCO3(s)+CO(g)Kp=ekPa,则p(CO)=ekPa,设N2O的转化压强为xkPa,则,则b-x+e+2x=c,x=c-e-b,则Kp=。
8.(1)0.0224
(2)BD
(3)
(4)B
(5)依据反应③过程,CO 的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO
【详解】(1)根据已知条件列出“三段式”
某时刻转化率为20%,选择性为40%,则=0.2,=0.4,解得x=0.32,y=0.48,则该时刻反应①的浓度商=0.0224。
(2)A.反应①是吸热的熵增的反应,自发进行的条件是高温,故A错误;
B.反应②分解生产C和H2的反应是吸热反应,升高温度,平衡正向移动,平衡常数增大,故B正确;
C.增大压强,活化分子数不一定增多,所以其反应速率不一定最多,如恒温恒容条件下加入惰性气体,体系压强增大但反应物浓度不变,反应速率不变,故C错误;
D.C(s)的物质的量不再变化,说明反应②的正逆反应速率相等,反应达到平衡,故D正确;
故选BD。
(3)反应①分三步进行,由图可知,步骤1为吸附在催化剂表面,该过程为放热反应,则步骤2为N在催化剂表面生成C3H6(g)和NH2(g),步骤3为NC3H6(g)和NH2(g)从催化剂表面解吸附生成N(s)、C3H6(g)和H2(g),该过程是吸热反应,结合反应①总反应为吸热反应,画出步骤2和步骤3生成产物的反应过程能量示意图为: 。
(4)A.由图可知,M和 在过程1中被消耗,在过程2中又生成,二者都可循环利用,故A错误;
B.过程1作用力a是H原子和O原子之间形成的氢键,过程2涉及极性键的形成和断裂,故B正确;
C.温度升高,可能导致催化剂活性降低,总反应速率不一定加快,故C错误;
D.催化剂不改变反应热,其他条件不变,更换不同催化剂,同样生产1mol (g)所需能量相同,故D错误;
故选B。
(5)依据反应③过程,CO 的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO。
9.(1)-123.0kJ·mol-1
(2) *HCOO+4*H=* H3CO+ H2O 水为反应③的反应物,适当加入少量的水能够促进平衡正向移动,增大甲醇的产率
(3) 反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度 增大
(4) CO 先减小后增大 0.16 0. 015
【详解】(1)反应I的2倍加上反应Ⅱ得到反应2CO2 (g) + 6H2 (g)CH3OCH3 (g)+3H2O(g)的△H=-123.0kJ·mol-1;故答案为:-123.0kJ·mol-1。
(2)根据图中信息,图中反应②是*HCOO和*H反应生成* H3CO和H2O,其反应方程式为*HCOO+4*H=* H3CO+ H2O。在反应气中适当加入少量的水能够增大甲醇的产率,根据图中信息水为反应③的反应物,适当加入水蒸气,增大反应③的反应物浓度,有利于平衡正向移动,增大甲醇的产率;故答案为:水为反应③的反应物,适当加入少量的水能够促进平衡正向移动,增大甲醇的产率。
(3)温度600K以下,根据图中信息甲醇减少,二甲醚也再减少且二甲醚减小的幅度大于甲醇减小的幅度,因此甲醇的物质的量分数变化的可能原因是反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度。一定温度下,反应I和反应Ⅱ都是体积减小的反应,增大压强,平衡都正向移动,因此二甲醚的物质的量分数增大;故答案为:反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度;增大。
(4)①反应I是放热反应,反应Ⅲ是吸热反应,升高温度,反应I平衡逆向移动,反应Ⅲ平衡正向移动,因此甲醇的量减少,CO的量增大,因此图中n代表的物质是CO;故答案为:CO。
②150~400°C范围内,随着温度升高,H2O的平衡产量的变化趋势与二氧化碳的转化率变化趋势一样,是先减小后增大;故答案为:先减小后增大。
③270 °C时,假设开始加入1mol二氧化碳,3mol氢气,建立三段式,,则x+y=0.24,x=y,则x=0.12,CH3OH的分压为MPa(保留2位小数);反应Ⅲ的平衡常数;故答案为:0.015。
10.(1) 高温 < BD
(2) 2
【详解】(1)①反应Ⅱ是吸热反应,熵增的反应,根据 ,则在高温下为自发反应,第一个方程式2倍减去第二个方程式得到反应Ⅲ的反应热;故答案为:高温;。
②已知反应I的正、逆反应活化能分别为,反应Ⅱ的正、逆反应活化能分别为,,,第二个方程式减去第一个方程式,则;故答案为:<。
③A.,一个正向反应,一个逆向反应,速率之比不等于计量系数之比,故A不符合题意;B.平均摩尔质量等于质量除以气体物质的量,气体质量不变,正向反应,气体物质的量增大,气体平均摩尔质量减小,当气体平均相对分子质量不再改变,则达到平衡,故B符合题意;C.气体密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,当气体密度不再改变,不能作为判断平衡标志,故C不符合题意;D.随着反应正向进行,与的物质的量之比发生改变,当与的物质的量之比不再改变,说明达到平衡,故D符合题意;综上所述,答案为:BD。
④一定条件下,向体积为VL的恒容密闭容器中通入1mol和1mol,发生反应I、Ⅱ、Ⅲ,建立三段式、、,达到平衡时,容器中和的物质的量均为0.2mol,1 x 2y=0.2,y z=0.2,C物质的量为x+2z=0.4,此时CO的浓度为,根据前面分析得到甲烷、二氧化碳、一氧化碳、氢气物质的量分别为0.4mol、0.2mol、0.4mol、2mol,则反应Ⅲ的平衡常数为;故答案为:;。
(2)向该电池中持续通入,甲烷为负极,空气为正极,此时负极的电极反应式为,正极电极反应式为;总反应方程式为:,时刻,已消耗的体积为67.2L(标准状况下气体物质的量为3mol),则消耗KOH物质的量为6mol,则向时刻的溶液中加入2molKOH并将溶液混匀,可使溶液中只含有一种溶质;故答案为:;2。
11.(1)
(2)Fe2+发生水解反应产生白色絮状物,再与氧气发生反应生成红褐色固体。
(3) 6.5 氢离子浓度较高,反应速率快且Fe2+水解程度小附着物占据活性中心少
氢离子浓度降低Fe2+水解程度增大附着物占据活性中心增多
(4)或与发生归中反应生成氮气
(5)
【详解】(1)由图可知,被还原为,根据氧化还原反应规律得到:。
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色由此判断原因为:Fe2+发生水解反应产生白色絮状物,再与氧气发生反应生成红褐色固体。
(3)当pH=6.5时由图像可知去除率最高;题干信息告知:离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(无法占据活性位点)。t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,综合分析,可知:前期氢离子浓度较高,反应速率快且Fe2+水解程度小附着物占据活性中心少,反应速率快;后期
氢离子浓度降低Fe2+水解程度增大附着物占据活性中心增多,反应速率降低。
(4)40min时总氮量较初始时下降,说明部分含氮微粒脱离溶液体系,极有可能是转化为气体,由此猜测可能原因是或与发生归中反应生成氮气。
(5)由图可知阴极得电子转化为,即。次氯酸将氧化为氮气,即。
12.(1)大于
(2)Fe2O3+3H2O(g) +6e- =2Fe+6OH-
(3) HOOC-NH2 =H2O+HN=C=O 241
(4) 1000 1000 变大
(5) Cat2 Cat2 直线斜率变化值较小(或直线Cat2斜率绝对值较小或直线Cat2较Catl平缓) ,活化能较小催化效能较高(其他答案合理均可)
【详解】(1)该反应为放热反应,随着反应的进行,绝热容器中体系的温度会逐渐升高,平衡逆向移动,不利于CO(NH2)2(g)的生成,CO(NH2)2(g)所占体系的百分含量减少,a大于b。
(2)根据图示可知,惰性电极Ⅰ为阴极,反应得电子,电极反应式为Fe2O3+3H2O(g)+6e-=2Fe+6OH-。
(3)根据图所示,能垒最大的即为决速步骤,故该步骤的方程式为:HOOC NH2→HN=C=O+H2;根据2NH3+CO2=CO(NH2)2+H2O △H= 87kJ/mol,图中最终生成物对初始反应物的能量差是 87kJ/mol,那么由TS3到最终产物,就有ΔE2=ΔE1+87.5kJ/mol ( 87kJ/mol)=241kJ/mol。
(4)该反应△H<0,温度升高,平衡向逆方向移动,因为T1<T2,故在图中上面的那条线是T1℃对应的图像,平衡时v正=v逆,k正 p(HNCO) p(NH3)=k逆 p[CO(NH2)2],代入横坐标为1、纵坐标为5那个点的数据得:kPa-1;T2℃时,根据标准平衡常数的表达式,并代入A点的数据得:;若点A时继续投入等物质的量的两种反应物,容器体积不变,相当于加压,加压时平衡向气体计量数减小的正方向移动,CO(NH2)2的体积分数变大。
(5)已知活化能较小催化效能较高,由图可知,Cat2直线斜率变化值较小,活化能较小催化效能较高,所以催化效能较高的催化剂是Cat2。
13.(1)
(2)
(3) < 增大与的投料比,的平衡转化率增大 AC 3
【详解】(1)由图可知,与还可以发生反应生成CO和H2O,反应ⅰⅰⅰ为:。
(2)反应热等于生成物的生成焓减去反应物的生成焓, =-242-115.9+393.5=。
(3)①增大与的投料比,相当于增大的浓度,平衡正向移动,的平衡转化率增大,图甲中x<3;
②A.在恒压容器中,反应进行时气体总质量不变,总体积减小,混合气体的密度增大,当容器中气体密度不再变化时,体系处于平衡状态,故A错误;
B.平衡常数只受温度影响,体系达平衡时,若分离出部分,反应ⅱ的平衡常数值将不变,故B错误;
C.在恒压容器中若充入稀有气体,容器体积增大,压强减小,与发生的反应ⅰ和ⅱ总体来看是气体体积减小的反应,反应会逆向进行,体系重新达平衡时HCHO的物质的量会减少
,故C正确;
D.升高温度,反应ⅰ的和都增大,故D错误;
故选AC;
③根据已知条件列出“三段式”:
P点对应的体系中消耗了2.7mol ,则x+2y=2.7mol,的选择性为=0.5,解得x=y=0.9mol,CO2的平衡转化率为=60%,解得a=3,则体系中充入的3mol,此时反应ⅰ的平衡常数。
14.(1)-90.14
(2) < 升高温度,平衡逆向移动,为保持转化率不变,需要增大压强,使平衡正向移动
(3) 1.68 66.7% 或
(4)随着CO分压的增大,(或)的反应速率变大,从而使的选择性升高
【详解】(1)已知:
①
②
由盖斯定律可知,②-①得:;
(2)由图表可知,随着温度升高,平衡常数减小,说明平衡逆向移动,则反应为放热反应,焓变小于零;反应为气体分子数减小的放热反应,升高温度,平衡逆向移动,为保持转化率不变,需要增大压强,使平衡正向移动,故随着温度升高所需压强增大;
(3)①由反应Ⅰ 、反应Ⅱ 体现的关系可知,表示的反应速率为;
②在2L刚性容器中充入合成气,总压,则一氧化碳、氢气初始分压均为20MPa,平衡时,若和体积分数相等,则分压均为aMPa,则
则的选择性为
的分压为,则20-3a-2a=x,,则氢气、一氧化碳分压分别为、,故应Ⅰ的平衡常数;
(4)CO分压增大选择性升高的原因为:随着CO分压的增大,(或)的反应速率变大,从而使的选择性升高。
15.(1)-1838kJ mol-1
(2) 温度小于500℃,反应未达到平衡,随着温度升高,速率增大 温度大于500℃,生成物N2浓度下降,H2O(g)的浓度升高,则有副反应发生
(3) 250℃,V7/Ti D 不变 2kPa
【详解】(1)反应Ⅱ的正反应与逆反应活化能之差为反应Ⅱ的焓变, H=反应物的总键能-生成物的总键能,;故答案为:-1838kJ mol-1;
(2)①温度小于500℃,随着温度的升高,N2的含量上升的原因是:温度小于500℃,反应未达到平衡,随着温度升高,速率增大;
②温度大于500℃,生成物N2浓度下降,H2O(g)的浓度升高,则有副反应发生;
(3)①在250℃、V7/Ti时NO的转化率最大,为工业生产中最佳适宜条件;
A.升高温度,反应速率加快,但该反应为放热反应,故平衡逆向进行,减小了NO转化率,A不符合题意;
B.移去N2,NO的平衡转化率增大,但反应速率减小,B不符合题意;
C.密闭容器内充入氩气,反应速率不变,平衡不移动,C不符合题意;
D.充入氨气,反应速率加快,平衡正向进行,提高NO平衡转化率,D符合题意;
故答案为:D;
②K只受温度影响,温度不变,K不变,故K比值不变;故答案为:不变;
③向1L密闭容器中充入4molNO、4molNH3和1molO2发生反应I和反应Ⅱ,A点时NO转化率为95%,则NO消耗3.8mol,平衡时为0.2molNO,已知平衡时N2的物质的量为3.7mol,假设反应I消耗4x mol NO、生成4x molN2,反应Ⅱ消耗6y mol NO、生成5y molN2,则4x+6y=3.8、4x+5y=3.7,解得x=0.8,y=0.1,列三段式:反应I反应Ⅱ,平衡时总物质的量为,由压强之比等于物质的量之比,,解得平衡时压强为P平衡=99kPa,平衡时容器中NO的分压为,NH3的分压为,N2的分压为,H2O的分压为,pθ=100kPa,反应Ⅱ的标准平衡常数。
16.(1) <
(2)
(3)
(4)96.8
(5)高
(6)BCD
【详解】(1)反应②,氧气由气态变为液态可知为放热反应,因此,由盖斯定律可知,反应③=①-②,即,故答案为:<;;
(2)37 ℃氧气分压一定时,增大氢离子浓度,平衡向正反应方向移动,Hb与氧气的结合度减小,由图可知,曲线A的Hb与氧气的结合度最大说明溶液的pH最大,则pH=7.6时对应的曲线为;故答案为:;
(3)本题考查化学平衡常数的计算,反应①,有,根据题干中液平衡体系中,例如平衡常数表达式为:,可知,观察平衡时与的结合度α(转化率)的关系图可知,当pH=7.4,可知,p(O2)=4kPa时,此时的结合度为60%,即c(HbO2)=c×60%mol·L-1,c(HbH+)=c×40%mol·L-1,代入表达式可得,;故答案为:;
(4)根据前面可知,则有根据氧分压为80kPa,温度为37℃,pH=7.4时可知,K只受温度的影响,温度不变,则K不变,带入表达式有,因此K=,p(O2)=80kPa,代入上述表达式,即=96.8%;故答案为:96.8%;
(5)考查影响化学平衡的因素,氧气分压高,使平衡①向正反应方向进行,增加与氧气的结合度,c(H+)增大,促使反应④向逆反应方向进行,因此有利于CO2排出体外,故答案为:高;
(6)A.根据反应⑤:且正常人Mb含量为小于Hb含量为,可知平衡正向移动的倾向更大,因此Hb结合氧气的能力弱于Mb,更易生成MbO2,故A错误;
B.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) MbO2(aq),高氧分压下,血液中浓度增加,故B正确;
C.高海拔中的氧气较为稀薄,更需要能与氧气较为容易结合的Mb,因此居民体内Mb的含量偏高,故C正确;
D.当肌肉细胞中Mb浓度不变时,说明反应⑤达到平衡,因此氧气运输达平衡,故D正确;
故答案选BCD。
17.(1)
(2) L3 1 >
(3) 温度较高,催化剂失活
(4)空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率
(5) H2 75%
【详解】(1)给反应I编为序号①;
反应II编为序号②:
③;④;⑤,根据盖斯定律可得出目标方程式①=③-④-⑤-②,即可得,故答案为:;
(2)①温度越高,反应速率越快,k正、k逆越大,该反应为吸热反应,则k正增大的倍数大于k逆,则图中能够代表k送的曲线为L3;②反应达到平衡时,v正=v逆,则k正c[CH3CH(CH3)CH3] ·c(CO2) = k逆c[CH2=c(CH3)2]c(H2O) ×c(CO),K=== 1,假设CH3CH(CH3)CH3的转化率为50%,Qc===0.5;
(3)①由图可知,a点CO2的转化率小于平衡转化率率,说明反应未达到平衡状态,但在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率相等,说明催化剂失去活性,
②设起始CO2、CH4、H2O物质的量为1mol、1mol、nmol,列化学平衡三段式
混合气体总物质的量为(1-a+1-a+2a+2a +n)= (2+2a+n) mol,Kp===;故答案为:温度较高,催化剂失活;;
(4)从产率角度分析其优点是空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率,故答案为:空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率;
(5)在阴极氢离子也易得到电子转化为H2,则阴极生成的副产物可能是H2;标准状况下,当阳极生成氧气体积为224mL时,转移电子的物质的量为 0.04mol,测得阴极区内的c( HCOO-) = 0.015mol/L,转移电子的物质的量为0.015mol/L×1L×2 = 0.03mol,电解效率为=75%,故答案为:H2;75%。
18.(1)还原
(2) 盐酸具有还原性,能与NaClO反应 2NO+3HClO+H2O 2+3Cl-+5H+ 溶液初始pH高,c(H+)小,有利于2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+正向进行,NOx脱除率大
(3) NO2+2I-+2H3PO4=NO+I2+2+H2O 偏低
【详解】(1)在形成酸雨过程中,NOx在大气中最终被氧化硝酸,该程中NOx表现还原性,故答案为:还原;
(2)①盐酸是还原性酸,能与NaClO发生氧化还原反应,因此不能用盐酸调节NaClO溶液初始pH,故答案为:盐酸具有还原性,能与NaClO反应;
②将pH=3.5时NaClO首先结合氢离子生成HClO,HClO表现强强化性,将NO氧化为,自身被还原为Cl-,其离子方程式为2NO+3HClO+H2O 2+3Cl-+5H+,故答案为:2NO+3HClO+H2O 2+3Cl-+5H+;
③脱除NOx的反应为2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+,可反应可知pH<5.5时随pH升高,氢离子浓度减小,有利于平衡正向移动,从而提高NOx脱除率,故答案为:溶液初始pH高,c(H+)小,有利于2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+正向进行,NOx脱除率大;
(3)①NO2在电解池中被I-还原为NO,而I-被氧化为I2,结合电解质环境H3PO4提供氢离子最终生成,根据得电子守恒可得反应方程式NO2+2I-+2H3PO4=NO+I2+2+H2O,故答案为:NO2+2I-+2H3PO4=NO+I2+2+H2O;
②可用转移电子物质的量表示NOx的物质的量,则脱除前NOx的物质的量为a mol,脱除后NOx的物质的量为b mol,NOx的脱出率为,故答案为:;
③测量结束后,电解池中还检测到少量和,说明NOx没有完全转化为NO2,导致NO2测定值偏低,故答案为:偏低。
答案第1页,共2页
答案第1页,共2页
1.(2022·四川南充·统考二模)实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。
甲醇的制备原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为 。
(2)甲醇的制备反应一般认为通过如下两步来实现:
①CO2(g)+H2(g) CO(g)+H2O(g)kJ/mol
②CO(g)+2H2(g) CH3OH(g)kJ/mol
根据盖斯定律,该反应的 kJ·mol-1,反应能在 (填“高温”或“低温”)自发进行。
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)= 。
②该温度下的平衡常数K= (mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图象正确的是 。
(4)我国科学家制备了一种ZO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(S)随温度的变化曲线如图。
①生成CH3OH的最佳温度约为 。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因: 。
(5)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g) HCOOH(g)<0。在一容积固定的密闭容器中进行反应,实验测得:,、为速率常数。温度为T1℃时,该反应K=2,温度为T2℃时,,则T2℃时平衡压强 (填“>”“<”或“=”)T1℃时平衡压强,理由是 。
2.(2023·浙江·统考高考真题)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
该反应分两步完成:
请回答:
(1) 。
(2)恒定总压和水碳比[]投料,在不同条件下达到平衡时和的分压(某成分分压=总压×该成分的物质的量分数)如下表:
条件1 0.40 0.40 0
条件2 0.42 0.36 0.02
①在条件1下,水煤气变换反应的平衡常数 。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式 。
(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入
B.恒定水碳比,增加体系总压可提高的平衡产率
C.通入过量的水蒸气可防止被进一步还原为
D.通过充入惰性气体增加体系总压,可提高反应速率
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。
①在催化剂活性温度范围内,图2中b-c段对应降温操作的过程,实现该过程的一种操作方法是 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出平衡转化率随温度变化的曲线 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是 。
3.(2023·北京·统考高考真题)尿素合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银与在一定条件下反应制得,实现了由无机物到有机物的合成。该反应的化学方程式是 。
(2)二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.和生成;
ⅱ.分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是 (填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.
(3)近年研究发现,电催化和含氮物质(等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成,电解原理如图所示。
①电极是电解池的 极。
②电解过程中生成尿素的电极反应式是 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中不能直接用溶液准确滴定。
①消化液中的含氮粒子是 。
②步骤ⅳ中标准溶液的浓度和消耗的体积分别为和,计算样品含氮量还需要的实验数据有 。
4.(2023·辽宁·统考高考真题)硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、 和 (填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为 。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是 (答出两点即可)。
(3)接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是 。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp= (用平衡分压代替平衡浓度计算)。
5.(2023·山东济南·统考三模)二氧化碳捕集利用与封存、甲烷重整是实现“双碳”目标的重要途径。回答下列问题:
Ⅰ.化学家通过理论计算与研究,提出含氧空位的氧化铜对加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。加氢选择合成甲醇的主要反应如下:
①
②
③
298K时,测得键能数据如下表所示。
化学键 C=O() C-O C-H O-H H-H
键能 803 326 414 464 436
(1)有利于反应①自发进行的条件是 (填“高温”或“低温”); ,有利于提高甲醇产率的措施有 (至少回答2条)。
(2)将与按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。
A.容器体积不再发生改变
B.
C.混合气体的平均相对分子质量不再改变
D.某时刻测得与的物质的量之比为3:1
Ⅱ.甲烷重整工艺主要包括甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的主要反应为④ 。若将与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为,在条件下与p的关系、在条件下与t的关系如图a所示。当CO的平衡转化率为时,反应条件可能是 ;210℃条件下,反应④的压强平衡常数 (保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。
(4)与重整制氢主要反应为⑤,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式(为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为 。
6.(2023·江西宜春·江西省宜丰中学校考模拟预测)将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
(1)已知:①2H2(g)+O2(g)2H2O(g) ΔH= 484 kJ mol 1
②2CH3OH(g)+ 3O2(g) 2CO2(g)+4H2O(g) ΔH = 1353 kJ mol 1
则CO2(g)+ 3H2(g) CH3OH(g)+H2O(g) ΔH = kJ mol 1.
(2)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ mol 1.在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[(CH3OH)%= ×100%]随着温度变化关系如下图所示。
①分析温度高于236°C时图中曲线下降的原因 。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244°C时反应生成CH3OH的物质的量为 mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp= 。 (列出计算式即可)
7.(2023·陕西咸阳·统考三模)用CO还原N2O,实现无害化处理是环境治理的一个重要方法:N2O(g)+CO(g)N2(g)+CO2(g)ΔH。回答下列问题:
(1)已知:i.2CO(g)+O2(g)2CO2(g)ΔH1
ii.2N2O(g)2N2(g)+O2(g)ΔH2
ΔH= (用含ΔH1、ΔH2的式子表示)。
(2)N2O和CO在Fe+作用下的反应分两步进行:
反应I:Fe++N2O→FeO++N2
反应Ⅱ:FeO++CO→Fe++CO2
反应过程的能量变化如图所示:
①决定总反应速率的是 (填“反应I”或“反应Ⅱ”)。
②对于反应N2O(g)+CO(g)N2(g)+CO2(g),下列说法正确的是 (填字母)。
A.Fe+是催化剂,能降低反应的焓变
B.升高温度,N2O的平衡转化率减小
C.降低反应温度,反应平衡常数不变
D.上述反应过程中断裂离子键和极性键
(3)N2O(g)+CO(g)N2(g)+CO2(g)的速率方程为v正=k正c(CO) c(N2O),v逆=k逆c(O2) c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
①反应速率Δv等于正、逆反应速率之差。平衡时,Δv(500K) Δv(550K)(填“>”或“=”)。
②该反应的平衡常数为K,在图中画出pK(pK=-lgK)随温度的倒数()的变化曲线 。
(4)在473K时,向恒容密闭容器中充入amolCO和amolN2O,发生上述反应,平衡时N2O的体积分数为25%,该温度下的平衡常数的数值为 。
(5)已知500℃时,CaC2O4(s)CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g)N2(g)+CO2(g)的平衡常数Kp= (用含e、b、c的式子表示)。
8.(2023·浙江·校联考模拟预测)工业上,以为原料,通过不同反应生产更高价值的。
I.直接分解生产:
反应①:
反应②:
请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol (g)(仅考虑发生上述反应)。某时刻转化率为20%,选择性为40%,则该时刻反应①的浓度商 。
(2)下列说法正确的是_______。
A.反应①能自发进行的条件是低温
B.温度升高,反应②的平衡常数增大
C.压强增大,活化分子百分数增多,导致反应①速率加快
D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态
(3)研究表明,在固体催化剂N存在下,反应①分三步进行,生成步骤的活化能远大于生成步骤的活化能,且开始一段时间内与的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图 。
II.辅助生产:
反应③:
恒温恒压下,和按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
(4)关于反应过程,下列说法正确的是_______。
A.M可循环利用, 不可循环利用
B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂
C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快
D.其他条件不变,更换不同催化剂,同样生产1mol (g)所需能量不一定相同
(5)对该反应器催化剂表面上CO的生成速率和的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和的消耗速率不相等的可能原因 。
9.(2023·广西·统考三模)以CO2为原料合成CH3OH和CH3OCH3是实现碳中和的重要途径之一、一定条件下,有关反应如下:
反应I.CO2(g) +3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.0 kJ ·mol-1
反应Ⅱ.2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-25.0 kJ ·mol-1
反应Ⅲ.CO2(g)+ H2(g)CO(g)+H2O(g) ΔH3=+41.2kJ ·mol-1
回答下列问题:
(1)反应2CO2 (g) + 6H2 (g)CH3OCH3 (g)+3H2O(g)的△H= 。
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的反应历程如图所示。
图中反应②的化学方程式为 。在反应气中适当加入少量的水能够增大甲醇的产率,原因是 。
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、二甲醚的物质的量分数的影响如图所示。
温度600K以下,甲醇的物质的量分数变化的可能原因是 。一定温度下,增大压强,二甲醚的物质的量分数 (填“增大”“减小”或“不变”)。
(4)在5MPa下,CO2和H2按物质的量之比为1:3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。
①图中n代表的物质是 。
②150~400°C范围内,随着温度升高,H2O的平衡产量的变化趋势是 。
③270 °C时,CH3OH的分压为 MPa(保留2位小数);反应Ⅲ的平衡常数K= (Kp为以分压表示的平衡常数,分压=总压 ×物质的量分数。保留3位小数)。
10.(2023·重庆沙坪坝·重庆南开中学校考模拟预测)天然气是一种重要的化工原料,现代工业中常用天然气生产氢气、一氧化碳、甲醇等高附加值化学品,或是将其用于燃料电池。
(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.
Ⅱ.
Ⅲ.
①反应Ⅱ在 (填“高温”、“低温”或“任何温度”)下为自发反应,反应Ⅲ的反应热 。
②已知反应I的正、逆反应活化能分别为,反应Ⅱ的正、逆反应活化能分别为,则 (填“>”、“<”或“=”)。
③在一定条件下,向恒容密闭容器中通入1mol和2mol,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是 (填序号)。
A.
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D.与的物质的量之比不再改变
④一定条件下,向体积为VL的恒容密闭容器中通入1mol和1mol,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中和的物质的量均为0.2mol,此时CO的浓度为 ,反应Ⅲ的平衡常数为 。
(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入,时刻,已消耗的体积为67.2L(标准状况下),继续通入,此时负极的电极反应式为 ;若向时刻的溶液中加入 molKOH并将溶液混匀,可使溶液中只含有一种溶质。
11.(2023·北京海淀·101中学校考三模)用纳米Fe/Ni复合材料能去除污染水体的,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO分两步,将步骤ii补充完整: 。
i. +Fe+2H+=+Fe2++H2O
ii.______+______+H+=Fe2++______+______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因 。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图所示。(注:为初始时NO的浓度。)
①为达到最高去除率,应调水体的初始pH= 。
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是 。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是 。
(5)利用电解无害化处理水体中的NO,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为 。
②生成N2的离子方程式为 。
12.(2023·新疆·统考三模)深入研究含碳、氮元素的物质转化有着重要的实际意义,合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g) ΔH=-87.0kJ ·mol-1。
(1)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2mol的NH3和0.1mol的CO2,若达平衡时等温等容容器中CO(NH2)2的质量分数为a%,绝热等容容器中CO(NH2)2的质量分数为b%,则a b(填“大于”“小于”或“等于”)。
(2)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。电解装置如图所示,熔融NaOH-KOH为电解液,Fe2O3在发生电极反应时生成中间体Fe。惰性电极I的电极反应为 , 生成氨气的反应:2Fe+N2 +3H2O(g)=Fe2O3+2NH3。
(3)如图是上述反应合成尿素的机理及能量变化(单位:kJ·mol-1) ,TS表示过渡态。
该反应历程中,起决速步骤的方程式是 。若 ΔE1=66.5 kJ·mol-1,则 ΔE2= kJ·mol-1。
(4)在T1℃和T2℃时(T1
(5)已知:Arrhenius经验公式为Rlnk=-+C(Ea为活化能,k为速率常数,R和C为常数)。实验探究Catl、Cat2两种催化剂的催化效能,获得如图曲线。则催化效能较高的催化剂是 (填“Catl”或“Cat2”),判断依据是 。
13.(2023·福建三明·统考模拟预测)与在固载金属催化剂(M)上可发生以下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:……
可能的机理如图所示:
(1)写出反应ⅲ的化学方程式: 。
(2)已知298K时下列几种物质的标准生成焓。
[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]
物质 (g) (g) HCHO(g) (g)
标准生成焓/ -393.5 -242 -115.9 0
则反应ⅱ的 。
(3)向一装有催化剂的反应容器中通入和,维持体系压强为p MPa,只发生反应ⅰ和ⅱ,测得不同投料比下的平衡转化率随温度变化的曲线如图甲所示;时,HCHO和HCOOH的选择性随温度的变化曲线如图乙所示。
已知:物质B的选择性
①图甲中x (填“>”、“<”或“=”)3,理由是 。
②下列说法正确的是 (填标号)。
A.当容器中气体密度不再变化时,体系处于平衡状态
B.体系达平衡时,若分离出部分,反应ⅱ的平衡常数值将增大
C.若充入稀有气体,体系重新达平衡时HCHO的物质的量会减少
D.升高温度,反应ⅰ的增大,减小
③P点对应的体系中消耗了2.7mol ,则体系中充入的 mol,此时反应ⅰ的平衡常数 。(列出计算式即可)为以分+压表示的平衡常数,分压=总压×物质的量分数)。
14.(2023·福建宁德·统考模拟预测)乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下,,,则 。
(2)在恒压密闭容器中充入合成气,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
温度T/K 298.15 300 354.7 400
压强P/kPa 5.73 6.38 49.27 260.99
反应Ⅰ平衡常数K 1
则 (填“>”或“<”)0,随着温度升高所需压强增大的原因是 。
(3)在2L刚性容器中充入合成气,总压,温度473K,催化剂(含)下进行反应。
①测得和的时空收率分别为和(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用表示的反应速率为 。
②平衡时,若和体积分数相等,的分压为,则的选择性为 ,反应Ⅰ的平衡常数 (用含x的式子表示)。(已知:的选择性;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
图1(TS表示过渡态,*表示吸附在催化剂表面)
图2
结合图1,图2,从速率角度解释CO分压增大选择性升高的原因 。
15.(2023·四川南充·统考三模)自“十四五规划”提出氮氧化物减排目标,烟气脱硝成为新型科研热点。其反应原理为:
反应I:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH<0
反应Ⅱ:6NO(g)+4NH3(g)5N2(g)+6H2O(g)
(1)相关化学键的键能如表所示,则反应Ⅱ的正反应与逆反应活化能之差为 。
化学键 N≡O(NO气体) N-H N≡N H-O
键能/(kJ mol-1) 630 391 946 465
(2)在密闭体系中进行上述实验,一定条件下,测得不同温度下的相同时间内各组分含量如图1所示(部分反应物未画出)。
①温度小于500℃,随着温度的升高,N2的含量上升的原因是 。
②分析图像可知该容器内还发生了其它副反应,理由是 。
(3)烟气脱硝过程通常使用Vx/Ti作催化剂,实验室向1L密闭容器中充入4molNO、4molNH3和1molO2,发生反应I和反应Ⅱ,采用催化剂V0.5/Ti和V7/Ti测得不同温度下,NO转化率如图2所示。
①工业生产中最佳适宜条件为 ;在最佳适宜条件下进行反应,达平衡后,既能增大NO的平衡转化率又能加快反应速率的措施是 (填字母标号)。
A.升高温度 B.移去N2 C.充入氩气 D.充入2molNH3
②若恒温时,向体系再通入1molO2,则Kp(Ⅰ)/Kp(Ⅱ)的值将 (填“增大”“减小”或“不变”)。
③图中A点时(若A点为平衡状态),初始压强为90kPa,平衡时N2的物质的量为3.7mol,平衡时容器中NO的分压为 ,则反应Ⅱ的标准平衡常数K= 。(列计算式)已知K=,其中pθ为标准压强(100kPa),p(N2)、p(H2O)、p(NO)、p(NH3)为各组分的平衡分压}
16.(2023·广东·广州市第二中学校联考三模)人体内的血红蛋白(Hb)与肌红蛋白(Mb)均可结合,血红蛋白(Hb)与结合的过程存在如下反应:
①
②
③
回答下列问题:
(1) 0(填“>”“<”), (用、表示)
(2)科研人员仅对于反应①进行模拟研究发现,37℃,pH=7.4时氧气分压与达到平衡时与的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为 (在下图中绘出)。
(3)已知:气液平衡体系中,例如平衡常数表达式为:。则37℃,pH=7.4时,反应①的平衡常数为
(4)高压氧舱常用于CO中毒治疗。若控制氧分压为80kPa,则37℃,pH=7.4时,达到平衡时与氧气的结合度α(转化率)为 %(保留一位小数)。
(5)血液中还同时存在反应④:,则氧分压 (填“高”或“低”)有利于排出体外。
(6)血液向肌肉细胞输送氧气时还存在反应⑤:,由向肌肉细胞快速提供氧气。正常人Mb含量为,Hb含量为。下列说法正确的是___________。
A.Hb结合氧气的能力强于Mb
B.高氧分压下,血液中浓度增加
C.高海拔居民体内Mb的含量偏高
D.肌肉细胞中Mb浓度不变时,氧气运输达平衡
17.(2023·广东深圳·翠园中学校考模拟预测)我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将转化为高附加值化学品成为科学家研究的重要课题。异丁烯作为汽油添加剂的主要成分,可利用异丁烷与反应来制备。
反应I:
反应II:
已知:
回答下列问题:
(1)已知:异丁烷,异丁烯,CO的燃烧热热化学方程式的焓变分别为,,,则 (用题目给的反应焓变来表示)
(2)向恒容密闭容器中加入和,利用反应Ⅰ制备异丁烯。已知。已知正反应速率表示为,逆反应速率表示为,其中、为速率常数。
①图中能够代表的曲线为 (填“”“”“”或“”)。
②温度为时,该反应化学平衡常数 ,平衡时转化率 50%(填“>”、“=”、“<”)。
(3)重整技术是实现“碳中和”的一种理想的利用技术,反应为:。在时,将和按物质的量之为充入密闭容器中,分别在无催化剂及催化下反应相同时间,测得的转化率与温度的关系如图所示:
①a点转化率相等的原因是 。
②在、900℃、催化条件下,将、、按物质的量之比为充入密闭容器,的平衡转化率为,此时平衡常数 (以分压表示,分压=总压×物质的量分数;写出含、n、p的计算表达式)。
(4)相比于反应II直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应相比于异丁烷直按脱氢制备丁烯。从产率角度分析该方法的优点是 。
(5)利用电化学可以将有效转化为,装置如图所示。
装置工作时,阴极除有生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是 ,标准状况下,当阳极生成的体积为时,测得阴极区内的,则电解效率为 。(忽略电解前后液体积的变化)
已知:电解效率=×100%。
18.(2023·湖北荆门·荆门市龙泉中学校联考二模)工业烟气中常含有NOx(NO、NO2)。用NaClO溶液将NOx氧化为,实现烟气中NOx的脱除。
(1)NOx在大气中会形成酸雨。形成酸雨的过程中,NO表现 性。
(2)向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
已知:NOx脱除率=×100%
①不用盐酸调节NaClO溶液初始pH的原因是 。
②将pH=3.5时NaClO溶液脱除NO的离子方程式(可逆)为 。
③pH<5.5时,分析NOx脱除率随溶液初始pH升高而增大的可能原因: 。
(3)用CrO3分别将脱除前后的NOx全部转化为NO2,并用库仑仪测定NO2的量,可计算NOx脱除率。库仑仪工作的原理和装置如下:
检测前,电解质溶液中的保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
①NO2在电解池中被I-还原为NO的离子方程式为 。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。NOx脱除率是 。
③测量结束后,电解池中还检测到少量和,这将导致NO2测定结果 (填“偏高”或“偏低”),需进行校正。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)NH3·H2O+ CO2=NH+HCO
(2) —49 低温
(3) 0.225mol(L·min) 5.3 AC
(4) 320℃ 温度升高,反应速率加快,CO2转化率增大,但CH3OH的选择性降低,副反应也增多,CH3OH的含量降低
(5) > 该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的体积分数增大,压强增大
【详解】(1)由题意可知,浓氨水与二氧化碳反应生成碳酸氢铵,反应的离子方程式为NH3·H2O+ CO2=NH+HCO,故答案为:NH3·H2O+ CO2=NH+HCO;
(2)由盖斯定律可知,反应①+②得到二氧化碳转化为甲醇的反应,反应△H=△H1+△H2=(+41kJ/mol)+(—90kJ/mol)=—49 kJ/mol,该反应为熵减的放热反应,低温条件下,反应△H—T△S<0,反应能自发进行,故答案为:—49;低温;
(3)10min时测得二氧化碳和甲醇的体积分数之比变为1:3且比值不再随时间变化可知反应达到平衡,设平衡时生成甲醇的浓度为amol/L,由题意可建立如下三段式:
由二氧化碳和甲醇的体积分数之比变为1:3可得:3(1—a)=a,解得a=0.75;
①由三段式数据可知,反应开始到平衡时氢气的反应速率为=0.225mol(L·min),故答案为:0.225mol(L·min);
②由三段式数据可知,该温度下的平衡常数K=≈5.3,故答案为:5.3;
③该反应为放热反应,升高温度,化学反应速率增大,反应达到平衡后,平衡向逆反应方向移动,化学平衡常数减小、甲醇的浓度增大、氢气的体积分数增大,故选AC;
(4)①由图可知,温度为320℃时,甲醇的选择性较高、二氧化碳转化率较高,则生成甲醇的最佳温度约为320℃,故答案为:320℃;
②温度升高,二氧化碳转化率升高,但产物甲醇含量降低说明温度升高,反应速率加快,二氧化碳转化率增大、甲醇的选择性降低,甲醇的选择性降低导致副反应也增多,甲醇的含量降低,故答案为:温度升高,反应速率加快,CO2转化率增大,但CH3OH的选择性降低,副反应也增多,CH3OH的含量降低;
(5)该反应为气体体积减小放热反应,升高温度,平衡向逆反应方向移动,由温度为T2℃时,可得平衡常数K==1.9,平衡常数小于温度为T1℃时说明T1小于T2,T1℃时气体的体积分数小于T2℃时,压强小于T2℃时,故答案为:>;该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的体积分数增大,压强增大。
2.(1)6
(2) 2 CO+3H2 CH4+H2O
(3)AC
(4) AC
(5)温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小
【详解】(1)设方程式①
②
③
根据盖斯定律可知,③=①-②,则;
(2)①条件1下没有甲烷生成,只发生了水煤气变换反应,该反应是一个气体分子数不变的反应。设在条件1下平衡时容器的总体积为V,水蒸气和一氧化碳的投料分别为12mol和5mol,参加反应的一氧化碳为xmol,根据已知信息可得以下三段式:
,解得x=4;
则平衡常数;
②根据表格中的数据可知,有甲烷生成,且该副反应没有二氧化碳参与,且氢气的产率降低,则该方程式为:CO+3H2 CH4+H2O;
(3)A.一氧化碳和氢气都可以和氧气反应,则通入反应器的原料气中应避免混入,A正确;
B.该反应前后气体计量系数相同,则增加体系总压平衡不移动,不能提高平衡产率,B错误;
C.通入过量的水蒸气可以促进四氧化三铁被氧化为氧化铁,水蒸气不能将铁的氧化物还原为单质铁,但过量的水蒸气可以降低体系中CO和H2的浓度,从而防止铁的氧化物被还原为单质铁,C正确;
D.若保持容器的体积不变,通过充入惰性气体增加体系总压,反应物浓度不变,反应速率不变,D错误;
故选AC;
(4)①A.按原水碳比通入冷的原料气,可以降低温度,同时化学反应速率稍减小,导致CO的转化率稍减小,与图中变化相符,A正确;
B.喷入冷水(蒸气),可以降低温度,但是同时水蒸气的浓度增大,会导致CO的转化率增大,与图中变化不符,B错误;
C.通过热交换器换热,可以降低温度,且不改变投料比,同时化学反应速率稍减小,导致CO的转化率稍减小,与图中变化相符,C正确;
故选AC;
②增大水蒸气的浓度,平衡正向移动,则一氧化碳的的平衡转化率增大,会高于原平衡线,故图像为: ;
(5)反应物分子在催化剂表面的吸附是一个放热的快速过程,温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小。
3.(1)
(2)ab
(3) 阳
(4) 样品的质量、步骤Ⅲ所加入溶液的体积和浓度
【详解】(1)根据原子守恒分析,二者反应生成尿素和氯化银,化学方程式是。答案为;
(2)a.反应ⅰ的活化能是,反应ⅱ活化能是,,a项正确;
b.从图中反应物和生成物能量的相对大小可看出反应ⅰ放热,反应ⅱ吸热,b项正确;
c.总反应的:,c项错误;
故选ab。
(3)①电极b上发生失电子生成的氧化反应,是电解池的阳极。②a极硝酸根离子得电子转化为尿素,再结合酸性环境可分析出电极反应式为。答案为阳极;;
(4)①尿素消化分解生成和,由于反应中存在浓,则消化液中含氮粒子为。②除了已知数据外,还需要的是样品的质量、步骤ⅲ所加入溶液的体积和浓度。答案为;样品的质量、步骤Ⅲ所加入H2SO4溶液的体积和浓度。
4.(1) CuO SO3
(2) 催化剂 反应中有污染空气的NO和NO2放出影响空气环境、NO2可以溶解在硫酸中给产物硫酸带来杂质、产率不高(答案合理即可)
(3) cd d
【详解】(1)根据图示的热重曲线所示,在700℃左右会出现两个吸热峰,说明此时CuSO4发生热分解反应,从TG图像可以看出,质量减少量为原CuSO4质量的一半,说明有固体CuO剩余,还有其他气体产出,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO43CuO+2SO2↑+SO3↑+O2↑,结合反应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO2、SO3、O2,故答案为CuO、SO3。
(2)(i)根据所给的反应方程式,NO2在反应过程中线消耗再生成,说明NO2在反应中起催化剂的作用;
(ii)近年来,铅室法被接触法代替因为在反应中有污染空气的NO和NO2放出影响空气环境、同时作为催化剂的NO2可以溶解在硫酸中给产物硫酸带来杂质影响产品质量、产率不高(答案合理即可)。
(3)(i)a.根据不同转化率下的反应速率曲线可以看出,随着温度的升高反应速率先加快后减慢,a错误;
b.从图中所给出的速率曲线可以看出,相同温度下,转化率越低反应速率越快,但在转化率小于88%的时的反应速率图像并没有给出,无法判断α=0.88的条件下是平衡转化率,b错误;
c.从图像可以看出随着转化率的增大,最大反应速率不断减小,最大反应速率出现的温度也逐渐降低,c正确;
d.从图像可以看出随着转化率的增大,最大反应速率出现的温度也逐渐降低,这时可以根据不同转化率选择合适的反应温度以减少能源的消耗,d正确;
故答案选cd;
(ii)为了提高催化剂的综合性能,科学家对催化剂进行了改良,从图中可以看出标号为d的催化剂V-K-Cs-Ce对SO2的转化率最好,产率最佳,故答案选d;
(iii)利用分压代替浓度计算平衡常数,反应的平衡常数Kp===;设SO2初始量为m mol,则平衡时n(SO2)=m-m·αe=m(1-αe),n(SO3)=m·αe,Kp==,故答案为。
5.(1) 低温 -88 降温、加压、及时分离出产物
(2)D
(3) 250℃、9×105Pa或210℃、5×105Pa 1.08×1012 使原料气部分发生氧化反应,为甲烷进一步转化提供热量
(4)30
【详解】(1)反应的焓变等于反应物键能和减去生成物键能和,则反应的焓变为,反应①为放热的熵减反应,故低温利于反应的自发进行;
已知:① ,② ,根据盖斯定律可知,反应①-②得:③,故;
生成甲醇的反应为气体分子数减小的放热反应,故降温、加压、及时分离出产物均有利于平衡正向移动,利于提高甲醇产率;
(2)A.反应为气体分子数改变的反应,容器体积不再发生改变,说明达到平衡状态,A不符合题意;
B.,说明此时正逆反应速率相等,则达到平衡状态,B不符合题意;
C.混合气体的平均摩尔质量为M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,C不符合题意;
D.投料比为反应的二氧化碳、氢气的系数比,故二氧化碳、氢气的物质的量之比为定值,某时刻测得与的物质的量之比为3:1,不能说明反应达到平衡,D符合题意;
故选D;
(3)已知:,则温度相同,增大压强,平衡逆向移动,甲烷含量增大,故向上的曲线为条件下与p的关系;压强相同,升高温度,平衡正向进行,甲烷含量减小,故向下的曲线为条件下与t的关系;
假设与CO 投料分别为3mol、1mol,CO的平衡转化率为时,反应CO为1mol
则反应后总的物质的量为,,故反应条件可能是250℃、9×105Pa或210℃、5×105Pa;
210℃条件下,反应后总的物质的量为,甲烷、水、氢气、一氧化碳的物质的量分别为、、2mol、,分压分别为、、、,反应④的压强平衡常数;
通入空气或氧气的目的是使原料气部分发生氧化反应,为甲烷进一步转化提供热量;
(4)已知,则,也就是图像的斜率为活化能,故反应⑤逆反应的活化能为。
6.(1) 49.5
(2) 主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使 CO2转化率、甲醇选择性均下降 0.061
【详解】(1)根据盖斯定律,将反应①的焓变值的1.5倍减去反应②的焓变值的一半得到CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g), ΔH =[( 484 kJ mol 1)×1.5] [( 1353 kJ mol 1)÷2]= 49.5kJ mol 1,故答案为 49.5;
(2)分析温度高于236°C时图中曲线下降的原因根据方程式分析主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使 CO2转化率、甲醇选择性均下降;
按1 mol CO2(g)、3 mol H2(g)投料反应,244°C时二氧化碳转化率是10.5%,甲醇选择性为58.3%,因此此温度下反应生成CH3OH的物质的量为1mol×10.5%×58.3%≈0.061mol,故答案为0.061;
在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,,,则平衡时二氧化碳物质的量为0.8mol,氢气物质的量为2.6mol,甲醇物质的量为0.1mol,水蒸气物质的量为0.2mol,一氧化碳物质的量为0.1mol,总气体物质的量为3.8mol,则该温度下主反应的平衡常数;
7.(1)
(2) 反应I BD
(3) =
(4)1
(5)
【详解】(1)已知:i.2CO(g)+O2(g)2CO2(g)ΔH1,ii.2N2O(g)2N2(g)+O2(g)ΔH2,根据盖斯定律,反应N2O(g)+CO(g)N2(g)+CO2(g)为反应(i+ii),则H=。
(2)①决定总反应速率是由慢反应决定,活化能越大,化学反应速率越慢,根据图像可知,第一步反应活化能大,因此决定总反应速率是由第一步决定;故答案为反应I;
②A.根据题意,Fe+是N2O和CO反应的催化剂,催化剂改变历程,但对ΔH无影响,故A错误;
B.反应I为放热反应,升高温度,平衡逆向进行,CO2的体积分数减小,故B正确;
C.降低温度平衡正向移动,平衡常数增大,故C错误;
D.CO分子中C和O共用叁键,CO2的结构式为O=C=O,因此反应中有极性键的断裂,也有离子键的断裂,故D正确;
答案为BD;
(3)①达到平衡时,正反应速率=逆反应速率净反应速率为0,即Δv(500K)=Δv(550K),故答案为=;
②反应为放热反应,升高温度,K减小,pK=-lgK,pK增大,pK与温度的倒数的图像是 ;故答案为;
(4)①开始N2O的投入量是amol,CO是amol,N2O的转化量是2x,则有,平衡后O的体积分数为25%,则有,解得x=0.5a,则该温度下平衡常数,故答案为:1;
(5)已知CaC2O4(s)CaCO3(s)+CO(g)Kp=ekPa,则p(CO)=ekPa,设N2O的转化压强为xkPa,则,则b-x+e+2x=c,x=c-e-b,则Kp=。
8.(1)0.0224
(2)BD
(3)
(4)B
(5)依据反应③过程,CO 的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO
【详解】(1)根据已知条件列出“三段式”
某时刻转化率为20%,选择性为40%,则=0.2,=0.4,解得x=0.32,y=0.48,则该时刻反应①的浓度商=0.0224。
(2)A.反应①是吸热的熵增的反应,自发进行的条件是高温,故A错误;
B.反应②分解生产C和H2的反应是吸热反应,升高温度,平衡正向移动,平衡常数增大,故B正确;
C.增大压强,活化分子数不一定增多,所以其反应速率不一定最多,如恒温恒容条件下加入惰性气体,体系压强增大但反应物浓度不变,反应速率不变,故C错误;
D.C(s)的物质的量不再变化,说明反应②的正逆反应速率相等,反应达到平衡,故D正确;
故选BD。
(3)反应①分三步进行,由图可知,步骤1为吸附在催化剂表面,该过程为放热反应,则步骤2为N在催化剂表面生成C3H6(g)和NH2(g),步骤3为NC3H6(g)和NH2(g)从催化剂表面解吸附生成N(s)、C3H6(g)和H2(g),该过程是吸热反应,结合反应①总反应为吸热反应,画出步骤2和步骤3生成产物的反应过程能量示意图为: 。
(4)A.由图可知,M和 在过程1中被消耗,在过程2中又生成,二者都可循环利用,故A错误;
B.过程1作用力a是H原子和O原子之间形成的氢键,过程2涉及极性键的形成和断裂,故B正确;
C.温度升高,可能导致催化剂活性降低,总反应速率不一定加快,故C错误;
D.催化剂不改变反应热,其他条件不变,更换不同催化剂,同样生产1mol (g)所需能量相同,故D错误;
故选B。
(5)依据反应③过程,CO 的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO。
9.(1)-123.0kJ·mol-1
(2) *HCOO+4*H=* H3CO+ H2O 水为反应③的反应物,适当加入少量的水能够促进平衡正向移动,增大甲醇的产率
(3) 反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度 增大
(4) CO 先减小后增大 0.16 0. 015
【详解】(1)反应I的2倍加上反应Ⅱ得到反应2CO2 (g) + 6H2 (g)CH3OCH3 (g)+3H2O(g)的△H=-123.0kJ·mol-1;故答案为:-123.0kJ·mol-1。
(2)根据图中信息,图中反应②是*HCOO和*H反应生成* H3CO和H2O,其反应方程式为*HCOO+4*H=* H3CO+ H2O。在反应气中适当加入少量的水能够增大甲醇的产率,根据图中信息水为反应③的反应物,适当加入水蒸气,增大反应③的反应物浓度,有利于平衡正向移动,增大甲醇的产率;故答案为:水为反应③的反应物,适当加入少量的水能够促进平衡正向移动,增大甲醇的产率。
(3)温度600K以下,根据图中信息甲醇减少,二甲醚也再减少且二甲醚减小的幅度大于甲醇减小的幅度,因此甲醇的物质的量分数变化的可能原因是反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度。一定温度下,反应I和反应Ⅱ都是体积减小的反应,增大压强,平衡都正向移动,因此二甲醚的物质的量分数增大;故答案为:反应I和反应Ⅱ均为放热反应,温度600K以下,温度升高,反应Ⅱ平衡逆向移动的程度大于反应I平衡逆向移动的程度;增大。
(4)①反应I是放热反应,反应Ⅲ是吸热反应,升高温度,反应I平衡逆向移动,反应Ⅲ平衡正向移动,因此甲醇的量减少,CO的量增大,因此图中n代表的物质是CO;故答案为:CO。
②150~400°C范围内,随着温度升高,H2O的平衡产量的变化趋势与二氧化碳的转化率变化趋势一样,是先减小后增大;故答案为:先减小后增大。
③270 °C时,假设开始加入1mol二氧化碳,3mol氢气,建立三段式,,则x+y=0.24,x=y,则x=0.12,CH3OH的分压为MPa(保留2位小数);反应Ⅲ的平衡常数;故答案为:0.015。
10.(1) 高温 < BD
(2) 2
【详解】(1)①反应Ⅱ是吸热反应,熵增的反应,根据 ,则在高温下为自发反应,第一个方程式2倍减去第二个方程式得到反应Ⅲ的反应热;故答案为:高温;。
②已知反应I的正、逆反应活化能分别为,反应Ⅱ的正、逆反应活化能分别为,,,第二个方程式减去第一个方程式,则;故答案为:<。
③A.,一个正向反应,一个逆向反应,速率之比不等于计量系数之比,故A不符合题意;B.平均摩尔质量等于质量除以气体物质的量,气体质量不变,正向反应,气体物质的量增大,气体平均摩尔质量减小,当气体平均相对分子质量不再改变,则达到平衡,故B符合题意;C.气体密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,当气体密度不再改变,不能作为判断平衡标志,故C不符合题意;D.随着反应正向进行,与的物质的量之比发生改变,当与的物质的量之比不再改变,说明达到平衡,故D符合题意;综上所述,答案为:BD。
④一定条件下,向体积为VL的恒容密闭容器中通入1mol和1mol,发生反应I、Ⅱ、Ⅲ,建立三段式、、,达到平衡时,容器中和的物质的量均为0.2mol,1 x 2y=0.2,y z=0.2,C物质的量为x+2z=0.4,此时CO的浓度为,根据前面分析得到甲烷、二氧化碳、一氧化碳、氢气物质的量分别为0.4mol、0.2mol、0.4mol、2mol,则反应Ⅲ的平衡常数为;故答案为:;。
(2)向该电池中持续通入,甲烷为负极,空气为正极,此时负极的电极反应式为,正极电极反应式为;总反应方程式为:,时刻,已消耗的体积为67.2L(标准状况下气体物质的量为3mol),则消耗KOH物质的量为6mol,则向时刻的溶液中加入2molKOH并将溶液混匀,可使溶液中只含有一种溶质;故答案为:;2。
11.(1)
(2)Fe2+发生水解反应产生白色絮状物,再与氧气发生反应生成红褐色固体。
(3) 6.5 氢离子浓度较高,反应速率快且Fe2+水解程度小附着物占据活性中心少
氢离子浓度降低Fe2+水解程度增大附着物占据活性中心增多
(4)或与发生归中反应生成氮气
(5)
【详解】(1)由图可知,被还原为,根据氧化还原反应规律得到:。
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色由此判断原因为:Fe2+发生水解反应产生白色絮状物,再与氧气发生反应生成红褐色固体。
(3)当pH=6.5时由图像可知去除率最高;题干信息告知:离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(无法占据活性位点)。t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,综合分析,可知:前期氢离子浓度较高,反应速率快且Fe2+水解程度小附着物占据活性中心少,反应速率快;后期
氢离子浓度降低Fe2+水解程度增大附着物占据活性中心增多,反应速率降低。
(4)40min时总氮量较初始时下降,说明部分含氮微粒脱离溶液体系,极有可能是转化为气体,由此猜测可能原因是或与发生归中反应生成氮气。
(5)由图可知阴极得电子转化为,即。次氯酸将氧化为氮气,即。
12.(1)大于
(2)Fe2O3+3H2O(g) +6e- =2Fe+6OH-
(3) HOOC-NH2 =H2O+HN=C=O 241
(4) 1000 1000 变大
(5) Cat2 Cat2 直线斜率变化值较小(或直线Cat2斜率绝对值较小或直线Cat2较Catl平缓) ,活化能较小催化效能较高(其他答案合理均可)
【详解】(1)该反应为放热反应,随着反应的进行,绝热容器中体系的温度会逐渐升高,平衡逆向移动,不利于CO(NH2)2(g)的生成,CO(NH2)2(g)所占体系的百分含量减少,a大于b。
(2)根据图示可知,惰性电极Ⅰ为阴极,反应得电子,电极反应式为Fe2O3+3H2O(g)+6e-=2Fe+6OH-。
(3)根据图所示,能垒最大的即为决速步骤,故该步骤的方程式为:HOOC NH2→HN=C=O+H2;根据2NH3+CO2=CO(NH2)2+H2O △H= 87kJ/mol,图中最终生成物对初始反应物的能量差是 87kJ/mol,那么由TS3到最终产物,就有ΔE2=ΔE1+87.5kJ/mol ( 87kJ/mol)=241kJ/mol。
(4)该反应△H<0,温度升高,平衡向逆方向移动,因为T1<T2,故在图中上面的那条线是T1℃对应的图像,平衡时v正=v逆,k正 p(HNCO) p(NH3)=k逆 p[CO(NH2)2],代入横坐标为1、纵坐标为5那个点的数据得:kPa-1;T2℃时,根据标准平衡常数的表达式,并代入A点的数据得:;若点A时继续投入等物质的量的两种反应物,容器体积不变,相当于加压,加压时平衡向气体计量数减小的正方向移动,CO(NH2)2的体积分数变大。
(5)已知活化能较小催化效能较高,由图可知,Cat2直线斜率变化值较小,活化能较小催化效能较高,所以催化效能较高的催化剂是Cat2。
13.(1)
(2)
(3) < 增大与的投料比,的平衡转化率增大 AC 3
【详解】(1)由图可知,与还可以发生反应生成CO和H2O,反应ⅰⅰⅰ为:。
(2)反应热等于生成物的生成焓减去反应物的生成焓, =-242-115.9+393.5=。
(3)①增大与的投料比,相当于增大的浓度,平衡正向移动,的平衡转化率增大,图甲中x<3;
②A.在恒压容器中,反应进行时气体总质量不变,总体积减小,混合气体的密度增大,当容器中气体密度不再变化时,体系处于平衡状态,故A错误;
B.平衡常数只受温度影响,体系达平衡时,若分离出部分,反应ⅱ的平衡常数值将不变,故B错误;
C.在恒压容器中若充入稀有气体,容器体积增大,压强减小,与发生的反应ⅰ和ⅱ总体来看是气体体积减小的反应,反应会逆向进行,体系重新达平衡时HCHO的物质的量会减少
,故C正确;
D.升高温度,反应ⅰ的和都增大,故D错误;
故选AC;
③根据已知条件列出“三段式”:
P点对应的体系中消耗了2.7mol ,则x+2y=2.7mol,的选择性为=0.5,解得x=y=0.9mol,CO2的平衡转化率为=60%,解得a=3,则体系中充入的3mol,此时反应ⅰ的平衡常数。
14.(1)-90.14
(2) < 升高温度,平衡逆向移动,为保持转化率不变,需要增大压强,使平衡正向移动
(3) 1.68 66.7% 或
(4)随着CO分压的增大,(或)的反应速率变大,从而使的选择性升高
【详解】(1)已知:
①
②
由盖斯定律可知,②-①得:;
(2)由图表可知,随着温度升高,平衡常数减小,说明平衡逆向移动,则反应为放热反应,焓变小于零;反应为气体分子数减小的放热反应,升高温度,平衡逆向移动,为保持转化率不变,需要增大压强,使平衡正向移动,故随着温度升高所需压强增大;
(3)①由反应Ⅰ 、反应Ⅱ 体现的关系可知,表示的反应速率为;
②在2L刚性容器中充入合成气,总压,则一氧化碳、氢气初始分压均为20MPa,平衡时,若和体积分数相等,则分压均为aMPa,则
则的选择性为
的分压为,则20-3a-2a=x,,则氢气、一氧化碳分压分别为、,故应Ⅰ的平衡常数;
(4)CO分压增大选择性升高的原因为:随着CO分压的增大,(或)的反应速率变大,从而使的选择性升高。
15.(1)-1838kJ mol-1
(2) 温度小于500℃,反应未达到平衡,随着温度升高,速率增大 温度大于500℃,生成物N2浓度下降,H2O(g)的浓度升高,则有副反应发生
(3) 250℃,V7/Ti D 不变 2kPa
【详解】(1)反应Ⅱ的正反应与逆反应活化能之差为反应Ⅱ的焓变, H=反应物的总键能-生成物的总键能,;故答案为:-1838kJ mol-1;
(2)①温度小于500℃,随着温度的升高,N2的含量上升的原因是:温度小于500℃,反应未达到平衡,随着温度升高,速率增大;
②温度大于500℃,生成物N2浓度下降,H2O(g)的浓度升高,则有副反应发生;
(3)①在250℃、V7/Ti时NO的转化率最大,为工业生产中最佳适宜条件;
A.升高温度,反应速率加快,但该反应为放热反应,故平衡逆向进行,减小了NO转化率,A不符合题意;
B.移去N2,NO的平衡转化率增大,但反应速率减小,B不符合题意;
C.密闭容器内充入氩气,反应速率不变,平衡不移动,C不符合题意;
D.充入氨气,反应速率加快,平衡正向进行,提高NO平衡转化率,D符合题意;
故答案为:D;
②K只受温度影响,温度不变,K不变,故K比值不变;故答案为:不变;
③向1L密闭容器中充入4molNO、4molNH3和1molO2发生反应I和反应Ⅱ,A点时NO转化率为95%,则NO消耗3.8mol,平衡时为0.2molNO,已知平衡时N2的物质的量为3.7mol,假设反应I消耗4x mol NO、生成4x molN2,反应Ⅱ消耗6y mol NO、生成5y molN2,则4x+6y=3.8、4x+5y=3.7,解得x=0.8,y=0.1,列三段式:反应I反应Ⅱ,平衡时总物质的量为,由压强之比等于物质的量之比,,解得平衡时压强为P平衡=99kPa,平衡时容器中NO的分压为,NH3的分压为,N2的分压为,H2O的分压为,pθ=100kPa,反应Ⅱ的标准平衡常数。
16.(1) <
(2)
(3)
(4)96.8
(5)高
(6)BCD
【详解】(1)反应②,氧气由气态变为液态可知为放热反应,因此,由盖斯定律可知,反应③=①-②,即,故答案为:<;;
(2)37 ℃氧气分压一定时,增大氢离子浓度,平衡向正反应方向移动,Hb与氧气的结合度减小,由图可知,曲线A的Hb与氧气的结合度最大说明溶液的pH最大,则pH=7.6时对应的曲线为;故答案为:;
(3)本题考查化学平衡常数的计算,反应①,有,根据题干中液平衡体系中,例如平衡常数表达式为:,可知,观察平衡时与的结合度α(转化率)的关系图可知,当pH=7.4,可知,p(O2)=4kPa时,此时的结合度为60%,即c(HbO2)=c×60%mol·L-1,c(HbH+)=c×40%mol·L-1,代入表达式可得,;故答案为:;
(4)根据前面可知,则有根据氧分压为80kPa,温度为37℃,pH=7.4时可知,K只受温度的影响,温度不变,则K不变,带入表达式有,因此K=,p(O2)=80kPa,代入上述表达式,即=96.8%;故答案为:96.8%;
(5)考查影响化学平衡的因素,氧气分压高,使平衡①向正反应方向进行,增加与氧气的结合度,c(H+)增大,促使反应④向逆反应方向进行,因此有利于CO2排出体外,故答案为:高;
(6)A.根据反应⑤:且正常人Mb含量为小于Hb含量为,可知平衡正向移动的倾向更大,因此Hb结合氧气的能力弱于Mb,更易生成MbO2,故A错误;
B.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) MbO2(aq),高氧分压下,血液中浓度增加,故B正确;
C.高海拔中的氧气较为稀薄,更需要能与氧气较为容易结合的Mb,因此居民体内Mb的含量偏高,故C正确;
D.当肌肉细胞中Mb浓度不变时,说明反应⑤达到平衡,因此氧气运输达平衡,故D正确;
故答案选BCD。
17.(1)
(2) L3 1 >
(3) 温度较高,催化剂失活
(4)空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率
(5) H2 75%
【详解】(1)给反应I编为序号①;
反应II编为序号②:
③;④;⑤,根据盖斯定律可得出目标方程式①=③-④-⑤-②,即可得,故答案为:;
(2)①温度越高,反应速率越快,k正、k逆越大,该反应为吸热反应,则k正增大的倍数大于k逆,则图中能够代表k送的曲线为L3;②反应达到平衡时,v正=v逆,则k正c[CH3CH(CH3)CH3] ·c(CO2) = k逆c[CH2=c(CH3)2]c(H2O) ×c(CO),K=== 1,假设CH3CH(CH3)CH3的转化率为50%,Qc===0.5
(3)①由图可知,a点CO2的转化率小于平衡转化率率,说明反应未达到平衡状态,但在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率相等,说明催化剂失去活性,
②设起始CO2、CH4、H2O物质的量为1mol、1mol、nmol,列化学平衡三段式
混合气体总物质的量为(1-a+1-a+2a+2a +n)= (2+2a+n) mol,Kp===;故答案为:温度较高,催化剂失活;;
(4)从产率角度分析其优点是空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率,故答案为:空气中氧气与产物氢气反应生成水,同时惰性的氮气加入该分子数增加的反应中,二者均可使平衡正向移动,提高异丁烯产率;
(5)在阴极氢离子也易得到电子转化为H2,则阴极生成的副产物可能是H2;标准状况下,当阳极生成氧气体积为224mL时,转移电子的物质的量为 0.04mol,测得阴极区内的c( HCOO-) = 0.015mol/L,转移电子的物质的量为0.015mol/L×1L×2 = 0.03mol,电解效率为=75%,故答案为:H2;75%。
18.(1)还原
(2) 盐酸具有还原性,能与NaClO反应 2NO+3HClO+H2O 2+3Cl-+5H+ 溶液初始pH高,c(H+)小,有利于2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+正向进行,NOx脱除率大
(3) NO2+2I-+2H3PO4=NO+I2+2+H2O 偏低
【详解】(1)在形成酸雨过程中,NOx在大气中最终被氧化硝酸,该程中NOx表现还原性,故答案为:还原;
(2)①盐酸是还原性酸,能与NaClO发生氧化还原反应,因此不能用盐酸调节NaClO溶液初始pH,故答案为:盐酸具有还原性,能与NaClO反应;
②将pH=3.5时NaClO首先结合氢离子生成HClO,HClO表现强强化性,将NO氧化为,自身被还原为Cl-,其离子方程式为2NO+3HClO+H2O 2+3Cl-+5H+,故答案为:2NO+3HClO+H2O 2+3Cl-+5H+;
③脱除NOx的反应为2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+,可反应可知pH<5.5时随pH升高,氢离子浓度减小,有利于平衡正向移动,从而提高NOx脱除率,故答案为:溶液初始pH高,c(H+)小,有利于2NO+3HClO+H2O 2+3Cl-+5H+和2NO2+HClO+H2O 2+Cl-+3H+正向进行,NOx脱除率大;
(3)①NO2在电解池中被I-还原为NO,而I-被氧化为I2,结合电解质环境H3PO4提供氢离子最终生成,根据得电子守恒可得反应方程式NO2+2I-+2H3PO4=NO+I2+2+H2O,故答案为:NO2+2I-+2H3PO4=NO+I2+2+H2O;
②可用转移电子物质的量表示NOx的物质的量,则脱除前NOx的物质的量为a mol,脱除后NOx的物质的量为b mol,NOx的脱出率为,故答案为:;
③测量结束后,电解池中还检测到少量和,说明NOx没有完全转化为NO2,导致NO2测定值偏低,故答案为:偏低。
答案第1页,共2页
答案第1页,共2页
同课章节目录
