2024届高三新高考化学大一轮专题训练题-- --工业流程题(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练题-- --工业流程题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 12:44:41 | ||
图片预览




文档简介
2024届高三新高考化学大一轮专题训练题----工业流程题
1.(2023·全国·模拟预测)稀土(RE)是元素周期表第Ⅲ族副族元素钪(Sc)、钇(Y)和镧系元素共17种化学元素的合称,是隐形战机、超导、核工业等高精尖领域必备的原料,但是稀土的开采和加工对环境破坏比较大。从某种矿物(含铁、铝等元素)中提取稀土的工艺如图:
已知:①月桂酸(C11H23COOH)熔点为44 ℃,月桂酸和(C11H23COO)3RE均难溶于水。
②该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8。
③Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表:
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“过滤1”前,用NaOH溶液调pH,控制的范围为 ,得到的滤渣主要成分为 。
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为4.8g/L。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于 mol·L-1 (保留两位有效数字)。
(3)①“加热搅拌”控制在55℃,其原因是 。
②“操作X”的过程为先 ,再固液分离。
(4)该工艺中,可再生循环利用的物质有 (写化学式)。
(5)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作航空航天或耐高温材料。通常用电解熔融ScCl3制备金属钪,ScCl3易水解,工业上制备无水ScCl3过程中与NH4Cl共热。原理为:
I.ScCl3(s)+H2O(g)ScOCl(s)+2HCl(g);
II. (完成方程式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为 。
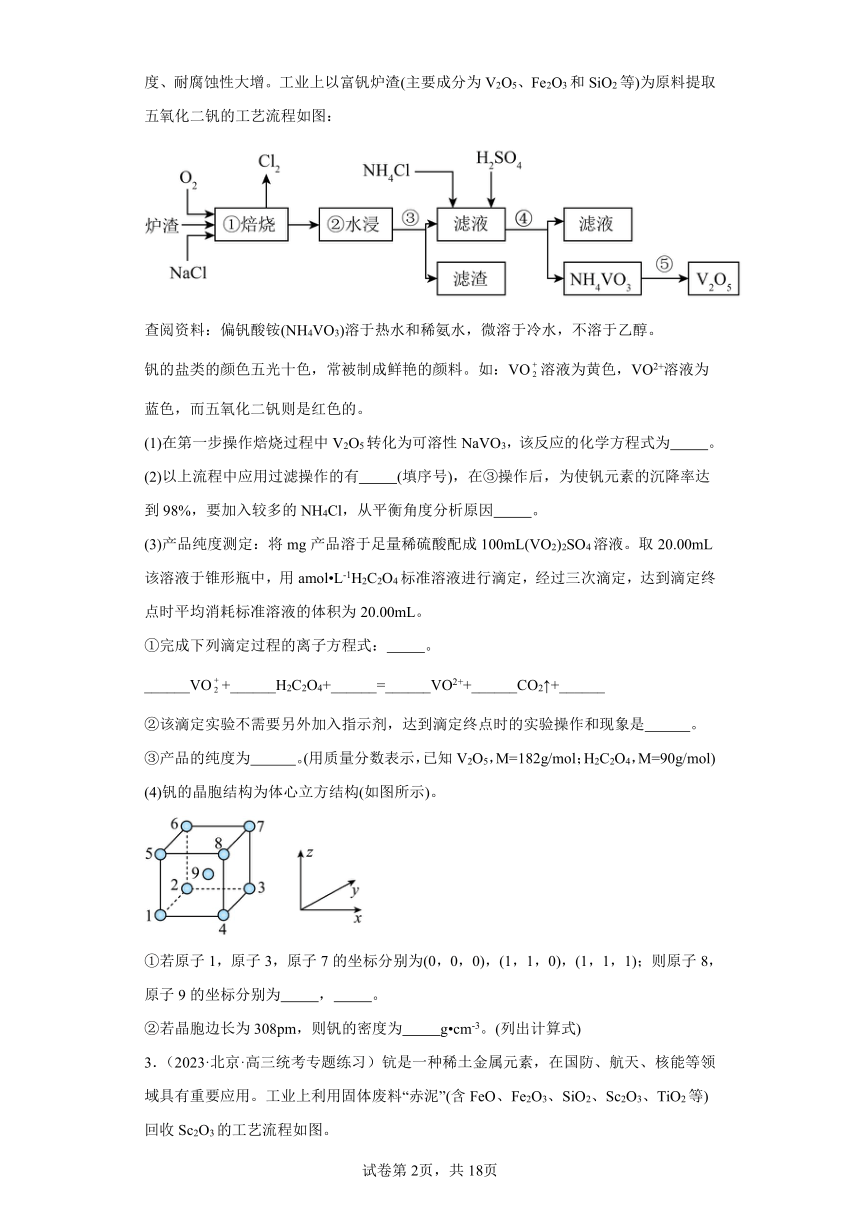
2.(2023·黑龙江哈尔滨·哈尔滨三中校考二模)在钢中加入一定量的钒,就能使钢的硬度、耐腐蚀性大增。工业上以富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)为原料提取五氧化二钒的工艺流程如图:
查阅资料:偏钒酸铵(NH4VO3)溶于热水和稀氨水,微溶于冷水,不溶于乙醇。
钒的盐类的颜色五光十色,常被制成鲜艳的颜料。如:VO溶液为黄色,VO2+溶液为蓝色,而五氧化二钒则是红色的。
(1)在第一步操作焙烧过程中V2O5转化为可溶性NaVO3,该反应的化学方程式为 。
(2)以上流程中应用过滤操作的有 (填序号),在③操作后,为使钒元素的沉降率达到98%,要加入较多的NH4Cl,从平衡角度分析原因 。
(3)产品纯度测定:将mg产品溶于足量稀硫酸配成100mL(VO2)2SO4溶液。取20.00mL该溶液于锥形瓶中,用amol L-1H2C2O4标准溶液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准溶液的体积为20.00mL。
①完成下列滴定过程的离子方程式: 。
______VO+______H2C2O4+______=______VO2++______CO2↑+______
②该滴定实验不需要另外加入指示剂,达到滴定终点时的实验操作和现象是 。
③产品的纯度为 。(用质量分数表示,已知V2O5,M=182g/mol;H2C2O4,M=90g/mol)
(4)钒的晶胞结构为体心立方结构(如图所示)。
①若原子1,原子3,原子7的坐标分别为(0,0,0),(1,1,0),(1,1,1);则原子8,原子9的坐标分别为 , 。
②若晶胞边长为308pm,则钒的密度为 g cm-3。(列出计算式)
3.(2023·北京·高三统考专题练习)钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10 38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为 ;滤渣I的主要成分是 (填化学式)。
(2)“氧化”时加入足量H2O2的目的是 ;氧化后溶液中Fe3+浓度为0.001 mol L 1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为 (忽略调pH前后溶液的体积变化)。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+,该反应的平衡常数K= (用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,写出反应的化学方程式 。
4.(2023·黑龙江齐齐哈尔·统考一模)一种废镍催化剂中含有Ni、 Al、Cr。、Cu、FeS及碳粉,以其为原料制备环烷酸镍[(C10H8COO)2Ni,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Fe3+ Fe2+ Ni2+ Cu2+
开始沉淀的pH 1.9 7.0 6.4 5.4
完全沉淀的pH 3.2 9.0 8.4 6.7
回答下列问题:
(1)充分“灼烧”后,产生废气中的有毒气体的化学式为 。
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、 。基态Cr原子的价层电子排布式为 。
(3)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是 。
(4)“调pH”时,溶液pH的范围为 。
(5)常温下,CuS的Ksp极小,用S2-可将Cu2+完全沉淀。CuS晶胞中S2-的位置如图1所示,Cu2+位于S2-所构成的四面体中心,晶胞侧视图如图2所示。
①与S2-距离最近的S2-数目为 。
②CuS的晶胞参数为a pm,阿伏加德罗常数的值为NA,则CuS晶体的密度为 g·cm-3。
(6)环烷酸的化学式为C10H8COOH,写出“合成”反应的化学方程式: 。
(7)测定样品纯度:已知环烷酸镍样品中含有环烷酸杂质。取1.000g环烷酸镍样品,加入足量稀硫酸[发生反应:(C10H8COO)2Ni+H2SO4=2C10H8COOH+ NiSO4]后,用氨水调节溶液pH为9~10时,加入紫脲酸胺作指示剂,用0.1000mol· L-1 EDTA标准溶液滴定(Ni2+与EDTA反应的化学计量数之比为1:1),消耗EDTA标准溶液20.00mL。则环烷酸镍样品纯度为 %。
5.(2023·河北衡水·衡水市第二中学校考模拟预测)近日,科学家利用光催化剂实现高选择性制备氢气。某小组以辉铋矿(主要成分是,含少量、Bi、和等杂质)为原料制备钒酸铋()的流程如下:
已知:
①滤液1中所含阳离子主要有、、和。
②几种氢氧化物沉淀的pH如表所示。
氢氧化物
开始沉淀pH 7.5 2.3 4.0
沉淀完全pH 9.7 3.7
回答下列问题:
(1)滤渣2的主要成分是 (填化学式)。将辉铋矿粉碎过筛制成矿粉,其目的是 。
(2)“酸洗”中用盐酸代替水的目的是 。滤液3可以循环用于“ ”工序(填名称)。
(3)“氯化”的化学方程式为 。
(4)“合成”过程中将溶液和溶液混合容易形成胶体,导致过滤困难。为防止生成胶体可采用的措施为 (任答一条)。
(5)已知辉铋矿中所含Bi元素的质量分数为a%,wt这种矿石经上述转化最终制得b kg ,则铋的收率为 %()。
(6)的立方晶胞结构如图所示。已知晶体密度为,设为阿伏加德罗常数的值,则该晶体中与距离最近且相等的有 个,相邻2个的核间距为 nm。
6.(2023·北京·高三专题练习)煤化学链技术具有成本低、能耗低的捕集特性。以铁矿石(主要含铁物质为)为载氧体的煤化学链制氢 艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是 。
(2)分离燃烧反应器中产生的(g)和,可进行高纯捕集和封存,其分离方法是 。
(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡()溶液。
ii.用重铬酸钾()标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时溶液过量会对测定结果产生影响,分析影响结果及其原因 。
(4)测定燃烧反应后产物中单质铁含量:取a g样品,用溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b 溶标准液,消耗标准液V mL。已知被还原为,样品中单质铁的质量分数为 。
(5) 艺中不同价态铁元素含量测定结果如下。
①制氢产物主要为,写出蒸汽反应器中发生反应的化学方程式 。
② 艺中可循环使用的物质是 (填化学式)。
7.(2023·江苏·高三专题练习)以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图:
(1)“焙烧”过程中AlCl3最终转化为Al2O3和 (填化学式)。
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol L-1,“除杂”需要调节溶液的pH不低于 。
(3)离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为 。
(4)已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有 。
(5)“合成”在高温下进行,其化学方程式为 。
(6)LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
8.(2023·北京·高三专题练习)是重要化工原料。由软锰矿制备的一种工艺流程如下:
资料:①软锰矿的主要成分为,主要杂质有和。
②金属离子沉淀的
开始沉淀时 1.5 3.4 5.8 6.3
完全沉淀时 2.8 4.7 7.8 8.3
③该工艺条件下,与不反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是 。
②溶出时,的氧化过程及得到的主要途径如图所示。
ⅰ.Ⅱ是从软锰矿中溶出的主要反应,反应的离子方程式是 。
ⅱ.若全部来自于反应,完全溶出所需与的物质的量比值为2。而实际比值(0.9)小于2,原因是 。
(2)纯化
已知:的氧化性与溶液有关。纯化时先加入,后加入,调溶液。说明试剂加入顺序及调节的原因: 。
(3)电解
纯化液经电解得,生成的电极反应式是 。
(4)产品纯度测定
向产品中依次加入足量和足量稀,加热至充分反应,再用溶液滴定剩余至终点,消耗溶液的体积为。(已知:及均被还原为。相对分子质量: 86.94; 134.0)
产品纯度为 (用质量分数表示)。
9.(2023·辽宁葫芦岛·统考一模)碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
已知:①还原焙烧的主反应为
②氧化能力
可能用到的数据如下:
氢氧化物
开始沉淀pH 1.5 6.5 4.2 8.3
沉淀完全pH 3.7 9.7 7.4 9.8
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为 ,中存在过氧键(),请问中S的化合价为 。
(2)在实验室进行步骤B操作时,可能用到的主要仪器为 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是 。
(4)步骤G发生的离子方程式为 ,若Mn2+恰好沉淀完全时测得溶液中的浓度为mol·L,则 。
(5)实验室可以用溶液来检验Mn2+是否完全发生反应,请写出对应的离子方程式 。
10.(2023·吉林白山·统考三模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1))在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为 ,的空间结构为 。
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式: ;“ 含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的= 。[已知:Ka1 (H2SO3)=l.4×10-2;Ka2(H2SO3)=6. 0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为 (填化学式),分离“滤液”'“滤渣”的操作名称为 。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是 (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS) :ZnS(s) +Cu2+ (aq) CuS(s)+Zn2+(aq) ,该反应的平衡常数K= 。 [已知:Ksp(ZnS)=1. 6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2 +Zn+(1+ )H2O+ZnSO4MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为 。
11.(2023·江西上饶·铅山县第一中学校联考模拟预测)氯酸镁[]常用作催熟剂、除草剂等,制备少粉量的流程如图所示:
已知:
①卤块主要成分为,含有较多的、、等杂质。
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。
(1)过滤的主要玻璃仪器是 。
(2)加调节pH后过滤所得滤渣的主要成分为 。
(3)试剂X的滴加顺序为 (填字母)。
a.溶液,溶液,过滤后加适量盐酸
b.溶液,溶液,过滤后加适量盐酸
c.以上两种顺序都可
(4)加入饱和溶液后发生反应的化学方程式为 ,再进一步制取的实验步骤依次为①蒸发结晶;② ;③冷却结晶;④过滤、洗涤。
(5)产品中含量的测定:
步骤1:准确称量4.20g产品配成100mL溶液;
步骤2:取10.00mL于锥形瓶中,加入30.00mL 0.200 溶液;
步骤3:用0.100的碘液滴定剩余的,此过程中反应的离子方程式为;
步骤4:将步骤2、3重复两次,平均消耗标准碘液20.00mL。
①步骤2中,硫元素被氧化至最高价态,试写出该反应的离子方程式: 。
②产品中的质量分数为 (保留两位有效数字)。
12.(2023·安徽蚌埠·统考二模)如图是以硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、A12O3)为原料生产硼酸及轻质氧化镁的工艺流程:
回答下列问题:
(1)为了提高硼镁矿的“溶浸”速率,工业中可以采取下列适当措施 ( 填序号)。
A.升高溶浸温度 B.加快搅拌速度 C.缩短酸浸时间
(2)滤渣的主要成分有 。
(3)吸收过程中发生的离子方程式为 ,的空间构型为 。
(4)沉镁时调pH≈6.5的原因是 。
(5)已知溶浸后得1000L含Mg2+3.0mol·L-1的溶液,假定过滤I和过滤II两步Mg2+损.耗率共10%,沉镁时沉淀率99.9% ,最多能生成Mg( OH)2· MgCO3 kg(保留到小数点后第1位)。
13.(2023·北京·高三专题练习)工业以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰()。其工业流程如下:
(1)浸锰过程中与反应的离子方程式为,该反应是经历以下两步反应实现的。
i.
ii.……
写出ii的离子方程式: 。
(2)氧化过程中被氧化的物质主要有(写化学式): 。
(3)“浸锰”反应中往往有副产物生成,温度对“浸锰”反应的影响如图所示:
为减少的生成,“浸锰”的适宜温度是 ,向过滤II所得的滤液中加入溶液时温度不宜太高的原因是 。
(4)加入溶液后,生成沉淀,同时还有气体生成,写出反应的离子方程式: 。
(5)滴定法测产品纯度
I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:;
II.加入过量KI溶液和适量稀,沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L 溶液进行滴定,发生反应:,滴定终点时消耗溶液20.00mL。
①写出II中反应的离子方程式 ;
②判断滴定终点的方法是 ;
③假设杂质不参与反应,则产品纯度为 。(保留四位有效数字)
14.(2022·重庆·高三专题练习)磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100gH2O)如表:
温度/℃ 0 20 30 40 100
NH4Fe(SO4)2 70.6 75.4 78.3 81.0 102.1
NH4Al(SO4)2 2.1 5.0 7.7 10.9 26.7
(1)气体I中的成分中除氧气外,还有 。
(2)写出“焙烧II”中Fe2O3发生的化学反应方程式 。
(3)写出滤渣I主要成分的一种用途 。
(4)从滤液中获得NH4Al(SO4)2的操作是 。
(5)“反应III”在隔绝空气条件下进行,参与反应的n(FeS2):n(Fe2O3)= 。
(6)该工业流程中有多种气体产生,将它们综合利用可合成流程中的某种反应物,该合成总反应的化学方程式为 。
(7)为测定Al2O3产品的纯度(Al2O3的质量分数),称量mg样品溶解于足量稀硫酸,配成100.00mL溶液,取出20.00mL溶液,加入c1mol L-1EDTA标准溶液V1mL,调节溶液pH并煮沸,冷却后用c2mol L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则制得的Al2O3的纯度为 (用代数式表示)。
15.(2023·广东·模拟预测)电解金属锰阳极渣(主要成分,杂质为、、元素的化合物)和黄铁矿为原料可制备,其流程如图所示:
已知:、,回答下列问题:
(1)锰原子价层电子的轨道表示式为 ,它处于周期表的 区,中的化合价为 。
(2)“酸浸”时,所用的稀酸X是 。
(3)“酸浸”过程中,、的质量浓度、浸出率与时间的关系如图1所示。
内,浸出元素的主要离子方程式为 。
(4)若“净化”过程中的浓度为,则此时的浓度为 。
(5)是一种两性氧化物,用软锰矿(主要成分为,含少量铁的氧化物)和可制备高纯。保持投料量不变,随与投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当时,产率减小的原因是 。
(6)碳酸锰在空气中加热可以生成相应的氧化物,称取碳酸锰(摩尔质量)加热,固体物质的质量随温度的变化如图3所示。
527.4℃时,生成相应固体物质的化学方程式为 。
16.(2023·福建·统考模拟预测)FeOOH为一种不溶于水的黄色固体。某学校以废料(含少量、FeO等)为原料制备FeOOH,流程如图所示。
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有 (填一种即可)。
(2)“废渣”的主要成分可用于 (填一种即可)。
(3)“酸浸”时 (填“能”或“不能”)使用稀,原因是 。
(4)“试剂X”可使用 (填化学式,填一种即可)。
(5)从“滤液2”中获得晶体的一种方法是: 、过滤、洗涤。
(6)由转化为FeOOH的离子方程式是 。
(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
熔点/℃ 硬度 水溶性 导电性 水溶液与反应
A 811 较大 易溶 水溶液或熔融时导电 白色沉淀
B 3550 很大 不溶 不导电 不反应
C -114.2 很小 易溶 液态不导电 白色沉淀
根据以上实验数据,填写表格:
化学式 晶体类型 微粒间作用力
A
B
C
17.(2023·山东·高三专题练习)硼化钛(结构式为B=Ti=B)常用于制备导电陶瓷材料和PTC材料。工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)为原料制取的流程如下:
已知:①电弧炉是由石墨电极和石墨坩埚组成的高温加热装置;
②高温下蒸气压大、易挥发;
③可溶于热的浓硫酸形成。
回答下列问题:
(1)滤渣的主要成分为 (填化学式)。
(2)“水解”需在沸水中进行,离子方程式为 ,该工艺中,经处理可循环利用的物质为 (填化学式)。
(3)“热还原”中发生反应的化学方程式为 ,的实际用量超过了理论化学计量所要求的用量,原因是 。仅增大配料中的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是 (用化学方程式解释)。
(4)原料中的可由硼酸脱水制得。以为原料,用电渗析法制备硼酸()的工作原理如图所示,产品室中发生反应的离子方程式为 。若反应前后NaOH溶液的质量变化为m kg,则制得的质量为 kg。
18.(2023春·广东·高三校联考开学考试)镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体的工艺流程如下。
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为价。
②部分金属阳离子沉淀的如下表。
沉淀物
开始沉淀 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀 3.2 8.9 9.2 1.1 5.2 9.2
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有 (任写1条)。
(2)“调”时溶液的范围是 ,所得滤渣1的主要成分为 (填化学式)。
(3)“氧化分离”操作控制溶液,加入发生反应的离子方程式为 。
(4)“溶解1”操作中加入的作用为 ,“沉钴”操作过程中发生反应的离子方程式为 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为 。
(6)碱金属可以插入石墨层中,钾的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
C—C键的键长为,则K层中m与n两个K原子之间的距离为 ,设为阿伏加德罗常数的值,若晶胞参数分别为、、,则该石墨插层化合物的晶胞密度为 (用含x、y、z、的代数式表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 4.7≤pH<6.2 Al(OH)3、Fe(OH)3
(2)3.0×10-4
(3) 低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离 冷却结晶
(4)MgSO4
(5)ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g)
(6)O2+4e-+2H2O=4OH-
【分析】从某种矿物(含铁、铝等元素)中提取稀土元素RE时,先将矿物用酸化的MgSO4溶液浸取,浸取液中加入氧化剂将Fe2+氧化,再调节pH,使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,同时需防止RE3+离子生成沉淀:过滤后,往滤液1中加入月桂酸钠,将RE3+转化为(C11H23COO)3RE沉淀;MgSO4全部进入滤液2;将滤饼中加入盐酸,并维持在55℃,加热搅拌,冷却结晶后,将月桂酸转化为沉淀,然后过滤分离。
【详解】(1)“过滤1”前,用NaOH溶液调pH,在此步操作中,需除去的杂质离子为Fe3+、Al3+,并将它们转化为氢氧化物沉淀,但不能将RE3+转化为沉淀,所以需控制的范围为4.7≤pH<6.2,得到的滤渣主要成分为Al(OH)3、Fe(OH)3。答案为:4.7≤pH<6.2;Al(OH)3、Fe(OH)3;
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为4.8g/L,物质的量浓度为0.2mol/L。Ksp [(C11H23COO)2Mg]=1.8×10-8,c(C11H23COO-)=mol·L-1=3.0×10-4mol·L-1。答案为:3.0×10-4;
(3)①“加热搅拌”的目的,是将(C11H23COO)3RE充分溶解,并转化为RECl3和C11H23COOH,此时既需控制温度,又需保证盐酸具有一定的浓度,则控温在55℃,其原因是:低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离。
②“操作X”的过程中,需将C11H23COOH转化为沉淀,所以应先冷却结晶,再固液分离。答案为:低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离;冷却结晶;
(4)该工艺中,滤液②中含有大量的MgSO4,可再生循环利用的物质有MgSO4。答案为:MgSO4;
(5)通常用电解熔融ScCl3制备金属钪,ScCl3易水解,工业上制备无水ScCl3过程中与NH4Cl共热。原理为:
I.ScCl3(s)+H2O(g)ScOCl(s)+2HCl(g);
II. 应将ScOCl(s)转化为ScCl3(s),则ScOCl(s)与NH4Cl(s)反应的方程式为:ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g)。答案为:ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g);
(6)Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,则在正极,O2得电子产物与电解质反应生成OH-,发生的电极反应为O2+4e-+2H2O=4OH-。答案为:O2+4e-+2H2O=4OH-。
【点睛】月桂酸(C11H23COOH)熔点为44℃,冷却结晶时,溶液温度应降到44℃以下。
2.(1)2V2O5+O2+4NaCl4NaVO3+2Cl2
(2) ③和④ 偏钒酸铵微溶于冷水,铵根离子浓度增大,促进生成偏钒酸铵沉淀平衡正向移动,增加铵根的浓度促进偏钒酸根水解平衡正向移动,钒元素沉降率增大
(3) 2VO+H2C2O4+2H+=2VO2++2CO2↑+2H2O 当滴入最后半滴标准液后,溶液变为蓝色,且半分钟内不恢复到原来的的颜色 %
(4) (1,0,1) (,,)
【分析】根据题意,焙烧时将五氧化二钒转化为偏钒酸钠,氧化铁和二氧化硅无变化,其反应为2V2O5+O2+4NaCl4NaVO3+2Cl2;水浸后除去氧化铁和二氧化硅,向滤液中加入氯化铵和硫酸可分离出偏钒酸铵,高温灼烧偏钒酸铵分解得到五氧化二钒,以此解答。
【详解】(1)在第一步操作焙烧过程中V2O5转化为可溶性NaVO3,该过程中O元素由0价下降到-2价,Cl元素由-1价上升到0价,根据得失电子守恒和原子守恒配平方程式为:2V2O5+O2+4NaCl4NaVO3+2Cl2。
(2)根据流程可知,水浸后偏钒酸钠溶于水,氧化铁和二氧化硅不溶于水。需过滤除去;在滤液中加入氯化铵和硫酸后有偏钒酸铵析出,需过滤得到偏钒酸铵;应用过滤操作的有③和④;偏钒酸铵微溶于冷水,铵根离子浓度增大,促进生成偏钒酸铵沉淀平衡正向移动,增加铵根的浓度促进偏钒酸根水解平衡正向移动,钒元素沉降率增大。
(3)①有CO2气体生成,则反应应在酸性条件下进行,结合氧化还原反应的电子守恒规律、电荷守恒和原子守恒可得2VO+H2C2O4+2H+=2VO2++2CO2↑+2H2O;
②VO溶液为黄色,VO2+溶液为蓝色,所以终点的现象为:当滴入最后一滴标准液后,溶液由黄色变为蓝色,且半分钟内不恢复到原来的颜色;
③根据反应可得关系式2 VO~ H2C2O4,可得c(VO)=,带入数据可得c(VO)=2amol/L,n(VO)=cV=2amol/L0.1L, 又2VO~V2O5,故n(V2O5) = = 0.1amol,m(V2O5)=nM= 0.1amol182g/mol=18.2ag,样品的纯度为=%。
(4)①由晶胞结构可知,原子8位于晶胞的顶点,坐标为:(1,0,1);原子9位于晶胞的体心,坐标为:(,,);
②晶胞中V的个数为1+8=2,若晶胞边长为308pm,则钒的密度为=。
3.(1) 将“赤泥”粉碎 SiO2、TiO2
(2) 将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+ 99%
(3)
(4)2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O
【分析】“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,FeO、Fe2O3、Sc2O3与盐酸反应生成 Fe2+、Fe3+、Sc3+,过滤的滤渣主要成分为SiO2、TiO2,滤液中加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+,加氨水调节pH值沉淀铁离子,过滤得固体沉淀物为Fe(OH)3沉淀,向滤液中加入草酸,得到草酸钪晶体,过滤洗涤干燥后,在空气中加热可得Sc2O3固体。
【详解】(1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;故答案为:将“赤泥”粉碎;SiO2、TiO2。
(2)由分析可知,氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度c(OH-)=10 11 mol L 1,此时三价铁的浓度为,则Fe3+的去除率为;故答案为:将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;99%。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4=Sc2(C2O4)3+6H+的平衡常数;故答案为:。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,草酸根被氧化为二氧化碳,说明氧气参与反应,则反应的化学方程式2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O;故答案为:2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O。
4.(1)SO2
(2) 、 3d54s1
(3)浓H2SO4稀释放热,可节约能耗、加快反应速率
(4)3. 2≤pH<5.4
(5) 12
(6)2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O
(7)80. 60
【分析】废镍催化剂(含有Ni、 Al、Cr、Cu、FeS及碳粉) 通入空气灼烧,C元素转化为CO2、S元素转化为SO2从而除去,用NaOH溶液进行碱浸,Al、Cr的氧化物与NaOH反应溶解,过滤取滤渣,干燥后金属元素转化为相应的氧化物,之后加入硫酸溶解过滤,得到含有Ni2+、Fe2+、 Fe3+、 Cr3+等阳离子的溶液,加入试剂X调节pH使Fe元素转化为沉淀,加硫酸铵除铜,过滤后经过结晶得到硫酸镍,经过氨化,得到Ni2(OH)2SO4、、NH3·H2O的混合物,加入环烷酸合成环烷酸镍,经过汽油萃取环烷酸镍,分液分离有机层,蒸馏分离最终得到产品。
【详解】(1)根据分析,充分“灼烧”后,产生废气中的有毒气体的化学式为SO2;
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、、;Cr的原子序数为24,核外电子数为24,根据洪特规则特例,基态Cr原子的价层电子排布式为3d54s1;
(3)浓硫酸在稀释过程中会放热,温度越高,反应速率越快,故答案为:浓H2SO4稀释放热,可节约能耗、加快反应速率;
(4)调节pH的目的是使Fe3+完全沉淀,而Cu2+不沉淀,根据题目所给数据可知pH的范围为3. 2≤pH<5.4;
(5)①离顶点的S2-最近的S2-位于面心,个数为,故与S2-距离最近的S2-数目为12;
S2-位于顶点和面心,个数为8+6=4,根据化学式可知,存在4个Cu2+,则晶胞质量为g=,晶胞体积为(a)3cm3,则晶胞密度=g·cm-3;
(6)环烷酸的化学式为C10H8COOH,“合成”反应中C10H8COOH与Ni2(OH)2 SO4反应生成(C10H8COO)2Ni、硫酸镍和水,反应的化学方程式为2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O;
(7)根据反应:(C10H8COO)2Ni+H2SO4=2C10H8COOH+ NiSO4]可知关系式为(C10H8COO)2Ni ~(Ni2+~EDTA,则环烷酸镍样品纯度为=80.60%。
5.(1) 增大接触面积,加快浸取速率
(2) 将转化为 浸取
(3)
(4)搅拌、加热等
(5)
(6) 12
【分析】辉铋矿(主要成分是,含少量、Bi、和等杂质)加盐酸溶解,同时加氯化铁将硫氧化为单质,得到滤液主要成分为、,同时有过量的盐酸和氯化铁,滤渣1为硫单质和;滤液1中加双氧水将亚铁离子氧化为三价铁,再加NaOH将三价铁转化为沉淀,过滤后,滤液2中含有氯化铋、氯化钠稀释,促进氯化铋水解生成和HCl,过滤后,滤饼溶于稀盐酸得到,与发生反应得到和二氧化硫,与反应生成,据此分析解答。
【详解】(1)由以上分析可知滤渣2主要成分为,将辉铋矿粉碎过筛制成矿粉,可以增大矿粉与溶液的接触面积,加快溶解速率,故答案为:;增大接触面积,加快浸取速率;
(2)滤液2稀释,促进氯化铋水解生成,过滤后,滤饼溶于稀盐酸得到,滤液3中含有水解生成的HCl,可用于浸取,故答案为:将转化为;浸取;
(3)与发生反应得到和二氧化硫,反应方程式为:,故答案为:;
(4)为防止生成胶体在合成过程中可不断搅拌或者加热条件下合成,故答案为:搅拌、加热等;
(5)辉铋矿中所含Bi元素的质量分数为a%,wt矿石中Bi的含量为:,最终制得b kg,则实际回收的Bi的质量为,铋的收率为=%,故答案为:;
(6)该晶体中分别位于顶点和面心,与距离最近且相等的有12个,该晶胞中含有4个和4个,晶胞质量为g,晶胞边长为:cm,相邻2个的核间距为面对角线的一半,即为nm,故答案为:12;。
6.(1)增大接触面积,升高温度,提高化学反应速率
(2)冷凝
(3)过量的能与反应,导致测定结果(铁元素含量)偏高
(4)
(5) ; ()
【分析】铁矿石(主要含铁物质为)与C反应生成气态水、二氧化碳、单质铁和氧化亚铁,单质铁和氧化亚铁与水蒸气反应生成四氧化三铁与氢气,500度以下在空气中加热Fe3O4粉末,可以生成Fe2O3,据此分析解题。
【详解】(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是增大接触面积,升高温度,提高化学反应速率;
(2)分离燃烧反应器中产生的(g)和,可进行高纯捕集和封存,其分离方法是冷凝,因为经过冷凝后气态水转化为液态水;
(3)配制铁矿石待测液时溶液过量会对测定结果产生影响,分析影响结果及其原因过量的能与反应,导致测定结果(铁元素含量)偏高;
(4)已知被还原为,关系式为 ,样品中单质铁的质量b×V ×10-3L×56g/mol×2=0.112bVg,质量分数为;
(5)①制氢产物主要为,蒸汽反应器中发生反应的化学方程式;;
②据分析可知, 艺中可循环使用的物质是()。
7.(1)HCl
(2)11
(3)在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+
(4)随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大
(5)Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑
(6)4
【分析】粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料进行焙烧进行一定的转化,根据题设问可知,“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,加水溶解后“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。继续加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,可得到富集的Li+;加入碳酸钠溶液后,发生2Li++CO=Li2CO3↓,得到Li2CO3与H2C2O4和FePO4反应,反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
【详解】(1)“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,故答案是HCl;
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等,加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol L-1,则此时溶液中c(OH-)==,故c(H+)===10-11,故“除杂”需要调节溶液的pH不低于11;
(3)离子筛法“富集”锂的原理如图分析,离子筛中含H+和Li+,若在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+,故答案是在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+;
(4)由图像可知,温度越高,Li2CO3溶解度减小,越易产生沉淀;“沉锂”发生2Li++CO=Li2CO3↓,温度越高,反应速率越大,相同时间内产生Li2CO3含量越大,故“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大;
(5)“合成”在高温下进行,其化学方程式为Li2CO3与H2C2O4和FePO4反应生成产物LiFePO4,分析元素化合价变化,可知FePO4中铁元素化合价由+3降到+2,做氧化剂,H2C2O4中碳元素化合价由+3价,升高到+4价,其产物是CO2,根据氧化还原反应,故反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
(6)由题图可知,小白球表示锂离子,每个晶胞中的锂离子数为8×+4×+4×=4,故一个晶胞中含有LiFePO4的单元数有4个。
8.(1) 增大固体与浓硫酸接触面积,增大反应速率,提高浸出率 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O 二氧化锰能够氧化单质铁为Fe2+
(2)MnO2的氧化性随酸性的减弱逐渐减弱,先加入 MnO2 ,将Fe2+氧化为Fe3+,再通过NH3 H2O 调pH除去溶液中的A13+、Fe3+
(3)Mn2+-2e- +2H2O=MnO2+4H+
(4)
【分析】软锰矿首先进行研磨,可增大固体与硫酸的接触面积,增大反应速率,提高浸出率。加入浓硫酸及过量的铁屑,铁屑与硫酸反应生成硫酸亚铁,亚铁离子与二氧化锰反应生成二价锰离子和铁离子,溶液中还存在铝离子,纯化除去铁离子和铝离子,再电解Mn2+的纯化液制取MnO2。
【详解】(1)①溶出前,软锰矿需研磨,研磨软锰矿可增大固体与浓硫酸接触面积,增大反应速率,提高浸出率。
②根据反应途径可知,Fe与H2SO4反应产生Fe2+,MnO2与Fe2+反应生成Mn2+和Fe3+,则反应的离子方程式为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
根据方程式可知:Fe与MnO2的物质的量比值为2,实际反应时,二氧化锰能够氧化单质铁为Fe2+,导致需要的Fe减少,故实际比值( 0.9)小于2。
(2)MnO2的氧化性与溶液pH有关,且随酸性的减弱,氧化性逐渐减弱,溶液显酸性时,二氧化锰的氧化性较强,故纯化时先加入MnO2,将Fe2+氧化为Fe3+,再后加入NH3·H2O,调溶液pH≈5,除去溶液中的A13+、Fe3+。
(3)电解时,溶液呈酸性,Mn2+失电子与水反应生成二氧化锰和氢离子,则电极反应式为:Mn2+-2e- +2H2O=MnO2+4H+。
(4)根据题意可知:部分草酸钠与二氧化锰发生氧化还原反应,剩余部分再与高锰酸钾反应(5Na2C2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O+5Na2SO4),则与二氧化锰反应的草酸钠:MnO2+Na2C2O4+2H2SO4=Na2SO4+ MnSO4+2CO2↑+2H2O,则n(MnO2)=n(Na2C2O4)=,则产品的纯度为:。
9.(1) 3d54s2 +6
(2)C
(3)使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+
(4) 2.2×10-11
(5)
【分析】软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)中加入木炭粉进行还原焙烧,将MnO2还原为MnO,同时Fe2O3也可能被还原;加入硫酸浸取,过滤出滤渣;加入MnO2将Fe2+氧化为Fe3+,再加入10%NaOH调节溶液的pH,此时Fe3+、Cu2+转化为Fe(OH)3、Cu(OH)2沉淀;过滤后,往滤液中加入NH4HCO3,将Mn2+转化为MnCO3沉淀,分离烘干可得到成品。
【详解】(1)锰为25号元素,基态锰原子的电子排布式为1s22s22p63s23p63d54s2,则价层电子排布式为3d54s2,中存在过氧键(),则S原子在此化合物中不具有还原性,S原子的最外电子数为6,所以中S的化合价为+6。答案为:3d54s2;+6;
(2)B操作为浸取,通常在烧杯中进行,则在实验室进行步骤B操作时,可能用到的主要仪器为烧杯,故选C。答案为:C;
(3)步骤E中调节3.7<pH<8.3,此时Fe3+、Cu2+都完全沉淀,而Mn2+不生成沉淀,则其目的是:使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+。答案为:使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+;
(4)步骤G中,Mn2+与发生反应,生成MnCO3沉淀和CO2气体等,发生的离子方程式为,若Mn2+恰好沉淀完全时测得溶液中的浓度为2.2×10-6mol·L,则=2.2×10-6×1.0×10-5=2.2×10-11。答案为:;2.2×10-11;
(5)实验室可以用溶液来检验Mn2+是否完全发生反应,若含有Mn2+,则被氧化为,对应的离子方程式:。答案为:。
【点睛】除去溶液中的Fe2+时,通常先将其氧化为Fe3+,再通过调节溶液的pH,让Fe3+转化为Fe(OH)3沉淀。
10.(1) 纺锤形 正四面体形
(2) 3FeS+5O2 Fe3O4 +3SO2 6× 10-3
(3) Zn、Fe 过滤
(4) A 2.5×1011
(5)MnO2 +e- + H2O=MnOOH+OH-
【分析】硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用。
【详解】(1)基态S原子的核外电子排布式为:,最高能级的原子轨道为3p轨道,形状为纺锤形,的中心S原子价层电子对数位,无孤电子对,为正四面体形结构,故答案为:纺锤形;正四面体形;
(2)已知“焙砂”中铁元素主要以Fe3O4形式存在,说明 “焙烧”过程FeS中Fe被氧化,S被还原,所以主要发生反应的化学方程式为3FeS+5O2Fe3O4 +3SO2;SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,c(H+)=1×10-5mol/L,已知Ka2(H2SO3)=6.0×10-8,所以=6×10 8,所以=6× 10-3;故答案:为3FeS+5O2Fe3O4 +3SO2;6× 10-3;
(3)浸出液“净化”过程中加入的主要物质为锌粉,过量锌充分反应,可置换出铁,所得“滤渣”的成分为Zn、Fe;过滤可分离“滤液”'“滤渣”;故答案为:Zn、Fe;过滤。
(4)①A.将稀硫酸更换为98%的浓硫酸,将发生氧化还原反应,产生二氧化硫,故A不合理;
B.将硫化锌精矿粉碎,增大接触面积,有利于快浸取反应速率,故B合理;
C.适当升高温度,有利于加快浸取反应速率,故C合理;
故答案选:A。
②反应ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)的平衡常数K=,已知:Ksp(ZnS)=c(Zn2+)·c(S2-)=1.6×10 24,Ksp(CuS)=c(Cu2+)·c(S2-)=6.4×10 36;所以K====2.5×1011,故答案为:2.5×1011。
(5)电池总反应为MnO2+12Zn+(1+x6)H2O+16ZnSO4MnOOH+16[ZnSO4·3Zn(OH)2·xH2O],放电时正极发生还原反应,所以电极方程式为MnO2 +e- + H2O=MnOOH+OH-;故答案为:MnO2 +e- + H2O=MnOOH+OH-。
11.(1)烧杯、漏斗、玻璃棒
(2)
(3)a
(4) 趁热过滤
(5) 95%
【分析】卤块粉碎后,加酸酸浸,得到Mg2+、Cl-、Fe3+、SO,加入过氧化氢,利用过氧化氢的氧化性,将Fe2+氧化成Fe3+,调节pH=4,使Fe3+以氢氧化铁形式沉淀出,过滤后,滤液中含有Mg2+、Cl-、SO,加入试剂X,应除去SO,需要加入BaCl2,加入氯化钡是过量,需要除去,还需要加入碳酸钠溶液,除去多余CO,应是过滤后,再加入适量盐酸,滤液浓缩后,加入饱和氯酸钠溶液,根据溶解度与温度的关系,发生2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,经过一系列操作得到产品,据此分析;
【详解】(1)过滤的主要仪器有玻璃棒、(普通)漏斗、烧杯;故答案为玻璃棒、(普通)漏斗、烧杯;
(2)加入过氧化氢,利用过氧化氢的氧化性,将Fe2+氧化成Fe3+,调节pH=4,使Fe3+以氢氧化铁形式沉淀出;故答案为Fe(OH)3;
(3)加入除杂试剂往往过量,过量除杂试剂需要除去,滤液中含有Mg2+、Cl-、SO,加入试剂X,应除去SO,需要加入BaCl2,加入氯化钡是过量,需要除去,还需要加入碳酸钠溶液,除去多余CO,应是过滤后,再加入适量盐酸;故答案为a;
(4)浓缩后溶液为饱和溶液,溶液中有Mg2+、Cl-,根据溶解度与温度可知,氯化钠溶解度较小,加入氯酸钠饱和溶液,会有NaCl晶体析出,即反应方程式为2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,反应后溶液中溶质为Mg(ClO3)2、NaCl,因NaCl溶解度低,因此蒸发结晶时,有NaCl晶体析出,然后趁热过滤,除去NaCl,Mg(ClO3)2溶解度受温度的影响较大,冷却结晶,得到Mg(ClO3)2·6H2O,故答案为2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;趁热过滤;
(5)①硫元素被氧化至最高价态,即被氧化成SO,ClO作氧化剂,被还原为Cl-,根据化合价升降、原子守恒和电荷守恒,其离子方程式为;故答案为;
②根据化学反应,剩余的硫代硫酸钠的物质的量是,消耗的硫代硫酸钠的物质的量是,根据反应,氯酸根离子的物质的量是,的质量分数是,故答案为95%。
12.(1)AB
(2)SiO2、Fe2O3、Al2O3
(3) NH3 += + 正四面体形
(4)pH过小Mg2+难水解生成Mg(OH)2,pH过大生成Mg(OH)2过多,不利于Mg(OH)2·MgCO3生成
(5)191.5
【分析】硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、A12O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3+2H2O=Mg(OH)2· MgCO3↓+2,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4;
【详解】(1)根据流程图知,硼镁矿粉中加入硫酸铵溶液,为了提高溶浸速率,可以采取适当升温、适当增大溶浸液浓度、研磨成粉末、搅拌等措施,答案选AB;
(2)根据分析可知,滤渣为难溶性的SiO2、Fe2O3、Al2O3;
(3)得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,发生的离子方程式为NH3 += + ;
中心原子N电子对数=4+=4,中心原子是sp3杂化,没有一对孤电子对,所以的立体结构是正四面体型;
(4)沉镁时调pH≈6.5的原因是:pH过小Mg2+难水解生成Mg(OH)2,pH过大生成Mg(OH)2过多,不利于Mg(OH)2·MgCO3生成;
(5)根据镁守恒可知,最多能生成Mg( OH)2· MgCO3的质量为1000L3.0mol/L(1-10%)99.9%142g/mol=191.5kg。
13.(1)
(2)、(等)
(3) 90℃ 防止受热分解,以提高原料利用率
(4)
(5) 滴入最后半滴溶液,蓝色褪去且半分钟内颜色不复原 99.14%
【分析】软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2+++H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体;
【详解】(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+2H+=2Fe2+++H2O,该反应是经过氧化铁与酸反应生成铁离子,铁离子与二氧化硫反应实现的:、;
故答案为:;
(2)具有较强氧化性,氧化过程中被氧化的物质主要有、(等);
(3)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃;NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率;
故答案为:90℃;防止受热分解,以提高原料利用率;
(4)Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:;
故答案为:;
(5)①II中加入过量KI溶液和适量稀,沉淀溶解,溶液变黄,则MnO(OH)2将碘离子氧化生成碘单质,反应的离子方程式为;
②将所有碘单质还原时溶液蓝色褪去,故判断滴定终点的方法是滴入最后半滴溶液,蓝色褪去且半分钟内颜色不复原;
③反应过程,,,关系式为,故n(MnCO3)==0.01mol,假设杂质不参与反应,则产品纯度为=99.14%,答案为99.14%。
14.(1)SO2
(2)Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O
(3)制玻璃、光导纤维等
(4)蒸发浓缩、冷却结晶、过滤、洗涤、干燥
(5)1∶16
(6)2SO2+O2+4NH3+2H2O=2(NH4)2SO4
(7)×100%
【分析】根据高硫铝土矿的成分,焙烧Ⅰ中FeS2与氧气反应4FeS2+11O22Fe2O3+8SO2,根据流程图中,操作Ⅰ后得到滤液主要成分,焙烧Ⅱ中氧化铁和氧化铝与硫酸铵反应,发生非氧化还原反应,根据原子守恒进行分析,其反应方程式为Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O、Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O,气体Ⅱ为氨气,反应Ⅲ中发生FeS2+Fe2O3→SO2↑+Fe3O4,据此分析;
【详解】(1)根据上述分析,焙烧Ⅰ中FeS2与氧气反应4FeS2+11O22Fe2O3+8SO2,气体Ⅰ中成分除氧气外,还含有SO2;故答案为SO2;
(2)该反应为非氧化还原反应,根据原子守恒进行,令Fe2O3的系数为1,则NH4Fe(SO4)2系数为2,NH4Fe(SO4)2含有2个SO,因此硫酸铵的系数为4,即气体为氨气,其反应方程式为Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O;故答案为Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O;
(3)根据上述分析,滤渣Ⅰ为SiO2,可以制玻璃、光导纤维等,故答案为制玻璃、光导纤维等;
(4)根据表中数据,NH4Fe(SO4)2溶解度较小,且变化较大,因此采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)反应Ⅲ中发生FeS2+Fe2O3→SO2↑+Fe3O4,令FeS2物质的量为amol,Fe2O3物质的量为bmol,根据得失电子数目守恒,a×(-2)+2a×[4-(-1)]=b×2×(3-),则a∶b=1∶16,故答案为1∶16;
(6)根据上述分析,产生气体有SO2、NH3,氨气与二氧化硫、氧气反应生成硫酸铵,即反应方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;故答案为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;
(7)Al3+、Cu2+与EDTA反应的化学计量比为1∶1,n(Al3+)+n(Cu2+)=n(EDTA),n(Al3+)= n(EDTA)-n(Cu2+)=V1×10-3L×c1mol/L-V2×10-3L×c2mol/L,根据原子守恒,mg样品中氧化铝纯度为×100%=×100%;故答案为×100%。
15.(1) d +2、+3
(2)稀硫酸
(3)
(4)
(5)过量的消耗了反应生成的Ba(OH)2
(6)
【分析】MnO2在酸性条件下有强氧化性,FeS2有强还原性,二者在酸浸的时候会发生氧化还原反应,结合题图中后续操作后得到的是MnSO4溶液,可知所用的稀酸X为稀硫酸。然后向滤液中加入H2O2可以将杂质离子为Fe2+氧化为Fe3+,再加入CaO调整溶液pH,使Fe3+、Cu2+形成Fe(OH)3、Cu(OH)2沉淀,但是用CaO来调pH又会导致溶液中留下较多的Ca2+,净化阶段加入MnF2的目的就是使Ca2+转化为难溶物CaF2除去,过滤得到的滤液含有MnSO4,然后经一系列处理得到Mn3O4;据此分析解答。
【详解】(1)Mn原子序数为25,价电子排布图为 ,位于周期表中d区;中O为-2价,结合化合物中各元素的代数和为可知,中Mn的化合价既有+2价也有+3价,故答案为: ;d;+2、+3;
(2)由分析知,稀酸X为稀硫酸,故答案为:稀硫酸;
(3)由图可知,内,Mn元素浸出率提高,含量明显增加,说明此时与反应生成Mn2+、、S等,对应的离子方程式为:,故答案为:;
(4)由,的浓度为,可得:;再由,可得,故答案为:;
(5)由题意可知,二氧化锰与硫化钡反应生成氢氧化钡,因反应物是一种两性氧化物,当时,二氧化锰过量,过量的二氧化锰与氢氧化钡反应消耗氢氧化钡,导致其产率降低,故答案为:过量的消耗了反应生成的Ba(OH)2;
(6),则,;527.4℃时,,,可知:,则此时产物为:,反应方程式为:,故答案为:;
16.(1)废料粉碎、适当升高温度、适当增大硫酸浓度等
(2)制取单晶硅
(3) 不能 反应放出有毒的一氧化氮等氮氧化物
(4)Fe
(5)蒸发浓缩、降温结晶
(6)
(7) NaCl 离子晶体 离子键 C(金刚石) 共价晶体 共价键 HCl 分子晶体 分子间作用力
【分析】废料,加入硫酸酸浸二氧化硅不反应成为废渣,铁转化为硫酸盐,加入过量铁,将三价铁转化为二价铁,加入乙醇促使硫酸亚铁晶体析出,晶体加入氢氧化钠、空气得到FeOOH;
【详解】(1)为提高“酸浸”的速率,可采取的措施有废料粉碎、适当升高温度、适当增大硫酸浓度等;
(2)根据分析,废料主要为二氧化硅,可以用于制取单晶硅;
(3)硝酸与亚铁离子反应放出有毒的一氧化氮等气体,故“酸浸”时不能使用稀;
(4)试剂X将三价铁转化为二价铁,且不引入新杂质,故为铁;
(5)从“滤液2”中获得晶体,其方法为蒸发浓缩、降温结晶、过滤、洗涤。
(6)和氢氧化钠溶液、空气中氧气反应生成FeOOH,反应为;
(7)A熔点高、硬度较大,易溶于水、水溶液或熔融时导电,和银离子生成白色沉淀,则为盐酸盐,可以为NaCl,是由钠离子和氯离子构成的离子晶体,存在离子键;
B熔点很高、硬度很大、不溶于水,则为共价晶体,可以为金刚石,是由碳原子直接构成的共价晶体,存在共价键;
C熔点很低、硬度很小,易溶于水且该物质液体不导电,水溶液能和银离子反应生成白色沉淀,则可以为氯化氢,是由氯化氢分子构成的分子晶体,存在分子间作用力。
17.(1)
(2) ++2H+ H2SO4
(3) ++5C+5CO↑ 高温下蒸气压大、易挥发,只有部分参加了反应 ++2C+3CO↑
(4) H++[B(OH)4]-=H3BO3+H2O
【分析】工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)加入稀盐酸,只有不会溶解,可溶于热的浓硫酸形成,在沸水中形成,“热还原”中发生反应的化学方程式为++5C+5CO↑,据此分析解题。
【详解】(1)加入稀盐酸,只有不会溶解,滤渣为;
(2)“水解”需在沸水中进行,在沸水中形成,离子方程式为++2H+,该工艺中,经处理可循环利用的物质为H2SO4;
(3)“热还原”中发生反应的化学方程式为++5C+5CO↑,的实际用量超过了理论化学计量所要求的用量,原因是高温下蒸气压大、易挥发,只有部分参加了反应;仅增大配料中的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是++2C+3CO↑;
(4)有稀硫酸得一极为阳极,1膜为阳离子交换膜,氢离子由左边极室通过1膜进入产品室,2膜为阴离子交换膜,原料室中的[B(OH)4]-通过2膜进入产品室,产品室中发生反应的离子方程式为H++[B(OH)4]-=H3BO3+H2O。原料室中的钠离子通过阳极膜进入右侧极室,由电荷守恒可知,当阴极上通过1mol电子时,NaOH溶液的质量变化为23g-1g=22g,此时制得的物质的量为1mol,质量为62g,若反应前后NaOH溶液的质量变化为m kg,则制得的质量。
18.(1)增大硫酸浓度,升高温度,延长浸取时间等
(2) 、
(3)
(4) 还原生成
(5)重结晶
(6)
【分析】由题中流程可知,镍电池废料(主要成分为镍、钻,还含有铝、铁等),用硫酸浸取后,金属元素转化为对应的离子进入溶液中,加入的目的是将母液中的氧化为,调节溶液,使和完全转化为沉淀和沉淀,过滤,滤渣1为和,向滤液中加入将氧化变成并水解生成沉淀,然后向沉淀中加入和,溶解得到溶液,向溶液中加入得到沉淀,过滤后的沉淀溶解在冰醋酸中得到醋酸钴溶液,将醋酸钴溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到醋酸钴晶体,据此解答。
【详解】(1)为提高浸取速率,除适当升高温度外,还可采取的措施有延长浸取时间、适当增加硫酸浓度等。故答案为:增大硫酸浓度,升高温度,延长浸取时间等;
(2)由后续流程可知,第一次调节时,已经将铁、铝化合物全部除去,则滤渣1的成分除了外,还有,结合表中数据可知,为了使完全沉淀而不沉淀,应当调节溶液的范围是,故答案为:;
(3)“母液”中含有的能够和发生氧化还原反应,根据得失电子守恒和原子守恒,可知反应的离子方程式为,故答案为:;
(4)向中加入、混合液,结合后续流程,最后得到产物中,以二价离子化合物形式存在,所以此时加入的为还原剂,离子方程式为:,故答案为:还原生成,;
(5)为提高醋酸钴晶体纯度,需要重新溶解、浓缩、结晶析出纯度更高的晶体,即重结晶操作,故答案为:重结晶;
(6)根据晶胞结构,K原子在晶胞的8个顶点、6个面心和4个在体内,1个晶胞中含K原子的个数为;由晶胞结构知m与n的距离如图 中的之间距离,C—C键的键长为,则;晶胞中每层石墨烯部分结构中有4条边(8个C原子)处于晶胞面上,其他C原子处于晶胞内部,晶胞中C原子数目,则晶胞的质量,晶胞的体积,所以该晶胞的密度,故答案为:,。
答案第1页,共2页
答案第1页,共2页
1.(2023·全国·模拟预测)稀土(RE)是元素周期表第Ⅲ族副族元素钪(Sc)、钇(Y)和镧系元素共17种化学元素的合称,是隐形战机、超导、核工业等高精尖领域必备的原料,但是稀土的开采和加工对环境破坏比较大。从某种矿物(含铁、铝等元素)中提取稀土的工艺如图:
已知:①月桂酸(C11H23COOH)熔点为44 ℃,月桂酸和(C11H23COO)3RE均难溶于水。
②该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8。
③Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表:
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“过滤1”前,用NaOH溶液调pH,控制的范围为 ,得到的滤渣主要成分为 。
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为4.8g/L。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于 mol·L-1 (保留两位有效数字)。
(3)①“加热搅拌”控制在55℃,其原因是 。
②“操作X”的过程为先 ,再固液分离。
(4)该工艺中,可再生循环利用的物质有 (写化学式)。
(5)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作航空航天或耐高温材料。通常用电解熔融ScCl3制备金属钪,ScCl3易水解,工业上制备无水ScCl3过程中与NH4Cl共热。原理为:
I.ScCl3(s)+H2O(g)ScOCl(s)+2HCl(g);
II. (完成方程式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为 。
2.(2023·黑龙江哈尔滨·哈尔滨三中校考二模)在钢中加入一定量的钒,就能使钢的硬度、耐腐蚀性大增。工业上以富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)为原料提取五氧化二钒的工艺流程如图:
查阅资料:偏钒酸铵(NH4VO3)溶于热水和稀氨水,微溶于冷水,不溶于乙醇。
钒的盐类的颜色五光十色,常被制成鲜艳的颜料。如:VO溶液为黄色,VO2+溶液为蓝色,而五氧化二钒则是红色的。
(1)在第一步操作焙烧过程中V2O5转化为可溶性NaVO3,该反应的化学方程式为 。
(2)以上流程中应用过滤操作的有 (填序号),在③操作后,为使钒元素的沉降率达到98%,要加入较多的NH4Cl,从平衡角度分析原因 。
(3)产品纯度测定:将mg产品溶于足量稀硫酸配成100mL(VO2)2SO4溶液。取20.00mL该溶液于锥形瓶中,用amol L-1H2C2O4标准溶液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准溶液的体积为20.00mL。
①完成下列滴定过程的离子方程式: 。
______VO+______H2C2O4+______=______VO2++______CO2↑+______
②该滴定实验不需要另外加入指示剂,达到滴定终点时的实验操作和现象是 。
③产品的纯度为 。(用质量分数表示,已知V2O5,M=182g/mol;H2C2O4,M=90g/mol)
(4)钒的晶胞结构为体心立方结构(如图所示)。
①若原子1,原子3,原子7的坐标分别为(0,0,0),(1,1,0),(1,1,1);则原子8,原子9的坐标分别为 , 。
②若晶胞边长为308pm,则钒的密度为 g cm-3。(列出计算式)
3.(2023·北京·高三统考专题练习)钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10 38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为 ;滤渣I的主要成分是 (填化学式)。
(2)“氧化”时加入足量H2O2的目的是 ;氧化后溶液中Fe3+浓度为0.001 mol L 1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为 (忽略调pH前后溶液的体积变化)。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+,该反应的平衡常数K= (用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,写出反应的化学方程式 。
4.(2023·黑龙江齐齐哈尔·统考一模)一种废镍催化剂中含有Ni、 Al、Cr。、Cu、FeS及碳粉,以其为原料制备环烷酸镍[(C10H8COO)2Ni,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Fe3+ Fe2+ Ni2+ Cu2+
开始沉淀的pH 1.9 7.0 6.4 5.4
完全沉淀的pH 3.2 9.0 8.4 6.7
回答下列问题:
(1)充分“灼烧”后,产生废气中的有毒气体的化学式为 。
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、 。基态Cr原子的价层电子排布式为 。
(3)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是 。
(4)“调pH”时,溶液pH的范围为 。
(5)常温下,CuS的Ksp极小,用S2-可将Cu2+完全沉淀。CuS晶胞中S2-的位置如图1所示,Cu2+位于S2-所构成的四面体中心,晶胞侧视图如图2所示。
①与S2-距离最近的S2-数目为 。
②CuS的晶胞参数为a pm,阿伏加德罗常数的值为NA,则CuS晶体的密度为 g·cm-3。
(6)环烷酸的化学式为C10H8COOH,写出“合成”反应的化学方程式: 。
(7)测定样品纯度:已知环烷酸镍样品中含有环烷酸杂质。取1.000g环烷酸镍样品,加入足量稀硫酸[发生反应:(C10H8COO)2Ni+H2SO4=2C10H8COOH+ NiSO4]后,用氨水调节溶液pH为9~10时,加入紫脲酸胺作指示剂,用0.1000mol· L-1 EDTA标准溶液滴定(Ni2+与EDTA反应的化学计量数之比为1:1),消耗EDTA标准溶液20.00mL。则环烷酸镍样品纯度为 %。
5.(2023·河北衡水·衡水市第二中学校考模拟预测)近日,科学家利用光催化剂实现高选择性制备氢气。某小组以辉铋矿(主要成分是,含少量、Bi、和等杂质)为原料制备钒酸铋()的流程如下:
已知:
①滤液1中所含阳离子主要有、、和。
②几种氢氧化物沉淀的pH如表所示。
氢氧化物
开始沉淀pH 7.5 2.3 4.0
沉淀完全pH 9.7 3.7
回答下列问题:
(1)滤渣2的主要成分是 (填化学式)。将辉铋矿粉碎过筛制成矿粉,其目的是 。
(2)“酸洗”中用盐酸代替水的目的是 。滤液3可以循环用于“ ”工序(填名称)。
(3)“氯化”的化学方程式为 。
(4)“合成”过程中将溶液和溶液混合容易形成胶体,导致过滤困难。为防止生成胶体可采用的措施为 (任答一条)。
(5)已知辉铋矿中所含Bi元素的质量分数为a%,wt这种矿石经上述转化最终制得b kg ,则铋的收率为 %()。
(6)的立方晶胞结构如图所示。已知晶体密度为,设为阿伏加德罗常数的值,则该晶体中与距离最近且相等的有 个,相邻2个的核间距为 nm。
6.(2023·北京·高三专题练习)煤化学链技术具有成本低、能耗低的捕集特性。以铁矿石(主要含铁物质为)为载氧体的煤化学链制氢 艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是 。
(2)分离燃烧反应器中产生的(g)和,可进行高纯捕集和封存,其分离方法是 。
(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡()溶液。
ii.用重铬酸钾()标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时溶液过量会对测定结果产生影响,分析影响结果及其原因 。
(4)测定燃烧反应后产物中单质铁含量:取a g样品,用溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b 溶标准液,消耗标准液V mL。已知被还原为,样品中单质铁的质量分数为 。
(5) 艺中不同价态铁元素含量测定结果如下。
①制氢产物主要为,写出蒸汽反应器中发生反应的化学方程式 。
② 艺中可循环使用的物质是 (填化学式)。
7.(2023·江苏·高三专题练习)以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图:
(1)“焙烧”过程中AlCl3最终转化为Al2O3和 (填化学式)。
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol L-1,“除杂”需要调节溶液的pH不低于 。
(3)离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为 。
(4)已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有 。
(5)“合成”在高温下进行,其化学方程式为 。
(6)LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
8.(2023·北京·高三专题练习)是重要化工原料。由软锰矿制备的一种工艺流程如下:
资料:①软锰矿的主要成分为,主要杂质有和。
②金属离子沉淀的
开始沉淀时 1.5 3.4 5.8 6.3
完全沉淀时 2.8 4.7 7.8 8.3
③该工艺条件下,与不反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是 。
②溶出时,的氧化过程及得到的主要途径如图所示。
ⅰ.Ⅱ是从软锰矿中溶出的主要反应,反应的离子方程式是 。
ⅱ.若全部来自于反应,完全溶出所需与的物质的量比值为2。而实际比值(0.9)小于2,原因是 。
(2)纯化
已知:的氧化性与溶液有关。纯化时先加入,后加入,调溶液。说明试剂加入顺序及调节的原因: 。
(3)电解
纯化液经电解得,生成的电极反应式是 。
(4)产品纯度测定
向产品中依次加入足量和足量稀,加热至充分反应,再用溶液滴定剩余至终点,消耗溶液的体积为。(已知:及均被还原为。相对分子质量: 86.94; 134.0)
产品纯度为 (用质量分数表示)。
9.(2023·辽宁葫芦岛·统考一模)碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
已知:①还原焙烧的主反应为
②氧化能力
可能用到的数据如下:
氢氧化物
开始沉淀pH 1.5 6.5 4.2 8.3
沉淀完全pH 3.7 9.7 7.4 9.8
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为 ,中存在过氧键(),请问中S的化合价为 。
(2)在实验室进行步骤B操作时,可能用到的主要仪器为 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是 。
(4)步骤G发生的离子方程式为 ,若Mn2+恰好沉淀完全时测得溶液中的浓度为mol·L,则 。
(5)实验室可以用溶液来检验Mn2+是否完全发生反应,请写出对应的离子方程式 。
10.(2023·吉林白山·统考三模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1))在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为 ,的空间结构为 。
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式: ;“ 含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的= 。[已知:Ka1 (H2SO3)=l.4×10-2;Ka2(H2SO3)=6. 0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为 (填化学式),分离“滤液”'“滤渣”的操作名称为 。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是 (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS) :ZnS(s) +Cu2+ (aq) CuS(s)+Zn2+(aq) ,该反应的平衡常数K= 。 [已知:Ksp(ZnS)=1. 6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2 +Zn+(1+ )H2O+ZnSO4MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为 。
11.(2023·江西上饶·铅山县第一中学校联考模拟预测)氯酸镁[]常用作催熟剂、除草剂等,制备少粉量的流程如图所示:
已知:
①卤块主要成分为,含有较多的、、等杂质。
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。
(1)过滤的主要玻璃仪器是 。
(2)加调节pH后过滤所得滤渣的主要成分为 。
(3)试剂X的滴加顺序为 (填字母)。
a.溶液,溶液,过滤后加适量盐酸
b.溶液,溶液,过滤后加适量盐酸
c.以上两种顺序都可
(4)加入饱和溶液后发生反应的化学方程式为 ,再进一步制取的实验步骤依次为①蒸发结晶;② ;③冷却结晶;④过滤、洗涤。
(5)产品中含量的测定:
步骤1:准确称量4.20g产品配成100mL溶液;
步骤2:取10.00mL于锥形瓶中,加入30.00mL 0.200 溶液;
步骤3:用0.100的碘液滴定剩余的,此过程中反应的离子方程式为;
步骤4:将步骤2、3重复两次,平均消耗标准碘液20.00mL。
①步骤2中,硫元素被氧化至最高价态,试写出该反应的离子方程式: 。
②产品中的质量分数为 (保留两位有效数字)。
12.(2023·安徽蚌埠·统考二模)如图是以硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、A12O3)为原料生产硼酸及轻质氧化镁的工艺流程:
回答下列问题:
(1)为了提高硼镁矿的“溶浸”速率,工业中可以采取下列适当措施 ( 填序号)。
A.升高溶浸温度 B.加快搅拌速度 C.缩短酸浸时间
(2)滤渣的主要成分有 。
(3)吸收过程中发生的离子方程式为 ,的空间构型为 。
(4)沉镁时调pH≈6.5的原因是 。
(5)已知溶浸后得1000L含Mg2+3.0mol·L-1的溶液,假定过滤I和过滤II两步Mg2+损.耗率共10%,沉镁时沉淀率99.9% ,最多能生成Mg( OH)2· MgCO3 kg(保留到小数点后第1位)。
13.(2023·北京·高三专题练习)工业以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰()。其工业流程如下:
(1)浸锰过程中与反应的离子方程式为,该反应是经历以下两步反应实现的。
i.
ii.……
写出ii的离子方程式: 。
(2)氧化过程中被氧化的物质主要有(写化学式): 。
(3)“浸锰”反应中往往有副产物生成,温度对“浸锰”反应的影响如图所示:
为减少的生成,“浸锰”的适宜温度是 ,向过滤II所得的滤液中加入溶液时温度不宜太高的原因是 。
(4)加入溶液后,生成沉淀,同时还有气体生成,写出反应的离子方程式: 。
(5)滴定法测产品纯度
I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:;
II.加入过量KI溶液和适量稀,沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L 溶液进行滴定,发生反应:,滴定终点时消耗溶液20.00mL。
①写出II中反应的离子方程式 ;
②判断滴定终点的方法是 ;
③假设杂质不参与反应,则产品纯度为 。(保留四位有效数字)
14.(2022·重庆·高三专题练习)磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100gH2O)如表:
温度/℃ 0 20 30 40 100
NH4Fe(SO4)2 70.6 75.4 78.3 81.0 102.1
NH4Al(SO4)2 2.1 5.0 7.7 10.9 26.7
(1)气体I中的成分中除氧气外,还有 。
(2)写出“焙烧II”中Fe2O3发生的化学反应方程式 。
(3)写出滤渣I主要成分的一种用途 。
(4)从滤液中获得NH4Al(SO4)2的操作是 。
(5)“反应III”在隔绝空气条件下进行,参与反应的n(FeS2):n(Fe2O3)= 。
(6)该工业流程中有多种气体产生,将它们综合利用可合成流程中的某种反应物,该合成总反应的化学方程式为 。
(7)为测定Al2O3产品的纯度(Al2O3的质量分数),称量mg样品溶解于足量稀硫酸,配成100.00mL溶液,取出20.00mL溶液,加入c1mol L-1EDTA标准溶液V1mL,调节溶液pH并煮沸,冷却后用c2mol L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则制得的Al2O3的纯度为 (用代数式表示)。
15.(2023·广东·模拟预测)电解金属锰阳极渣(主要成分,杂质为、、元素的化合物)和黄铁矿为原料可制备,其流程如图所示:
已知:、,回答下列问题:
(1)锰原子价层电子的轨道表示式为 ,它处于周期表的 区,中的化合价为 。
(2)“酸浸”时,所用的稀酸X是 。
(3)“酸浸”过程中,、的质量浓度、浸出率与时间的关系如图1所示。
内,浸出元素的主要离子方程式为 。
(4)若“净化”过程中的浓度为,则此时的浓度为 。
(5)是一种两性氧化物,用软锰矿(主要成分为,含少量铁的氧化物)和可制备高纯。保持投料量不变,随与投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当时,产率减小的原因是 。
(6)碳酸锰在空气中加热可以生成相应的氧化物,称取碳酸锰(摩尔质量)加热,固体物质的质量随温度的变化如图3所示。
527.4℃时,生成相应固体物质的化学方程式为 。
16.(2023·福建·统考模拟预测)FeOOH为一种不溶于水的黄色固体。某学校以废料(含少量、FeO等)为原料制备FeOOH,流程如图所示。
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有 (填一种即可)。
(2)“废渣”的主要成分可用于 (填一种即可)。
(3)“酸浸”时 (填“能”或“不能”)使用稀,原因是 。
(4)“试剂X”可使用 (填化学式,填一种即可)。
(5)从“滤液2”中获得晶体的一种方法是: 、过滤、洗涤。
(6)由转化为FeOOH的离子方程式是 。
(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
熔点/℃ 硬度 水溶性 导电性 水溶液与反应
A 811 较大 易溶 水溶液或熔融时导电 白色沉淀
B 3550 很大 不溶 不导电 不反应
C -114.2 很小 易溶 液态不导电 白色沉淀
根据以上实验数据,填写表格:
化学式 晶体类型 微粒间作用力
A
B
C
17.(2023·山东·高三专题练习)硼化钛(结构式为B=Ti=B)常用于制备导电陶瓷材料和PTC材料。工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)为原料制取的流程如下:
已知:①电弧炉是由石墨电极和石墨坩埚组成的高温加热装置;
②高温下蒸气压大、易挥发;
③可溶于热的浓硫酸形成。
回答下列问题:
(1)滤渣的主要成分为 (填化学式)。
(2)“水解”需在沸水中进行,离子方程式为 ,该工艺中,经处理可循环利用的物质为 (填化学式)。
(3)“热还原”中发生反应的化学方程式为 ,的实际用量超过了理论化学计量所要求的用量,原因是 。仅增大配料中的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是 (用化学方程式解释)。
(4)原料中的可由硼酸脱水制得。以为原料,用电渗析法制备硼酸()的工作原理如图所示,产品室中发生反应的离子方程式为 。若反应前后NaOH溶液的质量变化为m kg,则制得的质量为 kg。
18.(2023春·广东·高三校联考开学考试)镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体的工艺流程如下。
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为价。
②部分金属阳离子沉淀的如下表。
沉淀物
开始沉淀 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀 3.2 8.9 9.2 1.1 5.2 9.2
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有 (任写1条)。
(2)“调”时溶液的范围是 ,所得滤渣1的主要成分为 (填化学式)。
(3)“氧化分离”操作控制溶液,加入发生反应的离子方程式为 。
(4)“溶解1”操作中加入的作用为 ,“沉钴”操作过程中发生反应的离子方程式为 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为 。
(6)碱金属可以插入石墨层中,钾的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
C—C键的键长为,则K层中m与n两个K原子之间的距离为 ,设为阿伏加德罗常数的值,若晶胞参数分别为、、,则该石墨插层化合物的晶胞密度为 (用含x、y、z、的代数式表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 4.7≤pH<6.2 Al(OH)3、Fe(OH)3
(2)3.0×10-4
(3) 低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离 冷却结晶
(4)MgSO4
(5)ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g)
(6)O2+4e-+2H2O=4OH-
【分析】从某种矿物(含铁、铝等元素)中提取稀土元素RE时,先将矿物用酸化的MgSO4溶液浸取,浸取液中加入氧化剂将Fe2+氧化,再调节pH,使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,同时需防止RE3+离子生成沉淀:过滤后,往滤液1中加入月桂酸钠,将RE3+转化为(C11H23COO)3RE沉淀;MgSO4全部进入滤液2;将滤饼中加入盐酸,并维持在55℃,加热搅拌,冷却结晶后,将月桂酸转化为沉淀,然后过滤分离。
【详解】(1)“过滤1”前,用NaOH溶液调pH,在此步操作中,需除去的杂质离子为Fe3+、Al3+,并将它们转化为氢氧化物沉淀,但不能将RE3+转化为沉淀,所以需控制的范围为4.7≤pH<6.2,得到的滤渣主要成分为Al(OH)3、Fe(OH)3。答案为:4.7≤pH<6.2;Al(OH)3、Fe(OH)3;
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为4.8g/L,物质的量浓度为0.2mol/L。Ksp [(C11H23COO)2Mg]=1.8×10-8,c(C11H23COO-)=mol·L-1=3.0×10-4mol·L-1。答案为:3.0×10-4;
(3)①“加热搅拌”的目的,是将(C11H23COO)3RE充分溶解,并转化为RECl3和C11H23COOH,此时既需控制温度,又需保证盐酸具有一定的浓度,则控温在55℃,其原因是:低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离。
②“操作X”的过程中,需将C11H23COOH转化为沉淀,所以应先冷却结晶,再固液分离。答案为:低于55℃溶解不完全;温度太高,盐酸挥发,溶解度降低,不利于分离;冷却结晶;
(4)该工艺中,滤液②中含有大量的MgSO4,可再生循环利用的物质有MgSO4。答案为:MgSO4;
(5)通常用电解熔融ScCl3制备金属钪,ScCl3易水解,工业上制备无水ScCl3过程中与NH4Cl共热。原理为:
I.ScCl3(s)+H2O(g)ScOCl(s)+2HCl(g);
II. 应将ScOCl(s)转化为ScCl3(s),则ScOCl(s)与NH4Cl(s)反应的方程式为:ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g)。答案为:ScOCl(s)+2NH4Cl(s)ScCl3(s)+2NH3(g)+H2O(g);
(6)Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,则在正极,O2得电子产物与电解质反应生成OH-,发生的电极反应为O2+4e-+2H2O=4OH-。答案为:O2+4e-+2H2O=4OH-。
【点睛】月桂酸(C11H23COOH)熔点为44℃,冷却结晶时,溶液温度应降到44℃以下。
2.(1)2V2O5+O2+4NaCl4NaVO3+2Cl2
(2) ③和④ 偏钒酸铵微溶于冷水,铵根离子浓度增大,促进生成偏钒酸铵沉淀平衡正向移动,增加铵根的浓度促进偏钒酸根水解平衡正向移动,钒元素沉降率增大
(3) 2VO+H2C2O4+2H+=2VO2++2CO2↑+2H2O 当滴入最后半滴标准液后,溶液变为蓝色,且半分钟内不恢复到原来的的颜色 %
(4) (1,0,1) (,,)
【分析】根据题意,焙烧时将五氧化二钒转化为偏钒酸钠,氧化铁和二氧化硅无变化,其反应为2V2O5+O2+4NaCl4NaVO3+2Cl2;水浸后除去氧化铁和二氧化硅,向滤液中加入氯化铵和硫酸可分离出偏钒酸铵,高温灼烧偏钒酸铵分解得到五氧化二钒,以此解答。
【详解】(1)在第一步操作焙烧过程中V2O5转化为可溶性NaVO3,该过程中O元素由0价下降到-2价,Cl元素由-1价上升到0价,根据得失电子守恒和原子守恒配平方程式为:2V2O5+O2+4NaCl4NaVO3+2Cl2。
(2)根据流程可知,水浸后偏钒酸钠溶于水,氧化铁和二氧化硅不溶于水。需过滤除去;在滤液中加入氯化铵和硫酸后有偏钒酸铵析出,需过滤得到偏钒酸铵;应用过滤操作的有③和④;偏钒酸铵微溶于冷水,铵根离子浓度增大,促进生成偏钒酸铵沉淀平衡正向移动,增加铵根的浓度促进偏钒酸根水解平衡正向移动,钒元素沉降率增大。
(3)①有CO2气体生成,则反应应在酸性条件下进行,结合氧化还原反应的电子守恒规律、电荷守恒和原子守恒可得2VO+H2C2O4+2H+=2VO2++2CO2↑+2H2O;
②VO溶液为黄色,VO2+溶液为蓝色,所以终点的现象为:当滴入最后一滴标准液后,溶液由黄色变为蓝色,且半分钟内不恢复到原来的颜色;
③根据反应可得关系式2 VO~ H2C2O4,可得c(VO)=,带入数据可得c(VO)=2amol/L,n(VO)=cV=2amol/L0.1L, 又2VO~V2O5,故n(V2O5) = = 0.1amol,m(V2O5)=nM= 0.1amol182g/mol=18.2ag,样品的纯度为=%。
(4)①由晶胞结构可知,原子8位于晶胞的顶点,坐标为:(1,0,1);原子9位于晶胞的体心,坐标为:(,,);
②晶胞中V的个数为1+8=2,若晶胞边长为308pm,则钒的密度为=。
3.(1) 将“赤泥”粉碎 SiO2、TiO2
(2) 将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+ 99%
(3)
(4)2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O
【分析】“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,FeO、Fe2O3、Sc2O3与盐酸反应生成 Fe2+、Fe3+、Sc3+,过滤的滤渣主要成分为SiO2、TiO2,滤液中加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+,加氨水调节pH值沉淀铁离子,过滤得固体沉淀物为Fe(OH)3沉淀,向滤液中加入草酸,得到草酸钪晶体,过滤洗涤干燥后,在空气中加热可得Sc2O3固体。
【详解】(1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;故答案为:将“赤泥”粉碎;SiO2、TiO2。
(2)由分析可知,氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度c(OH-)=10 11 mol L 1,此时三价铁的浓度为,则Fe3+的去除率为;故答案为:将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;99%。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4=Sc2(C2O4)3+6H+的平衡常数;故答案为:。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,草酸根被氧化为二氧化碳,说明氧气参与反应,则反应的化学方程式2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O;故答案为:2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O。
4.(1)SO2
(2) 、 3d54s1
(3)浓H2SO4稀释放热,可节约能耗、加快反应速率
(4)3. 2≤pH<5.4
(5) 12
(6)2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O
(7)80. 60
【分析】废镍催化剂(含有Ni、 Al、Cr、Cu、FeS及碳粉) 通入空气灼烧,C元素转化为CO2、S元素转化为SO2从而除去,用NaOH溶液进行碱浸,Al、Cr的氧化物与NaOH反应溶解,过滤取滤渣,干燥后金属元素转化为相应的氧化物,之后加入硫酸溶解过滤,得到含有Ni2+、Fe2+、 Fe3+、 Cr3+等阳离子的溶液,加入试剂X调节pH使Fe元素转化为沉淀,加硫酸铵除铜,过滤后经过结晶得到硫酸镍,经过氨化,得到Ni2(OH)2SO4、、NH3·H2O的混合物,加入环烷酸合成环烷酸镍,经过汽油萃取环烷酸镍,分液分离有机层,蒸馏分离最终得到产品。
【详解】(1)根据分析,充分“灼烧”后,产生废气中的有毒气体的化学式为SO2;
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、、;Cr的原子序数为24,核外电子数为24,根据洪特规则特例,基态Cr原子的价层电子排布式为3d54s1;
(3)浓硫酸在稀释过程中会放热,温度越高,反应速率越快,故答案为:浓H2SO4稀释放热,可节约能耗、加快反应速率;
(4)调节pH的目的是使Fe3+完全沉淀,而Cu2+不沉淀,根据题目所给数据可知pH的范围为3. 2≤pH<5.4;
(5)①离顶点的S2-最近的S2-位于面心,个数为,故与S2-距离最近的S2-数目为12;
S2-位于顶点和面心,个数为8+6=4,根据化学式可知,存在4个Cu2+,则晶胞质量为g=,晶胞体积为(a)3cm3,则晶胞密度=g·cm-3;
(6)环烷酸的化学式为C10H8COOH,“合成”反应中C10H8COOH与Ni2(OH)2 SO4反应生成(C10H8COO)2Ni、硫酸镍和水,反应的化学方程式为2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O;
(7)根据反应:(C10H8COO)2Ni+H2SO4=2C10H8COOH+ NiSO4]可知关系式为(C10H8COO)2Ni ~(Ni2+~EDTA,则环烷酸镍样品纯度为=80.60%。
5.(1) 增大接触面积,加快浸取速率
(2) 将转化为 浸取
(3)
(4)搅拌、加热等
(5)
(6) 12
【分析】辉铋矿(主要成分是,含少量、Bi、和等杂质)加盐酸溶解,同时加氯化铁将硫氧化为单质,得到滤液主要成分为、,同时有过量的盐酸和氯化铁,滤渣1为硫单质和;滤液1中加双氧水将亚铁离子氧化为三价铁,再加NaOH将三价铁转化为沉淀,过滤后,滤液2中含有氯化铋、氯化钠稀释,促进氯化铋水解生成和HCl,过滤后,滤饼溶于稀盐酸得到,与发生反应得到和二氧化硫,与反应生成,据此分析解答。
【详解】(1)由以上分析可知滤渣2主要成分为,将辉铋矿粉碎过筛制成矿粉,可以增大矿粉与溶液的接触面积,加快溶解速率,故答案为:;增大接触面积,加快浸取速率;
(2)滤液2稀释,促进氯化铋水解生成,过滤后,滤饼溶于稀盐酸得到,滤液3中含有水解生成的HCl,可用于浸取,故答案为:将转化为;浸取;
(3)与发生反应得到和二氧化硫,反应方程式为:,故答案为:;
(4)为防止生成胶体在合成过程中可不断搅拌或者加热条件下合成,故答案为:搅拌、加热等;
(5)辉铋矿中所含Bi元素的质量分数为a%,wt矿石中Bi的含量为:,最终制得b kg,则实际回收的Bi的质量为,铋的收率为=%,故答案为:;
(6)该晶体中分别位于顶点和面心,与距离最近且相等的有12个,该晶胞中含有4个和4个,晶胞质量为g,晶胞边长为:cm,相邻2个的核间距为面对角线的一半,即为nm,故答案为:12;。
6.(1)增大接触面积,升高温度,提高化学反应速率
(2)冷凝
(3)过量的能与反应,导致测定结果(铁元素含量)偏高
(4)
(5) ; ()
【分析】铁矿石(主要含铁物质为)与C反应生成气态水、二氧化碳、单质铁和氧化亚铁,单质铁和氧化亚铁与水蒸气反应生成四氧化三铁与氢气,500度以下在空气中加热Fe3O4粉末,可以生成Fe2O3,据此分析解题。
【详解】(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是增大接触面积,升高温度,提高化学反应速率;
(2)分离燃烧反应器中产生的(g)和,可进行高纯捕集和封存,其分离方法是冷凝,因为经过冷凝后气态水转化为液态水;
(3)配制铁矿石待测液时溶液过量会对测定结果产生影响,分析影响结果及其原因过量的能与反应,导致测定结果(铁元素含量)偏高;
(4)已知被还原为,关系式为 ,样品中单质铁的质量b×V ×10-3L×56g/mol×2=0.112bVg,质量分数为;
(5)①制氢产物主要为,蒸汽反应器中发生反应的化学方程式;;
②据分析可知, 艺中可循环使用的物质是()。
7.(1)HCl
(2)11
(3)在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+
(4)随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大
(5)Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑
(6)4
【分析】粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料进行焙烧进行一定的转化,根据题设问可知,“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,加水溶解后“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。继续加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,可得到富集的Li+;加入碳酸钠溶液后,发生2Li++CO=Li2CO3↓,得到Li2CO3与H2C2O4和FePO4反应,反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
【详解】(1)“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,故答案是HCl;
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等,加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol L-1,则此时溶液中c(OH-)==,故c(H+)===10-11,故“除杂”需要调节溶液的pH不低于11;
(3)离子筛法“富集”锂的原理如图分析,离子筛中含H+和Li+,若在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+,故答案是在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+;
(4)由图像可知,温度越高,Li2CO3溶解度减小,越易产生沉淀;“沉锂”发生2Li++CO=Li2CO3↓,温度越高,反应速率越大,相同时间内产生Li2CO3含量越大,故“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大;
(5)“合成”在高温下进行,其化学方程式为Li2CO3与H2C2O4和FePO4反应生成产物LiFePO4,分析元素化合价变化,可知FePO4中铁元素化合价由+3降到+2,做氧化剂,H2C2O4中碳元素化合价由+3价,升高到+4价,其产物是CO2,根据氧化还原反应,故反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
(6)由题图可知,小白球表示锂离子,每个晶胞中的锂离子数为8×+4×+4×=4,故一个晶胞中含有LiFePO4的单元数有4个。
8.(1) 增大固体与浓硫酸接触面积,增大反应速率,提高浸出率 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O 二氧化锰能够氧化单质铁为Fe2+
(2)MnO2的氧化性随酸性的减弱逐渐减弱,先加入 MnO2 ,将Fe2+氧化为Fe3+,再通过NH3 H2O 调pH除去溶液中的A13+、Fe3+
(3)Mn2+-2e- +2H2O=MnO2+4H+
(4)
【分析】软锰矿首先进行研磨,可增大固体与硫酸的接触面积,增大反应速率,提高浸出率。加入浓硫酸及过量的铁屑,铁屑与硫酸反应生成硫酸亚铁,亚铁离子与二氧化锰反应生成二价锰离子和铁离子,溶液中还存在铝离子,纯化除去铁离子和铝离子,再电解Mn2+的纯化液制取MnO2。
【详解】(1)①溶出前,软锰矿需研磨,研磨软锰矿可增大固体与浓硫酸接触面积,增大反应速率,提高浸出率。
②根据反应途径可知,Fe与H2SO4反应产生Fe2+,MnO2与Fe2+反应生成Mn2+和Fe3+,则反应的离子方程式为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
根据方程式可知:Fe与MnO2的物质的量比值为2,实际反应时,二氧化锰能够氧化单质铁为Fe2+,导致需要的Fe减少,故实际比值( 0.9)小于2。
(2)MnO2的氧化性与溶液pH有关,且随酸性的减弱,氧化性逐渐减弱,溶液显酸性时,二氧化锰的氧化性较强,故纯化时先加入MnO2,将Fe2+氧化为Fe3+,再后加入NH3·H2O,调溶液pH≈5,除去溶液中的A13+、Fe3+。
(3)电解时,溶液呈酸性,Mn2+失电子与水反应生成二氧化锰和氢离子,则电极反应式为:Mn2+-2e- +2H2O=MnO2+4H+。
(4)根据题意可知:部分草酸钠与二氧化锰发生氧化还原反应,剩余部分再与高锰酸钾反应(5Na2C2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O+5Na2SO4),则与二氧化锰反应的草酸钠:MnO2+Na2C2O4+2H2SO4=Na2SO4+ MnSO4+2CO2↑+2H2O,则n(MnO2)=n(Na2C2O4)=,则产品的纯度为:。
9.(1) 3d54s2 +6
(2)C
(3)使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+
(4) 2.2×10-11
(5)
【分析】软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)中加入木炭粉进行还原焙烧,将MnO2还原为MnO,同时Fe2O3也可能被还原;加入硫酸浸取,过滤出滤渣;加入MnO2将Fe2+氧化为Fe3+,再加入10%NaOH调节溶液的pH,此时Fe3+、Cu2+转化为Fe(OH)3、Cu(OH)2沉淀;过滤后,往滤液中加入NH4HCO3,将Mn2+转化为MnCO3沉淀,分离烘干可得到成品。
【详解】(1)锰为25号元素,基态锰原子的电子排布式为1s22s22p63s23p63d54s2,则价层电子排布式为3d54s2,中存在过氧键(),则S原子在此化合物中不具有还原性,S原子的最外电子数为6,所以中S的化合价为+6。答案为:3d54s2;+6;
(2)B操作为浸取,通常在烧杯中进行,则在实验室进行步骤B操作时,可能用到的主要仪器为烧杯,故选C。答案为:C;
(3)步骤E中调节3.7<pH<8.3,此时Fe3+、Cu2+都完全沉淀,而Mn2+不生成沉淀,则其目的是:使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+。答案为:使Fe3+转化为Fe(OH)3和Cu2+转化为Cu(OH)2而除去,不影响Mn2+;
(4)步骤G中,Mn2+与发生反应,生成MnCO3沉淀和CO2气体等,发生的离子方程式为,若Mn2+恰好沉淀完全时测得溶液中的浓度为2.2×10-6mol·L,则=2.2×10-6×1.0×10-5=2.2×10-11。答案为:;2.2×10-11;
(5)实验室可以用溶液来检验Mn2+是否完全发生反应,若含有Mn2+,则被氧化为,对应的离子方程式:。答案为:。
【点睛】除去溶液中的Fe2+时,通常先将其氧化为Fe3+,再通过调节溶液的pH,让Fe3+转化为Fe(OH)3沉淀。
10.(1) 纺锤形 正四面体形
(2) 3FeS+5O2 Fe3O4 +3SO2 6× 10-3
(3) Zn、Fe 过滤
(4) A 2.5×1011
(5)MnO2 +e- + H2O=MnOOH+OH-
【分析】硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用。
【详解】(1)基态S原子的核外电子排布式为:,最高能级的原子轨道为3p轨道,形状为纺锤形,的中心S原子价层电子对数位,无孤电子对,为正四面体形结构,故答案为:纺锤形;正四面体形;
(2)已知“焙砂”中铁元素主要以Fe3O4形式存在,说明 “焙烧”过程FeS中Fe被氧化,S被还原,所以主要发生反应的化学方程式为3FeS+5O2Fe3O4 +3SO2;SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,c(H+)=1×10-5mol/L,已知Ka2(H2SO3)=6.0×10-8,所以=6×10 8,所以=6× 10-3;故答案:为3FeS+5O2Fe3O4 +3SO2;6× 10-3;
(3)浸出液“净化”过程中加入的主要物质为锌粉,过量锌充分反应,可置换出铁,所得“滤渣”的成分为Zn、Fe;过滤可分离“滤液”'“滤渣”;故答案为:Zn、Fe;过滤。
(4)①A.将稀硫酸更换为98%的浓硫酸,将发生氧化还原反应,产生二氧化硫,故A不合理;
B.将硫化锌精矿粉碎,增大接触面积,有利于快浸取反应速率,故B合理;
C.适当升高温度,有利于加快浸取反应速率,故C合理;
故答案选:A。
②反应ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)的平衡常数K=,已知:Ksp(ZnS)=c(Zn2+)·c(S2-)=1.6×10 24,Ksp(CuS)=c(Cu2+)·c(S2-)=6.4×10 36;所以K====2.5×1011,故答案为:2.5×1011。
(5)电池总反应为MnO2+12Zn+(1+x6)H2O+16ZnSO4MnOOH+16[ZnSO4·3Zn(OH)2·xH2O],放电时正极发生还原反应,所以电极方程式为MnO2 +e- + H2O=MnOOH+OH-;故答案为:MnO2 +e- + H2O=MnOOH+OH-。
11.(1)烧杯、漏斗、玻璃棒
(2)
(3)a
(4) 趁热过滤
(5) 95%
【分析】卤块粉碎后,加酸酸浸,得到Mg2+、Cl-、Fe3+、SO,加入过氧化氢,利用过氧化氢的氧化性,将Fe2+氧化成Fe3+,调节pH=4,使Fe3+以氢氧化铁形式沉淀出,过滤后,滤液中含有Mg2+、Cl-、SO,加入试剂X,应除去SO,需要加入BaCl2,加入氯化钡是过量,需要除去,还需要加入碳酸钠溶液,除去多余CO,应是过滤后,再加入适量盐酸,滤液浓缩后,加入饱和氯酸钠溶液,根据溶解度与温度的关系,发生2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,经过一系列操作得到产品,据此分析;
【详解】(1)过滤的主要仪器有玻璃棒、(普通)漏斗、烧杯;故答案为玻璃棒、(普通)漏斗、烧杯;
(2)加入过氧化氢,利用过氧化氢的氧化性,将Fe2+氧化成Fe3+,调节pH=4,使Fe3+以氢氧化铁形式沉淀出;故答案为Fe(OH)3;
(3)加入除杂试剂往往过量,过量除杂试剂需要除去,滤液中含有Mg2+、Cl-、SO,加入试剂X,应除去SO,需要加入BaCl2,加入氯化钡是过量,需要除去,还需要加入碳酸钠溶液,除去多余CO,应是过滤后,再加入适量盐酸;故答案为a;
(4)浓缩后溶液为饱和溶液,溶液中有Mg2+、Cl-,根据溶解度与温度可知,氯化钠溶解度较小,加入氯酸钠饱和溶液,会有NaCl晶体析出,即反应方程式为2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,反应后溶液中溶质为Mg(ClO3)2、NaCl,因NaCl溶解度低,因此蒸发结晶时,有NaCl晶体析出,然后趁热过滤,除去NaCl,Mg(ClO3)2溶解度受温度的影响较大,冷却结晶,得到Mg(ClO3)2·6H2O,故答案为2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;趁热过滤;
(5)①硫元素被氧化至最高价态,即被氧化成SO,ClO作氧化剂,被还原为Cl-,根据化合价升降、原子守恒和电荷守恒,其离子方程式为;故答案为;
②根据化学反应,剩余的硫代硫酸钠的物质的量是,消耗的硫代硫酸钠的物质的量是,根据反应,氯酸根离子的物质的量是,的质量分数是,故答案为95%。
12.(1)AB
(2)SiO2、Fe2O3、Al2O3
(3) NH3 += + 正四面体形
(4)pH过小Mg2+难水解生成Mg(OH)2,pH过大生成Mg(OH)2过多,不利于Mg(OH)2·MgCO3生成
(5)191.5
【分析】硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、A12O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3+2H2O=Mg(OH)2· MgCO3↓+2,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4;
【详解】(1)根据流程图知,硼镁矿粉中加入硫酸铵溶液,为了提高溶浸速率,可以采取适当升温、适当增大溶浸液浓度、研磨成粉末、搅拌等措施,答案选AB;
(2)根据分析可知,滤渣为难溶性的SiO2、Fe2O3、Al2O3;
(3)得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,发生的离子方程式为NH3 += + ;
中心原子N电子对数=4+=4,中心原子是sp3杂化,没有一对孤电子对,所以的立体结构是正四面体型;
(4)沉镁时调pH≈6.5的原因是:pH过小Mg2+难水解生成Mg(OH)2,pH过大生成Mg(OH)2过多,不利于Mg(OH)2·MgCO3生成;
(5)根据镁守恒可知,最多能生成Mg( OH)2· MgCO3的质量为1000L3.0mol/L(1-10%)99.9%142g/mol=191.5kg。
13.(1)
(2)、(等)
(3) 90℃ 防止受热分解,以提高原料利用率
(4)
(5) 滴入最后半滴溶液,蓝色褪去且半分钟内颜色不复原 99.14%
【分析】软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2+++H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体;
【详解】(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+2H+=2Fe2+++H2O,该反应是经过氧化铁与酸反应生成铁离子,铁离子与二氧化硫反应实现的:、;
故答案为:;
(2)具有较强氧化性,氧化过程中被氧化的物质主要有、(等);
(3)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃;NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率;
故答案为:90℃;防止受热分解,以提高原料利用率;
(4)Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:;
故答案为:;
(5)①II中加入过量KI溶液和适量稀,沉淀溶解,溶液变黄,则MnO(OH)2将碘离子氧化生成碘单质,反应的离子方程式为;
②将所有碘单质还原时溶液蓝色褪去,故判断滴定终点的方法是滴入最后半滴溶液,蓝色褪去且半分钟内颜色不复原;
③反应过程,,,关系式为,故n(MnCO3)==0.01mol,假设杂质不参与反应,则产品纯度为=99.14%,答案为99.14%。
14.(1)SO2
(2)Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O
(3)制玻璃、光导纤维等
(4)蒸发浓缩、冷却结晶、过滤、洗涤、干燥
(5)1∶16
(6)2SO2+O2+4NH3+2H2O=2(NH4)2SO4
(7)×100%
【分析】根据高硫铝土矿的成分,焙烧Ⅰ中FeS2与氧气反应4FeS2+11O22Fe2O3+8SO2,根据流程图中,操作Ⅰ后得到滤液主要成分,焙烧Ⅱ中氧化铁和氧化铝与硫酸铵反应,发生非氧化还原反应,根据原子守恒进行分析,其反应方程式为Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O、Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O,气体Ⅱ为氨气,反应Ⅲ中发生FeS2+Fe2O3→SO2↑+Fe3O4,据此分析;
【详解】(1)根据上述分析,焙烧Ⅰ中FeS2与氧气反应4FeS2+11O22Fe2O3+8SO2,气体Ⅰ中成分除氧气外,还含有SO2;故答案为SO2;
(2)该反应为非氧化还原反应,根据原子守恒进行,令Fe2O3的系数为1,则NH4Fe(SO4)2系数为2,NH4Fe(SO4)2含有2个SO,因此硫酸铵的系数为4,即气体为氨气,其反应方程式为Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O;故答案为Fe2O3+4(NH4)2SO42NH4Fe(SO4)2+6NH3↑+3H2O;
(3)根据上述分析,滤渣Ⅰ为SiO2,可以制玻璃、光导纤维等,故答案为制玻璃、光导纤维等;
(4)根据表中数据,NH4Fe(SO4)2溶解度较小,且变化较大,因此采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)反应Ⅲ中发生FeS2+Fe2O3→SO2↑+Fe3O4,令FeS2物质的量为amol,Fe2O3物质的量为bmol,根据得失电子数目守恒,a×(-2)+2a×[4-(-1)]=b×2×(3-),则a∶b=1∶16,故答案为1∶16;
(6)根据上述分析,产生气体有SO2、NH3,氨气与二氧化硫、氧气反应生成硫酸铵,即反应方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;故答案为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;
(7)Al3+、Cu2+与EDTA反应的化学计量比为1∶1,n(Al3+)+n(Cu2+)=n(EDTA),n(Al3+)= n(EDTA)-n(Cu2+)=V1×10-3L×c1mol/L-V2×10-3L×c2mol/L,根据原子守恒,mg样品中氧化铝纯度为×100%=×100%;故答案为×100%。
15.(1) d +2、+3
(2)稀硫酸
(3)
(4)
(5)过量的消耗了反应生成的Ba(OH)2
(6)
【分析】MnO2在酸性条件下有强氧化性,FeS2有强还原性,二者在酸浸的时候会发生氧化还原反应,结合题图中后续操作后得到的是MnSO4溶液,可知所用的稀酸X为稀硫酸。然后向滤液中加入H2O2可以将杂质离子为Fe2+氧化为Fe3+,再加入CaO调整溶液pH,使Fe3+、Cu2+形成Fe(OH)3、Cu(OH)2沉淀,但是用CaO来调pH又会导致溶液中留下较多的Ca2+,净化阶段加入MnF2的目的就是使Ca2+转化为难溶物CaF2除去,过滤得到的滤液含有MnSO4,然后经一系列处理得到Mn3O4;据此分析解答。
【详解】(1)Mn原子序数为25,价电子排布图为 ,位于周期表中d区;中O为-2价,结合化合物中各元素的代数和为可知,中Mn的化合价既有+2价也有+3价,故答案为: ;d;+2、+3;
(2)由分析知,稀酸X为稀硫酸,故答案为:稀硫酸;
(3)由图可知,内,Mn元素浸出率提高,含量明显增加,说明此时与反应生成Mn2+、、S等,对应的离子方程式为:,故答案为:;
(4)由,的浓度为,可得:;再由,可得,故答案为:;
(5)由题意可知,二氧化锰与硫化钡反应生成氢氧化钡,因反应物是一种两性氧化物,当时,二氧化锰过量,过量的二氧化锰与氢氧化钡反应消耗氢氧化钡,导致其产率降低,故答案为:过量的消耗了反应生成的Ba(OH)2;
(6),则,;527.4℃时,,,可知:,则此时产物为:,反应方程式为:,故答案为:;
16.(1)废料粉碎、适当升高温度、适当增大硫酸浓度等
(2)制取单晶硅
(3) 不能 反应放出有毒的一氧化氮等氮氧化物
(4)Fe
(5)蒸发浓缩、降温结晶
(6)
(7) NaCl 离子晶体 离子键 C(金刚石) 共价晶体 共价键 HCl 分子晶体 分子间作用力
【分析】废料,加入硫酸酸浸二氧化硅不反应成为废渣,铁转化为硫酸盐,加入过量铁,将三价铁转化为二价铁,加入乙醇促使硫酸亚铁晶体析出,晶体加入氢氧化钠、空气得到FeOOH;
【详解】(1)为提高“酸浸”的速率,可采取的措施有废料粉碎、适当升高温度、适当增大硫酸浓度等;
(2)根据分析,废料主要为二氧化硅,可以用于制取单晶硅;
(3)硝酸与亚铁离子反应放出有毒的一氧化氮等气体,故“酸浸”时不能使用稀;
(4)试剂X将三价铁转化为二价铁,且不引入新杂质,故为铁;
(5)从“滤液2”中获得晶体,其方法为蒸发浓缩、降温结晶、过滤、洗涤。
(6)和氢氧化钠溶液、空气中氧气反应生成FeOOH,反应为;
(7)A熔点高、硬度较大,易溶于水、水溶液或熔融时导电,和银离子生成白色沉淀,则为盐酸盐,可以为NaCl,是由钠离子和氯离子构成的离子晶体,存在离子键;
B熔点很高、硬度很大、不溶于水,则为共价晶体,可以为金刚石,是由碳原子直接构成的共价晶体,存在共价键;
C熔点很低、硬度很小,易溶于水且该物质液体不导电,水溶液能和银离子反应生成白色沉淀,则可以为氯化氢,是由氯化氢分子构成的分子晶体,存在分子间作用力。
17.(1)
(2) ++2H+ H2SO4
(3) ++5C+5CO↑ 高温下蒸气压大、易挥发,只有部分参加了反应 ++2C+3CO↑
(4) H++[B(OH)4]-=H3BO3+H2O
【分析】工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)加入稀盐酸,只有不会溶解,可溶于热的浓硫酸形成,在沸水中形成,“热还原”中发生反应的化学方程式为++5C+5CO↑,据此分析解题。
【详解】(1)加入稀盐酸,只有不会溶解,滤渣为;
(2)“水解”需在沸水中进行,在沸水中形成,离子方程式为++2H+,该工艺中,经处理可循环利用的物质为H2SO4;
(3)“热还原”中发生反应的化学方程式为++5C+5CO↑,的实际用量超过了理论化学计量所要求的用量,原因是高温下蒸气压大、易挥发,只有部分参加了反应;仅增大配料中的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是++2C+3CO↑;
(4)有稀硫酸得一极为阳极,1膜为阳离子交换膜,氢离子由左边极室通过1膜进入产品室,2膜为阴离子交换膜,原料室中的[B(OH)4]-通过2膜进入产品室,产品室中发生反应的离子方程式为H++[B(OH)4]-=H3BO3+H2O。原料室中的钠离子通过阳极膜进入右侧极室,由电荷守恒可知,当阴极上通过1mol电子时,NaOH溶液的质量变化为23g-1g=22g,此时制得的物质的量为1mol,质量为62g,若反应前后NaOH溶液的质量变化为m kg,则制得的质量。
18.(1)增大硫酸浓度,升高温度,延长浸取时间等
(2) 、
(3)
(4) 还原生成
(5)重结晶
(6)
【分析】由题中流程可知,镍电池废料(主要成分为镍、钻,还含有铝、铁等),用硫酸浸取后,金属元素转化为对应的离子进入溶液中,加入的目的是将母液中的氧化为,调节溶液,使和完全转化为沉淀和沉淀,过滤,滤渣1为和,向滤液中加入将氧化变成并水解生成沉淀,然后向沉淀中加入和,溶解得到溶液,向溶液中加入得到沉淀,过滤后的沉淀溶解在冰醋酸中得到醋酸钴溶液,将醋酸钴溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到醋酸钴晶体,据此解答。
【详解】(1)为提高浸取速率,除适当升高温度外,还可采取的措施有延长浸取时间、适当增加硫酸浓度等。故答案为:增大硫酸浓度,升高温度,延长浸取时间等;
(2)由后续流程可知,第一次调节时,已经将铁、铝化合物全部除去,则滤渣1的成分除了外,还有,结合表中数据可知,为了使完全沉淀而不沉淀,应当调节溶液的范围是,故答案为:;
(3)“母液”中含有的能够和发生氧化还原反应,根据得失电子守恒和原子守恒,可知反应的离子方程式为,故答案为:;
(4)向中加入、混合液,结合后续流程,最后得到产物中,以二价离子化合物形式存在,所以此时加入的为还原剂,离子方程式为:,故答案为:还原生成,;
(5)为提高醋酸钴晶体纯度,需要重新溶解、浓缩、结晶析出纯度更高的晶体,即重结晶操作,故答案为:重结晶;
(6)根据晶胞结构,K原子在晶胞的8个顶点、6个面心和4个在体内,1个晶胞中含K原子的个数为;由晶胞结构知m与n的距离如图 中的之间距离,C—C键的键长为,则;晶胞中每层石墨烯部分结构中有4条边(8个C原子)处于晶胞面上,其他C原子处于晶胞内部,晶胞中C原子数目,则晶胞的质量,晶胞的体积,所以该晶胞的密度,故答案为:,。
答案第1页,共2页
答案第1页,共2页
同课章节目录
