2024届高三化学一轮专题复习--电离平衡(含解析)
文档属性
| 名称 | 2024届高三化学一轮专题复习--电离平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 508.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-03 09:07:40 | ||
图片预览



文档简介
2024届高三化学一轮专题复习--电离平衡
一、单选题
1.(2023上·四川内江·高三四川省内江市第二中学校考期中)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法不正确的是
A.a、b、c三点溶液的:
B.a、b、c三点醋酸的电离程度:
C.a、b、c三点的醋酸分子:
D.a、b、c三点溶液用氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
2.(2023上·四川内江·高三四川省内江市第二中学校考期中)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是
A.HA、HB两酸溶液的物质的量浓度一定相等
B.稀释后,HA溶液的酸性比HB溶液强
C.若a≠5时,稀释后,HA溶液中导电离子的数目减少
D.若a=5时,稀释过程中,溶液中不变
3.(2023上·广东深圳·高三深圳市高级中学校考期中)相同温度下,HY、HZ两种一元酸的电离常数如下表所示,下列判断正确的是
酸
电离常数
A.两种酸的强弱关系:HY>HZ
B.反应能够发生
C.相同温度下,0.1mol/L的NaY、NaZ溶液,NaZ溶液的pH更大
D.相同温度下,1mol/L HZ溶液和0.1mol/L HZ溶液中,前者Ka(HZ)更大
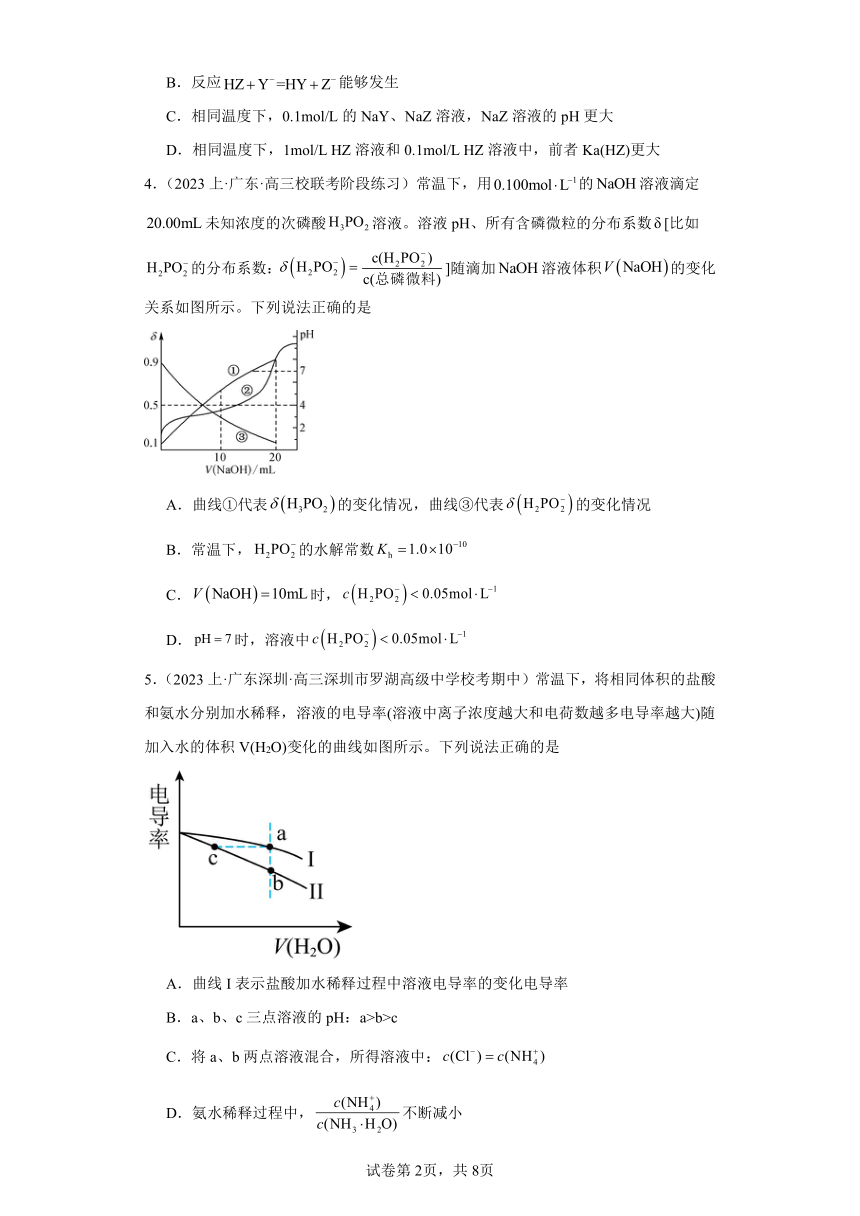
4.(2023上·广东·高三校联考阶段练习)常温下,用的溶液滴定未知浓度的次磷酸溶液。溶液pH、所有含磷微粒的分布系数[比如的分布系数:]随滴加溶液体积的变化关系如图所示。下列说法正确的是
A.曲线①代表的变化情况,曲线③代表的变化情况
B.常温下,的水解常数
C.时,
D.时,溶液中
5.(2023上·广东深圳·高三深圳市罗湖高级中学校考期中)常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率(溶液中离子浓度越大和电荷数越多电导率越大)随加入水的体积V(H2O)变化的曲线如图所示。下列说法正确的是
A.曲线I表示盐酸加水稀释过程中溶液电导率的变化电导率
B.a、b、c三点溶液的pH:a>b>c
C.将a、b两点溶液混合,所得溶液中:
D.氨水稀释过程中,不断减小
6.(2023上·四川成都·高三石室中学校考阶段练习)已知25 ℃时有关弱电解质的电离平衡常数如下表:
弱电解质 HCN H2CO3 HNO2
电离平衡常数 4.9×10-10 K1=4.3×10-7,K2=5.6×10-11 7.2×10-4
下列说法正确的是
A.等浓度HCN和HNO2溶液,HCN的pH更小
B.NaCN溶液与少量CO2反应的离子反应方程式为2CN-+ CO2 +H2O = CO+2HCN
C.向0.1 mol/L的HNO2溶液中通入HCl气体至pH=2,则HNO2的电离度为7.2%
D.结合H+的能力HCO>CN -
7.(2023上·黑龙江哈尔滨·高三哈九中校考阶段练习)常温下,某三元有机中强酸H3A在一定pH范围内,存在以下平衡:H3A(s)H3A(aq);H3A(aq) H+(aq)+H2A-(aq);H2A-(aq)H+(aq)+HA2-(aq); HA2-(aq)H+(aq)+A3-(aq)。平衡常数依次为K0、K1、K2、K3。已知lgc(H2A-)、1gc(HA2-)、lgc(A3-)随 pH变化关系如图所示。下列说法正确的是
A.随pH增大,H3A(aq)的浓度一定变小
B.直线L表示lgc(H2A-)的变化情况
C.a=(pK2+ pK3) (已知: pK=-lgK)
D.pH=14时,则有c(A3-)>c(H2A-)>c(HA2-)
8.(2023上·山东菏泽·高三山东省鄄城县第一中学校考阶段练习)常温下,取的X、Y两种碱的溶液各1mL,分别加水稀释到100mL,其pH随溶液体积(V)的变化关系如图所示,下列说法正确的是
A.稀释前X、Y溶液中溶质的浓度一定相等
B.稀释相同倍数时,X溶液的碱性比Y溶液的碱性强
C.稀释前,完全中和X、Y溶液时,消耗同浓度盐酸的体积:X>Y
D.若,则X、Y都是弱碱
9.(2023下·陕西西安·高三校考开学考试)下列说法中,正确的是
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中只有离子没有分子
C.弱电解质的稀溶液中只有分子
D.纯净的强电解质在液态时,有的导电,有的不导电
10.(2023上·浙江·高三校联考期中)下列有关说法不正确的是
A.将pH相等的氨水和NaOH溶液均稀释10倍,氨水的pH变化小
B.25℃时反应 ,说明25℃时该分解反应速率很慢
C.反应的平衡常数表达式:
D.25℃,中和等体积、等pH的溶液和盐酸溶液时,消耗NaOH的物质的量相等
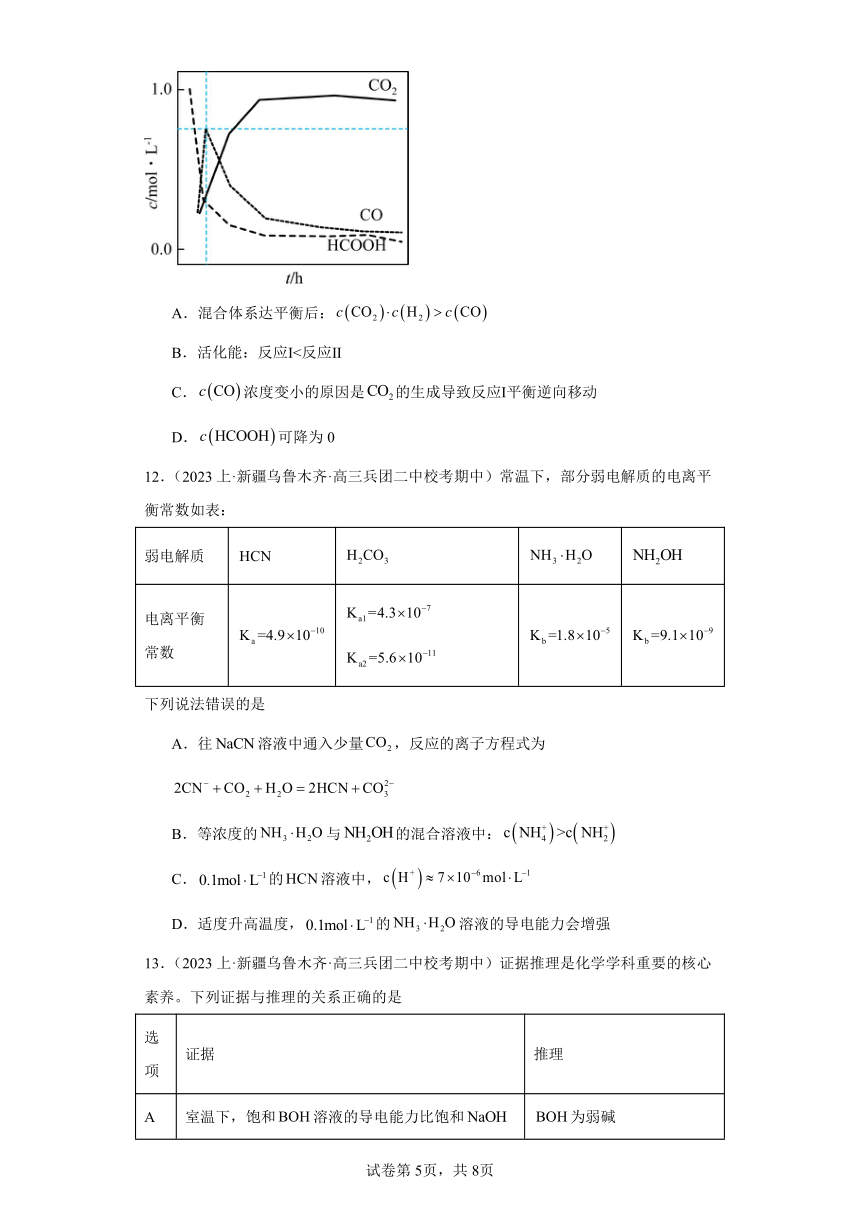
11.(2024·浙江温州·统考一模)已知HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.
Ⅱ.
T温度下,在密封石英管内完全充满水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法不正确的是
A.混合体系达平衡后:
B.活化能:反应Ⅰ<反应Ⅱ
C.浓度变小的原因是的生成导致反应Ⅰ平衡逆向移动
D.可降为0
12.(2023上·新疆乌鲁木齐·高三兵团二中校考期中)常温下,部分弱电解质的电离平衡常数如表:
弱电解质
电离平衡常数
下列说法错误的是
A.往溶液中通入少量,反应的离子方程式为
B.等浓度的与的混合溶液中:
C.的溶液中,
D.适度升高温度,的溶液的导电能力会增强
13.(2023上·新疆乌鲁木齐·高三兵团二中校考期中)证据推理是化学学科重要的核心素养。下列证据与推理的关系正确的是
选项 证据 推理
A 室温下,饱和溶液的导电能力比饱和溶液弱 为弱碱
B 增大反应物浓度,化学反应速率加快 增大反应物浓度,反应物活化分子百分数增大
C 往过氧化氢溶液中加入适量溶液,一段时间后溶液变为棕黄色且有大量气泡产生 对的分解具有催化作用
D HA溶液中不存在HA分子 HA为强酸
A.A B.B C.C D.D
14.(2023上·河北承德·高三河北省隆化存瑞中学校考阶段练习)室温,下列能判断HA是一种弱酸的是
A.足量的Zn粉分别与同pH值的HA溶液和CH3COOH溶液,后者放出的氢气较多
B.相同pH值的NaA溶液和CH3COONa溶液,后者的浓度较大
C.pH=a的HA溶液和pH=b的NaOH溶液,a+b=14,等体积混合,溶液显酸性
D.中和等pH值的HA溶液和CH3COOH溶液,后者所需的NaOH的物质的量较多
二、非选择题
15.(2023上·北京朝阳·高三和平街第一中学校考期中)回答下列问题:
(1)醋酸的电离方程式为 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是____。
A.c(CH3COO-) B.c(H+) C.c(OH-) D.CH3COOH电离平衡常数
(3)向0.1mol/LCH3COOH溶液中加水稀释,的比值将 (填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是_________(填字母)。
A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸>醋酸
B.1mol/LCH3COOH溶液能使紫色石蕊试液变红
C.25℃时,1mol/LCH3COOH溶液的pH约为2
D.10mL1mol/L的CH3COOH溶液恰好与10mL1mol/LNaOH溶液完全反应
(5)现有a. CH3COOH b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a b。
16.(2022上·北京·高三北京市第二十二中学校考期中)25℃时,醋酸、次氯酸、碳酸和亚硫酸电离平衡常数分别为:醋酸K=1.75×10-5;次氯酸K=2.95×10-8;碳酸K1=4.30×10-7,K2=5.61×10-11;亚硫酸K1=1.54×10-2,K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1= 。
(2)在相同条件下,等浓度的CH3COO-、ClO-、CO32-和SO32-溶液中结合H+能力最强的是 。
(3)已知下面三个数据:6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2;NaNO2+HF=HNO2+NaF.由此可判断下列叙述不正确的是___________
A.Ka(HF)=6.3×10-4
B.Ka(HNO2)=6.2×10-10
C.三种酸的强弱顺序为HF>HNO2>HCN
D.Ka(HCN)17.(2023上·高三课时练习)水体中的含氮化合物是引起富营养化的主要污染物,分析监测水体中的硝酸(盐)和亚硝酸(盐)含量,控制水体中的含氮污染物,对水资源的循环利用意义重大。
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为 。
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为 。
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为 ,其中氧化产物为 (写化学式)。
18.(2023上·高三课时练习)下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 CH3COOH HNO2 HCN HClO
电离平衡常数(Ka) 1.8×10-5 4.6×10-4 5×10-10 3×10-8
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
E.加氢氧化钠固体
(3)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2,K2=5.4×10-5,写出草酸的电离方程式 、 ,试从电离平衡移动的角度解释K1 K2的原因 。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实 (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案: 。
试卷第2页,共2页
试卷第1页,共1页
参考答案:
1.A
【详解】A.导电能力越强,离子浓度越大,氢离子浓度越大,越小,则 a、b、c 三点溶液的为,A错误;
B.冰醋酸的电离是在水分子作用下发生的,,加水体积增大,电离平衡正移,电离程度增大,即溶液越稀弱电解质的电离程度越大,a、b、c三点醋酸的电离程度为,B正确;
C.溶液越稀弱电解质的电离程度越大,弱电解质分子越少,a、b、c三点的醋酸分子为,C正确;
D.a、b、c三点溶液浓度不同,溶液体积不同,但所含冰醋酸的物质的量相同,与氢氧化钠溶液反应,消耗的氢氧化钠溶液体积为,D正确;
答案选A。
2.D
【分析】从图中可以看出,相同pH的两种酸稀释1000倍后,HA的pH变化大,则HA的酸性比HB的酸性强。
【详解】A.由分析可知,HA的酸性比HB的酸性强,即相同温度、相同浓度时HA的电离程度比HB大,所以HA、HB两酸溶液的物质的量浓度HB比HA大,A不正确;
B.稀释后,HA溶液的pH比HB溶液大,则HA溶液的酸性比HB溶液的酸性弱,B不正确;
C.若a≠5时,HA、HB都是弱酸,稀释后,HA、HB的电离程度都增大,HA溶液中导电离子的数目增多,C不正确;
D.若a=5时,稀释过程中,溶液中==,稀释过程中,Ka(HB)、KW不变,D正确;
故选D。
3.B
【详解】A.相同温度下,酸的电离常数越大,酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,两种酸的强弱顺序是HZ>HY,故A错误;
B.由A知,HZ的酸性大于HY,根据强酸制取弱酸知,能发生,故B正确;
C.根据电离平衡常数知,酸的强弱顺序是HZ>HY,酸的电离程度越大,酸根离子水解程度越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以0.1 mol/L的NaY、NaZ溶液,NaZ溶液pH更小,故C错误;
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选B。
4.D
【详解】A.根据加入溶液后减少的量与增加的量相等可判断曲线①代表的变化情况,曲线③代表的变化情况,曲线②代表pH变化,A错误;
B.由曲线①③交点可知,故,对应曲线②,即,,的水解常数,B错误;
C.时,溶质成分为和,浓度之比为,混合溶液呈酸性,说明的电离程度大于的水解程度,所以,C错误;
D.根据图像信息,时,溶液所加氢氧化钠溶液体积大于小于,原溶液体积为,氢氧化钠溶液浓度为,根据钠元素守恒,以及电荷守恒,,则,D正确。
故选D。
5.B
【详解】A.加水稀释时,一水合氨进一步电离,导电能力变化较小,则曲线I为氨水稀释曲线,故A错误;
B.盐酸显酸性,氨水显碱性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:a>b>c,故B正确;
C.将a、b两点溶液混合,由于氨水浓度大于盐酸浓度,反应后氨水过量,所以溶液显碱性,c(Cl-)≠c(NH),故C错误;
D.氨水稀释过程中,Kb= c(NH)·c(OH-)/c(NH3·H2O)不变,而c(OH-)减小,所以c(NH)/c(NH3·H2O)不断增大,故D错误;
故选B。
6.C
【详解】A.电离平衡常数HCN<HNO2,二者均为一元弱酸,则等浓度溶液中HNO2的pH更小,故A错误;
B. K2(H2CO3)<K(HCN),因此NaCN溶液与少量CO2反应的离子反应方程式为,故B错误;
C.pH=2,,则,HNO2的电离度为,故C正确;
D.K1(H2CO3)>K(HCN),结合H+的能力HCO<CN -,故D错误;
故选C。
7.A
【分析】由已知信息,常温下,为常数,因此原溶液中始终不变,,,;,,因此,,,与pH的变化关系直线的斜率分别为1,2,3;
【详解】A.由分析可知,pH在一定范围内增大,的浓度是不变的,A错误;
B.由分析可知,直线L的斜率最大,表示的变化情况,B错误;
C.由分析可知,M点存在,即,整理得到,C错误;
D.由分析可知,从图像来看,pH=14时,则有,D正确;
答案选D。
8.D
【分析】根据图象曲线变化及信息可知,两种碱溶液具有相同的体积和pH,碱的溶液加水稀释时,氢氧根离子浓度不断减小,pH不断减小,并且Y的pH变化小于X的pH变化,则X、Y的碱性强弱:X>Y,并且Y一定是弱碱,据此分析解答。
【详解】A.稀释前X、Y溶液的pH相等,则X溶液中溶质的浓度小于Y溶液中溶质的浓度,A错误;
B.稀释相同倍数时,溶液的pH:XC.稀释前X、Y溶液的pH相等,X、Y的碱性强弱:X>Y,则Y的物质的量浓度大于X,消耗同浓度盐酸的体积:XD.若X为强碱,则,若,则X为弱碱,由于碱性:X>Y,则当X是弱碱时,Y一定是弱碱,D正确。
答案为D。
9.D
【详解】A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,如硫酸钡是强电解质,水溶液的导电能力弱于弱电解质醋酸溶液的导电能力,故A错误;
B.强电解质在溶液中完全电离,稀溶液中存在电离出的阴阳离子和水分子,故B错误;
C.弱电解质在溶液中部分电离,稀溶液中存在电离出的阴阳离子、未电离的弱电解质分子和水分子,故C错误;
D.若强电解质为离子化合物,液态时,化合物能电离出自由移动的离子,能导电,如熔融的氢氧化钠,若强电解质为共价化合物,液态时,化合物不能电离出自由移动的离子,不能导电,如液态硫酸,所以纯净的强电解质在液态时,有的导电,有的不导电,故D正确;
故选D。
10.B
【详解】A.氨水为弱碱,稀释促进电离,而氢氧化钠为强碱完全电离,故将pH相等的氨水和NaOH溶液均稀释10倍,氨水的pH变化小,故A正确;
B.平衡常数体现反应进行的程度大小,不能体现反应的速率,故B错误;
C.平衡常数等于生成物浓度系数次方之积与反应物浓度系数次方之积的比;反应的本质为铁离子和硫氰根离子反应生成硫氰化铁,则平衡常数表达式:,故C正确;
D.25℃,等体积、等pH的溶液和盐酸溶液中氢离子的物质的量相同,则中和等体积、等pH的溶液和盐酸溶液时,消耗NaOH的物质的量相等,故D正确;
故选B。
11.D
【详解】A.根据图像可知混合体系达平衡后,,故A正确;
B.根据图像可知,CO浓度达到最大值时表明反应I达平衡,此时浓度未达最大值,即反应II尚未达平衡状态,说明反应I的反应速率大于反应II,即活化能:反应Ⅰ<反应Ⅱ,故B正确;
C.根据图像中和CO浓度变化,即反应I和II可知,浓度变小的原因是的生成导致反应Ⅰ平衡逆向移动,故C正确;
D.过程I和II均为可逆过程,则不可能降为0,故D错误;
答案选D。
12.A
【详解】A.由电离常数可知,氢氰酸的电离程度大于碳酸氢根离子,由强酸制弱酸的原理可知,氢氰酸钠溶液与少量二氧化碳反应生成氢氰酸和碳酸氢钠,反应的离子方程式为,故A错误;
B.由电离常数可知,一水合氨的电离程度大于羟胺,则等浓度的一水合氨和羟胺混合溶液中,铵根离子浓度大于NH,故B正确;
C.由电离常数可知,0.1mol/L氢氰酸溶液中氢离子浓度约为=7×10—6mol/L,故C正确;
D.一水合氨在溶液中的电离为吸热过程,适度升高温度,电离平衡右移,溶液中的离子浓度增大,导电能力会增强,故D正确;
故选A。
13.D
【详解】A.不知道两溶液的浓度是否相等,不能判断二者碱性强弱,A项错误;
B.增大反应物浓度,反应物活化分子百分数不变,B项错误;
C.一段时间后的分解速率加快是因为对的分解具有催化作用,C项错误;
D.HA溶液中不存在HA分子,说明HA已经 完全电离,则HA为强酸,D项正确;
故选:D。
14.C
【详解】A.两种酸溶液的体积相对大小未知,所以不能根据生成氢气的多少判断HA酸性强弱,故A错误;
B.相同浓度的一元酸的钠盐溶液,酸根离子水解程度越大,钠盐溶液的pH值越大,其对应的酸酸性越弱,相同浓度的NaA溶液和CH3COONa溶液,CH3COONa溶液pH较大,则HA的酸性大于醋酸,醋酸是弱酸,则HA可能是强酸也可能是弱酸,故B错误;
C.pH=a的HA溶液中c(H+)=10-amol/L,pH=b的NaOH溶液中c(OH-)=mol/L=10b-14mol/L=10-amol/L,两种溶液等体积混合后,混合溶液呈酸性,说明HA部分电离,则HA为弱酸,故C正确;
D.两种酸的体积未知,所以不能根据消耗NaOH溶液的物质的量判断HA的酸性强弱,故D错误;
故选:C。
15.(1)
(2)B
(3)变大
(4)AC
(5) < >
【详解】(1)醋酸为弱酸,部分发生电离,电离方程式为:
(2)A.通入氨气,促进CH3COOH的电离,则c(CH3COO-)增大,A错误;
B.通入氨气,NH3和H+反应生成,c(H+)减小,B正确;
C.通入氨气,NH3和H+反应生成,c(H+)减小,温度不变,Kw不变,则c(OH-)增大,C错误;
D.由于温度不变,CH3COOH的电离平衡常数不变,D错误;
答案选B。
(3)向0.1mol/LCH3COOH溶液中加水稀释,促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,温度不变,电离常数不变,则的比值变大;
(4)A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比: 盐酸>醋酸,说明盐酸中离子浓度大于醋酸,HCl是强电解质,完全电离,则醋酸部分电离,为弱电解质, A正确;
B.1mol/LCH3COOH溶液能使紫色石蕊试液变红,说明醋酸电离出氢离子,醋酸为酸,不能说明醋酸部分电离,则不能证明醋酸为弱电解质,B错误;
C.25°C时,1mol/LCH3COOH溶液的pH约为2,氢离子浓度小于醋酸浓度,醋酸部分电离,为弱电解质,C正确;
D.10mL1mol/L的CH3COOH溶液恰好与10mL1mol/LNaOH溶液完全反应,说明醋酸是一元酸,不能说明醋酸部分电离,则不能证明醋酸是弱电解质,D错误;
答案选AC。
(5)①HCl完全电离,醋酸部分电离,加水稀释促进醋酸电离,将pH相同的两种酸溶液分别稀释100倍后,c(H+):a>b,溶液的pH: a②pH相同、体积相同的两种酸溶液中分别加入足量锌,n(醋酸)>n(盐酸),相同状况下产生气体体积与酸的物质的量成正比,所以生成气体体积:a>b。
16.(1)
(2)CO
(3)B
【详解】(1)碳酸的第一级电离方程式为:,则碳酸的第一级电离平衡常数表达式为 ;
(2)电离平衡常数K越小,越难电离;电离出H+剩下的离子,其结合H+能力越强;因K2(H2CO3)最小,所以等浓度的CH3COO-、ClO-、和溶液中结合H+能力最强的是;
(3)结合题中反应,根据相对强的酸制取相对弱的酸可知三种一元弱酸的酸性:HF>HNO2>HCN,则Ka(HF)>Ka(HNO2)>Ka(HCN),所以Ka(HF)=6.3×10-4、Ka(HNO2)=5.6×10-4、Ka(HCN)=6.2×10-10;
A.Ka(HF)=6.3×10-4,A正确;
B.K(HNO2)=5.6×10-4,B错误;
C.三种酸的强弱顺序为:HF>HNO2>HCN,C正确;
D.电离平衡常数:Ka(HCN)故选B。
17.(1)
(2) -1 2HNO2+2I-+2H+=I2+2NO↑+2H2O I2
【详解】(1)亚硝酸的电离方程式为HNO2=+H+,因此其电离平衡常数Ka=。
(2)①根据化合物中所有元素的化合价代数和为0可知,NH2OH中氮元素的化合价为-1。②亚硝酸具有氧化性,被I-还原,生成NO,I-被氧化为I2,反应的离子方程式为2HNO2+2I-+2H+=I2+2NO↑+2H2O,氧化产物为I2。
18.(1)增大
(2)B
(3) H2C2O4H++ H++ 由于一级电离H2C2O4H++产生氢离子,增大了溶液中氢离子浓度,使电离平衡H++向左移动
(4) 能 往石灰石中加入醋酸,观察是否有气体产生
【详解】(1)弱酸的电离吸热,当温度升高时,促进电离,则K值增大;
(2)A.弱酸的电离吸热,当温度升高时,促进电离,则K值增大,A不符题意;
B.加水稀释,促进电离,温度不变K值不变,B符题意;
C.加少量的CH3COONa固体,醋酸根离子浓度增大、抑制电离,温度不变K值不变,C不符题意;
D.加少量冰醋酸,电离平衡正向移动,平衡正向移动,但其自身电离程度减小,D不符题意;
E.加氢氧化钠固体,发生反应、大量放热,温度升高,K值增大,E不符题意;
故选B;
(3)多元弱酸分步电离。已知草酸是一种二元弱酸,则草酸的一级电离方程式H2C2O4H++、二级电离方程式H++。由于一级电离H2C2O4H++产生氢离子,增大了溶液中氢离子浓度,使电离平衡H++向左移动,导致K1 K2;
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,则水垢中的碳酸钙和食醋发生了反应,故通过该事实能比较:醋酸酸性大于碳酸。实验中可依据强酸制备弱酸的原理来证明酸性强弱,方案为往石灰石中加入醋酸,观察是否有气体产生,若有气体产生可证明醋酸的酸性大于碳酸。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023上·四川内江·高三四川省内江市第二中学校考期中)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法不正确的是
A.a、b、c三点溶液的:
B.a、b、c三点醋酸的电离程度:
C.a、b、c三点的醋酸分子:
D.a、b、c三点溶液用氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
2.(2023上·四川内江·高三四川省内江市第二中学校考期中)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是
A.HA、HB两酸溶液的物质的量浓度一定相等
B.稀释后,HA溶液的酸性比HB溶液强
C.若a≠5时,稀释后,HA溶液中导电离子的数目减少
D.若a=5时,稀释过程中,溶液中不变
3.(2023上·广东深圳·高三深圳市高级中学校考期中)相同温度下,HY、HZ两种一元酸的电离常数如下表所示,下列判断正确的是
酸
电离常数
A.两种酸的强弱关系:HY>HZ
B.反应能够发生
C.相同温度下,0.1mol/L的NaY、NaZ溶液,NaZ溶液的pH更大
D.相同温度下,1mol/L HZ溶液和0.1mol/L HZ溶液中,前者Ka(HZ)更大
4.(2023上·广东·高三校联考阶段练习)常温下,用的溶液滴定未知浓度的次磷酸溶液。溶液pH、所有含磷微粒的分布系数[比如的分布系数:]随滴加溶液体积的变化关系如图所示。下列说法正确的是
A.曲线①代表的变化情况,曲线③代表的变化情况
B.常温下,的水解常数
C.时,
D.时,溶液中
5.(2023上·广东深圳·高三深圳市罗湖高级中学校考期中)常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率(溶液中离子浓度越大和电荷数越多电导率越大)随加入水的体积V(H2O)变化的曲线如图所示。下列说法正确的是
A.曲线I表示盐酸加水稀释过程中溶液电导率的变化电导率
B.a、b、c三点溶液的pH:a>b>c
C.将a、b两点溶液混合,所得溶液中:
D.氨水稀释过程中,不断减小
6.(2023上·四川成都·高三石室中学校考阶段练习)已知25 ℃时有关弱电解质的电离平衡常数如下表:
弱电解质 HCN H2CO3 HNO2
电离平衡常数 4.9×10-10 K1=4.3×10-7,K2=5.6×10-11 7.2×10-4
下列说法正确的是
A.等浓度HCN和HNO2溶液,HCN的pH更小
B.NaCN溶液与少量CO2反应的离子反应方程式为2CN-+ CO2 +H2O = CO+2HCN
C.向0.1 mol/L的HNO2溶液中通入HCl气体至pH=2,则HNO2的电离度为7.2%
D.结合H+的能力HCO>CN -
7.(2023上·黑龙江哈尔滨·高三哈九中校考阶段练习)常温下,某三元有机中强酸H3A在一定pH范围内,存在以下平衡:H3A(s)H3A(aq);H3A(aq) H+(aq)+H2A-(aq);H2A-(aq)H+(aq)+HA2-(aq); HA2-(aq)H+(aq)+A3-(aq)。平衡常数依次为K0、K1、K2、K3。已知lgc(H2A-)、1gc(HA2-)、lgc(A3-)随 pH变化关系如图所示。下列说法正确的是
A.随pH增大,H3A(aq)的浓度一定变小
B.直线L表示lgc(H2A-)的变化情况
C.a=(pK2+ pK3) (已知: pK=-lgK)
D.pH=14时,则有c(A3-)>c(H2A-)>c(HA2-)
8.(2023上·山东菏泽·高三山东省鄄城县第一中学校考阶段练习)常温下,取的X、Y两种碱的溶液各1mL,分别加水稀释到100mL,其pH随溶液体积(V)的变化关系如图所示,下列说法正确的是
A.稀释前X、Y溶液中溶质的浓度一定相等
B.稀释相同倍数时,X溶液的碱性比Y溶液的碱性强
C.稀释前,完全中和X、Y溶液时,消耗同浓度盐酸的体积:X>Y
D.若,则X、Y都是弱碱
9.(2023下·陕西西安·高三校考开学考试)下列说法中,正确的是
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中只有离子没有分子
C.弱电解质的稀溶液中只有分子
D.纯净的强电解质在液态时,有的导电,有的不导电
10.(2023上·浙江·高三校联考期中)下列有关说法不正确的是
A.将pH相等的氨水和NaOH溶液均稀释10倍,氨水的pH变化小
B.25℃时反应 ,说明25℃时该分解反应速率很慢
C.反应的平衡常数表达式:
D.25℃,中和等体积、等pH的溶液和盐酸溶液时,消耗NaOH的物质的量相等
11.(2024·浙江温州·统考一模)已知HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.
Ⅱ.
T温度下,在密封石英管内完全充满水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法不正确的是
A.混合体系达平衡后:
B.活化能:反应Ⅰ<反应Ⅱ
C.浓度变小的原因是的生成导致反应Ⅰ平衡逆向移动
D.可降为0
12.(2023上·新疆乌鲁木齐·高三兵团二中校考期中)常温下,部分弱电解质的电离平衡常数如表:
弱电解质
电离平衡常数
下列说法错误的是
A.往溶液中通入少量,反应的离子方程式为
B.等浓度的与的混合溶液中:
C.的溶液中,
D.适度升高温度,的溶液的导电能力会增强
13.(2023上·新疆乌鲁木齐·高三兵团二中校考期中)证据推理是化学学科重要的核心素养。下列证据与推理的关系正确的是
选项 证据 推理
A 室温下,饱和溶液的导电能力比饱和溶液弱 为弱碱
B 增大反应物浓度,化学反应速率加快 增大反应物浓度,反应物活化分子百分数增大
C 往过氧化氢溶液中加入适量溶液,一段时间后溶液变为棕黄色且有大量气泡产生 对的分解具有催化作用
D HA溶液中不存在HA分子 HA为强酸
A.A B.B C.C D.D
14.(2023上·河北承德·高三河北省隆化存瑞中学校考阶段练习)室温,下列能判断HA是一种弱酸的是
A.足量的Zn粉分别与同pH值的HA溶液和CH3COOH溶液,后者放出的氢气较多
B.相同pH值的NaA溶液和CH3COONa溶液,后者的浓度较大
C.pH=a的HA溶液和pH=b的NaOH溶液,a+b=14,等体积混合,溶液显酸性
D.中和等pH值的HA溶液和CH3COOH溶液,后者所需的NaOH的物质的量较多
二、非选择题
15.(2023上·北京朝阳·高三和平街第一中学校考期中)回答下列问题:
(1)醋酸的电离方程式为 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是____。
A.c(CH3COO-) B.c(H+) C.c(OH-) D.CH3COOH电离平衡常数
(3)向0.1mol/LCH3COOH溶液中加水稀释,的比值将 (填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是_________(填字母)。
A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸>醋酸
B.1mol/LCH3COOH溶液能使紫色石蕊试液变红
C.25℃时,1mol/LCH3COOH溶液的pH约为2
D.10mL1mol/L的CH3COOH溶液恰好与10mL1mol/LNaOH溶液完全反应
(5)现有a. CH3COOH b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a b。
16.(2022上·北京·高三北京市第二十二中学校考期中)25℃时,醋酸、次氯酸、碳酸和亚硫酸电离平衡常数分别为:醋酸K=1.75×10-5;次氯酸K=2.95×10-8;碳酸K1=4.30×10-7,K2=5.61×10-11;亚硫酸K1=1.54×10-2,K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1= 。
(2)在相同条件下,等浓度的CH3COO-、ClO-、CO32-和SO32-溶液中结合H+能力最强的是 。
(3)已知下面三个数据:6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2;NaNO2+HF=HNO2+NaF.由此可判断下列叙述不正确的是___________
A.Ka(HF)=6.3×10-4
B.Ka(HNO2)=6.2×10-10
C.三种酸的强弱顺序为HF>HNO2>HCN
D.Ka(HCN)
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为 。
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为 。
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为 ,其中氧化产物为 (写化学式)。
18.(2023上·高三课时练习)下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 CH3COOH HNO2 HCN HClO
电离平衡常数(Ka) 1.8×10-5 4.6×10-4 5×10-10 3×10-8
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
E.加氢氧化钠固体
(3)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2,K2=5.4×10-5,写出草酸的电离方程式 、 ,试从电离平衡移动的角度解释K1 K2的原因 。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实 (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案: 。
试卷第2页,共2页
试卷第1页,共1页
参考答案:
1.A
【详解】A.导电能力越强,离子浓度越大,氢离子浓度越大,越小,则 a、b、c 三点溶液的为,A错误;
B.冰醋酸的电离是在水分子作用下发生的,,加水体积增大,电离平衡正移,电离程度增大,即溶液越稀弱电解质的电离程度越大,a、b、c三点醋酸的电离程度为,B正确;
C.溶液越稀弱电解质的电离程度越大,弱电解质分子越少,a、b、c三点的醋酸分子为,C正确;
D.a、b、c三点溶液浓度不同,溶液体积不同,但所含冰醋酸的物质的量相同,与氢氧化钠溶液反应,消耗的氢氧化钠溶液体积为,D正确;
答案选A。
2.D
【分析】从图中可以看出,相同pH的两种酸稀释1000倍后,HA的pH变化大,则HA的酸性比HB的酸性强。
【详解】A.由分析可知,HA的酸性比HB的酸性强,即相同温度、相同浓度时HA的电离程度比HB大,所以HA、HB两酸溶液的物质的量浓度HB比HA大,A不正确;
B.稀释后,HA溶液的pH比HB溶液大,则HA溶液的酸性比HB溶液的酸性弱,B不正确;
C.若a≠5时,HA、HB都是弱酸,稀释后,HA、HB的电离程度都增大,HA溶液中导电离子的数目增多,C不正确;
D.若a=5时,稀释过程中,溶液中==,稀释过程中,Ka(HB)、KW不变,D正确;
故选D。
3.B
【详解】A.相同温度下,酸的电离常数越大,酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,两种酸的强弱顺序是HZ>HY,故A错误;
B.由A知,HZ的酸性大于HY,根据强酸制取弱酸知,能发生,故B正确;
C.根据电离平衡常数知,酸的强弱顺序是HZ>HY,酸的电离程度越大,酸根离子水解程度越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以0.1 mol/L的NaY、NaZ溶液,NaZ溶液pH更小,故C错误;
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选B。
4.D
【详解】A.根据加入溶液后减少的量与增加的量相等可判断曲线①代表的变化情况,曲线③代表的变化情况,曲线②代表pH变化,A错误;
B.由曲线①③交点可知,故,对应曲线②,即,,的水解常数,B错误;
C.时,溶质成分为和,浓度之比为,混合溶液呈酸性,说明的电离程度大于的水解程度,所以,C错误;
D.根据图像信息,时,溶液所加氢氧化钠溶液体积大于小于,原溶液体积为,氢氧化钠溶液浓度为,根据钠元素守恒,以及电荷守恒,,则,D正确。
故选D。
5.B
【详解】A.加水稀释时,一水合氨进一步电离,导电能力变化较小,则曲线I为氨水稀释曲线,故A错误;
B.盐酸显酸性,氨水显碱性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:a>b>c,故B正确;
C.将a、b两点溶液混合,由于氨水浓度大于盐酸浓度,反应后氨水过量,所以溶液显碱性,c(Cl-)≠c(NH),故C错误;
D.氨水稀释过程中,Kb= c(NH)·c(OH-)/c(NH3·H2O)不变,而c(OH-)减小,所以c(NH)/c(NH3·H2O)不断增大,故D错误;
故选B。
6.C
【详解】A.电离平衡常数HCN<HNO2,二者均为一元弱酸,则等浓度溶液中HNO2的pH更小,故A错误;
B. K2(H2CO3)<K(HCN),因此NaCN溶液与少量CO2反应的离子反应方程式为,故B错误;
C.pH=2,,则,HNO2的电离度为,故C正确;
D.K1(H2CO3)>K(HCN),结合H+的能力HCO<CN -,故D错误;
故选C。
7.A
【分析】由已知信息,常温下,为常数,因此原溶液中始终不变,,,;,,因此,,,与pH的变化关系直线的斜率分别为1,2,3;
【详解】A.由分析可知,pH在一定范围内增大,的浓度是不变的,A错误;
B.由分析可知,直线L的斜率最大,表示的变化情况,B错误;
C.由分析可知,M点存在,即,整理得到,C错误;
D.由分析可知,从图像来看,pH=14时,则有,D正确;
答案选D。
8.D
【分析】根据图象曲线变化及信息可知,两种碱溶液具有相同的体积和pH,碱的溶液加水稀释时,氢氧根离子浓度不断减小,pH不断减小,并且Y的pH变化小于X的pH变化,则X、Y的碱性强弱:X>Y,并且Y一定是弱碱,据此分析解答。
【详解】A.稀释前X、Y溶液的pH相等,则X溶液中溶质的浓度小于Y溶液中溶质的浓度,A错误;
B.稀释相同倍数时,溶液的pH:X
答案为D。
9.D
【详解】A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,如硫酸钡是强电解质,水溶液的导电能力弱于弱电解质醋酸溶液的导电能力,故A错误;
B.强电解质在溶液中完全电离,稀溶液中存在电离出的阴阳离子和水分子,故B错误;
C.弱电解质在溶液中部分电离,稀溶液中存在电离出的阴阳离子、未电离的弱电解质分子和水分子,故C错误;
D.若强电解质为离子化合物,液态时,化合物能电离出自由移动的离子,能导电,如熔融的氢氧化钠,若强电解质为共价化合物,液态时,化合物不能电离出自由移动的离子,不能导电,如液态硫酸,所以纯净的强电解质在液态时,有的导电,有的不导电,故D正确;
故选D。
10.B
【详解】A.氨水为弱碱,稀释促进电离,而氢氧化钠为强碱完全电离,故将pH相等的氨水和NaOH溶液均稀释10倍,氨水的pH变化小,故A正确;
B.平衡常数体现反应进行的程度大小,不能体现反应的速率,故B错误;
C.平衡常数等于生成物浓度系数次方之积与反应物浓度系数次方之积的比;反应的本质为铁离子和硫氰根离子反应生成硫氰化铁,则平衡常数表达式:,故C正确;
D.25℃,等体积、等pH的溶液和盐酸溶液中氢离子的物质的量相同,则中和等体积、等pH的溶液和盐酸溶液时,消耗NaOH的物质的量相等,故D正确;
故选B。
11.D
【详解】A.根据图像可知混合体系达平衡后,,故A正确;
B.根据图像可知,CO浓度达到最大值时表明反应I达平衡,此时浓度未达最大值,即反应II尚未达平衡状态,说明反应I的反应速率大于反应II,即活化能:反应Ⅰ<反应Ⅱ,故B正确;
C.根据图像中和CO浓度变化,即反应I和II可知,浓度变小的原因是的生成导致反应Ⅰ平衡逆向移动,故C正确;
D.过程I和II均为可逆过程,则不可能降为0,故D错误;
答案选D。
12.A
【详解】A.由电离常数可知,氢氰酸的电离程度大于碳酸氢根离子,由强酸制弱酸的原理可知,氢氰酸钠溶液与少量二氧化碳反应生成氢氰酸和碳酸氢钠,反应的离子方程式为,故A错误;
B.由电离常数可知,一水合氨的电离程度大于羟胺,则等浓度的一水合氨和羟胺混合溶液中,铵根离子浓度大于NH,故B正确;
C.由电离常数可知,0.1mol/L氢氰酸溶液中氢离子浓度约为=7×10—6mol/L,故C正确;
D.一水合氨在溶液中的电离为吸热过程,适度升高温度,电离平衡右移,溶液中的离子浓度增大,导电能力会增强,故D正确;
故选A。
13.D
【详解】A.不知道两溶液的浓度是否相等,不能判断二者碱性强弱,A项错误;
B.增大反应物浓度,反应物活化分子百分数不变,B项错误;
C.一段时间后的分解速率加快是因为对的分解具有催化作用,C项错误;
D.HA溶液中不存在HA分子,说明HA已经 完全电离,则HA为强酸,D项正确;
故选:D。
14.C
【详解】A.两种酸溶液的体积相对大小未知,所以不能根据生成氢气的多少判断HA酸性强弱,故A错误;
B.相同浓度的一元酸的钠盐溶液,酸根离子水解程度越大,钠盐溶液的pH值越大,其对应的酸酸性越弱,相同浓度的NaA溶液和CH3COONa溶液,CH3COONa溶液pH较大,则HA的酸性大于醋酸,醋酸是弱酸,则HA可能是强酸也可能是弱酸,故B错误;
C.pH=a的HA溶液中c(H+)=10-amol/L,pH=b的NaOH溶液中c(OH-)=mol/L=10b-14mol/L=10-amol/L,两种溶液等体积混合后,混合溶液呈酸性,说明HA部分电离,则HA为弱酸,故C正确;
D.两种酸的体积未知,所以不能根据消耗NaOH溶液的物质的量判断HA的酸性强弱,故D错误;
故选:C。
15.(1)
(2)B
(3)变大
(4)AC
(5) < >
【详解】(1)醋酸为弱酸,部分发生电离,电离方程式为:
(2)A.通入氨气,促进CH3COOH的电离,则c(CH3COO-)增大,A错误;
B.通入氨气,NH3和H+反应生成,c(H+)减小,B正确;
C.通入氨气,NH3和H+反应生成,c(H+)减小,温度不变,Kw不变,则c(OH-)增大,C错误;
D.由于温度不变,CH3COOH的电离平衡常数不变,D错误;
答案选B。
(3)向0.1mol/LCH3COOH溶液中加水稀释,促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,温度不变,电离常数不变,则的比值变大;
(4)A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比: 盐酸>醋酸,说明盐酸中离子浓度大于醋酸,HCl是强电解质,完全电离,则醋酸部分电离,为弱电解质, A正确;
B.1mol/LCH3COOH溶液能使紫色石蕊试液变红,说明醋酸电离出氢离子,醋酸为酸,不能说明醋酸部分电离,则不能证明醋酸为弱电解质,B错误;
C.25°C时,1mol/LCH3COOH溶液的pH约为2,氢离子浓度小于醋酸浓度,醋酸部分电离,为弱电解质,C正确;
D.10mL1mol/L的CH3COOH溶液恰好与10mL1mol/LNaOH溶液完全反应,说明醋酸是一元酸,不能说明醋酸部分电离,则不能证明醋酸是弱电解质,D错误;
答案选AC。
(5)①HCl完全电离,醋酸部分电离,加水稀释促进醋酸电离,将pH相同的两种酸溶液分别稀释100倍后,c(H+):a>b,溶液的pH: a
16.(1)
(2)CO
(3)B
【详解】(1)碳酸的第一级电离方程式为:,则碳酸的第一级电离平衡常数表达式为 ;
(2)电离平衡常数K越小,越难电离;电离出H+剩下的离子,其结合H+能力越强;因K2(H2CO3)最小,所以等浓度的CH3COO-、ClO-、和溶液中结合H+能力最强的是;
(3)结合题中反应,根据相对强的酸制取相对弱的酸可知三种一元弱酸的酸性:HF>HNO2>HCN,则Ka(HF)>Ka(HNO2)>Ka(HCN),所以Ka(HF)=6.3×10-4、Ka(HNO2)=5.6×10-4、Ka(HCN)=6.2×10-10;
A.Ka(HF)=6.3×10-4,A正确;
B.K(HNO2)=5.6×10-4,B错误;
C.三种酸的强弱顺序为:HF>HNO2>HCN,C正确;
D.电离平衡常数:Ka(HCN)
17.(1)
(2) -1 2HNO2+2I-+2H+=I2+2NO↑+2H2O I2
【详解】(1)亚硝酸的电离方程式为HNO2=+H+,因此其电离平衡常数Ka=。
(2)①根据化合物中所有元素的化合价代数和为0可知,NH2OH中氮元素的化合价为-1。②亚硝酸具有氧化性,被I-还原,生成NO,I-被氧化为I2,反应的离子方程式为2HNO2+2I-+2H+=I2+2NO↑+2H2O,氧化产物为I2。
18.(1)增大
(2)B
(3) H2C2O4H++ H++ 由于一级电离H2C2O4H++产生氢离子,增大了溶液中氢离子浓度,使电离平衡H++向左移动
(4) 能 往石灰石中加入醋酸,观察是否有气体产生
【详解】(1)弱酸的电离吸热,当温度升高时,促进电离,则K值增大;
(2)A.弱酸的电离吸热,当温度升高时,促进电离,则K值增大,A不符题意;
B.加水稀释,促进电离,温度不变K值不变,B符题意;
C.加少量的CH3COONa固体,醋酸根离子浓度增大、抑制电离,温度不变K值不变,C不符题意;
D.加少量冰醋酸,电离平衡正向移动,平衡正向移动,但其自身电离程度减小,D不符题意;
E.加氢氧化钠固体,发生反应、大量放热,温度升高,K值增大,E不符题意;
故选B;
(3)多元弱酸分步电离。已知草酸是一种二元弱酸,则草酸的一级电离方程式H2C2O4H++、二级电离方程式H++。由于一级电离H2C2O4H++产生氢离子,增大了溶液中氢离子浓度,使电离平衡H++向左移动,导致K1 K2;
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,则水垢中的碳酸钙和食醋发生了反应,故通过该事实能比较:醋酸酸性大于碳酸。实验中可依据强酸制备弱酸的原理来证明酸性强弱,方案为往石灰石中加入醋酸,观察是否有气体产生,若有气体产生可证明醋酸的酸性大于碳酸。
答案第1页,共2页
答案第1页,共2页
同课章节目录
