2024届高三新高考化学大一轮复习专题-物质的结构与性质(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮复习专题-物质的结构与性质(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-03 10:36:28 | ||
图片预览

文档简介
2024届高三新高考化学大一轮复习专题-物质的结构与性质
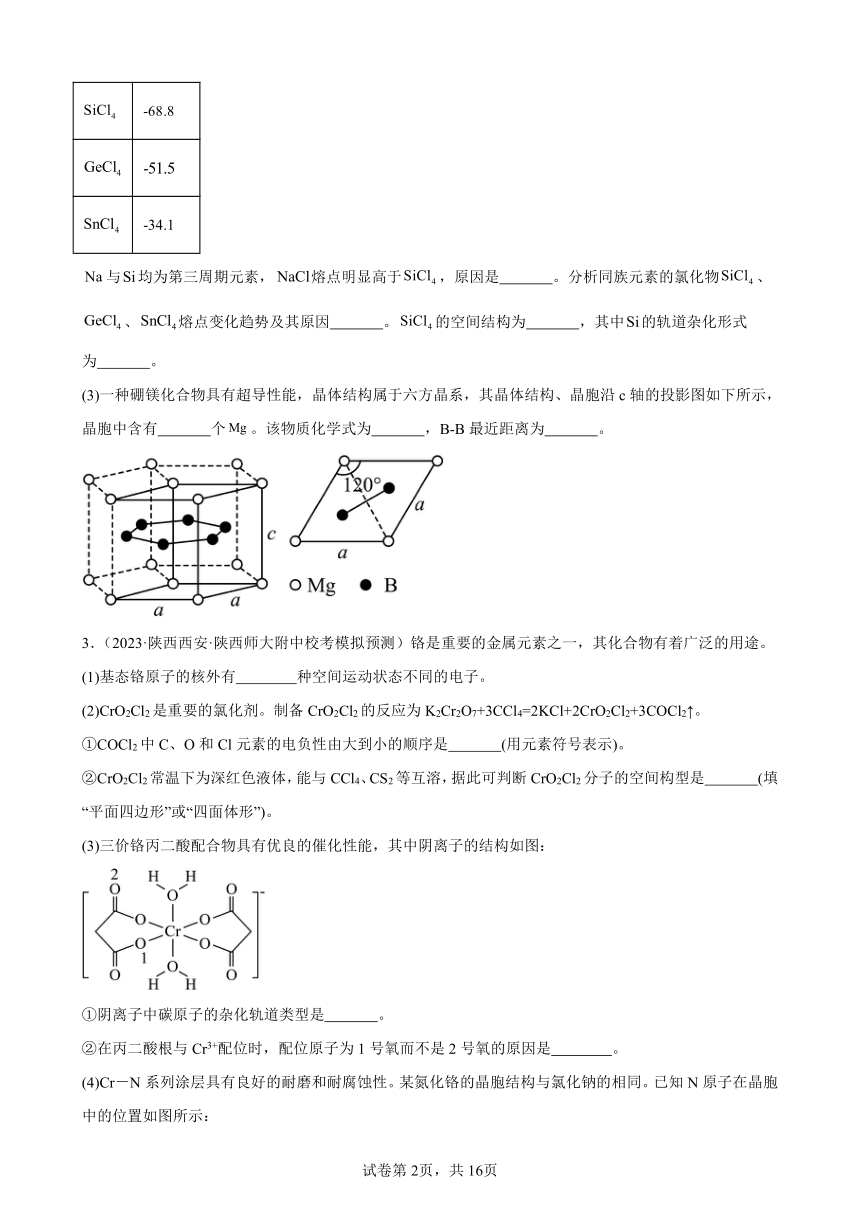
1.(2023·浙江·统考高考真题)氮的化合物种类繁多,应用广泛。
请回答:
(1)基态N原子的价层电子排布式是 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确的是 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式:
D.氮烷中N原子的杂化方式都是
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为 。
③给出的能力: (填“>”或“<”),理由是 。
(3)某含氮化合物晶胞如图,其化学式为 ,每个阴离子团的配位数(紧邻的阳离子数)为 。
2.(2023·全国·统考高考真题)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:
(1)基态原子的价电子排布式为 。橄榄石中,各元素电负性大小顺序为 ,铁的化合价为 。
(2)已知一些物质的熔点数据如下表:
物质 熔点/℃
800.7
与均为第三周期元素,熔点明显高于,原因是 。分析同族元素的氯化物、、熔点变化趋势及其原因 。的空间结构为 ,其中的轨道杂化形式为 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个。该物质化学式为 ,B-B最近距离为 。
3.(2023·陕西西安·陕西师大附中校考模拟预测)铬是重要的金属元素之一,其化合物有着广泛的用途。
(1)基态铬原子的核外有 种空间运动状态不同的电子。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是 (填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:
①阴离子中碳原子的杂化轨道类型是 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是 。
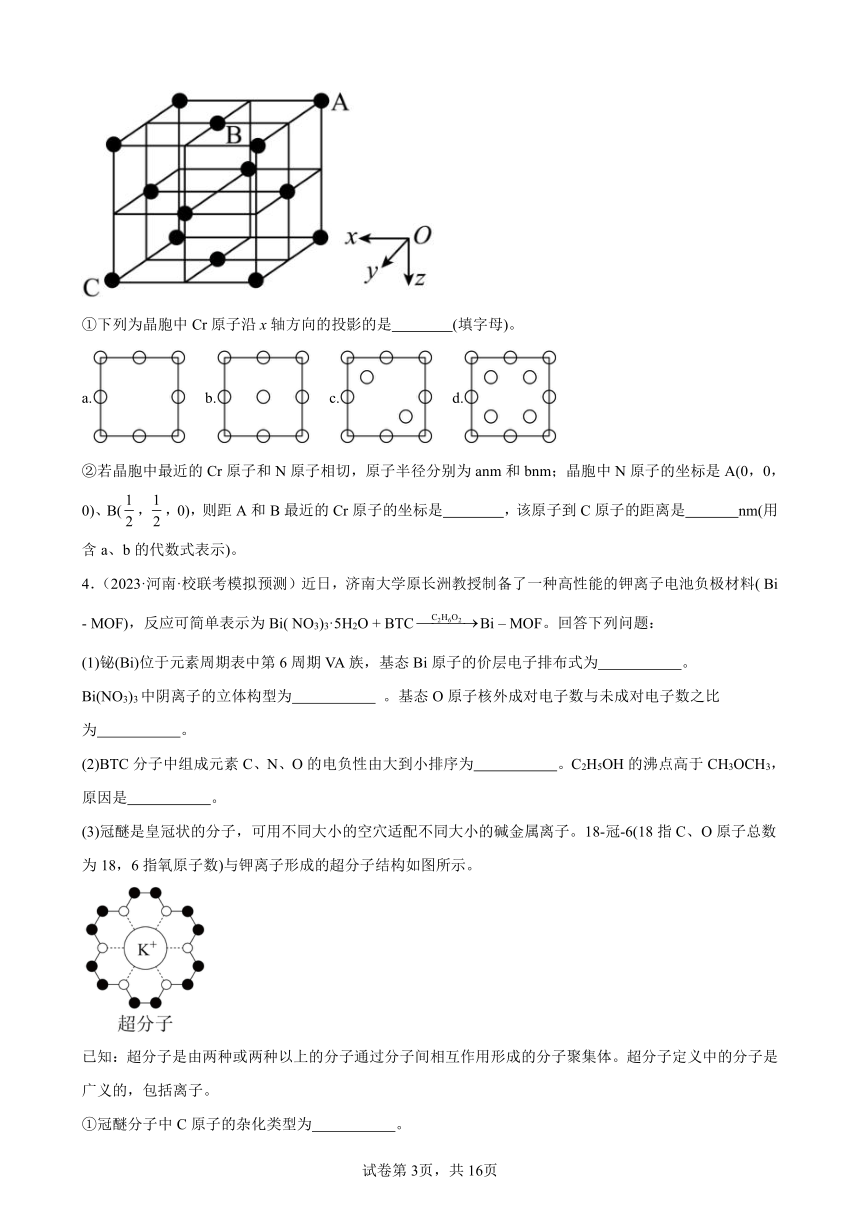
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
①下列为晶胞中Cr原子沿x轴方向的投影的是 (填字母)。
a. b. c. d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B(,,0),则距A和B最近的Cr原子的坐标是 ,该原子到C原子的距离是 nm(用含a、b的代数式表示)。
4.(2023·河南·校联考模拟预测)近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTCBi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为 。
Bi(NO3)3中阴离子的立体构型为 。基态O原子核外成对电子数与未成对电子数之比为 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为 。C2H5OH的沸点高于CH3OCH3,原因是 。
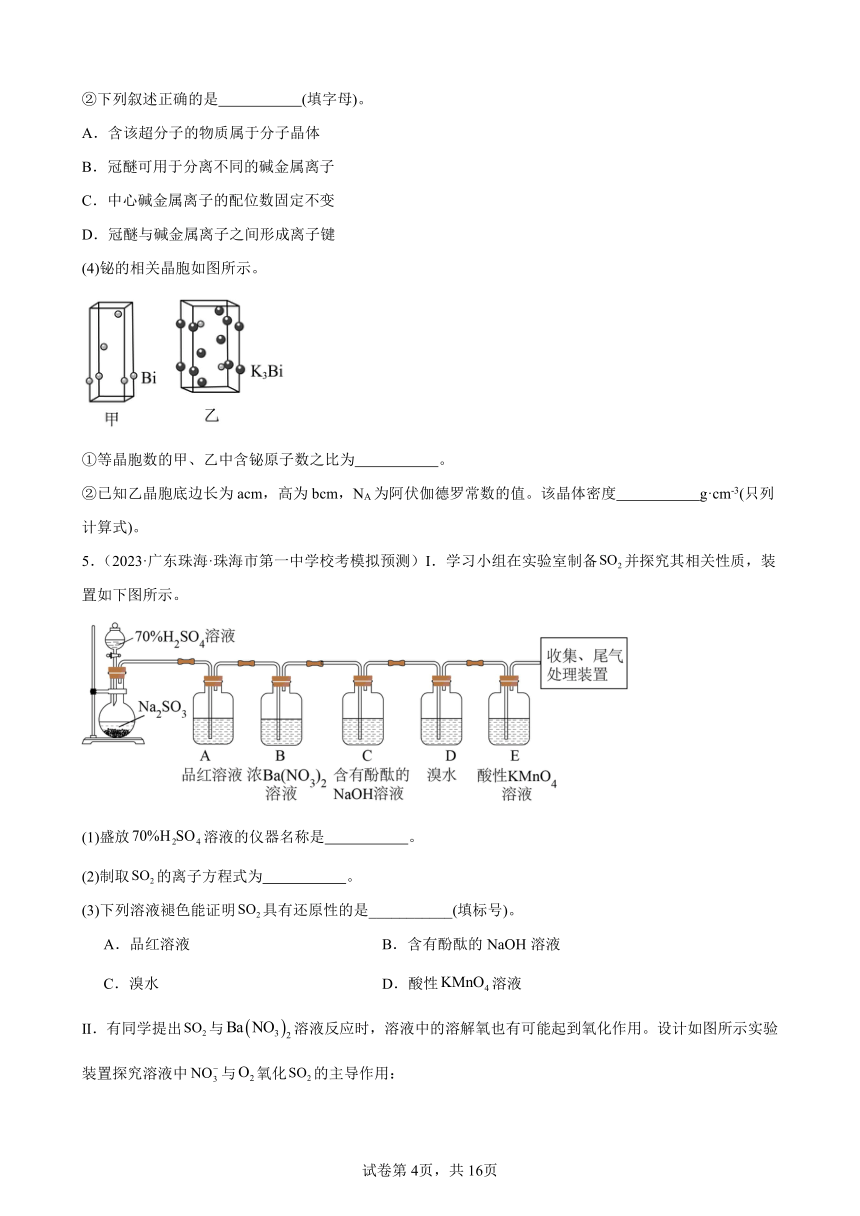
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为 。
②下列叙述正确的是 (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
①等晶胞数的甲、乙中含铋原子数之比为 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度 g·cm-3(只列计算式)。
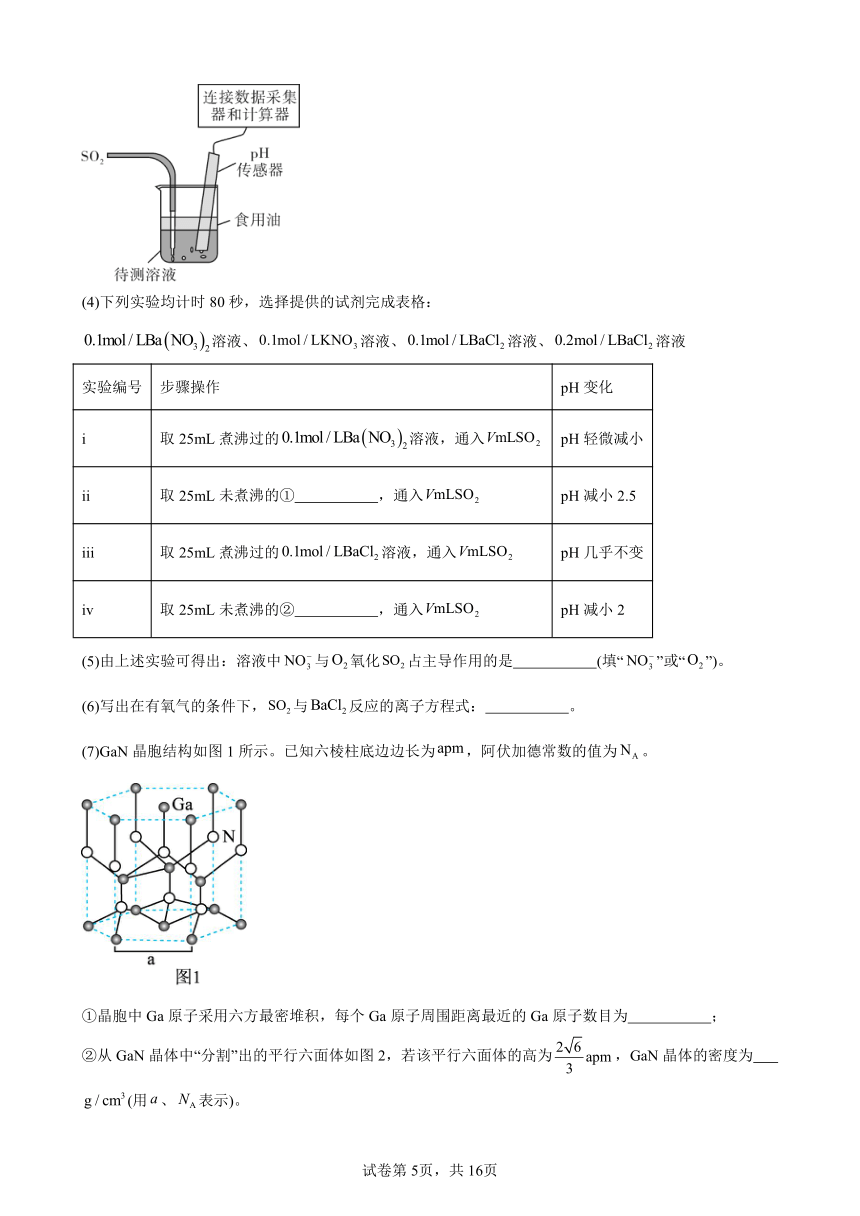
5.(2023·广东珠海·珠海市第一中学校考模拟预测)Ⅰ.学习小组在实验室制备并探究其相关性质,装置如下图所示。
(1)盛放溶液的仪器名称是 。
(2)制取的离子方程式为 。
(3)下列溶液褪色能证明具有还原性的是___________(填标号)。
A.品红溶液 B.含有酚酞的NaOH溶液
C.溴水 D.酸性溶液
Ⅱ.有同学提出与溶液反应时,溶液中的溶解氧也有可能起到氧化作用。设计如图所示实验装置探究溶液中与氧化的主导作用:
(4)下列实验均计时80秒,选择提供的试剂完成表格:
溶液、溶液、溶液、溶液
实验编号 步骤操作 pH变化
i 取25mL煮沸过的溶液,通入 pH轻微减小
ii 取25mL未煮沸的① ,通入 pH减小2.5
iii 取25mL煮沸过的溶液,通入 pH几乎不变
iv 取25mL未煮沸的② ,通入 pH减小2
(5)由上述实验可得出:溶液中与氧化占主导作用的是 (填“”或“”)。
(6)写出在有氧气的条件下,与反应的离子方程式: 。
(7)GaN晶胞结构如图1所示。已知六棱柱底边边长为,阿伏加德常数的值为。
①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子数目为 ;
②从GaN晶体中“分割”出的平行六面体如图2,若该平行六面体的高为,GaN晶体的密度为 (用、表示)。
6.(2023·江西赣州·统考二模)CuO、Cu2S等含铜化合物可以催化合成HCOOH.回答下列问题:
(1)基态铜原子的价电子排布式为 。
(2)HCOOH中碳原子的轨道杂化类型为 ,元素电负性从大到小的顺序为 。
(3)催化过程中可能产生,的空间构型为 ,碳氧键的平均键长比CH3OH要 (填“长”或“短”)。
(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是 。
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
S2-配位数为 ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的为Cu+原子分数坐标为 ;若晶胞参数anm,晶体的密度为dg·cm-3),则阿佛伽德罗常数的值为 (用含a和d的式子表示)。
7.(2023·山东青岛·统考三模)是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1)与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为 。
(2)可形成四种配离子且配离子中不存在非极性键,其中离子半径最小的配离子是 ,具有对称结构的中为 。图1中通过螯合作用形成配位键的N原子的杂化方式为 ,离子配体中N原子与中心离子配位的原因是 。
(3)的晶体结构如图2所示。
①和的电负性: (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为 形。
②用表示阿伏伽德罗常数的值,晶胞参数为,,则其密度为 (列出计算式即可)。
8.(2023·四川南充·统考三模)卤素及其化合物在药物中曾占有一定地位,现在临床上仍有使用。回答下列问题:
(1)基态Br的价电子排布式为 。基态N、O、F第一电离能由大到小的顺序是 。
(2)ClO2可用于杀菌消毒。ClO2键角介于ClO和ClO之间,ClO2键角 (填字母标号)。
A.>120° B.109°28'~120° C.<109°28'
(3)碘酊是I2和KI在乙醇中的溶液,用于皮肤消毒。I2和KI可形成直线形I离子,中心I采取的杂化类型为 (填字母标号)。
A.sp B.sp3 C.sp3d
(4)为提高含氮碱性有机药物的水溶性,常常用它们的盐酸盐。例如盐酸氨溴索(一种止咳药,结构见图)的阳离子可与水形成氢键,其表示式为O-H…O(H2O)、 、 。
(5)KBr、NaBr用作镇静剂,NaF可预防龋齿。三者中熔点最高的是 ,原因是 。
(6)氟化物有防治龋齿的作用,氟离子与羟(基)磷灰石[Ca5(PO4)3OH,M=502g mol-1]转化成氟磷灰石抵抗酸的侵蚀。Ca5(PO4)3OH晶胞结构如图。其中Ca2+、PO均位于体内,则1个晶胞中含有OH-的数目是 。晶胞参数分别为apm、apm、cpm,α=β=90°,γ=120°,其密度ρ= g cm-3(列出计算式,设NA为阿佛伽德罗常数的值)。
9.(2023·北京·高三统考专题练习)短周期元素B、C、N等元素可以形成多种物质,呈现出不同的性质,请回答以下问题:
(1)B、C、N三种元素中第一电离能最大的是 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是 。
(3)的结构与类似、但是性质差异较大。
①的空间结构为 形。N原子的轨道杂化类型为 。
②具有碱性(可与结合)而不显碱性,原因是 。
(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。
①距离硼原子最近的氮原子有 个,氮化硼晶体中含有的微粒间作用力为 。
②已知:立方氮化硼晶体的摩尔质量为ag mol,密度为ρg cm,设为阿佛加德罗常数的值,则该晶体的晶胞边长为 cm。
10.(2023·宁夏石嘴山·统考一模)H、N、O、S、Fe、Cu是日常生活中常见的元素。
(1)基态Fe2+的核外电子排布式为 ,Fe3+有 种能量不同的电子。
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为 ,的空间构型是 。
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是 。键角∠B-O-H不同于键角 ∠O-B-O的原因是 。
(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
①若图中原子1的分数坐标是(,,)则原子5的分数坐标是 。
②晶胞结构中原子1、5之间的距离为 cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为 g·cm-3。
11.(2023·西藏拉萨·统考一模)Na、Cl、 Cu是中学化学中常见的成盐元素,它们之间能形成多种化合物。回答下列问题:
(1)Na和Cl两种元素能形成多种化合物,如常见的NaCl,其晶胞结构如图1所示,氯离子位于晶胞的顶点和面心。
①Cl的基态原子核外电子排布式为 。
②图1所示晶胞中,与钠离子最近的钠离子共有 个。
③在高压下,Na与Cl可产生新的化合物,晶胞结构如图2所示,钠离子位于晶胞的顶点和体心,该物质的化学式为 。
④Na与Cl在某条件下还能形成一种团簇分子,分子结构如图3所示,氯原子位于顶点和面心。该团簇分子的分子式为 。
(2)Cu、NH3、Cl可以形成[Cu(NH3)4]Cl2。 NH3分子的空间构型为 ,[Cu(NH3)4]2+中提供空轨道的是 ,1 mol 该配合物中含有σ键的数目为 (NA为阿伏加德罗常数的值)。
(3)金属铜采取面心立方最密堆积方式,Cu晶胞的边长为a pm,其晶胞及相关结构如图甲、乙、丙所示:
①铜晶体的密度ρ= g·cm-3。
②根据图丙求出铜原子的半径r= pm。
12.(2023·广西南宁·统考二模)硼及其化合物具有重要的工业用途,请回答以下问题:
(1)基态B原子核外电子有 种能量不同的电子。
(2)在硼酸盐中,硼酸盐的阴离子结构丰富,有基本结构单元是[BO3]平面三角形和[BO4]四面体形,其基团的数目和连接方式不同,其中一种的结构如下,则B与O的原子数之比 ,其化学式为 。
(3)硼的卤化物的沸点如表所示:
卤化物 BF3 BCl3 BBr3
沸点/℃ -100.3 12.5 90
①硼的卤化物沸点变化规律并解释其原因 。
②BF3和NF3的键角大小关系为B3F NF3(填“>”、“<”或“=”),原因为 。
(4)硼可与多种金属形成化合物.其中与Ca组成的金属硼化物可做新型半导体材料,晶胞结构如图所示:
①该晶胞中B原子数为 个,晶体中Ca原子的配位数为 。
②晶胞在z轴方向的投影图为图中的 (填标号)。
③已知B6八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为(,,),则M点原子的分数坐标为 。
13.(2023·甘肃·统考二模)钴及其化合物具有广泛的用途,我国古代用的陶器釉料中就含有氧化钴。随着科技的不断发展,钴及其化合物成为制造合金、陶瓷颜料、催化剂、电池的重要原料之一,钴被也称为“工业味精”和“工业牙齿”,是重要的战略资源之一。回答下列问题。
(1)基态钴原子的价层电子排布式为 ,钴成为阳离子时首先失去 轨道电子。
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子 (填“大”“小”或“相同”),其原因为 。
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
①中N的杂化方式为 。
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是 。
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是 (填序号)。
A.NH3 B. C. D.H2O
(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。
①O2-周围紧邻的O2-数目为 ,晶体中正四面体空隙数与正八面体空隙数之比为 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为 g·cm-3(用含a和NA的代数式表示)。
14.(2023·福建莆田·统考二模)是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。
(1)基态Mn原子的外围电子轨道表示式为 。
(2)Mn、Fe元素的第三电离能(I3): (填“>”或“<”)。
(3)中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是 。其中分子中N原子的杂化类型为 。
(4)晶胞中,与形成配位键的元素有 。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于 位置。
15.(2023·山东·济南一中校联考三模)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。回答下列问题:
(1)石墨中碳原子的杂化方式为 ,基态碳原子中电子的空间运动状态有 种,D、E原子的分数坐标分别为 、 (以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标)。
(2)六方石墨晶体的密度为 (写出计算表达式,要求化简)。
(3)1个三方石墨晶胞中碳原子的个数为 。
(4)石墨可用作锂离子电池的负极材料,充电时可由形成计按如图所示均匀分布的锂碳化合物,该物质中存在的化学键有 ,充电时该电极的电极反应式为 。
(5)锂离子电池的正极材料为层状结构的。锂离子完全脱嵌时的层状结构会变得不稳定,用铝取代部分镍形成。可防止锂离子完全脱嵌而起到稳定结构的作用,其原因是 。
16.(2023·广西·统考三模)锌是动物必需的微量元素之一,参与机体的各种代谢活动。
(1)Zn位于元素周期表的 区,基态Zn原子的价电子排布图为 。
(2)第二电离能:Cu Zn(填“>”、“<”或“=”),判断依据是 。
(3)含有多个配位原子的配体与同一个中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物,一种Zn2+配合物的结构如图1所示(-OTs为含氧、硫的有机基团):
①1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N原子的杂化类型为 。
②该配合物所涉及非金属元素电负性最小的是 (填元素符号)。
(4)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图2所示,晶体中正负离子的配位数之比为 。
(5)已知每个Zn2+与其周围最近的S2-之间的距离都相等,以晶胞参数为单位长度建立坐标系,若A点坐标为(0,0,0),B点坐标为(,,),C点坐标为(0,0,u),则D点坐标为 。
17.(2023·全国·高三专题练习)有机—无机复合钙钛矿()型材料在太阳能电池及发光二极管等方面具有很好的应用前景,一种复合材料和(立方晶系)的晶胞结构如图所示。
已知:A为间隔的阳离子,例如、等;A'为单一组分钙钛阳离子,例如、、等;B为单一组分钙钛矿中心离子、等,X为单一组分钙钛矿的阴离子,例如、或等卤素离子。
回答下列问题:
(1)基态Ti原子的价电子排布式为 。
(2)H、C、N、O四种元素电负性由大到小的顺序为 ;第一电离能、、由大到小的顺序为 。
(3)中C的杂化方式为 ;正丁胺()的沸点为77.8℃,正丁醇()的沸点为117.6℃,正丁胺沸点低的原因是 。
(4)中Ca的配位数为 ;A为,A'为,B为,X为,晶胞参数为a nm和c nm,该晶体的密度为 。
18.(2023·全国·高三专题练习)钕铁硼磁铁在绝对零度时磁性仅次于钬磁铁,但是在常温下磁性远远强于目前已知的所有永久磁铁。生产钕铁硼磁铁的主要原料有稀土金属钕、纯铁、铝硼及其他稀土原料。
(1)钕(Nd)为60号元素,在周期表中第 周期。
(2)①铝原子激发态的电子排布式有 (填标号,下同) ,其中能量较高的是 。
A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于 分子(填“极性”或“非极性”),分子中Al采取 杂化。
(3)硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为 (用元素符号
表示)。晶体硼的熔点比晶体硅高,原因是 。
(4)羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为 ,且所有氢原子的化学环境都相同,则下列说法中正确的是 (填标号)。
A.二茂铁的中心粒子与配体间存在离子键,且配体中存在一个键
B.羰基铁中,配位原子为C原子,且配体与CN- 是等电子体
C.两种配合物的中心粒子价电子排布图均为
D.1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
①六方相氮化硼结构与石墨相似,但是却不导电的原因是 。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有 个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm= m3·mol-1 (列出计算式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)2s22p3
(2) A NnHn+2 2m(,m为正整数) < 形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂
(3) CaCN2 6
【详解】(1)N核电荷数为7,核外有7个电子,基态N原子电子排布式为1s22s22p3,则基态N原子的价层电子排布式是2s22p3;故答案为:2s22p3。
(2)①A.能量最低的激发态N原子应该是2p能级上一个电子跃迁到3s能级,其电子排布式:,故A错误;B.钙的金属性比镁的金属性强,则化学键中离子键成分的百分数:,故B正确;C.氮有三个价键,最简单的氮烯即含一个氮氮双键,另一个价键与氢结合,则其分子式:,故C正确;D.氮烷中N原子有一对孤对电子,有三个价键,则氮原子的杂化方式都是,故D正确;综上所述,答案为:A。
②氮和氢形成的无环氮多烯,一个氮的氮烷为NH3,两个氮的氮烷为N2H4,三个氮的氮烷为N3H5,四个氮的氮烷为N4H6,设分子中氮原子数为n,其氮烷分子式通式为NnHn+2,根据又一个氮氮双键,则少2个氢原子,因此当双键数为m,其分子式通式为NnHn+2 2m(,m为正整数);故答案为:NnHn+2 2m(,m为正整数)。
③形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂,因此给出的能力:<(填“>”或“<”);故答案为:<;形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂。
(3)钙个数为,个数为,则其化学式为CaCN2;根据六方最密堆积图 ,以上面的面心分析下面红色的有3个,同理上面也应该有3个,本体中分析得到 ,以这个进行分析,其俯视图为 ,因此距离最近的钙离子个数为6,其配位数为6;故答案为:CaCN2;6。
2.(1) O>Si>Fe>Mg +2
(2) 钠的电负性小于硅,氯化钠为离子晶体,而为分子晶体 随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大 正四面体
(3) 1
【详解】(1)为26号元素,基态原子的价电子排布式为。元素的金属性越强,其电负性越小,元素的非金属性越强则其电负性越大,因此,橄榄石()中,各元素电负性大小顺序为O>Si>Fe>Mg;因为中、、的化合价分别为+2、+4和-2,x+2-x=2,根据化合物中各元素的化合价的代数和为0,可以确定铁的化合价为+2。
(2)与均为第三周期元素,熔点明显高于,原因是:钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而为分子晶体,其熔点较低。由表中的数据可知, 、、熔点变化趋势为:随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大。的空间结构为正四面体,其中的价层电子对数为4,因此的轨道杂化形式为。
(3)由硼镁化合物的晶体结构可知位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有个,由晶胞沿c轴的投影图可知本题所给晶体结构包含三个晶胞,则晶胞中Mg的个数为1;晶体结构中在正六棱柱体内共6个,则该物质的化学式为;由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为,因此B-B最近距离为。
3.(1)15
(2) O>Cl>C 平面四边形
(3) sp3、sp2 1号氧比2号氧的价层孤电子对数多,且带负电,更易提供孤电子对
(4) b (,0,0)或(0,,0) 3(a+b)
【详解】(1)把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态Cr原子核外电子排布为1s22s22p63s23p63d54s1,则原子的核外有15种空间运动状态不同的电子。
(2)①同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;COCl2中C、O和Cl元素的电负性由大到小的顺序是O>Cl>C。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,根据相似相溶原理可知,CrO2Cl2为非极性分子,则CrO2Cl2分子中正负电荷重心重合,故空间构型是平面四边形结构;
(3)①阴离子中饱和碳原子为sp3杂化,与羰基直接相连的碳原子为sp2杂化;
②1号氧比2号氧的价层孤电子对数多,且带负电,更易提供孤电子对导致在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的;
(4)①氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图所示,则铬原子位于棱心、体心位,Cr原子沿x轴方向的投影位于正方形的顶点、边长中心、正方形中心,故选b;
②晶胞中N原子的坐标是A(0,0,0)、B(,,0),则距A和B最近的Cr原子图示为:,D在x、y、z轴上的投影坐标分别为、0、0;E在x、y、z轴上的投影坐标分别为0、、0;故坐标是(,0,0)或(0,,0);DE原子到C原子的距离是相等的,以CD距离为例,晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm,则晶胞边长为2(a+b)nm,则CD为。
4.(1) 6s26p3 平面三角形 3∶1
(2) O>N>C CH3CH2OH 中存在分子间氢键
(3) sp3 B
(4) 3∶2
【详解】(1)类比N的价层电子排布式可得基态Bi原子的价层电子排布式为6s26p3;NO中N原子的杂化方式为sp2,空间构型为平面三角形;基态O原子核外成对电子数为6与未成对电子数为2故比值为3:1。
(2)电负性O>N>C,故答案为O>N>C;CH3CH2OH可以形成分子间氢键,沸点大于CH3OCH3,故答案为CH3CH2OH可以形成分子间氢键。
(3)①C除了与两个O形成σ键之外还与两个H形成σ键,故杂化类型为sp3。
②A.含有该超分子的物质为离子晶体,A错误;
B.冠醚可以分离不同的碱金属离子,B正确;
C.中心碱金属离子的配位数随着冠醚分子的结构变化而变化,C错误;
D.冠醚和碱金属离子之间为共价键,D错误;
故选B。
(4)①;
②该晶胞中含有6个K和2个Bi,故密度为。
5.(1)分液漏斗
(2)
(3)CD
(4) 溶液 溶液
(5)
(6)
(7) 12
【分析】浓硫酸和亚硫酸钠生成二氧化硫,二氧化硫具有漂白性使A中品红溶液褪色,二氧化硫和硝酸钡溶液发生反应生成硫酸钡沉淀,二氧化硫和氢氧化钠反应使得溶液碱性消失导致酚酞溶液褪色,二氧化硫和溴水发生氧化还原反应而褪色,二氧化硫和酸性高锰酸钾发生氧化还原反应而褪色,尾气有毒需要处理;
【详解】(1)盛放溶液的仪器名称是分液漏斗;
(2)浓硫酸和亚硫酸钠反应生成硫酸钠和水、二氧化硫气体:;
(3)A.品红溶液体现了二氧化硫的漂白性,A不符合题意;
B.二氧化硫具有酸性氧化物的性质,和氢氧化钠反应使得溶液碱性消失,导致酚酞溶液褪色,B不符合题意;
C.溴水具有强氧化性,和二氧化硫发生氧化还原反应而褪色,体现二氧化硫还原性,C符合题意;
D.酸性高锰酸钾具有强氧化性,和二氧化硫发生氧化还原反应而褪色,体现二氧化硫还原性,D符合题意;
故选CD。
(4)实验中探究溶液中与氧化的主导作用,则需要控制实验中的变量唯一;
实验i、ii为对照实验,变量为硝酸钡溶液是否煮沸除去溶解氧,故实验ii填:溶液;
实验iii、iv为对照实验,变量为氯化钡溶液是否煮沸除去溶解氧,故实验iv填:溶液;
(5)由实验i、ii为对照,验iii、iv为对照,通过pH变化可知,存在溶解氧的pH更小,故溶液中与氧化占主导作用的是;
(6)在有氧气的条件下,氧气将四价硫氧化为六价硫的硫酸根离子,硫酸根离子和钡离子生成硫酸钡沉淀,总反应为;
(7)①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子在上中下层各存在3、6、3,共12个;
②根据“均摊法”,晶胞中含个Ga、个Ga,已知六棱柱底边边长为,则底面积为,该平行六面体的高为,则晶体密度为。
6.(1)3dl04S1
(2) sp2杂化 O>C>H
(3) 平面(正)三角形 短
(4)H2SO4有2个非羟基氧而H2CO3只有1个,中心原子的非羟基氧越多,其酸性越强
(5) 8 (,,)
【详解】(1)Cu为29号元素,其电子排布式为1s22s22p63s23p63d104s1,故其价电子排布式为3d104s1,故答案为:3d104s1;
(2)HCOOH中羧基上的碳原子形成1个碳氧双键、2个单键,是sp2杂化;
元素的非金属性越强,电负性越大,H、C、O电负性从大到小的顺序为O>C>H;
(3)的中心原子的价层电子对数=键数+孤电子对数=3+0=3,则C为sp3杂化,三个O原子分别位于杂化轨道的伸展方向上,所以的空间构型为平面三角形;由于有大键,所以中C-O键长较短;故答案为:平面三角形;短;
(4)H2SO4中有两个非羟基氧而H2CO3只有一个,非羟基氧越多,吸引电子能力越强,H-O的电子云密度(电子出现概率)越小,H越易电离,其酸性越强,故答案为:H2SO4中有两个非羟基氧而H2CO3只有一个,中心原子的非羟基氧越多,其酸性越强;
(5)在Cu2S晶胞中,四面体中心共有8个,每个四面体中心均分布着一个Cu+,每个S2-周围有8个Cu+,故S2-配位数为8;图中A处(S2-)的原子分数坐标为(0,0,0),A与相邻的三个面心原子形成一个正四面体,与A距离最近的Cu+位于此正四面体的中心,则Cu+的原子分数坐标为(,,);晶胞的体积为(a10-7)3cm3,每个晶胞的质量为,则d=,则mol-1,只涉及数值,省略单位mol-1,其数值为,故答案为:8;(,,);。
7.(1)
(2) 、 杂化 N原子电负性小于O,更易给出孤电子对
(3) 小于 哑铃(或纺锤)
【详解】(1)与铁在元素周期表中是同列相邻元素,是44号元素,最外层有一个未成对电子,其价电子排布式为。
(2)离子化合价越高,电子数越少,半径越小, 中Ru元素化合价依次为+3、+4、+7、+8,所以离子半径最小的配离子是;具有对称结构的为正八面体结构,6个Br-在6个顶点上、Ru在八面体中心,为、。图1中通过螯合作用形成配位键的N原子形成3个α键,无孤电子对,杂化方式为杂化,N原子电负性小于O,更易给出孤电子对,所以离子配体中N原子与中心离子配位。
(3)①和同周期,价电子数少,所以电负性小于,基态O原子电子占据最高能级是2p,电子云轮廓图为哑铃形。
②根据均摊原则,晶胞中Ru数为 、Sr数为、O数为 ,用表示阿伏伽德罗常数的值,晶胞参数为,,则其密度为。
8.(1) 4s24p1 F>N>O
(2)B
(3)C
(4) N-H…O(H2O) (H2O)O-H…O、(H2O)O-H…N
(5) NaF 三者均属于离子晶体,r(Na+)<r(K+),r(F-)<r(Br-),则NaF中离子键相对最强(晶格能相对大),故NaF熔点较高
(6) 2
【详解】(1)基态Br位于第四周期VIIA族,其价电子排布式为4s24p1;同周期元素其第一电离能呈增大趋势,N的最高能级为全充满稳定结构,其第一电离能比相邻元素的大,所以基态N、O、F第一电离能由大到小的顺序是F>N>O,故答案为:4s24p1;F>N>O;
(2)根据价层电子对理论可知,ClO的价层电子对数=2+=3,采用sp2杂化,VSEPR模型中空间构型为平面三角形,ClO的价层电子对数=2+=4,采用sp2杂化,VSEPR模型中空间构型为四面体形,ClO2键角介于ClO和ClO之间,则ClO2键角再109°28'~120°之间,故选B;
(3)根据信息可知,I离子为直线形,中心I的价层电子对数为2+=5,则采取的杂化类型为sp3d,故选C;
(4)电负性较强的N、O、F会与H原子之间形成分子间氢键,根据图中结构简式可知,盐酸氨溴索的阳离子可与水形成氢键,还可形成N-H…O(H2O)、(H2O)O-H…O、(H2O)O-H…N;
(5)KBr、NaBr均属于离子晶体,因为钠离子半径小于钾离子的,所以溴化钠的离子键键能大,同理,NaBr与NaF相比,两者也均属于离子晶体,因半径:F->Br-,所以NaF的离子键键能大,其晶体熔点较高,综上可知,三者熔点最高的是NaF,原因可总结为三者均属于离子晶体,r(Na+)<r(K+),r(F-)<r(Br-),则NaF中离子键相对最强(晶格能相对大),故NaF熔点较高;
(6)由于Ca2+、PO均位于体内,则1个晶胞中含有10个Ca2+和6个PO,结合羟(基)磷灰石的化学式为Ca5(PO4)3OH可知,晶胞中所含OH-的数目是2个;根据晶胞的密度为晶胞质量与晶胞体积之比,可得出该晶胞的密度==。
9.(1)N
(2)金刚石>碳化硅>硅
(3) 三角锥形 中F元素电负性强,使得N原子呈正电性(),难与结合
(4) 4 共价键
【详解】(1)同周期元素从左到右第一电离能有增大的趋势,B、C、N三种元素中第一电离能最大的是N;
(2)硅、金刚石和碳化硅都是共价晶体,原子半径越小,键能越大,原子半径C碳化硅>硅;
(3)①中N原子价电子对数为4,有1个孤电子对,空间结构为三角锥形。N原子的轨道杂化类型为。
②中F元素电负性强,使得N原子呈正电性(),难与结合,所以不显碱性。
(4)①根据图示,距离硼原子最近的氮原子有4个,氮化硼为共价晶体,含有的微粒间作用力为共价键。
②根据均摊原则,晶胞中B原子数为 、N原子数为4,立方氮化硼晶体的摩尔质量为ag mol,密度为ρg cm,设为阿佛加德罗常数的值,边长为xcm,则;该晶体的晶胞边长x=cm。
10.(1) [Ar]3d6(或1s22s22p63s23p63d6) 6
(2) 4 四面体
(3) sp2 O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力
(4) (1,,)
【详解】(1)铁为26号元素,Fe基态原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为Fe失去2个电子形成,基态核外电子排布式为[Ar]3d6(或1s22s22p63s23p63d6),Fe3+为Fe失去3个电子形成,基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5),则Fe3+有6种能量不同的电子;
(2)根据该配合物的结构可知,其中Cu2+的配位数为4,中S的价层电子对为4,则其空间构型为正四面体结构;
(3)根据硼酸晶体的结构为片层为平面结构,O原子与B原子之间形成大π键,则分子中氧原子杂化方式是sp2;键角∠B-O- H的中心原子O有2对孤电子对,而键角∠O- B-O的两个配原子O均由孤电子对,因为O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力,所以键角∠B-O- H不同于键角∠O- B-O;
(4)①根据数学立体几何关系可知,若图中原子1的分数坐标是(,,), 则原子5的分数坐标是(1,,);
②因为原子1的分数坐标为(,,),原子5的分数坐标为(1,0,),所以两个原子之间的距离为;
③其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,所以晶胞中Ga的原子个数为=4,N的原子个数也为4,设阿伏加德罗常数的值为NA,则GaN晶体晶胞质量为,故其密度为g·cm-3。
11.(1) 1s22s22p63s23p6或[Ne]3s23p5 12 NaCl3 Na13Cl14
(2) 三角锥形 Cu或Cu2+ 16NA
(3) a
【详解】(1)①为17号元素,其基态原子核外电子排布式为1s22s22p63s23p6或[Ne]3s23p5;
②由图可知,图1所示晶胞中,与钠离子最近的钠离子共有12个;
③根据“均摊法”,晶胞中含个Na、个Cl,该晶体的化学式为NaCl3;
④图3为气态团簇分子,该分子中Cl原子数为14、Na原子数为13,该团簇分子的分子式为Na13Cl14;
(2)NH3分子的中心N原子采取sp3杂化,其中1个杂化轨道被孤电子对占据,故NH3分子的空间构型为三角锥形;[Cu(NH3)4]2+ 中Cu2+提供空轨道,N原子提供孤电子对;铜离子的4个杂化轨道与N形成4个配位键,配位键属于σ键,4 molNH3含12molN-Hσ键,故1mol[Cu(NH3)4]Cl2中含有16 molσ键,数目为16NA;
(3)①根据铜晶胞结构和密度公式可知,;
②由图中几何关系可知,晶胞面对角线长度等于4倍的铜原子半径,则pm。
12.(1)3
(2) 1:2 BO
(3) BF3、BCl3、BBr3均为分子晶体,分子结构相似,随相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高 > BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3。
(4) 6 24 C (,0,0)
【详解】(1)基态B原子核外电子排布为,同一能级能量相同,则B原子有3种能量不同的电子,故答案为:3;
(2)由图可知每个[BO3]单元中都有1个B原子,1个氧完全属于该单元,剩余2个O分别为2个[BO3]单元共用,所以B:O=1:(1+2×)=1:2,,其化学式为:BO,故答案为:1:2;BO;
(3)①硼的卤化物的三种卤化物均为分子晶体,分子结构相似,相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高,故答案为:BF3、BCl3、BBr3均为分子晶体,分子结构相似,随相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高;
②BF3为平面三角形,键角120°;NF3为三角锥形,键角约为102.5°;故键角BF3>NF3;原因:BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3,故答案为:BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3;
(4)①由晶胞结构可知Ca位于以8个B6形成的立方晶胞的体心位置,B6的个数为:,则B原子个数为6,该晶胞的化学式为:CaB6,位于晶胞顶点的每个B6中只有3个B原子距离Ca原子最近,即Ca的配位数为24,故答案为:6;24;
②由晶胞结构可知B6围成正八面体构型,沿z轴方向的上下顶点投影为正方形的顶点,其余原子投影棱上,则符合的投影图为C,故答案为:C;
③B-B键的键长为rpm,则M点距离坐标原点的距离为pm,M点分数坐标为:(,0,0),故答案为:(,0,0)。
13.(1) 3d74s2 4s
(2) 大 NH3通过配位键与Co2+结合后,原来的孤电子对变为成键电子对,对其他N-H成键电子对的排斥力减小,H-N-H键之间的键角增大
(3) sp3 N、O BC
(4) 12 2:1
【详解】(1)基态钴原子核外电子数为27个,其电子排布式为,则价层电子排布式为3d74s2,钴成为阳离子时首先失去4s轨道电子;
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子,其原因为NH3通过配位键与Co2+结合后,原来的孤电子对变为成键电子对,对其他N-H成键电子对的排斥力减小,H-N-H键之间的键角增大;
(3)①中N的价电子对数为,且不含孤电子对,根据价层电子对互斥理论则其空间构型为正四面体,杂化方式为sp3;
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是提供孤电子的原子是N和O;
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”, NH3价电子对数为,且含有孤电子对数为1,根据价层电子对互斥理论其空间构型为三角锥形,各原子不在同一平面,不可以形成离城π键,价电子对数为,且不含有孤电子对,根据价层电子对互斥理论其空间构型为平面三角形,sp2杂化,2s、2p的两个轨道发生杂化,形成3个sp2杂化轨道,pz轨道留有一个电子,每个O的pz轨道留有一个单电子,还有得到的两个电子,4个pz轨道平行重叠形成4中心6电子的离域大π键,价电子对数为,且不含有孤电子对,根据价层电子对互斥理论其空间构型为平面三角形,sp2杂化,2s、2p的两个轨道发生杂化,形成3个sp2杂化轨道,pz轨道留有一个电子对,每个O的pz轨道留有一个单电子,还有得到的一个电子,4个pz轨道平行重叠形成4中心6电子的离域大π键,H2O中的H不含p电子,不可以形成离域大π键;
(4)①由晶胞可知,位于顶点的O2-与位于面心的O2-离子最近,则每个O2-周围紧邻的O2-数目为12,如1、3、6、7号O2-围成的正四面体为八个,一个顶点三个面心构成一个正四面体,八个顶点可以构成八个正四面体,正四面体空隙数为8,3、6、7、8、9、12号O2-围成正八面体,将晶体向外延伸可知,共用一条棱的4个面心与该棱的两个顶点上的O2-也可以构成正八面体结构,但是这样的八面体是四个晶胞共有,所以正八面体个数为,正八面体空隙数为4,晶体中正四面体空隙数与正八面体空隙数之比为2:1。
②已知晶胞参数为apm,阿伏加德罗常数为NA,由晶胞可知,晶胞中氧离子个数为,由化学式可知晶胞中含有一个Co3O4,晶胞的质量为,体积为,密度为。
14.(1)
(2)>
(3) 孤电子对越多,对成键电子对斥力越大,键能越小 sp3
(4) Fe、Mn 顶点、面心
【详解】(1)Mn的原子序数为25,价电子排布式为3d54s2,轨道表示式为;
(2)Mn的价电子排布式为3d54s2,Fe的价电子排布式为3d64s2,各失去2个电子后,外层电子排布式分别为3d5、3d6,Mn2+的3d轨道处于半充满,稳定,再失去一个电子所需要的能量较高,故>;
(3)孤电子对越多,对成键电子对斥力越大,键能越小,故中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小;分子中N原子均形成单键,杂化类型为sp3;
(4)晶胞中,与CN-形成配位键的元素有Fe、Mn;若0点处于晶胞体心,则Mn处于顶点、面心位置。
15.(1) sp2 4
(2)
(3)6
(4) 离子键、共价键、金属键
(5)脱嵌过程中Al不会变价,Li+不能完全脱嵌
【详解】(1)石墨中,每个碳原子形成3个σ键,无孤电子对,碳原子的杂化方式为sp2,基态碳原子核外电子排布式为1s22s22p2,电子占用4个原子轨道,电子的空间运动状态有4种,D在三方晶系底面上,原子的分数坐标为 ,E在六方晶系的内部,根据图示E原子的分数坐标为 。
(2)根据均摊原则,1个晶胞中含有4个C原子,C-C键长为0.142nm,则底面积为,六方石墨晶胞的体积为 ,六方石墨晶体的密度为。
(3)根据均摊原则,1个三方石墨晶胞中碳原子的个数为
(4)Li +嵌入石墨的A、B层间,导致石墨的堆积结构发生改变,形成化学式为LiC 6的嵌入化合物,可见该物质中存在的化学键有,Li +与相邻石墨环形成的离子键、碳与碳形成的共价键、石墨中层中还有金属键;充电时由形成,充电时的电极反应式为
(5)Ni的氧化数有+2、+3、+4,而Al的氧化数只有+3,如果Ni被氧化到+4价态,Li+可以完全脱嵌,形成NiO2,但有Al3+存在,必须有Li+形成电中性物质,所以用铝取代部分镍形成可防止锂离子完全脱嵌而起到稳定结构的作用。
16.(1) ds
(2) > 基态Cu+核外价电子为3d10,3d轨道为全满较稳定状态,不容易再失去一个电子;基态Zn+核外价电子为3d104s1,4s轨道有1个电子,容易失去1个电子
(3) 4 sp2杂化、sp3杂化 H
(4)1:1
(5)(,,)
【详解】(1)Zn为30号元素,位于元素周期表的ds区,基态Zn原子的价电子排布图为;
(2)基态Cu+核外价电子为3d10,3d轨道为全满较稳定状态,不容易再失去一个电子;基态Zn+核外价电子为3d104s1,4s轨道有1个电子,容易失去1个电子形成锌离子;故第二电离能:Cu>Zn;
(3)①由螯合物定义和结构示意图可知,1mol该配合物中通过螯合作用形成的配位键有4mol,该螯合物中环上N所在的环为平面结构,其杂化类型为sp2杂化,-NH-中氮原子形成3个共价键且存在1对孤电子对,为sp3杂化;
②同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;该配合物所涉及非金属元素电负性最小的是氢元素H;
(4)据“均摊法”,晶胞中含个S、个Zn,则化学式为ZnS,以B点硫为例,其最近且相邻的锌为4个,结合化学式可知,晶体中正负离子的配位数之比为4:4=1:1;
(5)由已知坐标可知,B点硫距离z轴距离为,则BC距离为,BC距离等于BD距离,则D点在y轴上投影坐标为,结合B点坐标可知,D点在x、y轴上投影坐标为、,故D点坐标为(,,)。
17.(1)
(2)
(3) 杂化 N的电负性小于O,正丁胺分子间的氢键弱于正丁醇分子间的氢键
(4) 12
【详解】(1)基态Ti原子为22号元素,价电子排布式为;
(2)同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;H、C、N、O四种元素电负性由大到小的顺序为;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能;
(3)中C形成3个共价键且无孤电子对,杂化方式为杂化;正丁胺()的沸点为77.8℃,正丁醇()的沸点为117.6℃,正丁胺沸点低的原因是N的电负性小于O,正丁胺分子间的氢键弱于正丁醇分子间的氢键,导致其沸点低于正丁醇;
(4)以底面右下角的Ca为例,同层、上下层最近相邻的O各有4个,则中Ca的配位数为12;
根据“均摊法”,晶胞中含个A、个A'、个B、个X,A为,A'为,B为,X为,晶胞参数为a nm和c nm,则晶体密度为。
18.(1)六
(2) AD D 非极性 sp3
(3) C>Be>B 晶体硼和晶体硅均为原子晶体,硼原子半径小于硅原子半径,B-B 键键长比Si-Si键键长短,键能大,因此晶体硼熔点高于晶体硅
(4)BD
(5) 层状结构中没有自由移动的电子 12
【详解】(1)钕(Nd)为60号元素,在周期表中第六周期第ⅢB族;
(2)①基态Al原子核外电子排布为1s22s22p63s23p1,则铝原子激发态的电子排布式有A.1s22s22p63s13p2、D.1s22s22p63p3,B.1s22s22p63s2、C.1s22s22p63s23p2两者为离子;故选AD;3p轨道能量大于3s,故其中能量较高的是D;
②已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于非极性分子;分子中Al形成4个共价键,采取sp3杂化;
(3)同一周期随着原子序数变大,第一电离能变大,但是Be原子价电子为2s2全满稳定状态,电离能较大,故硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为C>Be>B;晶体硼和晶体硅均为共价晶体,硼原子半径小于硅原子半径,B-B 键键长比Si-Si键键长短,键能大,因此晶体硼熔点高于晶体硅;
(4)A.二茂铁的中心粒子与配体间存在配位键,且配体环戊二烯离子带1个单位负电荷,存在1个5中心6电子的大π键,故为键,A错误;
B.等电子体是指价电子数和原子数相同的分子、离子或原子团;羰基铁中,C提供孤电子对,配位原子为C原子,且配体与CN- 是等电子体,B正确;
C.羰基铁[ Fe(CO)5]、二茂铁[ Fe(C5H5)2]两种配合物的中心粒子分别为铁原子、亚铁离子,价电子排布图不同,C错误;
D.单键均为σ键,双键中含有1个σ键、1个π键,叁键含有1个σ键、2个π键;1分子羰基铁配体中存在5个σ键和10个π键,配体与中心原子形成5个配位键,故共有10个σ键和10个π键,则1mol羰基铁中有10NA个σ键和10NA个π键,D正确;
故选BD;
(5)①六方相氮化硼结构与石墨相似,但是其层状结构中没有自由移动的电子,故不导电;
②立方相氮化硼中,以底面面心的硼为例,离硼原子最近且等距离的硼原子上层、同层、下层各有4个,故共有12个;
③根据“均摊法”,晶胞中B的个数为,N的个数为4,若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积=m3·mol-1。
答案第1页,共2页
答案第1页,共2页
1.(2023·浙江·统考高考真题)氮的化合物种类繁多,应用广泛。
请回答:
(1)基态N原子的价层电子排布式是 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确的是 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式:
D.氮烷中N原子的杂化方式都是
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为 。
③给出的能力: (填“>”或“<”),理由是 。
(3)某含氮化合物晶胞如图,其化学式为 ,每个阴离子团的配位数(紧邻的阳离子数)为 。
2.(2023·全国·统考高考真题)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:
(1)基态原子的价电子排布式为 。橄榄石中,各元素电负性大小顺序为 ,铁的化合价为 。
(2)已知一些物质的熔点数据如下表:
物质 熔点/℃
800.7
与均为第三周期元素,熔点明显高于,原因是 。分析同族元素的氯化物、、熔点变化趋势及其原因 。的空间结构为 ,其中的轨道杂化形式为 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个。该物质化学式为 ,B-B最近距离为 。
3.(2023·陕西西安·陕西师大附中校考模拟预测)铬是重要的金属元素之一,其化合物有着广泛的用途。
(1)基态铬原子的核外有 种空间运动状态不同的电子。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是 (填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:
①阴离子中碳原子的杂化轨道类型是 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是 。
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
①下列为晶胞中Cr原子沿x轴方向的投影的是 (填字母)。
a. b. c. d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B(,,0),则距A和B最近的Cr原子的坐标是 ,该原子到C原子的距离是 nm(用含a、b的代数式表示)。
4.(2023·河南·校联考模拟预测)近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTCBi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为 。
Bi(NO3)3中阴离子的立体构型为 。基态O原子核外成对电子数与未成对电子数之比为 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为 。C2H5OH的沸点高于CH3OCH3,原因是 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为 。
②下列叙述正确的是 (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
①等晶胞数的甲、乙中含铋原子数之比为 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度 g·cm-3(只列计算式)。
5.(2023·广东珠海·珠海市第一中学校考模拟预测)Ⅰ.学习小组在实验室制备并探究其相关性质,装置如下图所示。
(1)盛放溶液的仪器名称是 。
(2)制取的离子方程式为 。
(3)下列溶液褪色能证明具有还原性的是___________(填标号)。
A.品红溶液 B.含有酚酞的NaOH溶液
C.溴水 D.酸性溶液
Ⅱ.有同学提出与溶液反应时,溶液中的溶解氧也有可能起到氧化作用。设计如图所示实验装置探究溶液中与氧化的主导作用:
(4)下列实验均计时80秒,选择提供的试剂完成表格:
溶液、溶液、溶液、溶液
实验编号 步骤操作 pH变化
i 取25mL煮沸过的溶液,通入 pH轻微减小
ii 取25mL未煮沸的① ,通入 pH减小2.5
iii 取25mL煮沸过的溶液,通入 pH几乎不变
iv 取25mL未煮沸的② ,通入 pH减小2
(5)由上述实验可得出:溶液中与氧化占主导作用的是 (填“”或“”)。
(6)写出在有氧气的条件下,与反应的离子方程式: 。
(7)GaN晶胞结构如图1所示。已知六棱柱底边边长为,阿伏加德常数的值为。
①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子数目为 ;
②从GaN晶体中“分割”出的平行六面体如图2,若该平行六面体的高为,GaN晶体的密度为 (用、表示)。
6.(2023·江西赣州·统考二模)CuO、Cu2S等含铜化合物可以催化合成HCOOH.回答下列问题:
(1)基态铜原子的价电子排布式为 。
(2)HCOOH中碳原子的轨道杂化类型为 ,元素电负性从大到小的顺序为 。
(3)催化过程中可能产生,的空间构型为 ,碳氧键的平均键长比CH3OH要 (填“长”或“短”)。
(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是 。
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
S2-配位数为 ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的为Cu+原子分数坐标为 ;若晶胞参数anm,晶体的密度为dg·cm-3),则阿佛伽德罗常数的值为 (用含a和d的式子表示)。
7.(2023·山东青岛·统考三模)是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1)与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为 。
(2)可形成四种配离子且配离子中不存在非极性键,其中离子半径最小的配离子是 ,具有对称结构的中为 。图1中通过螯合作用形成配位键的N原子的杂化方式为 ,离子配体中N原子与中心离子配位的原因是 。
(3)的晶体结构如图2所示。
①和的电负性: (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为 形。
②用表示阿伏伽德罗常数的值,晶胞参数为,,则其密度为 (列出计算式即可)。
8.(2023·四川南充·统考三模)卤素及其化合物在药物中曾占有一定地位,现在临床上仍有使用。回答下列问题:
(1)基态Br的价电子排布式为 。基态N、O、F第一电离能由大到小的顺序是 。
(2)ClO2可用于杀菌消毒。ClO2键角介于ClO和ClO之间,ClO2键角 (填字母标号)。
A.>120° B.109°28'~120° C.<109°28'
(3)碘酊是I2和KI在乙醇中的溶液,用于皮肤消毒。I2和KI可形成直线形I离子,中心I采取的杂化类型为 (填字母标号)。
A.sp B.sp3 C.sp3d
(4)为提高含氮碱性有机药物的水溶性,常常用它们的盐酸盐。例如盐酸氨溴索(一种止咳药,结构见图)的阳离子可与水形成氢键,其表示式为O-H…O(H2O)、 、 。
(5)KBr、NaBr用作镇静剂,NaF可预防龋齿。三者中熔点最高的是 ,原因是 。
(6)氟化物有防治龋齿的作用,氟离子与羟(基)磷灰石[Ca5(PO4)3OH,M=502g mol-1]转化成氟磷灰石抵抗酸的侵蚀。Ca5(PO4)3OH晶胞结构如图。其中Ca2+、PO均位于体内,则1个晶胞中含有OH-的数目是 。晶胞参数分别为apm、apm、cpm,α=β=90°,γ=120°,其密度ρ= g cm-3(列出计算式,设NA为阿佛伽德罗常数的值)。
9.(2023·北京·高三统考专题练习)短周期元素B、C、N等元素可以形成多种物质,呈现出不同的性质,请回答以下问题:
(1)B、C、N三种元素中第一电离能最大的是 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是 。
(3)的结构与类似、但是性质差异较大。
①的空间结构为 形。N原子的轨道杂化类型为 。
②具有碱性(可与结合)而不显碱性,原因是 。
(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。
①距离硼原子最近的氮原子有 个,氮化硼晶体中含有的微粒间作用力为 。
②已知:立方氮化硼晶体的摩尔质量为ag mol,密度为ρg cm,设为阿佛加德罗常数的值,则该晶体的晶胞边长为 cm。
10.(2023·宁夏石嘴山·统考一模)H、N、O、S、Fe、Cu是日常生活中常见的元素。
(1)基态Fe2+的核外电子排布式为 ,Fe3+有 种能量不同的电子。
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为 ,的空间构型是 。
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是 。键角∠B-O-H不同于键角 ∠O-B-O的原因是 。
(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
①若图中原子1的分数坐标是(,,)则原子5的分数坐标是 。
②晶胞结构中原子1、5之间的距离为 cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为 g·cm-3。
11.(2023·西藏拉萨·统考一模)Na、Cl、 Cu是中学化学中常见的成盐元素,它们之间能形成多种化合物。回答下列问题:
(1)Na和Cl两种元素能形成多种化合物,如常见的NaCl,其晶胞结构如图1所示,氯离子位于晶胞的顶点和面心。
①Cl的基态原子核外电子排布式为 。
②图1所示晶胞中,与钠离子最近的钠离子共有 个。
③在高压下,Na与Cl可产生新的化合物,晶胞结构如图2所示,钠离子位于晶胞的顶点和体心,该物质的化学式为 。
④Na与Cl在某条件下还能形成一种团簇分子,分子结构如图3所示,氯原子位于顶点和面心。该团簇分子的分子式为 。
(2)Cu、NH3、Cl可以形成[Cu(NH3)4]Cl2。 NH3分子的空间构型为 ,[Cu(NH3)4]2+中提供空轨道的是 ,1 mol 该配合物中含有σ键的数目为 (NA为阿伏加德罗常数的值)。
(3)金属铜采取面心立方最密堆积方式,Cu晶胞的边长为a pm,其晶胞及相关结构如图甲、乙、丙所示:
①铜晶体的密度ρ= g·cm-3。
②根据图丙求出铜原子的半径r= pm。
12.(2023·广西南宁·统考二模)硼及其化合物具有重要的工业用途,请回答以下问题:
(1)基态B原子核外电子有 种能量不同的电子。
(2)在硼酸盐中,硼酸盐的阴离子结构丰富,有基本结构单元是[BO3]平面三角形和[BO4]四面体形,其基团的数目和连接方式不同,其中一种的结构如下,则B与O的原子数之比 ,其化学式为 。
(3)硼的卤化物的沸点如表所示:
卤化物 BF3 BCl3 BBr3
沸点/℃ -100.3 12.5 90
①硼的卤化物沸点变化规律并解释其原因 。
②BF3和NF3的键角大小关系为B3F NF3(填“>”、“<”或“=”),原因为 。
(4)硼可与多种金属形成化合物.其中与Ca组成的金属硼化物可做新型半导体材料,晶胞结构如图所示:
①该晶胞中B原子数为 个,晶体中Ca原子的配位数为 。
②晶胞在z轴方向的投影图为图中的 (填标号)。
③已知B6八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为(,,),则M点原子的分数坐标为 。
13.(2023·甘肃·统考二模)钴及其化合物具有广泛的用途,我国古代用的陶器釉料中就含有氧化钴。随着科技的不断发展,钴及其化合物成为制造合金、陶瓷颜料、催化剂、电池的重要原料之一,钴被也称为“工业味精”和“工业牙齿”,是重要的战略资源之一。回答下列问题。
(1)基态钴原子的价层电子排布式为 ,钴成为阳离子时首先失去 轨道电子。
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子 (填“大”“小”或“相同”),其原因为 。
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
①中N的杂化方式为 。
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是 。
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是 (填序号)。
A.NH3 B. C. D.H2O
(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。
①O2-周围紧邻的O2-数目为 ,晶体中正四面体空隙数与正八面体空隙数之比为 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为 g·cm-3(用含a和NA的代数式表示)。
14.(2023·福建莆田·统考二模)是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。
(1)基态Mn原子的外围电子轨道表示式为 。
(2)Mn、Fe元素的第三电离能(I3): (填“>”或“<”)。
(3)中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是 。其中分子中N原子的杂化类型为 。
(4)晶胞中,与形成配位键的元素有 。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于 位置。
15.(2023·山东·济南一中校联考三模)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。回答下列问题:
(1)石墨中碳原子的杂化方式为 ,基态碳原子中电子的空间运动状态有 种,D、E原子的分数坐标分别为 、 (以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标)。
(2)六方石墨晶体的密度为 (写出计算表达式,要求化简)。
(3)1个三方石墨晶胞中碳原子的个数为 。
(4)石墨可用作锂离子电池的负极材料,充电时可由形成计按如图所示均匀分布的锂碳化合物,该物质中存在的化学键有 ,充电时该电极的电极反应式为 。
(5)锂离子电池的正极材料为层状结构的。锂离子完全脱嵌时的层状结构会变得不稳定,用铝取代部分镍形成。可防止锂离子完全脱嵌而起到稳定结构的作用,其原因是 。
16.(2023·广西·统考三模)锌是动物必需的微量元素之一,参与机体的各种代谢活动。
(1)Zn位于元素周期表的 区,基态Zn原子的价电子排布图为 。
(2)第二电离能:Cu Zn(填“>”、“<”或“=”),判断依据是 。
(3)含有多个配位原子的配体与同一个中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物,一种Zn2+配合物的结构如图1所示(-OTs为含氧、硫的有机基团):
①1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N原子的杂化类型为 。
②该配合物所涉及非金属元素电负性最小的是 (填元素符号)。
(4)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图2所示,晶体中正负离子的配位数之比为 。
(5)已知每个Zn2+与其周围最近的S2-之间的距离都相等,以晶胞参数为单位长度建立坐标系,若A点坐标为(0,0,0),B点坐标为(,,),C点坐标为(0,0,u),则D点坐标为 。
17.(2023·全国·高三专题练习)有机—无机复合钙钛矿()型材料在太阳能电池及发光二极管等方面具有很好的应用前景,一种复合材料和(立方晶系)的晶胞结构如图所示。
已知:A为间隔的阳离子,例如、等;A'为单一组分钙钛阳离子,例如、、等;B为单一组分钙钛矿中心离子、等,X为单一组分钙钛矿的阴离子,例如、或等卤素离子。
回答下列问题:
(1)基态Ti原子的价电子排布式为 。
(2)H、C、N、O四种元素电负性由大到小的顺序为 ;第一电离能、、由大到小的顺序为 。
(3)中C的杂化方式为 ;正丁胺()的沸点为77.8℃,正丁醇()的沸点为117.6℃,正丁胺沸点低的原因是 。
(4)中Ca的配位数为 ;A为,A'为,B为,X为,晶胞参数为a nm和c nm,该晶体的密度为 。
18.(2023·全国·高三专题练习)钕铁硼磁铁在绝对零度时磁性仅次于钬磁铁,但是在常温下磁性远远强于目前已知的所有永久磁铁。生产钕铁硼磁铁的主要原料有稀土金属钕、纯铁、铝硼及其他稀土原料。
(1)钕(Nd)为60号元素,在周期表中第 周期。
(2)①铝原子激发态的电子排布式有 (填标号,下同) ,其中能量较高的是 。
A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于 分子(填“极性”或“非极性”),分子中Al采取 杂化。
(3)硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为 (用元素符号
表示)。晶体硼的熔点比晶体硅高,原因是 。
(4)羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为 ,且所有氢原子的化学环境都相同,则下列说法中正确的是 (填标号)。
A.二茂铁的中心粒子与配体间存在离子键,且配体中存在一个键
B.羰基铁中,配位原子为C原子,且配体与CN- 是等电子体
C.两种配合物的中心粒子价电子排布图均为
D.1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
①六方相氮化硼结构与石墨相似,但是却不导电的原因是 。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有 个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm= m3·mol-1 (列出计算式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)2s22p3
(2) A NnHn+2 2m(,m为正整数) < 形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂
(3) CaCN2 6
【详解】(1)N核电荷数为7,核外有7个电子,基态N原子电子排布式为1s22s22p3,则基态N原子的价层电子排布式是2s22p3;故答案为:2s22p3。
(2)①A.能量最低的激发态N原子应该是2p能级上一个电子跃迁到3s能级,其电子排布式:,故A错误;B.钙的金属性比镁的金属性强,则化学键中离子键成分的百分数:,故B正确;C.氮有三个价键,最简单的氮烯即含一个氮氮双键,另一个价键与氢结合,则其分子式:,故C正确;D.氮烷中N原子有一对孤对电子,有三个价键,则氮原子的杂化方式都是,故D正确;综上所述,答案为:A。
②氮和氢形成的无环氮多烯,一个氮的氮烷为NH3,两个氮的氮烷为N2H4,三个氮的氮烷为N3H5,四个氮的氮烷为N4H6,设分子中氮原子数为n,其氮烷分子式通式为NnHn+2,根据又一个氮氮双键,则少2个氢原子,因此当双键数为m,其分子式通式为NnHn+2 2m(,m为正整数);故答案为:NnHn+2 2m(,m为正整数)。
③形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂,因此给出的能力:<(填“>”或“<”);故答案为:<;形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂。
(3)钙个数为,个数为,则其化学式为CaCN2;根据六方最密堆积图 ,以上面的面心分析下面红色的有3个,同理上面也应该有3个,本体中分析得到 ,以这个进行分析,其俯视图为 ,因此距离最近的钙离子个数为6,其配位数为6;故答案为:CaCN2;6。
2.(1) O>Si>Fe>Mg +2
(2) 钠的电负性小于硅,氯化钠为离子晶体,而为分子晶体 随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大 正四面体
(3) 1
【详解】(1)为26号元素,基态原子的价电子排布式为。元素的金属性越强,其电负性越小,元素的非金属性越强则其电负性越大,因此,橄榄石()中,各元素电负性大小顺序为O>Si>Fe>Mg;因为中、、的化合价分别为+2、+4和-2,x+2-x=2,根据化合物中各元素的化合价的代数和为0,可以确定铁的化合价为+2。
(2)与均为第三周期元素,熔点明显高于,原因是:钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而为分子晶体,其熔点较低。由表中的数据可知, 、、熔点变化趋势为:随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大。的空间结构为正四面体,其中的价层电子对数为4,因此的轨道杂化形式为。
(3)由硼镁化合物的晶体结构可知位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有个,由晶胞沿c轴的投影图可知本题所给晶体结构包含三个晶胞,则晶胞中Mg的个数为1;晶体结构中在正六棱柱体内共6个,则该物质的化学式为;由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为,因此B-B最近距离为。
3.(1)15
(2) O>Cl>C 平面四边形
(3) sp3、sp2 1号氧比2号氧的价层孤电子对数多,且带负电,更易提供孤电子对
(4) b (,0,0)或(0,,0) 3(a+b)
【详解】(1)把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态Cr原子核外电子排布为1s22s22p63s23p63d54s1,则原子的核外有15种空间运动状态不同的电子。
(2)①同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;COCl2中C、O和Cl元素的电负性由大到小的顺序是O>Cl>C。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,根据相似相溶原理可知,CrO2Cl2为非极性分子,则CrO2Cl2分子中正负电荷重心重合,故空间构型是平面四边形结构;
(3)①阴离子中饱和碳原子为sp3杂化,与羰基直接相连的碳原子为sp2杂化;
②1号氧比2号氧的价层孤电子对数多,且带负电,更易提供孤电子对导致在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的;
(4)①氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图所示,则铬原子位于棱心、体心位,Cr原子沿x轴方向的投影位于正方形的顶点、边长中心、正方形中心,故选b;
②晶胞中N原子的坐标是A(0,0,0)、B(,,0),则距A和B最近的Cr原子图示为:,D在x、y、z轴上的投影坐标分别为、0、0;E在x、y、z轴上的投影坐标分别为0、、0;故坐标是(,0,0)或(0,,0);DE原子到C原子的距离是相等的,以CD距离为例,晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm,则晶胞边长为2(a+b)nm,则CD为。
4.(1) 6s26p3 平面三角形 3∶1
(2) O>N>C CH3CH2OH 中存在分子间氢键
(3) sp3 B
(4) 3∶2
【详解】(1)类比N的价层电子排布式可得基态Bi原子的价层电子排布式为6s26p3;NO中N原子的杂化方式为sp2,空间构型为平面三角形;基态O原子核外成对电子数为6与未成对电子数为2故比值为3:1。
(2)电负性O>N>C,故答案为O>N>C;CH3CH2OH可以形成分子间氢键,沸点大于CH3OCH3,故答案为CH3CH2OH可以形成分子间氢键。
(3)①C除了与两个O形成σ键之外还与两个H形成σ键,故杂化类型为sp3。
②A.含有该超分子的物质为离子晶体,A错误;
B.冠醚可以分离不同的碱金属离子,B正确;
C.中心碱金属离子的配位数随着冠醚分子的结构变化而变化,C错误;
D.冠醚和碱金属离子之间为共价键,D错误;
故选B。
(4)①;
②该晶胞中含有6个K和2个Bi,故密度为。
5.(1)分液漏斗
(2)
(3)CD
(4) 溶液 溶液
(5)
(6)
(7) 12
【分析】浓硫酸和亚硫酸钠生成二氧化硫,二氧化硫具有漂白性使A中品红溶液褪色,二氧化硫和硝酸钡溶液发生反应生成硫酸钡沉淀,二氧化硫和氢氧化钠反应使得溶液碱性消失导致酚酞溶液褪色,二氧化硫和溴水发生氧化还原反应而褪色,二氧化硫和酸性高锰酸钾发生氧化还原反应而褪色,尾气有毒需要处理;
【详解】(1)盛放溶液的仪器名称是分液漏斗;
(2)浓硫酸和亚硫酸钠反应生成硫酸钠和水、二氧化硫气体:;
(3)A.品红溶液体现了二氧化硫的漂白性,A不符合题意;
B.二氧化硫具有酸性氧化物的性质,和氢氧化钠反应使得溶液碱性消失,导致酚酞溶液褪色,B不符合题意;
C.溴水具有强氧化性,和二氧化硫发生氧化还原反应而褪色,体现二氧化硫还原性,C符合题意;
D.酸性高锰酸钾具有强氧化性,和二氧化硫发生氧化还原反应而褪色,体现二氧化硫还原性,D符合题意;
故选CD。
(4)实验中探究溶液中与氧化的主导作用,则需要控制实验中的变量唯一;
实验i、ii为对照实验,变量为硝酸钡溶液是否煮沸除去溶解氧,故实验ii填:溶液;
实验iii、iv为对照实验,变量为氯化钡溶液是否煮沸除去溶解氧,故实验iv填:溶液;
(5)由实验i、ii为对照,验iii、iv为对照,通过pH变化可知,存在溶解氧的pH更小,故溶液中与氧化占主导作用的是;
(6)在有氧气的条件下,氧气将四价硫氧化为六价硫的硫酸根离子,硫酸根离子和钡离子生成硫酸钡沉淀,总反应为;
(7)①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子在上中下层各存在3、6、3,共12个;
②根据“均摊法”,晶胞中含个Ga、个Ga,已知六棱柱底边边长为,则底面积为,该平行六面体的高为,则晶体密度为。
6.(1)3dl04S1
(2) sp2杂化 O>C>H
(3) 平面(正)三角形 短
(4)H2SO4有2个非羟基氧而H2CO3只有1个,中心原子的非羟基氧越多,其酸性越强
(5) 8 (,,)
【详解】(1)Cu为29号元素,其电子排布式为1s22s22p63s23p63d104s1,故其价电子排布式为3d104s1,故答案为:3d104s1;
(2)HCOOH中羧基上的碳原子形成1个碳氧双键、2个单键,是sp2杂化;
元素的非金属性越强,电负性越大,H、C、O电负性从大到小的顺序为O>C>H;
(3)的中心原子的价层电子对数=键数+孤电子对数=3+0=3,则C为sp3杂化,三个O原子分别位于杂化轨道的伸展方向上,所以的空间构型为平面三角形;由于有大键,所以中C-O键长较短;故答案为:平面三角形;短;
(4)H2SO4中有两个非羟基氧而H2CO3只有一个,非羟基氧越多,吸引电子能力越强,H-O的电子云密度(电子出现概率)越小,H越易电离,其酸性越强,故答案为:H2SO4中有两个非羟基氧而H2CO3只有一个,中心原子的非羟基氧越多,其酸性越强;
(5)在Cu2S晶胞中,四面体中心共有8个,每个四面体中心均分布着一个Cu+,每个S2-周围有8个Cu+,故S2-配位数为8;图中A处(S2-)的原子分数坐标为(0,0,0),A与相邻的三个面心原子形成一个正四面体,与A距离最近的Cu+位于此正四面体的中心,则Cu+的原子分数坐标为(,,);晶胞的体积为(a10-7)3cm3,每个晶胞的质量为,则d=,则mol-1,只涉及数值,省略单位mol-1,其数值为,故答案为:8;(,,);。
7.(1)
(2) 、 杂化 N原子电负性小于O,更易给出孤电子对
(3) 小于 哑铃(或纺锤)
【详解】(1)与铁在元素周期表中是同列相邻元素,是44号元素,最外层有一个未成对电子,其价电子排布式为。
(2)离子化合价越高,电子数越少,半径越小, 中Ru元素化合价依次为+3、+4、+7、+8,所以离子半径最小的配离子是;具有对称结构的为正八面体结构,6个Br-在6个顶点上、Ru在八面体中心,为、。图1中通过螯合作用形成配位键的N原子形成3个α键,无孤电子对,杂化方式为杂化,N原子电负性小于O,更易给出孤电子对,所以离子配体中N原子与中心离子配位。
(3)①和同周期,价电子数少,所以电负性小于,基态O原子电子占据最高能级是2p,电子云轮廓图为哑铃形。
②根据均摊原则,晶胞中Ru数为 、Sr数为、O数为 ,用表示阿伏伽德罗常数的值,晶胞参数为,,则其密度为。
8.(1) 4s24p1 F>N>O
(2)B
(3)C
(4) N-H…O(H2O) (H2O)O-H…O、(H2O)O-H…N
(5) NaF 三者均属于离子晶体,r(Na+)<r(K+),r(F-)<r(Br-),则NaF中离子键相对最强(晶格能相对大),故NaF熔点较高
(6) 2
【详解】(1)基态Br位于第四周期VIIA族,其价电子排布式为4s24p1;同周期元素其第一电离能呈增大趋势,N的最高能级为全充满稳定结构,其第一电离能比相邻元素的大,所以基态N、O、F第一电离能由大到小的顺序是F>N>O,故答案为:4s24p1;F>N>O;
(2)根据价层电子对理论可知,ClO的价层电子对数=2+=3,采用sp2杂化,VSEPR模型中空间构型为平面三角形,ClO的价层电子对数=2+=4,采用sp2杂化,VSEPR模型中空间构型为四面体形,ClO2键角介于ClO和ClO之间,则ClO2键角再109°28'~120°之间,故选B;
(3)根据信息可知,I离子为直线形,中心I的价层电子对数为2+=5,则采取的杂化类型为sp3d,故选C;
(4)电负性较强的N、O、F会与H原子之间形成分子间氢键,根据图中结构简式可知,盐酸氨溴索的阳离子可与水形成氢键,还可形成N-H…O(H2O)、(H2O)O-H…O、(H2O)O-H…N;
(5)KBr、NaBr均属于离子晶体,因为钠离子半径小于钾离子的,所以溴化钠的离子键键能大,同理,NaBr与NaF相比,两者也均属于离子晶体,因半径:F->Br-,所以NaF的离子键键能大,其晶体熔点较高,综上可知,三者熔点最高的是NaF,原因可总结为三者均属于离子晶体,r(Na+)<r(K+),r(F-)<r(Br-),则NaF中离子键相对最强(晶格能相对大),故NaF熔点较高;
(6)由于Ca2+、PO均位于体内,则1个晶胞中含有10个Ca2+和6个PO,结合羟(基)磷灰石的化学式为Ca5(PO4)3OH可知,晶胞中所含OH-的数目是2个;根据晶胞的密度为晶胞质量与晶胞体积之比,可得出该晶胞的密度==。
9.(1)N
(2)金刚石>碳化硅>硅
(3) 三角锥形 中F元素电负性强,使得N原子呈正电性(),难与结合
(4) 4 共价键
【详解】(1)同周期元素从左到右第一电离能有增大的趋势,B、C、N三种元素中第一电离能最大的是N;
(2)硅、金刚石和碳化硅都是共价晶体,原子半径越小,键能越大,原子半径C
(3)①中N原子价电子对数为4,有1个孤电子对,空间结构为三角锥形。N原子的轨道杂化类型为。
②中F元素电负性强,使得N原子呈正电性(),难与结合,所以不显碱性。
(4)①根据图示,距离硼原子最近的氮原子有4个,氮化硼为共价晶体,含有的微粒间作用力为共价键。
②根据均摊原则,晶胞中B原子数为 、N原子数为4,立方氮化硼晶体的摩尔质量为ag mol,密度为ρg cm,设为阿佛加德罗常数的值,边长为xcm,则;该晶体的晶胞边长x=cm。
10.(1) [Ar]3d6(或1s22s22p63s23p63d6) 6
(2) 4 四面体
(3) sp2 O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力
(4) (1,,)
【详解】(1)铁为26号元素,Fe基态原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为Fe失去2个电子形成,基态核外电子排布式为[Ar]3d6(或1s22s22p63s23p63d6),Fe3+为Fe失去3个电子形成,基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5),则Fe3+有6种能量不同的电子;
(2)根据该配合物的结构可知,其中Cu2+的配位数为4,中S的价层电子对为4,则其空间构型为正四面体结构;
(3)根据硼酸晶体的结构为片层为平面结构,O原子与B原子之间形成大π键,则分子中氧原子杂化方式是sp2;键角∠B-O- H的中心原子O有2对孤电子对,而键角∠O- B-O的两个配原子O均由孤电子对,因为O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力,所以键角∠B-O- H不同于键角∠O- B-O;
(4)①根据数学立体几何关系可知,若图中原子1的分数坐标是(,,), 则原子5的分数坐标是(1,,);
②因为原子1的分数坐标为(,,),原子5的分数坐标为(1,0,),所以两个原子之间的距离为;
③其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,所以晶胞中Ga的原子个数为=4,N的原子个数也为4,设阿伏加德罗常数的值为NA,则GaN晶体晶胞质量为,故其密度为g·cm-3。
11.(1) 1s22s22p63s23p6或[Ne]3s23p5 12 NaCl3 Na13Cl14
(2) 三角锥形 Cu或Cu2+ 16NA
(3) a
【详解】(1)①为17号元素,其基态原子核外电子排布式为1s22s22p63s23p6或[Ne]3s23p5;
②由图可知,图1所示晶胞中,与钠离子最近的钠离子共有12个;
③根据“均摊法”,晶胞中含个Na、个Cl,该晶体的化学式为NaCl3;
④图3为气态团簇分子,该分子中Cl原子数为14、Na原子数为13,该团簇分子的分子式为Na13Cl14;
(2)NH3分子的中心N原子采取sp3杂化,其中1个杂化轨道被孤电子对占据,故NH3分子的空间构型为三角锥形;[Cu(NH3)4]2+ 中Cu2+提供空轨道,N原子提供孤电子对;铜离子的4个杂化轨道与N形成4个配位键,配位键属于σ键,4 molNH3含12molN-Hσ键,故1mol[Cu(NH3)4]Cl2中含有16 molσ键,数目为16NA;
(3)①根据铜晶胞结构和密度公式可知,;
②由图中几何关系可知,晶胞面对角线长度等于4倍的铜原子半径,则pm。
12.(1)3
(2) 1:2 BO
(3) BF3、BCl3、BBr3均为分子晶体,分子结构相似,随相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高 > BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3。
(4) 6 24 C (,0,0)
【详解】(1)基态B原子核外电子排布为,同一能级能量相同,则B原子有3种能量不同的电子,故答案为:3;
(2)由图可知每个[BO3]单元中都有1个B原子,1个氧完全属于该单元,剩余2个O分别为2个[BO3]单元共用,所以B:O=1:(1+2×)=1:2,,其化学式为:BO,故答案为:1:2;BO;
(3)①硼的卤化物的三种卤化物均为分子晶体,分子结构相似,相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高,故答案为:BF3、BCl3、BBr3均为分子晶体,分子结构相似,随相对分子质量增大,分子间作用力逐渐增强,故沸点依次升高;
②BF3为平面三角形,键角120°;NF3为三角锥形,键角约为102.5°;故键角BF3>NF3;原因:BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3,故答案为:BF3中B原子采用sp2杂化,无孤对电子,键角120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′,故键角:BF3>NF3;
(4)①由晶胞结构可知Ca位于以8个B6形成的立方晶胞的体心位置,B6的个数为:,则B原子个数为6,该晶胞的化学式为:CaB6,位于晶胞顶点的每个B6中只有3个B原子距离Ca原子最近,即Ca的配位数为24,故答案为:6;24;
②由晶胞结构可知B6围成正八面体构型,沿z轴方向的上下顶点投影为正方形的顶点,其余原子投影棱上,则符合的投影图为C,故答案为:C;
③B-B键的键长为rpm,则M点距离坐标原点的距离为pm,M点分数坐标为:(,0,0),故答案为:(,0,0)。
13.(1) 3d74s2 4s
(2) 大 NH3通过配位键与Co2+结合后,原来的孤电子对变为成键电子对,对其他N-H成键电子对的排斥力减小,H-N-H键之间的键角增大
(3) sp3 N、O BC
(4) 12 2:1
【详解】(1)基态钴原子核外电子数为27个,其电子排布式为,则价层电子排布式为3d74s2,钴成为阳离子时首先失去4s轨道电子;
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子,其原因为NH3通过配位键与Co2+结合后,原来的孤电子对变为成键电子对,对其他N-H成键电子对的排斥力减小,H-N-H键之间的键角增大;
(3)①中N的价电子对数为,且不含孤电子对,根据价层电子对互斥理论则其空间构型为正四面体,杂化方式为sp3;
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是提供孤电子的原子是N和O;
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”, NH3价电子对数为,且含有孤电子对数为1,根据价层电子对互斥理论其空间构型为三角锥形,各原子不在同一平面,不可以形成离城π键,价电子对数为,且不含有孤电子对,根据价层电子对互斥理论其空间构型为平面三角形,sp2杂化,2s、2p的两个轨道发生杂化,形成3个sp2杂化轨道,pz轨道留有一个电子,每个O的pz轨道留有一个单电子,还有得到的两个电子,4个pz轨道平行重叠形成4中心6电子的离域大π键,价电子对数为,且不含有孤电子对,根据价层电子对互斥理论其空间构型为平面三角形,sp2杂化,2s、2p的两个轨道发生杂化,形成3个sp2杂化轨道,pz轨道留有一个电子对,每个O的pz轨道留有一个单电子,还有得到的一个电子,4个pz轨道平行重叠形成4中心6电子的离域大π键,H2O中的H不含p电子,不可以形成离域大π键;
(4)①由晶胞可知,位于顶点的O2-与位于面心的O2-离子最近,则每个O2-周围紧邻的O2-数目为12,如1、3、6、7号O2-围成的正四面体为八个,一个顶点三个面心构成一个正四面体,八个顶点可以构成八个正四面体,正四面体空隙数为8,3、6、7、8、9、12号O2-围成正八面体,将晶体向外延伸可知,共用一条棱的4个面心与该棱的两个顶点上的O2-也可以构成正八面体结构,但是这样的八面体是四个晶胞共有,所以正八面体个数为,正八面体空隙数为4,晶体中正四面体空隙数与正八面体空隙数之比为2:1。
②已知晶胞参数为apm,阿伏加德罗常数为NA,由晶胞可知,晶胞中氧离子个数为,由化学式可知晶胞中含有一个Co3O4,晶胞的质量为,体积为,密度为。
14.(1)
(2)>
(3) 孤电子对越多,对成键电子对斥力越大,键能越小 sp3
(4) Fe、Mn 顶点、面心
【详解】(1)Mn的原子序数为25,价电子排布式为3d54s2,轨道表示式为;
(2)Mn的价电子排布式为3d54s2,Fe的价电子排布式为3d64s2,各失去2个电子后,外层电子排布式分别为3d5、3d6,Mn2+的3d轨道处于半充满,稳定,再失去一个电子所需要的能量较高,故>;
(3)孤电子对越多,对成键电子对斥力越大,键能越小,故中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小;分子中N原子均形成单键,杂化类型为sp3;
(4)晶胞中,与CN-形成配位键的元素有Fe、Mn;若0点处于晶胞体心,则Mn处于顶点、面心位置。
15.(1) sp2 4
(2)
(3)6
(4) 离子键、共价键、金属键
(5)脱嵌过程中Al不会变价,Li+不能完全脱嵌
【详解】(1)石墨中,每个碳原子形成3个σ键,无孤电子对,碳原子的杂化方式为sp2,基态碳原子核外电子排布式为1s22s22p2,电子占用4个原子轨道,电子的空间运动状态有4种,D在三方晶系底面上,原子的分数坐标为 ,E在六方晶系的内部,根据图示E原子的分数坐标为 。
(2)根据均摊原则,1个晶胞中含有4个C原子,C-C键长为0.142nm,则底面积为,六方石墨晶胞的体积为 ,六方石墨晶体的密度为。
(3)根据均摊原则,1个三方石墨晶胞中碳原子的个数为
(4)Li +嵌入石墨的A、B层间,导致石墨的堆积结构发生改变,形成化学式为LiC 6的嵌入化合物,可见该物质中存在的化学键有,Li +与相邻石墨环形成的离子键、碳与碳形成的共价键、石墨中层中还有金属键;充电时由形成,充电时的电极反应式为
(5)Ni的氧化数有+2、+3、+4,而Al的氧化数只有+3,如果Ni被氧化到+4价态,Li+可以完全脱嵌,形成NiO2,但有Al3+存在,必须有Li+形成电中性物质,所以用铝取代部分镍形成可防止锂离子完全脱嵌而起到稳定结构的作用。
16.(1) ds
(2) > 基态Cu+核外价电子为3d10,3d轨道为全满较稳定状态,不容易再失去一个电子;基态Zn+核外价电子为3d104s1,4s轨道有1个电子,容易失去1个电子
(3) 4 sp2杂化、sp3杂化 H
(4)1:1
(5)(,,)
【详解】(1)Zn为30号元素,位于元素周期表的ds区,基态Zn原子的价电子排布图为;
(2)基态Cu+核外价电子为3d10,3d轨道为全满较稳定状态,不容易再失去一个电子;基态Zn+核外价电子为3d104s1,4s轨道有1个电子,容易失去1个电子形成锌离子;故第二电离能:Cu>Zn;
(3)①由螯合物定义和结构示意图可知,1mol该配合物中通过螯合作用形成的配位键有4mol,该螯合物中环上N所在的环为平面结构,其杂化类型为sp2杂化,-NH-中氮原子形成3个共价键且存在1对孤电子对,为sp3杂化;
②同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;该配合物所涉及非金属元素电负性最小的是氢元素H;
(4)据“均摊法”,晶胞中含个S、个Zn,则化学式为ZnS,以B点硫为例,其最近且相邻的锌为4个,结合化学式可知,晶体中正负离子的配位数之比为4:4=1:1;
(5)由已知坐标可知,B点硫距离z轴距离为,则BC距离为,BC距离等于BD距离,则D点在y轴上投影坐标为,结合B点坐标可知,D点在x、y轴上投影坐标为、,故D点坐标为(,,)。
17.(1)
(2)
(3) 杂化 N的电负性小于O,正丁胺分子间的氢键弱于正丁醇分子间的氢键
(4) 12
【详解】(1)基态Ti原子为22号元素,价电子排布式为;
(2)同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;H、C、N、O四种元素电负性由大到小的顺序为;同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能;
(3)中C形成3个共价键且无孤电子对,杂化方式为杂化;正丁胺()的沸点为77.8℃,正丁醇()的沸点为117.6℃,正丁胺沸点低的原因是N的电负性小于O,正丁胺分子间的氢键弱于正丁醇分子间的氢键,导致其沸点低于正丁醇;
(4)以底面右下角的Ca为例,同层、上下层最近相邻的O各有4个,则中Ca的配位数为12;
根据“均摊法”,晶胞中含个A、个A'、个B、个X,A为,A'为,B为,X为,晶胞参数为a nm和c nm,则晶体密度为。
18.(1)六
(2) AD D 非极性 sp3
(3) C>Be>B 晶体硼和晶体硅均为原子晶体,硼原子半径小于硅原子半径,B-B 键键长比Si-Si键键长短,键能大,因此晶体硼熔点高于晶体硅
(4)BD
(5) 层状结构中没有自由移动的电子 12
【详解】(1)钕(Nd)为60号元素,在周期表中第六周期第ⅢB族;
(2)①基态Al原子核外电子排布为1s22s22p63s23p1,则铝原子激发态的电子排布式有A.1s22s22p63s13p2、D.1s22s22p63p3,B.1s22s22p63s2、C.1s22s22p63s23p2两者为离子;故选AD;3p轨道能量大于3s,故其中能量较高的是D;
②已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于非极性分子;分子中Al形成4个共价键,采取sp3杂化;
(3)同一周期随着原子序数变大,第一电离能变大,但是Be原子价电子为2s2全满稳定状态,电离能较大,故硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为C>Be>B;晶体硼和晶体硅均为共价晶体,硼原子半径小于硅原子半径,B-B 键键长比Si-Si键键长短,键能大,因此晶体硼熔点高于晶体硅;
(4)A.二茂铁的中心粒子与配体间存在配位键,且配体环戊二烯离子带1个单位负电荷,存在1个5中心6电子的大π键,故为键,A错误;
B.等电子体是指价电子数和原子数相同的分子、离子或原子团;羰基铁中,C提供孤电子对,配位原子为C原子,且配体与CN- 是等电子体,B正确;
C.羰基铁[ Fe(CO)5]、二茂铁[ Fe(C5H5)2]两种配合物的中心粒子分别为铁原子、亚铁离子,价电子排布图不同,C错误;
D.单键均为σ键,双键中含有1个σ键、1个π键,叁键含有1个σ键、2个π键;1分子羰基铁配体中存在5个σ键和10个π键,配体与中心原子形成5个配位键,故共有10个σ键和10个π键,则1mol羰基铁中有10NA个σ键和10NA个π键,D正确;
故选BD;
(5)①六方相氮化硼结构与石墨相似,但是其层状结构中没有自由移动的电子,故不导电;
②立方相氮化硼中,以底面面心的硼为例,离硼原子最近且等距离的硼原子上层、同层、下层各有4个,故共有12个;
③根据“均摊法”,晶胞中B的个数为,N的个数为4,若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积=m3·mol-1。
答案第1页,共2页
答案第1页,共2页
同课章节目录
