2024届高三化学一轮专题复习—电解池(含解析)
文档属性
| 名称 | 2024届高三化学一轮专题复习—电解池(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 924.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-04 23:15:41 | ||
图片预览

文档简介
2024届高三化学一轮专题复习—电解池
一、单选题
1.(2023下·全国·高三专题练习)用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2OCu2O+H2↑,装置如图,下列说法中正确的是
A.电解时Cl-通过交换膜向Cu极移动
B.阳极发生的反应为2Cu-2e-+2OH-=Cu2O+H2O
C.阴极OH-放电,有O2生成
D.Ti电极和Cu电极生成物物质的量之比为2∶1
2.(2023上·河南南阳·高三统考期末)近年来,国家相继出台一系列政策,扶持光伏发电项目建设。如图1是太阳能电池工作示意图,与图2装置联合可实现能量的转化和储存,下列说法错误的是
A.Y电极接太阳能电池的P电极
B.工作一段时间后,图2左池pH增大
C.每转移1mol电子,图2右池溶液中n(H+)的变化量为1mol
D.图2总反应为:VO2++V3++H2OV2++VO+2H+
3.(2023上·全国·高三专题练习)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂,装置图如下。下列说法不正确的是
A.是原电池
B.池能够生产
C.电路中电子流向为,形成闭合回路
D.、中均从左边迁移到右边
4.(2023·河北保定·定州一中校考模拟预测)双极膜是由阳离子交换膜和阴离子交换膜复合而成的,其内层为水层,装置工作时水层中的H2O解离成H+和OH-,分别向两侧发生迁移。CO2电化学还原法制备甲醇的电解原理如图所示。该装置工作时,下列说法正确的是
A.催化电极上发生氧化反应
B.石墨电极区溶液pH不变
C.H+穿过b膜进入右室溶液
D.电解一段时间后,右室HCO的物质的量减少
5.(2023上·高三课时练习)SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
A.电子流动方向为a→A→B→b
B.a、A极上均发生氧化反应
C.离子交换膜为阳离子交换膜
D.B极上的电极反应式为SO2+2e-+2H2O=SO+4H+
6.(2023上·四川成都·高三成都七中校考阶段练习)我国科学家用毛笔书写后的纸张(含石墨)作空气电极,设计并组装了可折叠的可充电锂—空气电池,工作原理如图所示。下列有关说法正确的是
A.放电时,纸张中的纤维素作为锂电池的正极材料
B.充电时,金属锂电极增重7g,空气电极放出
C.充电时,有机电解质溶液中Li 移向金属锂电极发生氧化反应
D.放电时,正极的电极反应式为:
7.(2023上·湖南长沙·高三雅礼中学校考阶段练习)为阿伏加德罗常数的值,下列有关说法正确的是
A.18g中含有的质子数为
B.14.2g含σ键的数目为
C.6.5gZn与一定量浓硫酸反应完全溶解,转移的电子数为
D.用电解法精炼铜时,若阳极质量减轻64g,则电路中转移电子数一定为
8.(2023上·四川遂宁·高三射洪中学校考阶段练习)最近《化学学报》报道了用聚环氧乙烷电解质基的高压固态锂离子电池,锂离子在该电解质基中有较好的传递效率,同时具有较好的安全性,正极材料为Li1-aMnxFeyPO4/LiMnxFeyPO4,Li1-aMnxFeyPO4中Mn,Fe元素均为+2价,电池结构示意图如下。下列说法错误的是
A.正极材料Li1-aMnxFeyPO4中,若x+y=1.2,则α=0.4
B.充电时,阴极反应为:Li1-aMnxFeyPO4 +aLi+ + ae-= LiMnxFeyPO4
C.放电时,当外电路转移0.2 mol电子,理论上负极质量减少1.4 g
D.放电时总反应: Li1-aMnxFeyPO4 +aLi = LiMnxFeyPO4
9.(2023上·高三课时练习)生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类的水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入CaCl2溶液,溶液的红色逐渐褪去
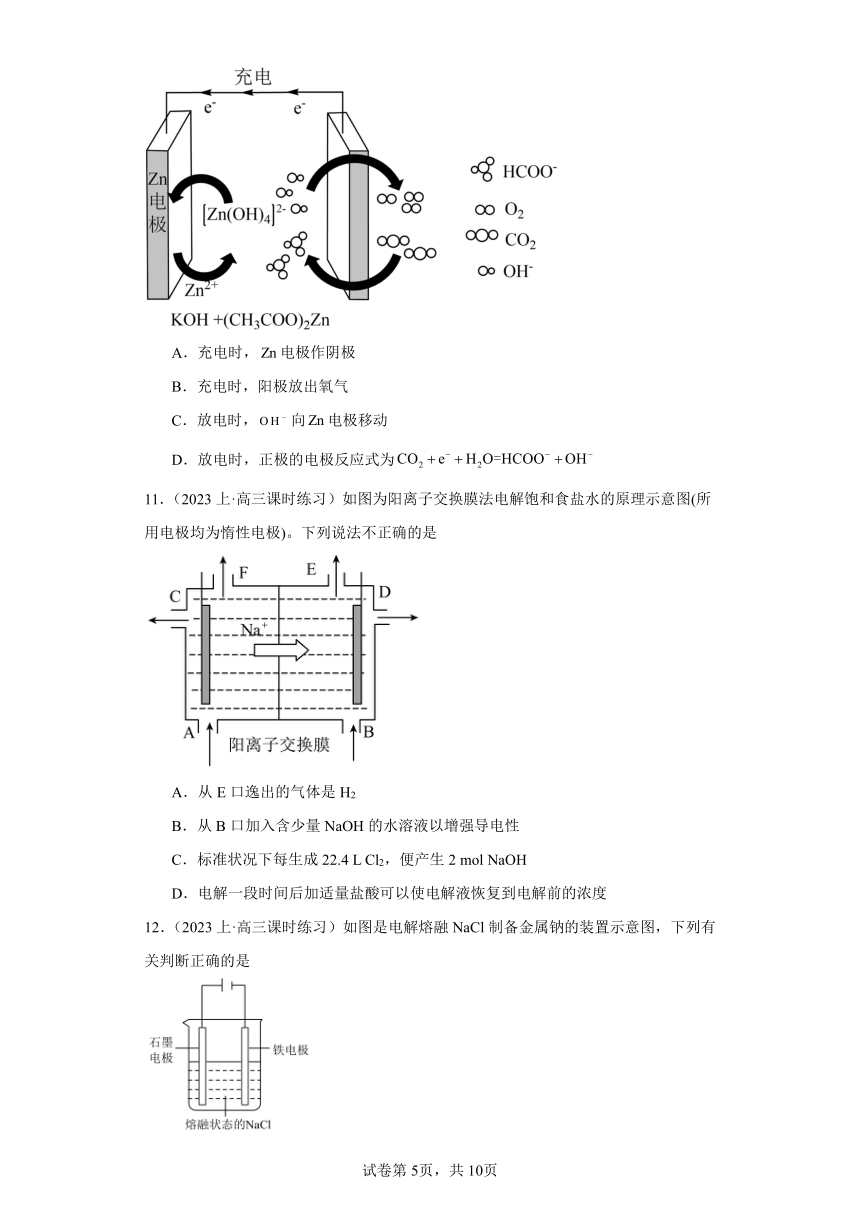
10.(2023上·陕西汉中·高三统考阶段练习)一种电化学催化制甲酸盐的装置如图。下列说法错误的是
A.充电时,电极作阴极
B.充电时,阳极放出氧气
C.放电时,向电极移动
D.放电时,正极的电极反应式为
11.(2023上·高三课时练习)如图为阳离子交换膜法电解饱和食盐水的原理示意图(所用电极均为惰性电极)。下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以使电解液恢复到电解前的浓度
12.(2023上·高三课时练习)如图是电解熔融NaCl制备金属钠的装置示意图,下列有关判断正确的是
A.通过该装置可以将化学能转变为电能
B.石墨电极为正极
C.Na+在铁极上得到电子被还原为钠原子
D.铁电极为阳极
13.(2022上·辽宁大连·高三大连八中校考期中)下列反应的离子方程式正确的是
A.碳酸氢钠溶液与过量的氢氧化钡溶液混合:2+Ba2++2OH-=BaCO3↓+ +2H2O
B.用惰性电极电解CuCl2水溶液:
C.在溶液中KIO3与Na2SO3充分反应生成KI:+3= I- +3
D.用高锰酸钾标准溶液滴定草酸:
14.(2023下·江苏盐城·高三盐城市伍佑中学校联考阶段练习)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.电解NaCl饱和溶液,可制得烧碱和氯气
B.在海轮外壳上镶入铜块,可减缓船体的腐蚀速率
C.医用消毒酒精中乙醇的浓度(体积分数)为75%
D.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
二、非选择题
15.(2024上·湖北·高三校联考阶段练习)铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:;
方法2:湿法炼铜:。
上述两种方法中,方法2比方法1更好,其原因是 (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为 。
(2)黄铜矿的含铜成分为,常采用溶液浸取,生成和等,该反应的化学方程式为 。
(3)将、和组成的混合物加入溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)气体。若将此混合物用足量的加热还原,所得固体的质量为 g。
(4)和的燃烧热分别为、,已知 ;则的 。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
实验序号 装置示意图 实验现象
1 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
2 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
①实验ⅰ中气体减少的原因是 。
②实验ⅰ中,推测产生,可能发生的反应有、 。
③随着阴极析出,实验ⅱ中平衡不移动,理由是 。
16.(2023上·河南周口·高三项城市第一高级中学校联考阶段练习)绿色甲醇是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、的捕集、和一步法制甲醇。
(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”(,具有强氧化性),驱动并加快电极反应]。
①电极X为 (填“阴”或“阳”)极。
②理论上生成的气体M与N的质量之比为 。
③在酸性介质中生成M的电极反应式为 。
(2)工业上从高炉气中捕集的示意图如图所示。
①高炉气从“吸收塔”底部通入,溶液从塔顶喷洒,这样做的优点是 。
②若从“吸收塔”出来的盐溶液中,则该溶液的pH为
[该条件下、,不考虑其他因素对pH的影响]。
③为研究温度对的影响,将一定量的溶液置于密闭容器中,并充入一定量的气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得气体的浓度如图所示:
化学平衡常数 (填“>”“<”或“=”);温度范围内,容器内气体浓度呈减小的趋势,其原因是 。
17.(2023上·福建龙岩·高三福建省连城县第一中学校考阶段练习)Ⅰ.如图所示,E为浸过含酚酞的Na2SO4溶液的滤纸。A、B分别为铂片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极,在碱溶液中可视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央滴一滴紫色的KMnO4溶液,将开关K打开,接通电源一段时间后,C、D中有气体产生。
请回答下列问题:
(1)R为 (填“正”或“负”)极。
(2)通电后,B附近发生的电极反应式为 。
(3)滤纸上的紫色点向 (填“A”或“B”)方向移动。
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间后,C、D中的气体逐渐减少,C中的电极为 (填“正”或“负”)极,电极反应式为 。
Ⅱ.通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
(5)Pt电极上发生的是 反应(填“氧化”或“还原”)。
(6)写出NiO电极的电极反应式: 。
18.(2023·全国·高三竞赛)海水中锂的提取
随着锂电池的广泛应用,锂已成为重要的战略资源,被称为白色石油。据估计,海水中锂的总含量为陆地锂总含量的5000倍以上,但海水中锂的质量浓度仅为0.1-0.2ppm,从海水提取锂首先需要对低浓度的Li+进行选择性富集。Li+能够嵌入某些氧化物并在一定条件下脱出,据此可以进行Li+的富集。
(1)以Li2CO3和MnO2为原料,充分混合后在720°C下煅烧3h,冷至室温后即可得到复合氧化物LiMn2O4(LMO)。用1molL-1的HCl在60°C处理LMO,将其中所有Li+置换后得到HMO,HMO可以和Li+反应再生成LMO,然后LMO与酸作用脱出Li+从而实现Li+富集。如此,可以循环处理。
①写出合成LiMn2O4的方程式 。
②用酸处理LMO时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中Mn的平均氧化态有所升高,写出副反应对应的化学方程式。这一副反应对再生后的HMO的锂富集性能有何影响 ?
(2)利用电化学富集锂也是有效的方法之一、某电化学系统如图所示,其包含两个电池单元,中间区域置有具有一维孔道结构的λ-MnO2,该孔道可以容纳合适的阳离子进出。MnO2电极通过阳离子交换膜与两个电化学池中的对电极隔开,腔室1和2中的电解质分别为0.5M的Na2SO4.和0.1M的LiOH.该电化学系统的工作步骤如下:
i.向MnO2所在腔室通入海水,启动电源1,使海水中的Li+进入MnO2结构而形成LixMn2O4;
ii.关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使LixMn2O4中的Li+脱出进入腔室2。
①为衡量MnO2对Li+的富集效果,将0.50M的LiC1溶液通入MnO2(4.8mg)所在腔室,启动电源1,使电流恒定在5.0mA,累计工作325s后发现MnO2的电极电势快速下降,计算所得LixMn2O4中的x 。
②写出上述过程中发生腔室2中阴极和阳极上的电极反应 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】根据装置图和电解总反应分析,Cu极为阳极,Cu极电极反应式为2Cu-2e-+2OH-=Cu2O+H2O; Ti极为阴极,Ti极电极反应式为2H2O+2e-= H2↑+2OH-;电解池中阴离子通过阴离子交换膜向阳极移动,据此分析作答。
【详解】A.由图可知,Ti极与负极相连为阴极,Cu极与正极相连为阳极,电解时阴离子向阳极移动,OH-通过阴离子交换膜向Cu极移动,故A错误;
B.由总方程式可知,Cu在阳极失去电子生成Cu2O,根据得失电子守恒和电荷守恒配平电极方程式为:2Cu-2e-+2OH-=Cu2O+H2O,故B正确;
C.钛极与电源负极相连是阴极发生H+得电子的还原反应,有H2生成,故C错误;
D.由图可知,Ti极与负极相连为阴极,电极方程式为:2H2O+2e-= H2↑+2OH-,Cu极与正极相连为阳极,电极方程式为:2Cu-2e-+2OH-=Cu2O+H2O,当转移相同物质的量电子时,Ti极生成的H2和Cu极生成的Cu2O物质的量之比为1:1,故D错误;
故选B。
2.B
【分析】由图1可知,太阳能电池中带正电粒子向P电极移动,则P电极为正极,N电极为负极;图2中,VO2+在Y电极生成VO,V元素价态由+4价升高为+5价,发生失电子的反应、作阳极,则Y极接太阳能电池的P电极,阳极反应式为VO2+﹣e﹣+H2O= VO+2H+,X为阴极,电极反应为V3++e﹣=V2+,右池中氢离子通过质子交换膜进入左池。
【详解】A.光伏电池中P电极为正极,由图2可知VO2+在Y电极生成VO,发生失电子的反应,与正极P相接,A正确;
B.图2为电解池,X为阴极,阳极反应式为VO2+﹣e﹣+H2O= VO+2H+,左池pH减小,B错误;
C.阳极电极反应式为VO2+﹣e﹣+H2O= VO+2H+,每转移1mol电子,右池中产生2molH+,但右池中有1molH+通过质子交换膜进入左池,右池溶液中H+增加2mol﹣1mol=1mol,C正确;
D.图2为电解池,阳极电极反应式为VO2+﹣e﹣+H2O= VO+2H+,阴极反应为V3++e﹣=V2+,则二式相加即得选项中的总反应,D正确。
故选B。
3.C
【分析】X装置有能自发进行的氧化还原反应,为原电池装置,二氧化硫在a极发生失电子的氧化反应,则a为负极,氧气在b极发生得电子的还原反应,则b为正极;Y装置与原电池装置相连,为电解池,c极连接原电池正极,为阳极,d极连接原电池负极,为阴极;
【详解】A.X装置有能自发进行的氧化还原反应,为原电池装置,故A正确;
B.结合Y装置可知,在c极失电子转化为,故B正确;
C.电子只能沿着导线移动,所以电路种电子流向:、,故C错误;
D.在X原电池装置中,向正极移动,在Y装置中,向阴极移动,都是从左到右的方向,故D正确;
答案选C。
4.C
【详解】A.催化电极上CO2转化为甲醇,碳元素化合价降低,发生还原反应,A错误;
B.石墨电极上电极反应式为,水层中的H2O解离成H+和OH-,OH-通过a膜向阳极(石墨电极)移动,石墨电极消耗的OH-与迁移过来的OH-数目相等,石墨电极区溶液中OH-物质的量不变,但电解过程中石墨电极区生成了水,溶液的pH减小,B错误;
C.水电离的H+通过b膜向阴极移动,进入右室溶液,C正确;
D.催化电极上的电极反应式为,通过b膜迁移过来的H+与反应生成,故的物质的量不变,D错误;
故选C。
5.C
【分析】B电极SO2失电子发生氧化反应生成SO,B是阳极;A电极SO 得电子发生还原反应生成,A是阴极;则a为电源负极、b为电源正极。
【详解】A.a为电源负极、b为电源正极,电子流动方向为a→A、B→b,电子不能通过电解质溶液,故A错误;
B.a为电源负极,发生氧化反应,A极为电解池阴极,发生还原反应,故B错误;
C.阳极的电极反应式为SO2+2H2O-2e-=SO+4H+,阴极的电极反应式为2SO+4H++2e-=S2O+2H2O,离子交换膜应使H+通过,应为阳离子交换膜,故C正确;
D.B极为电解池的阳极,二氧化硫失去电子发生氧化反应生成SO,电极反应式为SO2-2e-+2H2O=SO+4H+,故D错误;
选C。
6.D
【详解】A.纤维素不导电,是C作为锂电池的正极材料,故A错误;
B.充电时,氧元素从Li2O2的-1价升高到0价,根据得失电子守恒有Li~e-~0.5O2,金属锂电极增重7g,标况下,空气电极放出11.2LO2,未指明气体状况,则不能确定其体积,故B错误;
C.充电时,有机电解质溶液中Li 移向金属锂电极发生还原反应,故C错误;
D.放电时,正极氧气得电子结合锂离子生成过氧化锂:,故D正确;
故选D。
7.C
【详解】A.18g中含有的质子数为,故A错误;
B.由题干图示可知,1分子含16个键,故14.2g含键的数目为,B错误;
C.0.1mol锌完全反应生成0.1mol锌离子,转移了0.2mol电子,转移电子数一定为,C正确;
D.电解精炼铜时,阳极上放电的是粗铜中的铜以及比铜活泼的杂质,阳极质量减轻64g时转移电子数无法计算,故D错误;
选C。
8.B
【分析】结合题干描述和电池结构示意图,正极材料为Li1-aMnxFeyPO4/LiMnxFeyPO4,正极的电极反应为Li1-aMnxFeyPO4+aLi++ ae-= LiMnxFeyPO4,负极为LiaCn,电极反应式为:LiaCn-ae-=aLi++Cn;根据放电时的正负极反应可以得出充电时的阴阳极反应。
【详解】A.由化合物中元素化合价代数和为0可得,当x+y=1.2,(1-a)+1.22=3,解得a=0.4,故A正确,不符合题意;
B.充电时,阴极得到电子,电极反应式为:aLi++ae-+Cn= LiaCn,故B错误,符合题意;
C.放电时,负极的电极反应式为LiaCn-ae-=aLi++Cn;因此当外电路转移0.2mole-时,理论上负极减少的质量为0.2mol7g/mol=1.4g,故C正确,不符合题意;
D.根据分析,正极的电极反应为Li1-aMnxFeyPO4+aLi++ ae-= LiMnxFeyPO4,负极电极反应式为:LiaCn-ae-=aLi++Cn;放电时总反应为Li1-aMnxFeyPO4 +aLi = LiMnxFeyPO4,故D正确,不符合题意。
答案选B。
9.D
【详解】A.天然弱碱性水呈碱性是因为水中的弱酸根离子水解,A项错误;
B.水解使溶液显酸性,溶液能与铁锈发生反应,B项错误;
C.电解与水解的原理不同,C项错误;
D.溶于水后电离生成的水解,使溶液显碱性,加入,与结合生成沉淀,使溶液中的浓度逐渐减小,最终溶液的红色褪去,D项正确;
答案选D。
10.D
【分析】由图中电子流向可知,充电时Zn电极为阴极,阴极电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-,阳极反应为4OH--4e-=O2↑+H2O,放电时,锌失电子生成[Zn(OH)4]2-,负极反应为Zn-2e-+4OH-═[Zn(OH)4]2-,催化电极为正极,正极上CO2得电子生成HCOO-,正极反应为CO2+2e-+H2O=HCOO-+OH-,据此分析解答。
【详解】A.由分析可知,充电时,电极作阴极,故A正确;
B.由分析可知,充电时,阳极反应为4OH--4e-=O2↑+H2O,故B正确;
C.放电时,Zn电极为负极,原电池中阴离子向负极移动,则向电极移动,故C正确;
D.由分析可知,放电时,正极的电极反应式为CO2+2e-+H2O=HCOO-+OH-,故D错误;
故选D。
11.D
【分析】由钠离子的移动方向可以确定左边电极为阳极,右边电极为阴极,据此分析解答。
【详解】A.阴极发生还原反应,氢气从E口逸出,故A正确;
B.B口应补充含少量NaOH的水溶液,D口得到氢氧化钠浓溶液,故B正确。
C.电解饱和食盐水的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,当有22.4 L Cl2即1 mol氯气生成时,有2 mol氢氧化钠生成,故C正确;
D.电解过程中减少的是氢气和氯气且二者物质的量之比为1∶1,因此补充适量的氯化氢气体可以使电解液恢复到电解前的浓度,故D错误;
故选:D。
12.C
【详解】A.该装置为电解装置,电能转化为化学能,A错误;
B.电解池中,与电源正极相连的石墨电极为阳极,B错误;
C.电解池中,Na+在阴极上得到电子被还原为钠原子,C正确;
D.电解池中,与电源负极相连的铁电极为阴极,D错误;
故选C。
13.C
【详解】A.碳酸氢钠溶液与过量的氢氧化钡溶液混合反应生成碳酸钡沉淀,离子方程式为:+Ba2++OH-=BaCO3↓+H2O,故A错误;
B.用惰性电极电解CuCl2水溶液,Cl-在阳极放电得到Cl2,Cu2+在阴极得到电子生成Cu,总方程式为:Cu2++2Cl-Cl2↑+Cu,故B错误;
C.在溶液中KIO3与Na2SO3充分反应生成KI,SO被氧化为,根据得失电子守恒和电荷守恒配平离子方程式为:+3= I- +3,故C正确;
D.草酸为弱酸,不能拆分,所以用高锰酸钾标准溶液滴定草酸的离子方程式为:,故D错误;
故选C。
14.B
【详解】A.电解NaCl饱和溶液发生反应,即可制得烧碱和氯气,A正确;
B.铜的活泼性弱于铁,即在海轮外壳上镶入铜块时可构成铜铁海水原电池,铁作负极铜作正极,可加快船体的腐蚀速率,B错误;
C.医用消毒酒精中乙醇的浓度(体积分数)为75%,C正确;
D.明矾溶于水电离出的铝离子水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化,D正确;
故选B。
15.(1) 方法2不会产生污染空气的气体或湿法炼铜不需要外界提供能量等
(2)
(3)16
(4)
(5) 由于溶液中减小,且覆盖铁电极,阻碍与铁接触 阳极产生的与阴极消耗的相等,溶液中铜离子浓度不变,故平衡不移动
【详解】(1)上述两种方法中,方法2比方法1更好,其原因是方法2不会产生污染空气的气体(或湿法炼铜不需要外界提供能量等)上述两种方法冶炼铜中,对应6mol电子转移,对应2mol电子转移;若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为。
(2)采用溶液浸取,生成和等,该反应的化学方程式为:。
(3)将、和组成的混合物加入溶液恰好使混合物完全溶解,同时收集到(标准状况)气体,也即0.1molNO,根据N守恒,所以Cu(NO3)2的物质的量为,此混合物用足量的加热还原生成单质铜,质量为:。
(4)分析此反应,根据盖斯定律可知,此反应的焓变等于碳的燃烧热-CO的燃烧热-×题中氧化亚铜转化为氧化铜的焓变,可得=。
(5)①实验i中气体减少的原因是由于溶液中减小,且生成红色固体Cu覆盖铁电极,阻碍与铁接触。
②实验i中,推测产生,可能发生的反应有铁和硫酸直接接触的氧化反应反应,也可能发生铁和硫酸铜溶液直接接触的氧化还原反应,故还可能发生:。
③分析实验ii电解原理,中阳极产生的与阴极消耗的相等,溶液中铜离子浓度不变,故平衡不移动。
16.(1) 阴 8:1
(2) 增大反应物接触面积,加快反应速率(合理即可) 8.4 > b点以前,反应没有达到平衡状态,温度升高,反应速率加快,相同时间内二氧化碳反应的速率较大,二氧化碳浓度减小(合理即可)
【详解】(1)①根据图示,H2O在X电极获得电子发生还原反应生成氢气,则电极X为阴极。
②X是阴极生成氢气,H2O在阳极生成氧气,M是氧气、N是氢气,电解水的方程式为 ,理论上生成的气体M与N的物质的量比为1:2,质量之比为8:1;
在酸性介质中水生成氧气的的电极反应式为;
(2)①高炉气从“吸收塔”底部通入,溶液从塔顶喷洒,碳酸钾溶液和二氧化碳气体成分接触,这样做的优点是增大反应物接触面积,加快反应速率,提高吸收效率。
②,若从“吸收塔”出来的盐溶液中,=10-16.8,则该溶液的pH=8.4
③温度越低反应速率越慢,温度低于T2时,反应没有达到平衡状态,温度高于T2时,反应达到平衡状态。升高温度二氧化碳的浓度增大,说明平衡逆向移动,正反应放热,化学平衡常数>;温度范围内,容器内气体浓度呈减小的趋势,其原因是b点以前,反应没有达到平衡状态,温度升高,反应速率加快,相同时间内二氧化碳反应的速率较大,二氧化碳浓度减小。
17.(1)负
(2)4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+
(3)B
(4) 负 2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
(5)还原
(6)NO-2e-+O2-=NO2
【分析】C、D和电解池中都充满浓KOH溶液,实际是电解水,由C、D中产生的气体体积可知,C中气体为H2,D中气体为O2,则M为阴极,N为阳极,R为电源负极,S为电源正极,B为阳极,A为阴极。
【详解】(1)由分析可知,R为负极;
(2)由分析可知,B为阳极,则电极反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;
(3)B为阳极,阴离子()向阳极移动,则滤纸上的紫色点向B方向移动;
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,此时装置变为燃料电池,经过一段时间,C、D中的气体逐渐减少,H2和O2反应生成水,在碱性条件下,C中H2发生氧化反应,C电极为负极,电极反应式为2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O;
(5)根据图中信息NO化合价升高变为NO2,则NiO电极为负极,Pt为正极,Pt电极上发生的是还原反应;
(6)NiO电极为负极,其电极反应式:。
18.(1) ,由于富集有效成分减少,这一副反应会使得再生后的HMO的锂富集性能降低
(2) 通电过程中转移电子数为:
参与反应的MnO2的物质的量为:
因此由可得,x=0.61 阴极:;阳极:
【解析】略
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023下·全国·高三专题练习)用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2OCu2O+H2↑,装置如图,下列说法中正确的是
A.电解时Cl-通过交换膜向Cu极移动
B.阳极发生的反应为2Cu-2e-+2OH-=Cu2O+H2O
C.阴极OH-放电,有O2生成
D.Ti电极和Cu电极生成物物质的量之比为2∶1
2.(2023上·河南南阳·高三统考期末)近年来,国家相继出台一系列政策,扶持光伏发电项目建设。如图1是太阳能电池工作示意图,与图2装置联合可实现能量的转化和储存,下列说法错误的是
A.Y电极接太阳能电池的P电极
B.工作一段时间后,图2左池pH增大
C.每转移1mol电子,图2右池溶液中n(H+)的变化量为1mol
D.图2总反应为:VO2++V3++H2OV2++VO+2H+
3.(2023上·全国·高三专题练习)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂,装置图如下。下列说法不正确的是
A.是原电池
B.池能够生产
C.电路中电子流向为,形成闭合回路
D.、中均从左边迁移到右边
4.(2023·河北保定·定州一中校考模拟预测)双极膜是由阳离子交换膜和阴离子交换膜复合而成的,其内层为水层,装置工作时水层中的H2O解离成H+和OH-,分别向两侧发生迁移。CO2电化学还原法制备甲醇的电解原理如图所示。该装置工作时,下列说法正确的是
A.催化电极上发生氧化反应
B.石墨电极区溶液pH不变
C.H+穿过b膜进入右室溶液
D.电解一段时间后,右室HCO的物质的量减少
5.(2023上·高三课时练习)SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
A.电子流动方向为a→A→B→b
B.a、A极上均发生氧化反应
C.离子交换膜为阳离子交换膜
D.B极上的电极反应式为SO2+2e-+2H2O=SO+4H+
6.(2023上·四川成都·高三成都七中校考阶段练习)我国科学家用毛笔书写后的纸张(含石墨)作空气电极,设计并组装了可折叠的可充电锂—空气电池,工作原理如图所示。下列有关说法正确的是
A.放电时,纸张中的纤维素作为锂电池的正极材料
B.充电时,金属锂电极增重7g,空气电极放出
C.充电时,有机电解质溶液中Li 移向金属锂电极发生氧化反应
D.放电时,正极的电极反应式为:
7.(2023上·湖南长沙·高三雅礼中学校考阶段练习)为阿伏加德罗常数的值,下列有关说法正确的是
A.18g中含有的质子数为
B.14.2g含σ键的数目为
C.6.5gZn与一定量浓硫酸反应完全溶解,转移的电子数为
D.用电解法精炼铜时,若阳极质量减轻64g,则电路中转移电子数一定为
8.(2023上·四川遂宁·高三射洪中学校考阶段练习)最近《化学学报》报道了用聚环氧乙烷电解质基的高压固态锂离子电池,锂离子在该电解质基中有较好的传递效率,同时具有较好的安全性,正极材料为Li1-aMnxFeyPO4/LiMnxFeyPO4,Li1-aMnxFeyPO4中Mn,Fe元素均为+2价,电池结构示意图如下。下列说法错误的是
A.正极材料Li1-aMnxFeyPO4中,若x+y=1.2,则α=0.4
B.充电时,阴极反应为:Li1-aMnxFeyPO4 +aLi+ + ae-= LiMnxFeyPO4
C.放电时,当外电路转移0.2 mol电子,理论上负极质量减少1.4 g
D.放电时总反应: Li1-aMnxFeyPO4 +aLi = LiMnxFeyPO4
9.(2023上·高三课时练习)生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类的水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入CaCl2溶液,溶液的红色逐渐褪去
10.(2023上·陕西汉中·高三统考阶段练习)一种电化学催化制甲酸盐的装置如图。下列说法错误的是
A.充电时,电极作阴极
B.充电时,阳极放出氧气
C.放电时,向电极移动
D.放电时,正极的电极反应式为
11.(2023上·高三课时练习)如图为阳离子交换膜法电解饱和食盐水的原理示意图(所用电极均为惰性电极)。下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以使电解液恢复到电解前的浓度
12.(2023上·高三课时练习)如图是电解熔融NaCl制备金属钠的装置示意图,下列有关判断正确的是
A.通过该装置可以将化学能转变为电能
B.石墨电极为正极
C.Na+在铁极上得到电子被还原为钠原子
D.铁电极为阳极
13.(2022上·辽宁大连·高三大连八中校考期中)下列反应的离子方程式正确的是
A.碳酸氢钠溶液与过量的氢氧化钡溶液混合:2+Ba2++2OH-=BaCO3↓+ +2H2O
B.用惰性电极电解CuCl2水溶液:
C.在溶液中KIO3与Na2SO3充分反应生成KI:+3= I- +3
D.用高锰酸钾标准溶液滴定草酸:
14.(2023下·江苏盐城·高三盐城市伍佑中学校联考阶段练习)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.电解NaCl饱和溶液,可制得烧碱和氯气
B.在海轮外壳上镶入铜块,可减缓船体的腐蚀速率
C.医用消毒酒精中乙醇的浓度(体积分数)为75%
D.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
二、非选择题
15.(2024上·湖北·高三校联考阶段练习)铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:;
方法2:湿法炼铜:。
上述两种方法中,方法2比方法1更好,其原因是 (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为 。
(2)黄铜矿的含铜成分为,常采用溶液浸取,生成和等,该反应的化学方程式为 。
(3)将、和组成的混合物加入溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)气体。若将此混合物用足量的加热还原,所得固体的质量为 g。
(4)和的燃烧热分别为、,已知 ;则的 。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
实验序号 装置示意图 实验现象
1 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
2 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
①实验ⅰ中气体减少的原因是 。
②实验ⅰ中,推测产生,可能发生的反应有、 。
③随着阴极析出,实验ⅱ中平衡不移动,理由是 。
16.(2023上·河南周口·高三项城市第一高级中学校联考阶段练习)绿色甲醇是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、的捕集、和一步法制甲醇。
(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”(,具有强氧化性),驱动并加快电极反应]。
①电极X为 (填“阴”或“阳”)极。
②理论上生成的气体M与N的质量之比为 。
③在酸性介质中生成M的电极反应式为 。
(2)工业上从高炉气中捕集的示意图如图所示。
①高炉气从“吸收塔”底部通入,溶液从塔顶喷洒,这样做的优点是 。
②若从“吸收塔”出来的盐溶液中,则该溶液的pH为
[该条件下、,不考虑其他因素对pH的影响]。
③为研究温度对的影响,将一定量的溶液置于密闭容器中,并充入一定量的气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得气体的浓度如图所示:
化学平衡常数 (填“>”“<”或“=”);温度范围内,容器内气体浓度呈减小的趋势,其原因是 。
17.(2023上·福建龙岩·高三福建省连城县第一中学校考阶段练习)Ⅰ.如图所示,E为浸过含酚酞的Na2SO4溶液的滤纸。A、B分别为铂片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极,在碱溶液中可视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央滴一滴紫色的KMnO4溶液,将开关K打开,接通电源一段时间后,C、D中有气体产生。
请回答下列问题:
(1)R为 (填“正”或“负”)极。
(2)通电后,B附近发生的电极反应式为 。
(3)滤纸上的紫色点向 (填“A”或“B”)方向移动。
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间后,C、D中的气体逐渐减少,C中的电极为 (填“正”或“负”)极,电极反应式为 。
Ⅱ.通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
(5)Pt电极上发生的是 反应(填“氧化”或“还原”)。
(6)写出NiO电极的电极反应式: 。
18.(2023·全国·高三竞赛)海水中锂的提取
随着锂电池的广泛应用,锂已成为重要的战略资源,被称为白色石油。据估计,海水中锂的总含量为陆地锂总含量的5000倍以上,但海水中锂的质量浓度仅为0.1-0.2ppm,从海水提取锂首先需要对低浓度的Li+进行选择性富集。Li+能够嵌入某些氧化物并在一定条件下脱出,据此可以进行Li+的富集。
(1)以Li2CO3和MnO2为原料,充分混合后在720°C下煅烧3h,冷至室温后即可得到复合氧化物LiMn2O4(LMO)。用1molL-1的HCl在60°C处理LMO,将其中所有Li+置换后得到HMO,HMO可以和Li+反应再生成LMO,然后LMO与酸作用脱出Li+从而实现Li+富集。如此,可以循环处理。
①写出合成LiMn2O4的方程式 。
②用酸处理LMO时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中Mn的平均氧化态有所升高,写出副反应对应的化学方程式。这一副反应对再生后的HMO的锂富集性能有何影响 ?
(2)利用电化学富集锂也是有效的方法之一、某电化学系统如图所示,其包含两个电池单元,中间区域置有具有一维孔道结构的λ-MnO2,该孔道可以容纳合适的阳离子进出。MnO2电极通过阳离子交换膜与两个电化学池中的对电极隔开,腔室1和2中的电解质分别为0.5M的Na2SO4.和0.1M的LiOH.该电化学系统的工作步骤如下:
i.向MnO2所在腔室通入海水,启动电源1,使海水中的Li+进入MnO2结构而形成LixMn2O4;
ii.关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使LixMn2O4中的Li+脱出进入腔室2。
①为衡量MnO2对Li+的富集效果,将0.50M的LiC1溶液通入MnO2(4.8mg)所在腔室,启动电源1,使电流恒定在5.0mA,累计工作325s后发现MnO2的电极电势快速下降,计算所得LixMn2O4中的x 。
②写出上述过程中发生腔室2中阴极和阳极上的电极反应 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】根据装置图和电解总反应分析,Cu极为阳极,Cu极电极反应式为2Cu-2e-+2OH-=Cu2O+H2O; Ti极为阴极,Ti极电极反应式为2H2O+2e-= H2↑+2OH-;电解池中阴离子通过阴离子交换膜向阳极移动,据此分析作答。
【详解】A.由图可知,Ti极与负极相连为阴极,Cu极与正极相连为阳极,电解时阴离子向阳极移动,OH-通过阴离子交换膜向Cu极移动,故A错误;
B.由总方程式可知,Cu在阳极失去电子生成Cu2O,根据得失电子守恒和电荷守恒配平电极方程式为:2Cu-2e-+2OH-=Cu2O+H2O,故B正确;
C.钛极与电源负极相连是阴极发生H+得电子的还原反应,有H2生成,故C错误;
D.由图可知,Ti极与负极相连为阴极,电极方程式为:2H2O+2e-= H2↑+2OH-,Cu极与正极相连为阳极,电极方程式为:2Cu-2e-+2OH-=Cu2O+H2O,当转移相同物质的量电子时,Ti极生成的H2和Cu极生成的Cu2O物质的量之比为1:1,故D错误;
故选B。
2.B
【分析】由图1可知,太阳能电池中带正电粒子向P电极移动,则P电极为正极,N电极为负极;图2中,VO2+在Y电极生成VO,V元素价态由+4价升高为+5价,发生失电子的反应、作阳极,则Y极接太阳能电池的P电极,阳极反应式为VO2+﹣e﹣+H2O= VO+2H+,X为阴极,电极反应为V3++e﹣=V2+,右池中氢离子通过质子交换膜进入左池。
【详解】A.光伏电池中P电极为正极,由图2可知VO2+在Y电极生成VO,发生失电子的反应,与正极P相接,A正确;
B.图2为电解池,X为阴极,阳极反应式为VO2+﹣e﹣+H2O= VO+2H+,左池pH减小,B错误;
C.阳极电极反应式为VO2+﹣e﹣+H2O= VO+2H+,每转移1mol电子,右池中产生2molH+,但右池中有1molH+通过质子交换膜进入左池,右池溶液中H+增加2mol﹣1mol=1mol,C正确;
D.图2为电解池,阳极电极反应式为VO2+﹣e﹣+H2O= VO+2H+,阴极反应为V3++e﹣=V2+,则二式相加即得选项中的总反应,D正确。
故选B。
3.C
【分析】X装置有能自发进行的氧化还原反应,为原电池装置,二氧化硫在a极发生失电子的氧化反应,则a为负极,氧气在b极发生得电子的还原反应,则b为正极;Y装置与原电池装置相连,为电解池,c极连接原电池正极,为阳极,d极连接原电池负极,为阴极;
【详解】A.X装置有能自发进行的氧化还原反应,为原电池装置,故A正确;
B.结合Y装置可知,在c极失电子转化为,故B正确;
C.电子只能沿着导线移动,所以电路种电子流向:、,故C错误;
D.在X原电池装置中,向正极移动,在Y装置中,向阴极移动,都是从左到右的方向,故D正确;
答案选C。
4.C
【详解】A.催化电极上CO2转化为甲醇,碳元素化合价降低,发生还原反应,A错误;
B.石墨电极上电极反应式为,水层中的H2O解离成H+和OH-,OH-通过a膜向阳极(石墨电极)移动,石墨电极消耗的OH-与迁移过来的OH-数目相等,石墨电极区溶液中OH-物质的量不变,但电解过程中石墨电极区生成了水,溶液的pH减小,B错误;
C.水电离的H+通过b膜向阴极移动,进入右室溶液,C正确;
D.催化电极上的电极反应式为,通过b膜迁移过来的H+与反应生成,故的物质的量不变,D错误;
故选C。
5.C
【分析】B电极SO2失电子发生氧化反应生成SO,B是阳极;A电极SO 得电子发生还原反应生成,A是阴极;则a为电源负极、b为电源正极。
【详解】A.a为电源负极、b为电源正极,电子流动方向为a→A、B→b,电子不能通过电解质溶液,故A错误;
B.a为电源负极,发生氧化反应,A极为电解池阴极,发生还原反应,故B错误;
C.阳极的电极反应式为SO2+2H2O-2e-=SO+4H+,阴极的电极反应式为2SO+4H++2e-=S2O+2H2O,离子交换膜应使H+通过,应为阳离子交换膜,故C正确;
D.B极为电解池的阳极,二氧化硫失去电子发生氧化反应生成SO,电极反应式为SO2-2e-+2H2O=SO+4H+,故D错误;
选C。
6.D
【详解】A.纤维素不导电,是C作为锂电池的正极材料,故A错误;
B.充电时,氧元素从Li2O2的-1价升高到0价,根据得失电子守恒有Li~e-~0.5O2,金属锂电极增重7g,标况下,空气电极放出11.2LO2,未指明气体状况,则不能确定其体积,故B错误;
C.充电时,有机电解质溶液中Li 移向金属锂电极发生还原反应,故C错误;
D.放电时,正极氧气得电子结合锂离子生成过氧化锂:,故D正确;
故选D。
7.C
【详解】A.18g中含有的质子数为,故A错误;
B.由题干图示可知,1分子含16个键,故14.2g含键的数目为,B错误;
C.0.1mol锌完全反应生成0.1mol锌离子,转移了0.2mol电子,转移电子数一定为,C正确;
D.电解精炼铜时,阳极上放电的是粗铜中的铜以及比铜活泼的杂质,阳极质量减轻64g时转移电子数无法计算,故D错误;
选C。
8.B
【分析】结合题干描述和电池结构示意图,正极材料为Li1-aMnxFeyPO4/LiMnxFeyPO4,正极的电极反应为Li1-aMnxFeyPO4+aLi++ ae-= LiMnxFeyPO4,负极为LiaCn,电极反应式为:LiaCn-ae-=aLi++Cn;根据放电时的正负极反应可以得出充电时的阴阳极反应。
【详解】A.由化合物中元素化合价代数和为0可得,当x+y=1.2,(1-a)+1.22=3,解得a=0.4,故A正确,不符合题意;
B.充电时,阴极得到电子,电极反应式为:aLi++ae-+Cn= LiaCn,故B错误,符合题意;
C.放电时,负极的电极反应式为LiaCn-ae-=aLi++Cn;因此当外电路转移0.2mole-时,理论上负极减少的质量为0.2mol7g/mol=1.4g,故C正确,不符合题意;
D.根据分析,正极的电极反应为Li1-aMnxFeyPO4+aLi++ ae-= LiMnxFeyPO4,负极电极反应式为:LiaCn-ae-=aLi++Cn;放电时总反应为Li1-aMnxFeyPO4 +aLi = LiMnxFeyPO4,故D正确,不符合题意。
答案选B。
9.D
【详解】A.天然弱碱性水呈碱性是因为水中的弱酸根离子水解,A项错误;
B.水解使溶液显酸性,溶液能与铁锈发生反应,B项错误;
C.电解与水解的原理不同,C项错误;
D.溶于水后电离生成的水解,使溶液显碱性,加入,与结合生成沉淀,使溶液中的浓度逐渐减小,最终溶液的红色褪去,D项正确;
答案选D。
10.D
【分析】由图中电子流向可知,充电时Zn电极为阴极,阴极电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-,阳极反应为4OH--4e-=O2↑+H2O,放电时,锌失电子生成[Zn(OH)4]2-,负极反应为Zn-2e-+4OH-═[Zn(OH)4]2-,催化电极为正极,正极上CO2得电子生成HCOO-,正极反应为CO2+2e-+H2O=HCOO-+OH-,据此分析解答。
【详解】A.由分析可知,充电时,电极作阴极,故A正确;
B.由分析可知,充电时,阳极反应为4OH--4e-=O2↑+H2O,故B正确;
C.放电时,Zn电极为负极,原电池中阴离子向负极移动,则向电极移动,故C正确;
D.由分析可知,放电时,正极的电极反应式为CO2+2e-+H2O=HCOO-+OH-,故D错误;
故选D。
11.D
【分析】由钠离子的移动方向可以确定左边电极为阳极,右边电极为阴极,据此分析解答。
【详解】A.阴极发生还原反应,氢气从E口逸出,故A正确;
B.B口应补充含少量NaOH的水溶液,D口得到氢氧化钠浓溶液,故B正确。
C.电解饱和食盐水的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,当有22.4 L Cl2即1 mol氯气生成时,有2 mol氢氧化钠生成,故C正确;
D.电解过程中减少的是氢气和氯气且二者物质的量之比为1∶1,因此补充适量的氯化氢气体可以使电解液恢复到电解前的浓度,故D错误;
故选:D。
12.C
【详解】A.该装置为电解装置,电能转化为化学能,A错误;
B.电解池中,与电源正极相连的石墨电极为阳极,B错误;
C.电解池中,Na+在阴极上得到电子被还原为钠原子,C正确;
D.电解池中,与电源负极相连的铁电极为阴极,D错误;
故选C。
13.C
【详解】A.碳酸氢钠溶液与过量的氢氧化钡溶液混合反应生成碳酸钡沉淀,离子方程式为:+Ba2++OH-=BaCO3↓+H2O,故A错误;
B.用惰性电极电解CuCl2水溶液,Cl-在阳极放电得到Cl2,Cu2+在阴极得到电子生成Cu,总方程式为:Cu2++2Cl-Cl2↑+Cu,故B错误;
C.在溶液中KIO3与Na2SO3充分反应生成KI,SO被氧化为,根据得失电子守恒和电荷守恒配平离子方程式为:+3= I- +3,故C正确;
D.草酸为弱酸,不能拆分,所以用高锰酸钾标准溶液滴定草酸的离子方程式为:,故D错误;
故选C。
14.B
【详解】A.电解NaCl饱和溶液发生反应,即可制得烧碱和氯气,A正确;
B.铜的活泼性弱于铁,即在海轮外壳上镶入铜块时可构成铜铁海水原电池,铁作负极铜作正极,可加快船体的腐蚀速率,B错误;
C.医用消毒酒精中乙醇的浓度(体积分数)为75%,C正确;
D.明矾溶于水电离出的铝离子水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化,D正确;
故选B。
15.(1) 方法2不会产生污染空气的气体或湿法炼铜不需要外界提供能量等
(2)
(3)16
(4)
(5) 由于溶液中减小,且覆盖铁电极,阻碍与铁接触 阳极产生的与阴极消耗的相等,溶液中铜离子浓度不变,故平衡不移动
【详解】(1)上述两种方法中,方法2比方法1更好,其原因是方法2不会产生污染空气的气体(或湿法炼铜不需要外界提供能量等)上述两种方法冶炼铜中,对应6mol电子转移,对应2mol电子转移;若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为。
(2)采用溶液浸取,生成和等,该反应的化学方程式为:。
(3)将、和组成的混合物加入溶液恰好使混合物完全溶解,同时收集到(标准状况)气体,也即0.1molNO,根据N守恒,所以Cu(NO3)2的物质的量为,此混合物用足量的加热还原生成单质铜,质量为:。
(4)分析此反应,根据盖斯定律可知,此反应的焓变等于碳的燃烧热-CO的燃烧热-×题中氧化亚铜转化为氧化铜的焓变,可得=。
(5)①实验i中气体减少的原因是由于溶液中减小,且生成红色固体Cu覆盖铁电极,阻碍与铁接触。
②实验i中,推测产生,可能发生的反应有铁和硫酸直接接触的氧化反应反应,也可能发生铁和硫酸铜溶液直接接触的氧化还原反应,故还可能发生:。
③分析实验ii电解原理,中阳极产生的与阴极消耗的相等,溶液中铜离子浓度不变,故平衡不移动。
16.(1) 阴 8:1
(2) 增大反应物接触面积,加快反应速率(合理即可) 8.4 > b点以前,反应没有达到平衡状态,温度升高,反应速率加快,相同时间内二氧化碳反应的速率较大,二氧化碳浓度减小(合理即可)
【详解】(1)①根据图示,H2O在X电极获得电子发生还原反应生成氢气,则电极X为阴极。
②X是阴极生成氢气,H2O在阳极生成氧气,M是氧气、N是氢气,电解水的方程式为 ,理论上生成的气体M与N的物质的量比为1:2,质量之比为8:1;
在酸性介质中水生成氧气的的电极反应式为;
(2)①高炉气从“吸收塔”底部通入,溶液从塔顶喷洒,碳酸钾溶液和二氧化碳气体成分接触,这样做的优点是增大反应物接触面积,加快反应速率,提高吸收效率。
②,若从“吸收塔”出来的盐溶液中,=10-16.8,则该溶液的pH=8.4
③温度越低反应速率越慢,温度低于T2时,反应没有达到平衡状态,温度高于T2时,反应达到平衡状态。升高温度二氧化碳的浓度增大,说明平衡逆向移动,正反应放热,化学平衡常数>;温度范围内,容器内气体浓度呈减小的趋势,其原因是b点以前,反应没有达到平衡状态,温度升高,反应速率加快,相同时间内二氧化碳反应的速率较大,二氧化碳浓度减小。
17.(1)负
(2)4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+
(3)B
(4) 负 2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
(5)还原
(6)NO-2e-+O2-=NO2
【分析】C、D和电解池中都充满浓KOH溶液,实际是电解水,由C、D中产生的气体体积可知,C中气体为H2,D中气体为O2,则M为阴极,N为阳极,R为电源负极,S为电源正极,B为阳极,A为阴极。
【详解】(1)由分析可知,R为负极;
(2)由分析可知,B为阳极,则电极反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;
(3)B为阳极,阴离子()向阳极移动,则滤纸上的紫色点向B方向移动;
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,此时装置变为燃料电池,经过一段时间,C、D中的气体逐渐减少,H2和O2反应生成水,在碱性条件下,C中H2发生氧化反应,C电极为负极,电极反应式为2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O;
(5)根据图中信息NO化合价升高变为NO2,则NiO电极为负极,Pt为正极,Pt电极上发生的是还原反应;
(6)NiO电极为负极,其电极反应式:。
18.(1) ,由于富集有效成分减少,这一副反应会使得再生后的HMO的锂富集性能降低
(2) 通电过程中转移电子数为:
参与反应的MnO2的物质的量为:
因此由可得,x=0.61 阴极:;阳极:
【解析】略
答案第1页,共2页
答案第1页,共2页
同课章节目录
