辽宁省锦州市2023-2024学年高三上学期1月期末考试化学试题(无答案)
文档属性
| 名称 | 辽宁省锦州市2023-2024学年高三上学期1月期末考试化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 00:15:38 | ||
图片预览


文档简介
锦州市2023~2024学年度第一学期期末考试
高三化学
考生注意:
1.本试卷考试时间为75分钟,满分100分。
2.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.答选择题时,选出每小题答案后,用2B铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号;答非选择题时,将答案写在答题卡上相应区域内,超出答题区域或写在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
1.古代文献记载很多与化学相关的内容。下列解释错误的是( )
A.“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”,“气”指乙烯
B.“盖此矾色绿,味酸,烧之则赤……”,绿矾在溶液中能电离出,所以“味酸”
C.“以火烧之,紫青烟起,乃真硝石也”,利用焰色试验鉴别钾盐
D.“用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”,涉及蒸馏操作
2.下列化学应用中不涉及氧化还原反应的是( )
A.“84消毒液”用于环境消毒 B.用作呼吸面具中的供氧剂
C.溶液用作印刷电路板的“腐蚀液” D.工业上用油脂生产肥皂
3.制备的离子方程式为:。下列说法正确的是( )
A.HCN中键与键的数目之比为1:1
B.的空间结构模型为
C.基态价层电子的轨道表示式为
D.的结构式为
4.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,将通入水中,、、HClO的数目之和为
B.100g46%的水溶液中含有O原子的数目为
C.已知核反应:,则中含有中子的数目为
D.晶体中,离子总数为
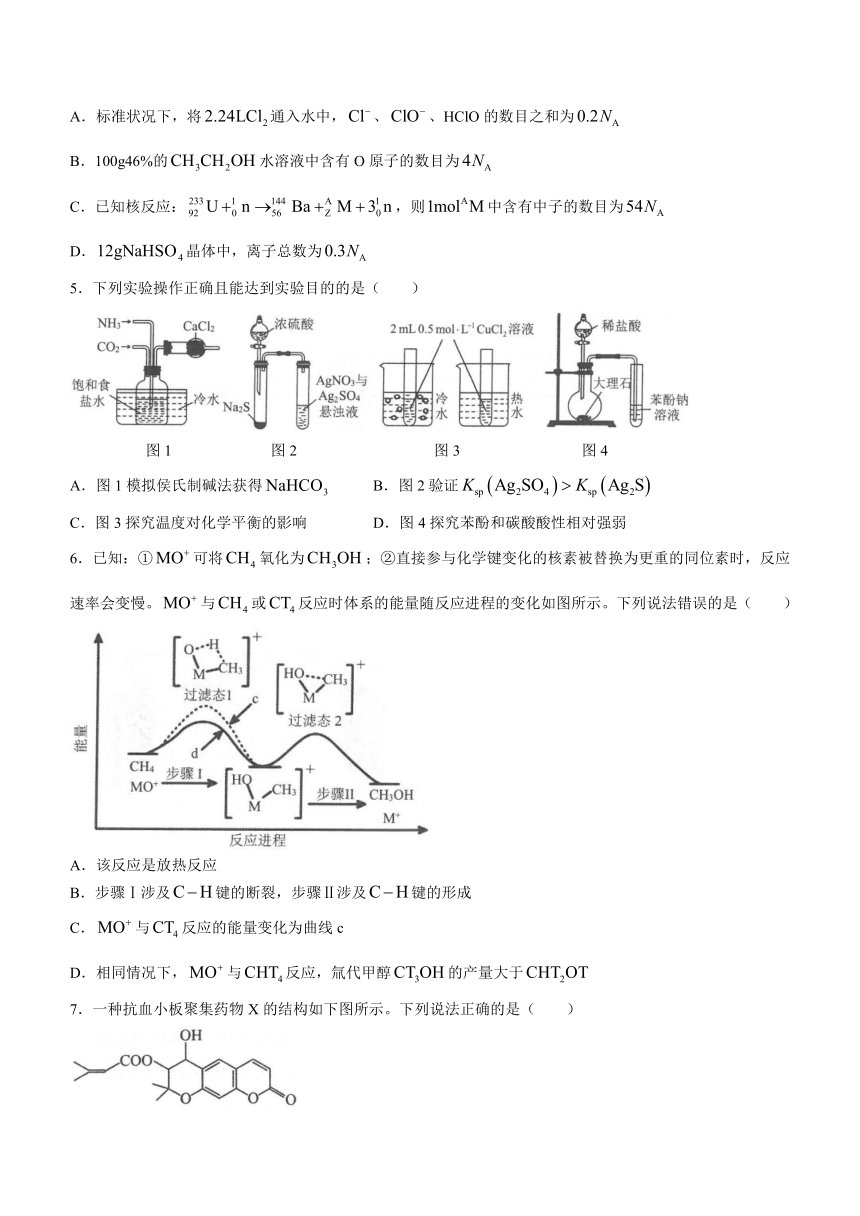
5.下列实验操作正确且能达到实验目的的是( )
图1 图2 图3 图4
A.图1模拟侯氏制碱法获得 B.图2验证
C.图3探究温度对化学平衡的影响 D.图4探究苯酚和碳酸酸性相对强弱
6.已知:①可将氧化为;②直接参与化学键变化的核素被替换为更重的同位素时,反应速率会变慢。与或反应时体系的能量随反应进程的变化如图所示。下列说法错误的是( )
A.该反应是放热反应
B.步骤Ⅰ涉及键的断裂,步骤Ⅱ涉及键的形成
C.与反应的能量变化为曲线c
D.相同情况下,与反应,氚代甲醇的产量大于
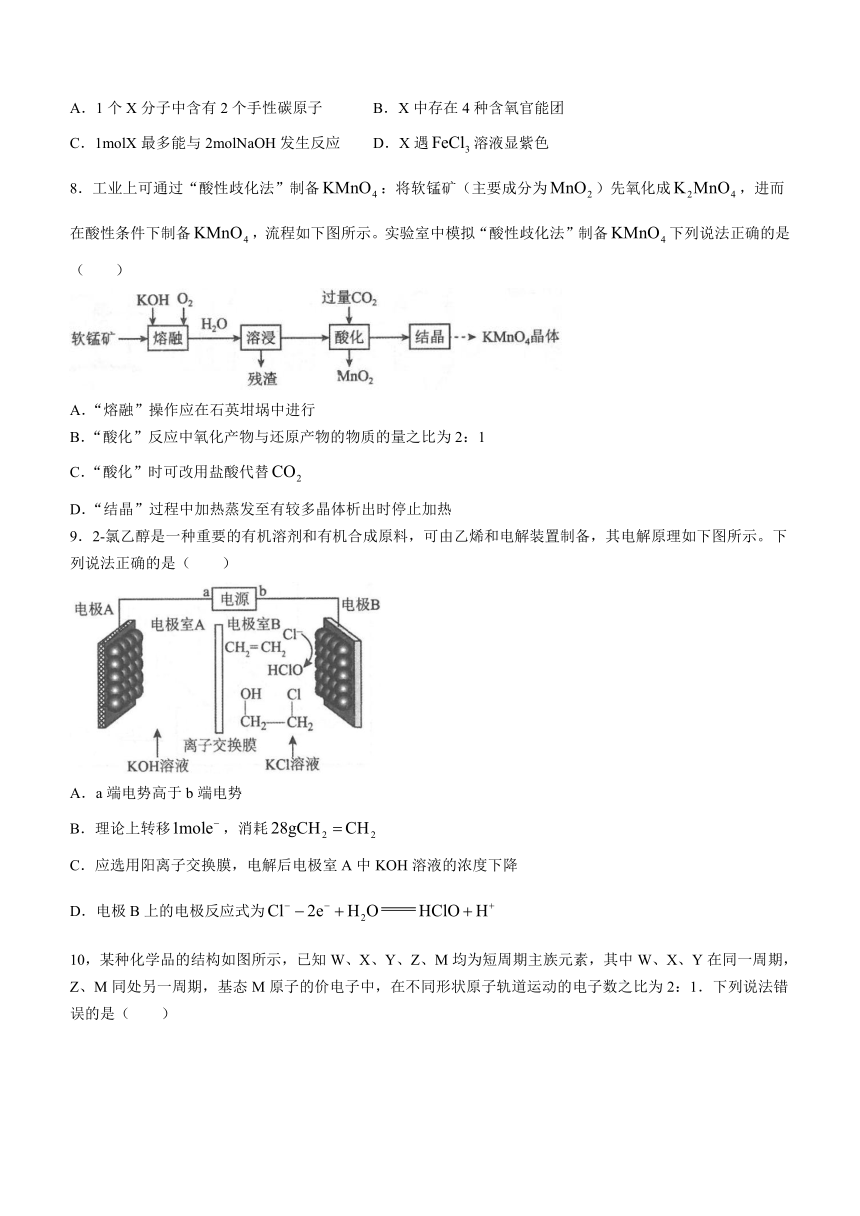
7.一种抗血小板聚集药物X的结构如下图所示。下列说法正确的是( )
A.1个X分子中含有2个手性碳原子 B.X中存在4种含氧官能团
C.1molX最多能与2molNaOH发生反应 D.X遇溶液显紫色
8.工业上可通过“酸性歧化法”制备:将软锰矿(主要成分为)先氧化成,进而在酸性条件下制备,流程如下图所示。实验室中模拟“酸性歧化法”制备下列说法正确的是( )
A.“熔融”操作应在石英坩埚中进行
B.“酸化”反应中氧化产物与还原产物的物质的量之比为2:1
C.“酸化”时可改用盐酸代替
D.“结晶”过程中加热蒸发至有较多晶体析出时停止加热
9.2-氯乙醇是一种重要的有机溶剂和有机合成原料,可由乙烯和电解装置制备,其电解原理如下图所示。下列说法正确的是( )
A.a端电势高于b端电势
B.理论上转移,消耗
C.应选用阳离子交换膜,电解后电极室A中KOH溶液的浓度下降
D.电极B上的电极反应式为
10,某种化学品的结构如图所示,已知W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,基态M原子的价电子中,在不同形状原子轨道运动的电子数之比为2:1.下列说法错误的是( )
A.同一周期中,第一电离能处在Z和M之间的元素有1种
B.简单离子半径:Z>X>M
C.简单气态氢化物稳定性:X>W>Z
D.Y与W可以形成只含极性键的非极性分子
11.由下列实验操作及现象得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 将少量固体溶于稀,滴加KSCN溶液 溶液变红 固体已氧化变质
B 溴乙烷加入NaOH的乙醇溶液,加热,将产生的气体通入酸性溶液中 酸性溶液褪色 溴乙烷发生了消去反应
C 向溶液中逐滴滴加氨水至过量,并边加边振荡 先生成蓝色沉淀,后又溶解得到深蓝色溶液 与的配位能力:强于
D 向含有酚酞的溶液中加入少量固体 出现白色沉淀且溶液红色变浅 溶液中存在水解平衡
12.一种由Mn、Se组成的化合物立方晶胞结构如图所示。已知化合物的摩尔质量为,晶胞参数为anm,阿伏加德罗常数的值为。下列说法错误的是( )
A.该化合物的化学式可表示为MnSe B.与Se原子距离最近的Se原子有12个
C.Mn、Se原子的最近距离是 D.晶胞密度为
13.工业上生产CO的反应原理为 。一定条件下,将足量焦炭和一定量放入体积为2L的恒容密闭容器中发生反应,和CO的物质的量n随时间t的变化关系如图。下列说法正确的是( )
A.0~2min,;2~3min,
B.当容器内的气体密度()不变时,反应一定达到平衡状态,且
C.3min时温度由升高到,则,平衡常数
D.5min时再充入一定量的CO,a、d曲线分别表示、的变化
14.盐酸羟胺()是一种常见的还原剂和显像剂,其化学性质类似。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是( )
图1 图2
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.图2中,X为和,Y为
C.电池工作一段时间后,正极区溶液的pH减小
D.理论上,当有标准状况下参与反应时,左室溶液质量增加3.3g
15.已知: , 。
、、的分布分数与关系如图所示,浓度单位为mol/L。
{例如:分布分数},下列说法正确的是( )
A.曲线c代表的分布分数
B.平衡常数
C.
D.当时,
二、非选择题:本题共4小题,共55分。
16,(14分)五氧化二钒()和三氧化钼()是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为、、,还有少量的、、有机物)
来制备这两种氧化物的工艺流程图如下:
回答下列问题:
(1)基态钒原子的价层电子排布式为__________。
(2)“焙烧”的目的是__________。
(3)滤渣的主要成分是__________(填化学式)。
(4)向滤液①中加的作用是__________。
(5)常温下,当滤液①调pH=8时,铝元素是否沉淀完全__________(填“是”或“否”);写出计算过程__________。[已知: ;离子浓度小于认为沉淀完全]
(6)在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是__________;沉淀分解生成的化学方程式为__________。
17,(13分)环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少大气污染有重要意义。
回答下列问题:
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用还原NO的反应原理为: 。该反应的能量变化过程如图:
(1)__________(用图中字母a、b、c、d表示)。该反应在__________(填“高温”、“低温”或“任意温度”)条件下有利于自发进行。
II.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成,可有效降低汽车尾气污染。
已知反应: 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
(2)据图分析可知,__________(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是__________(填标号)。
a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的__________点方向移动。
(4)E点的压强平衡常数__________(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①250℃脱氮率较好的催化剂是__________(填“Cat-1”或“Cat-2”).
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是__________。
18.(14分)硫脲[]可用于制造药物,也可用作橡胶的硫化促进剂以及金属矿物的浮选剂。硫脲是一种白色晶体,熔点180℃,易溶于水和乙醇,高温时部分发生异构化反应而生成硫氰化铵。化学小组在实验室制备硫脲并对其在产品中的含量进行测定,相关实验如下。
回答下列问题:
Ⅰ.硫脲的制备
已知:将氰氨化钙()和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示(加热装置已省略)。
(1)M的名称为__________。
(2)装置B中的试剂X和试剂Y的最佳组合是__________(填序号)。
A.FeS固体和浓硫酸 B.FeS固体和稀硝酸 C.FeS固体和稀盐酸
(3)按气流从左到右的方向,装置的合理连接顺序为c→__________(填仪器接口的小写字母)。
(4)装置A中饱和NaHS溶液的作用是__________。
(5)装置C中反应温度控制在80℃,温度不宜过高也不宜过低的原因是__________,装置C中反应的化学方程式为__________。
Ⅱ.硫脲的分离及产品含量的测定
(6)装置C反应后的液体过滤后,将滤液减压蒸发浓缩,之后冷却结晶,离心分离,烘干即可得到产品。称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用标准溶液滴定,滴定至终点时消耗标准溶液VmL。
①硫脲[]易溶于水,除硫脲和水都是极性分子外,其原因还有__________。
②滴定时,硫脲转化为、、,则__________。
③样品中硫脲的质量分数为__________%(用含“m、c、V”的式子表示)。
19.(14分)3-氯靛红酸酐()是重要的材料中间体,其制备流程图如下:
已知:
回答下列问题:
(1)3-氯靛红酸酐中碳原子的杂化方式为。
(2)B的名称为__________,写出符合下列两个条件的B的所有同分异构体的结构简式(不考虑立体异构)。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备有机物B,而是经由①、②、③三步反应进行制取,其目的是__________。
(4)⑥的反应类型为__________。
(5)⑧的反应试剂为__________(写化学式)。
(6)以有机物C为原料,在一定条件下制备含酰胺基聚合物的化学方程式为__________。
高三化学
考生注意:
1.本试卷考试时间为75分钟,满分100分。
2.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.答选择题时,选出每小题答案后,用2B铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号;答非选择题时,将答案写在答题卡上相应区域内,超出答题区域或写在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
1.古代文献记载很多与化学相关的内容。下列解释错误的是( )
A.“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”,“气”指乙烯
B.“盖此矾色绿,味酸,烧之则赤……”,绿矾在溶液中能电离出,所以“味酸”
C.“以火烧之,紫青烟起,乃真硝石也”,利用焰色试验鉴别钾盐
D.“用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”,涉及蒸馏操作
2.下列化学应用中不涉及氧化还原反应的是( )
A.“84消毒液”用于环境消毒 B.用作呼吸面具中的供氧剂
C.溶液用作印刷电路板的“腐蚀液” D.工业上用油脂生产肥皂
3.制备的离子方程式为:。下列说法正确的是( )
A.HCN中键与键的数目之比为1:1
B.的空间结构模型为
C.基态价层电子的轨道表示式为
D.的结构式为
4.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,将通入水中,、、HClO的数目之和为
B.100g46%的水溶液中含有O原子的数目为
C.已知核反应:,则中含有中子的数目为
D.晶体中,离子总数为
5.下列实验操作正确且能达到实验目的的是( )
图1 图2 图3 图4
A.图1模拟侯氏制碱法获得 B.图2验证
C.图3探究温度对化学平衡的影响 D.图4探究苯酚和碳酸酸性相对强弱
6.已知:①可将氧化为;②直接参与化学键变化的核素被替换为更重的同位素时,反应速率会变慢。与或反应时体系的能量随反应进程的变化如图所示。下列说法错误的是( )
A.该反应是放热反应
B.步骤Ⅰ涉及键的断裂,步骤Ⅱ涉及键的形成
C.与反应的能量变化为曲线c
D.相同情况下,与反应,氚代甲醇的产量大于
7.一种抗血小板聚集药物X的结构如下图所示。下列说法正确的是( )
A.1个X分子中含有2个手性碳原子 B.X中存在4种含氧官能团
C.1molX最多能与2molNaOH发生反应 D.X遇溶液显紫色
8.工业上可通过“酸性歧化法”制备:将软锰矿(主要成分为)先氧化成,进而在酸性条件下制备,流程如下图所示。实验室中模拟“酸性歧化法”制备下列说法正确的是( )
A.“熔融”操作应在石英坩埚中进行
B.“酸化”反应中氧化产物与还原产物的物质的量之比为2:1
C.“酸化”时可改用盐酸代替
D.“结晶”过程中加热蒸发至有较多晶体析出时停止加热
9.2-氯乙醇是一种重要的有机溶剂和有机合成原料,可由乙烯和电解装置制备,其电解原理如下图所示。下列说法正确的是( )
A.a端电势高于b端电势
B.理论上转移,消耗
C.应选用阳离子交换膜,电解后电极室A中KOH溶液的浓度下降
D.电极B上的电极反应式为
10,某种化学品的结构如图所示,已知W、X、Y、Z、M均为短周期主族元素,其中W、X、Y在同一周期,Z、M同处另一周期,基态M原子的价电子中,在不同形状原子轨道运动的电子数之比为2:1.下列说法错误的是( )
A.同一周期中,第一电离能处在Z和M之间的元素有1种
B.简单离子半径:Z>X>M
C.简单气态氢化物稳定性:X>W>Z
D.Y与W可以形成只含极性键的非极性分子
11.由下列实验操作及现象得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 将少量固体溶于稀,滴加KSCN溶液 溶液变红 固体已氧化变质
B 溴乙烷加入NaOH的乙醇溶液,加热,将产生的气体通入酸性溶液中 酸性溶液褪色 溴乙烷发生了消去反应
C 向溶液中逐滴滴加氨水至过量,并边加边振荡 先生成蓝色沉淀,后又溶解得到深蓝色溶液 与的配位能力:强于
D 向含有酚酞的溶液中加入少量固体 出现白色沉淀且溶液红色变浅 溶液中存在水解平衡
12.一种由Mn、Se组成的化合物立方晶胞结构如图所示。已知化合物的摩尔质量为,晶胞参数为anm,阿伏加德罗常数的值为。下列说法错误的是( )
A.该化合物的化学式可表示为MnSe B.与Se原子距离最近的Se原子有12个
C.Mn、Se原子的最近距离是 D.晶胞密度为
13.工业上生产CO的反应原理为 。一定条件下,将足量焦炭和一定量放入体积为2L的恒容密闭容器中发生反应,和CO的物质的量n随时间t的变化关系如图。下列说法正确的是( )
A.0~2min,;2~3min,
B.当容器内的气体密度()不变时,反应一定达到平衡状态,且
C.3min时温度由升高到,则,平衡常数
D.5min时再充入一定量的CO,a、d曲线分别表示、的变化
14.盐酸羟胺()是一种常见的还原剂和显像剂,其化学性质类似。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是( )
图1 图2
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.图2中,X为和,Y为
C.电池工作一段时间后,正极区溶液的pH减小
D.理论上,当有标准状况下参与反应时,左室溶液质量增加3.3g
15.已知: , 。
、、的分布分数与关系如图所示,浓度单位为mol/L。
{例如:分布分数},下列说法正确的是( )
A.曲线c代表的分布分数
B.平衡常数
C.
D.当时,
二、非选择题:本题共4小题,共55分。
16,(14分)五氧化二钒()和三氧化钼()是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为、、,还有少量的、、有机物)
来制备这两种氧化物的工艺流程图如下:
回答下列问题:
(1)基态钒原子的价层电子排布式为__________。
(2)“焙烧”的目的是__________。
(3)滤渣的主要成分是__________(填化学式)。
(4)向滤液①中加的作用是__________。
(5)常温下,当滤液①调pH=8时,铝元素是否沉淀完全__________(填“是”或“否”);写出计算过程__________。[已知: ;离子浓度小于认为沉淀完全]
(6)在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是__________;沉淀分解生成的化学方程式为__________。
17,(13分)环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少大气污染有重要意义。
回答下列问题:
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用还原NO的反应原理为: 。该反应的能量变化过程如图:
(1)__________(用图中字母a、b、c、d表示)。该反应在__________(填“高温”、“低温”或“任意温度”)条件下有利于自发进行。
II.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成,可有效降低汽车尾气污染。
已知反应: 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
(2)据图分析可知,__________(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是__________(填标号)。
a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的__________点方向移动。
(4)E点的压强平衡常数__________(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①250℃脱氮率较好的催化剂是__________(填“Cat-1”或“Cat-2”).
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是__________。
18.(14分)硫脲[]可用于制造药物,也可用作橡胶的硫化促进剂以及金属矿物的浮选剂。硫脲是一种白色晶体,熔点180℃,易溶于水和乙醇,高温时部分发生异构化反应而生成硫氰化铵。化学小组在实验室制备硫脲并对其在产品中的含量进行测定,相关实验如下。
回答下列问题:
Ⅰ.硫脲的制备
已知:将氰氨化钙()和水的混合物加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示(加热装置已省略)。
(1)M的名称为__________。
(2)装置B中的试剂X和试剂Y的最佳组合是__________(填序号)。
A.FeS固体和浓硫酸 B.FeS固体和稀硝酸 C.FeS固体和稀盐酸
(3)按气流从左到右的方向,装置的合理连接顺序为c→__________(填仪器接口的小写字母)。
(4)装置A中饱和NaHS溶液的作用是__________。
(5)装置C中反应温度控制在80℃,温度不宜过高也不宜过低的原因是__________,装置C中反应的化学方程式为__________。
Ⅱ.硫脲的分离及产品含量的测定
(6)装置C反应后的液体过滤后,将滤液减压蒸发浓缩,之后冷却结晶,离心分离,烘干即可得到产品。称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用标准溶液滴定,滴定至终点时消耗标准溶液VmL。
①硫脲[]易溶于水,除硫脲和水都是极性分子外,其原因还有__________。
②滴定时,硫脲转化为、、,则__________。
③样品中硫脲的质量分数为__________%(用含“m、c、V”的式子表示)。
19.(14分)3-氯靛红酸酐()是重要的材料中间体,其制备流程图如下:
已知:
回答下列问题:
(1)3-氯靛红酸酐中碳原子的杂化方式为。
(2)B的名称为__________,写出符合下列两个条件的B的所有同分异构体的结构简式(不考虑立体异构)。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备有机物B,而是经由①、②、③三步反应进行制取,其目的是__________。
(4)⑥的反应类型为__________。
(5)⑧的反应试剂为__________(写化学式)。
(6)以有机物C为原料,在一定条件下制备含酰胺基聚合物的化学方程式为__________。
同课章节目录
