化学人教版(2019)必修第一册2.2.1氯气的性质(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.1氯气的性质(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 10:02:19 | ||
图片预览








文档简介
(共24张PPT)
2019人教版必修一
氯是一种重要的“成盐元素”,简称“卤素”。
海水 盐湖 盐矿
在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
氯的存在及用途
氯气的用途:是一种重要的化工原料
大量用于制造盐酸、有机溶剂、农药、染料和药品等
盐酸
有机溶剂
农药
药品
染料
氯的存在及用途
一、氯气的物理性质
颜色
状态
气味
毒性
密度
溶解性
熔沸点
黄绿色
气体
刺激性气味
有毒
密度比空气大
1体积的水约溶解2体积的氯气
熔沸点较低(易液化)
氯气
液氯(纯净物)
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。
2.氯气与单质的反应
(1)原子结构:
(结构决定性质)氯的化学性质非常活泼,表现出 。
Cl
最外层容易得到 个电子
Cl-
强氧化性
1
化学性质
与金属单质反应
现象
剧烈燃烧
钠
白色的烟
2Na+Cl2 2NaCl
△
化学性质
与金属单质反应
Na
现象
剧烈燃烧
棕褐色的烟
2Fe+3Cl2 2FeCl3
△
Fe
白色的烟
2Na+Cl2 2NaCl
△
常温下铁与氯气不反应
化学性质
与金属单质反应
Cu
现象
剧烈燃烧
棕黄色的烟
Na
白色的烟
2Na+Cl2 2NaCl
△
Fe
棕褐色的烟
2Fe+3Cl2 2FeCl3
△
Cu+Cl2 CuCl2
△
特别提醒 氯气在加热条件下能与大多数金属化合,把变价金属(如Fe、Cu)一般氧化到最高价
2、与非金属单质H2的反应
实验现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
二、氯气的化学性质
【思考与讨论1】:我们以前学过的燃烧反应,都是物质在氧气中的燃烧。通过学习H2在Cl2中的燃烧,你对燃烧的条件及其本质有什么新的认识?
(1)燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
(2)燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
定义:任何发光发热的剧烈的化学反应叫燃烧。
二、氯气的化学性质
3.与水反应
【生活常识】目前很多自来水厂会用氯气杀菌消毒,在生活中打开自来水时,偶尔会闻到刺激性气味,这种刺激性气味是余氯的味道。为什么氯气可以用于自来水杀菌消毒呢?
氯气能溶于水(常温常压下,1体积水约溶解2体积的氯气),氯气的水溶液叫氯水。
二、氯气的化学性质
3.与水反应
二、氯气的化学性质
3.与水反应
【问题2】试纸褪色的是Cl2?氯气具有漂白性吗?
操作 实验现象
湿润的红色纸条放入氯气瓶中
干燥的红色纸条放入氯气瓶中
纸条褪色
没有现象
有色的鲜花放入氯气瓶中
鲜花褪色
实验结论:
(1)干燥的氯气不具有漂白性,湿润的氯气具有漂白性。
(2)氯水中一定产生了一种新的漂白性物质。
二、氯气的化学性质
3.与水反应
产生的新的漂白性物质是什么?
Cl2 + H2O HCl + HClO (可逆反应)
Cl2 + H2O H+ + Cl-+ HClO
+1
探究课堂
化学性质 (次氯酸)
① 强氧化性:
ⅰ. 能将有色物质氧化为无色物质,作 ________________
ⅱ. 杀菌、消毒。
② 不稳定(光照易分解产生气体):
次氯酸分解反应的化学方程式为__________________________________
③ 弱酸性:
漂白剂
盐酸>醋酸>碳酸>HClO
2HClO 2HCl+O2↑
探究课堂
氯水的成分和性质
1. 氯水的成分
Cl2+H2O HCl+HClO
HCl是强电解质,H2O和HClO都是弱电解质
H2O H++OH-
HClO H++ClO-
HCl = H++ Cl-
探究课堂
氯水的成分和性质
2. 氯水的性质
新制氯水的多种成分决定了它具有多重性质,
在不同的化学反应中,氯水中参与反应的微粒不同。
氯水
浅黄绿色
活动四:探究氯水在光照条件下的变化
1.利用数字化实验,采集到密闭容器中氯水光照时,氯水的pH、氯离子的浓度和氧气的体积分数随时间的变化如下图所示。由图像可以得出哪些结论?
【答案】 随着时间推移,溶液的pH减小,酸性增强;氯离子浓度增大(生成H+和Cl-);还有氧气生成。
3.氯水光照时,只有次氯酸发生了反应,写出该反应的化学方程式。久置氯水与新制氯水相比,溶质的性质将发生哪些变化?
探究课堂
3. 液氯、新制氯水、久置氯水的比较
物质 液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、 H+、Cl-、ClO-、OH- H+、Cl-、H2O、OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 只有酸性,且酸性增强
保存 特制钢瓶 棕色试剂瓶盛装, 密封保存于阴凉处,一般现用现配 —
氯水的成分和性质
二、氯气的化学性质
4.与碱反应
(1)Cl2与NaOH反应制备漂白液
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
2NaOH+Cl2= NaClO + NaCl +H2O
Cl2+2OH-=Cl-+ClO-+H2O
漂白液的有效成分是 。
次氯酸钠
化学性质
4. 与碱的反应
(2) 与冷的石灰乳反应——制取漂白粉
① 制取反应的化学方程式:_____________________________________________
② 漂白粉的主要成分是_______________________,有效成分是___________,漂粉精的主要成分是_____________
(3) 漂白液、漂白粉和漂粉精既可作 又可作 。
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
漂白剂
消毒剂
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
(1)漂白粉的漂白原理
(2)漂白粉的失效原理
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑
光照
酸+ 次氯酸盐 →次氯酸+盐
生效原理
(反应原理:较强酸制取弱酸)
漂白粉放置久了易变质失效,应密封保存。
应用
小结
Cl元素
原子结构
氯气
物理性质
与水反应
强氧化性
最外层有7个电子,易得到1个电子
化学性质
与碱反应
次氯酸
一种黄绿色有刺激性气味的有毒气体,密度比空气大,可溶于水
与金属单质、非金属单质、还原性氧化物
Cl2+H2O=HCl+HClO
制取漂白粉、漂白液
强氧化性、弱酸性、不稳定性
2019人教版必修一
氯是一种重要的“成盐元素”,简称“卤素”。
海水 盐湖 盐矿
在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
氯的存在及用途
氯气的用途:是一种重要的化工原料
大量用于制造盐酸、有机溶剂、农药、染料和药品等
盐酸
有机溶剂
农药
药品
染料
氯的存在及用途
一、氯气的物理性质
颜色
状态
气味
毒性
密度
溶解性
熔沸点
黄绿色
气体
刺激性气味
有毒
密度比空气大
1体积的水约溶解2体积的氯气
熔沸点较低(易液化)
氯气
液氯(纯净物)
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。
2.氯气与单质的反应
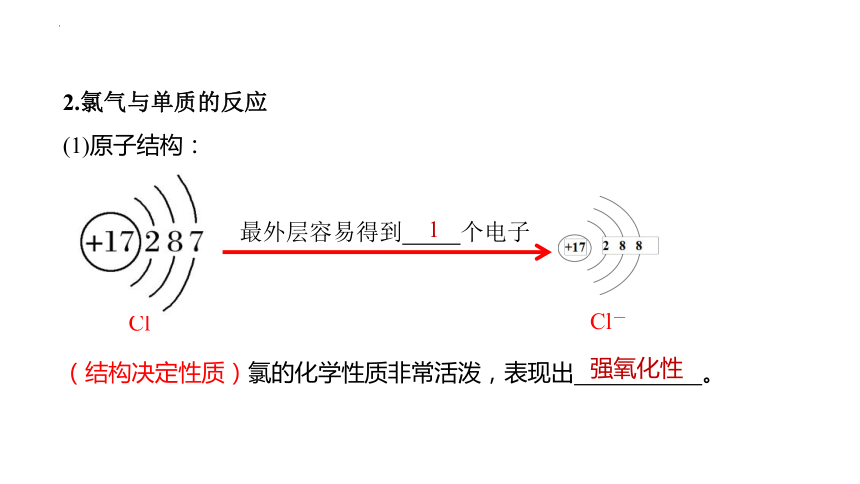
(1)原子结构:
(结构决定性质)氯的化学性质非常活泼,表现出 。
Cl
最外层容易得到 个电子
Cl-
强氧化性
1
化学性质
与金属单质反应
现象
剧烈燃烧
钠
白色的烟
2Na+Cl2 2NaCl
△
化学性质
与金属单质反应
Na
现象
剧烈燃烧
棕褐色的烟
2Fe+3Cl2 2FeCl3
△
Fe
白色的烟
2Na+Cl2 2NaCl
△
常温下铁与氯气不反应
化学性质
与金属单质反应
Cu
现象
剧烈燃烧
棕黄色的烟
Na
白色的烟
2Na+Cl2 2NaCl
△
Fe
棕褐色的烟
2Fe+3Cl2 2FeCl3
△
Cu+Cl2 CuCl2
△
特别提醒 氯气在加热条件下能与大多数金属化合,把变价金属(如Fe、Cu)一般氧化到最高价
2、与非金属单质H2的反应
实验现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
二、氯气的化学性质
【思考与讨论1】:我们以前学过的燃烧反应,都是物质在氧气中的燃烧。通过学习H2在Cl2中的燃烧,你对燃烧的条件及其本质有什么新的认识?
(1)燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
(2)燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
定义:任何发光发热的剧烈的化学反应叫燃烧。
二、氯气的化学性质
3.与水反应
【生活常识】目前很多自来水厂会用氯气杀菌消毒,在生活中打开自来水时,偶尔会闻到刺激性气味,这种刺激性气味是余氯的味道。为什么氯气可以用于自来水杀菌消毒呢?
氯气能溶于水(常温常压下,1体积水约溶解2体积的氯气),氯气的水溶液叫氯水。
二、氯气的化学性质
3.与水反应
二、氯气的化学性质
3.与水反应
【问题2】试纸褪色的是Cl2?氯气具有漂白性吗?
操作 实验现象
湿润的红色纸条放入氯气瓶中
干燥的红色纸条放入氯气瓶中
纸条褪色
没有现象
有色的鲜花放入氯气瓶中
鲜花褪色
实验结论:
(1)干燥的氯气不具有漂白性,湿润的氯气具有漂白性。
(2)氯水中一定产生了一种新的漂白性物质。
二、氯气的化学性质
3.与水反应
产生的新的漂白性物质是什么?
Cl2 + H2O HCl + HClO (可逆反应)
Cl2 + H2O H+ + Cl-+ HClO
+1
探究课堂
化学性质 (次氯酸)
① 强氧化性:
ⅰ. 能将有色物质氧化为无色物质,作 ________________
ⅱ. 杀菌、消毒。
② 不稳定(光照易分解产生气体):
次氯酸分解反应的化学方程式为__________________________________
③ 弱酸性:
漂白剂
盐酸>醋酸>碳酸>HClO
2HClO 2HCl+O2↑
探究课堂
氯水的成分和性质
1. 氯水的成分
Cl2+H2O HCl+HClO
HCl是强电解质,H2O和HClO都是弱电解质
H2O H++OH-
HClO H++ClO-
HCl = H++ Cl-
探究课堂
氯水的成分和性质
2. 氯水的性质
新制氯水的多种成分决定了它具有多重性质,
在不同的化学反应中,氯水中参与反应的微粒不同。
氯水
浅黄绿色
活动四:探究氯水在光照条件下的变化
1.利用数字化实验,采集到密闭容器中氯水光照时,氯水的pH、氯离子的浓度和氧气的体积分数随时间的变化如下图所示。由图像可以得出哪些结论?
【答案】 随着时间推移,溶液的pH减小,酸性增强;氯离子浓度增大(生成H+和Cl-);还有氧气生成。
3.氯水光照时,只有次氯酸发生了反应,写出该反应的化学方程式。久置氯水与新制氯水相比,溶质的性质将发生哪些变化?
探究课堂
3. 液氯、新制氯水、久置氯水的比较
物质 液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、 H+、Cl-、ClO-、OH- H+、Cl-、H2O、OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 只有酸性,且酸性增强
保存 特制钢瓶 棕色试剂瓶盛装, 密封保存于阴凉处,一般现用现配 —
氯水的成分和性质
二、氯气的化学性质
4.与碱反应
(1)Cl2与NaOH反应制备漂白液
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
2NaOH+Cl2= NaClO + NaCl +H2O
Cl2+2OH-=Cl-+ClO-+H2O
漂白液的有效成分是 。
次氯酸钠
化学性质
4. 与碱的反应
(2) 与冷的石灰乳反应——制取漂白粉
① 制取反应的化学方程式:_____________________________________________
② 漂白粉的主要成分是_______________________,有效成分是___________,漂粉精的主要成分是_____________
(3) 漂白液、漂白粉和漂粉精既可作 又可作 。
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
漂白剂
消毒剂
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
(1)漂白粉的漂白原理
(2)漂白粉的失效原理
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑
光照
酸+ 次氯酸盐 →次氯酸+盐
生效原理
(反应原理:较强酸制取弱酸)
漂白粉放置久了易变质失效,应密封保存。
应用
小结
Cl元素
原子结构
氯气
物理性质
与水反应
强氧化性
最外层有7个电子,易得到1个电子
化学性质
与碱反应
次氯酸
一种黄绿色有刺激性气味的有毒气体,密度比空气大,可溶于水
与金属单质、非金属单质、还原性氧化物
Cl2+H2O=HCl+HClO
制取漂白粉、漂白液
强氧化性、弱酸性、不稳定性
