北京市2025年第一次普通高中学业水平合格性考试化学试卷(含答案)
文档属性
| 名称 | 北京市2025年第一次普通高中学业水平合格性考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 509.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 01:28:23 | ||
图片预览




文档简介
2025年北京市第一次普通高中学业水平合格性考试化学试卷
一、单选题
1.我国第五座南极考察站——秦岭站中使用了多种新材料。下列属于有机高分子材料的是
A.光伏电池板——硅 B.高强度框架结构——耐低温耐蚀钢
C.高能锂电池正极——磷酸铁锂 D.幕墙保温层泡沫板——聚氨酯
2.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀 B.胶体 C.溶液 D.蔗糖溶液
3.下列物质中,含有离子键的是
A. B. C. D.
4.下列不能导电的物质是
A. B.固体 C.溶液 D.熔融的
5.实验室用二氧化锰和浓盐酸共热制备氯气,选用的发生装置是
A. B. C. D.
6.下列操作不符合实验安全要求或实验操作规范的是
A.熄灭酒精灯时,用灯帽盖灭
B.将氯化钠固体放在容量瓶中加水溶解
C.金属钠不慎着火时,立即用沙土覆盖
D.点燃氢气前,先验纯,确认氢气纯净后再点燃
7.“嫦娥六号”探测器成功从月球带回月壤样本。研究表明月壤中含有。属于
A.单质 B.氧化物 C.酸 D.碱
8.一定温度下,在恒容密闭容器中发生反应:。当该反应达到化学平衡状态时,下列说法正确的是
A.、、的浓度不再变化
B.全部转化为和
C.正、逆反应速率相等且等于零
D.、、的浓度一定相等
9.钇的一种核素可用于癌症的靶向放射治疗。下列关于的说法不正确的是
A.质子数为39 B.中子数为51
C.核外电子数为129 D.质量数为90
10.下列化合物中,与互为同分异构体的是
A. B.
C. D.
11.变量控制是科学研究的重要方法。相同质量的铁与足量硫酸溶液分别在下列条件下发生反应,开始阶段化学反应速率最大的是
选项 A B C D
铁的状态 片状 粉状 片状 粉状
温度/℃ 20 20 30 30
A.A B.B C.C D.D
12.工业制备金属钛的反应为,其中用作还原剂的是
A. B. C. D.
13.下列电离方程式书写不正确的是
A. B.
C. D.
14.下列电子式书写不正确的是
A. B. C. D.
15.下列关于过氧化钠的说法不正确的是
A.白色固体 B.能与水反应
C.能与二氧化碳反应 D.可用作供氧剂
16.下列关于氨的说法不正确的是
A.有刺激性气味 B.常温常压下密度比空气的小
C.难溶于水 D.能与反应
17.下列物质在一定条件下与硫反应,产物中含有+4价硫元素的是
A.氧气 B.氢气 C.铁 D.铜
18.根据原电池原理,人们研制出了满足不同用电需要的化学电池。某原电池如图。下列说法不正确的是
A.电流表指针偏转,说明化学能转化为电能
B.锌片作原电池的正极
C.铜片上发生反应:
D.该装置可使氧化反应和还原反应分别在两个不同的区域进行
19.下列关于蛋白质的说法不正确的是
A.是重要的营养物质 B.可发生水解反应
C.仅含、、三种元素 D.牛奶中含有蛋白质
20.氢气在氯气中燃烧的反应为。下列关于该反应的说法正确的是
A.属于吸热反应
B.反应物的总能量低于生成物的总能量
C.化学键的断裂和形成是该反应中能量变化的主要原因
D.相同条件下,生成的越多,反应吸收的能量越多
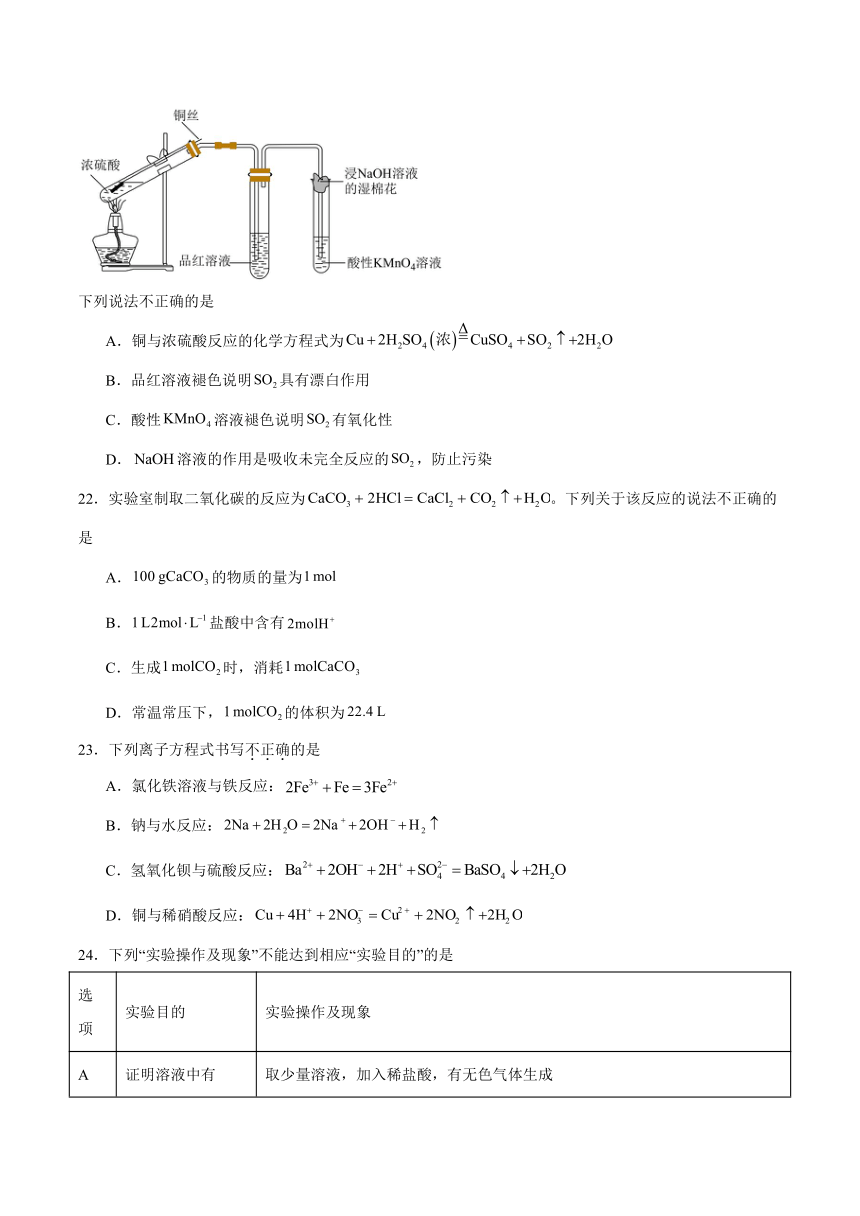
21.某小组为研究二氧化硫的性质,设计并完成如下实验。
下列说法不正确的是
A.铜与浓硫酸反应的化学方程式为
B.品红溶液褪色说明具有漂白作用
C.酸性溶液褪色说明有氧化性
D.溶液的作用是吸收未完全反应的,防止污染
22.实验室制取二氧化碳的反应为。下列关于该反应的说法不正确的是
A.的物质的量为
B.盐酸中含有
C.生成时,消耗
D.常温常压下,的体积为
23.下列离子方程式书写不正确的是
A.氯化铁溶液与铁反应:
B.钠与水反应:
C.氢氧化钡与硫酸反应:
D.铜与稀硝酸反应:
24.下列“实验操作及现象”不能达到相应“实验目的”的是
选项 实验目的 实验操作及现象
A 证明溶液中有 取少量溶液,加入稀盐酸,有无色气体生成
B 证明溶液中有 取少量溶液,加入溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
C 证明溶液中有 取少量溶液,滴加溶液,溶液变红
D 证明溶液中有 取少量溶液,加入足量稀盐酸,无明显现象;再加入溶液,有白色沉淀生成
A.A B.B C.C D.D
25.由硫铁矿烧渣(含、、等)制备铁红()的一种工艺流程如图。
下列说法不正确的是
A.酸浸时,不与稀硫酸反应
B.酸浸后,溶液中的金属阳离子只有
C.沉铁时,氨水提供了
D.煅烧时,发生的反应为
二、填空题
26.阅读短文,回答问题。
果糖是常用的食品甜味剂,也可在生物精炼过程中转化为多种物质,需求量大。然而自然界中果糖的含量远低于葡萄糖。我国科研团队在催化葡萄糖转化为果糖方面取得新进展,发展了高浓度葡萄糖高效异构化制备果糖的催化体系。
科研人员将铟()掺入分子筛中,使分子筛边界上形成和的纳米颗粒,起到催化作用。在甲醇的协同作用下,葡萄糖可转化为甲基果糖,进而在少量水的作用下转化为果糖。实验结果显示,使用该催化体系可将果糖产率提升至54.9%。该成果有助于推进化学催化葡萄糖异构化的工业实践。
(1)果糖的用途有 (写出一条即可)。
(2)葡萄糖转化为果糖属于 (填“物理变化”或“化学变化”)。
(3)依据以上短文,判断下列说法是否正确(填“是”或“否”)。
①自然界中,葡萄糖的含量高于果糖。
②铟元素在催化过程中起到了重要作用。
③该方法中,葡萄糖转化为果糖的过程中甲醇起到了协同作用。
(4)结合短文回答,该成果的意义是 。
27.有机化合物种类繁多,与生产生活息息相关。
(1)补齐下列有机化合物与其用途之间的连线 。
物质 用途 A.油脂___________a.生产肥皂 B.乙醇 b.清除水垢 C.乙酸 c.制作医用消毒剂
(2)乙烯是重要的有机化工基础原料。乙烯的分子结构模型如图。
①乙烯的结构简式为 。
②乙烯的官能团是 。
③下列关于乙烯的说法正确的是 (填序号)。
a.无色气体 b.可与酸性溶液反应
④区分乙烯和甲烷的方法有多种。
方法a:分别在空气中点燃,火焰明亮并伴有黑烟的是乙烯。
方法b:分别通入盛有溴的四氯化碳溶液的两支试管中,使溶液褪色的是 。
⑤以乙烯为原料可以制备乙酸乙酯,转化关系如图。
a.反应i、ii中,属于加成反应的是 (填序号)。
b.将反应iv的化学方程式补充完整:
。
28.镁铝尖晶石()是一种重要的耐火材料,广泛应用于钢铁冶炼、航空航天等领域。
(1)在元素周期表中的位置是第 周期、第ⅡA族。
(2)金属性强于。
①用原子结构解释原因:和位于同一周期,原子核外电子层数相同, ,原子半径大于,失电子能力强于。
②用元素金属性的差异预测物质的性质:镁和铝分别与水反应,更易置换出的是 。
(3)在元素周期表中,硒()位于第4周期,与同主族。利用元素周期表可以推测及其化合物的某些性质。
①画出的原子结构示意图: 。
②Se的最外层电子数为 。
③下列说法正确的是 (填序号)。
a.原子半径:
b.非金属性:
c.气态氢化物的稳定性:
三、解答题
29.某小组同学探究与溶液的反应。
(1)依据碘元素的化合价判断,具有 (填“氧化性”或“还原性”)。
(2)实验1:向盛有溶液的试管中滴加5滴溶液,观察到溶液变为黄色,有气泡产生。
①依据溶液变为黄色,小组同学推测该反应有生成。向反应后的溶液中滴加淀粉溶液,观察到 ,证实了上述推测。
②实验中产生的气体可使带火星的木条复燃,该气体为 。
(3)针对实验1中产生气泡的现象进行分析,设计并完成实验2.
查阅资料:能促进分解。
实验序号 操作 试剂a 试剂b 现象
2-1 水 5滴30%溶液 无气泡产生
2-2 溶液 5滴30%溶液 无气泡产生
①下列分析合理的是 (填序号)。
a.实验2-1说明,无,其他条件与实验1相同时,无明显分解
b.实验2-2可排除实验1中对分解的影响
c.上述实验可证明,加入能促进分解
②分解的化学方程式为 。
(4)综合以上实验,与溶液反应时,的作用有 。
参考答案
1.D
2.B
3.A
4.B
5.D
6.B
7.B
8.A
9.C
10.B
11.D
12.A
13.A
14.C
15.A
16.C
17.A
18.B
19.C
20.C
21.C
22.D
23.D
24.A
25.B
26.(1)食品甜味剂
(2)化学变化
(3) 是 是 是
(4)提高果糖产率和工业应用价值
27.(1)
(2) 碳碳双键 ab 乙烯 i
28.(1)三
(2) Mg的核电荷数比Al小 Mg
(3) 6 abc
29.(1)还原性
(2) 溶液变蓝色 氧气
(3) abc
(4)还原剂、催化剂
一、单选题
1.我国第五座南极考察站——秦岭站中使用了多种新材料。下列属于有机高分子材料的是
A.光伏电池板——硅 B.高强度框架结构——耐低温耐蚀钢
C.高能锂电池正极——磷酸铁锂 D.幕墙保温层泡沫板——聚氨酯
2.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀 B.胶体 C.溶液 D.蔗糖溶液
3.下列物质中,含有离子键的是
A. B. C. D.
4.下列不能导电的物质是
A. B.固体 C.溶液 D.熔融的
5.实验室用二氧化锰和浓盐酸共热制备氯气,选用的发生装置是
A. B. C. D.
6.下列操作不符合实验安全要求或实验操作规范的是
A.熄灭酒精灯时,用灯帽盖灭
B.将氯化钠固体放在容量瓶中加水溶解
C.金属钠不慎着火时,立即用沙土覆盖
D.点燃氢气前,先验纯,确认氢气纯净后再点燃
7.“嫦娥六号”探测器成功从月球带回月壤样本。研究表明月壤中含有。属于
A.单质 B.氧化物 C.酸 D.碱
8.一定温度下,在恒容密闭容器中发生反应:。当该反应达到化学平衡状态时,下列说法正确的是
A.、、的浓度不再变化
B.全部转化为和
C.正、逆反应速率相等且等于零
D.、、的浓度一定相等
9.钇的一种核素可用于癌症的靶向放射治疗。下列关于的说法不正确的是
A.质子数为39 B.中子数为51
C.核外电子数为129 D.质量数为90
10.下列化合物中,与互为同分异构体的是
A. B.
C. D.
11.变量控制是科学研究的重要方法。相同质量的铁与足量硫酸溶液分别在下列条件下发生反应,开始阶段化学反应速率最大的是
选项 A B C D
铁的状态 片状 粉状 片状 粉状
温度/℃ 20 20 30 30
A.A B.B C.C D.D
12.工业制备金属钛的反应为,其中用作还原剂的是
A. B. C. D.
13.下列电离方程式书写不正确的是
A. B.
C. D.
14.下列电子式书写不正确的是
A. B. C. D.
15.下列关于过氧化钠的说法不正确的是
A.白色固体 B.能与水反应
C.能与二氧化碳反应 D.可用作供氧剂
16.下列关于氨的说法不正确的是
A.有刺激性气味 B.常温常压下密度比空气的小
C.难溶于水 D.能与反应
17.下列物质在一定条件下与硫反应,产物中含有+4价硫元素的是
A.氧气 B.氢气 C.铁 D.铜
18.根据原电池原理,人们研制出了满足不同用电需要的化学电池。某原电池如图。下列说法不正确的是
A.电流表指针偏转,说明化学能转化为电能
B.锌片作原电池的正极
C.铜片上发生反应:
D.该装置可使氧化反应和还原反应分别在两个不同的区域进行
19.下列关于蛋白质的说法不正确的是
A.是重要的营养物质 B.可发生水解反应
C.仅含、、三种元素 D.牛奶中含有蛋白质
20.氢气在氯气中燃烧的反应为。下列关于该反应的说法正确的是
A.属于吸热反应
B.反应物的总能量低于生成物的总能量
C.化学键的断裂和形成是该反应中能量变化的主要原因
D.相同条件下,生成的越多,反应吸收的能量越多
21.某小组为研究二氧化硫的性质,设计并完成如下实验。
下列说法不正确的是
A.铜与浓硫酸反应的化学方程式为
B.品红溶液褪色说明具有漂白作用
C.酸性溶液褪色说明有氧化性
D.溶液的作用是吸收未完全反应的,防止污染
22.实验室制取二氧化碳的反应为。下列关于该反应的说法不正确的是
A.的物质的量为
B.盐酸中含有
C.生成时,消耗
D.常温常压下,的体积为
23.下列离子方程式书写不正确的是
A.氯化铁溶液与铁反应:
B.钠与水反应:
C.氢氧化钡与硫酸反应:
D.铜与稀硝酸反应:
24.下列“实验操作及现象”不能达到相应“实验目的”的是
选项 实验目的 实验操作及现象
A 证明溶液中有 取少量溶液,加入稀盐酸,有无色气体生成
B 证明溶液中有 取少量溶液,加入溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
C 证明溶液中有 取少量溶液,滴加溶液,溶液变红
D 证明溶液中有 取少量溶液,加入足量稀盐酸,无明显现象;再加入溶液,有白色沉淀生成
A.A B.B C.C D.D
25.由硫铁矿烧渣(含、、等)制备铁红()的一种工艺流程如图。
下列说法不正确的是
A.酸浸时,不与稀硫酸反应
B.酸浸后,溶液中的金属阳离子只有
C.沉铁时,氨水提供了
D.煅烧时,发生的反应为
二、填空题
26.阅读短文,回答问题。
果糖是常用的食品甜味剂,也可在生物精炼过程中转化为多种物质,需求量大。然而自然界中果糖的含量远低于葡萄糖。我国科研团队在催化葡萄糖转化为果糖方面取得新进展,发展了高浓度葡萄糖高效异构化制备果糖的催化体系。
科研人员将铟()掺入分子筛中,使分子筛边界上形成和的纳米颗粒,起到催化作用。在甲醇的协同作用下,葡萄糖可转化为甲基果糖,进而在少量水的作用下转化为果糖。实验结果显示,使用该催化体系可将果糖产率提升至54.9%。该成果有助于推进化学催化葡萄糖异构化的工业实践。
(1)果糖的用途有 (写出一条即可)。
(2)葡萄糖转化为果糖属于 (填“物理变化”或“化学变化”)。
(3)依据以上短文,判断下列说法是否正确(填“是”或“否”)。
①自然界中,葡萄糖的含量高于果糖。
②铟元素在催化过程中起到了重要作用。
③该方法中,葡萄糖转化为果糖的过程中甲醇起到了协同作用。
(4)结合短文回答,该成果的意义是 。
27.有机化合物种类繁多,与生产生活息息相关。
(1)补齐下列有机化合物与其用途之间的连线 。
物质 用途 A.油脂___________a.生产肥皂 B.乙醇 b.清除水垢 C.乙酸 c.制作医用消毒剂
(2)乙烯是重要的有机化工基础原料。乙烯的分子结构模型如图。
①乙烯的结构简式为 。
②乙烯的官能团是 。
③下列关于乙烯的说法正确的是 (填序号)。
a.无色气体 b.可与酸性溶液反应
④区分乙烯和甲烷的方法有多种。
方法a:分别在空气中点燃,火焰明亮并伴有黑烟的是乙烯。
方法b:分别通入盛有溴的四氯化碳溶液的两支试管中,使溶液褪色的是 。
⑤以乙烯为原料可以制备乙酸乙酯,转化关系如图。
a.反应i、ii中,属于加成反应的是 (填序号)。
b.将反应iv的化学方程式补充完整:
。
28.镁铝尖晶石()是一种重要的耐火材料,广泛应用于钢铁冶炼、航空航天等领域。
(1)在元素周期表中的位置是第 周期、第ⅡA族。
(2)金属性强于。
①用原子结构解释原因:和位于同一周期,原子核外电子层数相同, ,原子半径大于,失电子能力强于。
②用元素金属性的差异预测物质的性质:镁和铝分别与水反应,更易置换出的是 。
(3)在元素周期表中,硒()位于第4周期,与同主族。利用元素周期表可以推测及其化合物的某些性质。
①画出的原子结构示意图: 。
②Se的最外层电子数为 。
③下列说法正确的是 (填序号)。
a.原子半径:
b.非金属性:
c.气态氢化物的稳定性:
三、解答题
29.某小组同学探究与溶液的反应。
(1)依据碘元素的化合价判断,具有 (填“氧化性”或“还原性”)。
(2)实验1:向盛有溶液的试管中滴加5滴溶液,观察到溶液变为黄色,有气泡产生。
①依据溶液变为黄色,小组同学推测该反应有生成。向反应后的溶液中滴加淀粉溶液,观察到 ,证实了上述推测。
②实验中产生的气体可使带火星的木条复燃,该气体为 。
(3)针对实验1中产生气泡的现象进行分析,设计并完成实验2.
查阅资料:能促进分解。
实验序号 操作 试剂a 试剂b 现象
2-1 水 5滴30%溶液 无气泡产生
2-2 溶液 5滴30%溶液 无气泡产生
①下列分析合理的是 (填序号)。
a.实验2-1说明,无,其他条件与实验1相同时,无明显分解
b.实验2-2可排除实验1中对分解的影响
c.上述实验可证明,加入能促进分解
②分解的化学方程式为 。
(4)综合以上实验,与溶液反应时,的作用有 。
参考答案
1.D
2.B
3.A
4.B
5.D
6.B
7.B
8.A
9.C
10.B
11.D
12.A
13.A
14.C
15.A
16.C
17.A
18.B
19.C
20.C
21.C
22.D
23.D
24.A
25.B
26.(1)食品甜味剂
(2)化学变化
(3) 是 是 是
(4)提高果糖产率和工业应用价值
27.(1)
(2) 碳碳双键 ab 乙烯 i
28.(1)三
(2) Mg的核电荷数比Al小 Mg
(3) 6 abc
29.(1)还原性
(2) 溶液变蓝色 氧气
(3) abc
(4)还原剂、催化剂
同课章节目录
