第二单元 空气、物质的构成与组成 练习 (含答案)2025-2026学年化学科粤版九年级上册
文档属性
| 名称 | 第二单元 空气、物质的构成与组成 练习 (含答案)2025-2026学年化学科粤版九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 231.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 15:06:07 | ||
图片预览


文档简介
第二单元 空气、物质的构成与组成
(满分:100分 时间:60分钟)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.吉林雾凇,北国盛景。空气成分中与雾凇形成有关的是 ( )
A.水蒸气 B.二氧化碳 C.氧气 D.氮气
2.(2024福建中考)生活中常接触到“加铁酱油”“含氟牙膏”等用品,这里的铁、氟指的是 ( )
A.单质 B.元素 C.原子 D.分子
3.国家正在深入推进环境污染防治,持续深入打好蓝天、碧水、净土三大保卫战。空气是一种宝贵的资源,下列有关空气的说法不正确的是 ( )
A.稀有气体在通电时能发光,可制成霓虹灯
B.空气中含有氧气,氧气的体积分数约为78%
C.空气中氮气化学性质不活泼,可用作食品防腐的保护气
D.目前计入空气污染指数的有害气体主要包括SO2、CO、NO2、O3等
4.下列事实从微观角度来解释,其中不正确的是 ( )
A.电解水实验生成氢气和氧气——分子种类发生改变
B.氧气压缩为液氧——氧分子的体积变小
C.湿衣服在太阳下容易晒干——温度越高,水分子的运动速率越快
D.过氧化氢与水的元素组成相同而性质不同——分子构成不同
5.2024年3月1日生态环境部发布2024年六五环境日主题为“全面推进美丽中国建设”。下列做法不符合该主题的是 ( )
A.鼓励焚烧秸秆就地取肥 B.推广使用新能源汽车
C.建设城市湿地公园 D.提倡回收废旧电池
6.(2024哈尔滨中考)依据所学知识及图示所示信息判断,下列叙述错误的是 ( )
A.氧元素的相对原子质量为16.00
B.1个氧原子含有8个质子
C.氧元素的符号是O
D.氧原子在化学变化中易失去电子
7.(2024烟台中考)元素观、微粒观是重要的化学观念。下列有关说法错误的是 ( )
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核的体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
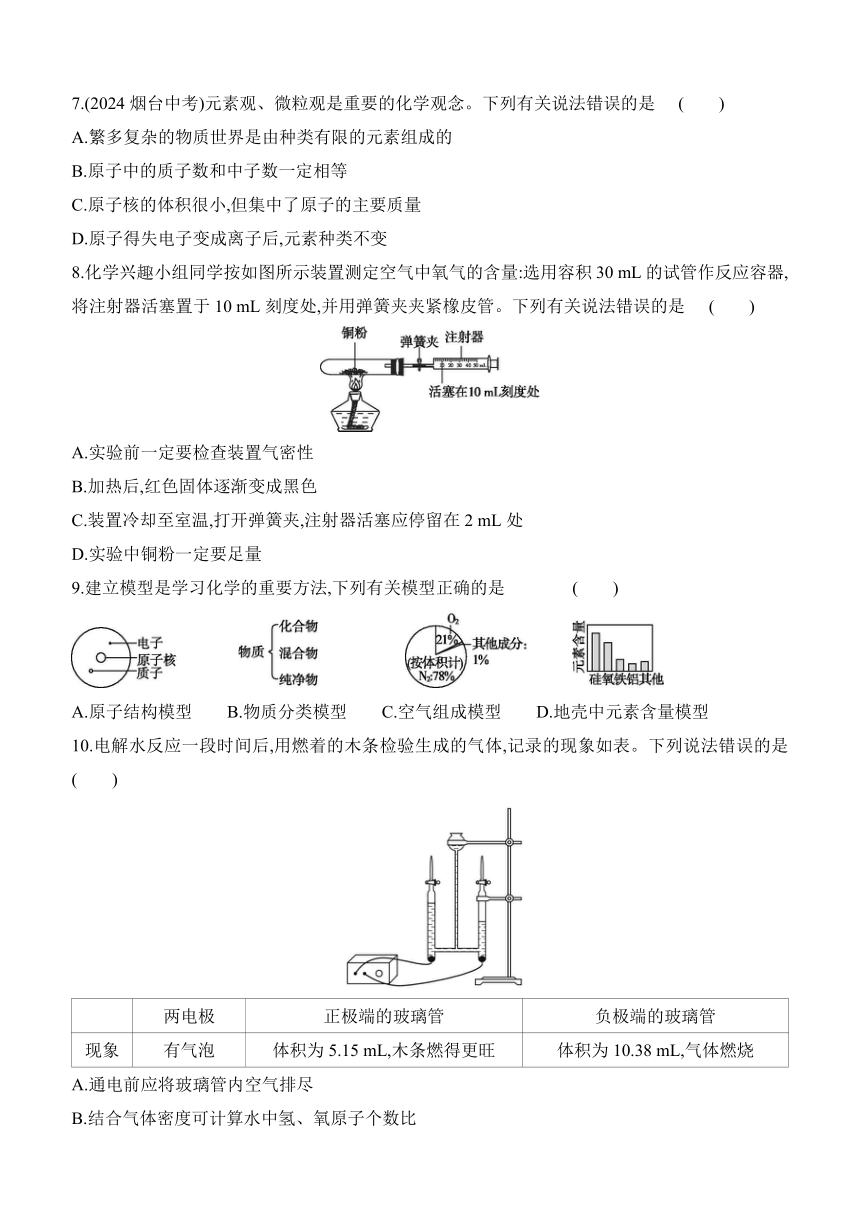
8.化学兴趣小组同学按如图所示装置测定空气中氧气的含量:选用容积30 mL的试管作反应容器,将注射器活塞置于10 mL刻度处,并用弹簧夹夹紧橡皮管。下列有关说法错误的是 ( )
A.实验前一定要检查装置气密性
B.加热后,红色固体逐渐变成黑色
C.装置冷却至室温,打开弹簧夹,注射器活塞应停留在2 mL处
D.实验中铜粉一定要足量
9.建立模型是学习化学的重要方法,下列有关模型正确的是 ( )
A.原子结构模型 B.物质分类模型 C.空气组成模型 D.地壳中元素含量模型
10.电解水反应一段时间后,用燃着的木条检验生成的气体,记录的现象如表。下列说法错误的是 ( )
两电极 正极端的玻璃管 负极端的玻璃管
现象 有气泡 体积为5.15 mL,木条燃得更旺 体积为10.38 mL,气体燃烧
A.通电前应将玻璃管内空气排尽
B.结合气体密度可计算水中氢、氧原子个数比
C.电解过程中电能转化为化学能
D.两电极产生气泡的速率不相同
11.科学思维是化学核心素养的重要组成部分,下列示例说法不正确的是 ( )
A.比较:钠原子(Na)和钠离子(Na+)核电荷数相同,化学性质相似
B.分类:熔点、密度是物理性质,可燃性、稳定性是化学性质
C.分析:稀有气体用于霓虹灯,因为通电时稀有气体发出不同颜色的光
D.推理:分子是由原子构成的,所以氧分子是由氧原子构成的
12.下列各组物质,按单质、氧化物、混合物顺序排列的是 ( )
A.石墨、氯酸钾、石油 B.钢、氧化镁、铁锈
C.臭氧、二氧化硫、冰水混合物 D.液态氧、干冰、空气
13.元素观、微粒观是化学的重要观念。下列有关元素和微观粒子的说法不正确的是 ( )
A.最外层电子数为8的粒子不一定是稀有气体原子
B.同种元素的原子核内质子数与中子数一定相等
C.元素的原子序数与该元素原子核电荷数在数值上相同
D.在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
14.(2025清远月考)如图是4种粒子的结构示意图,下列说法不正确的是 ( )
A.②③属于不同种元素
B.②④的化学性质相似
C.②的符号为Al
D.①③原子都容易得到电子
15.(2025德州武城县期中)推理是化学学习的一种方法,以下推理正确的是 ( )
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.分子、原子可以构成物质,所以物质一定是由分子、原子构成的
C.Na+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
D.化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
二、填空题(本题共4小题,共36分)
16.(11分)按要求填空。
(1)用化学符号填空。
①氯元素 ;②两个铁原子 ;③镁离子 。
(2)用“元素”“分子”“原子”“离子”填空。
①保持水的化学性质的是水 ;
②二氧化碳是由碳、氧两种 组成的;
③镁燃烧的反应中的最小微观粒子是镁 和氧 ;
④氯化钠是由 构成的物质。
(3)从微观角度:用“”表示氮原子,“”表示氧原子。
①用“”可表示的微观粒子是 (填名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,可表示空气微观模型的是 (填字母)。
(4)原子不显电性,是因为原子中 。
17.(5分)元素周期表是学习化学的重要工具。下表是元素周期表中的一部分,请回答下列问题:
(1)表中①所示元素的名称是 ,地壳中含量最多的金属元素的原子序数是 。
(2)X2-与Ar的核外电子排布相同,则X的元素符号是 ,它在元素周期表中位于第 周期。
(3)元素周期表中同族和同周期元素具有一定的相似性和变化规律,同族元素化学性质相似的原因是 相同。
18.(10分)如图所示,A、B、C、D每瓶气体中,“”“”“”“”代表不同原子,现对A、B、C、D四瓶气体进行如下分类,回答下列问题:
(1)属于①的是 (填字母,下同);属于②的是 ;属于③的是 ;属于稀有气体的可能是 。
(2)上述将纯净物分类成①和②,这种分类依据是 。
19.(10分)同学们用如图所示的实验,在体验科学家们探究水的组成的历程。
(1)电解水发生反应的文字表达式为 。
(2)实验中观察到的现象:正负两极上都有气泡产生且气体体积比约为 。
(3)切断装置中的电源,用 分别在两个尖嘴口检验电解水产生的气体,观察到b管现象是 。
(4)通过检验确定水的元素组成后,同学们查阅资料得知,相同条件下,氧气密度是氢气密度的16倍,可以根据体积和密度计算得出氧气和氢气的质量比约为 。
(5)老师提示:质量除相对原子质量的比值,就是原子个数比。大家经过计算,得出水中氢、氧原子个数比约为 ,恍然大悟,物质的化学式原来都是用精确的实验测定的。
(6)问题与交流:
①为保证实验的成功,你认为需要注意什么 请写出一条: 。
②请描述电解水的微观实质: 。
③该实验是将被探究的物质水作为反应物,通过分解反应探究水的组成,除此之外还可以将水作为生成物,通过 化合物探究水的组成。两种方法的依据:化学反应前后 不变。
三、实验题(本题共1小题,共10分)
20.某实验小组用图1所示装置测定空气中氧气的含量。
【实验原理】
(1)图1是利用红磷燃烧消耗瓶内氧气,导致瓶内气压减小,水进入集气瓶,进入瓶内的水的体积即为空气中氧气的体积。红磷燃烧的文字表达式为 。
【实验过程】
(2)①用弹簧夹夹紧橡皮管。
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞。
③等 ,打开弹簧夹。
④观察并记录水面的变化情况。
【实验结果】
(3)多次实验发现集气瓶内上升的水面始终低于预想的高度,其可能的原因是 。
【拓展探究】
(4)小组同学利用图2装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开弹簧夹。如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 ,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中除了氧气外,一定有 。
四、计算题(本题共1小题,共9分)
21.已知碳原子(碳-12)的质量为1.99×10-26 kg。某原子的质量为8.6×10-26 kg,且该原子核内中子数比质子数多4个。
求:(1)该原子的相对原子质量(保留整数)。
(2)该原子的核外电子数。
【详解答案】
1.A
2.B
3.B 解析:空气中含有氧气,氧气的体积分数约为21%。
4.B 解析:电解水实验生成氢气和氧气,水分子分成氢原子和氧原子,氢原子与氧原子重新结合成氢分子和氧分子,分子种类发生了改变;氧气压缩为液氧,是因为分子间的间隔变小;湿衣服在太阳下容易晒干,是因为阳光下温度高,温度越高,水分子的运动速率越快;过氧化氢与水的元素组成相同而性质不同,是因为它们的分子构成不同。
5.A 解析:焚烧秸秆就地取肥,会产生有害气体和烟尘,污染环境,不利于环境保护。
6.D 解析:氧原子的最外层电子数是6,多于4,在化学反应中易得到2个电子而形成阴离子。
7.B 解析:物质是由元素组成的,虽然元素的种类是有限的,但由元素组成的物质种类是繁多的;同种元素的原子核内质子数和中子数不一定相等,例如碳-12、碳-13、碳-14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等;原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量;元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变。
8.C 解析:实验前一定要检查装置气密性,以防止装置漏气影响实验结果;加热后,红色固体逐渐变成黑色,是因为加热时铜和氧气反应生成黑色固体氧化铜;氧气约占空气总体积的五分之一。装置冷却至室温,打开弹簧夹,注射器活塞应停留在10 mL-30 mL×=4 mL处;铜要足量,目的是把氧气耗尽。
9.C 解析:原子核由质子和中子构成,模型中质子不在原子核内;纯净物包括化合物和单质,模型中化合物没包括在纯净物中;按体积计算,空气由78%N2和21%O2还有1%其他成分组成,模型描述与事实相符;地壳中元素含量前四位的是氧、硅、铝、铁。
10.B 解析:为了实验准确,通电前应将玻璃管内空气排尽,A正确;结合气体密度不能计算出氢、氧原子个数比,B错误;电解水产生氢气和氧气,将电能转化为了化学能,C正确;正、负极均能观察到有无色气泡产生,负极产生的气体体积多,速率快,正极产生的气体体积少,速率慢,D正确。
11.A 解析:钠原子失去最外层的一个电子形成钠离子,它们核电荷数相同,但钠原子最外层电子数为1,不稳定,而钠离子最外层电子数为8,相对稳定,它们化学性质不相似。熔点、密度不需要通过化学变化就能表现出来,是物理性质;可燃性、稳定性需要通过化学变化表现出来,是化学性质。稀有气体用于霓虹灯,因为通电时稀有气体发出不同颜色的光。分子是由原子构成的,所以氧分子是由氧原子构成的。
12.D 解析:氯酸钾不是氧化物,故A错误;钢为混合物,故B错误;冰水混合物为纯净物,故C错误;液态氧为单质,干冰为氧化物,空气为混合物,故D正确。
13.B 解析:最外层电子数为8的粒子不一定是稀有气体的原子,如镁离子,A正确;同种元素的质子数一定相等,中子数不一定相等,例如碳原子有碳-12(6质子、6中子),碳-13(6质子、7中子),B错误;元素周期表是按照原子序数依次增大的顺序排列起来的,原子序数即原子核电荷数,C正确;在物质发生化学变化时,原子的种类不变,元素的种类也不会改变,D正确。故选B。
14.D 解析:②③的质子数不同,属于不同种元素; ②④的最外层电子数相同,化学性质相似; ②的质子数=电子数=13,表示铝原子,符号为Al; ①原子的最外层电子数是1,小于4,在化学反应中易失去电子,③原子的最外层电子数是7,大于4,在化学反应中容易得到电子。
15.D 解析:单质一定是由同种元素组成的,但是由同种元素组成的物质不一定是单质,例如氧气和臭氧的混合物,是由一种元素组成的混合物,A错误;分子、原子可以构成物质,但物质不一定都是由分子、原子构成的,离子也可以构成物质,如氯化钠是由钠离子和氯离子构成的,B错误;Na+、Cl-的最外层电子数均为8,但最外层电子数为8的粒子不一定都是离子,也有可能是原子,如氖原子最外层电子数也为8,C错误;化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物,D正确。故选D。
16.(1)①Cl ②2Fe ③Mg2+ (2)①分子
②元素 ③原子 原子 ④离子
(3)氮分子 C (4)质子数等于电子数,正电荷数等于负电荷数
17.(1)氮 13 (2)S 三 (3)最外层电子数
18.(1)BC D A C
(2)组成元素的种类
19.(1)水氢气+氧气 (2)1∶2
(3)燃着的木条 气体燃烧,产生淡蓝色火焰
(4)8∶1 (5)2∶1 (6)①装置的气密性良好(合理即可) ②水分子分成氢原子和氧原子,氢原子和氧原子再重新组合成新的分子
③合成 元素的种类
解析:(2)实验中观察到的现象:正负两极上都有气泡产生且气体体积比约为1∶2。(3)切断装置中的电源,用燃着的木条分别在两个尖嘴口检验电解水产生的气体,由于b管收集的气体较多,是氢气,氢气可以燃烧,所以观察到b管现象是气体燃烧,产生淡蓝色火焰。(4)设生成氢气的体积为2 L,则生成氧气的体积为1 L,设氢气的密度为x g/L,则氧气的密度为16x g/L,则生成的氧气和氢气的质量比为(1 L×16x g/L)∶(2 L×x g/L)=8∶1。(5)假设氢气的质量为1份质量,则氧气的质量为8份质量,则水中氢、氧原子个数比约为∶=2∶1。(6)反应中要收集气体,所以要注意装置的气密性良好;电解水的微观实质:水分子分成氢原子和氧原子,氢原子和氧原子再重新组合成新的分子。
20.(1)红磷+氧气五氧化二磷
(2)③冷却至室温
(3)红磷不足(合理即可)
(4) 氮气(或N2)
21.解:(1)该原子的相对原子质量为
≈52。
(2)设该原子的质子数为x,则其中子数为x+4,由相对原子质量=质子数+中子数得,52=x+x+4,则x=24。原子中核电荷数=核内质子数=核外电子数,则该原子的核外电子数为24。
答:(1)该原子的相对原子质量为52。(2)该原子的核外电子数为24。
(满分:100分 时间:60分钟)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.吉林雾凇,北国盛景。空气成分中与雾凇形成有关的是 ( )
A.水蒸气 B.二氧化碳 C.氧气 D.氮气
2.(2024福建中考)生活中常接触到“加铁酱油”“含氟牙膏”等用品,这里的铁、氟指的是 ( )
A.单质 B.元素 C.原子 D.分子
3.国家正在深入推进环境污染防治,持续深入打好蓝天、碧水、净土三大保卫战。空气是一种宝贵的资源,下列有关空气的说法不正确的是 ( )
A.稀有气体在通电时能发光,可制成霓虹灯
B.空气中含有氧气,氧气的体积分数约为78%
C.空气中氮气化学性质不活泼,可用作食品防腐的保护气
D.目前计入空气污染指数的有害气体主要包括SO2、CO、NO2、O3等
4.下列事实从微观角度来解释,其中不正确的是 ( )
A.电解水实验生成氢气和氧气——分子种类发生改变
B.氧气压缩为液氧——氧分子的体积变小
C.湿衣服在太阳下容易晒干——温度越高,水分子的运动速率越快
D.过氧化氢与水的元素组成相同而性质不同——分子构成不同
5.2024年3月1日生态环境部发布2024年六五环境日主题为“全面推进美丽中国建设”。下列做法不符合该主题的是 ( )
A.鼓励焚烧秸秆就地取肥 B.推广使用新能源汽车
C.建设城市湿地公园 D.提倡回收废旧电池
6.(2024哈尔滨中考)依据所学知识及图示所示信息判断,下列叙述错误的是 ( )
A.氧元素的相对原子质量为16.00
B.1个氧原子含有8个质子
C.氧元素的符号是O
D.氧原子在化学变化中易失去电子
7.(2024烟台中考)元素观、微粒观是重要的化学观念。下列有关说法错误的是 ( )
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核的体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
8.化学兴趣小组同学按如图所示装置测定空气中氧气的含量:选用容积30 mL的试管作反应容器,将注射器活塞置于10 mL刻度处,并用弹簧夹夹紧橡皮管。下列有关说法错误的是 ( )
A.实验前一定要检查装置气密性
B.加热后,红色固体逐渐变成黑色
C.装置冷却至室温,打开弹簧夹,注射器活塞应停留在2 mL处
D.实验中铜粉一定要足量
9.建立模型是学习化学的重要方法,下列有关模型正确的是 ( )
A.原子结构模型 B.物质分类模型 C.空气组成模型 D.地壳中元素含量模型
10.电解水反应一段时间后,用燃着的木条检验生成的气体,记录的现象如表。下列说法错误的是 ( )
两电极 正极端的玻璃管 负极端的玻璃管
现象 有气泡 体积为5.15 mL,木条燃得更旺 体积为10.38 mL,气体燃烧
A.通电前应将玻璃管内空气排尽
B.结合气体密度可计算水中氢、氧原子个数比
C.电解过程中电能转化为化学能
D.两电极产生气泡的速率不相同
11.科学思维是化学核心素养的重要组成部分,下列示例说法不正确的是 ( )
A.比较:钠原子(Na)和钠离子(Na+)核电荷数相同,化学性质相似
B.分类:熔点、密度是物理性质,可燃性、稳定性是化学性质
C.分析:稀有气体用于霓虹灯,因为通电时稀有气体发出不同颜色的光
D.推理:分子是由原子构成的,所以氧分子是由氧原子构成的
12.下列各组物质,按单质、氧化物、混合物顺序排列的是 ( )
A.石墨、氯酸钾、石油 B.钢、氧化镁、铁锈
C.臭氧、二氧化硫、冰水混合物 D.液态氧、干冰、空气
13.元素观、微粒观是化学的重要观念。下列有关元素和微观粒子的说法不正确的是 ( )
A.最外层电子数为8的粒子不一定是稀有气体原子
B.同种元素的原子核内质子数与中子数一定相等
C.元素的原子序数与该元素原子核电荷数在数值上相同
D.在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
14.(2025清远月考)如图是4种粒子的结构示意图,下列说法不正确的是 ( )
A.②③属于不同种元素
B.②④的化学性质相似
C.②的符号为Al
D.①③原子都容易得到电子
15.(2025德州武城县期中)推理是化学学习的一种方法,以下推理正确的是 ( )
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.分子、原子可以构成物质,所以物质一定是由分子、原子构成的
C.Na+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
D.化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
二、填空题(本题共4小题,共36分)
16.(11分)按要求填空。
(1)用化学符号填空。
①氯元素 ;②两个铁原子 ;③镁离子 。
(2)用“元素”“分子”“原子”“离子”填空。
①保持水的化学性质的是水 ;
②二氧化碳是由碳、氧两种 组成的;
③镁燃烧的反应中的最小微观粒子是镁 和氧 ;
④氯化钠是由 构成的物质。
(3)从微观角度:用“”表示氮原子,“”表示氧原子。
①用“”可表示的微观粒子是 (填名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,可表示空气微观模型的是 (填字母)。
(4)原子不显电性,是因为原子中 。
17.(5分)元素周期表是学习化学的重要工具。下表是元素周期表中的一部分,请回答下列问题:
(1)表中①所示元素的名称是 ,地壳中含量最多的金属元素的原子序数是 。
(2)X2-与Ar的核外电子排布相同,则X的元素符号是 ,它在元素周期表中位于第 周期。
(3)元素周期表中同族和同周期元素具有一定的相似性和变化规律,同族元素化学性质相似的原因是 相同。
18.(10分)如图所示,A、B、C、D每瓶气体中,“”“”“”“”代表不同原子,现对A、B、C、D四瓶气体进行如下分类,回答下列问题:
(1)属于①的是 (填字母,下同);属于②的是 ;属于③的是 ;属于稀有气体的可能是 。
(2)上述将纯净物分类成①和②,这种分类依据是 。
19.(10分)同学们用如图所示的实验,在体验科学家们探究水的组成的历程。
(1)电解水发生反应的文字表达式为 。
(2)实验中观察到的现象:正负两极上都有气泡产生且气体体积比约为 。
(3)切断装置中的电源,用 分别在两个尖嘴口检验电解水产生的气体,观察到b管现象是 。
(4)通过检验确定水的元素组成后,同学们查阅资料得知,相同条件下,氧气密度是氢气密度的16倍,可以根据体积和密度计算得出氧气和氢气的质量比约为 。
(5)老师提示:质量除相对原子质量的比值,就是原子个数比。大家经过计算,得出水中氢、氧原子个数比约为 ,恍然大悟,物质的化学式原来都是用精确的实验测定的。
(6)问题与交流:
①为保证实验的成功,你认为需要注意什么 请写出一条: 。
②请描述电解水的微观实质: 。
③该实验是将被探究的物质水作为反应物,通过分解反应探究水的组成,除此之外还可以将水作为生成物,通过 化合物探究水的组成。两种方法的依据:化学反应前后 不变。
三、实验题(本题共1小题,共10分)
20.某实验小组用图1所示装置测定空气中氧气的含量。
【实验原理】
(1)图1是利用红磷燃烧消耗瓶内氧气,导致瓶内气压减小,水进入集气瓶,进入瓶内的水的体积即为空气中氧气的体积。红磷燃烧的文字表达式为 。
【实验过程】
(2)①用弹簧夹夹紧橡皮管。
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞。
③等 ,打开弹簧夹。
④观察并记录水面的变化情况。
【实验结果】
(3)多次实验发现集气瓶内上升的水面始终低于预想的高度,其可能的原因是 。
【拓展探究】
(4)小组同学利用图2装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开弹簧夹。如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 ,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中除了氧气外,一定有 。
四、计算题(本题共1小题,共9分)
21.已知碳原子(碳-12)的质量为1.99×10-26 kg。某原子的质量为8.6×10-26 kg,且该原子核内中子数比质子数多4个。
求:(1)该原子的相对原子质量(保留整数)。
(2)该原子的核外电子数。
【详解答案】
1.A
2.B
3.B 解析:空气中含有氧气,氧气的体积分数约为21%。
4.B 解析:电解水实验生成氢气和氧气,水分子分成氢原子和氧原子,氢原子与氧原子重新结合成氢分子和氧分子,分子种类发生了改变;氧气压缩为液氧,是因为分子间的间隔变小;湿衣服在太阳下容易晒干,是因为阳光下温度高,温度越高,水分子的运动速率越快;过氧化氢与水的元素组成相同而性质不同,是因为它们的分子构成不同。
5.A 解析:焚烧秸秆就地取肥,会产生有害气体和烟尘,污染环境,不利于环境保护。
6.D 解析:氧原子的最外层电子数是6,多于4,在化学反应中易得到2个电子而形成阴离子。
7.B 解析:物质是由元素组成的,虽然元素的种类是有限的,但由元素组成的物质种类是繁多的;同种元素的原子核内质子数和中子数不一定相等,例如碳-12、碳-13、碳-14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等;原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量;元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变。
8.C 解析:实验前一定要检查装置气密性,以防止装置漏气影响实验结果;加热后,红色固体逐渐变成黑色,是因为加热时铜和氧气反应生成黑色固体氧化铜;氧气约占空气总体积的五分之一。装置冷却至室温,打开弹簧夹,注射器活塞应停留在10 mL-30 mL×=4 mL处;铜要足量,目的是把氧气耗尽。
9.C 解析:原子核由质子和中子构成,模型中质子不在原子核内;纯净物包括化合物和单质,模型中化合物没包括在纯净物中;按体积计算,空气由78%N2和21%O2还有1%其他成分组成,模型描述与事实相符;地壳中元素含量前四位的是氧、硅、铝、铁。
10.B 解析:为了实验准确,通电前应将玻璃管内空气排尽,A正确;结合气体密度不能计算出氢、氧原子个数比,B错误;电解水产生氢气和氧气,将电能转化为了化学能,C正确;正、负极均能观察到有无色气泡产生,负极产生的气体体积多,速率快,正极产生的气体体积少,速率慢,D正确。
11.A 解析:钠原子失去最外层的一个电子形成钠离子,它们核电荷数相同,但钠原子最外层电子数为1,不稳定,而钠离子最外层电子数为8,相对稳定,它们化学性质不相似。熔点、密度不需要通过化学变化就能表现出来,是物理性质;可燃性、稳定性需要通过化学变化表现出来,是化学性质。稀有气体用于霓虹灯,因为通电时稀有气体发出不同颜色的光。分子是由原子构成的,所以氧分子是由氧原子构成的。
12.D 解析:氯酸钾不是氧化物,故A错误;钢为混合物,故B错误;冰水混合物为纯净物,故C错误;液态氧为单质,干冰为氧化物,空气为混合物,故D正确。
13.B 解析:最外层电子数为8的粒子不一定是稀有气体的原子,如镁离子,A正确;同种元素的质子数一定相等,中子数不一定相等,例如碳原子有碳-12(6质子、6中子),碳-13(6质子、7中子),B错误;元素周期表是按照原子序数依次增大的顺序排列起来的,原子序数即原子核电荷数,C正确;在物质发生化学变化时,原子的种类不变,元素的种类也不会改变,D正确。故选B。
14.D 解析:②③的质子数不同,属于不同种元素; ②④的最外层电子数相同,化学性质相似; ②的质子数=电子数=13,表示铝原子,符号为Al; ①原子的最外层电子数是1,小于4,在化学反应中易失去电子,③原子的最外层电子数是7,大于4,在化学反应中容易得到电子。
15.D 解析:单质一定是由同种元素组成的,但是由同种元素组成的物质不一定是单质,例如氧气和臭氧的混合物,是由一种元素组成的混合物,A错误;分子、原子可以构成物质,但物质不一定都是由分子、原子构成的,离子也可以构成物质,如氯化钠是由钠离子和氯离子构成的,B错误;Na+、Cl-的最外层电子数均为8,但最外层电子数为8的粒子不一定都是离子,也有可能是原子,如氖原子最外层电子数也为8,C错误;化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物,D正确。故选D。
16.(1)①Cl ②2Fe ③Mg2+ (2)①分子
②元素 ③原子 原子 ④离子
(3)氮分子 C (4)质子数等于电子数,正电荷数等于负电荷数
17.(1)氮 13 (2)S 三 (3)最外层电子数
18.(1)BC D A C
(2)组成元素的种类
19.(1)水氢气+氧气 (2)1∶2
(3)燃着的木条 气体燃烧,产生淡蓝色火焰
(4)8∶1 (5)2∶1 (6)①装置的气密性良好(合理即可) ②水分子分成氢原子和氧原子,氢原子和氧原子再重新组合成新的分子
③合成 元素的种类
解析:(2)实验中观察到的现象:正负两极上都有气泡产生且气体体积比约为1∶2。(3)切断装置中的电源,用燃着的木条分别在两个尖嘴口检验电解水产生的气体,由于b管收集的气体较多,是氢气,氢气可以燃烧,所以观察到b管现象是气体燃烧,产生淡蓝色火焰。(4)设生成氢气的体积为2 L,则生成氧气的体积为1 L,设氢气的密度为x g/L,则氧气的密度为16x g/L,则生成的氧气和氢气的质量比为(1 L×16x g/L)∶(2 L×x g/L)=8∶1。(5)假设氢气的质量为1份质量,则氧气的质量为8份质量,则水中氢、氧原子个数比约为∶=2∶1。(6)反应中要收集气体,所以要注意装置的气密性良好;电解水的微观实质:水分子分成氢原子和氧原子,氢原子和氧原子再重新组合成新的分子。
20.(1)红磷+氧气五氧化二磷
(2)③冷却至室温
(3)红磷不足(合理即可)
(4) 氮气(或N2)
21.解:(1)该原子的相对原子质量为
≈52。
(2)设该原子的质子数为x,则其中子数为x+4,由相对原子质量=质子数+中子数得,52=x+x+4,则x=24。原子中核电荷数=核内质子数=核外电子数,则该原子的核外电子数为24。
答:(1)该原子的相对原子质量为52。(2)该原子的核外电子数为24。
同课章节目录
