第四单元 化学式与化学方程式 练习 (含答案)2025-2026学年化学科粤版九年级上册
文档属性
| 名称 | 第四单元 化学式与化学方程式 练习 (含答案)2025-2026学年化学科粤版九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 224.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 15:49:29 | ||
图片预览



文档简介
第四单元 化学式与化学方程式
(满分:100分 时间:60分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Al—27 Cu—64
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.空间站的备用氧气,通常利用分解高氯酸锂(LiClO4)来制取,在高氯酸锂中锂元素的化合价为+1,则氯元素的化合价为 ( )
A.+1 B.+4 C.+7 D.+8
2.铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此可以推测铜生锈的条件为 ( )
A.H2O和O2 B.CO2、H2O和O2
C.CO2和O2 D.CO2、N2和H2O
3.物质名称和相应化学式的书写正确的是 ( )
A.氦气:He2 B.氧化铝:AlO C.氯化镁:MgCl2 D.碳酸钠:NaCO3
4.下列现象能用质量守恒定律解释的是 ( )
A.10 g NaCl溶解在90 g水中,成为100 g溶液
B.100 g干冰完全汽化成100 g气体
C.酒精燃烧后,什么都没有了
D.2 g氢气和2 g氧气混合得4 g气体
5.对于化学方程式3Fe+2O2Fe3O4,理解错误的是 ( )
A.3个铁和2个氧气在点燃的条件下,生成1个四氧化三铁
B.铁和氧气在点燃的条件下生成四氧化三铁
C.该反应中铁、氧气和四氧化三铁的微观粒子数目比为3∶2∶1
D.该反应中铁、氧气和四氧化三铁三种物质的质量比为21∶8∶29
6.(2024重庆A中考)中医认为艾草具有抗菌消炎、镇定止咳等功效。蓝桉醇(C15H26O)为艾草的一种成分,下列对蓝桉醇的说法正确的是 ( )
A.是一种氧化物 B.由三种元素组成
C.由42个原子构成 D.氢元素质量分数最高
7.(2024徐州中考)为了实现碳的资源化利用,我国科学家用纳米镍粒子作催化剂将二氧化碳合成甲烷,反应的化学方程式为CO2+4H2CH4+2X。下列说法正确的是 ( )
A.X的化学式为H2O2 B.甲烷中碳、氢元素的质量比为3∶1
C.反应前后分子的数目不变 D.参加反应的CO2和H2的质量比为22∶1
8.(2024西藏中考)化学用语是学习化学的重要工具。下列化学用语与含义相符的是 ( )
A.O2-:表示2个氧原子 B.2Al:表示2个铝元素
C.7SO2:表示7个二氧化硫 D.O5:表示五氧化二磷中磷元素的化合价为+5
9.下列指定反应的化学方程式正确的是 ( )
A.磷在氧气中燃烧:P+O2P2O5
B.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
C.高锰酸钾受热分解:2KMnO4K2MnO4+O2↑
D.绿色植物的光合作用:6CO2+6H2OC6H12O6+6O2
10.下列涉及化学观念的有关说法正确的是 ( )
A.根据微粒观:一个N2分子是由2个氮原子构成的
B.根据守恒观:100 g酒精+100 g水,总质量等于200 g,符合质量守恒定律
C.根据元素观:聚乙烯燃烧生成二氧化碳和水,推知聚乙烯一定由碳、氢、氧元素组成
D.根据结构观:氦原子和镁原子的最外层电子数相同,因此它们化学性质也相同
11.(2024·广东中考)我国科学家利用光催化技术实现了绿色制取H2O2,反应的微观示意图如图所示。下列说法正确的是 ( )
A.反应后氧原子个数减少
B.反应后催化剂的质量增加
C.b的化学式为H2O
D.参加反应的a、b分子个数比为1∶1
12.(2024陕西中考)乙烯(C2H4)与丙烯(C3H6)是两种重要的化工原料。对于质量相同的二者,下列说法正确的是 ( )
A.所含分子种类相同 B.所含分子数目相同
C.每个分子中所含原子数目相同 D.完全燃烧消耗氧气的质量相同
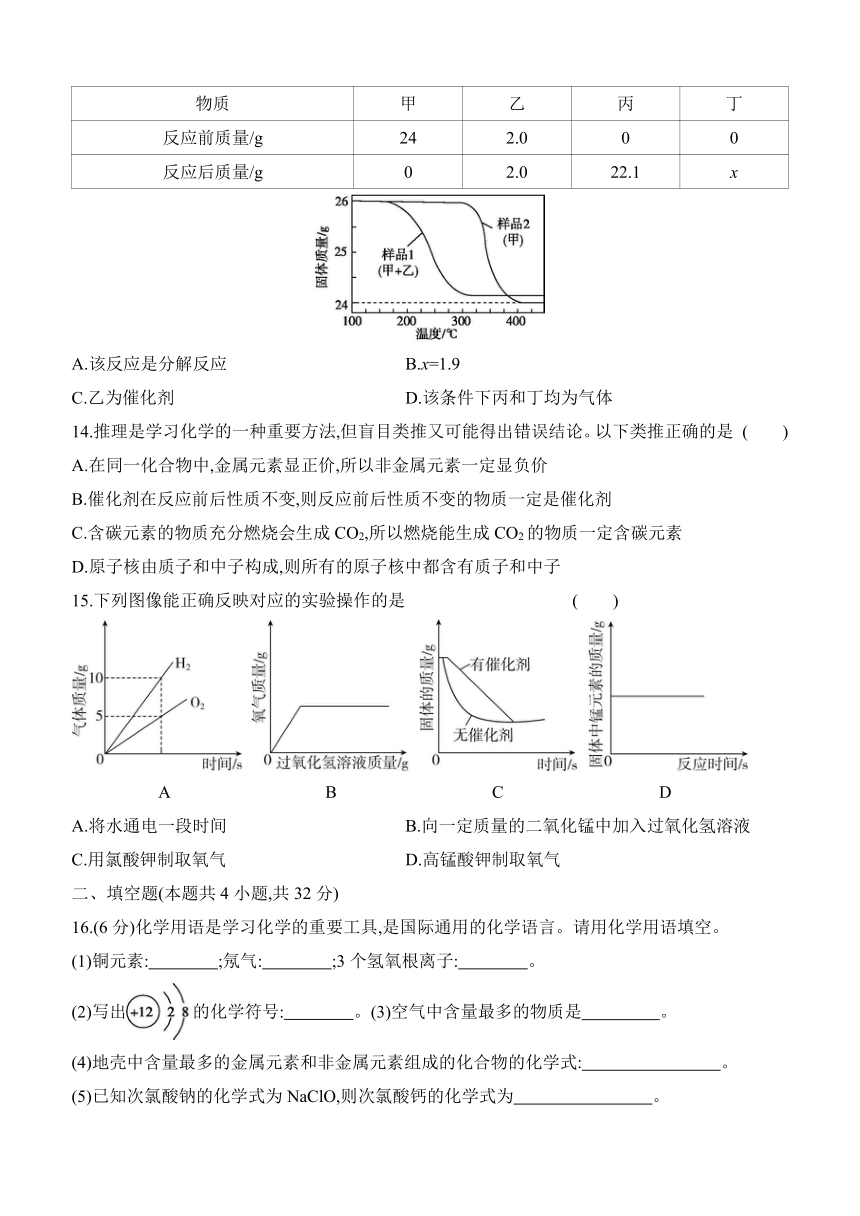
13.分别加热等质量的两种样品,固体质量随温度变化的曲线如图所示。样品1反应前后各物质的质量如表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同。下列说法错误的是 ( )
物质 甲 乙 丙 丁
反应前质量/g 24 2.0 0 0
反应后质量/g 0 2.0 22.1 x
A.该反应是分解反应 B.x=1.9
C.乙为催化剂 D.该条件下丙和丁均为气体
14.推理是学习化学的一种重要方法,但盲目类推又可能得出错误结论。以下类推正确的是 ( )
A.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
B.催化剂在反应前后性质不变,则反应前后性质不变的物质一定是催化剂
C.含碳元素的物质充分燃烧会生成CO2,所以燃烧能生成CO2的物质一定含碳元素
D.原子核由质子和中子构成,则所有的原子核中都含有质子和中子
15.下列图像能正确反映对应的实验操作的是 ( )
A B C D
A.将水通电一段时间 B.向一定质量的二氧化锰中加入过氧化氢溶液
C.用氯酸钾制取氧气 D.高锰酸钾制取氧气
二、填空题(本题共4小题,共32分)
16.(6分)化学用语是学习化学的重要工具,是国际通用的化学语言。请用化学用语填空。
(1)铜元素: ;氖气: ;3个氢氧根离子: 。
(2)写出的化学符号: 。(3)空气中含量最多的物质是 。
(4)地壳中含量最多的金属元素和非金属元素组成的化合物的化学式: 。
(5)已知次氯酸钠的化学式为NaClO,则次氯酸钙的化学式为 。
17.(6分)北斗卫星导航系统(以下简称北斗系统)是我国自主建设运行的全球卫星导航系统,为服务全球、造福人类贡献了中国智慧和力量。
(1)北斗系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的结构示意图如图1所示,铷的相对原子质量为 。
(2)图1中n= ;铷离子的符号为 。
(3)图2中与铷元素化学性质相似的元素是 (填元素符号)。
(4)E元素位于第 周期,与地壳中含量最多的非金属元素形成的化学式为 。
18.(8分)在物质的宏观、微观和符号之间建立联系是化学学科的特点。如图为高温下某反应的微观示意图,根据图示回答下列问题:
(1)该反应前后,共有 种氧化物。
(2)反应生成的两种物质的分子个数比为 。
(3)该反应前后没有发生变化的是 (填“分子”或“原子”)。
(4)该反应的化学方程式为 。
19.(12分)春晚《满庭芳·国色》节目点燃了国人复古寻色的热潮。其中桃红、凝脂、缃叶、群青、沉香代表红、白、黄、青、黑传统五色。
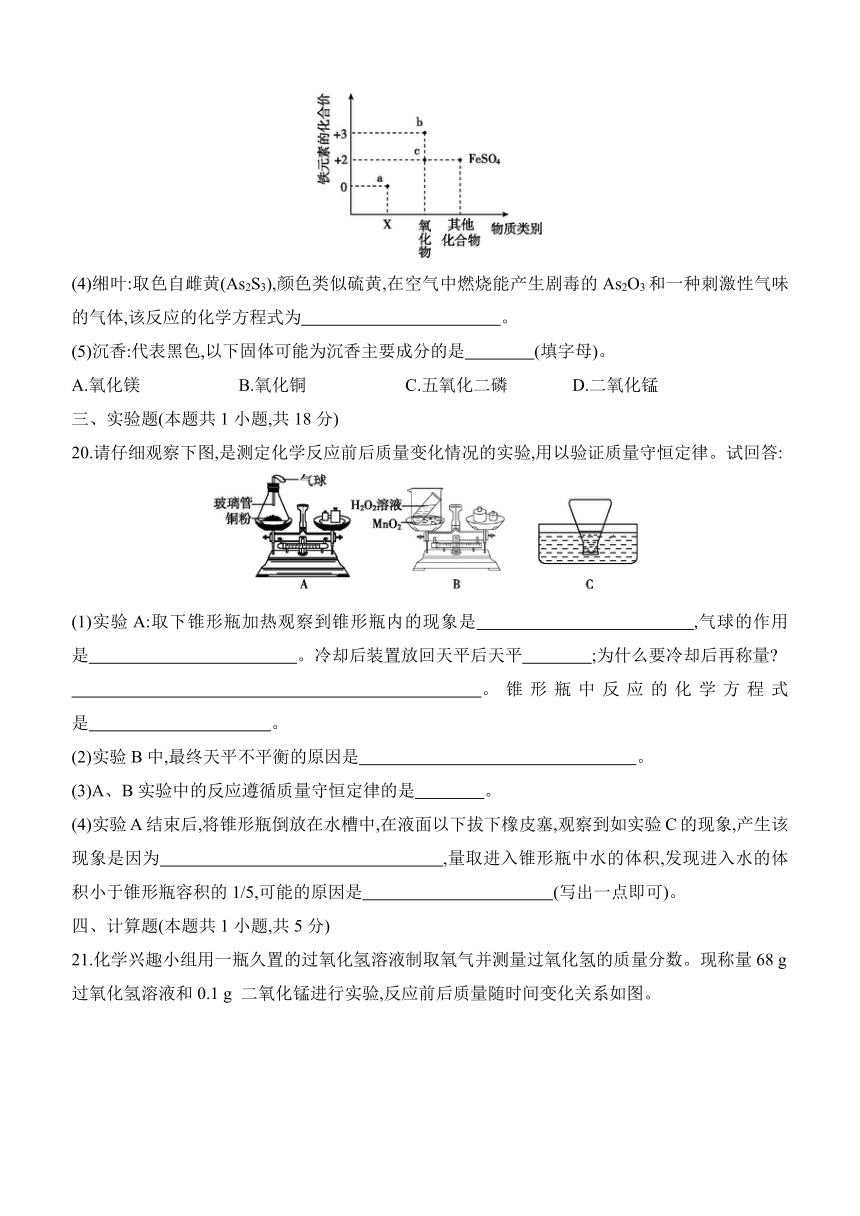
(1)群青:是一种品贵的高级颜料。青金石中含Na、Al、Si、S、Cl、O等元素,从原子结构的角度说明,这些元素最根本的区别是 不同,其中属于金属元素的有 、 (填元素名称)。其中+4价硅元素形成的氧化物化学式是 。
(2)桃红:用银朱调和,可以得到灿若桃花的颜色。银朱是用硫与汞加热制成的硫化汞,反应前后不变的微观粒子是 、 (填化学符号),写出反应的化学方程式: 。
(3)凝脂:降低原料中含铁氧化物含量,实现从青瓷到凝脂似玉的白瓷。如图为铁元素的价类二维图,a点表示物质的类别是 ,写出b点物质的化学式: ,硫酸亚铁中阳离子符号: 。
(4)缃叶:取色自雌黄(As2S3),颜色类似硫黄,在空气中燃烧能产生剧毒的As2O3和一种刺激性气味的气体,该反应的化学方程式为 。
(5)沉香:代表黑色,以下固体可能为沉香主要成分的是 (填字母)。
A.氧化镁 B.氧化铜 C.五氧化二磷 D.二氧化锰
三、实验题(本题共1小题,共18分)
20.请仔细观察下图,是测定化学反应前后质量变化情况的实验,用以验证质量守恒定律。试回答:
(1)实验A:取下锥形瓶加热观察到锥形瓶内的现象是 ,气球的作用是 。冷却后装置放回天平后天平 ;为什么要冷却后再称量
。锥形瓶中反应的化学方程式是 。
(2)实验B中,最终天平不平衡的原因是 。
(3)A、B实验中的反应遵循质量守恒定律的是 。
(4)实验A结束后,将锥形瓶倒放在水槽中,在液面以下拔下橡皮塞,观察到如实验C的现象,产生该现象是因为 ,量取进入锥形瓶中水的体积,发现进入水的体积小于锥形瓶容积的1/5,可能的原因是 (写出一点即可)。
四、计算题(本题共1小题,共5分)
21.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量68 g过氧化氢溶液和0.1 g 二氧化锰进行实验,反应前后质量随时间变化关系如图。
计算:(1)制得氧气的质量是 g。
(2)由反应图线可知,随着反应的进行,反应速率逐渐减小,你认为可能的原因是 。
(3)计算参加反应的过氧化氢质量是多少
【详解答案】
1.C
2.B
3.C 解析:氦气是由原子直接构成的,表示为He;在氧化铝中,铝元素显+3价,氧元素显-2价,化学式为Al2O3;在氯化镁中,镁元素显+2价,氯元素显-1价,化学式为MgCl2; 碳酸钠中,钠元素化合价为+1,碳酸根化合价为-2,则化学式为Na2CO3。
4.C 解析:10 g NaCl溶解在90 g水中,成为100 g溶液,没有新物质生成,100 g干冰完全汽化成100 g气体,没有新物质生成,氢气和氧气混合,没有新物质生成,均属于物理变化,不能用质量守恒定律解释;酒精燃烧生成二氧化碳和水,有新物质生成,属于化学变化,燃烧过程中生成的二氧化碳和水蒸气逸散到了空气中,所以“什么都没有了”,能用质量守恒定律解释。
5.A
6.B 解析:氧化物是由两种元素组成,其中一种元素是氧元素的化合物,蓝桉醇是由三种元素组成的,不属于氧化物;由化学式可知,蓝桉醇是由碳、氢、氧三种元素组成的;蓝桉醇是由蓝桉醇分子构成的,一个蓝桉醇分子是由15个碳原子、26个氢原子和1个氧原子,共42个原子构成的;蓝桉醇中碳、氢、氧三种元素的质量比为(12×15)∶(1×26)∶16=90∶13∶8,所以碳元素质量分数最高。
7.B 解析:由反应的化学方程式CO2+4H2CH4+2X可知,反应前碳、氢、氧原子个数分别为1、8、2,反应后的生成物中碳、氢、氧原子个数分别为1、4、0,根据化学反应前后原子种类、数目不变,则2X分子中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O;甲烷中碳、氢元素的质量比为12∶(1×4)=3∶1; 微观上,该反应是1个二氧化碳分子和4个氢分子反应生成1个甲烷分子和2个水分子,反应前后分子的数目减少; 参加反应的CO2和H2的质量比为44∶(2×4)=11∶2。
8.D 解析:O2-表示1个氧离子; 元素符号前出现数字表示几个原子,故2Al表示2个铝原子; 由分子构成的物质,其化学式前出现数字表示几个分子,故7SO2表示7个二氧化硫分子。
9.D 解析:A.磷在氧气中燃烧生成五氧化二磷,该反应的化学方程式为4P+5O22P2O5,错误;B.铁丝在氧气中燃烧,该反应的化学方程式为3Fe+2O2Fe3O4,错误;C.高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑,错误;D.绿色植物光合作用,是二氧化碳和水在光照和叶绿素的作用下反应生成葡萄糖和氧气,该反应的化学方程式为6CO2+6H2OC6H12O6+6O2,正确。故选D。
10.A 解析:酒精和水混合没有发生化学变化,不能用质量守恒定律解释,B错误;根据化学反应前后元素种类不变,可推知聚乙烯中一定含有氢、碳元素,可能含有氧元素,C错误;氦原子最外层有2个电子,但是第一层为稳定结构,镁原子最外层两个电子,容易失去,二者化学性质不同,D错误。
11.C 解析:根据质量守恒定律,反应前后原子种类和数目不变,则反应后氧原子个数不变,故A错误;在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫作催化剂,则反应后催化剂的质量不变,故B错误;由题图可知,一个b分子是由一个氧原子和两个氢原子构成的,则b的化学式为H2O,故C正确;由题图可知,氧气和水在催化剂的作用下反应生成过氧化氢,化学方程式:O2+2H2O2H2O2,则参加反应的a、b分子个数比为1∶2,故D错误。
12.D 解析:乙烯是由乙烯分子构成的,丙烯是由丙烯分子构成的,质量相同的二者,所含分子种类不相同;乙烯的相对分子质量为12×2+1×4=28,丙烯的相对分子质量为12×3+1×6=42,相同质量的物质,其分子的数目与相对分子质量成反比,相对分子质量越大,气体含有的分子数越少,则质量相同的二者,所含分子数目不相同,质量相同的乙烯比丙烯所含分子数目多;每个乙烯分子中含有2+4=6个原子,每个丙烯分子中含有3+6=9个原子,则每个分子中所含原子数目不相同;乙烯的化学式为C2H4,丙烯的化学式为C3H6,二者最简式都是CH2,故质量相同的二者,完全燃烧消耗氧气的质量相同。
13.D 解析:该反应是甲在加热的条件下生成丙和丁,符合“一变多”的特点,属于分解反应; 由题表中数据可知,x=24+2.0+0+0-0-2.0-22.1=1.9;由题表中数据可知,反应前后乙的质量不变,对比样品1、2的曲线可知,相同温度,样品1固体质量减少更快,即加入乙反应速率更快,分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同,说明乙的化学性质不变,则乙是催化剂; 乙是催化剂,反应前后质量和化学性质不变,由题图可知,加热样品1后,固体质量减少,最后质量大于2 g,则生成物中有气体,有固体。
14.C 解析:在同一化合物中,金属元素显正价,但是非金属元素不一定显负价,比如氯酸钾中,钾元素显+1价,氯元素显+5价,A错误;催化剂反应前后化学性质不变,B错误;根据质量守恒定律反应前后元素种类不变,含碳元素的物质充分燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素,C正确;原子核由质子和中子构成,但并不是所有的原子核中都含有质子和中子,比如有一种氢原子的原子核中不含中子,D错误。
15.D 解析:通电分解水,生成氢气和氧气的体积(而不是质量)之比为2∶1,A错误;过氧化氢在二氧化锰的催化作用下分解为水和氧气,在该反应中二氧化锰是催化剂,反应前后二氧化锰的质量和化学性质不变,随着过氧化氢溶液的不断加入,生成氧气的质量逐渐增大,B错误;用氯酸钾制取氧气,有催化剂的反应速率快,固体的质量减少得快,化学反应前后,催化剂的质量和化学性质不变,最后有催化剂的剩余固体的质量多,C错误;高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,根据质量守恒定律,化学反应前后,元素的种类和质量不变,则固体中锰元素的质量不变,D正确。
16.(1)Cu Ne 3OH- (2)Mg2+
(3)N2 (4)Al2O3 (5)Ca(ClO)2
17.(1)85.47 (2)1 Rb+ (3)Na
(4)三 Al2O3
解析:(2)元素信息示意图左上角的数字表示原子序数,根据题图1,铷的原子序数为37。原子的核外电子数等于原子序数,则n=1。(3)一般来说,微观粒子的最外层电子数相等,化学性质相似。铷原子的最外层电子数为1,根据题图2,A、B、C、D、E的最外层电子数分别是1、7、8、1、8,且铷属于金属元素,D(氢原子)属于非金属元素,则题图2中与铷元素化学性质相似的元素是A,A的质子数为11,属于钠元素。(4)E的质子数为13,原子的质子数等于核外电子数,则E处于原子状态下时核外电子数为13,核外电子排布为2、8、3,有3个电子层,原子的核外电子层数等于对应元素的周期数,因此E元素位于第三周期;E的质子数为13,属于铝元素,地壳中含量前五的元素由高到低依次为氧、硅、铝、铁、钙,则地壳中含量最多的非金属元素是氧元素,铝元素与氧元素形成的化合物是氧化铝;化合物中元素正负化合价之和为零,氧化铝中氧元素显-2价,铝元素显+3价,设氧化铝的化学式为AlxOy,则(+3)x+(-2)y=0,解得x∶y=2∶3,化学式为Al2O3。
18.(1)2 (2)1∶1 (3)原子
(4)C+H2OCO+H2
19.(1)质子数 钠 铝 SiO2 (2)Hg S
Hg+SHgS
(3)单质 Fe2O3 Fe2+ (4)2As2S3+9O22As2O3+6SO2 (5)BD
20.(1)红色固体逐渐变为黑色,气球胀大 平衡锥形瓶中的气压,防止锥形瓶中气压过大,冲开橡皮塞 平衡 气球变大,产生浮力,影响称量的结果 2Cu+O22CuO
(2)过氧化氢分解生成氧气,氧气逸散到空气中,使得总质量减小
(3)AB
(4)锥形瓶中氧气被消耗,恢复至室温气压减小,小于大气压,水在大气压作用下压入锥形瓶 铜粉的量不足(合理即可)
21.解:(1)0.8
(2)过氧化氢的浓度越来越小
(3)设参加反应的过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 0.8 g
=
x=1.7 g
答:参加反应的过氧化氢的质量为1.7 g。
解析:(1)根据质量守恒定律可知,化学反应前后物质的总质量不变,故制得氧气的质量是68.1 g-67.3 g=0.8 g。(2)随着反应的进行,过氧化氢的质量减少,浓度减小,所以反应速率逐渐减小。
(满分:100分 时间:60分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Al—27 Cu—64
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.空间站的备用氧气,通常利用分解高氯酸锂(LiClO4)来制取,在高氯酸锂中锂元素的化合价为+1,则氯元素的化合价为 ( )
A.+1 B.+4 C.+7 D.+8
2.铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此可以推测铜生锈的条件为 ( )
A.H2O和O2 B.CO2、H2O和O2
C.CO2和O2 D.CO2、N2和H2O
3.物质名称和相应化学式的书写正确的是 ( )
A.氦气:He2 B.氧化铝:AlO C.氯化镁:MgCl2 D.碳酸钠:NaCO3
4.下列现象能用质量守恒定律解释的是 ( )
A.10 g NaCl溶解在90 g水中,成为100 g溶液
B.100 g干冰完全汽化成100 g气体
C.酒精燃烧后,什么都没有了
D.2 g氢气和2 g氧气混合得4 g气体
5.对于化学方程式3Fe+2O2Fe3O4,理解错误的是 ( )
A.3个铁和2个氧气在点燃的条件下,生成1个四氧化三铁
B.铁和氧气在点燃的条件下生成四氧化三铁
C.该反应中铁、氧气和四氧化三铁的微观粒子数目比为3∶2∶1
D.该反应中铁、氧气和四氧化三铁三种物质的质量比为21∶8∶29
6.(2024重庆A中考)中医认为艾草具有抗菌消炎、镇定止咳等功效。蓝桉醇(C15H26O)为艾草的一种成分,下列对蓝桉醇的说法正确的是 ( )
A.是一种氧化物 B.由三种元素组成
C.由42个原子构成 D.氢元素质量分数最高
7.(2024徐州中考)为了实现碳的资源化利用,我国科学家用纳米镍粒子作催化剂将二氧化碳合成甲烷,反应的化学方程式为CO2+4H2CH4+2X。下列说法正确的是 ( )
A.X的化学式为H2O2 B.甲烷中碳、氢元素的质量比为3∶1
C.反应前后分子的数目不变 D.参加反应的CO2和H2的质量比为22∶1
8.(2024西藏中考)化学用语是学习化学的重要工具。下列化学用语与含义相符的是 ( )
A.O2-:表示2个氧原子 B.2Al:表示2个铝元素
C.7SO2:表示7个二氧化硫 D.O5:表示五氧化二磷中磷元素的化合价为+5
9.下列指定反应的化学方程式正确的是 ( )
A.磷在氧气中燃烧:P+O2P2O5
B.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
C.高锰酸钾受热分解:2KMnO4K2MnO4+O2↑
D.绿色植物的光合作用:6CO2+6H2OC6H12O6+6O2
10.下列涉及化学观念的有关说法正确的是 ( )
A.根据微粒观:一个N2分子是由2个氮原子构成的
B.根据守恒观:100 g酒精+100 g水,总质量等于200 g,符合质量守恒定律
C.根据元素观:聚乙烯燃烧生成二氧化碳和水,推知聚乙烯一定由碳、氢、氧元素组成
D.根据结构观:氦原子和镁原子的最外层电子数相同,因此它们化学性质也相同
11.(2024·广东中考)我国科学家利用光催化技术实现了绿色制取H2O2,反应的微观示意图如图所示。下列说法正确的是 ( )
A.反应后氧原子个数减少
B.反应后催化剂的质量增加
C.b的化学式为H2O
D.参加反应的a、b分子个数比为1∶1
12.(2024陕西中考)乙烯(C2H4)与丙烯(C3H6)是两种重要的化工原料。对于质量相同的二者,下列说法正确的是 ( )
A.所含分子种类相同 B.所含分子数目相同
C.每个分子中所含原子数目相同 D.完全燃烧消耗氧气的质量相同
13.分别加热等质量的两种样品,固体质量随温度变化的曲线如图所示。样品1反应前后各物质的质量如表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同。下列说法错误的是 ( )
物质 甲 乙 丙 丁
反应前质量/g 24 2.0 0 0
反应后质量/g 0 2.0 22.1 x
A.该反应是分解反应 B.x=1.9
C.乙为催化剂 D.该条件下丙和丁均为气体
14.推理是学习化学的一种重要方法,但盲目类推又可能得出错误结论。以下类推正确的是 ( )
A.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
B.催化剂在反应前后性质不变,则反应前后性质不变的物质一定是催化剂
C.含碳元素的物质充分燃烧会生成CO2,所以燃烧能生成CO2的物质一定含碳元素
D.原子核由质子和中子构成,则所有的原子核中都含有质子和中子
15.下列图像能正确反映对应的实验操作的是 ( )
A B C D
A.将水通电一段时间 B.向一定质量的二氧化锰中加入过氧化氢溶液
C.用氯酸钾制取氧气 D.高锰酸钾制取氧气
二、填空题(本题共4小题,共32分)
16.(6分)化学用语是学习化学的重要工具,是国际通用的化学语言。请用化学用语填空。
(1)铜元素: ;氖气: ;3个氢氧根离子: 。
(2)写出的化学符号: 。(3)空气中含量最多的物质是 。
(4)地壳中含量最多的金属元素和非金属元素组成的化合物的化学式: 。
(5)已知次氯酸钠的化学式为NaClO,则次氯酸钙的化学式为 。
17.(6分)北斗卫星导航系统(以下简称北斗系统)是我国自主建设运行的全球卫星导航系统,为服务全球、造福人类贡献了中国智慧和力量。
(1)北斗系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的结构示意图如图1所示,铷的相对原子质量为 。
(2)图1中n= ;铷离子的符号为 。
(3)图2中与铷元素化学性质相似的元素是 (填元素符号)。
(4)E元素位于第 周期,与地壳中含量最多的非金属元素形成的化学式为 。
18.(8分)在物质的宏观、微观和符号之间建立联系是化学学科的特点。如图为高温下某反应的微观示意图,根据图示回答下列问题:
(1)该反应前后,共有 种氧化物。
(2)反应生成的两种物质的分子个数比为 。
(3)该反应前后没有发生变化的是 (填“分子”或“原子”)。
(4)该反应的化学方程式为 。
19.(12分)春晚《满庭芳·国色》节目点燃了国人复古寻色的热潮。其中桃红、凝脂、缃叶、群青、沉香代表红、白、黄、青、黑传统五色。
(1)群青:是一种品贵的高级颜料。青金石中含Na、Al、Si、S、Cl、O等元素,从原子结构的角度说明,这些元素最根本的区别是 不同,其中属于金属元素的有 、 (填元素名称)。其中+4价硅元素形成的氧化物化学式是 。
(2)桃红:用银朱调和,可以得到灿若桃花的颜色。银朱是用硫与汞加热制成的硫化汞,反应前后不变的微观粒子是 、 (填化学符号),写出反应的化学方程式: 。
(3)凝脂:降低原料中含铁氧化物含量,实现从青瓷到凝脂似玉的白瓷。如图为铁元素的价类二维图,a点表示物质的类别是 ,写出b点物质的化学式: ,硫酸亚铁中阳离子符号: 。
(4)缃叶:取色自雌黄(As2S3),颜色类似硫黄,在空气中燃烧能产生剧毒的As2O3和一种刺激性气味的气体,该反应的化学方程式为 。
(5)沉香:代表黑色,以下固体可能为沉香主要成分的是 (填字母)。
A.氧化镁 B.氧化铜 C.五氧化二磷 D.二氧化锰
三、实验题(本题共1小题,共18分)
20.请仔细观察下图,是测定化学反应前后质量变化情况的实验,用以验证质量守恒定律。试回答:
(1)实验A:取下锥形瓶加热观察到锥形瓶内的现象是 ,气球的作用是 。冷却后装置放回天平后天平 ;为什么要冷却后再称量
。锥形瓶中反应的化学方程式是 。
(2)实验B中,最终天平不平衡的原因是 。
(3)A、B实验中的反应遵循质量守恒定律的是 。
(4)实验A结束后,将锥形瓶倒放在水槽中,在液面以下拔下橡皮塞,观察到如实验C的现象,产生该现象是因为 ,量取进入锥形瓶中水的体积,发现进入水的体积小于锥形瓶容积的1/5,可能的原因是 (写出一点即可)。
四、计算题(本题共1小题,共5分)
21.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量68 g过氧化氢溶液和0.1 g 二氧化锰进行实验,反应前后质量随时间变化关系如图。
计算:(1)制得氧气的质量是 g。
(2)由反应图线可知,随着反应的进行,反应速率逐渐减小,你认为可能的原因是 。
(3)计算参加反应的过氧化氢质量是多少
【详解答案】
1.C
2.B
3.C 解析:氦气是由原子直接构成的,表示为He;在氧化铝中,铝元素显+3价,氧元素显-2价,化学式为Al2O3;在氯化镁中,镁元素显+2价,氯元素显-1价,化学式为MgCl2; 碳酸钠中,钠元素化合价为+1,碳酸根化合价为-2,则化学式为Na2CO3。
4.C 解析:10 g NaCl溶解在90 g水中,成为100 g溶液,没有新物质生成,100 g干冰完全汽化成100 g气体,没有新物质生成,氢气和氧气混合,没有新物质生成,均属于物理变化,不能用质量守恒定律解释;酒精燃烧生成二氧化碳和水,有新物质生成,属于化学变化,燃烧过程中生成的二氧化碳和水蒸气逸散到了空气中,所以“什么都没有了”,能用质量守恒定律解释。
5.A
6.B 解析:氧化物是由两种元素组成,其中一种元素是氧元素的化合物,蓝桉醇是由三种元素组成的,不属于氧化物;由化学式可知,蓝桉醇是由碳、氢、氧三种元素组成的;蓝桉醇是由蓝桉醇分子构成的,一个蓝桉醇分子是由15个碳原子、26个氢原子和1个氧原子,共42个原子构成的;蓝桉醇中碳、氢、氧三种元素的质量比为(12×15)∶(1×26)∶16=90∶13∶8,所以碳元素质量分数最高。
7.B 解析:由反应的化学方程式CO2+4H2CH4+2X可知,反应前碳、氢、氧原子个数分别为1、8、2,反应后的生成物中碳、氢、氧原子个数分别为1、4、0,根据化学反应前后原子种类、数目不变,则2X分子中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O;甲烷中碳、氢元素的质量比为12∶(1×4)=3∶1; 微观上,该反应是1个二氧化碳分子和4个氢分子反应生成1个甲烷分子和2个水分子,反应前后分子的数目减少; 参加反应的CO2和H2的质量比为44∶(2×4)=11∶2。
8.D 解析:O2-表示1个氧离子; 元素符号前出现数字表示几个原子,故2Al表示2个铝原子; 由分子构成的物质,其化学式前出现数字表示几个分子,故7SO2表示7个二氧化硫分子。
9.D 解析:A.磷在氧气中燃烧生成五氧化二磷,该反应的化学方程式为4P+5O22P2O5,错误;B.铁丝在氧气中燃烧,该反应的化学方程式为3Fe+2O2Fe3O4,错误;C.高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑,错误;D.绿色植物光合作用,是二氧化碳和水在光照和叶绿素的作用下反应生成葡萄糖和氧气,该反应的化学方程式为6CO2+6H2OC6H12O6+6O2,正确。故选D。
10.A 解析:酒精和水混合没有发生化学变化,不能用质量守恒定律解释,B错误;根据化学反应前后元素种类不变,可推知聚乙烯中一定含有氢、碳元素,可能含有氧元素,C错误;氦原子最外层有2个电子,但是第一层为稳定结构,镁原子最外层两个电子,容易失去,二者化学性质不同,D错误。
11.C 解析:根据质量守恒定律,反应前后原子种类和数目不变,则反应后氧原子个数不变,故A错误;在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫作催化剂,则反应后催化剂的质量不变,故B错误;由题图可知,一个b分子是由一个氧原子和两个氢原子构成的,则b的化学式为H2O,故C正确;由题图可知,氧气和水在催化剂的作用下反应生成过氧化氢,化学方程式:O2+2H2O2H2O2,则参加反应的a、b分子个数比为1∶2,故D错误。
12.D 解析:乙烯是由乙烯分子构成的,丙烯是由丙烯分子构成的,质量相同的二者,所含分子种类不相同;乙烯的相对分子质量为12×2+1×4=28,丙烯的相对分子质量为12×3+1×6=42,相同质量的物质,其分子的数目与相对分子质量成反比,相对分子质量越大,气体含有的分子数越少,则质量相同的二者,所含分子数目不相同,质量相同的乙烯比丙烯所含分子数目多;每个乙烯分子中含有2+4=6个原子,每个丙烯分子中含有3+6=9个原子,则每个分子中所含原子数目不相同;乙烯的化学式为C2H4,丙烯的化学式为C3H6,二者最简式都是CH2,故质量相同的二者,完全燃烧消耗氧气的质量相同。
13.D 解析:该反应是甲在加热的条件下生成丙和丁,符合“一变多”的特点,属于分解反应; 由题表中数据可知,x=24+2.0+0+0-0-2.0-22.1=1.9;由题表中数据可知,反应前后乙的质量不变,对比样品1、2的曲线可知,相同温度,样品1固体质量减少更快,即加入乙反应速率更快,分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同,说明乙的化学性质不变,则乙是催化剂; 乙是催化剂,反应前后质量和化学性质不变,由题图可知,加热样品1后,固体质量减少,最后质量大于2 g,则生成物中有气体,有固体。
14.C 解析:在同一化合物中,金属元素显正价,但是非金属元素不一定显负价,比如氯酸钾中,钾元素显+1价,氯元素显+5价,A错误;催化剂反应前后化学性质不变,B错误;根据质量守恒定律反应前后元素种类不变,含碳元素的物质充分燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素,C正确;原子核由质子和中子构成,但并不是所有的原子核中都含有质子和中子,比如有一种氢原子的原子核中不含中子,D错误。
15.D 解析:通电分解水,生成氢气和氧气的体积(而不是质量)之比为2∶1,A错误;过氧化氢在二氧化锰的催化作用下分解为水和氧气,在该反应中二氧化锰是催化剂,反应前后二氧化锰的质量和化学性质不变,随着过氧化氢溶液的不断加入,生成氧气的质量逐渐增大,B错误;用氯酸钾制取氧气,有催化剂的反应速率快,固体的质量减少得快,化学反应前后,催化剂的质量和化学性质不变,最后有催化剂的剩余固体的质量多,C错误;高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,根据质量守恒定律,化学反应前后,元素的种类和质量不变,则固体中锰元素的质量不变,D正确。
16.(1)Cu Ne 3OH- (2)Mg2+
(3)N2 (4)Al2O3 (5)Ca(ClO)2
17.(1)85.47 (2)1 Rb+ (3)Na
(4)三 Al2O3
解析:(2)元素信息示意图左上角的数字表示原子序数,根据题图1,铷的原子序数为37。原子的核外电子数等于原子序数,则n=1。(3)一般来说,微观粒子的最外层电子数相等,化学性质相似。铷原子的最外层电子数为1,根据题图2,A、B、C、D、E的最外层电子数分别是1、7、8、1、8,且铷属于金属元素,D(氢原子)属于非金属元素,则题图2中与铷元素化学性质相似的元素是A,A的质子数为11,属于钠元素。(4)E的质子数为13,原子的质子数等于核外电子数,则E处于原子状态下时核外电子数为13,核外电子排布为2、8、3,有3个电子层,原子的核外电子层数等于对应元素的周期数,因此E元素位于第三周期;E的质子数为13,属于铝元素,地壳中含量前五的元素由高到低依次为氧、硅、铝、铁、钙,则地壳中含量最多的非金属元素是氧元素,铝元素与氧元素形成的化合物是氧化铝;化合物中元素正负化合价之和为零,氧化铝中氧元素显-2价,铝元素显+3价,设氧化铝的化学式为AlxOy,则(+3)x+(-2)y=0,解得x∶y=2∶3,化学式为Al2O3。
18.(1)2 (2)1∶1 (3)原子
(4)C+H2OCO+H2
19.(1)质子数 钠 铝 SiO2 (2)Hg S
Hg+SHgS
(3)单质 Fe2O3 Fe2+ (4)2As2S3+9O22As2O3+6SO2 (5)BD
20.(1)红色固体逐渐变为黑色,气球胀大 平衡锥形瓶中的气压,防止锥形瓶中气压过大,冲开橡皮塞 平衡 气球变大,产生浮力,影响称量的结果 2Cu+O22CuO
(2)过氧化氢分解生成氧气,氧气逸散到空气中,使得总质量减小
(3)AB
(4)锥形瓶中氧气被消耗,恢复至室温气压减小,小于大气压,水在大气压作用下压入锥形瓶 铜粉的量不足(合理即可)
21.解:(1)0.8
(2)过氧化氢的浓度越来越小
(3)设参加反应的过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 0.8 g
=
x=1.7 g
答:参加反应的过氧化氢的质量为1.7 g。
解析:(1)根据质量守恒定律可知,化学反应前后物质的总质量不变,故制得氧气的质量是68.1 g-67.3 g=0.8 g。(2)随着反应的进行,过氧化氢的质量减少,浓度减小,所以反应速率逐渐减小。
同课章节目录
