备考2026年中考化学一轮复习 计算题(含解析)
文档属性
| 名称 | 备考2026年中考化学一轮复习 计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 778.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-31 16:56:21 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中考化学一轮复习 计算题
一.计算题(共26小题)
1.(2025 青海)2025年4月30日,神舟十九号载人飞船返回舱成功着陆。返回舱部分材质为铝合金,其成分中铝的工业制法原理为2Al2O34Al+3O2↑,生产54t铝需要电解的氧化铝质量是多少?
2.(2025 长沙)小化同学在老师的指导下进行“氧气的实验室制取与性质”的实验活动。高锰酸钾制氧气的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑。请计算:
(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为 ;
(2)实验中需要0.64g氧气,如果一药匙高锰酸钾的质量为3g,他取两药匙高锰酸钾完全反应制得的氧气是否足够实验所需?(写出计算过程及结果)
3.(2025 吉林)吉林省位于黄金玉米带上。提高粮食产量,需要合理施用化肥。尿素是氮肥中最主要的一种,合成尿素的原理是CO2+2NH3CO(NH2)2+H2O。回答下列问题。
(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为 。
(2)利用上述化学方程式计算:44吨CO2能与多少吨NH3恰好完全反应?
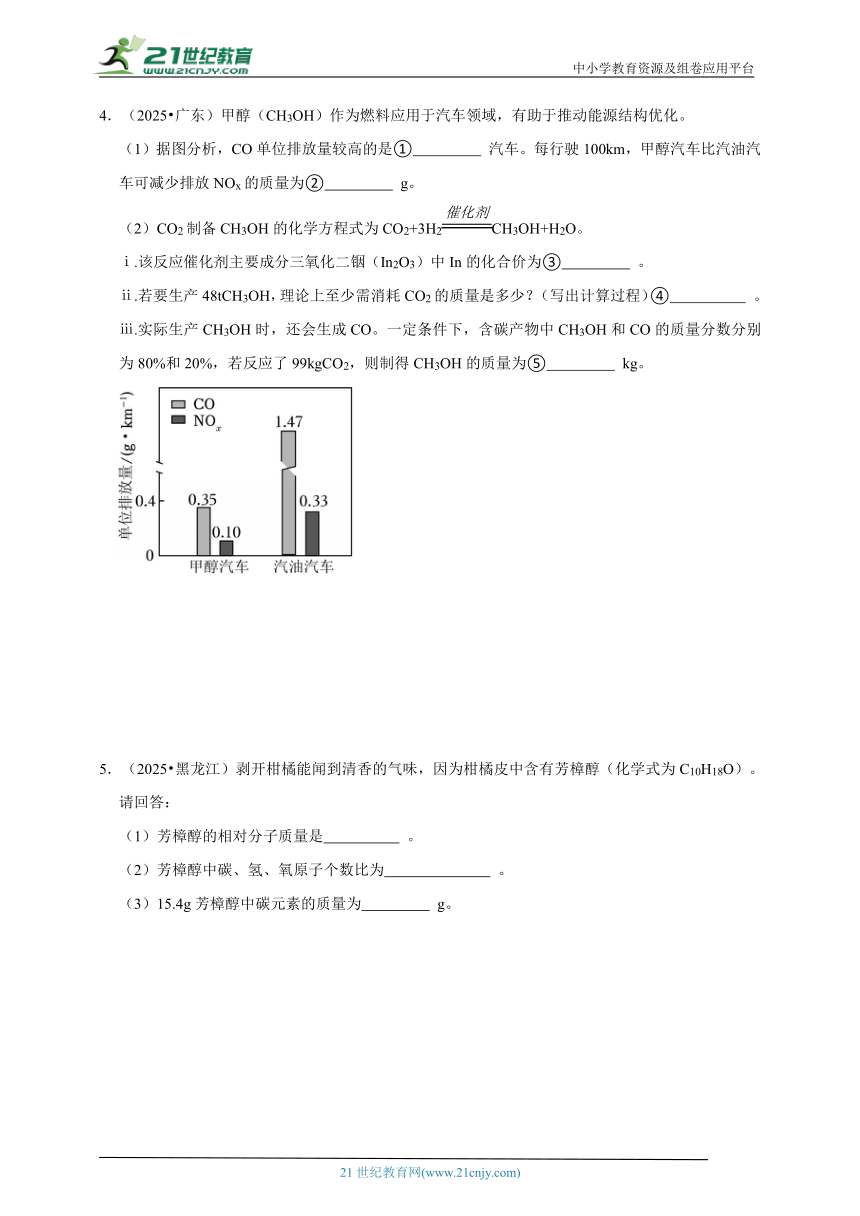
4.(2025 广东)甲醇(CH3OH)作为燃料应用于汽车领域,有助于推动能源结构优化。
(1)据图分析,CO单位排放量较高的是① 汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为② g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ.该反应催化剂主要成分三氧化二铟(In2O3)中In的化合价为③ 。
ⅱ.若要生产48tCH3OH,理论上至少需消耗CO2的质量是多少?(写出计算过程)④ 。
ⅲ.实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,则制得CH3OH的质量为⑤ kg。
5.(2025 黑龙江)剥开柑橘能闻到清香的气味,因为柑橘皮中含有芳樟醇(化学式为C10H18O)。请回答:
(1)芳樟醇的相对分子质量是 。
(2)芳樟醇中碳、氢、氧原子个数比为 。
(3)15.4g芳樟醇中碳元素的质量为 g。
6.(2025 齐齐哈尔)如图是一种加碘盐包装袋上的部分内容,请回答下列问题:
食品名称:天然海盐 配料:精制盐、碘酸钾 氯化钠:≥98.5g/100g 碘酸钾(以Ⅰ计):18 33mg/kg
(1)碘酸钾(KIO3)的相对分子质量是 。
(2)碘酸钾中钾元素和氧元素的质量比是 (写出最简整数比)。
(3)500g该食盐中碘元素的质量范围为 mg。
7.(2025 广西)碳化钛(TiC)具有高熔点、高硬度和高电导率的特点,在航空航天、电子工业等领域应用广泛。一种制备碳化钛的反应原理为:TiO2+3CTiC+2CO↑。
(1)TiC中Ti、C原子个数比为 ,Ti、C元素的质量比为 。
(2)用该方法制备90gTiC至少需要C的质量是多少?(写出计算过程)
8.(2025 天津)尿素[CO(NH2)2]是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
(1)尿素由 种元素组成(写数值);
(2)尿素的相对分子质量为 ;
(3)120g尿素中含有氮元素的质量为 g。
9.(2025 湖北)我国研制了世界最大口径碳化硅单体反射镜,应用于深空探测、气象观测等。
碳化硅可用硅与碳在高温下反应制备:
Si+CSiC
(1)SiC中硅、碳元素的质量比为 。
(2)若要制得40kgSiC,至少需要Si的质量是多少?(写出计算过程)
10.(2025 陕西)某水垢样品的主要成分是CaCO3和Mg(OH)2。学习小组同学想测定该水垢样品中CaCO3的质量分数,于是向盛有25g水垢样品的烧杯中加入100g足量稀盐酸,发生的反应是:CaCO3+2HCl═CaCl2+CO2↑+H2O,Mg(OH)2+2HCl═MgCl2+2H2O,待反应完全后,经称量烧杯内物质总质量为116.2g。(注意:忽略CO2在水中的溶解)
请完成下列分析及计算:
(1)实验过程中生成气体的质量是 g。
(2)计算该水垢样品中CaCO3的质量分数。
(3)实验所用稀盐酸的溶质质量分数 (填“大于”“小于”或“等于”)14.6%。
11.(2025 天津)现有一定质量的硫酸钠和硫酸铜的混合粉末,其中含钠元素2.3g。向该混合粉末中加入81.8g水,完全溶解后,逐滴滴入50g溶质质量分数为8%的氢氧化钠溶液,恰好完全反应,得到沉淀和溶液。计算:
(1)混合粉末中硫酸铜的质量;
(2)反应后所得溶液中溶质的质量分数;
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(1cm3=1mL;结果精确至0.1)。
12.(2025 山西)实验室用13g锌粒与足量的稀硫酸反应制取氢气,在标准状况下,理论上可以制得多少升氢气?(已知标准状况下,氢气的密度约为0.09g/L)
(1)反应前后,氢元素的化合价 (填“改变”或“不变”)。
(2)根据题目要求,完成计算过程(计算结果保留一位小数)。
13.(2025 湖南)化学社团同学为制作一个可以预测气温变化的简易“天气瓶”,查询到以下数据:
硝酸钾在不同温度时的溶解度
温度/℃ 10 20 30
溶解度/g 20.9 31.6 45.8
依据上述数据,完成下列问题。
(1)若“天气瓶”中物质的总质量为100g,则含氯化铵的质量是 g。
(2)计算10℃时硝酸钾饱和溶液中溶质的质量分数 (列出计算式,结果精确的0.1%)。
14.(2025 新疆)《天工开物》记载了用锡砂(主要成分为SnO2)冶炼金属锡(Sn)的方法,其反应原理为:C+SnO2Sn+CO2↑,用含SnO215.1t的锡砂,理论上可炼出锡的质量是多少?(写出计算过程)
15.(2025 福建)“84”消毒液(含NaClO)常用于环境消毒,其生产原理是:。欲生产100t质量分数为14.9%的NaClO溶液以配制“84”消毒液,请回答下列问题:
(1)100t该NaClO溶液含NaClO t。
(2)理论上需NaCl的质量是 (写出计算过程)。
16.(2025 安徽)氢气是清洁能源。硼氢化钠(NaBH4)作为一种环境友好的固体储氢材料,可与水反应生成氢气,化学方程式为NaBH4+2H2O=NaBO2+4H2↑。
(1)氢气被称为清洁能源的原因是 。
(2)某工厂生产燃料电池需要12t氢气,理论上需要NaBH4的质量是多少(写出计算过程)?
17.(2025 凉山州)某班同学在探究制取O2的多种方法时,通过查阅资料得知过氧化钠(Na2O2)能与H2O反应生成O2。为测定实验室中某过氧化钠样品的纯度(质量分数),他们将2g该样品与足量水反应(反应原理为2Na2O2+2H2O═4NaOH+O2↑,杂质不参与反应),并测得生成气体的质量与时间的关系如图所示。请完成下列题目:
(1)生成氧气的质量是 g。
(2)计算该样品中过氧化钠的质量分数。
18.(2025 烟台)化学小组同学在实践基地发现一袋久置的熟石灰,标签显示其含少量杂质(杂质不溶于水也不与酸反应)。同学们为探究其变质程度,进行以下实验。取该熟石灰样品10g于锥形瓶中,加入40g水,振荡,然后逐滴加入一定溶质质量分数的稀盐酸,边加边振荡。加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示。(忽略CO2在水中的溶解)请完成下列问题:
(1)10g该熟石灰样品产生CO2的质量是 g。
(2)计算所加入的稀盐酸的溶质质量分数。(写出计算过程,结果精确至0.1%)
(3)10g该熟石灰样品中氢氧化钙的质量是 g。(不写计算过程)
19.(2025 遂宁)化学是一门以实验为基础的自然学科,阳阳同学在实验室用100g一定溶质质量分数的过氧化氢溶液和二氧化锰制取氧气,完全反应后,生成氧气的质量与反应时间的关系如图:
(1)反应生成氧气的质量为 g。
(2)二氧化锰起 作用。
(3)计算参加反应的过氧化氢溶液的溶质质量分数(用方程式计算,写出解题过程)。
20.(2025 重庆)实验小组利用甲烷、氧气和氢氧化钠溶液组成的燃料电池进行模拟实验。一定条件下发生反应的化学方程式为CH4+2O2+2NaOHNa2CO3+3H2O,理论上若所有反应物刚好完全反应,恰好消耗100g4%的NaOH溶液。试计算:
(1)Na2CO3中碳元素与氧元素的质量比为 。
(2)所得溶液中溶质的质量分数(结果精确到0.1%)。
21.(2025 绥化)碳酸钾(K2CO3)俗称钾碱,主要用于印染、玻璃的生产等。为测定某钾碱样品中碳酸钾的质量分数,化学兴趣小组同学称取28.0g钾碱样品于烧杯中,将200.0g一定溶质质量分数的稀硫酸平均分成五份,依次加入上述烧杯中,充分反应,测得实验数据如表。
1 2 3 4 5
加入稀硫酸的质量/g 40 40 40 40 40
烧杯中剩余物质的质量/g 65.8 103.6 141.4 m 219.2
(1)m的值为 ,完全反应后生成二氧化碳的总质量为 g。
(2)计算该钾碱样品中碳酸钾的质量分数(写出计算过程,结果精确到0.1%)。
(3)第5次加入稀硫酸后所得溶液中K+和的个数比 2:1(填“>”、“<”或“=”)。
22.(2025 眉山)过氧化钠(Na2O2)可在消防员的呼吸面具或潜水艇中作为氧气的来源。反应原理是:2Na2O2+2CO2=2Na2CO3+O2。据资料得知,每人每天消耗氧气1.6千克。某潜水艇上有50人,假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需的Na2O2的质量是多少?(写出计算过程)
23.(2025 江西)实践小组为测定某品牌纯碱样品中Na2CO3的质量分数,进行了如图实验(杂质不参与反应)。
(1)实验室取用纯碱粉末需用到的仪器为 ,加入稀盐酸观察到的现象是 。
(2)充分反应后生成气体的质量是 g。
(3)计算样品中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
(4)由于二氧化碳能溶于水,该实验测得样品中Na2CO3的质量分数会 (选填“偏大”“偏小”或“不变”)。
24.(2025 云南)高端芯片制造国产化是助力产业转型升级的重要支点。GaN是一种被广泛使用的半导体材料,合成纳米级GaN的原理之一为GaCl3+Li3N═GaN+3LiCl。若制得42gGaN,计算参加反应的Li3N的质量。
25.(2025 广安)过氧化钠(Na2O2)可在呼吸面具中作供氧剂,久置易变质。为了测定某呼吸面具供氧剂中过氧化钠的质量分数,小吴同学进行了如下实验:向5.0g供氧剂样品中加入适量的水,使其充分反应,化学反应方程式为2Na2O2+2H2O=4NaOH+O2↑(无其它产生氧气的反应),测得产生氧气的质量与时间关系如图所示:
(1)充分反应后,产生氧气的质量为 g。
(2)计算该供氧剂样品中过氧化钠的质量分数。(写出计算过程)
26.(2025 达州)实验室取10g由CaCl2和NaCl组成的混合物,配制成不饱和溶液,向该溶液中逐滴加入Na2CO3溶液,生成沉淀与加入Na2CO3溶液的质量关系如图所示,请回答:
(1)CaCl2完全反应后生成CaCO3的质量为 g。
(2)A点对应的溶液中溶质为 。
(3)求原混合物中CaCl2的质量分数(写出计算过程)。
中考化学一轮复习 计算题
参考答案与试题解析
一.计算题(共26小题)
1.(2025 青海)2025年4月30日,神舟十九号载人飞船返回舱成功着陆。返回舱部分材质为铝合金,其成分中铝的工业制法原理为2Al2O34Al+3O2↑,生产54t铝需要电解的氧化铝质量是多少?
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】102t。
【分析】根据生成铝的质量、反应的化学方程式,列式计算出需要电解的氧化铝质量即可。
【解答】解:设需要电解的氧化铝质量为x。
2Al2O34Al+3O2↑
204 108
x 54t
x=102t
答:需要电解的氧化铝质量是102t。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
2.(2025 长沙)小化同学在老师的指导下进行“氧气的实验室制取与性质”的实验活动。高锰酸钾制氧气的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑。请计算:
(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为 39:55 ;
(2)实验中需要0.64g氧气,如果一药匙高锰酸钾的质量为3g,他取两药匙高锰酸钾完全反应制得的氧气是否足够实验所需?(写出计算过程及结果)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】有关化学方程式的计算.
【答案】(1)39:55。
(2)否。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为39:55=39:55。
(2)设制取0.64g氧气需要高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 0.64g
x=6.32g
取两药匙高锰酸钾仅为6g小于6.32g
答:制得的氧气不足以满足实验所需。
故答案为:(1)39:55。
(2)否。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
3.(2025 吉林)吉林省位于黄金玉米带上。提高粮食产量,需要合理施用化肥。尿素是氮肥中最主要的一种,合成尿素的原理是CO2+2NH3CO(NH2)2+H2O。回答下列问题。
(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为 7:1 。
(2)利用上述化学方程式计算:44吨CO2能与多少吨NH3恰好完全反应?
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】有关化学方程式的计算.
【答案】(1)7:1;
(2)34吨。
【分析】(1)根据化学式进行元素质量比的计算;
(2)根据二氧化碳的质量和方程式求出氨气的质量来分析解答。
【解答】解:(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为(14×2):(1×2×2)=7:1;
(2)设NH3的质量为x,
CO2+2NH3CO(NH2)2+H2O
44 34
44吨 x
x=34吨
答:44吨CO2能与34吨NH3恰好完全反应。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.(2025 广东)甲醇(CH3OH)作为燃料应用于汽车领域,有助于推动能源结构优化。
(1)据图分析,CO单位排放量较高的是① 汽油 汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为② 23 g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ.该反应催化剂主要成分三氧化二铟(In2O3)中In的化合价为③ +3 。
ⅱ.若要生产48tCH3OH,理论上至少需消耗CO2的质量是多少?(写出计算过程)④ 66t 。
ⅲ.实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,则制得CH3OH的质量为⑤ 56 kg。
【考点】物质的相互转化和制备;有关元素化合价的计算;不含杂质的化学方程式计算.
【专题】物质的制备.
【答案】(1)汽油;23;
(2)ⅰ、+3;
ⅱ、66t;
ⅲ、56。
【分析】(1)根据图中数据来分析;
(2)ⅰ、根据化合物中各元素正负化合价代数和为零来分析;
ⅱ、根据甲醇的质量和化学方程式的计算来分析;
ⅲ、根据化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:(1)据图分析,CO单位排放量较高的是汽油汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为:(0.33﹣0.10)g/km×100km=23g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ、三氧化二铟(In2O3)中氧元素的化合价为﹣2,根据化合物中各元素正负化合价代数和为零可知,In的化合价为+3。
ⅱ、设理论上至少需消耗CO2的质量是x。
CO2+3H2CH3OH+H2O
44 32
x 48t
x=66t
答:理论上至少需消耗CO2的质量是66t。
ⅲ、实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,根据质量守恒定律,化学反应前后元素的种类和质量不变,则生成CH3OH和CO中碳元素的质量为:99kg100%=27kg,设含碳产物的质量为m,由碳元素守恒可得:m×80%100%+m×20%100%=27kg,解得:m=70kg,所以制得CH3OH的质量为:70kg×80%=56kg。
故答案为:
(1)汽油;23;
(2)ⅰ、+3;
ⅱ、66t;
ⅲ、56。
【点评】本题主要考查了化合价原则、化学方程式的计算以及质量守恒定律的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
5.(2025 黑龙江)剥开柑橘能闻到清香的气味,因为柑橘皮中含有芳樟醇(化学式为C10H18O)。请回答:
(1)芳樟醇的相对分子质量是 154 。
(2)芳樟醇中碳、氢、氧原子个数比为 10:18:1 。
(3)15.4g芳樟醇中碳元素的质量为 12 g。
【考点】化合物中某元素的质量计算;化学式的书写及意义;相对分子质量的概念及其计算.
【专题】化学式的计算.
【答案】(1)154;
(2)10:18:1;
(3)12。
【分析】(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(2)根据1个芳樟醇分子的构成,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)C10H18O的相对分子质量为12×10+1×18+16×1=154。
(2)1个香樟醇分子是由10个碳原子、18个氢原子、1个氧原子构成的,则芳樟醇(C10H18O)中碳、氢、氧原子个数比为10:18:1。
(3)15.4g芳樟醇中碳元素的质量为。
故答案为:
(1)154;
(2)10:18:1;
(3)12。
【点评】本题难度不大,理解题意、灵活运用化学式的含义、有关计算等是正确解答本题的关键。
6.(2025 齐齐哈尔)如图是一种加碘盐包装袋上的部分内容,请回答下列问题:
食品名称:天然海盐 配料:精制盐、碘酸钾 氯化钠:≥98.5g/100g 碘酸钾(以Ⅰ计):18 33mg/kg
(1)碘酸钾(KIO3)的相对分子质量是 214 。
(2)碘酸钾中钾元素和氧元素的质量比是 13:16 (写出最简整数比)。
(3)500g该食盐中碘元素的质量范围为 9~16.5 mg。
【考点】化合物中某元素的质量计算;相对分子质量的概念及其计算;元素质量比的计算.
【专题】化学式的计算.
【答案】(1)214;
(2)13:16;
(3)9~16.5。
【分析】(1)根据相对分子质量=相对原子质量×原子个数之和来分析;
(2)根据元素的质量比=相对原子质量×原子个数之比来分析;
(3)根据碘酸钾(以I计)的含量为18 33mg/kg来分析。
【解答】解:(1)碘酸钾(KIO3)的相对分子质量为:39+127+16×3=39+127+48=214。
(2)碘酸钾(KIO3)中钾元素(K)与氧元素(O)的质量比为39:(16×3)=13:16。
(3)由题可知,碘酸钾(以I计)的含量为18 33mg/kg,500g=0.5kg,所以500g该食盐中碘元素的质量范围为0.5×18mg=9mg到0.5×33mg=16.5mg。
故答案为:
(1)214;
(2)13:16;
(3)9~16.5。
【点评】本题主要考查了化学式的相关计算,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
7.(2025 广西)碳化钛(TiC)具有高熔点、高硬度和高电导率的特点,在航空航天、电子工业等领域应用广泛。一种制备碳化钛的反应原理为:TiO2+3CTiC+2CO↑。
(1)TiC中Ti、C原子个数比为 1:1 ,Ti、C元素的质量比为 4:1 。
(2)用该方法制备90gTiC至少需要C的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】化学式的计算;有关化学方程式的计算.
【答案】(1)1:1;4:1;
(2)54g。
【分析】(1)根据碳化钛化学式的含义、化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据生成碳化钛的质量,结合反应的化学方程式列式计算出至少需要C的质量即可。
【解答】解:(1)1个碳化钛分子中含有1个钛原子、1个碳原子,则TiC中Ti、C原子个数比为1:1;Ti、C元素的质量比为48:12=4:1。
故答案为:1:1;4:1。
(2)设至少需要C的质量为x。
TiO2+3CTiC+2CO↑
36 60
x 90g
x=54g
答:至少需要C的质量是54g。
【点评】本题难度不大,掌握利用化学方程式的计算、化学式的有关计算即可正确解答本题,解题时要注意解题的规范性。
8.(2025 天津)尿素[CO(NH2)2]是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
(1)尿素由 4 种元素组成(写数值);
(2)尿素的相对分子质量为 60 ;
(3)120g尿素中含有氮元素的质量为 56 g。
【考点】化合物中某元素的质量计算;化学式的书写及意义;相对分子质量的概念及其计算.
【专题】化学式的计算.
【答案】(1)4;
(2)60;
(3)56。
【分析】(1)根据尿素化学式的含义,进行分析解答。
(2)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)尿素是由碳、氧、氮、氢4种元素组成的。
(2)尿素的相对分子质量为12+16+(14+1×2)×2=60。
(3)120g尿素中含有氮元素的质量为120g100%=56g。
故答案为:
(1)4;
(2)60;
(3)56。
【点评】本题难度不大,理解题意、灵活运用化学式的含义、有关计算等是正确解答本题的关键。
9.(2025 湖北)我国研制了世界最大口径碳化硅单体反射镜,应用于深空探测、气象观测等。
碳化硅可用硅与碳在高温下反应制备:
Si+CSiC
(1)SiC中硅、碳元素的质量比为 7:3 。
(2)若要制得40kgSiC,至少需要Si的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】化学式的计算;有关化学方程式的计算.
【答案】(1)7:3;
(2)28kg。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据制得SiC的质量,结合反应的化学方程式列式计算出至少需要Si的质量即可。
【解答】解:(1)SiC中硅、碳元素的质量比为28:12=7:3。
故答案为:7:3。
(2)设至少需要Si的质量为x。
Si+CSiC
28 40
x 40kg
x=28kg
答:至少需要Si的质量是28kg。
【点评】本题难度不大,掌握利用化学方程式的计算、化学式的有关计算即可正确解答本题,解题时要注意解题的规范性。
10.(2025 陕西)某水垢样品的主要成分是CaCO3和Mg(OH)2。学习小组同学想测定该水垢样品中CaCO3的质量分数,于是向盛有25g水垢样品的烧杯中加入100g足量稀盐酸,发生的反应是:CaCO3+2HCl═CaCl2+CO2↑+H2O,Mg(OH)2+2HCl═MgCl2+2H2O,待反应完全后,经称量烧杯内物质总质量为116.2g。(注意:忽略CO2在水中的溶解)
请完成下列分析及计算:
(1)实验过程中生成气体的质量是 8.8 g。
(2)计算该水垢样品中CaCO3的质量分数。
(3)实验所用稀盐酸的溶质质量分数 大于 (填“大于”“小于”或“等于”)14.6%。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)8.8;
(2)80%;
(3)大于。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变来分析;
(2)根据生成二氧化碳的质量和化学方程式的计算来分析;
(3)根据化学方程式的计算和溶质质量分数的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,由题中数据可知,实验过程中生成气体的质量是:25g+100g﹣116.2g=8.8g。
(2)设该水垢样品中CaCO3的质量为x。
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 8.8g
x=20g
则该水垢样品中CaCO3的质量分数为:100%=80%。
答:该水垢样品中CaCO3的质量分数为80%。
(3)设参加反应的HCl的质量为y。
CaCO3+2HCl═CaCl2+CO2↑+H2O
73 44
y 8.8g
y=14.6g
即与CaCO3反应的HCl质量为14.6g,100g溶质质量分数为14.6%的稀盐酸中,HCl的质量为:100g×14.6%=14.6g,由于水垢中还有Mg(OH)2,所以参加反应的HCl质量一定大于14.6g,则实验所用稀盐酸的溶质质量分数大于14.6%。
故答案为:
(1)8.8;
(2)80%;
(3)大于。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
11.(2025 天津)现有一定质量的硫酸钠和硫酸铜的混合粉末,其中含钠元素2.3g。向该混合粉末中加入81.8g水,完全溶解后,逐滴滴入50g溶质质量分数为8%的氢氧化钠溶液,恰好完全反应,得到沉淀和溶液。计算:
(1)混合粉末中硫酸铜的质量;
(2)反应后所得溶液中溶质的质量分数;
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(1cm3=1mL;结果精确至0.1)。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)8g;
(2)10%;
(3)16.7mL。
【分析】(1)根据参加反应的氢氧化钠质量和化学方程式的计算来分析;
(2)根据溶质质量分数100%来分析;
(3)根据溶液稀释前后溶质的质量不变来分析。
【解答】解:(1)硫酸钠和氢氧化钠不反应,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,由题中数据可知,参加反应的氢氧化钠质量为:50g×8%=4g;
设混合粉末中硫酸铜的质量为x,生成氢氧化铜的质量为y,生成硫酸钠的质量为z。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98 142
x 4g y z
,x=8g
,y=4.9g
,z=7.1g
答:混合粉末中硫酸铜的质量为8g。
(2)一定质量的硫酸钠和硫酸铜的混合粉末中含钠元素2.3g,只有硫酸钠中含有钠元素,则混合粉末中硫酸钠的质量为:2.3g÷(100%)=7.1g,硫酸铜和氢氧化钠反应生成了7.1g硫酸钠,则所得溶液中溶质的质量为:7.1g+7.1g=14.2g,而所得溶液的质量为:81.8g+50g+7.1g+8g﹣4.9g=142g,则所得溶液中溶质的质量分数为:。
答:反应后所得溶液中溶质的质量分数为10%。
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,根据溶液稀释前后溶质的质量不变可知,需要20%的氢氧化钠溶液的质量为:50g×8%÷20%=20g,体积为:20g÷1.2g/cm3≈16.7cm3≈16.7mL
答:需要20%的氢氧化钠溶液体积为16.7mL。
故答案为:
(1)8g;
(2)10%;
(3)16.7mL。
【点评】本题主要考查了溶质质量分数结合化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
12.(2025 山西)实验室用13g锌粒与足量的稀硫酸反应制取氢气,在标准状况下,理论上可以制得多少升氢气?(已知标准状况下,氢气的密度约为0.09g/L)
(1)反应前后,氢元素的化合价 改变 (填“改变”或“不变”)。
(2)根据题目要求,完成计算过程(计算结果保留一位小数)。
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】(1)改变;
(2)4.4L。
【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价的代数和为零,进行分析解答。
(2)根据参加反应的锌的质量,结合反应的化学方程式,列式计算出在可以制得氢气的质量,进而计算出在标准状况下氢气的体积。
【解答】解:(1)硫酸中氢元素显+1价,单质中元素的化合价为0,H2属于单质,故氢元素的化合价为0,则反应前后,氢元素的化合价改变。
故答案为:改变。
(2)设生成氢气的质量为x。
Zn+H2SO4═ZnSO4+H2↑
65 2
13g x
x=0.4g
标准状况下氢气的体积为0.4g÷0.09g/L≈4.4L。
答:在标准状况下,理论上可以制得4.4L氢气。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
13.(2025 湖南)化学社团同学为制作一个可以预测气温变化的简易“天气瓶”,查询到以下数据:
硝酸钾在不同温度时的溶解度
温度/℃ 10 20 30
溶解度/g 20.9 31.6 45.8
依据上述数据,完成下列问题。
(1)若“天气瓶”中物质的总质量为100g,则含氯化铵的质量是 3.1 g。
(2)计算10℃时硝酸钾饱和溶液中溶质的质量分数 17.3% (列出计算式,结果精确的0.1%)。
【考点】溶质的质量分数、溶解性和溶解度的关系;有关溶质质量分数的简单计算.
【专题】溶液、浊液与溶解度.
【答案】(1)3.1;
(2)17.3%。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据饱和溶液中溶质质量分数100%,进行分析解答。
【解答】解:(1)由图中数据可知,“天气瓶”中氯化铵的质量分数为3.1%,若总质量为100g,则含氯化铵的质量为100g×3.1%=3.1g。
(2)由图中数据可知,10℃时,硝酸钾的溶解度为20.9g,则10℃时,硝酸钾饱和溶液中溶质的质量分数为:。
故答案为:
(1)3.1;
(2)17.3%。
【点评】本题难度不大,了解饱和溶液中溶质质量分数100%、溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
14.(2025 新疆)《天工开物》记载了用锡砂(主要成分为SnO2)冶炼金属锡(Sn)的方法,其反应原理为:C+SnO2Sn+CO2↑,用含SnO215.1t的锡砂,理论上可炼出锡的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】11.9t。
【分析】根据二氧化锡的质量和化学方程式的计算来分析。
【解答】解:设理论上可炼出锡的质量是x。
C+SnO2Sn+CO2↑
151 119
15.1t x
x=11.9t
答:用含SnO215.1t的锡砂,理论上可炼出锡的质量是11.9t。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
15.(2025 福建)“84”消毒液(含NaClO)常用于环境消毒,其生产原理是:。欲生产100t质量分数为14.9%的NaClO溶液以配制“84”消毒液,请回答下列问题:
(1)100t该NaClO溶液含NaClO 14.9 t。
(2)理论上需NaCl的质量是 11.7t (写出计算过程)。
【考点】不含杂质的化学方程式计算;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算;有关化学方程式的计算.
【答案】(1)14.9;
(2)11.7t。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据参加反应的NaClO的质量,结合反应的化学方程式,列式计算出参加反应的氯化钠的质量即可。
【解答】解:(1)100t该NaClO溶液含NaClO的质量为100t×14.9%=14.9t。
(2)设理论上需NaCl的质量为x
x=11.7t
答:理论上需NaCl的质量为11.7t。
【点评】本题难度不大,掌握利用化学方程式的计算、溶质质量=溶液质量×溶质的质量分数即可正确解答本题,解题时要注意解题的规范性。
16.(2025 安徽)氢气是清洁能源。硼氢化钠(NaBH4)作为一种环境友好的固体储氢材料,可与水反应生成氢气,化学方程式为NaBH4+2H2O=NaBO2+4H2↑。
(1)氢气被称为清洁能源的原因是 产物为水,无污染 。
(2)某工厂生产燃料电池需要12t氢气,理论上需要NaBH4的质量是多少(写出计算过程)?
【考点】不含杂质的化学方程式计算;氢气的用途和氢能的优缺点.
【专题】有关化学方程式的计算.
【答案】(1)产物为水,无污染;
(2)57t。
【分析】(1)根据氢气燃烧生成水,进行分析解答。
(2)根据生成氢气的质量,结合反应的化学方程式列式计算出参加反应的NaBH4的质量即可。
【解答】解:(1)氢气燃烧生成水,无污染,被称为清洁能源。
故答案为:产物为水,无污染。
(2)设理论上需要NaBH4的质量为x。
NaBH4+2H2O=NaBO2+4H2↑
38 8
x 12t
x=57t
答:理论上需要NaBH4的质量为57t。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
17.(2025 凉山州)某班同学在探究制取O2的多种方法时,通过查阅资料得知过氧化钠(Na2O2)能与H2O反应生成O2。为测定实验室中某过氧化钠样品的纯度(质量分数),他们将2g该样品与足量水反应(反应原理为2Na2O2+2H2O═4NaOH+O2↑,杂质不参与反应),并测得生成气体的质量与时间的关系如图所示。请完成下列题目:
(1)生成氧气的质量是 0.32 g。
(2)计算该样品中过氧化钠的质量分数。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)0.32。
(2)78%。
【分析】(1)根据图示信息,生成气体的质量为0.32g,这是氧气的质量。
(2)根据氧气的质量和化学方程式,可以计算出过氧化钠的质量,进而计算出样品中过氧化钠的质量分数。
【解答】解:(1)根据图示,生成氧气的质量是0.32g。故答案为:0.32。
(2)设过氧化钠的质量为x,
2Na2O2+2H2O=4NaOH+O2↑
156 32
x 0.32g
x=1.56g
样品中过氧化钠的质量分数为:100%=78%,故答案为:78%。
【点评】本题主要考查了化学方程式的应用和质量分数的计算。完成此题需要从题干中抽取有用的信息,结合已有的化学知识进行分析和解答。通过这些知识点的综合应用,可以加深对化学反应和物质质量关系的理解,同时也体现了化学知识在实验数据处理中的实际应用价值。同时,这也考查了学生对化学反应微观过程的理解能力,以及将微观变化与宏观化学方程式联系起来的能力。
18.(2025 烟台)化学小组同学在实践基地发现一袋久置的熟石灰,标签显示其含少量杂质(杂质不溶于水也不与酸反应)。同学们为探究其变质程度,进行以下实验。取该熟石灰样品10g于锥形瓶中,加入40g水,振荡,然后逐滴加入一定溶质质量分数的稀盐酸,边加边振荡。加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示。(忽略CO2在水中的溶解)请完成下列问题:
(1)10g该熟石灰样品产生CO2的质量是 0.88 g。
(2)计算所加入的稀盐酸的溶质质量分数。(写出计算过程,结果精确至0.1%)
(3)10g该熟石灰样品中氢氧化钙的质量是 7.4 g。(不写计算过程)
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)0.88。
(2)14.6%。
(3)7.4。
【分析】加入50g稀盐酸,稀盐酸恰好和氢氧化钙完全反应生成氯化钙和水,再加入10g稀盐酸,稀盐酸恰好和碳酸钙反应生成氯化钙、水和二氧化碳,生成二氧化碳质量是50g+60g﹣109.12g=0.88g。
【解答】解:(1)10g该熟石灰样品产生CO2的质量是0.88g。
故答案为:0.88。
(2)与碳酸钙反应的稀盐酸质量是60g﹣50g=10g。
设所加入的稀盐酸的溶质质量分数是x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
10gx 0.88g
x=14.6%
答:稀盐酸质量分数是14.6%。
(3)设10g该熟石灰样品中氢氧化钙的质量是y。
Ca(OH)2+2HCl═CaCl2+2H2O
74 73
y 50g×14.6%
y=7.4g
答:氢氧化钙质量是7.4g。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
19.(2025 遂宁)化学是一门以实验为基础的自然学科,阳阳同学在实验室用100g一定溶质质量分数的过氧化氢溶液和二氧化锰制取氧气,完全反应后,生成氧气的质量与反应时间的关系如图:
(1)反应生成氧气的质量为 3.2 g。
(2)二氧化锰起 催化 作用。
(3)计算参加反应的过氧化氢溶液的溶质质量分数(用方程式计算,写出解题过程)。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)3.2。
(2)催化。
(3)6.8%。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)反应生成氧气的质量为3.2g。
故答案为:3.2。
(2)二氧化锰起催化作用。
故答案为:催化。
(3)设参加反应的过氧化氢溶液的溶质质量分数是x。
2H2O22H2O+O2↑
68 32
100gx 3.2g
x=6.8%
答:过氧化氢溶液质量分数是6.8%。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
20.(2025 重庆)实验小组利用甲烷、氧气和氢氧化钠溶液组成的燃料电池进行模拟实验。一定条件下发生反应的化学方程式为CH4+2O2+2NaOHNa2CO3+3H2O,理论上若所有反应物刚好完全反应,恰好消耗100g4%的NaOH溶液。试计算:
(1)Na2CO3中碳元素与氧元素的质量比为 1:4 。
(2)所得溶液中溶质的质量分数(结果精确到0.1%)。
【考点】溶质质量分数结合化学方程式的计算;元素质量比的计算.
【专题】化学式的计算;溶质质量分数与化学方程式相结合的计算.
【答案】(1)1:4;
(2)5.1%。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据参加反应的氢氧化钠溶液的质量、溶质质量分数,结合反应的化学方程式列式计算出生成碳酸钠的质量,进而计算出所得溶液中溶质的质量分数。
【解答】解:(1)Na2CO3中碳元素与氧元素的质量比为(12×1):(16×3)=1:4。
故答案为:1:4。
(2)设参加反应的甲烷的质量为x,参加反应的氧气的质量为y,生成碳酸钠的质量为z。
CH4+2O2+2NaOHNa2CO3+3H2O
16 64 80 106
x y 100g×4% z
x=0.8g
y=3.2g
z=5.3g
所得溶液中溶质的质量分数为100%≈5.1%。
答:所得溶液中溶质的质量分数为5.1%。
【点评】本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性。
21.(2025 绥化)碳酸钾(K2CO3)俗称钾碱,主要用于印染、玻璃的生产等。为测定某钾碱样品中碳酸钾的质量分数,化学兴趣小组同学称取28.0g钾碱样品于烧杯中,将200.0g一定溶质质量分数的稀硫酸平均分成五份,依次加入上述烧杯中,充分反应,测得实验数据如表。
1 2 3 4 5
加入稀硫酸的质量/g 40 40 40 40 40
烧杯中剩余物质的质量/g 65.8 103.6 141.4 m 219.2
(1)m的值为 179.2 ,完全反应后生成二氧化碳的总质量为 8.8 g。
(2)计算该钾碱样品中碳酸钾的质量分数(写出计算过程,结果精确到0.1%)。
(3)第5次加入稀硫酸后所得溶液中K+和的个数比 < 2:1(填“>”、“<”或“=”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)179.2;8.8;
(2)98.6%;
(3)<。
【分析】(1)根据每加入40g稀硫酸,生成二氧化碳的质量增加2.2g,再结合题中数据来分析解答;
(2)根据二氧化碳的质量和方程式来分析解答;
(3)根据硫酸钾中钾离子和硫酸根离子的个数比2:1,第5次加入的稀硫酸过量来分析解答。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,第1次加入40g稀硫酸时,反应前样品质量28.0g加上稀硫酸质量40g为28.0g+40g=68g,反应后剩余物质质量为65.8g,则生成二氧化碳的质量为68g﹣65.8g=2.2g,第2次加入40g稀硫酸时,共加入稀硫酸40g+40g=80g,反应前总质量为28.0g+80g=108g,反应后剩余物质质量为103.6g,生成二氧化碳的质量为108g﹣103.6g = 4.4g,第3次加入40g稀硫酸时,共加入稀硫酸40g×3=120g,反应前总质量为28.0g+120g=148g,反应后剩余物质质量为141.4g,生成二氧化碳的质量为148g﹣141.4g=6.6g,可以发现每加入40g稀硫酸,生成二氧化碳的质量增加2.2g,当第4次加入40g稀硫酸时,若反应完全,生成二氧化碳的质量应为8.8g,反应前总质量为28.0g+40g×4=188g,则反应后剩余物质质量为188g﹣8.8g=179.2g,当第5次加入40g稀硫酸时,反应后剩余物质质量为219.2g,共加入稀硫酸40g×5=200g,反应前总质量为28.0g+200g=228g,生成二氧化碳的质量为228g﹣219.2g=8.8g,说明第4次加入稀硫酸时已经完全反应,完全反应后生成二氧化碳的总质量为8.8g;
(2)设参加反应的K2CO3的质量为x,
K2CO3+H2SO4=K2SO4+H2O+CO2↑
138 44
x 8.8g
x=27.6g
该钾碱样品中碳酸钾的质量分数为100%≈98.6%,
答:该钾碱样品中碳酸钾的质量分数是98.6%;
(3)根据化学方程式K2CO3+H2SO4=K2SO4+H2O+CO2↑,碳酸钾与硫酸反应生成硫酸钾,钾离子和硫酸根离子的个数比2:1,且加入的稀硫酸是过量的(因为到第5次加入稀硫酸后不再产生二氧化碳,说明碳酸钾已完全反应),稀硫酸会电离出硫酸根离子导致硫酸根离子的数量增多,所以第5次加入稀硫酸后所得溶液中K+和的个数比<2:1。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
22.(2025 眉山)过氧化钠(Na2O2)可在消防员的呼吸面具或潜水艇中作为氧气的来源。反应原理是:2Na2O2+2CO2=2Na2CO3+O2。据资料得知,每人每天消耗氧气1.6千克。某潜水艇上有50人,假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需的Na2O2的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】390kg。
【分析】根据每人每天消耗氧气1.6千克,某潜水艇上有50人,可以计算出50人一天消耗的氧气的质量,结合反应的化学方程式列式计算出该潜水艇一天所需的Na2O2的质量即可。
【解答】解:该潜水艇一天耗氧气的质量为1.6kg×50=80kg。
设该潜水艇一天所需的Na2O2的质量是x。
2Na2O2+2CO2═2Na2CO3+O2
156 32
x 80kg
x=390kg
答:该潜水艇一天所需的Na2O2的质量是390kg。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
23.(2025 江西)实践小组为测定某品牌纯碱样品中Na2CO3的质量分数,进行了如图实验(杂质不参与反应)。
(1)实验室取用纯碱粉末需用到的仪器为 药匙 ,加入稀盐酸观察到的现象是 产生大量气泡 。
(2)充分反应后生成气体的质量是 2.2 g。
(3)计算样品中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
(4)由于二氧化碳能溶于水,该实验测得样品中Na2CO3的质量分数会 偏小 (选填“偏大”“偏小”或“不变”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)药匙;产生大量气泡;
(2)2.2
(3)88.3%;
(4)偏小。
【分析】(1)根据实验室用药匙来取用固体粉末,以及碳酸钠和盐酸反应生成氯化钠、水和二氧化碳来分析;
(2)根据化学反应前后物质的总质量不变,则反应后烧杯中减小的质量即为生成二氧化碳的质量来分析;
(3)根据生成二氧化碳的质量和化学方程式的计算来分析;
(4)根据二氧化碳能溶于水,反应后烧杯中会溶解少量二氧化碳,导致计算出的二氧化碳质量偏小,由二氧化碳质量计算出的碳酸钠质量也会偏小来分析。
【解答】解:(1)实验室取用纯碱粉末需用到的仪器为药匙,加入稀盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,则观察到的现象是产生大量气泡。
(2)根据质量守恒定律,化学反应前后物质的总质量不变,则反应后烧杯中减小的质量即为生成二氧化碳的质量,由图中数据可知,充分反应后生成气体的质量是:6g+61.7g﹣65.5g=2.2g。
(3)设样品中Na2CO3的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
x=5.3g
则样品中Na2CO3的质量分数为:100%≈88.3%。
答:样品中Na2CO3的质量分数为88.3%。
(4)由于二氧化碳能溶于水,反应后烧杯中会溶解少量二氧化碳,导致计算出的二氧化碳质量偏小,由二氧化碳质量计算出的碳酸钠质量也会偏小,所以该实验测得样品中Na2CO3的质量分数会偏小。
故答案为:
(1)药匙;产生大量气泡;
(2)2.2
(3)88.3%;
(4)偏小。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
24.(2025 云南)高端芯片制造国产化是助力产业转型升级的重要支点。GaN是一种被广泛使用的半导体材料,合成纳米级GaN的原理之一为GaCl3+Li3N═GaN+3LiCl。若制得42gGaN,计算参加反应的Li3N的质量。
【考点】不含杂质的化学方程式计算.
【答案】17.5g
【分析】根据生成GaN的质量,结合反应的化学方程式列式计算出参加反应的Li3N的质量即可。
【解答】解:设参加反应的Li3N的质量为x。
GaCl3+Li3N═GaN+3LiCl
35 84
x 42g
x=17.5g
答:参加反应的Li3N的质量为17.5g。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
25.(2025 广安)过氧化钠(Na2O2)可在呼吸面具中作供氧剂,久置易变质。为了测定某呼吸面具供氧剂中过氧化钠的质量分数,小吴同学进行了如下实验:向5.0g供氧剂样品中加入适量的水,使其充分反应,化学反应方程式为2Na2O2+2H2O=4NaOH+O2↑(无其它产生氧气的反应),测得产生氧气的质量与时间关系如图所示:
(1)充分反应后,产生氧气的质量为 0.8 g。
(2)计算该供氧剂样品中过氧化钠的质量分数。(写出计算过程)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)0.8;
(2)78%。
【分析】根据图示可知,最终生成氧气的质量为0.8g,结合反应的化学方程式列式计算出参加反应的过氧化钠的质量,进而计算出该供氧剂样品中过氧化钠的质量分数。
【解答】解:(1)由图示可知,充分反应后,产生氧气的质量为0.8g。
故答案为:0.8。
(2)设参加反应的过氧化钠的质量为x。
2Na2O2+2H2O=4NaOH+O2↑
156 32
x 0.8g
x=3.9g
该供氧剂样品中过氧化钠的质量分数为100%=78%。
答:该供氧剂样品中过氧化钠的质量分数为78%。
【点评】本题有一定难度,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意和图示信息等各种信息,确定生成氧气的质量是正确解答本题的前提和关键。
26.(2025 达州)实验室取10g由CaCl2和NaCl组成的混合物,配制成不饱和溶液,向该溶液中逐滴加入Na2CO3溶液,生成沉淀与加入Na2CO3溶液的质量关系如图所示,请回答:
(1)CaCl2完全反应后生成CaCO3的质量为 2 g。
(2)A点对应的溶液中溶质为 氯化钠、碳酸钠 。
(3)求原混合物中CaCl2的质量分数(写出计算过程)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)2;
(2)氯化钠、碳酸钠;
(3)22.2%。
【分析】根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,最终生成碳酸钙沉淀的质量为2g,结合反应的化学方程式,列式计算出参加反应的氯化钙的质量,进而计算出原混合物中CaCl2的质量分数。
【解答】解:(1)由图示可知,CaCl2完全反应后生成CaCO3的质量为2g。
故答案为:2。
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,A点是两者恰好完全反应后,继续滴加碳酸钠溶液,对应的溶液中溶质为氯化钠、碳酸钠。
故答案为:氯化钠、碳酸钠。
(3)设原混合物中CaCl2的质量为x。
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
x 2g
x=2.22g
原混合物中CaCl2的质量分数为100%=22.2%。
答:原混合物中CaCl2的质量分数为22.2%。
【点评】本题有一定难度,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意、图示信息等各种信息,1的俗称碳酸钙沉淀的质量是正确解答本题的前提和关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考化学一轮复习 计算题
一.计算题(共26小题)
1.(2025 青海)2025年4月30日,神舟十九号载人飞船返回舱成功着陆。返回舱部分材质为铝合金,其成分中铝的工业制法原理为2Al2O34Al+3O2↑,生产54t铝需要电解的氧化铝质量是多少?
2.(2025 长沙)小化同学在老师的指导下进行“氧气的实验室制取与性质”的实验活动。高锰酸钾制氧气的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑。请计算:
(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为 ;
(2)实验中需要0.64g氧气,如果一药匙高锰酸钾的质量为3g,他取两药匙高锰酸钾完全反应制得的氧气是否足够实验所需?(写出计算过程及结果)
3.(2025 吉林)吉林省位于黄金玉米带上。提高粮食产量,需要合理施用化肥。尿素是氮肥中最主要的一种,合成尿素的原理是CO2+2NH3CO(NH2)2+H2O。回答下列问题。
(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为 。
(2)利用上述化学方程式计算:44吨CO2能与多少吨NH3恰好完全反应?
4.(2025 广东)甲醇(CH3OH)作为燃料应用于汽车领域,有助于推动能源结构优化。
(1)据图分析,CO单位排放量较高的是① 汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为② g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ.该反应催化剂主要成分三氧化二铟(In2O3)中In的化合价为③ 。
ⅱ.若要生产48tCH3OH,理论上至少需消耗CO2的质量是多少?(写出计算过程)④ 。
ⅲ.实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,则制得CH3OH的质量为⑤ kg。
5.(2025 黑龙江)剥开柑橘能闻到清香的气味,因为柑橘皮中含有芳樟醇(化学式为C10H18O)。请回答:
(1)芳樟醇的相对分子质量是 。
(2)芳樟醇中碳、氢、氧原子个数比为 。
(3)15.4g芳樟醇中碳元素的质量为 g。
6.(2025 齐齐哈尔)如图是一种加碘盐包装袋上的部分内容,请回答下列问题:
食品名称:天然海盐 配料:精制盐、碘酸钾 氯化钠:≥98.5g/100g 碘酸钾(以Ⅰ计):18 33mg/kg
(1)碘酸钾(KIO3)的相对分子质量是 。
(2)碘酸钾中钾元素和氧元素的质量比是 (写出最简整数比)。
(3)500g该食盐中碘元素的质量范围为 mg。
7.(2025 广西)碳化钛(TiC)具有高熔点、高硬度和高电导率的特点,在航空航天、电子工业等领域应用广泛。一种制备碳化钛的反应原理为:TiO2+3CTiC+2CO↑。
(1)TiC中Ti、C原子个数比为 ,Ti、C元素的质量比为 。
(2)用该方法制备90gTiC至少需要C的质量是多少?(写出计算过程)
8.(2025 天津)尿素[CO(NH2)2]是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
(1)尿素由 种元素组成(写数值);
(2)尿素的相对分子质量为 ;
(3)120g尿素中含有氮元素的质量为 g。
9.(2025 湖北)我国研制了世界最大口径碳化硅单体反射镜,应用于深空探测、气象观测等。
碳化硅可用硅与碳在高温下反应制备:
Si+CSiC
(1)SiC中硅、碳元素的质量比为 。
(2)若要制得40kgSiC,至少需要Si的质量是多少?(写出计算过程)
10.(2025 陕西)某水垢样品的主要成分是CaCO3和Mg(OH)2。学习小组同学想测定该水垢样品中CaCO3的质量分数,于是向盛有25g水垢样品的烧杯中加入100g足量稀盐酸,发生的反应是:CaCO3+2HCl═CaCl2+CO2↑+H2O,Mg(OH)2+2HCl═MgCl2+2H2O,待反应完全后,经称量烧杯内物质总质量为116.2g。(注意:忽略CO2在水中的溶解)
请完成下列分析及计算:
(1)实验过程中生成气体的质量是 g。
(2)计算该水垢样品中CaCO3的质量分数。
(3)实验所用稀盐酸的溶质质量分数 (填“大于”“小于”或“等于”)14.6%。
11.(2025 天津)现有一定质量的硫酸钠和硫酸铜的混合粉末,其中含钠元素2.3g。向该混合粉末中加入81.8g水,完全溶解后,逐滴滴入50g溶质质量分数为8%的氢氧化钠溶液,恰好完全反应,得到沉淀和溶液。计算:
(1)混合粉末中硫酸铜的质量;
(2)反应后所得溶液中溶质的质量分数;
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(1cm3=1mL;结果精确至0.1)。
12.(2025 山西)实验室用13g锌粒与足量的稀硫酸反应制取氢气,在标准状况下,理论上可以制得多少升氢气?(已知标准状况下,氢气的密度约为0.09g/L)
(1)反应前后,氢元素的化合价 (填“改变”或“不变”)。
(2)根据题目要求,完成计算过程(计算结果保留一位小数)。
13.(2025 湖南)化学社团同学为制作一个可以预测气温变化的简易“天气瓶”,查询到以下数据:
硝酸钾在不同温度时的溶解度
温度/℃ 10 20 30
溶解度/g 20.9 31.6 45.8
依据上述数据,完成下列问题。
(1)若“天气瓶”中物质的总质量为100g,则含氯化铵的质量是 g。
(2)计算10℃时硝酸钾饱和溶液中溶质的质量分数 (列出计算式,结果精确的0.1%)。
14.(2025 新疆)《天工开物》记载了用锡砂(主要成分为SnO2)冶炼金属锡(Sn)的方法,其反应原理为:C+SnO2Sn+CO2↑,用含SnO215.1t的锡砂,理论上可炼出锡的质量是多少?(写出计算过程)
15.(2025 福建)“84”消毒液(含NaClO)常用于环境消毒,其生产原理是:。欲生产100t质量分数为14.9%的NaClO溶液以配制“84”消毒液,请回答下列问题:
(1)100t该NaClO溶液含NaClO t。
(2)理论上需NaCl的质量是 (写出计算过程)。
16.(2025 安徽)氢气是清洁能源。硼氢化钠(NaBH4)作为一种环境友好的固体储氢材料,可与水反应生成氢气,化学方程式为NaBH4+2H2O=NaBO2+4H2↑。
(1)氢气被称为清洁能源的原因是 。
(2)某工厂生产燃料电池需要12t氢气,理论上需要NaBH4的质量是多少(写出计算过程)?
17.(2025 凉山州)某班同学在探究制取O2的多种方法时,通过查阅资料得知过氧化钠(Na2O2)能与H2O反应生成O2。为测定实验室中某过氧化钠样品的纯度(质量分数),他们将2g该样品与足量水反应(反应原理为2Na2O2+2H2O═4NaOH+O2↑,杂质不参与反应),并测得生成气体的质量与时间的关系如图所示。请完成下列题目:
(1)生成氧气的质量是 g。
(2)计算该样品中过氧化钠的质量分数。
18.(2025 烟台)化学小组同学在实践基地发现一袋久置的熟石灰,标签显示其含少量杂质(杂质不溶于水也不与酸反应)。同学们为探究其变质程度,进行以下实验。取该熟石灰样品10g于锥形瓶中,加入40g水,振荡,然后逐滴加入一定溶质质量分数的稀盐酸,边加边振荡。加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示。(忽略CO2在水中的溶解)请完成下列问题:
(1)10g该熟石灰样品产生CO2的质量是 g。
(2)计算所加入的稀盐酸的溶质质量分数。(写出计算过程,结果精确至0.1%)
(3)10g该熟石灰样品中氢氧化钙的质量是 g。(不写计算过程)
19.(2025 遂宁)化学是一门以实验为基础的自然学科,阳阳同学在实验室用100g一定溶质质量分数的过氧化氢溶液和二氧化锰制取氧气,完全反应后,生成氧气的质量与反应时间的关系如图:
(1)反应生成氧气的质量为 g。
(2)二氧化锰起 作用。
(3)计算参加反应的过氧化氢溶液的溶质质量分数(用方程式计算,写出解题过程)。
20.(2025 重庆)实验小组利用甲烷、氧气和氢氧化钠溶液组成的燃料电池进行模拟实验。一定条件下发生反应的化学方程式为CH4+2O2+2NaOHNa2CO3+3H2O,理论上若所有反应物刚好完全反应,恰好消耗100g4%的NaOH溶液。试计算:
(1)Na2CO3中碳元素与氧元素的质量比为 。
(2)所得溶液中溶质的质量分数(结果精确到0.1%)。
21.(2025 绥化)碳酸钾(K2CO3)俗称钾碱,主要用于印染、玻璃的生产等。为测定某钾碱样品中碳酸钾的质量分数,化学兴趣小组同学称取28.0g钾碱样品于烧杯中,将200.0g一定溶质质量分数的稀硫酸平均分成五份,依次加入上述烧杯中,充分反应,测得实验数据如表。
1 2 3 4 5
加入稀硫酸的质量/g 40 40 40 40 40
烧杯中剩余物质的质量/g 65.8 103.6 141.4 m 219.2
(1)m的值为 ,完全反应后生成二氧化碳的总质量为 g。
(2)计算该钾碱样品中碳酸钾的质量分数(写出计算过程,结果精确到0.1%)。
(3)第5次加入稀硫酸后所得溶液中K+和的个数比 2:1(填“>”、“<”或“=”)。
22.(2025 眉山)过氧化钠(Na2O2)可在消防员的呼吸面具或潜水艇中作为氧气的来源。反应原理是:2Na2O2+2CO2=2Na2CO3+O2。据资料得知,每人每天消耗氧气1.6千克。某潜水艇上有50人,假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需的Na2O2的质量是多少?(写出计算过程)
23.(2025 江西)实践小组为测定某品牌纯碱样品中Na2CO3的质量分数,进行了如图实验(杂质不参与反应)。
(1)实验室取用纯碱粉末需用到的仪器为 ,加入稀盐酸观察到的现象是 。
(2)充分反应后生成气体的质量是 g。
(3)计算样品中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
(4)由于二氧化碳能溶于水,该实验测得样品中Na2CO3的质量分数会 (选填“偏大”“偏小”或“不变”)。
24.(2025 云南)高端芯片制造国产化是助力产业转型升级的重要支点。GaN是一种被广泛使用的半导体材料,合成纳米级GaN的原理之一为GaCl3+Li3N═GaN+3LiCl。若制得42gGaN,计算参加反应的Li3N的质量。
25.(2025 广安)过氧化钠(Na2O2)可在呼吸面具中作供氧剂,久置易变质。为了测定某呼吸面具供氧剂中过氧化钠的质量分数,小吴同学进行了如下实验:向5.0g供氧剂样品中加入适量的水,使其充分反应,化学反应方程式为2Na2O2+2H2O=4NaOH+O2↑(无其它产生氧气的反应),测得产生氧气的质量与时间关系如图所示:
(1)充分反应后,产生氧气的质量为 g。
(2)计算该供氧剂样品中过氧化钠的质量分数。(写出计算过程)
26.(2025 达州)实验室取10g由CaCl2和NaCl组成的混合物,配制成不饱和溶液,向该溶液中逐滴加入Na2CO3溶液,生成沉淀与加入Na2CO3溶液的质量关系如图所示,请回答:
(1)CaCl2完全反应后生成CaCO3的质量为 g。
(2)A点对应的溶液中溶质为 。
(3)求原混合物中CaCl2的质量分数(写出计算过程)。
中考化学一轮复习 计算题
参考答案与试题解析
一.计算题(共26小题)
1.(2025 青海)2025年4月30日,神舟十九号载人飞船返回舱成功着陆。返回舱部分材质为铝合金,其成分中铝的工业制法原理为2Al2O34Al+3O2↑,生产54t铝需要电解的氧化铝质量是多少?
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】102t。
【分析】根据生成铝的质量、反应的化学方程式,列式计算出需要电解的氧化铝质量即可。
【解答】解:设需要电解的氧化铝质量为x。
2Al2O34Al+3O2↑
204 108
x 54t
x=102t
答:需要电解的氧化铝质量是102t。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
2.(2025 长沙)小化同学在老师的指导下进行“氧气的实验室制取与性质”的实验活动。高锰酸钾制氧气的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑。请计算:
(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为 39:55 ;
(2)实验中需要0.64g氧气,如果一药匙高锰酸钾的质量为3g,他取两药匙高锰酸钾完全反应制得的氧气是否足够实验所需?(写出计算过程及结果)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】有关化学方程式的计算.
【答案】(1)39:55。
(2)否。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)高锰酸钾(KMnO4)中钾元素、锰元素的质量比为39:55=39:55。
(2)设制取0.64g氧气需要高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 0.64g
x=6.32g
取两药匙高锰酸钾仅为6g小于6.32g
答:制得的氧气不足以满足实验所需。
故答案为:(1)39:55。
(2)否。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
3.(2025 吉林)吉林省位于黄金玉米带上。提高粮食产量,需要合理施用化肥。尿素是氮肥中最主要的一种,合成尿素的原理是CO2+2NH3CO(NH2)2+H2O。回答下列问题。
(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为 7:1 。
(2)利用上述化学方程式计算:44吨CO2能与多少吨NH3恰好完全反应?
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】有关化学方程式的计算.
【答案】(1)7:1;
(2)34吨。
【分析】(1)根据化学式进行元素质量比的计算;
(2)根据二氧化碳的质量和方程式求出氨气的质量来分析解答。
【解答】解:(1)CO(NH2)2中氮元素和氢元素质量的最简整数比为(14×2):(1×2×2)=7:1;
(2)设NH3的质量为x,
CO2+2NH3CO(NH2)2+H2O
44 34
44吨 x
x=34吨
答:44吨CO2能与34吨NH3恰好完全反应。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.(2025 广东)甲醇(CH3OH)作为燃料应用于汽车领域,有助于推动能源结构优化。
(1)据图分析,CO单位排放量较高的是① 汽油 汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为② 23 g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ.该反应催化剂主要成分三氧化二铟(In2O3)中In的化合价为③ +3 。
ⅱ.若要生产48tCH3OH,理论上至少需消耗CO2的质量是多少?(写出计算过程)④ 66t 。
ⅲ.实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,则制得CH3OH的质量为⑤ 56 kg。
【考点】物质的相互转化和制备;有关元素化合价的计算;不含杂质的化学方程式计算.
【专题】物质的制备.
【答案】(1)汽油;23;
(2)ⅰ、+3;
ⅱ、66t;
ⅲ、56。
【分析】(1)根据图中数据来分析;
(2)ⅰ、根据化合物中各元素正负化合价代数和为零来分析;
ⅱ、根据甲醇的质量和化学方程式的计算来分析;
ⅲ、根据化学反应前后元素的种类和质量不变,结合题中数据来分析。
【解答】解:(1)据图分析,CO单位排放量较高的是汽油汽车。每行驶100km,甲醇汽车比汽油汽车可减少排放NOx的质量为:(0.33﹣0.10)g/km×100km=23g。
(2)CO2制备CH3OH的化学方程式为CO2+3H2CH3OH+H2O。
ⅰ、三氧化二铟(In2O3)中氧元素的化合价为﹣2,根据化合物中各元素正负化合价代数和为零可知,In的化合价为+3。
ⅱ、设理论上至少需消耗CO2的质量是x。
CO2+3H2CH3OH+H2O
44 32
x 48t
x=66t
答:理论上至少需消耗CO2的质量是66t。
ⅲ、实际生产CH3OH时,还会生成CO。一定条件下,含碳产物中CH3OH和CO的质量分数分别为80%和20%,若反应了99kgCO2,根据质量守恒定律,化学反应前后元素的种类和质量不变,则生成CH3OH和CO中碳元素的质量为:99kg100%=27kg,设含碳产物的质量为m,由碳元素守恒可得:m×80%100%+m×20%100%=27kg,解得:m=70kg,所以制得CH3OH的质量为:70kg×80%=56kg。
故答案为:
(1)汽油;23;
(2)ⅰ、+3;
ⅱ、66t;
ⅲ、56。
【点评】本题主要考查了化合价原则、化学方程式的计算以及质量守恒定律的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
5.(2025 黑龙江)剥开柑橘能闻到清香的气味,因为柑橘皮中含有芳樟醇(化学式为C10H18O)。请回答:
(1)芳樟醇的相对分子质量是 154 。
(2)芳樟醇中碳、氢、氧原子个数比为 10:18:1 。
(3)15.4g芳樟醇中碳元素的质量为 12 g。
【考点】化合物中某元素的质量计算;化学式的书写及意义;相对分子质量的概念及其计算.
【专题】化学式的计算.
【答案】(1)154;
(2)10:18:1;
(3)12。
【分析】(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(2)根据1个芳樟醇分子的构成,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)C10H18O的相对分子质量为12×10+1×18+16×1=154。
(2)1个香樟醇分子是由10个碳原子、18个氢原子、1个氧原子构成的,则芳樟醇(C10H18O)中碳、氢、氧原子个数比为10:18:1。
(3)15.4g芳樟醇中碳元素的质量为。
故答案为:
(1)154;
(2)10:18:1;
(3)12。
【点评】本题难度不大,理解题意、灵活运用化学式的含义、有关计算等是正确解答本题的关键。
6.(2025 齐齐哈尔)如图是一种加碘盐包装袋上的部分内容,请回答下列问题:
食品名称:天然海盐 配料:精制盐、碘酸钾 氯化钠:≥98.5g/100g 碘酸钾(以Ⅰ计):18 33mg/kg
(1)碘酸钾(KIO3)的相对分子质量是 214 。
(2)碘酸钾中钾元素和氧元素的质量比是 13:16 (写出最简整数比)。
(3)500g该食盐中碘元素的质量范围为 9~16.5 mg。
【考点】化合物中某元素的质量计算;相对分子质量的概念及其计算;元素质量比的计算.
【专题】化学式的计算.
【答案】(1)214;
(2)13:16;
(3)9~16.5。
【分析】(1)根据相对分子质量=相对原子质量×原子个数之和来分析;
(2)根据元素的质量比=相对原子质量×原子个数之比来分析;
(3)根据碘酸钾(以I计)的含量为18 33mg/kg来分析。
【解答】解:(1)碘酸钾(KIO3)的相对分子质量为:39+127+16×3=39+127+48=214。
(2)碘酸钾(KIO3)中钾元素(K)与氧元素(O)的质量比为39:(16×3)=13:16。
(3)由题可知,碘酸钾(以I计)的含量为18 33mg/kg,500g=0.5kg,所以500g该食盐中碘元素的质量范围为0.5×18mg=9mg到0.5×33mg=16.5mg。
故答案为:
(1)214;
(2)13:16;
(3)9~16.5。
【点评】本题主要考查了化学式的相关计算,难度不大,根据所学知识,结合题中信息,认真分析即可解答。
7.(2025 广西)碳化钛(TiC)具有高熔点、高硬度和高电导率的特点,在航空航天、电子工业等领域应用广泛。一种制备碳化钛的反应原理为:TiO2+3CTiC+2CO↑。
(1)TiC中Ti、C原子个数比为 1:1 ,Ti、C元素的质量比为 4:1 。
(2)用该方法制备90gTiC至少需要C的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】化学式的计算;有关化学方程式的计算.
【答案】(1)1:1;4:1;
(2)54g。
【分析】(1)根据碳化钛化学式的含义、化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据生成碳化钛的质量,结合反应的化学方程式列式计算出至少需要C的质量即可。
【解答】解:(1)1个碳化钛分子中含有1个钛原子、1个碳原子,则TiC中Ti、C原子个数比为1:1;Ti、C元素的质量比为48:12=4:1。
故答案为:1:1;4:1。
(2)设至少需要C的质量为x。
TiO2+3CTiC+2CO↑
36 60
x 90g
x=54g
答:至少需要C的质量是54g。
【点评】本题难度不大,掌握利用化学方程式的计算、化学式的有关计算即可正确解答本题,解题时要注意解题的规范性。
8.(2025 天津)尿素[CO(NH2)2]是一种常见氮肥,可以促进植物茎、叶生长茂盛。计算:
(1)尿素由 4 种元素组成(写数值);
(2)尿素的相对分子质量为 60 ;
(3)120g尿素中含有氮元素的质量为 56 g。
【考点】化合物中某元素的质量计算;化学式的书写及意义;相对分子质量的概念及其计算.
【专题】化学式的计算.
【答案】(1)4;
(2)60;
(3)56。
【分析】(1)根据尿素化学式的含义,进行分析解答。
(2)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【解答】解:(1)尿素是由碳、氧、氮、氢4种元素组成的。
(2)尿素的相对分子质量为12+16+(14+1×2)×2=60。
(3)120g尿素中含有氮元素的质量为120g100%=56g。
故答案为:
(1)4;
(2)60;
(3)56。
【点评】本题难度不大,理解题意、灵活运用化学式的含义、有关计算等是正确解答本题的关键。
9.(2025 湖北)我国研制了世界最大口径碳化硅单体反射镜,应用于深空探测、气象观测等。
碳化硅可用硅与碳在高温下反应制备:
Si+CSiC
(1)SiC中硅、碳元素的质量比为 7:3 。
(2)若要制得40kgSiC,至少需要Si的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算;元素质量比的计算.
【专题】化学式的计算;有关化学方程式的计算.
【答案】(1)7:3;
(2)28kg。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据制得SiC的质量,结合反应的化学方程式列式计算出至少需要Si的质量即可。
【解答】解:(1)SiC中硅、碳元素的质量比为28:12=7:3。
故答案为:7:3。
(2)设至少需要Si的质量为x。
Si+CSiC
28 40
x 40kg
x=28kg
答:至少需要Si的质量是28kg。
【点评】本题难度不大,掌握利用化学方程式的计算、化学式的有关计算即可正确解答本题,解题时要注意解题的规范性。
10.(2025 陕西)某水垢样品的主要成分是CaCO3和Mg(OH)2。学习小组同学想测定该水垢样品中CaCO3的质量分数,于是向盛有25g水垢样品的烧杯中加入100g足量稀盐酸,发生的反应是:CaCO3+2HCl═CaCl2+CO2↑+H2O,Mg(OH)2+2HCl═MgCl2+2H2O,待反应完全后,经称量烧杯内物质总质量为116.2g。(注意:忽略CO2在水中的溶解)
请完成下列分析及计算:
(1)实验过程中生成气体的质量是 8.8 g。
(2)计算该水垢样品中CaCO3的质量分数。
(3)实验所用稀盐酸的溶质质量分数 大于 (填“大于”“小于”或“等于”)14.6%。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)8.8;
(2)80%;
(3)大于。
【分析】(1)根据质量守恒定律,化学反应前后物质的总质量不变来分析;
(2)根据生成二氧化碳的质量和化学方程式的计算来分析;
(3)根据化学方程式的计算和溶质质量分数的计算来分析。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,由题中数据可知,实验过程中生成气体的质量是:25g+100g﹣116.2g=8.8g。
(2)设该水垢样品中CaCO3的质量为x。
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 8.8g
x=20g
则该水垢样品中CaCO3的质量分数为:100%=80%。
答:该水垢样品中CaCO3的质量分数为80%。
(3)设参加反应的HCl的质量为y。
CaCO3+2HCl═CaCl2+CO2↑+H2O
73 44
y 8.8g
y=14.6g
即与CaCO3反应的HCl质量为14.6g,100g溶质质量分数为14.6%的稀盐酸中,HCl的质量为:100g×14.6%=14.6g,由于水垢中还有Mg(OH)2,所以参加反应的HCl质量一定大于14.6g,则实验所用稀盐酸的溶质质量分数大于14.6%。
故答案为:
(1)8.8;
(2)80%;
(3)大于。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
11.(2025 天津)现有一定质量的硫酸钠和硫酸铜的混合粉末,其中含钠元素2.3g。向该混合粉末中加入81.8g水,完全溶解后,逐滴滴入50g溶质质量分数为8%的氢氧化钠溶液,恰好完全反应,得到沉淀和溶液。计算:
(1)混合粉末中硫酸铜的质量;
(2)反应后所得溶液中溶质的质量分数;
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,需要20%的氢氧化钠溶液多少毫升(1cm3=1mL;结果精确至0.1)。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)8g;
(2)10%;
(3)16.7mL。
【分析】(1)根据参加反应的氢氧化钠质量和化学方程式的计算来分析;
(2)根据溶质质量分数100%来分析;
(3)根据溶液稀释前后溶质的质量不变来分析。
【解答】解:(1)硫酸钠和氢氧化钠不反应,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,由题中数据可知,参加反应的氢氧化钠质量为:50g×8%=4g;
设混合粉末中硫酸铜的质量为x,生成氢氧化铜的质量为y,生成硫酸钠的质量为z。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98 142
x 4g y z
,x=8g
,y=4.9g
,z=7.1g
答:混合粉末中硫酸铜的质量为8g。
(2)一定质量的硫酸钠和硫酸铜的混合粉末中含钠元素2.3g,只有硫酸钠中含有钠元素,则混合粉末中硫酸钠的质量为:2.3g÷(100%)=7.1g,硫酸铜和氢氧化钠反应生成了7.1g硫酸钠,则所得溶液中溶质的质量为:7.1g+7.1g=14.2g,而所得溶液的质量为:81.8g+50g+7.1g+8g﹣4.9g=142g,则所得溶液中溶质的质量分数为:。
答:反应后所得溶液中溶质的质量分数为10%。
(3)若用20%的氢氧化钠溶液(密度为1.2g/cm3)配制上述50g质量分数为8%的氢氧化钠溶液,根据溶液稀释前后溶质的质量不变可知,需要20%的氢氧化钠溶液的质量为:50g×8%÷20%=20g,体积为:20g÷1.2g/cm3≈16.7cm3≈16.7mL
答:需要20%的氢氧化钠溶液体积为16.7mL。
故答案为:
(1)8g;
(2)10%;
(3)16.7mL。
【点评】本题主要考查了溶质质量分数结合化学方程式的计算,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
12.(2025 山西)实验室用13g锌粒与足量的稀硫酸反应制取氢气,在标准状况下,理论上可以制得多少升氢气?(已知标准状况下,氢气的密度约为0.09g/L)
(1)反应前后,氢元素的化合价 改变 (填“改变”或“不变”)。
(2)根据题目要求,完成计算过程(计算结果保留一位小数)。
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】(1)改变;
(2)4.4L。
【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价的代数和为零,进行分析解答。
(2)根据参加反应的锌的质量,结合反应的化学方程式,列式计算出在可以制得氢气的质量,进而计算出在标准状况下氢气的体积。
【解答】解:(1)硫酸中氢元素显+1价,单质中元素的化合价为0,H2属于单质,故氢元素的化合价为0,则反应前后,氢元素的化合价改变。
故答案为:改变。
(2)设生成氢气的质量为x。
Zn+H2SO4═ZnSO4+H2↑
65 2
13g x
x=0.4g
标准状况下氢气的体积为0.4g÷0.09g/L≈4.4L。
答:在标准状况下,理论上可以制得4.4L氢气。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
13.(2025 湖南)化学社团同学为制作一个可以预测气温变化的简易“天气瓶”,查询到以下数据:
硝酸钾在不同温度时的溶解度
温度/℃ 10 20 30
溶解度/g 20.9 31.6 45.8
依据上述数据,完成下列问题。
(1)若“天气瓶”中物质的总质量为100g,则含氯化铵的质量是 3.1 g。
(2)计算10℃时硝酸钾饱和溶液中溶质的质量分数 17.3% (列出计算式,结果精确的0.1%)。
【考点】溶质的质量分数、溶解性和溶解度的关系;有关溶质质量分数的简单计算.
【专题】溶液、浊液与溶解度.
【答案】(1)3.1;
(2)17.3%。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据饱和溶液中溶质质量分数100%,进行分析解答。
【解答】解:(1)由图中数据可知,“天气瓶”中氯化铵的质量分数为3.1%,若总质量为100g,则含氯化铵的质量为100g×3.1%=3.1g。
(2)由图中数据可知,10℃时,硝酸钾的溶解度为20.9g,则10℃时,硝酸钾饱和溶液中溶质的质量分数为:。
故答案为:
(1)3.1;
(2)17.3%。
【点评】本题难度不大,了解饱和溶液中溶质质量分数100%、溶质质量=溶液质量×溶质的质量分数是正确解答本题的关键。
14.(2025 新疆)《天工开物》记载了用锡砂(主要成分为SnO2)冶炼金属锡(Sn)的方法,其反应原理为:C+SnO2Sn+CO2↑,用含SnO215.1t的锡砂,理论上可炼出锡的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】11.9t。
【分析】根据二氧化锡的质量和化学方程式的计算来分析。
【解答】解:设理论上可炼出锡的质量是x。
C+SnO2Sn+CO2↑
151 119
15.1t x
x=11.9t
答:用含SnO215.1t的锡砂,理论上可炼出锡的质量是11.9t。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
15.(2025 福建)“84”消毒液(含NaClO)常用于环境消毒,其生产原理是:。欲生产100t质量分数为14.9%的NaClO溶液以配制“84”消毒液,请回答下列问题:
(1)100t该NaClO溶液含NaClO 14.9 t。
(2)理论上需NaCl的质量是 11.7t (写出计算过程)。
【考点】不含杂质的化学方程式计算;有关溶质质量分数的简单计算.
【专题】溶液的组成及溶质质量分数的计算;有关化学方程式的计算.
【答案】(1)14.9;
(2)11.7t。
【分析】(1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据参加反应的NaClO的质量,结合反应的化学方程式,列式计算出参加反应的氯化钠的质量即可。
【解答】解:(1)100t该NaClO溶液含NaClO的质量为100t×14.9%=14.9t。
(2)设理论上需NaCl的质量为x
x=11.7t
答:理论上需NaCl的质量为11.7t。
【点评】本题难度不大,掌握利用化学方程式的计算、溶质质量=溶液质量×溶质的质量分数即可正确解答本题,解题时要注意解题的规范性。
16.(2025 安徽)氢气是清洁能源。硼氢化钠(NaBH4)作为一种环境友好的固体储氢材料,可与水反应生成氢气,化学方程式为NaBH4+2H2O=NaBO2+4H2↑。
(1)氢气被称为清洁能源的原因是 产物为水,无污染 。
(2)某工厂生产燃料电池需要12t氢气,理论上需要NaBH4的质量是多少(写出计算过程)?
【考点】不含杂质的化学方程式计算;氢气的用途和氢能的优缺点.
【专题】有关化学方程式的计算.
【答案】(1)产物为水,无污染;
(2)57t。
【分析】(1)根据氢气燃烧生成水,进行分析解答。
(2)根据生成氢气的质量,结合反应的化学方程式列式计算出参加反应的NaBH4的质量即可。
【解答】解:(1)氢气燃烧生成水,无污染,被称为清洁能源。
故答案为:产物为水,无污染。
(2)设理论上需要NaBH4的质量为x。
NaBH4+2H2O=NaBO2+4H2↑
38 8
x 12t
x=57t
答:理论上需要NaBH4的质量为57t。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
17.(2025 凉山州)某班同学在探究制取O2的多种方法时,通过查阅资料得知过氧化钠(Na2O2)能与H2O反应生成O2。为测定实验室中某过氧化钠样品的纯度(质量分数),他们将2g该样品与足量水反应(反应原理为2Na2O2+2H2O═4NaOH+O2↑,杂质不参与反应),并测得生成气体的质量与时间的关系如图所示。请完成下列题目:
(1)生成氧气的质量是 0.32 g。
(2)计算该样品中过氧化钠的质量分数。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)0.32。
(2)78%。
【分析】(1)根据图示信息,生成气体的质量为0.32g,这是氧气的质量。
(2)根据氧气的质量和化学方程式,可以计算出过氧化钠的质量,进而计算出样品中过氧化钠的质量分数。
【解答】解:(1)根据图示,生成氧气的质量是0.32g。故答案为:0.32。
(2)设过氧化钠的质量为x,
2Na2O2+2H2O=4NaOH+O2↑
156 32
x 0.32g
x=1.56g
样品中过氧化钠的质量分数为:100%=78%,故答案为:78%。
【点评】本题主要考查了化学方程式的应用和质量分数的计算。完成此题需要从题干中抽取有用的信息,结合已有的化学知识进行分析和解答。通过这些知识点的综合应用,可以加深对化学反应和物质质量关系的理解,同时也体现了化学知识在实验数据处理中的实际应用价值。同时,这也考查了学生对化学反应微观过程的理解能力,以及将微观变化与宏观化学方程式联系起来的能力。
18.(2025 烟台)化学小组同学在实践基地发现一袋久置的熟石灰,标签显示其含少量杂质(杂质不溶于水也不与酸反应)。同学们为探究其变质程度,进行以下实验。取该熟石灰样品10g于锥形瓶中,加入40g水,振荡,然后逐滴加入一定溶质质量分数的稀盐酸,边加边振荡。加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示。(忽略CO2在水中的溶解)请完成下列问题:
(1)10g该熟石灰样品产生CO2的质量是 0.88 g。
(2)计算所加入的稀盐酸的溶质质量分数。(写出计算过程,结果精确至0.1%)
(3)10g该熟石灰样品中氢氧化钙的质量是 7.4 g。(不写计算过程)
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)0.88。
(2)14.6%。
(3)7.4。
【分析】加入50g稀盐酸,稀盐酸恰好和氢氧化钙完全反应生成氯化钙和水,再加入10g稀盐酸,稀盐酸恰好和碳酸钙反应生成氯化钙、水和二氧化碳,生成二氧化碳质量是50g+60g﹣109.12g=0.88g。
【解答】解:(1)10g该熟石灰样品产生CO2的质量是0.88g。
故答案为:0.88。
(2)与碳酸钙反应的稀盐酸质量是60g﹣50g=10g。
设所加入的稀盐酸的溶质质量分数是x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
10gx 0.88g
x=14.6%
答:稀盐酸质量分数是14.6%。
(3)设10g该熟石灰样品中氢氧化钙的质量是y。
Ca(OH)2+2HCl═CaCl2+2H2O
74 73
y 50g×14.6%
y=7.4g
答:氢氧化钙质量是7.4g。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
19.(2025 遂宁)化学是一门以实验为基础的自然学科,阳阳同学在实验室用100g一定溶质质量分数的过氧化氢溶液和二氧化锰制取氧气,完全反应后,生成氧气的质量与反应时间的关系如图:
(1)反应生成氧气的质量为 3.2 g。
(2)二氧化锰起 催化 作用。
(3)计算参加反应的过氧化氢溶液的溶质质量分数(用方程式计算,写出解题过程)。
【考点】溶质质量分数结合化学方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【答案】(1)3.2。
(2)催化。
(3)6.8%。
【分析】根据反应的化学方程式及其提供数据可以进行相关方面的计算和判断。
【解答】解:(1)反应生成氧气的质量为3.2g。
故答案为:3.2。
(2)二氧化锰起催化作用。
故答案为:催化。
(3)设参加反应的过氧化氢溶液的溶质质量分数是x。
2H2O22H2O+O2↑
68 32
100gx 3.2g
x=6.8%
答:过氧化氢溶液质量分数是6.8%。
【点评】本题主要考查学生进行计算和推断的能力,计算时要注意规范性和准确性。
20.(2025 重庆)实验小组利用甲烷、氧气和氢氧化钠溶液组成的燃料电池进行模拟实验。一定条件下发生反应的化学方程式为CH4+2O2+2NaOHNa2CO3+3H2O,理论上若所有反应物刚好完全反应,恰好消耗100g4%的NaOH溶液。试计算:
(1)Na2CO3中碳元素与氧元素的质量比为 1:4 。
(2)所得溶液中溶质的质量分数(结果精确到0.1%)。
【考点】溶质质量分数结合化学方程式的计算;元素质量比的计算.
【专题】化学式的计算;溶质质量分数与化学方程式相结合的计算.
【答案】(1)1:4;
(2)5.1%。
【分析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据参加反应的氢氧化钠溶液的质量、溶质质量分数,结合反应的化学方程式列式计算出生成碳酸钠的质量,进而计算出所得溶液中溶质的质量分数。
【解答】解:(1)Na2CO3中碳元素与氧元素的质量比为(12×1):(16×3)=1:4。
故答案为:1:4。
(2)设参加反应的甲烷的质量为x,参加反应的氧气的质量为y,生成碳酸钠的质量为z。
CH4+2O2+2NaOHNa2CO3+3H2O
16 64 80 106
x y 100g×4% z
x=0.8g
y=3.2g
z=5.3g
所得溶液中溶质的质量分数为100%≈5.1%。
答:所得溶液中溶质的质量分数为5.1%。
【点评】本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性。
21.(2025 绥化)碳酸钾(K2CO3)俗称钾碱,主要用于印染、玻璃的生产等。为测定某钾碱样品中碳酸钾的质量分数,化学兴趣小组同学称取28.0g钾碱样品于烧杯中,将200.0g一定溶质质量分数的稀硫酸平均分成五份,依次加入上述烧杯中,充分反应,测得实验数据如表。
1 2 3 4 5
加入稀硫酸的质量/g 40 40 40 40 40
烧杯中剩余物质的质量/g 65.8 103.6 141.4 m 219.2
(1)m的值为 179.2 ,完全反应后生成二氧化碳的总质量为 8.8 g。
(2)计算该钾碱样品中碳酸钾的质量分数(写出计算过程,结果精确到0.1%)。
(3)第5次加入稀硫酸后所得溶液中K+和的个数比 < 2:1(填“>”、“<”或“=”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)179.2;8.8;
(2)98.6%;
(3)<。
【分析】(1)根据每加入40g稀硫酸,生成二氧化碳的质量增加2.2g,再结合题中数据来分析解答;
(2)根据二氧化碳的质量和方程式来分析解答;
(3)根据硫酸钾中钾离子和硫酸根离子的个数比2:1,第5次加入的稀硫酸过量来分析解答。
【解答】解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,第1次加入40g稀硫酸时,反应前样品质量28.0g加上稀硫酸质量40g为28.0g+40g=68g,反应后剩余物质质量为65.8g,则生成二氧化碳的质量为68g﹣65.8g=2.2g,第2次加入40g稀硫酸时,共加入稀硫酸40g+40g=80g,反应前总质量为28.0g+80g=108g,反应后剩余物质质量为103.6g,生成二氧化碳的质量为108g﹣103.6g = 4.4g,第3次加入40g稀硫酸时,共加入稀硫酸40g×3=120g,反应前总质量为28.0g+120g=148g,反应后剩余物质质量为141.4g,生成二氧化碳的质量为148g﹣141.4g=6.6g,可以发现每加入40g稀硫酸,生成二氧化碳的质量增加2.2g,当第4次加入40g稀硫酸时,若反应完全,生成二氧化碳的质量应为8.8g,反应前总质量为28.0g+40g×4=188g,则反应后剩余物质质量为188g﹣8.8g=179.2g,当第5次加入40g稀硫酸时,反应后剩余物质质量为219.2g,共加入稀硫酸40g×5=200g,反应前总质量为28.0g+200g=228g,生成二氧化碳的质量为228g﹣219.2g=8.8g,说明第4次加入稀硫酸时已经完全反应,完全反应后生成二氧化碳的总质量为8.8g;
(2)设参加反应的K2CO3的质量为x,
K2CO3+H2SO4=K2SO4+H2O+CO2↑
138 44
x 8.8g
x=27.6g
该钾碱样品中碳酸钾的质量分数为100%≈98.6%,
答:该钾碱样品中碳酸钾的质量分数是98.6%;
(3)根据化学方程式K2CO3+H2SO4=K2SO4+H2O+CO2↑,碳酸钾与硫酸反应生成硫酸钾,钾离子和硫酸根离子的个数比2:1,且加入的稀硫酸是过量的(因为到第5次加入稀硫酸后不再产生二氧化碳,说明碳酸钾已完全反应),稀硫酸会电离出硫酸根离子导致硫酸根离子的数量增多,所以第5次加入稀硫酸后所得溶液中K+和的个数比<2:1。
【点评】本题主要考查化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
22.(2025 眉山)过氧化钠(Na2O2)可在消防员的呼吸面具或潜水艇中作为氧气的来源。反应原理是:2Na2O2+2CO2=2Na2CO3+O2。据资料得知,每人每天消耗氧气1.6千克。某潜水艇上有50人,假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需的Na2O2的质量是多少?(写出计算过程)
【考点】不含杂质的化学方程式计算.
【专题】有关化学方程式的计算.
【答案】390kg。
【分析】根据每人每天消耗氧气1.6千克,某潜水艇上有50人,可以计算出50人一天消耗的氧气的质量,结合反应的化学方程式列式计算出该潜水艇一天所需的Na2O2的质量即可。
【解答】解:该潜水艇一天耗氧气的质量为1.6kg×50=80kg。
设该潜水艇一天所需的Na2O2的质量是x。
2Na2O2+2CO2═2Na2CO3+O2
156 32
x 80kg
x=390kg
答:该潜水艇一天所需的Na2O2的质量是390kg。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
23.(2025 江西)实践小组为测定某品牌纯碱样品中Na2CO3的质量分数,进行了如图实验(杂质不参与反应)。
(1)实验室取用纯碱粉末需用到的仪器为 药匙 ,加入稀盐酸观察到的现象是 产生大量气泡 。
(2)充分反应后生成气体的质量是 2.2 g。
(3)计算样品中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
(4)由于二氧化碳能溶于水,该实验测得样品中Na2CO3的质量分数会 偏小 (选填“偏大”“偏小”或“不变”)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)药匙;产生大量气泡;
(2)2.2
(3)88.3%;
(4)偏小。
【分析】(1)根据实验室用药匙来取用固体粉末,以及碳酸钠和盐酸反应生成氯化钠、水和二氧化碳来分析;
(2)根据化学反应前后物质的总质量不变,则反应后烧杯中减小的质量即为生成二氧化碳的质量来分析;
(3)根据生成二氧化碳的质量和化学方程式的计算来分析;
(4)根据二氧化碳能溶于水,反应后烧杯中会溶解少量二氧化碳,导致计算出的二氧化碳质量偏小,由二氧化碳质量计算出的碳酸钠质量也会偏小来分析。
【解答】解:(1)实验室取用纯碱粉末需用到的仪器为药匙,加入稀盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,则观察到的现象是产生大量气泡。
(2)根据质量守恒定律,化学反应前后物质的总质量不变,则反应后烧杯中减小的质量即为生成二氧化碳的质量,由图中数据可知,充分反应后生成气体的质量是:6g+61.7g﹣65.5g=2.2g。
(3)设样品中Na2CO3的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
x=5.3g
则样品中Na2CO3的质量分数为:100%≈88.3%。
答:样品中Na2CO3的质量分数为88.3%。
(4)由于二氧化碳能溶于水,反应后烧杯中会溶解少量二氧化碳,导致计算出的二氧化碳质量偏小,由二氧化碳质量计算出的碳酸钠质量也会偏小,所以该实验测得样品中Na2CO3的质量分数会偏小。
故答案为:
(1)药匙;产生大量气泡;
(2)2.2
(3)88.3%;
(4)偏小。
【点评】本题主要考查了化学方程式的计算,在根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
24.(2025 云南)高端芯片制造国产化是助力产业转型升级的重要支点。GaN是一种被广泛使用的半导体材料,合成纳米级GaN的原理之一为GaCl3+Li3N═GaN+3LiCl。若制得42gGaN,计算参加反应的Li3N的质量。
【考点】不含杂质的化学方程式计算.
【答案】17.5g
【分析】根据生成GaN的质量,结合反应的化学方程式列式计算出参加反应的Li3N的质量即可。
【解答】解:设参加反应的Li3N的质量为x。
GaCl3+Li3N═GaN+3LiCl
35 84
x 42g
x=17.5g
答:参加反应的Li3N的质量为17.5g。
【点评】本题难度不大,掌握利用化学方程式的计算即可正确解答本题,解题时要注意解题的规范性。
25.(2025 广安)过氧化钠(Na2O2)可在呼吸面具中作供氧剂,久置易变质。为了测定某呼吸面具供氧剂中过氧化钠的质量分数,小吴同学进行了如下实验:向5.0g供氧剂样品中加入适量的水,使其充分反应,化学反应方程式为2Na2O2+2H2O=4NaOH+O2↑(无其它产生氧气的反应),测得产生氧气的质量与时间关系如图所示:
(1)充分反应后,产生氧气的质量为 0.8 g。
(2)计算该供氧剂样品中过氧化钠的质量分数。(写出计算过程)
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)0.8;
(2)78%。
【分析】根据图示可知,最终生成氧气的质量为0.8g,结合反应的化学方程式列式计算出参加反应的过氧化钠的质量,进而计算出该供氧剂样品中过氧化钠的质量分数。
【解答】解:(1)由图示可知,充分反应后,产生氧气的质量为0.8g。
故答案为:0.8。
(2)设参加反应的过氧化钠的质量为x。
2Na2O2+2H2O=4NaOH+O2↑
156 32
x 0.8g
x=3.9g
该供氧剂样品中过氧化钠的质量分数为100%=78%。
答:该供氧剂样品中过氧化钠的质量分数为78%。
【点评】本题有一定难度,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意和图示信息等各种信息,确定生成氧气的质量是正确解答本题的前提和关键。
26.(2025 达州)实验室取10g由CaCl2和NaCl组成的混合物,配制成不饱和溶液,向该溶液中逐滴加入Na2CO3溶液,生成沉淀与加入Na2CO3溶液的质量关系如图所示,请回答:
(1)CaCl2完全反应后生成CaCO3的质量为 2 g。
(2)A点对应的溶液中溶质为 氯化钠、碳酸钠 。
(3)求原混合物中CaCl2的质量分数(写出计算过程)。
【考点】化学方程式与实验的计算.
【专题】有关化学方程式的计算.
【答案】(1)2;
(2)氯化钠、碳酸钠;
(3)22.2%。
【分析】根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,最终生成碳酸钙沉淀的质量为2g,结合反应的化学方程式,列式计算出参加反应的氯化钙的质量,进而计算出原混合物中CaCl2的质量分数。
【解答】解:(1)由图示可知,CaCl2完全反应后生成CaCO3的质量为2g。
故答案为:2。
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,A点是两者恰好完全反应后,继续滴加碳酸钠溶液,对应的溶液中溶质为氯化钠、碳酸钠。
故答案为:氯化钠、碳酸钠。
(3)设原混合物中CaCl2的质量为x。
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
x 2g
x=2.22g
原混合物中CaCl2的质量分数为100%=22.2%。
答:原混合物中CaCl2的质量分数为22.2%。
【点评】本题有一定难度,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意、图示信息等各种信息,1的俗称碳酸钙沉淀的质量是正确解答本题的前提和关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
