备考2026年中考化学一轮复习 溶解度曲线及其应用(含解析)
文档属性
| 名称 | 备考2026年中考化学一轮复习 溶解度曲线及其应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-31 17:03:21 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中考化学一轮复习 溶解度曲线及其应用
一.选择题(共12小题)
1.(2025 广安)20℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量关系如图所示(图中两线相交于c点)。下列分析错误的是( )
A.20℃时,b点对应的乙溶液是不饱和溶液
B.20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等
C.20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲
D.20℃时,甲的饱和溶液溶质质量分数为25%
2.(2025 连云港)80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3的溶解度曲线如图所示。下列说法正确的是( )
A.Na2CO3的溶解度一定比Li2SO4的大
B.20℃时Li2SO4饱和溶液升温到40℃时变为不饱和溶液
C.40℃时将60gNa2CO3固体加入100g水中得到160g溶液
D.该制备反应利用了Li2CO3溶解度相对较小的性质
3.(2025 达州)a、b、c三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.a中混有少量b,可采用降温结晶的方法提纯a
B.t1℃时,a、c饱和溶液的溶质质量分数相等
C.t2℃时,将40ga加入50g水中充分溶解,所得溶液质量为70g
D.t3℃时,a、b、c的溶解度由大到小的关系是c>b>a
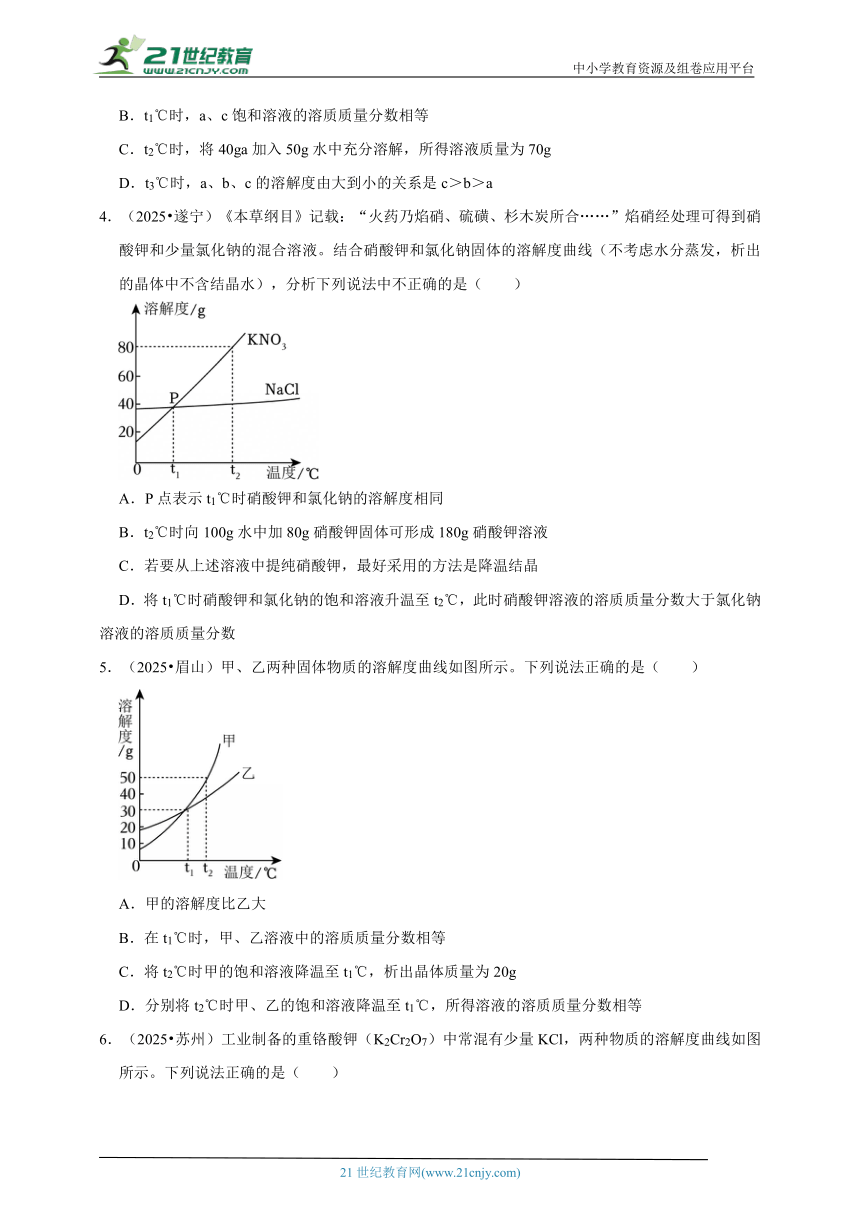
4.(2025 遂宁)《本草纲目》记载:“火药乃焰硝、硫磺、杉木炭所合……”焰硝经处理可得到硝酸钾和少量氯化钠的混合溶液。结合硝酸钾和氯化钠固体的溶解度曲线(不考虑水分蒸发,析出的晶体中不含结晶水),分析下列说法中不正确的是( )
A.P点表示t1℃时硝酸钾和氯化钠的溶解度相同
B.t2℃时向100g水中加80g硝酸钾固体可形成180g硝酸钾溶液
C.若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶
D.将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,此时硝酸钾溶液的溶质质量分数大于氯化钠溶液的溶质质量分数
5.(2025 眉山)甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.在t1℃时,甲、乙溶液中的溶质质量分数相等
C.将t2℃时甲的饱和溶液降温至t1℃,析出晶体质量为20g
D.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液的溶质质量分数相等
6.(2025 苏州)工业制备的重铬酸钾(K2Cr2O7)中常混有少量KCl,两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.K2Cr2O7的溶解度一定比KCl的大
B.40℃时,将50gKCl加入100g水中,所得溶液质量为150g
C.60℃时,两种物质的饱和溶液的溶质质量分数相等
D.采用蒸发结晶的方法可除去K2Cr2O7中混有的少量KCl
7.(2025 德阳)五水硫酸铜(CuSO4 5H2O)的溶解度曲线如图所示。结合你参与的“制备五水硫酸铜晶体”跨学科实践活动分析。下列说法错误的是( )
A.20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大
B.60℃时,50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液
C.根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体
D.饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状无影响
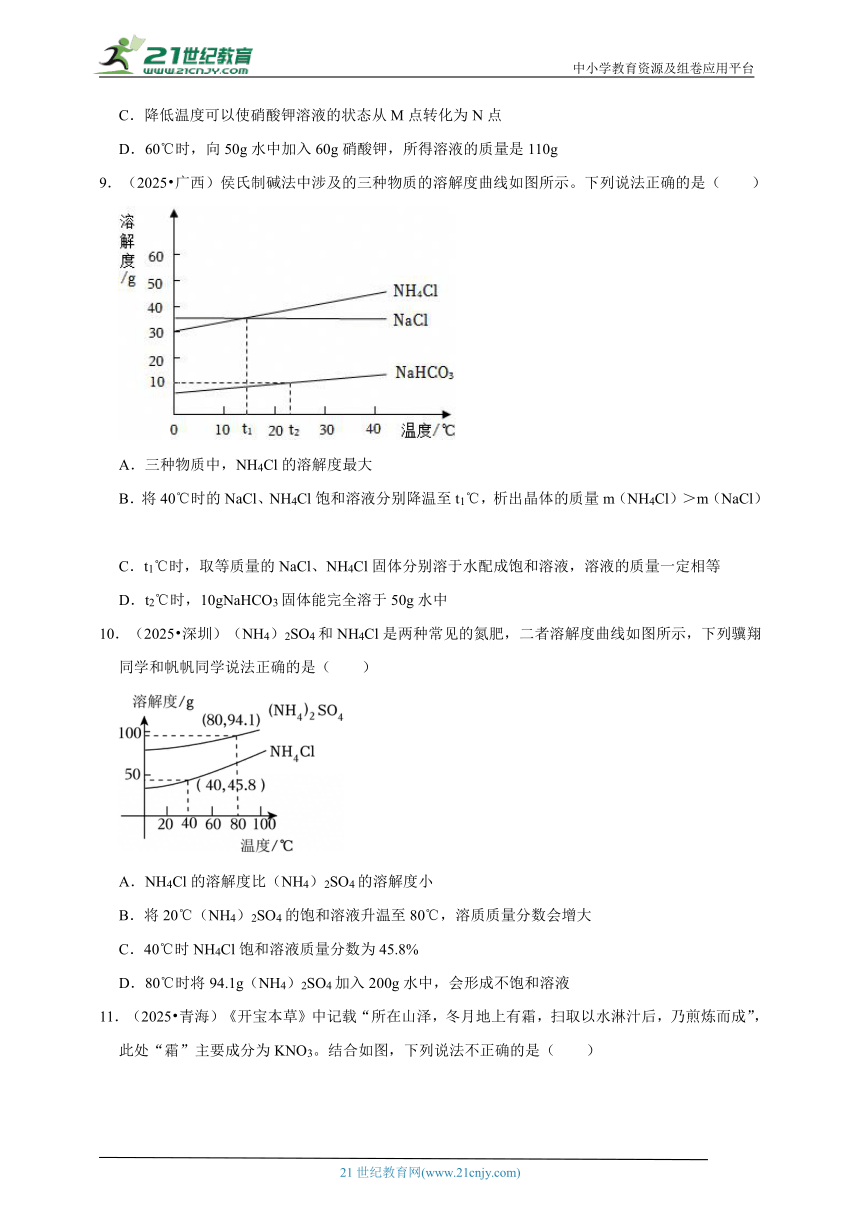
8.(2025 新疆)如图是硝酸钾的溶解度曲线。下列说法不正确的是( )
A.硝酸钾的溶解度随温度的升高而增大
B.60℃时,M点的硝酸钾溶液是不饱和溶液
C.降低温度可以使硝酸钾溶液的状态从M点转化为N点
D.60℃时,向50g水中加入60g硝酸钾,所得溶液的质量是110g
9.(2025 广西)侯氏制碱法中涉及的三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.三种物质中,NH4Cl的溶解度最大
B.将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,析出晶体的质量m(NH4Cl)>m(NaCl)
C.t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等
D.t2℃时,10gNaHCO3固体能完全溶于50g水中
10.(2025 深圳)(NH4)2SO4和NH4Cl是两种常见的氮肥,二者溶解度曲线如图所示,下列骥翔同学和帆帆同学说法正确的是( )
A.NH4Cl的溶解度比(NH4)2SO4的溶解度小
B.将20℃(NH4)2SO4的饱和溶液升温至80℃,溶质质量分数会增大
C.40℃时NH4Cl饱和溶液质量分数为45.8%
D.80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液
11.(2025 青海)《开宝本草》中记载“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,此处“霜”主要成分为KNO3。结合如图,下列说法不正确的是( )
A.20℃时,KNO3的溶解度是63.9g
B.“扫取以水淋汁”体现了硝酸钾易溶于水
C.40℃时,将70gKNO3加入100g水中得到饱和溶液
D.“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低
12.(2025 成都)《史记正义》记载“垦畦浇晒”产盐法,过程如图。卤水含大量Na2SO4和NaCl等物质,结合溶解度曲线分析,下列说法正确的是( )
A.晶体1是NaCl,晶体2是Na2SO4
B.“过箩”到“晒制”,NaCl的质量分数一直变大
C.“母液”中含有Na2SO4和NaCl
D.降温结晶可除去NaCl溶液中的少量Na2SO4
二.选择填充题(共1小题)
13.(2025 江西)从盐卤水(含硫酸钠、氯化钠等)中提取的硫酸钠可用于制中药西瓜霜,硫酸钠和氯化钠的溶解度曲线如图。下列说法正确的是 。
A.40℃时氯化钠的溶解度是48.8g
B.t℃时氯化钠溶液和硫酸钠溶液的溶质质量相等
C.可用降温结晶的方法从盐卤水中提取硫酸钠晶体
D.将t℃饱和硫酸钠溶液变为不饱和溶液的方法是
三.填空题(共6小题)
14.(2025 长沙)小湖同学在进行“海洋资源的综合利用与制盐”跨学科实践活动中,查阅到海水中氯化钠和硫酸钠的溶解度曲线如图所示。
(1)在0~40℃时,图中物质的溶解度受温度影响较大的是 。
(2)在t℃时,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数 (填“相等”或“不相等”)。
(3)通过实践活动最终获得了氯化钠固体,写出氯化钠的一种用途 。
15.(2025 黑龙江)海洋蕴藏着丰富的资源,人类应合理开发和应用。海水中含有KCl和MgSO4等物质,其在不同温度时的溶解度如下表所示,下图是对应的溶解度曲线。
温度℃ 20 30 40 60 80 100
溶解度/g KCl 34.0 37.0 40.0 45.5 51.1 56.7
MgSO4 33.7 38.9 44.5 54.6 55.8 50.4
(1)代表KCl溶解度曲线的是 (填“甲”或“乙”)。
(2)40℃时,将30gKCl固体加入50g水中,充分溶解后,所得溶液的质量为 g。
(3)t2℃时,将等质量的甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量甲 乙(填“>”“<”或“=”)。
(4)t3℃时,将100gMgSO4饱和溶液逐渐降温经t2℃直至t1℃,其溶质质量分数的变化趋势是 。
16.(2025 齐齐哈尔)如图是硝酸钾和氯化钠的溶解度曲线。请回答下列问题:
(1)图中P点的含义是 。
(2)若氯化钠中混有少量硝酸钾,可用 (填“蒸发结晶”或“降温结晶”)的方法提纯氯化钠。
(3)50℃时,将90g硝酸钾加入100g水中,充分溶解后,所得溶液是 (填“饱和”或“不饱和”)溶液,溶液的质量是 g。
(4)50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,对所得溶液的叙述正确的是 。
A.溶解度:氯化钠>硝酸钾
B.溶剂质量:氯化钠>硝酸钾
C.溶质质量分数:氯化钠=硝酸钾
D.溶质质量:氯化钠>硝酸钾
17.(2025 绥化)KNO3和NaCl的溶解度曲线如图所示。
(1) 的溶解度受温度影响变化较大。
(2)t2℃时,KNO3的溶解度 NaCl的溶解度(填“>”、“<”或“=”)。
(3)t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为 g。
18.(2025 河北)感探究之趣,赏化学之美——制作美丽硫酸铜晶体。图1所示为硫酸铜的溶解度曲线,图2所示为制作硫酸铜晶体的实验过程(不考虑水的蒸发)。
请回答下列问题:
(1)0~60℃,温度越高,硫酸铜的溶解度 。
(2)A点的意义:60℃时,硫酸铜的溶解度为 g。
(3)②中溶液是60℃时硫酸铜的 (填“饱和”或“不饱和”)溶液。
(4)比较①③溶液中硫酸铜的质量分数:① ③(填“>”“=”或“<”)。
(5)写出一种处理③中溶液的方法: 。
19.(2025 甘肃)如图为NaCl、NH4Cl和NaHCO3的溶解度曲线。
(1)t1℃时,NaCl的溶解度 (填“>”或”<”)NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是 (写一种即可)。
(3)当NH4Cl溶液中混有少量NaCl时,可采用 的方法提纯NH4Cl。
(4)t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为 (化为最简整数比)。
四.工艺流程题(共1小题)
20.(2025 烟台)黑火药是我国古代的四大发明之一,其成分含有KNO3。古代以硝土和草木灰(主要成分K2CO3)为原料生产KNO3的部分流程如图1所示。
【查阅资料】①硝土的主要成分是KNO3、Ca(NO3)2和NaCl等。
②Ca(NO3)2与K2CO3能发生复分解反应。
(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是 。淋硝所得的溶液称为“硝水”,其溶质中一定含有的物质是 。
(2)熬硝主要是将淋硝过程中得到的硝水浓缩成浓硝水。根据图2中的溶解度曲线分析,冷却热浓硝水,主要获得KNO3晶体的原因是 。若将80℃的269g硝酸钾饱和溶液降温到20℃,则析出硝酸钾晶体质量是 g。
(3)滤液A可以循环使用,原因是 。
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,则X的化学式是 。
五.解答题(共2小题)
21.(2025 天津)溶液与人类生产、生活密切相关。
(1)如表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
①20℃时,氯化钠的溶解度为 g。
②20℃时,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后得到的溶液质量为 g。
③60℃时,饱和硝酸钾溶液中溶质的质量分数为 (结果精确至0.1%)。
④将80℃时250g溶质的质量分数为60%的硝酸钾溶液降温到20℃,析出晶体的质量为 g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为 g。
22.(2025 福建)我国古代劳动人民因地制宜生产食盐。如《明史》记载:“解州之盐,风水所结;闽粤之盐,集卤。”
(1)解州之“盐”指池盐,即自然条件下盐湖结晶得到的食盐(含Na2SO4等杂质),常产于气候干旱地区。
①池盐属于 (填“纯净物”或“混合物”)。
②盐湖遇到西北风(冷空气)或南风(热空气)时,均会出现“一夜浮华”(析出大量晶体)的现象。所得晶体中,NaCl含量较高的自然条件是 (填“西北风”或“南风”),理由是 。(已知:Na2SO4和NaCl的溶解度曲线如图所示)
(2)闽粤之“盐”指海盐,其生产工艺(集卤):海水先经风吹和日晒获得较浓卤水,再煎制得食盐。生产时,古人用不同浓度的食盐水处理过的石莲子(一种植物果实)和竹筒制成莲管秤(如图A所示),用来检验卤水的浓度是否达到煎制要求。
①“集卤”工艺不采用直接蒸煮海水的方法提取食盐,其原因是 。
②处理石莲子时,需配制饱和食盐水,其操作是 。
③莲管秤中的1~4号石莲子的密度依次减小。现将两份卤水分别倒入莲管秤中,观察到石莲子的沉浮情况如图B和图C所示,对应的卤水浓度较大的是 (填“B”或“C”),莲管秤能区分不同浓度卤水的原理是 。
中考化学一轮复习 溶解度曲线及其应用
参考答案与试题解析
一.选择题(共12小题)
1.(2025 广安)20℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量关系如图所示(图中两线相交于c点)。下列分析错误的是( )
A.20℃时,b点对应的乙溶液是不饱和溶液
B.20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等
C.20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲
D.20℃时,甲的饱和溶液溶质质量分数为25%
【考点】晶体和结晶的概念与现象;有关溶质质量分数的简单计算;饱和溶液和不饱和溶液.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据乙溶液蒸发一定量的溶剂后才开始析出晶体,进行分析判断。
B、根据甲蒸发一开始蒸发溶剂后才开始析出晶体,乙溶液蒸发一定量的溶剂后才开始析出晶体,进行分析判断。
C、根据20℃时,由蒸发溶剂的质量与析出晶体的质量之间的关系图,有晶体析出后,乙曲线的斜率大,进行分析判断。
D、根据20℃时,蒸发15g水,析出10g甲晶体,进行分析判断。
【解答】解:A、b点后,乙溶液蒸发一定量的溶剂后才开始析出晶体,则20℃时,b点对应的乙溶液是不饱和溶液,故选项说法正确。
B、由图可知,20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等,故选项说法正确。
C、20℃时,由蒸发溶剂的质量与析出晶体的质量之间的关系图,有晶体析出后,乙曲线的斜率大,20℃时,乙的溶解度更大,则20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲,故选项说法正确。
D、20℃时,蒸发15g水,析出10g甲晶体,20℃时,甲的饱和溶液溶质质量分数为100%=40%,故选项说法错误。
故选:D。
【点评】本题难度不大,理解图示的含义、掌握饱和溶液的特征、溶解度的含义等是正确解答本题的关键。
2.(2025 连云港)80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3的溶解度曲线如图所示。下列说法正确的是( )
A.Na2CO3的溶解度一定比Li2SO4的大
B.20℃时Li2SO4饱和溶液升温到40℃时变为不饱和溶液
C.40℃时将60gNa2CO3固体加入100g水中得到160g溶液
D.该制备反应利用了Li2CO3溶解度相对较小的性质
【考点】固体溶解度曲线及其作用;溶解度的相关计算;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据Li2SO4的溶解度随着温度的升高而减小,进行分析判断。
C、根据40℃时碳酸钠的溶解度接近50g,进行分析判断。
D、根据Li2CO3溶解度相对较小,进行分析判断。
【解答】解:A、选项说法没有指明温度,Na2CO3的溶解度不一定比Li2SO4的大,故选项说法错误。
B、Li2SO4的溶解度随着温度的升高而减小,20℃时Li2SO4饱和溶液升温到40℃时,温度升高,Li2SO4的溶解度减小,有Li2SO4析出,溶液仍为饱和溶液,故选项说法错误。
C、40℃时碳酸钠的溶解度接近50g,40℃时将60gNa2CO3固体加入100g水中,最多能溶解的质量接近50g,不能得到160g溶液,故选项说法错误。
D、将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体,该制备反应利用了Li2CO3溶解度相对较小的性质,故选项说法正确。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
3.(2025 达州)a、b、c三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.a中混有少量b,可采用降温结晶的方法提纯a
B.t1℃时,a、c饱和溶液的溶质质量分数相等
C.t2℃时,将40ga加入50g水中充分溶解,所得溶液质量为70g
D.t3℃时,a、b、c的溶解度由大到小的关系是c>b>a
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据结晶的方法,进行分析判断。
B、根据t1℃时,a、c的溶解度相等,进行分析判断。
C、根据t2℃时,a的溶解度为40g,进行分析判断。
D、根据t3℃时三种物质的溶解度曲线上对应的点的位置高低,进行分析判断。
【解答】解:A、a和b的溶解度受温度的影响不同,a的溶解度受温度的影响变化较大,而b的溶解度受温度的影响变化较小,a中混有少量b,可采用降温结晶的方法提纯a,故选项说法正确。
B、t1℃时,a、c的溶解度相等,则t1℃时,a、c饱和溶液的溶质质量分数相等,故选项说法正确。
C、t2℃时,a的溶解度为40g,t2℃时,将40ga加入50g水中充分溶解,最多能溶解20g,所得溶液质量为50g+20g=70g,故选项说法正确。
D、由三种物质的溶解度曲线可知,t3℃时a曲线对应的点的位置最高,其次是b,再次是c,则三种物质的溶解度大小关系是a>b>c,故选项说法错误。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
4.(2025 遂宁)《本草纲目》记载:“火药乃焰硝、硫磺、杉木炭所合……”焰硝经处理可得到硝酸钾和少量氯化钠的混合溶液。结合硝酸钾和氯化钠固体的溶解度曲线(不考虑水分蒸发,析出的晶体中不含结晶水),分析下列说法中不正确的是( )
A.P点表示t1℃时硝酸钾和氯化钠的溶解度相同
B.t2℃时向100g水中加80g硝酸钾固体可形成180g硝酸钾溶液
C.若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶
D.将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,此时硝酸钾溶液的溶质质量分数大于氯化钠溶液的溶质质量分数
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;溶液浓度大小比较.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据P点的含义,进行分析判断。
B、根据t2℃时硝酸钾的溶解度为80g,进行分析判断。
C、根据KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度的影响变化较大,而氯化钠的溶解度受温度的影响变化较小,进行分析判断。
D、根据将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,硝酸钾、氯化钠的溶解度均增大,但溶液的组成没有发生改变,进行分析判断。
【解答】解:A、P点是硝酸钾和氯化钠曲线的交点,表示t1℃时硝酸钾和氯化钠的溶解度相同,故选项说法正确。
B、t2℃时硝酸钾的溶解度为80g,t2℃时向100g水中加80g硝酸钾固体,恰好完全溶解,可形成180g硝酸钾溶液,故选项说法正确。
C、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度的影响变化较大,而氯化钠的溶解度受温度的影响变化较小,若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶,故选项说法正确。
D、t1℃时硝酸钾的溶解度等于氯化钠的溶解度,t1℃硝酸钾溶液的溶质质量分数等于氯化钠溶液的溶质质量分数;将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,硝酸钾、氯化钠的溶解度均增大,但溶液的组成没有发生改变,此时硝酸钾溶液的溶质质量分数等于氯化钠溶液的溶质质量分数,故选项说法错误。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
5.(2025 眉山)甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.在t1℃时,甲、乙溶液中的溶质质量分数相等
C.将t2℃时甲的饱和溶液降温至t1℃,析出晶体质量为20g
D.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液的溶质质量分数相等
【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也比去年多,故A错误;
B、在t1℃时,甲、乙溶液的状态不能确定,所以溶液的溶质质量分数不能确定,故B错误;
C、将t2℃时甲的饱和溶液降温至t1℃,饱和溶液的质量不能确定,所以析出的晶体质量 不能确定,故C错误;
D、分别将t2℃时甲、乙的饱和溶液降温至t1℃,溶解度减小,且溶解度相等,所以所得溶液的溶质质量分数相等,故D正确。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
6.(2025 苏州)工业制备的重铬酸钾(K2Cr2O7)中常混有少量KCl,两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.K2Cr2O7的溶解度一定比KCl的大
B.40℃时,将50gKCl加入100g水中,所得溶液质量为150g
C.60℃时,两种物质的饱和溶液的溶质质量分数相等
D.采用蒸发结晶的方法可除去K2Cr2O7中混有的少量KCl
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;结晶的原理、方法及其应用.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据40℃时,KCl的溶解度为40g,进行分析判断。
C、根据60℃时,K2Cr2O7和KCl的溶解度相等,进行分析判断。
D、根据K2Cr2O7和KCl的溶解度受温度的影响不同,K2Cr2O7的溶解度受温度的影响变化较大,而KCl的溶解度受温度的影响变化较小,进行分析判断。
【解答】解:A、选项说法没有指明温度,K2Cr2O7的溶解度不一定比KCl的大,也可能是相等或小于,故选项说法错误。
B、40℃时,KCl的溶解度为40g,40℃时,将50gKCl加入100g水中,最多只能溶解40g,所得溶液质量为40g+100g=140g,故选项说法错误。
C、60℃时,K2Cr2O7和KCl的溶解度相等,饱和溶液中溶质质量分数100%,则60℃时,两种物质的饱和溶液的溶质质量分数相等,故选项说法正确。
D、K2Cr2O7和KCl的溶解度受温度的影响不同,K2Cr2O7的溶解度受温度的影响变化较大,而KCl的溶解度受温度的影响变化较小,采用降温结晶的方法可除去K2Cr2O7中混有的少量KCl,故选项说法错误。
故选:C。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
7.(2025 德阳)五水硫酸铜(CuSO4 5H2O)的溶解度曲线如图所示。结合你参与的“制备五水硫酸铜晶体”跨学科实践活动分析。下列说法错误的是( )
A.20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大
B.60℃时,50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液
C.根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体
D.饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状无影响
【考点】固体溶解度曲线及其作用.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、通过分析溶解度曲线可知,20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大,故A正确;
B、60℃时,五水硫酸铜的溶解度是83.8g,所以50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液,故B正确;
C、根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体,故C正确;
D、饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状影响较大,故D错误。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
8.(2025 新疆)如图是硝酸钾的溶解度曲线。下列说法不正确的是( )
A.硝酸钾的溶解度随温度的升高而增大
B.60℃时,M点的硝酸钾溶液是不饱和溶液
C.降低温度可以使硝酸钾溶液的状态从M点转化为N点
D.60℃时,向50g水中加入60g硝酸钾,所得溶液的质量是110g
【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、通过分析溶解度曲线可知,硝酸钾的溶解度随温度的升高而增大,故A正确;
B、60℃时,M点在硝酸钾溶解度曲线的下发,所以硝酸钾溶液是不饱和溶液,故B正确;
C、降低温度可以使硝酸钾溶液的状态从M点转化为N点,故C正确;
D、60℃时,硝酸钾的溶解度时110g,向50g水中加入60g硝酸钾,只能溶解55g的晶体,所得溶液的质量是105g,故D错误。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
9.(2025 广西)侯氏制碱法中涉及的三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.三种物质中,NH4Cl的溶解度最大
B.将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,析出晶体的质量m(NH4Cl)>m(NaCl)
C.t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等
D.t2℃时,10gNaHCO3固体能完全溶于50g水中
【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据选项说法没有指明饱和溶液的质量,进行分析判断。
C、根据t1℃时,NaCl、NH4Cl的溶解度相等,进行分析判断。
D、根据t2℃时,碳酸氢钠的溶解度为10g,进行分析判断。
【解答】解:A、选项说法没有指明温度,无法比较它们的溶解度大小,故选项说法错误。
B、选项说法没有指明饱和溶液的质量,将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,无法比较析出晶体的质量大小,故选项说法错误。
C、t1℃时,NaCl、NH4Cl的溶解度相等,t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等,故选项说法正确。
D、t2℃时,碳酸氢钠的溶解度为10g,t2℃时,50g水中最多能溶解5g碳酸氢钠,则t2℃时,10gNaHCO3固体不能完全溶于50g水中,故选项说法错误。
故选:C。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
10.(2025 深圳)(NH4)2SO4和NH4Cl是两种常见的氮肥,二者溶解度曲线如图所示,下列骥翔同学和帆帆同学说法正确的是( )
A.NH4Cl的溶解度比(NH4)2SO4的溶解度小
B.将20℃(NH4)2SO4的饱和溶液升温至80℃,溶质质量分数会增大
C.40℃时NH4Cl饱和溶液质量分数为45.8%
D.80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况。
【解答】解:A、比较溶解度大小,需要有温度的限制,故A错;
B、将20℃(NH4)2SO4的饱和溶液升温至80℃,溶解度变大,变为不饱和溶液,溶质质量分数不变,故B错;
C、40℃时NH4Cl饱和溶液质量分数为:31.4%,故B错;
D、80℃时,(NH4)2SO4的溶解度是94.1g,即在该温度下,100g水中最多溶解94.1g硫酸铵,所以200g水中最多溶解188.2g,所以80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液,故D正确。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
11.(2025 青海)《开宝本草》中记载“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,此处“霜”主要成分为KNO3。结合如图,下列说法不正确的是( )
A.20℃时,KNO3的溶解度是63.9g
B.“扫取以水淋汁”体现了硝酸钾易溶于水
C.40℃时,将70gKNO3加入100g水中得到饱和溶液
D.“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低
【考点】固体溶解度曲线及其作用;物质的溶解性及影响溶解性的因素.
【专题】溶液、浊液与溶解度.
【答案】A
【分析】A、根据溶解度曲线图,进行分析判断。
B、根据“扫取以水淋汁”的含义,进行分析判断。
C、根据40℃时,KNO3的溶解度是63.9g,进行分析判断。
D、根据“冬月地上有霜”,说明温度降低,有硝酸钾晶体析出,进行分析判断。
【解答】解:A、由溶解度曲线图可知,20℃时,KNO3的溶解度是31.6g,故选项说法错误。
B、“扫取以水淋汁”,指的是溶解,体现了硝酸钾易溶于水,故选项说法正确。
C、40℃时,KNO3的溶解度是63.9g,40℃时,将70gKNO3加入100g水中,最多能溶解63.9g,得到的是饱和溶液,故选项说法正确。
D、“冬月地上有霜”,说明温度降低,有硝酸钾晶体析出,证明KNO3的溶解度随温度的降低而降低,故选项说法正确。
故选:A。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
12.(2025 成都)《史记正义》记载“垦畦浇晒”产盐法,过程如图。卤水含大量Na2SO4和NaCl等物质,结合溶解度曲线分析,下列说法正确的是( )
A.晶体1是NaCl,晶体2是Na2SO4
B.“过箩”到“晒制”,NaCl的质量分数一直变大
C.“母液”中含有Na2SO4和NaCl
D.降温结晶可除去NaCl溶液中的少量Na2SO4
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、硫酸钠的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以晶体1是硫酸钠,晶体2是氯化钠,故A错误;
B、“过箩”到“晒制”,NaCl的质量分数先增大,析出晶体后不变,故B错误;
C、“母液”中含有Na2SO4和NaCl,故C正确;
D、蒸发结晶可除去NaCl溶液中的少量Na2SO4,故D错误。
故选:C。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
二.选择填充题(共1小题)
13.(2025 江西)从盐卤水(含硫酸钠、氯化钠等)中提取的硫酸钠可用于制中药西瓜霜,硫酸钠和氯化钠的溶解度曲线如图。下列说法正确的是 C 。
A.40℃时氯化钠的溶解度是48.8g
B.t℃时氯化钠溶液和硫酸钠溶液的溶质质量相等
C.可用降温结晶的方法从盐卤水中提取硫酸钠晶体
D.将t℃饱和硫酸钠溶液变为不饱和溶液的方法是 加入溶剂(或升高温度等)
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】C;加入溶剂(或升高温度等)。
【分析】A、根据溶解度曲线图,进行分析判断。
B、根据选项说法没有指明溶液的质量、溶液是否饱和,进行分析判断。
C、根据温度小于40℃,硫酸钠的溶解度随着温度的降低而减小,氯化钠的溶解度受温度的影响变化不大,进行分析判断。
D、根据饱和溶液转化为不饱和溶液的方法,进行分析判断。
【解答】解:A、由溶解度曲线图可知,40℃时硫酸钠的溶解度是48.8g,故选项说法错误。
B、选项说法没有指明溶液的质量、溶液是否饱和,则t℃时氯化钠溶液和硫酸钠溶液的溶质质量不一定相等,故选项说法错误。
C、温度小于40℃,硫酸钠的溶解度随着温度的降低而减小,氯化钠的溶解度受温度的影响变化不大,可用降温结晶的方法从盐卤水中提取硫酸钠晶体,故选项说法正确。
D、将t℃饱和硫酸钠溶液变为不饱和溶液的方法是加入溶剂、升高温度等。
故答案为:
C;加入溶剂(或升高温度等)。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
三.填空题(共6小题)
14.(2025 长沙)小湖同学在进行“海洋资源的综合利用与制盐”跨学科实践活动中,查阅到海水中氯化钠和硫酸钠的溶解度曲线如图所示。
(1)在0~40℃时,图中物质的溶解度受温度影响较大的是 硫酸钠 。
(2)在t℃时,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数 相等 (填“相等”或“不相等”)。
(3)通过实践活动最终获得了氯化钠固体,写出氯化钠的一种用途 用作化工原料或用作调味品等 。
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】解:(1)硫酸钠。
(2)相等。
(3)用作化工原料或用作调味品等。
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
饱和溶液溶质质量分数100%。
【解答】解:(1)在0~40℃时,图中物质的溶解度受温度影响较大的是硫酸钠。
故答案为:硫酸钠。
(2)在t℃时氯化钠和硫酸钠的溶解度相等,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数相等。
故答案为:相等。
(3)氯化钠的一种用途是用作化工原料或用作调味品等。
故答案为:用作化工原料或用作调味品等。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
15.(2025 黑龙江)海洋蕴藏着丰富的资源,人类应合理开发和应用。海水中含有KCl和MgSO4等物质,其在不同温度时的溶解度如下表所示,下图是对应的溶解度曲线。
温度℃ 20 30 40 60 80 100
溶解度/g KCl 34.0 37.0 40.0 45.5 51.1 56.7
MgSO4 33.7 38.9 44.5 54.6 55.8 50.4
(1)代表KCl溶解度曲线的是 甲 (填“甲”或“乙”)。
(2)40℃时,将30gKCl固体加入50g水中,充分溶解后,所得溶液的质量为 70 g。
(3)t2℃时,将等质量的甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量甲 = 乙(填“>”“<”或“=”)。
(4)t3℃时,将100gMgSO4饱和溶液逐渐降温经t2℃直至t1℃,其溶质质量分数的变化趋势是 先不变后变小 。
【考点】固体溶解度曲线及其作用;有关溶质质量分数的简单计算;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)甲;
(2)70;
(3)=;
(4)先不变后变小。
【分析】(1)根据KCl的溶解度随温度升高而增大来分析解答;
(2)根据40℃时,KCl的溶解度是40.0g来分析解答;
(3)根据t2℃时,甲、乙溶解度相等,降温到t1℃时,甲、乙的溶解度相等来分析解答;
(4)根据t3℃降温到t2℃,MgSO4溶解度增大,饱和溶液变为不饱和溶液,溶质、溶剂质量不变,t2℃降温到t1℃,MgSO4溶解度减小来分析解答。
【解答】解:(1)由表格数据可知,KCl的溶解度随温度升高而增大,MgSO4的溶解度随温度升高先增大后减小,曲线甲溶解度随温度升高持续增大,所以代表KCl溶解度曲线的是甲;
(2)40℃时,KCl的溶解度是40.0g,则40℃时,100g水中最多溶解40.0gKCl,那么50g水中最多溶解KCl的质量为20g,将30gKCl固体加入50g水中,只能溶解20g,所得溶液质量为20g+50g=70g;
(3)t2℃时,甲、乙溶解度相等,根据饱和溶液的溶质质量分数100%,等质量的甲、乙两物质饱和溶液的溶质质量分数相等,溶质质量也相等,降温到t1℃时,甲、乙的溶解度都减小,但仍相等,而溶剂质量都不变,所以析出晶体的质量甲=乙;
(4)t3℃降温到t2℃,MgSO4溶解度增大,饱和溶液变为不饱和溶液,溶质、溶剂质量不变,溶质质量分数不变,t2℃降温到t1℃,MgSO4溶解度减小,当溶解度小于t3℃的溶解度之后,会析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小,所以其溶质质量分数的变化趋势是先不变后变小。
故答案为:(1)甲;
(2)70;
(3)=;
(4)先不变后变小。
【点评】在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答。
16.(2025 齐齐哈尔)如图是硝酸钾和氯化钠的溶解度曲线。请回答下列问题:
(1)图中P点的含义是 t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等 。
(2)若氯化钠中混有少量硝酸钾,可用 蒸发结晶 (填“蒸发结晶”或“降温结晶”)的方法提纯氯化钠。
(3)50℃时,将90g硝酸钾加入100g水中,充分溶解后,所得溶液是 饱和 (填“饱和”或“不饱和”)溶液,溶液的质量是 185.5 g。
(4)50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,对所得溶液的叙述正确的是 BCD 。
A.溶解度:氯化钠>硝酸钾
B.溶剂质量:氯化钠>硝酸钾
C.溶质质量分数:氯化钠=硝酸钾
D.溶质质量:氯化钠>硝酸钾
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等;
(2)蒸发结晶;
(3)饱和;185.5;
(4)BCD。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)溶解度曲线交点的含义是在该温度下,两种物质的溶解度相等,观察可知,P点是硝酸钾和氯化钠溶解度曲线的交点,所以P点的含义是在t℃时,硝酸钾和氯化钠的溶解度相等;
(2)硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小。当氯化钠中含有少量硝酸钾时,蒸发结晶,大部分氯化钠会结晶析出,而硝酸钾在较高温度下溶解度较大,不会大量析出,从而可以得到氯化钠;
(3)由图可知,50℃时硝酸钾的溶解度是85.5g,即50℃时,100g水中最多溶解85.5g硝酸钾。将90g硝酸钾加入100g水中,充分溶解后,溶解的硝酸钾质量为85.5g,有90g﹣85.5g=4.5g硝酸钾未溶解,所以所得溶液是饱和溶液,溶液的质量是100g+85.5g=185.5g;
(4)A、由图可知,t℃时,氯化钠和硝酸钾的溶解度相等,故选项说法错误;
B、50℃时,硝酸钾的溶解度大于氯化钠,则等质量的硝酸钾饱和溶液和氯化钠饱和溶液中,氯化钠溶液中溶剂质量更大,则50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,溶剂质量不变,则t℃时,溶剂质量:氯化钠>硝酸钾,故选项说法正确;
C、氯化钠和硝酸钾的溶解度都随温度降低而减小,50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,二者还是饱和溶液,t℃时,氯化钠和硝酸钾的溶解度相等,饱和溶液的溶质质量分数,则t℃时,溶质质量分数:氯化钠=硝酸钾,故选项说法正确;
D、t℃时,氯化钠和硝酸钾的溶解度相等,二者还是饱和溶液,且t℃时,溶剂质量:氯化钠>硝酸钾,则溶质质量:氯化钠>硝酸钾,故选项说法正确;
故答案为:(1)t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等;
(2)蒸发结晶;
(3)饱和;185.5;
(4)BCD。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
17.(2025 绥化)KNO3和NaCl的溶解度曲线如图所示。
(1) KNO3或硝酸钾 的溶解度受温度影响变化较大。
(2)t2℃时,KNO3的溶解度 = NaCl的溶解度(填“>”、“<”或“=”)。
(3)t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为 36 g。
【考点】固体溶解度曲线及其作用.
【专题】溶液、浊液与溶解度.
【答案】(1)KNO3或硝酸钾;
(2)=;
(3)36。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)由溶解度曲线可知,硝酸钾的溶解度受温度影响变化较大;
(2)由溶解度曲线可知,t2℃时,KNO3的溶解度=NaCl的溶解度;
(3)t3℃时,KNO3的溶解度是80g,即在该温度下,100g水中最多溶解80g硝酸钾,所以10g水中最多溶解8g硝酸钾,所以完全溶解16gKNO3固体,需要20g水,所以t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为:16g+20g=36g。
故答案为:(1)KNO3或硝酸钾;
(2)=;
(3)36。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
18.(2025 河北)感探究之趣,赏化学之美——制作美丽硫酸铜晶体。图1所示为硫酸铜的溶解度曲线,图2所示为制作硫酸铜晶体的实验过程(不考虑水的蒸发)。
请回答下列问题:
(1)0~60℃,温度越高,硫酸铜的溶解度 增大 。
(2)A点的意义:60℃时,硫酸铜的溶解度为 40 g。
(3)②中溶液是60℃时硫酸铜的 不饱和 (填“饱和”或“不饱和”)溶液。
(4)比较①③溶液中硫酸铜的质量分数:① = ③(填“>”“=”或“<”)。
(5)写出一种处理③中溶液的方法: 用于配制农药波尔多液(答案不唯一) 。
【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)增大;
(2)40;
(3)不饱和;
(4)=;
(5)用于配制农药波尔多液(答案不唯一)。
【分析】(1)根据硫酸铜的溶解度曲线,进行分析解答。
(2)根据溶解度曲线某一点的含义,进行分析解答。
(3)根据60℃时,硫酸铜的溶解度为40g,进行分析解答。
(4)根据③中溶液是20℃时取出晶体后得到的,进行分析解答。
(5)根据处理硫酸铜溶液的方法,进行分析解答。
【解答】解:(1)由硫酸铜的溶解度曲线可知,0~60℃,温度越高,硫酸铜的溶解度增大。
(2)A点的意义:60℃时,硫酸铜的溶解度为40g。
(3)60℃时,硫酸铜的溶解度为40g,该温度下,100g水中最多能溶解40g硫酸铜,则②中溶液,溶质的质量为36g,是60℃时硫酸铜的不饱和溶液。
(4)③中溶液是20℃时取出晶体后得到的,①③溶液均为20℃时硫酸铜的饱和溶液,①③溶液中硫酸铜的质量分数:①=③。
(5)③中溶液是硫酸铜的饱和溶液,硫酸铜溶液可用于配制农药波尔多液,则处理③中溶液可以是用于配制农药波尔多液(答案不唯一)。
故答案为:
(1)增大;
(2)40;
(3)不饱和;
(4)=;
(5)用于配制农药波尔多液(答案不唯一)。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
19.(2025 甘肃)如图为NaCl、NH4Cl和NaHCO3的溶解度曲线。
(1)t1℃时,NaCl的溶解度 > (填“>”或”<”)NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是 加入氯化铵或恒温蒸发溶剂等 (写一种即可)。
(3)当NH4Cl溶液中混有少量NaCl时,可采用 降温结晶 的方法提纯NH4Cl。
(4)t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为 3:25 (化为最简整数比)。
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;饱和溶液和不饱和溶液相互转变的方法.
【答案】(1)>;
(2)加入氯化铵或恒温蒸发溶剂等;
(3)降温结晶;
(4)3:25。
【分析】(1)根据t1℃时两种物质的溶解度曲线上对应的点的位置高低,进行分析判断。
(2)根据不饱和溶液变为该温度下的饱和溶液的方法,进行分析解答。
(3)根据NH4Cl和NaCl的溶解度受温度的影响不同,NH4Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,进行分析解答。
(4)根据t3℃时,碳酸氢钠的溶解度为12g,进行分析解答。
【解答】解:(1)t1℃时氯化钠对应的点的位置高,则t1℃时,NaCl的溶解度>NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是加入氯化铵、恒温蒸发溶剂等。
(3)NH4Cl和NaCl的溶解度受温度的影响不同,NH4Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,当NH4Cl溶液中混有少量NaCl时,可采用降温结晶的方法。
(4)t3℃时,碳酸氢钠的溶解度为12g,t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为12g:100g=3:25。
故答案为:
(1)>;
(2)加入氯化铵或恒温蒸发溶剂等;
(3)降温结晶;
(4)3:25。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
四.工艺流程题(共1小题)
20.(2025 烟台)黑火药是我国古代的四大发明之一,其成分含有KNO3。古代以硝土和草木灰(主要成分K2CO3)为原料生产KNO3的部分流程如图1所示。
【查阅资料】①硝土的主要成分是KNO3、Ca(NO3)2和NaCl等。
②Ca(NO3)2与K2CO3能发生复分解反应。
(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是 Ca(NO3)2+K2CO3=CaCO3↓+2KNO3 。淋硝所得的溶液称为“硝水”,其溶质中一定含有的物质是 KNO3、NaCl 。
(2)熬硝主要是将淋硝过程中得到的硝水浓缩成浓硝水。根据图2中的溶解度曲线分析,冷却热浓硝水,主要获得KNO3晶体的原因是 硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出 。若将80℃的269g硝酸钾饱和溶液降温到20℃,则析出硝酸钾晶体质量是 137.4 g。
(3)滤液A可以循环使用,原因是 滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费 。
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,则X的化学式是 N2 。
【考点】物质的相互转化和制备;根据质量守恒定律判断物质的化学式;固体溶解度曲线及其作用.
【专题】物质的制备.
【答案】(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;KNO3、NaCl;
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;137.4;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)N2。
【分析】(1)根据硝酸钙与碳酸钾反应的原理来分析;
(2)根据溶解度曲线图并结合饱和溶液的特点来分析;
(3)根据滤液A是KNO3的饱和溶液来分析;
(4)根据质量守恒定律来分析。
【解答】解:(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是Ca(NO3)2+K2CO3=CaCO3↓+2KNO3。根据以上反应原理可知,“硝水”中一定含有的溶质是反应生成的KNO3,以及原本存在的NaCl(因硝土中有,用水冲淋会溶解)等,结合流程可知一定有KNO3、NaCl。
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;80℃时169g硝酸钾溶于适量水(100g)形成饱和溶液(题中给出80℃时饱和溶液的质量为269g),降温到20℃,20℃时硝酸钾溶解度31.6g,所以析出质量为80℃时溶解度与20℃时溶解度差值,即析出晶体质量:169g﹣31.6g=137.4g;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,根据化学反应前后原子的总数保持不变可知,生成物还缺少2个N,即X为N2。
故答案为:
(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;KNO3、NaCl;
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;137.4;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)N2。
【点评】这是一道关于化学工艺和溶解度曲线的化学题,涉及反应方程式、溶解度分析、物质循环及质量守恒定律应用等相关知识,掌握常见物质的性质即可解答本题。
五.解答题(共2小题)
21.(2025 天津)溶液与人类生产、生活密切相关。
(1)如表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
①20℃时,氯化钠的溶解度为 36.0 g。
②20℃时,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后得到的溶液质量为 68 g。
③60℃时,饱和硝酸钾溶液中溶质的质量分数为 52.4% (结果精确至0.1%)。
④将80℃时250g溶质的质量分数为60%的硝酸钾溶液降温到20℃,析出晶体的质量为 118.4 g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为 48 g。
【考点】固体溶解度表格及其作用;有关溶质质量分数的简单计算;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)①36.0。
②68。
③52.4%。
④118.4。
(2)48。
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液的溶质质量分数100%。
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
【解答】解:(1)①20℃时,氯化钠的溶解度为36.0g。
②20℃时氯化钠溶解度是36.0g,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后,能够溶解18g,得到的溶液质量为50g+18g=68g。
③60℃时硝酸钾溶解度是110g,饱和硝酸钾溶液中溶质的质量分数为100%≈52.4%。
④250g溶质的质量分数为60%的硝酸钾溶液中,硝酸钾质量是250g×60%=150g,水的质量是250g﹣150g=100g,降温到20℃,20℃时硝酸钾溶解度是31.6g,析出晶体的质量为150g﹣31.6g=118.4g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为300g×16%=48g。
故答案为:(1)①36.0。
②68。
③52.4%。
④118.4。
(2)48。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
22.(2025 福建)我国古代劳动人民因地制宜生产食盐。如《明史》记载:“解州之盐,风水所结;闽粤之盐,集卤。”
(1)解州之“盐”指池盐,即自然条件下盐湖结晶得到的食盐(含Na2SO4等杂质),常产于气候干旱地区。
①池盐属于 混合物 (填“纯净物”或“混合物”)。
②盐湖遇到西北风(冷空气)或南风(热空气)时,均会出现“一夜浮华”(析出大量晶体)的现象。所得晶体中,NaCl含量较高的自然条件是 南风 (填“西北风”或“南风”),理由是 Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低 。(已知:Na2SO4和NaCl的溶解度曲线如图所示)
(2)闽粤之“盐”指海盐,其生产工艺(集卤):海水先经风吹和日晒获得较浓卤水,再煎制得食盐。生产时,古人用不同浓度的食盐水处理过的石莲子(一种植物果实)和竹筒制成莲管秤(如图A所示),用来检验卤水的浓度是否达到煎制要求。
①“集卤”工艺不采用直接蒸煮海水的方法提取食盐,其原因是 直接蒸煮海水需要消耗大量能源 。
②处理石莲子时,需配制饱和食盐水,其操作是 取适量水,加入食盐并充分搅拌,直至不再溶解 。
③莲管秤中的1~4号石莲子的密度依次减小。现将两份卤水分别倒入莲管秤中,观察到石莲子的沉浮情况如图B和图C所示,对应的卤水浓度较大的是 B (填“B”或“C”),莲管秤能区分不同浓度卤水的原理是 卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大 。
【考点】固体溶解度曲线及其作用;氯化钠与粗盐提纯.
【答案】(1)①混合物;
②南风;Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低;
(2)①直接蒸煮海水需要消耗大量能源;
②取适量水,加入食盐并充分搅拌,直至不再溶解;
③B;卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大。
【分析】(1)①根据纯净物是由一种物质组成的物质,混合物是指由两种或两种以上物质组成的物质,进行分析解答。
②根据Na2SO4的溶解度随温度升高而明显增大,进行分析解答。
(2)①根据氯化钠的溶解度受温度的影响变化较小,进行分析解答。
②根据配制饱和食盐水的方法,进行分析解答。
③根据在B中要比C中石莲子上浮的个数多,卤水的浓度和密度的关系,进行分析解答。
【解答】解:(1)①池盐中含有食盐,主要成分是氯化钠,含Na2SO4等杂质等多种物质,属于混合物。
②由溶解度曲线可知,Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低,所得晶体中NaCl含量较高。
(2)①氯化钠的溶解度受温度的影响变化较小,需要蒸发溶剂的方法结晶;若直接蒸煮海水需要消耗大量能源。
②常温下,食盐易溶于水,配制饱和食盐水的方法为:取适量水,加入食盐并充分搅拌,直至不再溶解。
③据图可知,在B中要比C中石莲子上浮的个数多,对应的卤水浓度较大的是B;由实验可知,卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大,所以可以用莲管秤来区分不同浓度卤水。
故答案为:
(1)①混合物;
②南风;Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低;
(2)①直接蒸煮海水需要消耗大量能源;
②取适量水,加入食盐并充分搅拌,直至不再溶解;
③B;卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大。
【点评】本题难度不大,了解溶解度曲线的含义、饱和溶液的特征、结晶的方法等是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考化学一轮复习 溶解度曲线及其应用
一.选择题(共12小题)
1.(2025 广安)20℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量关系如图所示(图中两线相交于c点)。下列分析错误的是( )
A.20℃时,b点对应的乙溶液是不饱和溶液
B.20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等
C.20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲
D.20℃时,甲的饱和溶液溶质质量分数为25%
2.(2025 连云港)80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3的溶解度曲线如图所示。下列说法正确的是( )
A.Na2CO3的溶解度一定比Li2SO4的大
B.20℃时Li2SO4饱和溶液升温到40℃时变为不饱和溶液
C.40℃时将60gNa2CO3固体加入100g水中得到160g溶液
D.该制备反应利用了Li2CO3溶解度相对较小的性质
3.(2025 达州)a、b、c三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.a中混有少量b,可采用降温结晶的方法提纯a
B.t1℃时,a、c饱和溶液的溶质质量分数相等
C.t2℃时,将40ga加入50g水中充分溶解,所得溶液质量为70g
D.t3℃时,a、b、c的溶解度由大到小的关系是c>b>a
4.(2025 遂宁)《本草纲目》记载:“火药乃焰硝、硫磺、杉木炭所合……”焰硝经处理可得到硝酸钾和少量氯化钠的混合溶液。结合硝酸钾和氯化钠固体的溶解度曲线(不考虑水分蒸发,析出的晶体中不含结晶水),分析下列说法中不正确的是( )
A.P点表示t1℃时硝酸钾和氯化钠的溶解度相同
B.t2℃时向100g水中加80g硝酸钾固体可形成180g硝酸钾溶液
C.若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶
D.将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,此时硝酸钾溶液的溶质质量分数大于氯化钠溶液的溶质质量分数
5.(2025 眉山)甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.在t1℃时,甲、乙溶液中的溶质质量分数相等
C.将t2℃时甲的饱和溶液降温至t1℃,析出晶体质量为20g
D.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液的溶质质量分数相等
6.(2025 苏州)工业制备的重铬酸钾(K2Cr2O7)中常混有少量KCl,两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.K2Cr2O7的溶解度一定比KCl的大
B.40℃时,将50gKCl加入100g水中,所得溶液质量为150g
C.60℃时,两种物质的饱和溶液的溶质质量分数相等
D.采用蒸发结晶的方法可除去K2Cr2O7中混有的少量KCl
7.(2025 德阳)五水硫酸铜(CuSO4 5H2O)的溶解度曲线如图所示。结合你参与的“制备五水硫酸铜晶体”跨学科实践活动分析。下列说法错误的是( )
A.20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大
B.60℃时,50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液
C.根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体
D.饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状无影响
8.(2025 新疆)如图是硝酸钾的溶解度曲线。下列说法不正确的是( )
A.硝酸钾的溶解度随温度的升高而增大
B.60℃时,M点的硝酸钾溶液是不饱和溶液
C.降低温度可以使硝酸钾溶液的状态从M点转化为N点
D.60℃时,向50g水中加入60g硝酸钾,所得溶液的质量是110g
9.(2025 广西)侯氏制碱法中涉及的三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.三种物质中,NH4Cl的溶解度最大
B.将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,析出晶体的质量m(NH4Cl)>m(NaCl)
C.t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等
D.t2℃时,10gNaHCO3固体能完全溶于50g水中
10.(2025 深圳)(NH4)2SO4和NH4Cl是两种常见的氮肥,二者溶解度曲线如图所示,下列骥翔同学和帆帆同学说法正确的是( )
A.NH4Cl的溶解度比(NH4)2SO4的溶解度小
B.将20℃(NH4)2SO4的饱和溶液升温至80℃,溶质质量分数会增大
C.40℃时NH4Cl饱和溶液质量分数为45.8%
D.80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液
11.(2025 青海)《开宝本草》中记载“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,此处“霜”主要成分为KNO3。结合如图,下列说法不正确的是( )
A.20℃时,KNO3的溶解度是63.9g
B.“扫取以水淋汁”体现了硝酸钾易溶于水
C.40℃时,将70gKNO3加入100g水中得到饱和溶液
D.“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低
12.(2025 成都)《史记正义》记载“垦畦浇晒”产盐法,过程如图。卤水含大量Na2SO4和NaCl等物质,结合溶解度曲线分析,下列说法正确的是( )
A.晶体1是NaCl,晶体2是Na2SO4
B.“过箩”到“晒制”,NaCl的质量分数一直变大
C.“母液”中含有Na2SO4和NaCl
D.降温结晶可除去NaCl溶液中的少量Na2SO4
二.选择填充题(共1小题)
13.(2025 江西)从盐卤水(含硫酸钠、氯化钠等)中提取的硫酸钠可用于制中药西瓜霜,硫酸钠和氯化钠的溶解度曲线如图。下列说法正确的是 。
A.40℃时氯化钠的溶解度是48.8g
B.t℃时氯化钠溶液和硫酸钠溶液的溶质质量相等
C.可用降温结晶的方法从盐卤水中提取硫酸钠晶体
D.将t℃饱和硫酸钠溶液变为不饱和溶液的方法是
三.填空题(共6小题)
14.(2025 长沙)小湖同学在进行“海洋资源的综合利用与制盐”跨学科实践活动中,查阅到海水中氯化钠和硫酸钠的溶解度曲线如图所示。
(1)在0~40℃时,图中物质的溶解度受温度影响较大的是 。
(2)在t℃时,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数 (填“相等”或“不相等”)。
(3)通过实践活动最终获得了氯化钠固体,写出氯化钠的一种用途 。
15.(2025 黑龙江)海洋蕴藏着丰富的资源,人类应合理开发和应用。海水中含有KCl和MgSO4等物质,其在不同温度时的溶解度如下表所示,下图是对应的溶解度曲线。
温度℃ 20 30 40 60 80 100
溶解度/g KCl 34.0 37.0 40.0 45.5 51.1 56.7
MgSO4 33.7 38.9 44.5 54.6 55.8 50.4
(1)代表KCl溶解度曲线的是 (填“甲”或“乙”)。
(2)40℃时,将30gKCl固体加入50g水中,充分溶解后,所得溶液的质量为 g。
(3)t2℃时,将等质量的甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量甲 乙(填“>”“<”或“=”)。
(4)t3℃时,将100gMgSO4饱和溶液逐渐降温经t2℃直至t1℃,其溶质质量分数的变化趋势是 。
16.(2025 齐齐哈尔)如图是硝酸钾和氯化钠的溶解度曲线。请回答下列问题:
(1)图中P点的含义是 。
(2)若氯化钠中混有少量硝酸钾,可用 (填“蒸发结晶”或“降温结晶”)的方法提纯氯化钠。
(3)50℃时,将90g硝酸钾加入100g水中,充分溶解后,所得溶液是 (填“饱和”或“不饱和”)溶液,溶液的质量是 g。
(4)50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,对所得溶液的叙述正确的是 。
A.溶解度:氯化钠>硝酸钾
B.溶剂质量:氯化钠>硝酸钾
C.溶质质量分数:氯化钠=硝酸钾
D.溶质质量:氯化钠>硝酸钾
17.(2025 绥化)KNO3和NaCl的溶解度曲线如图所示。
(1) 的溶解度受温度影响变化较大。
(2)t2℃时,KNO3的溶解度 NaCl的溶解度(填“>”、“<”或“=”)。
(3)t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为 g。
18.(2025 河北)感探究之趣,赏化学之美——制作美丽硫酸铜晶体。图1所示为硫酸铜的溶解度曲线,图2所示为制作硫酸铜晶体的实验过程(不考虑水的蒸发)。
请回答下列问题:
(1)0~60℃,温度越高,硫酸铜的溶解度 。
(2)A点的意义:60℃时,硫酸铜的溶解度为 g。
(3)②中溶液是60℃时硫酸铜的 (填“饱和”或“不饱和”)溶液。
(4)比较①③溶液中硫酸铜的质量分数:① ③(填“>”“=”或“<”)。
(5)写出一种处理③中溶液的方法: 。
19.(2025 甘肃)如图为NaCl、NH4Cl和NaHCO3的溶解度曲线。
(1)t1℃时,NaCl的溶解度 (填“>”或”<”)NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是 (写一种即可)。
(3)当NH4Cl溶液中混有少量NaCl时,可采用 的方法提纯NH4Cl。
(4)t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为 (化为最简整数比)。
四.工艺流程题(共1小题)
20.(2025 烟台)黑火药是我国古代的四大发明之一,其成分含有KNO3。古代以硝土和草木灰(主要成分K2CO3)为原料生产KNO3的部分流程如图1所示。
【查阅资料】①硝土的主要成分是KNO3、Ca(NO3)2和NaCl等。
②Ca(NO3)2与K2CO3能发生复分解反应。
(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是 。淋硝所得的溶液称为“硝水”,其溶质中一定含有的物质是 。
(2)熬硝主要是将淋硝过程中得到的硝水浓缩成浓硝水。根据图2中的溶解度曲线分析,冷却热浓硝水,主要获得KNO3晶体的原因是 。若将80℃的269g硝酸钾饱和溶液降温到20℃,则析出硝酸钾晶体质量是 g。
(3)滤液A可以循环使用,原因是 。
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,则X的化学式是 。
五.解答题(共2小题)
21.(2025 天津)溶液与人类生产、生活密切相关。
(1)如表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
①20℃时,氯化钠的溶解度为 g。
②20℃时,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后得到的溶液质量为 g。
③60℃时,饱和硝酸钾溶液中溶质的质量分数为 (结果精确至0.1%)。
④将80℃时250g溶质的质量分数为60%的硝酸钾溶液降温到20℃,析出晶体的质量为 g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为 g。
22.(2025 福建)我国古代劳动人民因地制宜生产食盐。如《明史》记载:“解州之盐,风水所结;闽粤之盐,集卤。”
(1)解州之“盐”指池盐,即自然条件下盐湖结晶得到的食盐(含Na2SO4等杂质),常产于气候干旱地区。
①池盐属于 (填“纯净物”或“混合物”)。
②盐湖遇到西北风(冷空气)或南风(热空气)时,均会出现“一夜浮华”(析出大量晶体)的现象。所得晶体中,NaCl含量较高的自然条件是 (填“西北风”或“南风”),理由是 。(已知:Na2SO4和NaCl的溶解度曲线如图所示)
(2)闽粤之“盐”指海盐,其生产工艺(集卤):海水先经风吹和日晒获得较浓卤水,再煎制得食盐。生产时,古人用不同浓度的食盐水处理过的石莲子(一种植物果实)和竹筒制成莲管秤(如图A所示),用来检验卤水的浓度是否达到煎制要求。
①“集卤”工艺不采用直接蒸煮海水的方法提取食盐,其原因是 。
②处理石莲子时,需配制饱和食盐水,其操作是 。
③莲管秤中的1~4号石莲子的密度依次减小。现将两份卤水分别倒入莲管秤中,观察到石莲子的沉浮情况如图B和图C所示,对应的卤水浓度较大的是 (填“B”或“C”),莲管秤能区分不同浓度卤水的原理是 。
中考化学一轮复习 溶解度曲线及其应用
参考答案与试题解析
一.选择题(共12小题)
1.(2025 广安)20℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量关系如图所示(图中两线相交于c点)。下列分析错误的是( )
A.20℃时,b点对应的乙溶液是不饱和溶液
B.20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等
C.20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲
D.20℃时,甲的饱和溶液溶质质量分数为25%
【考点】晶体和结晶的概念与现象;有关溶质质量分数的简单计算;饱和溶液和不饱和溶液.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据乙溶液蒸发一定量的溶剂后才开始析出晶体,进行分析判断。
B、根据甲蒸发一开始蒸发溶剂后才开始析出晶体,乙溶液蒸发一定量的溶剂后才开始析出晶体,进行分析判断。
C、根据20℃时,由蒸发溶剂的质量与析出晶体的质量之间的关系图,有晶体析出后,乙曲线的斜率大,进行分析判断。
D、根据20℃时,蒸发15g水,析出10g甲晶体,进行分析判断。
【解答】解:A、b点后,乙溶液蒸发一定量的溶剂后才开始析出晶体,则20℃时,b点对应的乙溶液是不饱和溶液,故选项说法正确。
B、由图可知,20℃时,对甲、乙两种溶液恒温蒸发28g溶剂,两者析出晶体的质量相等,故选项说法正确。
C、20℃时,由蒸发溶剂的质量与析出晶体的质量之间的关系图,有晶体析出后,乙曲线的斜率大,20℃时,乙的溶解度更大,则20℃时,等质量的甲、乙两种饱和溶液中,溶质质量:乙>甲,故选项说法正确。
D、20℃时,蒸发15g水,析出10g甲晶体,20℃时,甲的饱和溶液溶质质量分数为100%=40%,故选项说法错误。
故选:D。
【点评】本题难度不大,理解图示的含义、掌握饱和溶液的特征、溶解度的含义等是正确解答本题的关键。
2.(2025 连云港)80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3的溶解度曲线如图所示。下列说法正确的是( )
A.Na2CO3的溶解度一定比Li2SO4的大
B.20℃时Li2SO4饱和溶液升温到40℃时变为不饱和溶液
C.40℃时将60gNa2CO3固体加入100g水中得到160g溶液
D.该制备反应利用了Li2CO3溶解度相对较小的性质
【考点】固体溶解度曲线及其作用;溶解度的相关计算;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据Li2SO4的溶解度随着温度的升高而减小,进行分析判断。
C、根据40℃时碳酸钠的溶解度接近50g,进行分析判断。
D、根据Li2CO3溶解度相对较小,进行分析判断。
【解答】解:A、选项说法没有指明温度,Na2CO3的溶解度不一定比Li2SO4的大,故选项说法错误。
B、Li2SO4的溶解度随着温度的升高而减小,20℃时Li2SO4饱和溶液升温到40℃时,温度升高,Li2SO4的溶解度减小,有Li2SO4析出,溶液仍为饱和溶液,故选项说法错误。
C、40℃时碳酸钠的溶解度接近50g,40℃时将60gNa2CO3固体加入100g水中,最多能溶解的质量接近50g,不能得到160g溶液,故选项说法错误。
D、将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体,该制备反应利用了Li2CO3溶解度相对较小的性质,故选项说法正确。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
3.(2025 达州)a、b、c三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.a中混有少量b,可采用降温结晶的方法提纯a
B.t1℃时,a、c饱和溶液的溶质质量分数相等
C.t2℃时,将40ga加入50g水中充分溶解,所得溶液质量为70g
D.t3℃时,a、b、c的溶解度由大到小的关系是c>b>a
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据结晶的方法,进行分析判断。
B、根据t1℃时,a、c的溶解度相等,进行分析判断。
C、根据t2℃时,a的溶解度为40g,进行分析判断。
D、根据t3℃时三种物质的溶解度曲线上对应的点的位置高低,进行分析判断。
【解答】解:A、a和b的溶解度受温度的影响不同,a的溶解度受温度的影响变化较大,而b的溶解度受温度的影响变化较小,a中混有少量b,可采用降温结晶的方法提纯a,故选项说法正确。
B、t1℃时,a、c的溶解度相等,则t1℃时,a、c饱和溶液的溶质质量分数相等,故选项说法正确。
C、t2℃时,a的溶解度为40g,t2℃时,将40ga加入50g水中充分溶解,最多能溶解20g,所得溶液质量为50g+20g=70g,故选项说法正确。
D、由三种物质的溶解度曲线可知,t3℃时a曲线对应的点的位置最高,其次是b,再次是c,则三种物质的溶解度大小关系是a>b>c,故选项说法错误。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
4.(2025 遂宁)《本草纲目》记载:“火药乃焰硝、硫磺、杉木炭所合……”焰硝经处理可得到硝酸钾和少量氯化钠的混合溶液。结合硝酸钾和氯化钠固体的溶解度曲线(不考虑水分蒸发,析出的晶体中不含结晶水),分析下列说法中不正确的是( )
A.P点表示t1℃时硝酸钾和氯化钠的溶解度相同
B.t2℃时向100g水中加80g硝酸钾固体可形成180g硝酸钾溶液
C.若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶
D.将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,此时硝酸钾溶液的溶质质量分数大于氯化钠溶液的溶质质量分数
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;溶液浓度大小比较.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】A、根据P点的含义,进行分析判断。
B、根据t2℃时硝酸钾的溶解度为80g,进行分析判断。
C、根据KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度的影响变化较大,而氯化钠的溶解度受温度的影响变化较小,进行分析判断。
D、根据将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,硝酸钾、氯化钠的溶解度均增大,但溶液的组成没有发生改变,进行分析判断。
【解答】解:A、P点是硝酸钾和氯化钠曲线的交点,表示t1℃时硝酸钾和氯化钠的溶解度相同,故选项说法正确。
B、t2℃时硝酸钾的溶解度为80g,t2℃时向100g水中加80g硝酸钾固体,恰好完全溶解,可形成180g硝酸钾溶液,故选项说法正确。
C、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度的影响变化较大,而氯化钠的溶解度受温度的影响变化较小,若要从上述溶液中提纯硝酸钾,最好采用的方法是降温结晶,故选项说法正确。
D、t1℃时硝酸钾的溶解度等于氯化钠的溶解度,t1℃硝酸钾溶液的溶质质量分数等于氯化钠溶液的溶质质量分数;将t1℃时硝酸钾和氯化钠的饱和溶液升温至t2℃,硝酸钾、氯化钠的溶解度均增大,但溶液的组成没有发生改变,此时硝酸钾溶液的溶质质量分数等于氯化钠溶液的溶质质量分数,故选项说法错误。
故选:D。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
5.(2025 眉山)甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.在t1℃时,甲、乙溶液中的溶质质量分数相等
C.将t2℃时甲的饱和溶液降温至t1℃,析出晶体质量为20g
D.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液的溶质质量分数相等
【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也比去年多,故A错误;
B、在t1℃时,甲、乙溶液的状态不能确定,所以溶液的溶质质量分数不能确定,故B错误;
C、将t2℃时甲的饱和溶液降温至t1℃,饱和溶液的质量不能确定,所以析出的晶体质量 不能确定,故C错误;
D、分别将t2℃时甲、乙的饱和溶液降温至t1℃,溶解度减小,且溶解度相等,所以所得溶液的溶质质量分数相等,故D正确。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
6.(2025 苏州)工业制备的重铬酸钾(K2Cr2O7)中常混有少量KCl,两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.K2Cr2O7的溶解度一定比KCl的大
B.40℃时,将50gKCl加入100g水中,所得溶液质量为150g
C.60℃时,两种物质的饱和溶液的溶质质量分数相等
D.采用蒸发结晶的方法可除去K2Cr2O7中混有的少量KCl
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;结晶的原理、方法及其应用.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据40℃时,KCl的溶解度为40g,进行分析判断。
C、根据60℃时,K2Cr2O7和KCl的溶解度相等,进行分析判断。
D、根据K2Cr2O7和KCl的溶解度受温度的影响不同,K2Cr2O7的溶解度受温度的影响变化较大,而KCl的溶解度受温度的影响变化较小,进行分析判断。
【解答】解:A、选项说法没有指明温度,K2Cr2O7的溶解度不一定比KCl的大,也可能是相等或小于,故选项说法错误。
B、40℃时,KCl的溶解度为40g,40℃时,将50gKCl加入100g水中,最多只能溶解40g,所得溶液质量为40g+100g=140g,故选项说法错误。
C、60℃时,K2Cr2O7和KCl的溶解度相等,饱和溶液中溶质质量分数100%,则60℃时,两种物质的饱和溶液的溶质质量分数相等,故选项说法正确。
D、K2Cr2O7和KCl的溶解度受温度的影响不同,K2Cr2O7的溶解度受温度的影响变化较大,而KCl的溶解度受温度的影响变化较小,采用降温结晶的方法可除去K2Cr2O7中混有的少量KCl,故选项说法错误。
故选:C。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
7.(2025 德阳)五水硫酸铜(CuSO4 5H2O)的溶解度曲线如图所示。结合你参与的“制备五水硫酸铜晶体”跨学科实践活动分析。下列说法错误的是( )
A.20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大
B.60℃时,50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液
C.根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体
D.饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状无影响
【考点】固体溶解度曲线及其作用.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、通过分析溶解度曲线可知,20℃~60℃时,五水硫酸铜的溶解度随温度升高而增大,故A正确;
B、60℃时,五水硫酸铜的溶解度是83.8g,所以50g水中加入45g五水硫酸铜充分溶解,可得硫酸铜饱和溶液,故B正确;
C、根据溶解度曲线判断,可采用降温结晶的方法制备五水硫酸铜晶体,故C正确;
D、饱和硫酸铜溶液降温结晶时,降温快慢对结晶出的五水硫酸铜晶体形状影响较大,故D错误。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
8.(2025 新疆)如图是硝酸钾的溶解度曲线。下列说法不正确的是( )
A.硝酸钾的溶解度随温度的升高而增大
B.60℃时,M点的硝酸钾溶液是不饱和溶液
C.降低温度可以使硝酸钾溶液的状态从M点转化为N点
D.60℃时,向50g水中加入60g硝酸钾,所得溶液的质量是110g
【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、通过分析溶解度曲线可知,硝酸钾的溶解度随温度的升高而增大,故A正确;
B、60℃时,M点在硝酸钾溶解度曲线的下发,所以硝酸钾溶液是不饱和溶液,故B正确;
C、降低温度可以使硝酸钾溶液的状态从M点转化为N点,故C正确;
D、60℃时,硝酸钾的溶解度时110g,向50g水中加入60g硝酸钾,只能溶解55g的晶体,所得溶液的质量是105g,故D错误。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
9.(2025 广西)侯氏制碱法中涉及的三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.三种物质中,NH4Cl的溶解度最大
B.将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,析出晶体的质量m(NH4Cl)>m(NaCl)
C.t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等
D.t2℃时,10gNaHCO3固体能完全溶于50g水中
【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】A、根据选项说法没有指明温度,进行分析判断。
B、根据选项说法没有指明饱和溶液的质量,进行分析判断。
C、根据t1℃时,NaCl、NH4Cl的溶解度相等,进行分析判断。
D、根据t2℃时,碳酸氢钠的溶解度为10g,进行分析判断。
【解答】解:A、选项说法没有指明温度,无法比较它们的溶解度大小,故选项说法错误。
B、选项说法没有指明饱和溶液的质量,将40℃时的NaCl、NH4Cl饱和溶液分别降温至t1℃,无法比较析出晶体的质量大小,故选项说法错误。
C、t1℃时,NaCl、NH4Cl的溶解度相等,t1℃时,取等质量的NaCl、NH4Cl固体分别溶于水配成饱和溶液,溶液的质量一定相等,故选项说法正确。
D、t2℃时,碳酸氢钠的溶解度为10g,t2℃时,50g水中最多能溶解5g碳酸氢钠,则t2℃时,10gNaHCO3固体不能完全溶于50g水中,故选项说法错误。
故选:C。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
10.(2025 深圳)(NH4)2SO4和NH4Cl是两种常见的氮肥,二者溶解度曲线如图所示,下列骥翔同学和帆帆同学说法正确的是( )
A.NH4Cl的溶解度比(NH4)2SO4的溶解度小
B.将20℃(NH4)2SO4的饱和溶液升温至80℃,溶质质量分数会增大
C.40℃时NH4Cl饱和溶液质量分数为45.8%
D.80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】D
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况。
【解答】解:A、比较溶解度大小,需要有温度的限制,故A错;
B、将20℃(NH4)2SO4的饱和溶液升温至80℃,溶解度变大,变为不饱和溶液,溶质质量分数不变,故B错;
C、40℃时NH4Cl饱和溶液质量分数为:31.4%,故B错;
D、80℃时,(NH4)2SO4的溶解度是94.1g,即在该温度下,100g水中最多溶解94.1g硫酸铵,所以200g水中最多溶解188.2g,所以80℃时将94.1g(NH4)2SO4加入200g水中,会形成不饱和溶液,故D正确。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
11.(2025 青海)《开宝本草》中记载“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,此处“霜”主要成分为KNO3。结合如图,下列说法不正确的是( )
A.20℃时,KNO3的溶解度是63.9g
B.“扫取以水淋汁”体现了硝酸钾易溶于水
C.40℃时,将70gKNO3加入100g水中得到饱和溶液
D.“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低
【考点】固体溶解度曲线及其作用;物质的溶解性及影响溶解性的因素.
【专题】溶液、浊液与溶解度.
【答案】A
【分析】A、根据溶解度曲线图,进行分析判断。
B、根据“扫取以水淋汁”的含义,进行分析判断。
C、根据40℃时,KNO3的溶解度是63.9g,进行分析判断。
D、根据“冬月地上有霜”,说明温度降低,有硝酸钾晶体析出,进行分析判断。
【解答】解:A、由溶解度曲线图可知,20℃时,KNO3的溶解度是31.6g,故选项说法错误。
B、“扫取以水淋汁”,指的是溶解,体现了硝酸钾易溶于水,故选项说法正确。
C、40℃时,KNO3的溶解度是63.9g,40℃时,将70gKNO3加入100g水中,最多能溶解63.9g,得到的是饱和溶液,故选项说法正确。
D、“冬月地上有霜”,说明温度降低,有硝酸钾晶体析出,证明KNO3的溶解度随温度的降低而降低,故选项说法正确。
故选:A。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
12.(2025 成都)《史记正义》记载“垦畦浇晒”产盐法,过程如图。卤水含大量Na2SO4和NaCl等物质,结合溶解度曲线分析,下列说法正确的是( )
A.晶体1是NaCl,晶体2是Na2SO4
B.“过箩”到“晒制”,NaCl的质量分数一直变大
C.“母液”中含有Na2SO4和NaCl
D.降温结晶可除去NaCl溶液中的少量Na2SO4
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法.
【专题】溶液、浊液与溶解度.
【答案】C
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:A、硫酸钠的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以晶体1是硫酸钠,晶体2是氯化钠,故A错误;
B、“过箩”到“晒制”,NaCl的质量分数先增大,析出晶体后不变,故B错误;
C、“母液”中含有Na2SO4和NaCl,故C正确;
D、蒸发结晶可除去NaCl溶液中的少量Na2SO4,故D错误。
故选:C。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
二.选择填充题(共1小题)
13.(2025 江西)从盐卤水(含硫酸钠、氯化钠等)中提取的硫酸钠可用于制中药西瓜霜,硫酸钠和氯化钠的溶解度曲线如图。下列说法正确的是 C 。
A.40℃时氯化钠的溶解度是48.8g
B.t℃时氯化钠溶液和硫酸钠溶液的溶质质量相等
C.可用降温结晶的方法从盐卤水中提取硫酸钠晶体
D.将t℃饱和硫酸钠溶液变为不饱和溶液的方法是 加入溶剂(或升高温度等)
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;饱和溶液和不饱和溶液相互转变的方法.
【专题】溶液、浊液与溶解度.
【答案】C;加入溶剂(或升高温度等)。
【分析】A、根据溶解度曲线图,进行分析判断。
B、根据选项说法没有指明溶液的质量、溶液是否饱和,进行分析判断。
C、根据温度小于40℃,硫酸钠的溶解度随着温度的降低而减小,氯化钠的溶解度受温度的影响变化不大,进行分析判断。
D、根据饱和溶液转化为不饱和溶液的方法,进行分析判断。
【解答】解:A、由溶解度曲线图可知,40℃时硫酸钠的溶解度是48.8g,故选项说法错误。
B、选项说法没有指明溶液的质量、溶液是否饱和,则t℃时氯化钠溶液和硫酸钠溶液的溶质质量不一定相等,故选项说法错误。
C、温度小于40℃,硫酸钠的溶解度随着温度的降低而减小,氯化钠的溶解度受温度的影响变化不大,可用降温结晶的方法从盐卤水中提取硫酸钠晶体,故选项说法正确。
D、将t℃饱和硫酸钠溶液变为不饱和溶液的方法是加入溶剂、升高温度等。
故答案为:
C;加入溶剂(或升高温度等)。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
三.填空题(共6小题)
14.(2025 长沙)小湖同学在进行“海洋资源的综合利用与制盐”跨学科实践活动中,查阅到海水中氯化钠和硫酸钠的溶解度曲线如图所示。
(1)在0~40℃时,图中物质的溶解度受温度影响较大的是 硫酸钠 。
(2)在t℃时,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数 相等 (填“相等”或“不相等”)。
(3)通过实践活动最终获得了氯化钠固体,写出氯化钠的一种用途 用作化工原料或用作调味品等 。
【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
【专题】溶液、浊液与溶解度.
【答案】解:(1)硫酸钠。
(2)相等。
(3)用作化工原料或用作调味品等。
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
饱和溶液溶质质量分数100%。
【解答】解:(1)在0~40℃时,图中物质的溶解度受温度影响较大的是硫酸钠。
故答案为:硫酸钠。
(2)在t℃时氯化钠和硫酸钠的溶解度相等,氯化钠饱和溶液、硫酸钠饱和溶液中溶质的质量分数相等。
故答案为:相等。
(3)氯化钠的一种用途是用作化工原料或用作调味品等。
故答案为:用作化工原料或用作调味品等。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
15.(2025 黑龙江)海洋蕴藏着丰富的资源,人类应合理开发和应用。海水中含有KCl和MgSO4等物质,其在不同温度时的溶解度如下表所示,下图是对应的溶解度曲线。
温度℃ 20 30 40 60 80 100
溶解度/g KCl 34.0 37.0 40.0 45.5 51.1 56.7
MgSO4 33.7 38.9 44.5 54.6 55.8 50.4
(1)代表KCl溶解度曲线的是 甲 (填“甲”或“乙”)。
(2)40℃时,将30gKCl固体加入50g水中,充分溶解后,所得溶液的质量为 70 g。
(3)t2℃时,将等质量的甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量甲 = 乙(填“>”“<”或“=”)。
(4)t3℃时,将100gMgSO4饱和溶液逐渐降温经t2℃直至t1℃,其溶质质量分数的变化趋势是 先不变后变小 。
【考点】固体溶解度曲线及其作用;有关溶质质量分数的简单计算;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)甲;
(2)70;
(3)=;
(4)先不变后变小。
【分析】(1)根据KCl的溶解度随温度升高而增大来分析解答;
(2)根据40℃时,KCl的溶解度是40.0g来分析解答;
(3)根据t2℃时,甲、乙溶解度相等,降温到t1℃时,甲、乙的溶解度相等来分析解答;
(4)根据t3℃降温到t2℃,MgSO4溶解度增大,饱和溶液变为不饱和溶液,溶质、溶剂质量不变,t2℃降温到t1℃,MgSO4溶解度减小来分析解答。
【解答】解:(1)由表格数据可知,KCl的溶解度随温度升高而增大,MgSO4的溶解度随温度升高先增大后减小,曲线甲溶解度随温度升高持续增大,所以代表KCl溶解度曲线的是甲;
(2)40℃时,KCl的溶解度是40.0g,则40℃时,100g水中最多溶解40.0gKCl,那么50g水中最多溶解KCl的质量为20g,将30gKCl固体加入50g水中,只能溶解20g,所得溶液质量为20g+50g=70g;
(3)t2℃时,甲、乙溶解度相等,根据饱和溶液的溶质质量分数100%,等质量的甲、乙两物质饱和溶液的溶质质量分数相等,溶质质量也相等,降温到t1℃时,甲、乙的溶解度都减小,但仍相等,而溶剂质量都不变,所以析出晶体的质量甲=乙;
(4)t3℃降温到t2℃,MgSO4溶解度增大,饱和溶液变为不饱和溶液,溶质、溶剂质量不变,溶质质量分数不变,t2℃降温到t1℃,MgSO4溶解度减小,当溶解度小于t3℃的溶解度之后,会析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小,所以其溶质质量分数的变化趋势是先不变后变小。
故答案为:(1)甲;
(2)70;
(3)=;
(4)先不变后变小。
【点评】在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答。
16.(2025 齐齐哈尔)如图是硝酸钾和氯化钠的溶解度曲线。请回答下列问题:
(1)图中P点的含义是 t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等 。
(2)若氯化钠中混有少量硝酸钾,可用 蒸发结晶 (填“蒸发结晶”或“降温结晶”)的方法提纯氯化钠。
(3)50℃时,将90g硝酸钾加入100g水中,充分溶解后,所得溶液是 饱和 (填“饱和”或“不饱和”)溶液,溶液的质量是 185.5 g。
(4)50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,对所得溶液的叙述正确的是 BCD 。
A.溶解度:氯化钠>硝酸钾
B.溶剂质量:氯化钠>硝酸钾
C.溶质质量分数:氯化钠=硝酸钾
D.溶质质量:氯化钠>硝酸钾
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等;
(2)蒸发结晶;
(3)饱和;185.5;
(4)BCD。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)溶解度曲线交点的含义是在该温度下,两种物质的溶解度相等,观察可知,P点是硝酸钾和氯化钠溶解度曲线的交点,所以P点的含义是在t℃时,硝酸钾和氯化钠的溶解度相等;
(2)硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小。当氯化钠中含有少量硝酸钾时,蒸发结晶,大部分氯化钠会结晶析出,而硝酸钾在较高温度下溶解度较大,不会大量析出,从而可以得到氯化钠;
(3)由图可知,50℃时硝酸钾的溶解度是85.5g,即50℃时,100g水中最多溶解85.5g硝酸钾。将90g硝酸钾加入100g水中,充分溶解后,溶解的硝酸钾质量为85.5g,有90g﹣85.5g=4.5g硝酸钾未溶解,所以所得溶液是饱和溶液,溶液的质量是100g+85.5g=185.5g;
(4)A、由图可知,t℃时,氯化钠和硝酸钾的溶解度相等,故选项说法错误;
B、50℃时,硝酸钾的溶解度大于氯化钠,则等质量的硝酸钾饱和溶液和氯化钠饱和溶液中,氯化钠溶液中溶剂质量更大,则50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,溶剂质量不变,则t℃时,溶剂质量:氯化钠>硝酸钾,故选项说法正确;
C、氯化钠和硝酸钾的溶解度都随温度降低而减小,50℃时,分别将等质量的硝酸钾饱和溶液和氯化钠饱和溶液降温至t℃,二者还是饱和溶液,t℃时,氯化钠和硝酸钾的溶解度相等,饱和溶液的溶质质量分数,则t℃时,溶质质量分数:氯化钠=硝酸钾,故选项说法正确;
D、t℃时,氯化钠和硝酸钾的溶解度相等,二者还是饱和溶液,且t℃时,溶剂质量:氯化钠>硝酸钾,则溶质质量:氯化钠>硝酸钾,故选项说法正确;
故答案为:(1)t℃时,硝酸钾和氯化钠(或KNO3和NaCl)的溶解度相等;
(2)蒸发结晶;
(3)饱和;185.5;
(4)BCD。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
17.(2025 绥化)KNO3和NaCl的溶解度曲线如图所示。
(1) KNO3或硝酸钾 的溶解度受温度影响变化较大。
(2)t2℃时,KNO3的溶解度 = NaCl的溶解度(填“>”、“<”或“=”)。
(3)t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为 36 g。
【考点】固体溶解度曲线及其作用.
【专题】溶液、浊液与溶解度.
【答案】(1)KNO3或硝酸钾;
(2)=;
(3)36。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)由溶解度曲线可知,硝酸钾的溶解度受温度影响变化较大;
(2)由溶解度曲线可知,t2℃时,KNO3的溶解度=NaCl的溶解度;
(3)t3℃时,KNO3的溶解度是80g,即在该温度下,100g水中最多溶解80g硝酸钾,所以10g水中最多溶解8g硝酸钾,所以完全溶解16gKNO3固体,需要20g水,所以t3℃时,完全溶解16gKNO3固体,可得到硝酸钾饱和溶液的质量为:16g+20g=36g。
故答案为:(1)KNO3或硝酸钾;
(2)=;
(3)36。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
18.(2025 河北)感探究之趣,赏化学之美——制作美丽硫酸铜晶体。图1所示为硫酸铜的溶解度曲线,图2所示为制作硫酸铜晶体的实验过程(不考虑水的蒸发)。
请回答下列问题:
(1)0~60℃,温度越高,硫酸铜的溶解度 增大 。
(2)A点的意义:60℃时,硫酸铜的溶解度为 40 g。
(3)②中溶液是60℃时硫酸铜的 不饱和 (填“饱和”或“不饱和”)溶液。
(4)比较①③溶液中硫酸铜的质量分数:① = ③(填“>”“=”或“<”)。
(5)写出一种处理③中溶液的方法: 用于配制农药波尔多液(答案不唯一) 。
【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)增大;
(2)40;
(3)不饱和;
(4)=;
(5)用于配制农药波尔多液(答案不唯一)。
【分析】(1)根据硫酸铜的溶解度曲线,进行分析解答。
(2)根据溶解度曲线某一点的含义,进行分析解答。
(3)根据60℃时,硫酸铜的溶解度为40g,进行分析解答。
(4)根据③中溶液是20℃时取出晶体后得到的,进行分析解答。
(5)根据处理硫酸铜溶液的方法,进行分析解答。
【解答】解:(1)由硫酸铜的溶解度曲线可知,0~60℃,温度越高,硫酸铜的溶解度增大。
(2)A点的意义:60℃时,硫酸铜的溶解度为40g。
(3)60℃时,硫酸铜的溶解度为40g,该温度下,100g水中最多能溶解40g硫酸铜,则②中溶液,溶质的质量为36g,是60℃时硫酸铜的不饱和溶液。
(4)③中溶液是20℃时取出晶体后得到的,①③溶液均为20℃时硫酸铜的饱和溶液,①③溶液中硫酸铜的质量分数:①=③。
(5)③中溶液是硫酸铜的饱和溶液,硫酸铜溶液可用于配制农药波尔多液,则处理③中溶液可以是用于配制农药波尔多液(答案不唯一)。
故答案为:
(1)增大;
(2)40;
(3)不饱和;
(4)=;
(5)用于配制农药波尔多液(答案不唯一)。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
19.(2025 甘肃)如图为NaCl、NH4Cl和NaHCO3的溶解度曲线。
(1)t1℃时,NaCl的溶解度 > (填“>”或”<”)NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是 加入氯化铵或恒温蒸发溶剂等 (写一种即可)。
(3)当NH4Cl溶液中混有少量NaCl时,可采用 降温结晶 的方法提纯NH4Cl。
(4)t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为 3:25 (化为最简整数比)。
【考点】固体溶解度曲线及其作用;利用溶解度曲线判断混合物分离提纯的方法;饱和溶液和不饱和溶液相互转变的方法.
【答案】(1)>;
(2)加入氯化铵或恒温蒸发溶剂等;
(3)降温结晶;
(4)3:25。
【分析】(1)根据t1℃时两种物质的溶解度曲线上对应的点的位置高低,进行分析判断。
(2)根据不饱和溶液变为该温度下的饱和溶液的方法,进行分析解答。
(3)根据NH4Cl和NaCl的溶解度受温度的影响不同,NH4Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,进行分析解答。
(4)根据t3℃时,碳酸氢钠的溶解度为12g,进行分析解答。
【解答】解:(1)t1℃时氯化钠对应的点的位置高,则t1℃时,NaCl的溶解度>NH4Cl的溶解度。
(2)将t2℃时NH4Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是加入氯化铵、恒温蒸发溶剂等。
(3)NH4Cl和NaCl的溶解度受温度的影响不同,NH4Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,当NH4Cl溶液中混有少量NaCl时,可采用降温结晶的方法。
(4)t3℃时,碳酸氢钠的溶解度为12g,t3℃时,NaHCO3饱和溶液中溶质与溶剂的质量比为12g:100g=3:25。
故答案为:
(1)>;
(2)加入氯化铵或恒温蒸发溶剂等;
(3)降温结晶;
(4)3:25。
【点评】本题难度不大,理解固体溶解度曲线的含义(点、线、面和交点等)并能灵活运用是正确解答本题的关键。
四.工艺流程题(共1小题)
20.(2025 烟台)黑火药是我国古代的四大发明之一,其成分含有KNO3。古代以硝土和草木灰(主要成分K2CO3)为原料生产KNO3的部分流程如图1所示。
【查阅资料】①硝土的主要成分是KNO3、Ca(NO3)2和NaCl等。
②Ca(NO3)2与K2CO3能发生复分解反应。
(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是 Ca(NO3)2+K2CO3=CaCO3↓+2KNO3 。淋硝所得的溶液称为“硝水”,其溶质中一定含有的物质是 KNO3、NaCl 。
(2)熬硝主要是将淋硝过程中得到的硝水浓缩成浓硝水。根据图2中的溶解度曲线分析,冷却热浓硝水,主要获得KNO3晶体的原因是 硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出 。若将80℃的269g硝酸钾饱和溶液降温到20℃,则析出硝酸钾晶体质量是 137.4 g。
(3)滤液A可以循环使用,原因是 滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费 。
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,则X的化学式是 N2 。
【考点】物质的相互转化和制备;根据质量守恒定律判断物质的化学式;固体溶解度曲线及其作用.
【专题】物质的制备.
【答案】(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;KNO3、NaCl;
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;137.4;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)N2。
【分析】(1)根据硝酸钙与碳酸钾反应的原理来分析;
(2)根据溶解度曲线图并结合饱和溶液的特点来分析;
(3)根据滤液A是KNO3的饱和溶液来分析;
(4)根据质量守恒定律来分析。
【解答】解:(1)淋硝过程中Ca(NO3)2与K2CO3反应的化学方程式是Ca(NO3)2+K2CO3=CaCO3↓+2KNO3。根据以上反应原理可知,“硝水”中一定含有的溶质是反应生成的KNO3,以及原本存在的NaCl(因硝土中有,用水冲淋会溶解)等,结合流程可知一定有KNO3、NaCl。
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;80℃时169g硝酸钾溶于适量水(100g)形成饱和溶液(题中给出80℃时饱和溶液的质量为269g),降温到20℃,20℃时硝酸钾溶解度31.6g,所以析出质量为80℃时溶解度与20℃时溶解度差值,即析出晶体质量:169g﹣31.6g=137.4g;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)黑火药爆炸时发生反应的化学方程式是2KNO3+S+3CK2S+X↑+3CO2↑,根据化学反应前后原子的总数保持不变可知,生成物还缺少2个N,即X为N2。
故答案为:
(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;KNO3、NaCl;
(2)硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出;137.4;
(3)滤液A是KNO3的饱和溶液,能够提高原料的利用率,减少资源浪费;
(4)N2。
【点评】这是一道关于化学工艺和溶解度曲线的化学题,涉及反应方程式、溶解度分析、物质循环及质量守恒定律应用等相关知识,掌握常见物质的性质即可解答本题。
五.解答题(共2小题)
21.(2025 天津)溶液与人类生产、生活密切相关。
(1)如表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
①20℃时,氯化钠的溶解度为 36.0 g。
②20℃时,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后得到的溶液质量为 68 g。
③60℃时,饱和硝酸钾溶液中溶质的质量分数为 52.4% (结果精确至0.1%)。
④将80℃时250g溶质的质量分数为60%的硝酸钾溶液降温到20℃,析出晶体的质量为 118.4 g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为 48 g。
【考点】固体溶解度表格及其作用;有关溶质质量分数的简单计算;晶体和结晶的概念与现象.
【专题】溶液、浊液与溶解度.
【答案】(1)①36.0。
②68。
③52.4%。
④118.4。
(2)48。
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液的溶质质量分数100%。
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
【解答】解:(1)①20℃时,氯化钠的溶解度为36.0g。
②20℃时氯化钠溶解度是36.0g,将20g氯化钠固体加入盛有50g水的烧杯中,充分溶解后,能够溶解18g,得到的溶液质量为50g+18g=68g。
③60℃时硝酸钾溶解度是110g,饱和硝酸钾溶液中溶质的质量分数为100%≈52.4%。
④250g溶质的质量分数为60%的硝酸钾溶液中,硝酸钾质量是250g×60%=150g,水的质量是250g﹣150g=100g,降温到20℃,20℃时硝酸钾溶解度是31.6g,析出晶体的质量为150g﹣31.6g=118.4g。
(2)农业生产可利用质量分数为16%的氯化钠溶液选种。在实验室配制300g这种溶液,需要氯化钠的质量为300g×16%=48g。
故答案为:(1)①36.0。
②68。
③52.4%。
④118.4。
(2)48。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
22.(2025 福建)我国古代劳动人民因地制宜生产食盐。如《明史》记载:“解州之盐,风水所结;闽粤之盐,集卤。”
(1)解州之“盐”指池盐,即自然条件下盐湖结晶得到的食盐(含Na2SO4等杂质),常产于气候干旱地区。
①池盐属于 混合物 (填“纯净物”或“混合物”)。
②盐湖遇到西北风(冷空气)或南风(热空气)时,均会出现“一夜浮华”(析出大量晶体)的现象。所得晶体中,NaCl含量较高的自然条件是 南风 (填“西北风”或“南风”),理由是 Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低 。(已知:Na2SO4和NaCl的溶解度曲线如图所示)
(2)闽粤之“盐”指海盐,其生产工艺(集卤):海水先经风吹和日晒获得较浓卤水,再煎制得食盐。生产时,古人用不同浓度的食盐水处理过的石莲子(一种植物果实)和竹筒制成莲管秤(如图A所示),用来检验卤水的浓度是否达到煎制要求。
①“集卤”工艺不采用直接蒸煮海水的方法提取食盐,其原因是 直接蒸煮海水需要消耗大量能源 。
②处理石莲子时,需配制饱和食盐水,其操作是 取适量水,加入食盐并充分搅拌,直至不再溶解 。
③莲管秤中的1~4号石莲子的密度依次减小。现将两份卤水分别倒入莲管秤中,观察到石莲子的沉浮情况如图B和图C所示,对应的卤水浓度较大的是 B (填“B”或“C”),莲管秤能区分不同浓度卤水的原理是 卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大 。
【考点】固体溶解度曲线及其作用;氯化钠与粗盐提纯.
【答案】(1)①混合物;
②南风;Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低;
(2)①直接蒸煮海水需要消耗大量能源;
②取适量水,加入食盐并充分搅拌,直至不再溶解;
③B;卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大。
【分析】(1)①根据纯净物是由一种物质组成的物质,混合物是指由两种或两种以上物质组成的物质,进行分析解答。
②根据Na2SO4的溶解度随温度升高而明显增大,进行分析解答。
(2)①根据氯化钠的溶解度受温度的影响变化较小,进行分析解答。
②根据配制饱和食盐水的方法,进行分析解答。
③根据在B中要比C中石莲子上浮的个数多,卤水的浓度和密度的关系,进行分析解答。
【解答】解:(1)①池盐中含有食盐,主要成分是氯化钠,含Na2SO4等杂质等多种物质,属于混合物。
②由溶解度曲线可知,Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低,所得晶体中NaCl含量较高。
(2)①氯化钠的溶解度受温度的影响变化较小,需要蒸发溶剂的方法结晶;若直接蒸煮海水需要消耗大量能源。
②常温下,食盐易溶于水,配制饱和食盐水的方法为:取适量水,加入食盐并充分搅拌,直至不再溶解。
③据图可知,在B中要比C中石莲子上浮的个数多,对应的卤水浓度较大的是B;由实验可知,卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大,所以可以用莲管秤来区分不同浓度卤水。
故答案为:
(1)①混合物;
②南风;Na2SO4的溶解度随温度升高而明显增大,南风时温度较高,析出的晶体中Na2SO4含量较低;
(2)①直接蒸煮海水需要消耗大量能源;
②取适量水,加入食盐并充分搅拌,直至不再溶解;
③B;卤水的浓度越大,密度越大,石莲子排开等体积的水所产生的浮力越大。
【点评】本题难度不大,了解溶解度曲线的含义、饱和溶液的特征、结晶的方法等是正确解答本题的关键。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
