3.1.2铁和铁的化合物 课件 (共28张PPT) 高中化学鲁科版(2019)必修一
文档属性
| 名称 | 3.1.2铁和铁的化合物 课件 (共28张PPT) 高中化学鲁科版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 21:28:21 | ||
图片预览








文档简介
(共28张PPT)
铁和铁的化合物
核心素养目标
1.掌握铁单质、铁的氧化物和铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,培养科学探究与创新意识。
2.能从物质类别和价态两个角度研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系,增强科学态度与社会责任。
一.铁单质
01
铁的物理性质
银白色金属
延展性
导热性
磁性
还有:密度为 7.86 g·cm-3,熔点为 1 538 ℃,导电性比铜、铝差
铁的化学性质
回顾初中及所学的高中知识,所涉及的铁的化学反应有什么?
被氧气氧化
金属活动性顺序
在氯气中燃烧
3Fe+2O2===Fe3O4
点燃
铁生锈
与稀盐酸反应 Fe+2HCl = FeCl2+H2↑
与硫酸铜反应 Fe+CuSO4 = Cu+FeSO4
2Fe+3Cl2===2FeCl3
在上述反应中,铁元素的化合价的变化有何异同?为什么?
铁单质中铁元素的化合价为0价,具有还原性。
Fe2+
Fe3+
较弱氧化剂(硫酸铜、稀盐酸等)
较强氧化剂(氯气等)
+
为什么初中没有学习铁与硝酸的反应?
两者反应的生成物是什么?
Fe(少量)+4HNO3(稀)══Fe(NO3)3+NO↑+2H2O
Fe+6HNO3(浓)══Fe(NO3)3+3NO2↑+3H2O
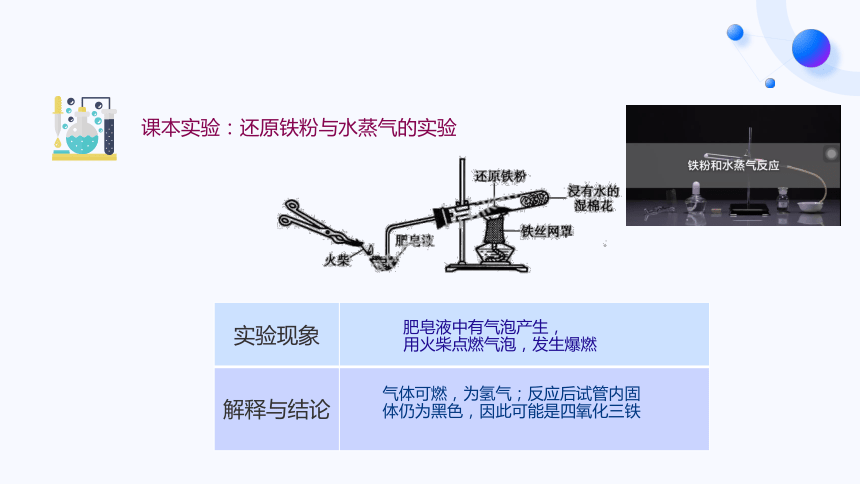
课本实验:还原铁粉与水蒸气的实验
实验现象
解释与结论
肥皂液中有气泡产生,
用火柴点燃气泡,发生爆燃
气体可燃,为氢气;反应后试管内固体仍为黑色,因此可能是四氧化三铁
如何证明黑色固体的成分?
提示 取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份。一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;
另一份加入KSCN溶液,溶液显红色,说明溶液中含有Fe3+。
二.铁的氧化物
02
试剂 氧化亚铁 氧化铁 四氧化三铁
化学式
俗名
颜色状态
溶解性 FeO
Fe2O3
Fe3O4
无
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
铁的氧化物的物理性质
铁的氧化物的用途
试剂 氧化亚铁 氧化铁 四氧化三铁
用途 用作色素 用作油漆、涂料、油墨的红色颜料 磁性材料
示例
铁的氧化物的化学性质
1.从物质类别的角度分析,FeO、Fe2O3都属于 ,它们都能与酸反应生成相应的 ,写出下列氧化物和稀盐酸反应的离子方程式:
①FeO:______________________。
②Fe2O3:_________________________。
③Fe3O4:Fe3O4+8H+===Fe2++2Fe3++4H2O。
碱性氧化物
盐和水
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
2.从元素化合价的角度分析,铁的氧化物都具有 ,其中FeO中Fe元素化合价为+2价,化合价还可以升高,具有 。
①FeO不稳定,在空气中受热被氧化生成 ,FeO在反应中表现 。
②铁的氧化物与铝粉在高温下可发生反应,Fe2O3和Al发生反应的化学方程式: ,反应放出 ,常用于_________、制备金属纳米复合材料等,Fe2O3在反应中表现 。
氧化性
还原性
Fe3O4
还原性
Fe2O3+2Al 2Fe+Al2O3
大量热
焊接钢轨
氧化性
特别提醒
①Fe3O4不属于碱性氧化物。
②Fe3O4的组成可用FeO·Fe2O3表示,但不表示Fe3O4是由FeO和Fe2O3组成的混合物,Fe3O4有固定的组成,是一种纯净物。
③FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应也叫铝热反应,常用KClO3和镁条引发该反应。
三.铁的氢氧化物
03
化学式 Fe(OH)2 Fe(OH)3
颜色、状态 ____色固体 _______色固体
溶解性 ____溶于水 ____溶于水
酸碱性 弱碱性 弱碱性
稳定性 在空气中易被氧化为_________ 受热易分解:2Fe(OH)3 Fe2O3+3H2O
铁的氢氧化物
白
红褐
难
难
Fe(OH)3
化学式 Fe(OH)2 Fe(OH)3
和非氧化性酸反应(离子方程式) ______________________ ________________________
制备 Fe2++2OH-===Fe(OH)2↓ Fe3++3OH-===Fe(OH)3↓
转化 4Fe(OH)2+O2+2H2O===4Fe(OH)3 现象:在空气中白色沉淀迅速变为___ ___,最终变为_______ Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
灰绿色
红褐色
制备Fe(OH)2
Fe(OH)2是一种白色沉淀,
极易被氧化生成Fe(OH)3
隔绝氧气
常用方法:
液封、煮沸(除去水中的氧气)
注意事项
实验装置
实验原理分析
为防止Fe(OH)2被氧化,可采用以下措施:
①用新制的FeSO4溶液和经过加热煮沸的NaOH溶液制
Fe(OH)2,目的是 。
②在FeSO4溶液表面覆盖一层煤油,目的是 。
③将吸有NaOH溶液的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液,
目的是 。
排除溶解的氧气,防止Fe(OH)2被氧化
隔绝空气中的氧气
防止带入氧气
实验步骤分析
打开止水夹a,稀硫酸与铁反应产生的氢气经支管进入B中,直至 ,再关闭a。
排尽B装置中的空气
关闭a后,稀硫酸与铁继续反应产生氢气,试管A中气体压强增大, ,与B中试剂反应产生Fe(OH)2。
液体被压入B中
相关反应的离子方程式为_____________ __
_____________________________。
Fe+2H+===Fe2++H2↑
Fe2++2OH-===Fe(OH)2↓
随课练习
下列关于金属铁的描述不正确的是
A.纯铁是银白色金属
B.能与水蒸气反应生成氧化铁
C.工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来
D.铁能导电但其导电性不如铜和铝
有关铁的氧化物的说法不正确的是
A.Fe3O4是黑色晶体,该晶体中每三个铁原子中有2个显+3价,1个显+2价
B.FeO、Fe3O4、Fe2O3都能与稀H2SO4反应生成盐和水,所以都是碱性氧
化物
C.FeO不稳定,空气中受热易转化为Fe3O4
D.Fe2O3俗称铁红,常用作红色油漆和涂料
随课练习
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量NaOH溶液,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和红棕色残渣分别是
A.Fe(OH)3,Fe2O3
B.Fe(OH)2,Fe2O3
C.Fe(OH)2,Fe(OH)3
D.Fe(OH)2,Fe3O4
随课练习
某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是
A.甲同学认为试管b中收集到的气体可点燃,且
产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四
氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,
加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
随课练习
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是
A.过程 Ⅰ 的化学方程式为2Fe3O4
6FeO+O2↑
B.过程 Ⅱ 中每生成23.2 g Fe3O4转移0.3 mol电子
C.利用该过程可以降低环境中CO2的含量
D.该过程总反应为CO2 C+O2
随课练习
随课练习
有下列物质:①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温)
与Fe反应时只生成+2价铁的化合物的是 (填序号,下同),只生成+3价铁的化合物的是 ,既生成+2价又生成+3价铁的化合物的是 。
②③④⑤
⑥
①⑦
THANK YOU
铁和铁的化合物
核心素养目标
1.掌握铁单质、铁的氧化物和铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,培养科学探究与创新意识。
2.能从物质类别和价态两个角度研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系,增强科学态度与社会责任。
一.铁单质
01
铁的物理性质
银白色金属
延展性
导热性
磁性
还有:密度为 7.86 g·cm-3,熔点为 1 538 ℃,导电性比铜、铝差
铁的化学性质
回顾初中及所学的高中知识,所涉及的铁的化学反应有什么?
被氧气氧化
金属活动性顺序
在氯气中燃烧
3Fe+2O2===Fe3O4
点燃
铁生锈
与稀盐酸反应 Fe+2HCl = FeCl2+H2↑
与硫酸铜反应 Fe+CuSO4 = Cu+FeSO4
2Fe+3Cl2===2FeCl3
在上述反应中,铁元素的化合价的变化有何异同?为什么?
铁单质中铁元素的化合价为0价,具有还原性。
Fe2+
Fe3+
较弱氧化剂(硫酸铜、稀盐酸等)
较强氧化剂(氯气等)
+
为什么初中没有学习铁与硝酸的反应?
两者反应的生成物是什么?
Fe(少量)+4HNO3(稀)══Fe(NO3)3+NO↑+2H2O
Fe+6HNO3(浓)══Fe(NO3)3+3NO2↑+3H2O
课本实验:还原铁粉与水蒸气的实验
实验现象
解释与结论
肥皂液中有气泡产生,
用火柴点燃气泡,发生爆燃
气体可燃,为氢气;反应后试管内固体仍为黑色,因此可能是四氧化三铁
如何证明黑色固体的成分?
提示 取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份。一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;
另一份加入KSCN溶液,溶液显红色,说明溶液中含有Fe3+。
二.铁的氧化物
02
试剂 氧化亚铁 氧化铁 四氧化三铁
化学式
俗名
颜色状态
溶解性 FeO
Fe2O3
Fe3O4
无
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
铁的氧化物的物理性质
铁的氧化物的用途
试剂 氧化亚铁 氧化铁 四氧化三铁
用途 用作色素 用作油漆、涂料、油墨的红色颜料 磁性材料
示例
铁的氧化物的化学性质
1.从物质类别的角度分析,FeO、Fe2O3都属于 ,它们都能与酸反应生成相应的 ,写出下列氧化物和稀盐酸反应的离子方程式:
①FeO:______________________。
②Fe2O3:_________________________。
③Fe3O4:Fe3O4+8H+===Fe2++2Fe3++4H2O。
碱性氧化物
盐和水
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
2.从元素化合价的角度分析,铁的氧化物都具有 ,其中FeO中Fe元素化合价为+2价,化合价还可以升高,具有 。
①FeO不稳定,在空气中受热被氧化生成 ,FeO在反应中表现 。
②铁的氧化物与铝粉在高温下可发生反应,Fe2O3和Al发生反应的化学方程式: ,反应放出 ,常用于_________、制备金属纳米复合材料等,Fe2O3在反应中表现 。
氧化性
还原性
Fe3O4
还原性
Fe2O3+2Al 2Fe+Al2O3
大量热
焊接钢轨
氧化性
特别提醒
①Fe3O4不属于碱性氧化物。
②Fe3O4的组成可用FeO·Fe2O3表示,但不表示Fe3O4是由FeO和Fe2O3组成的混合物,Fe3O4有固定的组成,是一种纯净物。
③FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应也叫铝热反应,常用KClO3和镁条引发该反应。
三.铁的氢氧化物
03
化学式 Fe(OH)2 Fe(OH)3
颜色、状态 ____色固体 _______色固体
溶解性 ____溶于水 ____溶于水
酸碱性 弱碱性 弱碱性
稳定性 在空气中易被氧化为_________ 受热易分解:2Fe(OH)3 Fe2O3+3H2O
铁的氢氧化物
白
红褐
难
难
Fe(OH)3
化学式 Fe(OH)2 Fe(OH)3
和非氧化性酸反应(离子方程式) ______________________ ________________________
制备 Fe2++2OH-===Fe(OH)2↓ Fe3++3OH-===Fe(OH)3↓
转化 4Fe(OH)2+O2+2H2O===4Fe(OH)3 现象:在空气中白色沉淀迅速变为___ ___,最终变为_______ Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
灰绿色
红褐色
制备Fe(OH)2
Fe(OH)2是一种白色沉淀,
极易被氧化生成Fe(OH)3
隔绝氧气
常用方法:
液封、煮沸(除去水中的氧气)
注意事项
实验装置
实验原理分析
为防止Fe(OH)2被氧化,可采用以下措施:
①用新制的FeSO4溶液和经过加热煮沸的NaOH溶液制
Fe(OH)2,目的是 。
②在FeSO4溶液表面覆盖一层煤油,目的是 。
③将吸有NaOH溶液的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液,
目的是 。
排除溶解的氧气,防止Fe(OH)2被氧化
隔绝空气中的氧气
防止带入氧气
实验步骤分析
打开止水夹a,稀硫酸与铁反应产生的氢气经支管进入B中,直至 ,再关闭a。
排尽B装置中的空气
关闭a后,稀硫酸与铁继续反应产生氢气,试管A中气体压强增大, ,与B中试剂反应产生Fe(OH)2。
液体被压入B中
相关反应的离子方程式为_____________ __
_____________________________。
Fe+2H+===Fe2++H2↑
Fe2++2OH-===Fe(OH)2↓
随课练习
下列关于金属铁的描述不正确的是
A.纯铁是银白色金属
B.能与水蒸气反应生成氧化铁
C.工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来
D.铁能导电但其导电性不如铜和铝
有关铁的氧化物的说法不正确的是
A.Fe3O4是黑色晶体,该晶体中每三个铁原子中有2个显+3价,1个显+2价
B.FeO、Fe3O4、Fe2O3都能与稀H2SO4反应生成盐和水,所以都是碱性氧
化物
C.FeO不稳定,空气中受热易转化为Fe3O4
D.Fe2O3俗称铁红,常用作红色油漆和涂料
随课练习
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量NaOH溶液,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和红棕色残渣分别是
A.Fe(OH)3,Fe2O3
B.Fe(OH)2,Fe2O3
C.Fe(OH)2,Fe(OH)3
D.Fe(OH)2,Fe3O4
随课练习
某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是
A.甲同学认为试管b中收集到的气体可点燃,且
产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四
氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,
加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
随课练习
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是
A.过程 Ⅰ 的化学方程式为2Fe3O4
6FeO+O2↑
B.过程 Ⅱ 中每生成23.2 g Fe3O4转移0.3 mol电子
C.利用该过程可以降低环境中CO2的含量
D.该过程总反应为CO2 C+O2
随课练习
随课练习
有下列物质:①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温)
与Fe反应时只生成+2价铁的化合物的是 (填序号,下同),只生成+3价铁的化合物的是 ,既生成+2价又生成+3价铁的化合物的是 。
②③④⑤
⑥
①⑦
THANK YOU
