3.3.2氮的循环(2)课件 (共22张PPT) 高中化学鲁科版(2019)必修一
文档属性
| 名称 | 3.3.2氮的循环(2)课件 (共22张PPT) 高中化学鲁科版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 21:34:43 | ||
图片预览








文档简介
(共22张PPT)
氮的循环(2)
核心素养目标
1.能从物质的类别、氮元素价态的角度,预测氨气、铵盐的性质与转化,掌握氨气、铵盐的物理性质和化学性质,提高证据推理与模型认知能力。
2.能够根据氨气、铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。
一.氨气的转化
01
氨气
1.氨气的物理性质
颜色 气味 密度 溶解性 沸点
____色 ________气味 ____空气 _____溶于水(常温常压下1∶700) 较低,易液化
无
有刺激性
小于
极易
2.氨气的化学性质
实验现象
实验结论
化学方程式
①氨气与水的反应
烧杯中的水倒吸进入烧瓶,
形成红色的喷泉
NH3极易溶于水,并能与水
反应生成碱性物质
H2O+NH3 NH3·H2O
②氨气与氯化氢气体的反应
实验现象
实验结论
化学方程式
集气瓶中迅速产生大量白烟
NH3能和氯化氢气体反应
生成氯化铵固体
NH3+HCl = NH4Cl
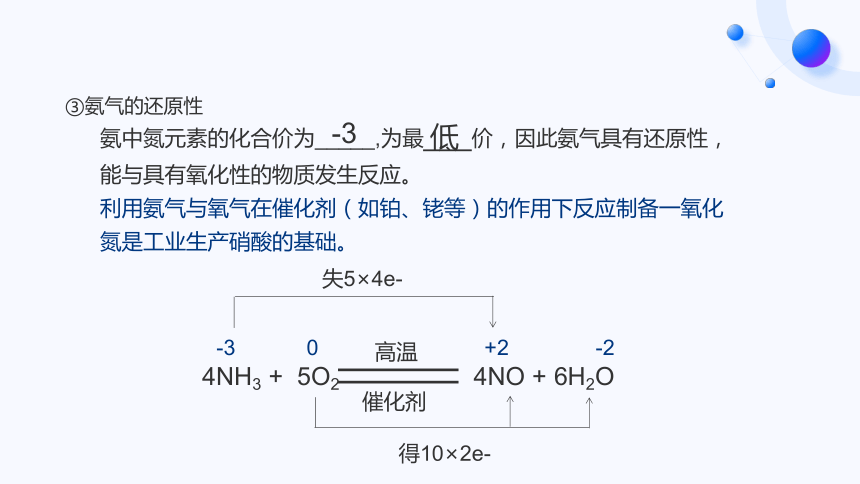
③氨气的还原性
氨中氮元素的化合价为_____,为最___价,因此氨气具有还原性,能与具有氧化性的物质发生反应。
利用氨气与氧气在催化剂(如铂、铑等)的作用下反应制备一氧化氮是工业生产硝酸的基础。
-3
低
失5×4e-
得10×2e-
高温
催化剂
-3
0
+2
-2
4NH3 + 5O2
4NO + 6H2O
氨气的还原性还体现在:
氨气和氧化铜在加热条件下生成N2和Cu:________________________。
氨气和氯气的反应:2NH3(少量)+3Cl2===6HCl+N2、8NH3(过量)+3Cl2 ===
(用于检验输送Cl2的管道是否漏气)。
2NH3+3CuO N2+3Cu+3H2O
6NH4Cl+N2
氨气与氯气的反应
二.氨气的生成
02
1.铵盐
定义 由铵根离子(NH4+)和酸根离子构成的化合物
物理性质 绝大多数铵盐都是白色或无色晶体且易溶于水
用途 农业上常用的化肥
示例
2.铵盐的化学性质
①受热易分解
NH4HCO3 ==== NH3 ↑ + CO2 ↑ + H2O
△
NH4Cl ==== NH3 ↑ + HCl ↑
△
②能与碱反应
NH4+ + OH- ==== NH3 ↑ + H2O
△
加热时:
不加热时:
NH4+ + OH- ==== NH3 · H2O
实验现象
实验结论
试管内壁上出现水珠,
澄清石灰水变浑浊
碳酸氢铵分解产生了水和
二氧化碳
加热碳酸氢铵固体
如何检验产物中有氨气?
①铵盐受热易分解,多数放出NH3,但也有的铵盐受热分解不放出NH3。例如NH4NO3受热分解:NH4NO3 N2O↑+2H2O、2NH4NO3 2N2↑+O2↑+4H2O。
②碳酸氢铵在常温下就有明显的分解。在储存碳酸氢铵化肥时,应密封包装并放置在阴凉通风处,施肥时,应将其埋在土中以保持肥效。
特别提醒
3.铵根离子的检验
铵
根
离
子
的
检
验
方
法
固体
溶液
取少量样品放入研钵中,加入固体碱进行研磨,若闻到氨
的刺激性气味,则说明样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石
蕊试纸放在试管口,若红色石蕊试纸变蓝,则说明样品中
含有NH4+
取少量溶液于试管中,加入浓碱液,微热,将湿润的红色
石蕊试纸放在试管口,若红色石蕊试纸变蓝,则说明样品
中含有NH4+
三.实验室制取氨气
03
1.实验原理
2NH4Cl + Ca(OH)2 ==== 2NH3 ↑ + CaCl2 + 2H2O
△
2.实验装置
装置中试管口塞一小团棉花的作用是什么?
棉花团的一个作用是防止氨气和空气发生对流,使收集的NH3更纯;另一个作用是浸有的水或稀硫酸可吸收多余的NH3,防止NH3污染空气。
实验装置还能如何改进?说明改进部分的作用。
改进装置
干燥氨气
实验装置
原理及化学方程式 氨水具有_________和_______,受热易分解。化学方程式___________________________。 NaOH固体具有________,溶于水_______,促使_______________。
CaO与水反应,使________减少;反应放热,促使一水合氨分解。化学方程式____________________________
3.其他制取氨气的方法
不稳定性
挥发性
NH3·H2O NH3↑+H2O
吸水性
放热
一水合氨分解
溶剂(水)
NH3·H2O+CaO===NH3↑+Ca(OH)2
已知氨气不溶于CCl4。下列关于氨气的说法正确的是
A.氨可以用浓硫酸干燥
B.氨溶于水显弱碱性,因此氨气可使湿润的酚酞试纸变蓝
C.氨本身没有毒,故发生液氨大量泄漏时,人们也不必采取任何防范措施
D.吸收NH3可用如图所示的装置防止倒吸
随课练习
如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是
A.挤压装置①的胶头滴管,
使NaOH溶液全部进入烧瓶,
片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开
止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
随课练习
试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
随课练习
THANK YOU
氮的循环(2)
核心素养目标
1.能从物质的类别、氮元素价态的角度,预测氨气、铵盐的性质与转化,掌握氨气、铵盐的物理性质和化学性质,提高证据推理与模型认知能力。
2.能够根据氨气、铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。
一.氨气的转化
01
氨气
1.氨气的物理性质
颜色 气味 密度 溶解性 沸点
____色 ________气味 ____空气 _____溶于水(常温常压下1∶700) 较低,易液化
无
有刺激性
小于
极易
2.氨气的化学性质
实验现象
实验结论
化学方程式
①氨气与水的反应
烧杯中的水倒吸进入烧瓶,
形成红色的喷泉
NH3极易溶于水,并能与水
反应生成碱性物质
H2O+NH3 NH3·H2O
②氨气与氯化氢气体的反应
实验现象
实验结论
化学方程式
集气瓶中迅速产生大量白烟
NH3能和氯化氢气体反应
生成氯化铵固体
NH3+HCl = NH4Cl
③氨气的还原性
氨中氮元素的化合价为_____,为最___价,因此氨气具有还原性,能与具有氧化性的物质发生反应。
利用氨气与氧气在催化剂(如铂、铑等)的作用下反应制备一氧化氮是工业生产硝酸的基础。
-3
低
失5×4e-
得10×2e-
高温
催化剂
-3
0
+2
-2
4NH3 + 5O2
4NO + 6H2O
氨气的还原性还体现在:
氨气和氧化铜在加热条件下生成N2和Cu:________________________。
氨气和氯气的反应:2NH3(少量)+3Cl2===6HCl+N2、8NH3(过量)+3Cl2 ===
(用于检验输送Cl2的管道是否漏气)。
2NH3+3CuO N2+3Cu+3H2O
6NH4Cl+N2
氨气与氯气的反应
二.氨气的生成
02
1.铵盐
定义 由铵根离子(NH4+)和酸根离子构成的化合物
物理性质 绝大多数铵盐都是白色或无色晶体且易溶于水
用途 农业上常用的化肥
示例
2.铵盐的化学性质
①受热易分解
NH4HCO3 ==== NH3 ↑ + CO2 ↑ + H2O
△
NH4Cl ==== NH3 ↑ + HCl ↑
△
②能与碱反应
NH4+ + OH- ==== NH3 ↑ + H2O
△
加热时:
不加热时:
NH4+ + OH- ==== NH3 · H2O
实验现象
实验结论
试管内壁上出现水珠,
澄清石灰水变浑浊
碳酸氢铵分解产生了水和
二氧化碳
加热碳酸氢铵固体
如何检验产物中有氨气?
①铵盐受热易分解,多数放出NH3,但也有的铵盐受热分解不放出NH3。例如NH4NO3受热分解:NH4NO3 N2O↑+2H2O、2NH4NO3 2N2↑+O2↑+4H2O。
②碳酸氢铵在常温下就有明显的分解。在储存碳酸氢铵化肥时,应密封包装并放置在阴凉通风处,施肥时,应将其埋在土中以保持肥效。
特别提醒
3.铵根离子的检验
铵
根
离
子
的
检
验
方
法
固体
溶液
取少量样品放入研钵中,加入固体碱进行研磨,若闻到氨
的刺激性气味,则说明样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石
蕊试纸放在试管口,若红色石蕊试纸变蓝,则说明样品中
含有NH4+
取少量溶液于试管中,加入浓碱液,微热,将湿润的红色
石蕊试纸放在试管口,若红色石蕊试纸变蓝,则说明样品
中含有NH4+
三.实验室制取氨气
03
1.实验原理
2NH4Cl + Ca(OH)2 ==== 2NH3 ↑ + CaCl2 + 2H2O
△
2.实验装置
装置中试管口塞一小团棉花的作用是什么?
棉花团的一个作用是防止氨气和空气发生对流,使收集的NH3更纯;另一个作用是浸有的水或稀硫酸可吸收多余的NH3,防止NH3污染空气。
实验装置还能如何改进?说明改进部分的作用。
改进装置
干燥氨气
实验装置
原理及化学方程式 氨水具有_________和_______,受热易分解。化学方程式___________________________。 NaOH固体具有________,溶于水_______,促使_______________。
CaO与水反应,使________减少;反应放热,促使一水合氨分解。化学方程式____________________________
3.其他制取氨气的方法
不稳定性
挥发性
NH3·H2O NH3↑+H2O
吸水性
放热
一水合氨分解
溶剂(水)
NH3·H2O+CaO===NH3↑+Ca(OH)2
已知氨气不溶于CCl4。下列关于氨气的说法正确的是
A.氨可以用浓硫酸干燥
B.氨溶于水显弱碱性,因此氨气可使湿润的酚酞试纸变蓝
C.氨本身没有毒,故发生液氨大量泄漏时,人们也不必采取任何防范措施
D.吸收NH3可用如图所示的装置防止倒吸
随课练习
如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是
A.挤压装置①的胶头滴管,
使NaOH溶液全部进入烧瓶,
片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开
止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
随课练习
试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
随课练习
THANK YOU
