模块质量检测(二)(含解析)高中化学人教版(2019)必修 第二册
文档属性
| 名称 | 模块质量检测(二)(含解析)高中化学人教版(2019)必修 第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 483.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-20 00:04:43 | ||
图片预览



文档简介
模块质量检测(二)
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是 ( )
A.利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变
B.发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐
C.研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
D.革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀
2.下列说法不正确的是 ( )
A.Al(OH)3呈两性,不能用于治疗胃酸过多
B.Na2O2能与CO2反应产生O2,可作供氧剂
C.FeO有还原性,能被氧化成Fe3O4
D.HNO3见光易分解,应保存在棕色试剂瓶中
3.下列资源利用中,在给定工艺条件下转化关系正确的是 ( )
A.煤煤油 B.石油乙烯
C.油脂甘油 D.淀粉乙醇
4.下列对食品的处理符合食品安全要求的是 ( )
A.使用“瘦肉精”激素饲料喂养的猪,猪肉的瘦肉率更高、营养价值更高
B.用福尔马林浸泡的海产品保鲜时间更长,味道更鲜美
C.添加工业染料“苏丹红”后的饲料喂养的鸭子产下的红心鸭蛋,营养价值更高
D.酱油中加铁、粮食制品中加赖氨酸营养更全面
5.下列反应条件的改变对3Cl2(g)+8NH3(g)N2(g)+6NH4Cl(s)反应速率的影响正确的是 ( )
A.增大Cl2的浓度能加快反应速率
B.减小N2的浓度能加快反应速率
C.降低温度能加快反应速率
D.及时将生成的NH4Cl移出可加快反应速率
6.辅酶Q10具有预防动脉硬化的功效,其结构简式如图。下列有关辅酶Q10的说法正确的是 ( )
A.分子式为C60H90O4
B.分子中含有14个甲基
C.分子中的四个氧原子不在同一平面
D.可发生加成反应,不能发生取代反应
7.下列实验操作、现象与结论的对应关系正确的是 ( )
选项 实验操作 现象 结论
A Cu和稀硝酸反应后Cu有剩余,再向该试管中加足量稀硫酸 无明显现象 Cu与稀硫酸不反应
B SO2通入氯水中 溶液褪色 SO2具有漂白性
C 向浓HNO3中插入红热的木炭 产生红棕色气体 证明碳与浓HNO3反应生成NO2
D 将铜片放入浓硝酸中 产生红棕色气体,溶液变为绿色 浓硝酸表现强氧化性和酸性
8.下列反应得到相同的产物,相关叙述错误的是 ( )
①+
②+
A.①的反应类型为取代反应
B.反应②是合成酯的方法之一
C.产物分子中所有碳原子共平面
D.产物的化学名称是乙酸异丙酯
9.尿素[CO(NH2)2]燃料电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电,其装置如图所示,下列说法不正确的是 ( )
A.该装置是将化学能转化为电能
B.A极为负极,发生还原反应
C.电流从B极经导线流向A极
D.B极反应式:O2+4e-+4H+2H2O
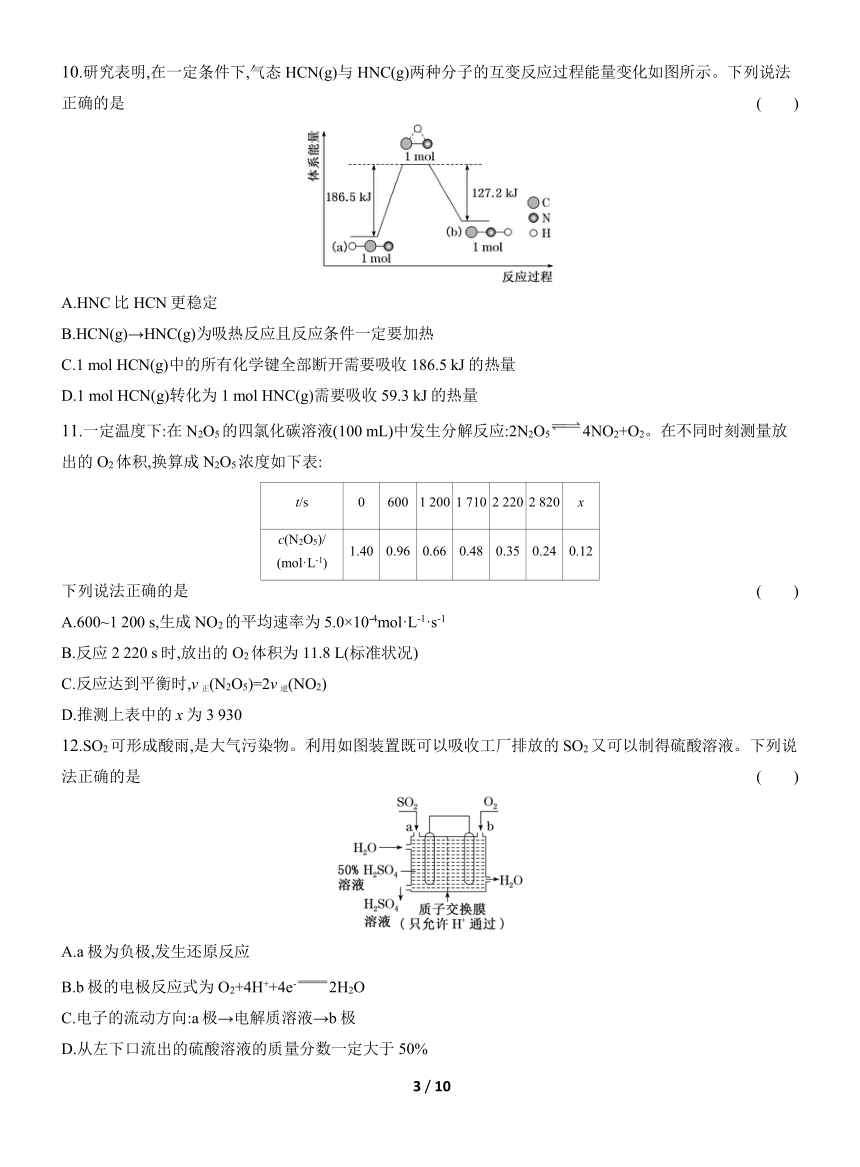
10.研究表明,在一定条件下,气态HCN(g)与HNC(g)两种分子的互变反应过程能量变化如图所示。下列说法正确的是 ( )
A.HNC比HCN更稳定
B.HCN(g)→HNC(g)为吸热反应且反应条件一定要加热
C.1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量
D.1 mol HCN(g)转化为1 mol HNC(g)需要吸收59.3 kJ的热量
11.一定温度下:在N2O5的四氯化碳溶液(100 mL)中发生分解反应:2N2O54NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
t/s 0 600 1 200 1 710 2 220 2 820 x
c(N2O5)/ (mol·L-1) 1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是 ( )
A.600~1 200 s,生成NO2的平均速率为5.0×10-4mol·L-1·s-1
B.反应2 220 s时,放出的O2体积为11.8 L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3 930
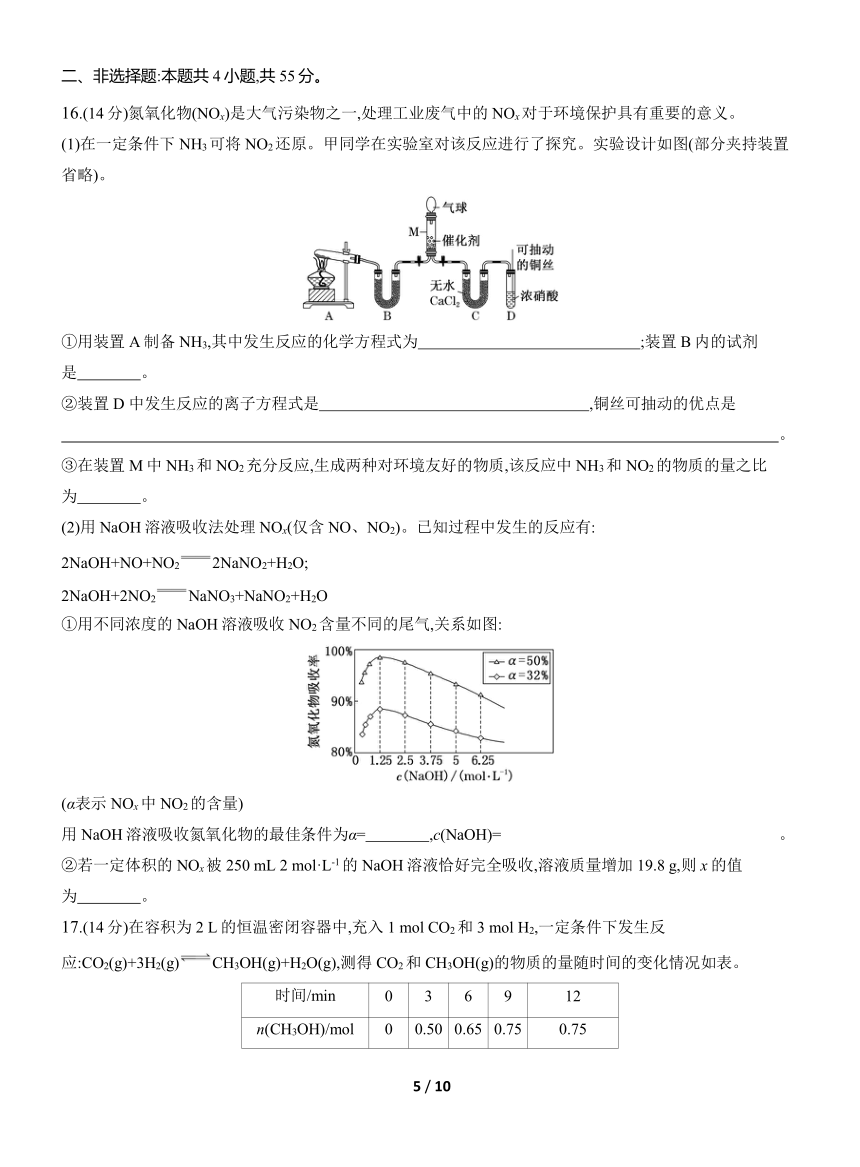
12.SO2可形成酸雨,是大气污染物。利用如图装置既可以吸收工厂排放的SO2又可以制得硫酸溶液。下列说法正确的是 ( )
A.a极为负极,发生还原反应
B.b极的电极反应式为O2+4H++4e-2H2O
C.电子的流动方向:a极→电解质溶液→b极
D.从左下口流出的硫酸溶液的质量分数一定大于50%
13.氮化硅(Si3N4)是一种重要的结构陶瓷材料。用石英砂和原料气(含N2和少量O2)制备Si3N4的操作流程如图(粗硅中含少量Fe、Cu的单质及化合物):
下列叙述不正确的是 ( )
A.“还原”反应的化学方程式为SiO2+2CSi(粗)+2CO↑
B.粗硅提纯所得的高纯硅是制造光导纤维的主要材料
C.“操作X”可将原料气通过灼热的铜网
D.“稀酸Y”可选用稀硝酸
14.以某铜渣(含少量Ag)为原料制备硫酸铜的实验步骤如下:向如图所示装置中加入铜渣,分批加入稀HNO3和稀H2SO4混合溶液,滴加的间隔鼓入氧气。反应结束后,向溶液中加入少量NaCl后过滤,从滤液中分离得到硫酸铜。下列叙述不正确的是 ( )
A.与直接用稀硝酸溶解铜渣相比,加入稀硫酸及鼓入氧气均可节约硝酸用量
B.当观察到鼓入O2不再出现红棕色,表明反应停止
C.加入氯化钠可除去溶液中少量的Ag+
D.将含硫酸铜的滤液蒸干、灼烧得硫酸铜晶体
15.某同学用图甲所示装置及器材,测定碳酸钙与一定体积盐酸反应生成CO2的体积[V(CO2)]随反应时间变化情况,并绘制出图乙所示曲线。有关分析不正确的是 ( )
A.收集气体最多的时间段为t1~t2
B.将CaCO3粉碎可以加快反应速率
C.平均反应速率:v(t2~t3)>v(t1~t2)>v(O~t1)>v(t3~t4)
D.CaCO3与盐酸反应的离子方程式为CaCO3+2H+Ca2++CO2↑+H2O
二、非选择题:本题共4小题,共55分。
16.(14分)氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
①用装置A制备NH3,其中发生反应的化学方程式为 ;装置B内的试剂是 。
②装置 D 中发生反应的离子方程式是 ,铜丝可抽动的优点是
。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中 NH3和NO2的物质的量之比为 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:
2NaOH+NO+NO22NaNO2+H2O;
2NaOH+2NO2NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
(α表示NOx中NO2的含量)
用NaOH溶液吸收氮氧化物的最佳条件为α= ,c(NaOH)= 。
②若一定体积的NOx被250 mL 2 mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8 g,则x的值为 。
17.(14分)在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。
时间/min 0 3 6 9 12
n(CH3OH)/mol 0 0.50 0.65 0.75 0.75
n(CO2)/mol 1 0.50 0.35 a 0.25
(1)下列说法正确的是 (填字母)。
A.使用催化剂可以提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使CO2全部转化为CH3OH
(2)a= ;3~6 min内,v(CO2)= 。
(3)达平衡时,H2的转化率为 ,混合气体中CH3OH的物质的量分数为 。
(4)能说明上述反应达到平衡状态的是 (填字母)。
A.v正(CO2)=3v逆(H2)
B.CH3OH的质量保持不变
C.混合气体的密度不随时间的变化而变化
D.单位时间内生成n mol CO2,同时生成n mol CH3OH
(5)第3 min时v正(CH3OH) (填“>”“<”或“=”)第9 min时v逆(CH3OH)。
18.(14分)乳酸乙酯广泛用于食品香精,在白酒中适量添加乳酸乙酯可增强白酒的香气。乳酸乙酯发生如图变化(已知烃A的产量可以用来衡量一个国家石油化学工业的发展水平),回答下列问题。
(1)B中含氧官能团的名称是 ;②的反应类型是 。
(2)A分子的空间结构是 。
(3)①的化学方程式是 ;F的结构简式为 。
(4)1 mol B与足量Na反应,可生成H2 mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的利用率为100%。下列转化符合绿色化学要求的是 (填字母)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl
c.2CH3CHO+O22CH3COOH
19.(13分)用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-H2O+IO-;H2O2+IO-H2O+O2↑+I-。总反应的化学方程式是 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是
(填字母)。
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2+I-H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到 ,说明有I2生成。
②气泡明显减少的原因可能是:ⅰ.H2O2浓度降低;ⅱ. 。以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是 。
模块质量检测(二)
1.选A 脂肪酸的相对分子质量较大,但不是高分子,A项错误;嫦娥石含有金属阳离子和酸根阴离子,属于无机盐,B项正确;太阳能电池将太阳能转化为电能,C项正确;多孔聚四氟乙烯为有机高分子材料,性质稳定,耐腐蚀,D项正确。
2.选A Al(OH)3呈两性,不溶于水,但可以与胃酸反应生成无毒物质,因此其能用于治疗胃酸过多,A不正确;Na2O2能与CO2反应产生O2,故Na2O2可作供氧剂,B正确;FeO有还原性,其中Fe元素的化合价为+2,用适当的氧化剂可以将其氧化成更高价态的Fe3O4,C正确;HNO3见光易分解,故其应保存在棕色试剂瓶中,D正确。
3.选C 煤的干馏产品为焦炭、煤焦油、出炉煤气,煤油为石油的分馏产品,A项错误;石油分馏得到汽油、煤油、柴油等轻质油,石油经裂化、裂解得到乙烯、丙烯、甲烷等化工原料,B项错误;油脂在碱性条件下的水解反应为皂化反应,生成高级脂肪酸盐和甘油,C项正确;淀粉水解生成葡萄糖,葡萄糖在酶的催化下转化为乙醇,D项错误。
4.选D “瘦肉精”对人体有害,A错误;福尔马林可使蛋白质变性,可用于处理生物标本,但不能用福尔马林浸泡海产品,会危害人体健康,B错误;“苏丹红”具有致癌性,对人体的肝肾器官具有明显的毒性作用,C错误;酱油中加铁可补充人体必需的铁元素,人体无法合成赖氨酸,粮食制品中加赖氨酸营养更全面,D正确。
5.选A 其他条件不变,增大氯气的浓度可以加快反应速率,故A正确;该反应不是可逆反应,减小生成物氮气的浓度,反应速率没有影响,故B错误;其他条件不变温度降低,反应速率减慢,故C错误;氯化铵为生成物,且是固体,及时移出氯化铵,反应物的浓度没有改变,反应速率不变,故D错误。
6.选B 由该物质的结构简式可知,其分子式为C59H90O4,A错误;键线式端点代表甲基,10个重复基团的最后一个连接H原子的碳是甲基,故分子中含有1+1+1+10+1=14个甲基,B正确;双键碳以及与其相连的四个原子共面,羰基碳原子和与其相连的氧原子及另外两个原子共面,因此分子中的四个氧原子在同一平面上,C错误;分子中有碳碳双键,能发生加成反应,含有甲基,能发生取代反应,D错误。
7.选D 向反应后的试管中加足量稀硫酸,剩余的N在酸性环境下具有强氧化性,发生反应3Cu+8H++2N3Cu2++2NO↑+4H2O,现象为有无色气体产生,且无色气体遇空气变为红棕色,A项错误;SO2通入氯水中发生反应SO2+Cl2+2H2OH2SO4+2HCl,溶液褪色,反应中SO2表现出还原性,B项错误;浓硝酸加热分解能生成红棕色的NO2,木炭与浓HNO3反应也能生成NO2,即该实验不能证明碳与浓HNO3反应生成NO2,C项错误;将铜片放入浓HNO3中发生反应Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,反应中浓HNO3表现出强氧化性和酸性,D项正确。
8.选C 由①②反应知,
反应①是酯化反应,也属于取代反应,A正确;反应②是丙烯中碳碳双键发生加成反应生成酯,也是合成酯的方法之一,B正确;产物中酯基右端连接2个甲基的碳原子为饱和碳原子,具有类似甲烷的四面体结构,故产物分子中所有碳原子不可能共平面,C错误;由反应①及产物的结构简式可确定其化学名称为乙酸异丙酯,D正确。
9.选B 燃料电池是将化学能转化为电能,A极为负极,N化合价升高,发生氧化反应,B极为正极,氧气得电子发生还原反应,电流从正极出发经导线流向负极,B项错误。
10.选D 由题图可知,等物质的量的HCN比HNC含有的能量更低,则HCN比HNC更稳定,A项错误;HCN(g)→HNC(g)时会吸收能量,即反应为吸热反应,但反应不一定在加热条件下进行,B项错误;由题图可知1 mol HCN(g)转化为中间状态的物质需吸收186.5 kJ的热量,该中间物质中仍存在化学键,故1 mol HCN(g)中的所有化学键全部断开吸收的热量要大于186.5 kJ,C项错误;由题图可知1 mol HCN(g)转化为1 mol HNC(g)吸收的能量为186.5 kJ-127.2 kJ=59.3 kJ,D项正确。
11.选D 600~1 200 s,N2O5的变化量为(0.96-0.66)mol·L-1=0.3 mol·L-1,在此时间段内NO2的变化量为其2倍,即0.6 mol·L-1,因此,生成NO2的平均速率为=1.0×10-3 mol·L-1·s-1,A说法不正确;由表中数据可知,反应2 220 s时,N2O5的变化量为(1.40-0.35)mol·L-1=1.05 mol·L-1,其物质的量的变化量为1.05 mol·L-1×0.1 L=0.105 mol,O2的变化量是其,即0.052 5 mol,因此,放出的O2在标准状况下的体积为0.052 5 mol ×22.4 L·mol-1=1.176 L,B说法不正确;反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,2v正(N2O5)=v逆(NO2),C说法不正确;分析表中数据可知,该反应经过1 110 s(600~1 710,1710~2 820)后N2O5的浓度会变为原来的,因此,N2O5的浓度由0.24 mol·L-1变为0.12 mol·L-1时,可以推测表中的x为(2 820+1 110)=3 930,D说法正确。
12.选B 根据图示,a通入SO2生成H2SO4,发生氧化反应,为原电池的负极,b通入O2,为原电池的正极,电极反应式:O2+4H++4e-2H2O。电子不能在电解质溶液中传导,C错误;氢离子由a极区向b极区移动,a极区发生反应SO2-2e-+2H2OS+4H+,左上口有水进入,左下口流出的硫酸溶液质量分数可能小于50%,D错误。
13.选B “还原”反应是用焦炭把二氧化硅还原为粗硅,反应的化学方程式为SiO2+2CSi(粗)+2CO↑,A正确;粗硅提纯所得的高纯硅是制造芯片的主要材料,制造光导纤维的主要材料是SiO2,B错误;“操作X”的目的是除去氮气中的少量氧气,可将原料气通过灼热的铜网,C正确;粗硅中含少量Fe、Cu的单质及化合物,稀硝酸能溶解Fe、Cu,且不与Si反应,所以“稀酸Y”可选用稀硝酸,D正确。
14.选D 铜渣和混合酸反应溶解,得到以硫酸铜为主的混合溶液,为了充分利用稀硝酸,在反应过程中不时地通入氧气,使生成的NO气体转化为硝酸,减小硝酸的消耗。由于杂质Ag也能被硝酸氧化溶解,为了把反应后溶液中的Ag+完全除去,在反应后的溶液中加入少量NaCl,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,得到含CuSO4的溶液。硫酸铜晶体含结晶水,应用冷却结晶法获得,将含硫酸铜的滤液蒸发浓缩、冷却结晶、过滤,可得硫酸铜晶体,D不正确。
15.选C 根据题图可知,t1~t2时间段内收集气体的体积为(V2-V1)mL,该时间段收集气体体积最大,A正确;将CaCO3粉碎,增大其与盐酸的接触面积,反应速率加快,B正确;根据相同时间内收集气体的体积大小,可知平均反应速率:v(t1~t2)>v(t2~t3)>v(O~t1)>v(t3~t4),C错误;CaCO3与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为CaCO3+2H+Ca2++CO2↑+H2O,D正确。16.解析:(2)②若一定体积的NOx被250 mL 2 mol·L-1的NaOH溶液恰好完全吸收,n(NaOH)=0.250 L×2 mol·L-1=0.5 mol,根据组成可知:n(Na)=n(N),结合守恒思想,则有n(NOx)=n(NaOH)=0.5 mol,溶液质量增加19.8 g,即NOx的质量,故NOx的摩尔质量M==(14+16x)g·mol-1,则x的值为1.6。
答案:(1)①Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O 碱石灰
②Cu+4H++2NCu2++2NO2↑+2H2O 可随时控制反应的发生与停止 ③4∶3
(2)①50% 1.25 mol·L-1 ②1.6
17.解析:(2)结合表中数据可知,9 min和12 min时甲醇的物质的量相等,说明9 min时已经达到平衡状态,9 min和12 min时二氧化碳的物质的量也相等,则a=0.25;3~6 min内,v(CO2)===0.025 mol·L-1·min-1。(3)达平衡时,Δn(CH3OH)=0.75 mol,各物质的物质的量变化量之比等于化学计量数之比,则Δn(H2)=3Δn(CH3OH)=2.25 mol,H2的转化率为=×100%=75%;平衡时n(CO2)=0.25 mol、n(H2)=3 mol-2.25 mol=0.75 mol、n(CH3OH)=n(H2O)=0.75 mol,则混合气体中CH3OH的物质的量分数为×100%=30%。(4)正、逆反应速率相等时,反应达到平衡状态,不同物质的反应速率之比等于相应的化学计量数之比,可知3v正(CO2)=v正(H2),则v正(CO2)=3v逆(H2)时,正、逆反应速率不相等,反应未达到平衡状态,A不符合题意;CH3OH的质量保持不变,说明反应达到平衡状态,B符合题意;混合气体的总质量不变,恒容密闭容器容积不变,混合气体的密度一直不变,故混合气体的密度不变,不能说明反应达到平衡状态,C不符合题意;单位时间内生成n mol CO2,同时生成n mol CH3OH,正、逆反应速率相等,说明反应达到平衡状态,D符合题意。(5)第3 min时反应没有达到平衡状态,第9 min时反应达到平衡状态,第9 min时v正(CH3OH)=v逆(CH3OH),由于反应物浓度:第3 min时>第9 min时,反应物浓度越小反应速率越小,则第3 min 时v正(CH3OH)>第9 min时v正(CH3OH),即大于第9 min时v逆(CH3OH)。
答案:(1)A (2)0.25 0.025 mol·L-1·min-1 (3)75% 30% (4)BD (5)>
18.解析:根据题意可知烃A是CH2CH2;经反应②生成的C为CH3CH2OH,乳酸乙酯发生水解反应生成的B为乳酸();结合图示转化可确定D、E、F分别为CH3CHO、CH3COOH和。
答案:(1)羟基、羧基 加成反应 (2)平面形
(3)+H2O
+C2H5OH
(4)1 (5)c
19.解析:(1)H2O2+I-H2O+IO-,H2O2+IO-H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式为2H2O22H2O+O2↑。(2)加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;加入KI后,反应物和生成物的能量都没有改变,b不正确;由图中可知,H2O2+I-H2O+IO-的反应物总能量小于生成物总能量,所以该反应是吸热反应,c不正确。(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。②虽然H2O2溶液的浓度相同,但观察到的现象是产生气泡的速率差异很大。
答案:(1)2H2O22H2O+O2↑ (2)a
(3)①下层溶液呈紫红色 ②水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小
7 / 7
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是 ( )
A.利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变
B.发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐
C.研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
D.革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀
2.下列说法不正确的是 ( )
A.Al(OH)3呈两性,不能用于治疗胃酸过多
B.Na2O2能与CO2反应产生O2,可作供氧剂
C.FeO有还原性,能被氧化成Fe3O4
D.HNO3见光易分解,应保存在棕色试剂瓶中
3.下列资源利用中,在给定工艺条件下转化关系正确的是 ( )
A.煤煤油 B.石油乙烯
C.油脂甘油 D.淀粉乙醇
4.下列对食品的处理符合食品安全要求的是 ( )
A.使用“瘦肉精”激素饲料喂养的猪,猪肉的瘦肉率更高、营养价值更高
B.用福尔马林浸泡的海产品保鲜时间更长,味道更鲜美
C.添加工业染料“苏丹红”后的饲料喂养的鸭子产下的红心鸭蛋,营养价值更高
D.酱油中加铁、粮食制品中加赖氨酸营养更全面
5.下列反应条件的改变对3Cl2(g)+8NH3(g)N2(g)+6NH4Cl(s)反应速率的影响正确的是 ( )
A.增大Cl2的浓度能加快反应速率
B.减小N2的浓度能加快反应速率
C.降低温度能加快反应速率
D.及时将生成的NH4Cl移出可加快反应速率
6.辅酶Q10具有预防动脉硬化的功效,其结构简式如图。下列有关辅酶Q10的说法正确的是 ( )
A.分子式为C60H90O4
B.分子中含有14个甲基
C.分子中的四个氧原子不在同一平面
D.可发生加成反应,不能发生取代反应
7.下列实验操作、现象与结论的对应关系正确的是 ( )
选项 实验操作 现象 结论
A Cu和稀硝酸反应后Cu有剩余,再向该试管中加足量稀硫酸 无明显现象 Cu与稀硫酸不反应
B SO2通入氯水中 溶液褪色 SO2具有漂白性
C 向浓HNO3中插入红热的木炭 产生红棕色气体 证明碳与浓HNO3反应生成NO2
D 将铜片放入浓硝酸中 产生红棕色气体,溶液变为绿色 浓硝酸表现强氧化性和酸性
8.下列反应得到相同的产物,相关叙述错误的是 ( )
①+
②+
A.①的反应类型为取代反应
B.反应②是合成酯的方法之一
C.产物分子中所有碳原子共平面
D.产物的化学名称是乙酸异丙酯
9.尿素[CO(NH2)2]燃料电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电,其装置如图所示,下列说法不正确的是 ( )
A.该装置是将化学能转化为电能
B.A极为负极,发生还原反应
C.电流从B极经导线流向A极
D.B极反应式:O2+4e-+4H+2H2O
10.研究表明,在一定条件下,气态HCN(g)与HNC(g)两种分子的互变反应过程能量变化如图所示。下列说法正确的是 ( )
A.HNC比HCN更稳定
B.HCN(g)→HNC(g)为吸热反应且反应条件一定要加热
C.1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量
D.1 mol HCN(g)转化为1 mol HNC(g)需要吸收59.3 kJ的热量
11.一定温度下:在N2O5的四氯化碳溶液(100 mL)中发生分解反应:2N2O54NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
t/s 0 600 1 200 1 710 2 220 2 820 x
c(N2O5)/ (mol·L-1) 1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是 ( )
A.600~1 200 s,生成NO2的平均速率为5.0×10-4mol·L-1·s-1
B.反应2 220 s时,放出的O2体积为11.8 L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3 930
12.SO2可形成酸雨,是大气污染物。利用如图装置既可以吸收工厂排放的SO2又可以制得硫酸溶液。下列说法正确的是 ( )
A.a极为负极,发生还原反应
B.b极的电极反应式为O2+4H++4e-2H2O
C.电子的流动方向:a极→电解质溶液→b极
D.从左下口流出的硫酸溶液的质量分数一定大于50%
13.氮化硅(Si3N4)是一种重要的结构陶瓷材料。用石英砂和原料气(含N2和少量O2)制备Si3N4的操作流程如图(粗硅中含少量Fe、Cu的单质及化合物):
下列叙述不正确的是 ( )
A.“还原”反应的化学方程式为SiO2+2CSi(粗)+2CO↑
B.粗硅提纯所得的高纯硅是制造光导纤维的主要材料
C.“操作X”可将原料气通过灼热的铜网
D.“稀酸Y”可选用稀硝酸
14.以某铜渣(含少量Ag)为原料制备硫酸铜的实验步骤如下:向如图所示装置中加入铜渣,分批加入稀HNO3和稀H2SO4混合溶液,滴加的间隔鼓入氧气。反应结束后,向溶液中加入少量NaCl后过滤,从滤液中分离得到硫酸铜。下列叙述不正确的是 ( )
A.与直接用稀硝酸溶解铜渣相比,加入稀硫酸及鼓入氧气均可节约硝酸用量
B.当观察到鼓入O2不再出现红棕色,表明反应停止
C.加入氯化钠可除去溶液中少量的Ag+
D.将含硫酸铜的滤液蒸干、灼烧得硫酸铜晶体
15.某同学用图甲所示装置及器材,测定碳酸钙与一定体积盐酸反应生成CO2的体积[V(CO2)]随反应时间变化情况,并绘制出图乙所示曲线。有关分析不正确的是 ( )
A.收集气体最多的时间段为t1~t2
B.将CaCO3粉碎可以加快反应速率
C.平均反应速率:v(t2~t3)>v(t1~t2)>v(O~t1)>v(t3~t4)
D.CaCO3与盐酸反应的离子方程式为CaCO3+2H+Ca2++CO2↑+H2O
二、非选择题:本题共4小题,共55分。
16.(14分)氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
①用装置A制备NH3,其中发生反应的化学方程式为 ;装置B内的试剂是 。
②装置 D 中发生反应的离子方程式是 ,铜丝可抽动的优点是
。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中 NH3和NO2的物质的量之比为 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:
2NaOH+NO+NO22NaNO2+H2O;
2NaOH+2NO2NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
(α表示NOx中NO2的含量)
用NaOH溶液吸收氮氧化物的最佳条件为α= ,c(NaOH)= 。
②若一定体积的NOx被250 mL 2 mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8 g,则x的值为 。
17.(14分)在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。
时间/min 0 3 6 9 12
n(CH3OH)/mol 0 0.50 0.65 0.75 0.75
n(CO2)/mol 1 0.50 0.35 a 0.25
(1)下列说法正确的是 (填字母)。
A.使用催化剂可以提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使CO2全部转化为CH3OH
(2)a= ;3~6 min内,v(CO2)= 。
(3)达平衡时,H2的转化率为 ,混合气体中CH3OH的物质的量分数为 。
(4)能说明上述反应达到平衡状态的是 (填字母)。
A.v正(CO2)=3v逆(H2)
B.CH3OH的质量保持不变
C.混合气体的密度不随时间的变化而变化
D.单位时间内生成n mol CO2,同时生成n mol CH3OH
(5)第3 min时v正(CH3OH) (填“>”“<”或“=”)第9 min时v逆(CH3OH)。
18.(14分)乳酸乙酯广泛用于食品香精,在白酒中适量添加乳酸乙酯可增强白酒的香气。乳酸乙酯发生如图变化(已知烃A的产量可以用来衡量一个国家石油化学工业的发展水平),回答下列问题。
(1)B中含氧官能团的名称是 ;②的反应类型是 。
(2)A分子的空间结构是 。
(3)①的化学方程式是 ;F的结构简式为 。
(4)1 mol B与足量Na反应,可生成H2 mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的利用率为100%。下列转化符合绿色化学要求的是 (填字母)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl
c.2CH3CHO+O22CH3COOH
19.(13分)用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-H2O+IO-;H2O2+IO-H2O+O2↑+I-。总反应的化学方程式是 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是
(填字母)。
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2+I-H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到 ,说明有I2生成。
②气泡明显减少的原因可能是:ⅰ.H2O2浓度降低;ⅱ. 。以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是 。
模块质量检测(二)
1.选A 脂肪酸的相对分子质量较大,但不是高分子,A项错误;嫦娥石含有金属阳离子和酸根阴离子,属于无机盐,B项正确;太阳能电池将太阳能转化为电能,C项正确;多孔聚四氟乙烯为有机高分子材料,性质稳定,耐腐蚀,D项正确。
2.选A Al(OH)3呈两性,不溶于水,但可以与胃酸反应生成无毒物质,因此其能用于治疗胃酸过多,A不正确;Na2O2能与CO2反应产生O2,故Na2O2可作供氧剂,B正确;FeO有还原性,其中Fe元素的化合价为+2,用适当的氧化剂可以将其氧化成更高价态的Fe3O4,C正确;HNO3见光易分解,故其应保存在棕色试剂瓶中,D正确。
3.选C 煤的干馏产品为焦炭、煤焦油、出炉煤气,煤油为石油的分馏产品,A项错误;石油分馏得到汽油、煤油、柴油等轻质油,石油经裂化、裂解得到乙烯、丙烯、甲烷等化工原料,B项错误;油脂在碱性条件下的水解反应为皂化反应,生成高级脂肪酸盐和甘油,C项正确;淀粉水解生成葡萄糖,葡萄糖在酶的催化下转化为乙醇,D项错误。
4.选D “瘦肉精”对人体有害,A错误;福尔马林可使蛋白质变性,可用于处理生物标本,但不能用福尔马林浸泡海产品,会危害人体健康,B错误;“苏丹红”具有致癌性,对人体的肝肾器官具有明显的毒性作用,C错误;酱油中加铁可补充人体必需的铁元素,人体无法合成赖氨酸,粮食制品中加赖氨酸营养更全面,D正确。
5.选A 其他条件不变,增大氯气的浓度可以加快反应速率,故A正确;该反应不是可逆反应,减小生成物氮气的浓度,反应速率没有影响,故B错误;其他条件不变温度降低,反应速率减慢,故C错误;氯化铵为生成物,且是固体,及时移出氯化铵,反应物的浓度没有改变,反应速率不变,故D错误。
6.选B 由该物质的结构简式可知,其分子式为C59H90O4,A错误;键线式端点代表甲基,10个重复基团的最后一个连接H原子的碳是甲基,故分子中含有1+1+1+10+1=14个甲基,B正确;双键碳以及与其相连的四个原子共面,羰基碳原子和与其相连的氧原子及另外两个原子共面,因此分子中的四个氧原子在同一平面上,C错误;分子中有碳碳双键,能发生加成反应,含有甲基,能发生取代反应,D错误。
7.选D 向反应后的试管中加足量稀硫酸,剩余的N在酸性环境下具有强氧化性,发生反应3Cu+8H++2N3Cu2++2NO↑+4H2O,现象为有无色气体产生,且无色气体遇空气变为红棕色,A项错误;SO2通入氯水中发生反应SO2+Cl2+2H2OH2SO4+2HCl,溶液褪色,反应中SO2表现出还原性,B项错误;浓硝酸加热分解能生成红棕色的NO2,木炭与浓HNO3反应也能生成NO2,即该实验不能证明碳与浓HNO3反应生成NO2,C项错误;将铜片放入浓HNO3中发生反应Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,反应中浓HNO3表现出强氧化性和酸性,D项正确。
8.选C 由①②反应知,
反应①是酯化反应,也属于取代反应,A正确;反应②是丙烯中碳碳双键发生加成反应生成酯,也是合成酯的方法之一,B正确;产物中酯基右端连接2个甲基的碳原子为饱和碳原子,具有类似甲烷的四面体结构,故产物分子中所有碳原子不可能共平面,C错误;由反应①及产物的结构简式可确定其化学名称为乙酸异丙酯,D正确。
9.选B 燃料电池是将化学能转化为电能,A极为负极,N化合价升高,发生氧化反应,B极为正极,氧气得电子发生还原反应,电流从正极出发经导线流向负极,B项错误。
10.选D 由题图可知,等物质的量的HCN比HNC含有的能量更低,则HCN比HNC更稳定,A项错误;HCN(g)→HNC(g)时会吸收能量,即反应为吸热反应,但反应不一定在加热条件下进行,B项错误;由题图可知1 mol HCN(g)转化为中间状态的物质需吸收186.5 kJ的热量,该中间物质中仍存在化学键,故1 mol HCN(g)中的所有化学键全部断开吸收的热量要大于186.5 kJ,C项错误;由题图可知1 mol HCN(g)转化为1 mol HNC(g)吸收的能量为186.5 kJ-127.2 kJ=59.3 kJ,D项正确。
11.选D 600~1 200 s,N2O5的变化量为(0.96-0.66)mol·L-1=0.3 mol·L-1,在此时间段内NO2的变化量为其2倍,即0.6 mol·L-1,因此,生成NO2的平均速率为=1.0×10-3 mol·L-1·s-1,A说法不正确;由表中数据可知,反应2 220 s时,N2O5的变化量为(1.40-0.35)mol·L-1=1.05 mol·L-1,其物质的量的变化量为1.05 mol·L-1×0.1 L=0.105 mol,O2的变化量是其,即0.052 5 mol,因此,放出的O2在标准状况下的体积为0.052 5 mol ×22.4 L·mol-1=1.176 L,B说法不正确;反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,2v正(N2O5)=v逆(NO2),C说法不正确;分析表中数据可知,该反应经过1 110 s(600~1 710,1710~2 820)后N2O5的浓度会变为原来的,因此,N2O5的浓度由0.24 mol·L-1变为0.12 mol·L-1时,可以推测表中的x为(2 820+1 110)=3 930,D说法正确。
12.选B 根据图示,a通入SO2生成H2SO4,发生氧化反应,为原电池的负极,b通入O2,为原电池的正极,电极反应式:O2+4H++4e-2H2O。电子不能在电解质溶液中传导,C错误;氢离子由a极区向b极区移动,a极区发生反应SO2-2e-+2H2OS+4H+,左上口有水进入,左下口流出的硫酸溶液质量分数可能小于50%,D错误。
13.选B “还原”反应是用焦炭把二氧化硅还原为粗硅,反应的化学方程式为SiO2+2CSi(粗)+2CO↑,A正确;粗硅提纯所得的高纯硅是制造芯片的主要材料,制造光导纤维的主要材料是SiO2,B错误;“操作X”的目的是除去氮气中的少量氧气,可将原料气通过灼热的铜网,C正确;粗硅中含少量Fe、Cu的单质及化合物,稀硝酸能溶解Fe、Cu,且不与Si反应,所以“稀酸Y”可选用稀硝酸,D正确。
14.选D 铜渣和混合酸反应溶解,得到以硫酸铜为主的混合溶液,为了充分利用稀硝酸,在反应过程中不时地通入氧气,使生成的NO气体转化为硝酸,减小硝酸的消耗。由于杂质Ag也能被硝酸氧化溶解,为了把反应后溶液中的Ag+完全除去,在反应后的溶液中加入少量NaCl,使硫酸银转化为更难溶的氯化银沉淀,然后过滤,得到含CuSO4的溶液。硫酸铜晶体含结晶水,应用冷却结晶法获得,将含硫酸铜的滤液蒸发浓缩、冷却结晶、过滤,可得硫酸铜晶体,D不正确。
15.选C 根据题图可知,t1~t2时间段内收集气体的体积为(V2-V1)mL,该时间段收集气体体积最大,A正确;将CaCO3粉碎,增大其与盐酸的接触面积,反应速率加快,B正确;根据相同时间内收集气体的体积大小,可知平均反应速率:v(t1~t2)>v(t2~t3)>v(O~t1)>v(t3~t4),C错误;CaCO3与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为CaCO3+2H+Ca2++CO2↑+H2O,D正确。16.解析:(2)②若一定体积的NOx被250 mL 2 mol·L-1的NaOH溶液恰好完全吸收,n(NaOH)=0.250 L×2 mol·L-1=0.5 mol,根据组成可知:n(Na)=n(N),结合守恒思想,则有n(NOx)=n(NaOH)=0.5 mol,溶液质量增加19.8 g,即NOx的质量,故NOx的摩尔质量M==(14+16x)g·mol-1,则x的值为1.6。
答案:(1)①Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O 碱石灰
②Cu+4H++2NCu2++2NO2↑+2H2O 可随时控制反应的发生与停止 ③4∶3
(2)①50% 1.25 mol·L-1 ②1.6
17.解析:(2)结合表中数据可知,9 min和12 min时甲醇的物质的量相等,说明9 min时已经达到平衡状态,9 min和12 min时二氧化碳的物质的量也相等,则a=0.25;3~6 min内,v(CO2)===0.025 mol·L-1·min-1。(3)达平衡时,Δn(CH3OH)=0.75 mol,各物质的物质的量变化量之比等于化学计量数之比,则Δn(H2)=3Δn(CH3OH)=2.25 mol,H2的转化率为=×100%=75%;平衡时n(CO2)=0.25 mol、n(H2)=3 mol-2.25 mol=0.75 mol、n(CH3OH)=n(H2O)=0.75 mol,则混合气体中CH3OH的物质的量分数为×100%=30%。(4)正、逆反应速率相等时,反应达到平衡状态,不同物质的反应速率之比等于相应的化学计量数之比,可知3v正(CO2)=v正(H2),则v正(CO2)=3v逆(H2)时,正、逆反应速率不相等,反应未达到平衡状态,A不符合题意;CH3OH的质量保持不变,说明反应达到平衡状态,B符合题意;混合气体的总质量不变,恒容密闭容器容积不变,混合气体的密度一直不变,故混合气体的密度不变,不能说明反应达到平衡状态,C不符合题意;单位时间内生成n mol CO2,同时生成n mol CH3OH,正、逆反应速率相等,说明反应达到平衡状态,D符合题意。(5)第3 min时反应没有达到平衡状态,第9 min时反应达到平衡状态,第9 min时v正(CH3OH)=v逆(CH3OH),由于反应物浓度:第3 min时>第9 min时,反应物浓度越小反应速率越小,则第3 min 时v正(CH3OH)>第9 min时v正(CH3OH),即大于第9 min时v逆(CH3OH)。
答案:(1)A (2)0.25 0.025 mol·L-1·min-1 (3)75% 30% (4)BD (5)>
18.解析:根据题意可知烃A是CH2CH2;经反应②生成的C为CH3CH2OH,乳酸乙酯发生水解反应生成的B为乳酸();结合图示转化可确定D、E、F分别为CH3CHO、CH3COOH和。
答案:(1)羟基、羧基 加成反应 (2)平面形
(3)+H2O
+C2H5OH
(4)1 (5)c
19.解析:(1)H2O2+I-H2O+IO-,H2O2+IO-H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式为2H2O22H2O+O2↑。(2)加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;加入KI后,反应物和生成物的能量都没有改变,b不正确;由图中可知,H2O2+I-H2O+IO-的反应物总能量小于生成物总能量,所以该反应是吸热反应,c不正确。(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。②虽然H2O2溶液的浓度相同,但观察到的现象是产生气泡的速率差异很大。
答案:(1)2H2O22H2O+O2↑ (2)a
(3)①下层溶液呈紫红色 ②水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小
7 / 7
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
